Разнообразие цвета фасеточных и дорсальных глаз у трутней APIS MELLIFERA
Краткая аннотация.
В период сбора нектара и пыльцы пчелы являются одной из первых наиболее уязвимых мишеней из компонентов биоценозов при поступлении в них ксенобиотиков (пестициды, инсектициды и пр.). Систематическое применение искусственно создаваемых различных химических препаратов является одним из наиболее существенных факторов антропогенного воздействия на пчел, который способствует биологическим и морфологическим изменениям.
Объектом исследований явились трутни. Оценку наличия изменений цвета глаз проводили визуально, с помощью ручной лупы. Методика основана на сравнении исследуемых объектов с нормой. Норма условно выделенное состояние объекта, обладающее характеристиками, присущими большинству таких же объектов в сходных условиях, в данный момент времени. Морфологические аномалии – результаты отклонения от нормального развития, т.е. возникновения нетипичных строений и деятельностей органов или всего организма.
Проведенные исследования по оценке наличия трутней с различными цветами фасеточных и дорсальных глаз свидетельствуют о распространенности двух цветов: коричневые или гранатовые и белые. Мониторинг данных изменений во взаимосвязи с экологической нагрузкой в районах, является подтверждением биотоксичности среды, где содержатся экотоксиканты. Данный факт позволяет отметить возможные изменения экологической ситуации, вызывающие мутационные процессы. В целях сохранения чувашской популяции среднерусского подвида медоносной пчелы в дальнейшем необходимо полностью провести экологический мониторинг всех районов Чувашской Республики. Подобное мероприятие позволит выявить места с высоким содержанием экотоксикантов с дальнейшим введением запрета на содержания пчел в данных районах или на использование продуктов пчеловодства из данных точек.
Ключевые слова: медоносная пчела, трутень, глаза, цвет, экология.
Введение
По сведениям специалистов, пчелы (Apis) – одна из наиболее процветающих групп насекомых, насчитывающая более 16 тыс. видов, которые относятся к 425 родам и 7 семействам. Пчелы встречаются на суше практически везде, где есть энтомофильные растения, т.е. вплоть до зоны многолетних льдов в приполярных районах и до снеговой линии в горах. Они являются одним из немногих групп насекомых, у которых известна настоящая социальная жизнь («эусоциальность»). По типу трофических связей пчел разделяют на две основные группы: полилектические виды, самки которых собирают пыльцу с широкого круга растений (широкие полилекты) или с немногих видов растений, принадлежащих к разным ботаническим семействам (узкие полилекты) и олиголекты виды, самки которых собирают пыльцу преимущественно или исключительно одного семейства растений (широкие олиголекты). Большое значение пчелы имеют и для агропромышленного комплекса (в основном для растениеводства и животноводства), являясь основными опылителями многих культивируемых энтомофильных растений (Michener, 2000; Protalkin, 2005) [1, 2].
Медоносная пчела (Apis mellifera), является эвритопным организмом, характеризуемым по трофическим связям, как широкий полилект и это связано, конечно же, с тем, что они ведут эусоциальный образ жизни. При этом, как отмечают специалисты, число биотических факторов, влияющих на живые организмы, в т.ч. на медоносную пчелу, намного превышает число абиотических. Среди биотических факторов намного больше первичных факторов, определяющих непосредственно возможность существования медоносной пчелы: сила семей, которая определяет способность насекомых противостоять неблагоприятным воздействиям, наличие достаточного количества пыльценосных и нектароносных растений и состояние окружающей среды (Korzh and Kiryushin, 2013) [3].
Особенности биологии медоносной пчелы делают ее лучшим опылителем энтомофильной флоры. В период сбора нектара и пыльцы пчелы являются одной из первых наиболее уязвимых мишеней из компонентов биоценозов при поступлении в них ксенобиотиков (пестициды, инсектициды и пр.). Систематическое применение искусственно создаваемых различных химических препаратов является одним из наиболее существенных факторов антропогенного воздействия на пчел. Савинов А.Б. писал, что важный аспект взаимодействия любых организмов – это мутуалистические связи. Естественно, что для экосистем наибольшее значение имеют мутуалистические связи медоносной пчелы с растениями и это для самого насекомого может укладываться в характеристику количества и качества пищи (Savinov, 2011; Bissembayev et al., 2023; [4, 5].
Однако, как отмечает Корж А.П. и Кирюшин Е.В. необходимо помнить еще об одном мутуалисте, которым является человек. В современном мире он берет на себя решение многих проблемных вопросов в пчеловодстве и они, большей частью, направлены на поддержание силы семей и их способности противостоять неблагоприятным воздействиям окружающей среды (Korzh and Kiryushin, 2013) [3].
В работах ряда авторов отмечалось, что при проведении исследований морфологии некоторых групп насекомых выявлены определенные отклонения от «норм», обусловленные различными факторами: солнечное излучение, низкий или высокий температурный режим в период развития, экотоксиканты и т.д. При этом для проведения мониторинга морфологических изменений успешно применена «Классификация морфологических аномалий насекомых» по J. Balazuc (1948) и Ю.А. Присному (2009).
Целью работы явилось проведение исследований аномалий цвета глаз у трутней, с применением классификации морфологических аномалий по J. Balazuc (Balazuc, 1948) [6] и Ю.А. Присный (Prisny, 2008) [7].
Материал и методы
Объектом исследований явились трутни. Общее количество исследованных трутней составило 21 тыс. Работы проводились в 2015-2017 гг. Оценку наличия изменений цвета глаз проводили визуально, с помощью ручной лупы, согласно классификации морфологических аномалий насекомых по J. Balazuc и Ю.А. Присный (Balazuc, 1948; Prisny, 2008) [6, 7]. Методика основана на сравнении исследуемых объектов с нормой.
Норма условно выделенное состояние объекта, обладающее характеристиками, присущими большинству таких же объектов в сходных условиях, в данный момент времени (Written, 1983) [8]. Морфологические аномалии – результаты отклонения от нормального развития, т.е. возникновения нетипичных строений и деятельностей органов или всего организма (Prisny, 2008) [7].
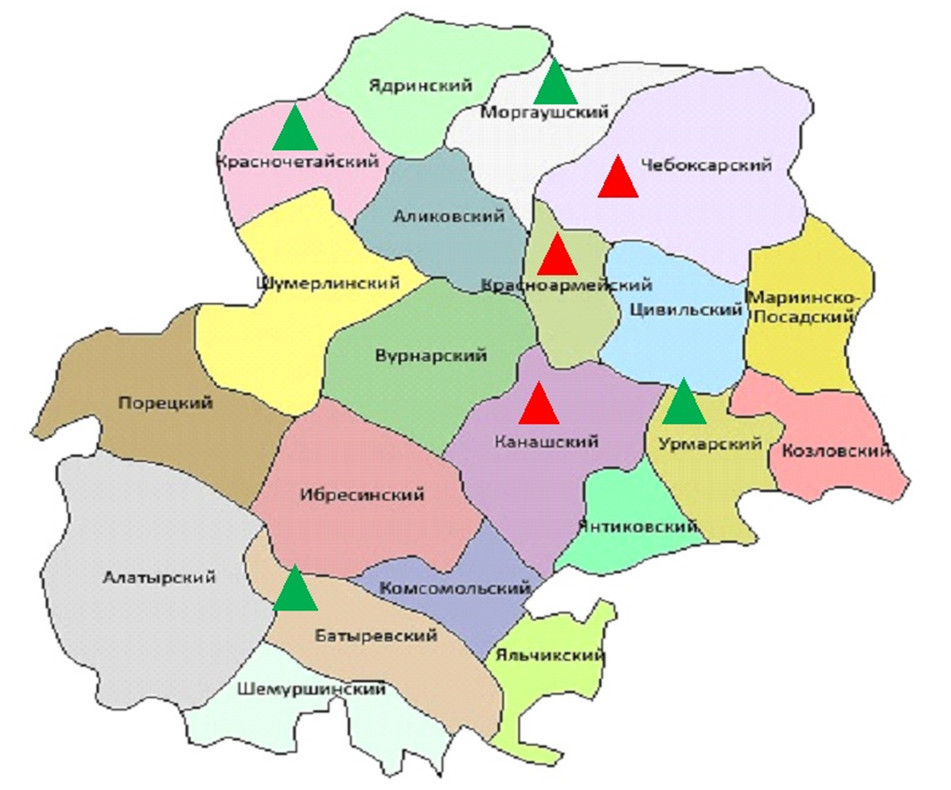
Мониторинг изменений цвета глаз трутней был проведен во взаимосвязи с экологической ситуацией в районах. Согласно официальному докладу «Об экологической ситуации в Чувашской Республике в 2014 г.» были выделены две группы районов: Группа №1 – с максимальным количеством экотоксикантов, выделяемых от всех стационарных источников (г. Канаш, Канашский район (1,603 тыс. тонн); Красноармейский район (6,408 тыс. тонн) и Чебоксарский район (13,096 тыс. тонн)); группа №2 – с минимальным количеством экотоксикантов, выделяемых от всех стационарных источников (Батыревский район (0,082 тыс. тонн); Красночетайский район (0,041 тыс. тонн); Моргаушский район (0,198 тыс. тонн) и Урмарский район (0,052)) (рис. 1).
Фотодокументация проводились с помощью фотоаппарата Canon EOS550D, при max. увел. 281х289 точек. Биометрическую обработку данных проводили в программе Microsoft Office Excel, 2007.
Результаты и обсуждение
Согласно «Классификации морфологических аномалий насекомых» по J. Balazuc [8] и Ю.А. Присному (Prisny, 2008) [7], на территории Чувашской Республики идентифицированы два типа отклонения от «нормы» (рис. 2 – А) в цвете фасеточных (сложных) глаз и дорсальных (простых) глазок у трутней: коричневые или гранатовые (рис. 2 - Б) и белые (рис. 2 - В). Представленные изменения цвета глаз классифицируются по группе № II «Локальные уродства».
Гетерохромия или разнообразие цветов фасеточных глаз и простых глазок у одного трутня не наблюдалось, т.е. особи имели одинаковую окраску глаз: нормальный, коричневый (гранатовый) или белый, соответственно.
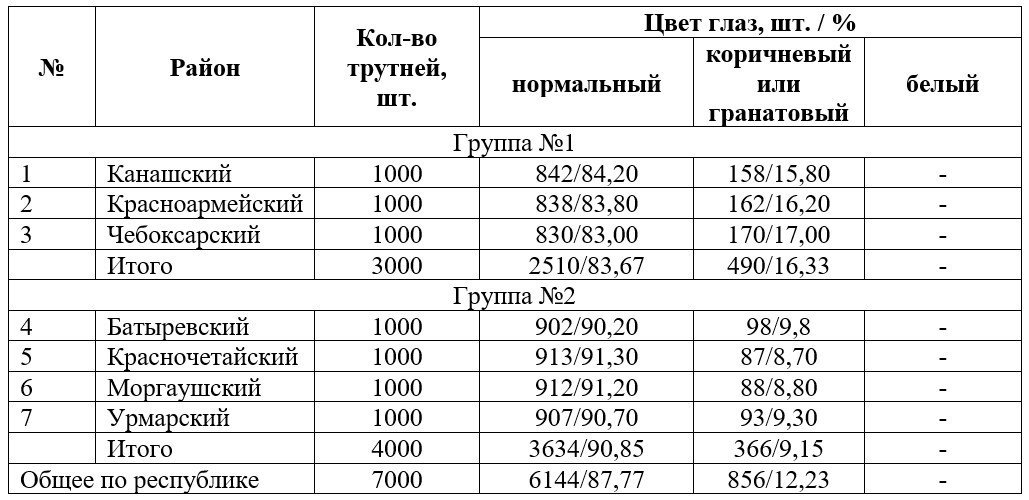
Данные по встречаемости идентифицированных цветов глаза у трутней за 2015 г. представлены в табл. 1.
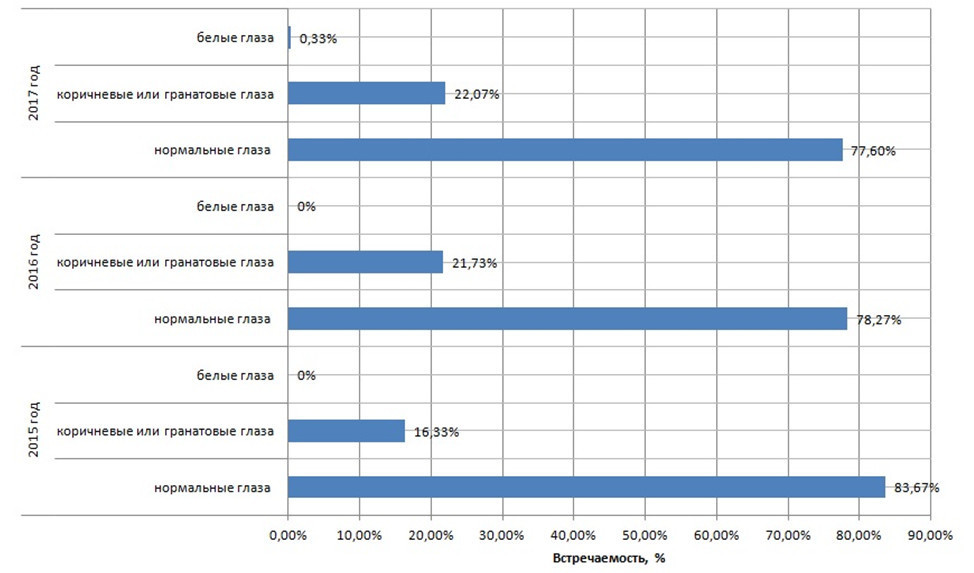
Как видно, в первой группе районов, где по официальным источникам наблюдается максимальное выделение экотоксикантов в окружающую среду, наблюдалась высокая доля трутней с коричневыми или гранатовыми глазами – 16,33 %.
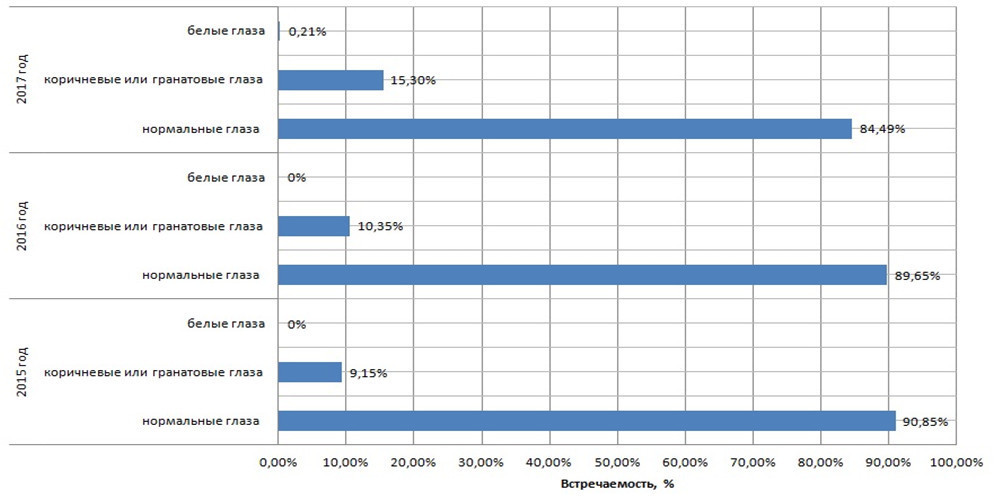
Во второй группе, т.е. выделение минимального количества экотоксикантов, было зафиксировано 12,23 % трутней с изменениями цвета глаз, от общего числа выборки.
В целом по республике количество трутней, отличающихся от «нормы» составило 12,23 % или 856 особей от общего числа выборки (7000 шт.).
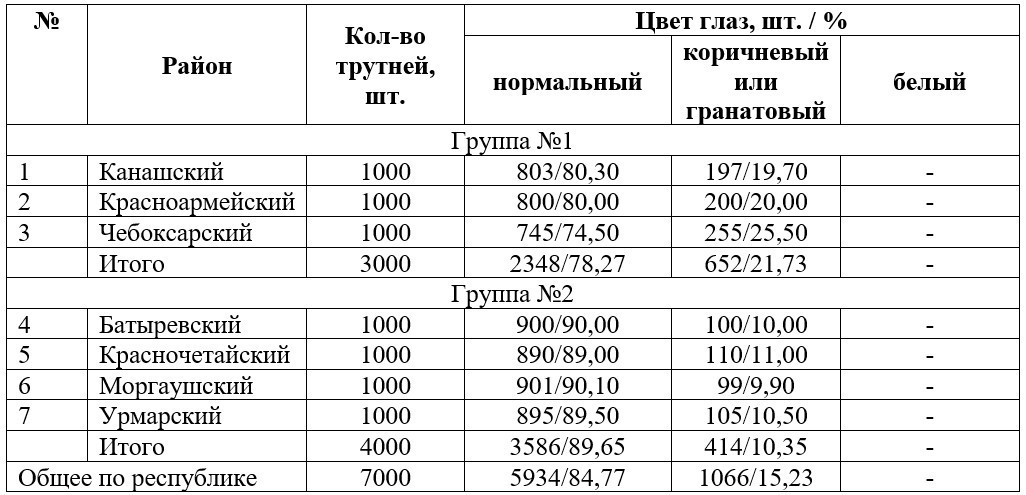
Данные за 2016 г. представлены в табл. 2. В первой группе районов количество трутней с различными цветами глаз встречались больше, чем во второй, на 11,38 %. При этом их количество в группе №1 составило – 21,73 % и в №2 – 10,35 %. Общее количество трутней по Чувашской Республике, с отклонениями от «нормы», составило 15,23 % или 1066 особей, от общего числа выборки. Данное количество превышало показатели 2015 года на 3,0 %.
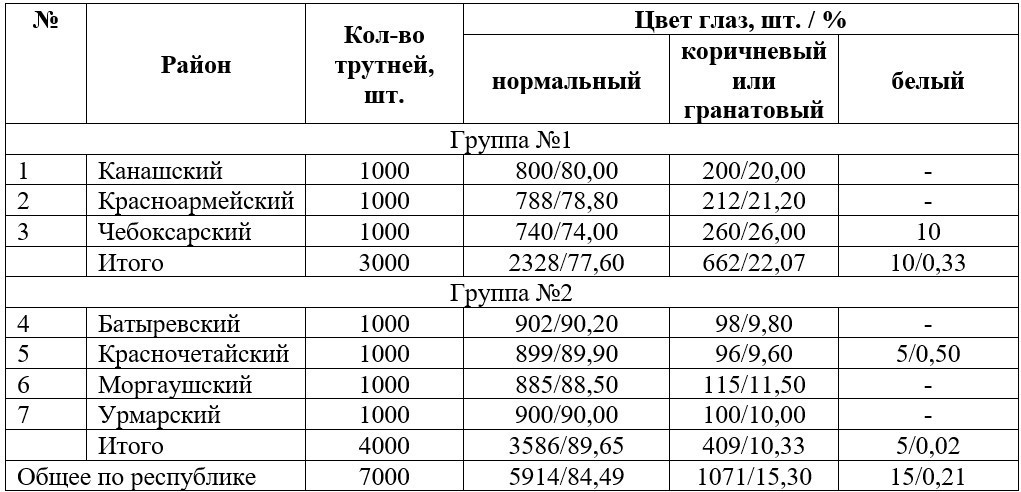
Как видно из полученных данных, трутни с аномалиями глаз в группе районов с максимальным количеством экотоксикантов, выделяемых от всех стационарных источников превышали по численному составу вторую группу, а именно: 22,07 % (группа №1) и 10,33 % (группа №2). По Чувашской Республике данный показатель составил 15,30 % или 1071 трутней, от общего числа выборки. При этом в 2017 г. были зарегистрированы трутни с белым цветом глаз, которые встречались в одном районе – Чебоксарский, где, судя по официальным источникам, наблюдается самое высокое количество выделяемых экотоксикантов – 13,096 тыс. тонн.
В целом, как мы видим, в группе №1 (максимальное количество экотоксикантов) встречается доминантное количество трутней с изменениями цвета глаз: 2015 г. – 16,33 %; 2016 г. – 21,73 % (увеличение на 5,4 %); 2017 г. – 22,07 % (по сравнению с 2015 г. увеличение на 5,74 % и с 2016 г. - на 0,34 %) (рис. 3).
В группе №1 (воздействие минимального количества экотоксикантов) трутни с изменениями цвета глаз также встречались, но их количество было меньше: 2015 г. – 9,15 %; 2016 г. – 10,35 %; 2017 г. – 15,30 % (рис. 4).
Как видно, было зарегистрировано ежегодное увеличение числа трутней с изменениями цвета глаз, а именно: 2016 г. увеличение составило на 1,2 %, 2017 г. – на 6,15%, по сравнению с 2015 г. и на 4,95 % с 2016 г.
Заключение
Проведенные исследования по оценке наличия трутней с различными цветами фасеточных и дорсальных глаз свидетельствуют о распространенности двух цветов: коричневые или гранатовые и белые. Согласно «Классификации морфологических аномалий насекомых» по J. Balazuc (Balazuc, 1948) [6] и Ю.А. Присный (Prisny, 2008) [7], представленные изменения цвета классифицируются по группе № II «Локальные уродства». Мониторинг данных изменений во взаимосвязи с экологической нагрузкой в районах, является подтверждением биотоксичности среды, где содержатся экотоксиканты Zakharov and Yablkov, 1985; Gribina et al, 2021) [9, 10]. Данный факт позволяет отметить возможные изменения экологической ситуации, вызывающие мутационные процессы. Еще Ф. Руттнер (Ruttner, 1982) [11] отмечал, что есть мутации, которые препятствуют нормальной окраске точечных и фасеточных глаз, так как образование пигментов зависит от многих наследственных основ, то возникает возможность появления различных глазных мутаций. В целях сохранения чувашской популяции среднерусского подвида медоносной пчелы в дальнейшем необходимо полностью провести экологический мониторинг всех районов Чувашской Республики. Подобное мероприятие позволит выявить места с высоким содержанием экотоксикантов с дальнейшим введением запрета на содержание пчел в данных районах или на использование продуктов пчеловодства из данных точек (Mannapov A. G.et al., 2022; FAO, 2020; Jacques J. M. van Alphen and Bart J. F., 2020) [12, 13, 14].
REFERENCES
[1] Michener, Ch. D. (2000). The Bees of the World. Baltimore; London: John Hopkins Univ. Press., 2000, 953p.
[2] Protalkin M.Yu. (2005). Fauna of bees (Hymenoptera, Apoidea) of the South of the Far East of Russia Morphology of knowledgeable bees Apis mellifera L. and conservation strategy in the Republic of Bashkortostan: Abstract. dis. cand. biol. sciences. Vladivostok, 22p.
[3] Korzh A. P., Kiryushin V. Or. (2013). The value of biotic factors for knowledgeable bees. Accounting. No. 2. P. 15-17.
[4] Savinov A. B. (2011). Autocenosis and democenosis individual and population level ecological categories in terms of symbiogenesis and systems approach Russian Journal of Ecology. Vol. 42. No. 3. P. 179-185.
[5] Bissembayev A. T., Zemskova N. E., Sattarov V. N., Semenov V. G., Kargayeva M. T. & Baimukanov A. D. (2023). Eidonomy of Apis mellifera Workers and Drones in Apiaries. On Line Journal of Biological Sciences, 23(2), P. 170-176. https://doi.org/10.3844/ojbsci.2023.170.176
[6] Balazuc J. (1948). La teratologie des coleopteres et experiences de transplantation chez Tenebrio molitor L. Mem. Mus. nat.hist. nat. de Paris. Volume 25, P.1-93.
[7] Prisny Yu. A. (2008). To avoid using the frequency distribution of morphological anomalies in insects to assess the qualities and environments. Ecological and faunal studies in the Central Chernozem and adjacent territories: Collection of materials of the III Regional Conference. Lipetsk: LGPU, P.107-113.
[8] Written A. S. (1983) Morphological anomalies of the Colorado beetle Leptinotarsa Decemlineata Say (Coleoptera, Chrysomelidae). Entomological state. Vol. 52, issue 4., P 690-701.
[9] Zakharov V. M. and Yablkov A. S. (1985) Analysis of morphological modification as a method of assessing the status of equivalent populations. New methods of searching for the obtained results in radioecological research. - Moscow: Nauka, P. 176-185.
[10] Gribina N.S. Fisenko P.S. Sobko O.A. (2021) Morphological anomalies in the ontogenesis of potato ladybug Henosepilachna vigintioctomaculata (Motschulsky, 1857) (Coleoptera: Coccinellidae). (Federal Scientific Center of Agrobiotechnology in the Far East named after A.K. Chaika, Ussuriysk, Timiryazevsky village). Bulletin of the FEB RAS. 2021. No. 3, P.57-62. DOI: 10.37102/0869-7698_2021_217_03_09
[11] Ruttner F. (1982) Biological justification and technical recombination. - Apimondia. 345p.
[12] Mannapov A. G., Khudaiberdiev A. A., Mannapova R. T., Yuldashbayev, Y. A. & Baimukanov D. A. (2022). Spring Growth Rates of Bee Families and the Level of Certain Amino Acids in Bees-Feeders with Stimulating Feeding. American Journal of Animal and Veterinary Sciences, 17(2), 108-112. https://doi.org/10.3844/ajavsp.2022.108.112
[13] FAO. (2020). Good beekeeping practices: Practical manual on how to identify and control the main diseases of the honeybee (Apis mellifera). TECA – Technologies and practices for small agricultural producers. 1. Rome. DOI: https://doi.org/10.4060/ca9182en
[14] Jacques J. M. van Alphen and Bart J. F. (2020). Natural selection, selective breeding, and the evolution of resistance of honeybees (Apis mellifera) against Varroa. Alphen and Fernhout Zoological Letters. 6:6 DOI: https://doi.org/10.1186/s40851-020-00158-4
Источник для подробного ознакомления:
1. Baimukanov D.A., Bissembayev A.T., Skvortsov A.I., Semenov V.G. Variation in color of compound and dorsal eyes in Apis Mellifera drones // Science and education. 2024. № 2-2 (75). Р. 200-208. DOI 10.52578/2305-9397-2024-2-2-200-208
Фото на заход: Википедия






























































































Комментарии (0)