Оценка эффективности оплодотворения ооцитов и развитие эмбрионов в условиях «IN VITRO» в молочном скотоводстве
АННОТАЦИЯ
Целью работы явилось определение эффективности оплодотворения фолликулярных ооцитов и развития экстракорпорально оплодотворенных эмбрионов крупного рогатого скота молочного направления продуктивности.
Исследования осуществлялись в соответствии с методикой опытного дела принятая в биотехнологии с обработкой материалов с использованием пакета программ Microsoft Excel. Опыты и используемая методика проведения исследований на лабораторных животных соответствует требования биологической безопасности и этическим принципам экспериментирования на животных, изложенных в Европейской конвенции по защите позвоночных животных, используемых в экспериментальных и других научных целях (Старсбург, 1987 г.).
В настоящее время как способ получения множественных эмбрионов в передовых зарубежных странах широко применяется метод получения яйцеклеток от живых доноров с помощью ультразвукового аппарата и вакуумного насоса без использования гонадотропных препаратов, чем и объясняется широкое распространение на рынке недорогих эмбрионов полученных на основе экстракорпорального оплодотворения. От высокоценных коров-доноров в течение года, возможно, получать морфологически полноценные яйцеклетки с предовуляторных фолликулов через каждые 15-20 дней, что позволит повысить экономическую эффективность и ускоренное воспроизводство высокопродуктивных племенных животных в несколько раз. Но на данном этапе в практике животноводства и в науке Казахстана эти методы практически не отработаны, чем и объясняется его не востребованность и в связи с этим на сегодняшнее время является немаловажным разработка и широкое распространение данного направления.
По результатам проведенных исследований установлено, что при экстракорпоральном оплодотворении фолликулярных ооцитов коров в различных культуральных системах в сравнительном аспекте было установлено, что наибольший процент оплодотворения и дальнейшего развития эмбрионов наблюдается в синтетической среде IVF- Universal, 64% против 16,8% и 21,8%, а развитие эмбрионов до поздней стадии составил 35,3%, тогда как в двух других использованных культуральных средах не было обнаружено ни одного эмбриона.
ANNOTATION
The purpose of the work was to determine the efficiency of fertilization of follicular oocytes and the development of in vitro fertilized embryos of dairy cattle.
The research was carried out in accordance with the experimental methodology adopted in biotechnology with the processing of materials using the Microsoft Excel software package. The experiments and methods used for conducting research on laboratory animals comply with the requirements of biological safety and ethical principles of experimentation on animals set out in the European Convention for the Protection of Vertebrate Animals Used for Experimental and Other Scientific Purposes (Starsburg, 1987).
Currently, as a method of obtaining multiple embryos in advanced foreign countries, the method of obtaining eggs from living donors using an ultrasound machine and a vacuum pump without the use of gonadotropic drugs is widely used, which explains the widespread availability on the market of inexpensive embryos obtained on the basis of in vitro fertilization. From high-value donor cows, it is possible to obtain morphologically complete eggs from preovulatory follicles every 15-20 days throughout the year, which will increase economic efficiency and accelerate the reproduction of highly productive breeding animals several times. But at this stage, in the practice of livestock farming and in the science of Kazakhstan, these methods have practically not been worked out, which explains its lack of demand, and in connection with this, the development and widespread dissemination of this direction is important today.
Based on the results of the studies, it was established that during in vitro fertilization of follicular oocytes of cows in various cultural systems, in a comparative aspect, it was found that the highest percentage of fertilization and further development of embryos is observed in the synthetic IVF-Universal medium, 64% versus 16.8% and 21.8 %, and the development of embryos to the late stage was 35.3%, while not a single embryo was detected in the other two culture media used.
Ключевые слова: крупный рогатый скот, молочное скотоводство, экстракорпоральное оплодотворение, in vitro, фолликул, ооцит, эмбрион.
Key words: cattle, dairy farming, in vitro fertilization, in vitro, follicle, oocyte, embryo.
Введение.
Важнейшим направлением развития животноводства в Казахстане является интенсификация производства, основанная на современных научных достижениях, обеспечивающих высокую производительность продукции животноводства. Внедрение прогрессивных технологий производства продуктов животноводства создает условия для наиболее полного проявления генетического потенциала животных [1].
При этом особое значение придается разработке и освоению эффективных методов биотехнологии, клеточной и генной инженерии, созданию на их основе эффективных методов размножения высокоценных сельскохозяйственных животных [2]. За последние десятилетия биологическая наука бурно развивается и создаёт новые направления, которые не только помогают решать задачи, но и намечает пути принципиально нового биологического производства, которая давно ставила перед биологией производственная практика [3-5].
Стремительно расширяющиеся знания о процессах жизнедеятельности позволяют не только приспосабливать эти процессы для практических целей, но и управлять ими, а также создавать весьма перспективные в практическом отношении новые системы, не существующие в природе, хотя и аналогичные существующим.
Кардинальное решение проблемы ускоренного воспроизводства животных в настоящее время основываются на том, чтобы перейти к нетрадиционным способам увеличения плодовитости. Для этого применяется целый ряд биотехнологических методов, разработанных на основе углубленных исследований репродуктивной функции, её регуляции, а также на совершенствование приемов манипуляции с эмбрионами, половыми и соматическими клетками.
Одним из эффективных и экономически выгодных методов позволяющая наиболее полно реализовать потенциал животных является разработка методики получения эмбрионов «in vitro» [6]. Использование методики экстракорпорального оплодотворения яйцеклеток, объясняется в первую очередь низкими затратами, возможностью извлечения большого количества яйцеклеток без использования дорогостоящих гормональных препаратов и наименьшими затратами труда при его проведении при том, что яйцеклетки от самок можно получать круглый год и в течение всей жизни животного [7]. Тем более известно, что в яичнике самок содержатся сотни тысяч половых клеток, представляющих огромный генетический резерв, который не используется из-за препятствий возникающий с вынашиванием детенышей [8].
На данном этапе методику получения эмбрионов in vitro можно применять не только в ускоренном воспроизводстве ценных генотипов, но также она необходима для проведения научно-исследовательских работ по клеточной и генетической инженерии, связанные с большими успехами достигнутые в совершенствовании методов микроманипуляции эмбрионов (получения клонов, трансгенных животных и эмбриональных стволовых клеток) [9]. В развитии этого поставлена задача разработки методов культивирования и оплодотворения фолликулярных ооцитов коров in vitro, а также влияния методов микроманипуляции на эмбрионы оплодотворенных экстракорпорально.
Цель исследования - определение эффективности оплодотворения фолликулярных ооцитов и развития экстракорпорально оплодотворенных эмбрионов крупного рогатого скота молочного направления продуктивности.
В соответствии с поставленной целью решали следующие задачи:
- определить степень оплодотворения фолликулярных ооцитов;
- оценка развития экстракорпорально оплодотворенных эмбрионов.
Материалы и методы исследований.
Научные исследования проводились в лаборатории ТОО «Учебный научно-производственный центр «Байсерке-Агро» Талгарского района Алматинской области на яичниках, полученных от забитых на убойном цехе Агрохолдинга «Байсерке-Агро» коров голштинской породы.
1. Получение и подготовка спермы к оплодотворению ооцитов. При проведении наших исследований для оплодотворения яйцеклеток мы использовали замороженно-оттаянное семя быка-производителя.
Как известно сперматозоиды млекопитающих перед естественным оплодотворением в половых путях самки проходит процесс дозревания так называемый процесс капацитации, и только после этого они способны проникнуть и оплодотворить яйцеклетку [10]. Процесс капацитации по мнению некоторых авторов заключается в дозревании, удалении протеина и других макромолекулярных субстанции в плазматической мембране сперматозоида, который в естественных условиях происходит в половом аппарате самки точнее в яйцепроводе. Поэтому при проведении работ по ЭКО ооцитов необходимо проводить центрифугирование и флотацию сперматозоидов [11].
2. Культивирование и оплодотворение ооцитов. Культивирование ооцитов и эмбрионов проводили в инкубаторе с 5% CO2 в воздухе при температуре 37±0,1 °С и влажности 80-90%. Эти условия соблюдаются при использовании CO2-инкубаторов, поддерживающих необходимую температуру, влажность и уровень CO2 в камере который поддерживается посредством подачи углекислого газа из баллона, где он находится в сжиженном состоянии, и воздуха из окружающей среды. Влажность в камере CO2-инкубаторов поддерживается постоянным испарением бидистиллированной воды со дна камеры из специального лотка. Уровень рН среды равняется 7,4, что соответствует рН крови, такая кислотность оптимальна для оплодотворения и предимплантационного развития ооцитов и эмбрионов [12, 13].
Яйцеклетки культивировали и оплодотворяли в 1 мл четырех-луночных чашках в 800 мкл среды для культивирования яйцеклеток. Ооциты переносили в отдельные лунки четырех-луночной чашки из расчета 12-15 штук в одну лунку. Прокультивированные в течение 24 ч. в инкубаторе при температуре 37ºС с 5% СО2 ооциты пипетором переносили в чистую среду для культивирования яйцеклеток, заранее находившиеся в СО2 инкубаторе в течение 12 ч [14].
Результаты и их обсуждение.
Помимо процессов созревания ядерного аппарата, в самой цитоплазме яйцеклетки также происходят структурные и биохимические преобразования: идет активный синтез и накопление необходимых для развития ооцита и будущего эмбриона веществ - белков, молекул-источников энергии, молекул РНК, а также распределение по цитоплазме клеточных органелл [15]. При дозревании яйцеклетка накапливает в себе необходимый для развития эмбриона набор веществ и в момент оплодотворения находится на стадии II блока мейоза, который снимается при проникновении сперматозоида. И исходя из этого для развития и оплодотворения недозревших фолликулярных ооцитов необходимы условия наиболее максимально соответствующие естественным, т.е. тем, в которых обеспечивается нормальное функционирование механизмов регуляции оогенеза и раннего эмбриогенеза «in vivo». В качестве биологически активного фактора в большинстве используют сыворотку крови, содержащую компоненты, способствующие выживанию и нормальному развитию клеток [16, 17, 18].
Изучение эффективности использования в качестве стимуляторов оогенеза экзогенных культуральных сред в культивировании «in vitro», исследование влияния различных систем на процессы оогенеза и эмбриогенеза у коров «in vitro», проведение сравнительного анализа позволит совершенствовать биотехнологические методы получения полноценных эмбрионов для работ по клеточной инженерии, а также в ускоренном воспроизводстве ценных генотипов [19, 20]. В связи с этим нами ставилась задача изучения влияния различных культуральных систем на степень дозревания, оплодотворения и в дальнейшем на дробление эмбрионов. Для этого мы использовали среду на основе Дюльбекко с 10% гомологичной сывороткой, 100% фолликулярную жидкость и среду IVF-Universal, разработанная для проведения экстракорпорального оплодотворения ооцитов «in vitro».
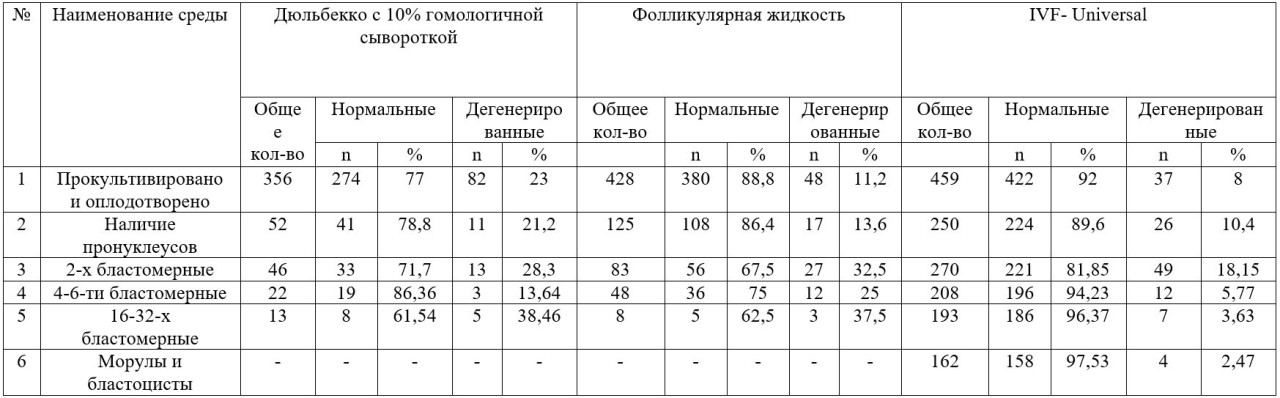
Таким образом, всего на культивирование как было сказано, поставлено 1243 ооцита полученные из яичников забитых овец, которые для сравнительного анализа были разделены на 3 группы. Первую группу состоящих из 356 морфологически полноценных ооцитов культивировали в среде Дюльбекко с 10% гомологичной сывороткой, вторую группу из 428 ооцитов в 100 % фолликулярной жидкости и третью группу из 459 ооцитов в среде IVF-Universal.
В ходе проведения эксперимента поэтапно проводили морфологическую оценку, то есть после культивирования перед оплодотворением, через 14-16 часов после инсеминации спермой (рис.18) и при каждом переносе эмбрионов в чистую среду. Морфологически неполноценные ооциты и эмбрионы выбраковывали. Основными критериями, которого служили неравномерность состояния цитоплазмы, наличие более двух пронуклеусов, асимметричное и фрагментированное деление клеток эмбриона.
Как видно из данных таблицы 1 при культивировании ооцитов в среде Дюльбекко с 10% гомологичной сывороткой морфологическую полноценность сохранили 77 % из 356 ооцитов, что составляет 274 ооцита, 23 % или 82 яйцеклетки были выбракованы вследствие фрагментации и дегенерирования внутренней массы. В фолликулярной жидкости показатель полноценности наблюдалось у 88,8 % или у 380 из 428 яйцеклеток, из которых 11,2 % также были выбракованы. Наиболее высокие показатели получены в среде IVF, в котором морфологическую полноценность сохранили 92 % из 459, что составляет 422 ооцитов, процент дегенерирования составил 8 или 37 ооцитов. При дальнейшем культивировании и исеминацией спермой ооцитов и наблюдении через 14-18 ч. наличие оплодотворения т.е. двух пронуклеусов и направительных телец обнаружено в среде Дюльбекко у 14,6 % от общего количества ооцитов или у 52 ооцитов из которых полноценными оказались 41 (78,8 %). У ооцитов, прокультивированных в ФЖ этот показатель был немного выше и составил 29,2 % от 428 ооцитов из которых 86,4 % полноценные. В среде IVF наличие двух пронуклеусов обнаружено у 54,4 %, что при сравнении во многом превышает показатели обоих сред.
Через 24-36 ч. культивирования происходило дробление оплодотворенных ооцитов и при микроскопической оценке наличие двух бластомеров в среде Дюльбекко с 10% гомологичной сывороткой обнаружено у 46 эмбрионов, что составляет от общего количества оплодотворенных яйцеклеток 12,9 %, из которых без видимых признаков фрагментации и с нормальным дроблением клеток оказались 33 эмбриона (71,7 %), а у 21,2 % наблюдались патологии связанные с фрагментированными и асинхронными дроблениями бластомеров. В ФЖ количество дробящихся эмбрионов составило 19,39 % или 83 двухбластомерных эмбрионов и нормальных 67,5 % или 56 эмбрионов. В IVF количество дробящихся эмбрионов было выше и составило 58,8 % (270) от числа ооцитов, а процент дегенерированных 18,5%.
Таким образом, всего на культивирование как было сказано, поставлено 1243 ооцита полученные из яичников забитых овец, которые для сравнительного анализа были разделены на 3 группы. Первую группу состоящих из 356 морфологически полноценных ооцитов культивировали в среде Дюльбекко с 10% гомологичной сывороткой, вторую группу из 428 ооцитов в 100 % фолликулярной жидкости и третью группу из 459 ооцитов в среде IVF-Universal. В ходе проведения эксперимента поэтапно проводили морфологическую оценку, то есть после культивирования перед оплодотворением, через 14-16 часов после инсеминации спермой и при каждом переносе эмбрионов в чистую среду. Морфологически неполноценные ооциты и эмбрионы выбраковывали. Основными критериями, которого служили неравномерность состояния цитоплазмы, наличие более двух пронуклеусов, асимметричное и фрагментированное деление клеток эмбриона.
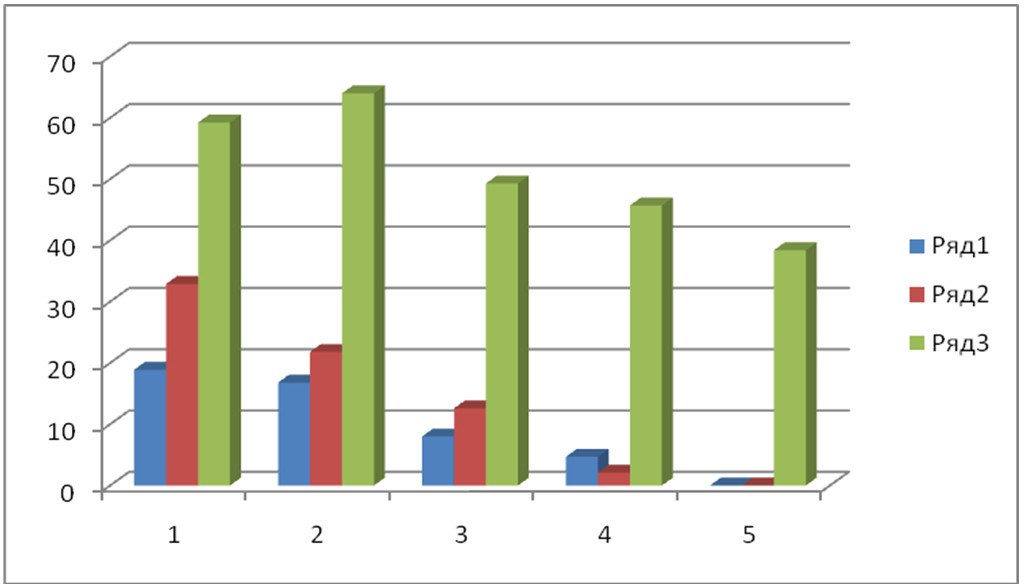
При переносе эмбрионов в чистую среду и культивировании до стадии 4-6-ти бластомеров дробились в среде Дюльбекко 22 эмбриона, из которых 86,36 % (19) морфологически полноценные, в ФЖ 48 или 11,2 % от числа ооцитов, в среде IVF-Universal данный показатель равнялся к 45,3 % или 208 4-х, 6-ти бластомерных эмбрионов, из которых нормальную морфологию сохранили 94,23 % или 196 эмбрионов. До стадии 16-ти, 32 –х бластомеров дробились в Дюльбекко 13 эмбрионов, из которых 38,46 % наблюдалось асинхронное деление бластомеров, в ФЖ эмбрионы продолживших дробление резко сократилось и составило всего 1,86 % от числа оплодотворенных ооцитов, а в среде IVF количество дробящихся остался практически на том же уровне и составил 42 % из которых у 96,37 % происходило нормальное дробление. На 6-8 день культивирования при просмотре под микроскопом у эмбрионов прокультивированные и оплодотворенные в средах Дюльбекко и ФЖ произошла остановка развития и наблюдалось сморщивание клеток, а между тем в среде IVF-Universal количество эмбрионов на поздних стадиях развития составило 35,3 %, что составляет 162 от общего числа оплодотворенных фолликулярных ооцитов (рис 1.).
Исходя из вышеизложенного можно сделать вывод, что основной составляющей нормального оплодотворения и развития эмбрионов является культуральная система. При культивировании в средах Дюльбекко с 10% гомологичной сывороткой и фолликулярной жидкости процент оплодотворенных составил 12,9 и 19,4, при культивировании дробление до 16-ти, 32-х клеток составило 3,65 % и 1,87 % соответственно, после которого происходил так называемый эмбриональный блок развития, то есть эмбрионы останавливали дальнейшее развитие и происходила их дегенерация. В сравнении количество оплодотворенных и прокультивированных до стадии 16-ти, 32-х клеток в среде IVF-Universal составили 58,8 % и 42 %, а количество прокультивированных эмбрионов до поздней стадии развития 35,3 %.
Таким образом, полученные нами результаты показали, что при культивировании и оплодотворении ооцитов наиболее высокие показатели отмечены у среды IVF- Universal. При морфологической оценке на степень оплодотворения, наличие пронуклеусов обнаружено в среде Дюльбекко у 18,9 %, в ФЖ у 32,9 % и в среде IVF- Universal у 59,24 % от общего количества отобранных морфологически полноценных ооцитов. Через 24-36 ч. культивирования наличие 2-х бластомеров обнаружено в среде Дюльбекко у 16,8 %, в ФЖ у 21,8 % и в IVF-Universal 64 %, что характеризует также наиболее достоверный показатель оплодотворения фолликулярных ооцитов.
1-й столбик – обнаружено пронуклеусов
2-й столбик – 2-х бластомерные
3-й столбик – 4,6-ти бластомерные
4-й столбик – 16,32-х бластомерные
5-й столбик – морулы и бластоцисты
При культивировании дальнейшее дробление до 4, 6-ти бластомеров продолжили 8 %, 12,6 % и 49,3 % от общего числа ооцитов. Все эти данные показывают о том, что использование в работах среды IVF-Universal намного эффективнее и превышают показатели других систем при дозревании и оплодотворении ооцитов, а также при культивировании эмбрионов в среднем в десять раз.
Также следует отметить, что при культивировании эмбрионов наблюдалось асинхронное развитие эмбрионов, который по данным ряда авторов характерно даже в естественных условиях развития. Наличие эмбрионов на стадии морулы и 16-ти клеток при одинаковом времени и условии оплодотворения и культивирования. Асинхронность развития эмбрионов в культуре обычно связывают с гетерогенностью созревания ооцитов и в последующим различиями во времени проникновения сперматозоидов в ооциты.
Заключение
После проведения эксперимента по культивированию «in vitro» и экстракорпоральному оплодотворению фолликулярных ооцитов крупного рогатого скота выделенных из фолликулов яичника убойных коров и телок случного возраста получены результаты, которые указывают, что основным условием дозревания и соответственно последующего развития эмбрионов является культуральная система.
При экстракорпоральном культивировании и оплодотворении фолликулярных ооцитов коров в различных культуральных системах в сравнительном аспекте было установлено, что наибольший процент дозревания, оплодотворения и дальнейшего развития эмбрионов наблюдается в синтетической среде IVF- Universal, 64% против 16,8% и 21,8%, а развитие эмбрионов до поздних стадий составил 35,3%, тогда как в двух других использованных культуральных средах не было обнаружено ни одного эмбриона.
Исходя из вышеизложенного можно прийти к выводу, что эмбрионы, полученные на основе экстракорпорального оплодотворения можно использовать в экспериментальных работах клеточной биотехнологии.
Благодарности. Финансирование данного исследования проводилось за счет Агрохолдинга «Байсерке-Агро». Хочу выразить особую признательность и огромную благодарность своему наставнику и другу Баймуканову Дастанбеку Асылбековичу за бесценную помощь в процессе научных исследований. Также я крайне признателен коллективу авторов данной работы, в особенности Каргаевой Макпал Темирхановне за совместную научно-исследовательскую работу, так как она является лучшим специалистом в области животноводства.
СПИСОК ЛИТЕРАТУРЫ
1 Mohamed S. Medan, A.M. Abd El-Aty, Advances in ultrasonography and its applications in domestic ruminants and other farm animals reproduction, Journal of Advanced Research, 10.1016/j.jare.2010.03.003, 1, 2, (123-128), (2010).
2 Bols PE. Puncture of immature ovarian follicles in bovine assisted reproduction. Verh K Acad Geneeskd Belg. 2005;67(3):177-202. PMID: 16089298.
3 Bols, P.E.J., Stout, T.A.E. (2018). Transvaginal Ultrasound-Guided Oocyte Retrieval (OPU: Ovum Pick-Up) in Cows and Mares. In: Niemann, H., Wrenzycki, C. (eds) Animal Biotechnology 1. Springer, Cham. https://doi.org/10.1007/978-3-319-92327-7_10.
4 Hansen PJ. The incompletely fulfilled promise of embryo transfer in cattle-why aren't pregnancy rates greater and what can we do about it? J Anim Sci. 2020 Nov 1;98(11):skaa288. doi: 10.1093/jas/skaa288. PMID: 33141879; PMCID: PMC7608916.
5 Kassens A, Held E, Salilew-Wondim D, Sieme H, Wrenzycki C, Tesfaye D, Schellander K, Hoelker M. Intrafollicular Oocyte Transfer (IFOT) of Abattoir-Derived and In Vitro-Matured Oocytes Results in Viable Blastocysts and Birth of Healthy Calves. Biol Reprod. 2015 Jun;92(6):150. doi: 10.1095/biolreprod.114.124883. Epub 2015 Apr 29. PMID: 25926438.
6 Ризос Д., Уорд Ф., Даффи П., Боланд М.П. ,Лонерган П. 2002 . Последствия созревания ооцитов крупного рогатого скота, оплодотворения или раннего развития эмбрионов in vitro по сравнению с in vivo: влияние на выход бластоцисты и качество бластоцисты . Мол. Репродукция. Дев. 61: 234 – 48.
7 Kate Hardy, Catherine S Wright, Stephen Franks, Robert M L Winston, In Vitro maturation of oocytes, British Medical Bulletin, Volume 56, Issue 3, 2000, Pages 588–602, https://doi.org/10.1258/0007142001903391.
8 Ashry M, Smith GW. Application of embryo transfer using in vitro produced embryos: intrinsic factors affecting efficiency. Cattle Pract. 2015;23(Pt 1):1-8. Epub 2015 Jan 21. PMID: 33384478; PMCID: PMC7773171.
9 Alan D. Crowe, Pat Lonergan, Stephen T. Butler, Invited review: Use of assisted reproduction techniques to accelerate genetic gain and increase value of beef production in dairy herds, Journal of Dairy Science, Volume 104, Issue 12, 2021, Pages 12189-12206, ISSN 0022-0302, https://doi.org/10.3168/jds.2021-20281.
10 Ickowicz D, Finkelstein M, Breitbart H. Mechanism of sperm capacitation and the acrosome reaction: role of protein kinases. Asian J Androl. 2012 Nov;14(6):816-21. doi: 10.1038/aja.2012.81. Epub 2012 Sep 24. PMID: 23001443; PMCID: PMC3720105.
11 Parrish JJ. Bovine in vitro fertilization: in vitro oocyte maturation and sperm capacitation with heparin. Theriogenology. 2014 Jan 1;81(1):67-73. doi: 10.1016/j.theriogenology.2013.08.005. PMID: 24274411; PMCID: PMC3886814.
12 Усенбеков Е.С., Бименова Ж.Ж., Джанабекова Г.К., Кузьмина Т.И., Спанов А.А., Бекенов Д.М., Хизат С. Трансвагинальная аспирация ооцитов у коров-доноров и их экстракорпоральное оплодотворение // XII международная научно-практическая конференция "аграрная наука - сельскому хозяйству" Барнаул, 07–08 февраля 2017 года // сборник статей: в 3 книгах. Том Книга 3. Алтайский государственный аграрный университет. 2017.
13 Сингина Г.Н., Багиров В.А., Данч С.С., Тарадайник Т.Е., Доцев А.В., and Зиновьева Н.А.. "Получение эмбрионов in vitro методом межвидового оплодотворения яйцеклеток коров (Bos taurus) семенем зубра (bison bonasus)" Сельскохозяйственная биология, vol. 51, no. 6, 2016, pp. 824-829.
14 Сингина Г.Н., Лебедева И.Ю., Шедова Е.Н., Тарадайник Т.Е., Митяшова О.С., Цындрина Е.В., and Данч С.С.. "Способность ооцитов коров к эмбриональному развитию при созревании в разных системах двухфазного культивирования" Сельскохозяйственная биология, vol. 52, no. 4, 2017, pp. 776-784.
15 Толмачева И.А. Биотехнология [Электронный ресурс]: учебное пособие / И.А. Толмачева; Пермский государственный национальный исследовательский университет. – Электронные данные. – Пермь, 2022. – 4,26 Мб; 177 с.
16 Soto-Moreno EJ, Balboula A, Spinka C, Rivera RM. Serum supplementation during bovine embryo culture affects their development and proliferation through macroautophagy and endoplasmic reticulum stress regulation. PLoS One. 2021 Dec 9;16(12):e0260123. doi: 10.1371/journal.pone.0260123. PMID: 34882691; PMCID: PMC8659681.
17 Thompson JG, Allen NW, McGowan LT, Bell AC, Lambert MG, Tervit HR. Effect of delayed supplementation of fetal calf serum to culture medium on bovine embryo development in vitro and following transfer. Theriogenology. 1998 Apr 15;49(6):1239-49. doi: 10.1016/s0093-691x(98)00071-5. PMID: 10732061.
18 Rorie RW, Miller GF, Nasti KB, McNew RW. In vitro development of bovine embryos as affected by different lots of bovine serum albumin and citrate. Theriogenology. 1994;42(3):397-403. doi: 10.1016/0093-691x(94)90678-c. PMID: 16727547.
19 Wang JJ, Ge W, Liu JC, Klinger FG, Dyce PW, De Felici M, Shen W. Complete in vitro oogenesis: retrospects and prospects. Cell Death Differ. 2017 Nov;24(11):1845-1852. doi: 10.1038/cdd.2017.134. Epub 2017 Aug 25. PMID: 28841213; PMCID: PMC5635224.
20 Araújo VR, Gastal MO, Figueiredo JR, Gastal EL. In vitro culture of bovine preantral follicles: a review. Reprod Biol Endocrinol. 2014 Aug 13;12:78. doi: 10.1186/1477-7827-12-78. PMID: 25117631; PMCID: PMC4148547.
REFERENCES
1 Mohamed S. Medan, A.M. Abd El-Aty, Advances in ultrasonography and its applications in domestic ruminants and other farm animals reproduction, Journal of Advanced Research, 10.1016/j.jare.2010.03.003, 1, 2, (123-128), (2010).
2 Bols PE. Puncture of immature ovarian follicles in bovine assisted reproduction. Verh K Acad Geneeskd Belg. 2005;67(3):177-202. PMID: 16089298.
3 Bols, P.E.J., Stout, T.A.E. (2018). Transvaginal Ultrasound-Guided Oocyte Retrieval (OPU: Ovum Pick-Up) in Cows and Mares. In: Niemann, H., Wrenzycki, C. (eds) Animal Biotechnology 1. Springer, Cham. https://doi.org/10.1007/978-3-319-92327-7_10.
4 Hansen PJ. The incompletely fulfilled promise of embryo transfer in cattle-why aren't pregnancy rates greater and what can we do about it? J Anim Sci. 2020 Nov 1;98(11):skaa288. doi: 10.1093/jas/skaa288. PMID: 33141879; PMCID: PMC7608916.
5 Kassens A, Held E, Salilew-Wondim D, Sieme H, Wrenzycki C, Tesfaye D, Schellander K, Hoelker M. Intrafollicular Oocyte Transfer (IFOT) of Abattoir-Derived and In Vitro-Matured Oocytes Results in Viable Blastocysts and Birth of Healthy Calves. Biol Reprod. 2015 Jun;92(6):150. doi: 10.1095/biolreprod.114.124883. Epub 2015 Apr 29. PMID: 25926438.
6 Rizos D., Uord F., Daffi P., Boland M.P. ,Lonergan P. 2002 . Posledstviya sozrevaniya oocitov krupnogo rogatogo skota, oplodotvoreniya ili rannego razvitiya embrionov in vitro po sravneniyu s in vivo: vliyanie na vyhod blastocisty i kachestvo blastocisty . Mol. Reprodukciya. Dev. 61: 234 – 48.7 Kate Hardy, Catherine S Wright, Stephen Franks, Robert M L Winston, In Vitro maturation of oocytes , British Medical Bulletin, Volume 56, Issue 3, 2000, Pages 588–602, https://doi.org/10.1258/0007142001903391.
8 Ashry M, Smith GW. Application of embryo transfer using in vitro produced embryos: intrinsic factors affecting efficiency. Cattle Pract. 2015;23(Pt 1):1-8. Epub 2015 Jan 21. PMID: 33384478; PMCID: PMC7773171.
9 Alan D. Crowe, Pat Lonergan, Stephen T. Butler, Invited review: Use of assisted reproduction techniques to accelerate genetic gain and increase value of beef production in dairy herds, Journal of Dairy Science, Volume 104, Issue 12, 2021, Pages 12189-12206, ISSN 0022-0302, https://doi.org/10.3168/jds.2021-20281.
10 Ickowicz D, Finkelstein M, Breitbart H. Mechanism of sperm capacitation and the acrosome reaction: role of protein kinases. Asian J Androl. 2012 Nov;14(6):816-21. doi: 10.1038/aja.2012.81. Epub 2012 Sep 24. PMID: 23001443; PMCID: PMC3720105.
11 Parrish JJ. Bovine in vitro fertilization: in vitro oocyte maturation and sperm capacitation with heparin. Theriogenology. 2014 Jan 1;81(1):67-73. doi: 10.1016/j.theriogenology.2013.08.005. PMID: 24274411; PMCID: PMC3886814.
12 Usenbekov E.S., Bimenova ZH.ZH., Dzhanabekova G.K., Kuz'mina T.I., Spanov A.A., Bekenov D.M., Hizat S. Transvaginal'naya aspiraciya oocitov u korov-donorov i ih ekstrakorporal'noe oplodotvorenie // XII mezhdunarodnaya nauchno-prakticheskaya konferenciya "agrarnaya nauka - sel'skomu hozyajstvu" Barnaul, 07–08 fevralya 2017 goda // sbornik statej: v 3 knigah. Tom Kniga 3. Altajskij gosudarstvennyj agrarnyj universitet. 2017.
13 Singina G.N., Bagirov V.A., Danch S.S., Taradajnik T.E., Docev A.V., and Zinov'eva N.A.. "Poluchenie embrionov in vitro metodom mezhvidovogo oplodotvoreniya yajcekletok korov (Bos taurus) semenem zubra (bison bonasus)" Sel'skohozyajstvennaya biologiya, vol. 51, no. 6, 2016, pp. 824-829.
14 Singina G.N., Lebedeva I.YU., SHedova E.N., Taradajnik T.E., Mityashova O.S., Cyndrina E.V., and Danch S.S.. "Sposobnost' oocitov korov k embrional'nomu razvitiyu pri sozrevanii v raznyh sistemah dvuhfaznogo kul'tivirovaniya" Sel'skohozyajstvennaya biologiya, vol. 52, no. 4, 2017, pp. 776-784.
15 Tolmacheva I.A. Biotekhnologiya [Elektronnyj resurs]: uchebnoe posobie / I.A. Tolmacheva; Permskij gosudarstvennyj nacional'nyj issledovatel'skij universitet. – Elektronnye dannye. – Perm', 2022. – 4,26 Mb; 177 s.16 Soto-Moreno EJ, Balboula A, Spinka C, Rivera RM. Serum supplementation during bovine embryo culture affects their development and proliferation through macroautophagy and endoplasmic reticulum stress regulation. PLoS One. 2021 Dec 9;16(12):e0260123. doi: 10.1371/journal.pone.0260123. PMID: 34882691; PMCID: PMC8659681.
17 Thompson JG, Allen NW, McGowan LT, Bell AC, Lambert MG, Tervit HR. Effect of delayed supplementation of fetal calf serum to culture medium on bovine embryo development in vitro and following transfer. Theriogenology. 1998 Apr 15;49(6):1239-49. doi: 10.1016/s0093-691x(98)00071-5. PMID: 10732061.
18 Rorie RW, Miller GF, Nasti KB, McNew RW. In vitro development of bovine embryos as affected by different lots of bovine serum albumin and citrate. Theriogenology. 1994;42(3):397-403. doi: 10.1016/0093-691x(94)90678-c. PMID: 16727547.
19 Wang JJ, Ge W, Liu JC, Klinger FG, Dyce PW, De Felici M, Shen W. Complete in vitro oogenesis: retrospects and prospects. Cell Death Differ. 2017 Nov;24(11):1845-1852. doi: 10.1038/cdd.2017.134. Epub 2017 Aug 25. PMID: 28841213; PMCID: PMC5635224.
20 Araújo VR, Gastal MO, Figueiredo JR, Gastal EL. In vitro culture of bovine preantral follicles: a review. Reprod Biol Endocrinol. 2014 Aug 13;12:78. doi: 10.1186/1477-7827-12-78. PMID: 25117631; PMCID: PMC4148547.
Оригинальная статья опубликована:
Бекенов Д.М., Баймуканов Д.А., Каргаева М.Т., Буралхиев Б.А. Оценка эффективности оплодотворения ооцитов и развитие эмбрионов в условиях «in vitro» в молочном скотоводстве // Наука и образование. 2024. № 2-2 (75). С. 189-200. DOI 10.52578/2305-9397-2024-2-2-189-200
Bekenov D.M., Baimukanov D.A., Kargaeva M.T., Buralkhiev B.A. Assessment of the effectiveness of oocyte fertilization and development of embryos in "in vitro" conditions in dairy cattle farming // Science and education. 2024. № 2-2 (75). Р. 189-200. DOI 10.52578/2305-9397-2024-2-2-189-200





































































Комментарии (0)