Изучение роли порошка съедобного щавеля (Rumex К-1) в улучшении показателей роста, здоровья органов и микробиоты слепой кишки у гусят Санхуа
В этом исследовании изучалось влияние диетического порошка щавеля съедобного (EDP) на показатели роста, развитие органов, биохимию сыворотки и микробиоту слепой кишки у гусят саньхуа.
Аннотация
В этом исследовании изучалось влияние пищевого порошка съедобного щавеля (EDP) на показатели роста, развитие органов, биохимию сыворотки крови и микробиоту слепой кишки у гусят Санхуа. В общей сложности 240 гусят были случайным образом распределены по четырем группам: одна контрольная группа (Группа А) и три экспериментальные группы с добавлением EDP в концентрациях 1,00% (Группа В), 2,50% (Группа С) и 4,00% (Группа D). Группа В показала значительное снижение коэффициента конверсии корма (F/G) по сравнению с контрольной группой (р < 0,05). Анализ органов выявил увеличение массы печени и железистого желудка в Группах В и С (р < 0,05). Уровни аспартаттрансаминазы (AST) в сыворотке крови были значительно снижены в группах с EDP (р < 0,05), а уровни глюкозы (GLU) были заметно ниже в Группах С и D по сравнению с контрольной группой (р < 0,05). Анализ микробиоты слепой кишки показал, что Группа В обогащена Prevotella и Streptococcaceae, в то время как Cyanobacteria и Alistipes были выше в Группе С. Кроме того, Desulfovibrio положительно коррелировал с массой железистого желудка, a Oxalobacter — с ADG (р < 0,05). Эти результаты предполагают, что добавка 1,00-2,50% EDP поддерживает рост, улучшает здоровье печени и кишечника, а также оптимизирует состав микробиоты, предоставляя жизнеспособную стратегию функционального кормления для гусят.
1. Введение
В последние годы глобальный спрос на безопасность пищевых продуктов и экологическую устойчивость возрос. Разработка эффективных и экологически чистых кормовых добавок стала ключевым направлением исследований в производстве водоплавающих птиц. Натуральные растительные кормовые добавки привлекают внимание благодаря их богатому питательному профилю и разнообразным преимуществам для здоровья [1, 2, 3].
Съедобный щавель (Rumex patientia L. x Rumex tianschanicus cv. Rumex K-1) — многолетнее травянистое растение семейства Polygonaceae, широко распространенное в Европе, Северной Америке и Азии, ценящееся за высокую адаптивность и экологическую гибкость [4]. В отличие от многих других растительных кормовых добавок, съедобный щавель особенно богат высококачественным белком и аминокислотами, а также полифенолами и флавоноидами, такими как кверцетин и кемпферол, а также пищевыми волокнами и необходимыми минералами. Эти компоненты придают съедобному щавелю значительные антиоксидантные, антибактериальные и противовоспалительные свойства, делая его перспективной натуральной кормовой добавкой для птицы [5]. Кроме того, его высокое содержание волокон служит важным субстратом для микробиоты слепой кишки, поддерживая рост полезных микробных сообществ и способствуя здоровью кишечника [6]. Недавние исследования показали, что добавка порошка листьев съедобного щавеля может улучшить показатели роста, повысить активность антиоксидантных ферментов и стимулировать полезный состав микробиоты слепой кишки у бройлеров [7]. Другое исследование продемонстрировало, что пищевая добавка порошка листьев Rumex nepalensis повысила производительность и улучшила иммунный антиоксидантный статус у цыплят-бройлеров [8]. Эта уникальная комбинация богатого белком питания и широких преимуществ для здоровья позиционирует съедобный щавель как устойчивую и эффективную кормовую добавку для птицы.
Гусь Санхуа — травоядная порода птицы, широко разводимая в южном Китае, высоко ценимая фермерами за отличные показатели роста и адаптивность [9]. Ювенильная стадия гусят Санхуа имеет решающее значение для определения их будущего потенциала роста и состояния здоровья, что делает необходимым оптимизировать их рост и здоровье через научно управляемое питание в этот период. Травоядная птица имеет пищеварительную систему, особенно адаптированную к растительным рационам, эффективно используя целлюлозу и другие сложные углеводы, что позиционирует порошок съедобного щавеля как уникально выгодную добавку в питании гуся Санхуа [10]. Слепая кишка, важная часть пищеварительной системы, содержит богатую микробную популяцию, которая жизненно важна для расщепления целлюлозы, производства короткоцепочечных жирных кислот и поглощения питательных веществ [11]. Таким образом, включение порошка съедобного щавеля, богатого функциональными компонентами, в рацион гусят Санхуа может помочь регулировать структуру и функцию микробиоты слепой кишки, приводя к улучшению показателей роста и общего здоровья.
Хотя исследования по съедобному щавелю растут, его практическое применение в питании водоплавающих птиц остается относительно ограниченным. Поэтому это исследование стремится тщательно оценить влияние порошка съедобного щавеля на показатели роста, здоровье органов, биохимию сыворотки крови и микробиоту слепой кишки у гусят Санхуа. Мы предполагаем, что соответствующее включение порошка съедобного щавеля оптимизирует микробиоту слепой кишки, тем самым значительно улучшая показатели роста и состояние здоровья гусят. Это исследование предоставит новые научные insights в использование растительных кормовых добавок в производстве травоядной птицы и обеспечит теоретическую поддержку для улучшения стратегий питания гусят Санхуа.
2. Методы исследования и материалы
Исследование животных было проведено после одобрения Комитета по уходу и использованию животных Шанхайской академии сельскохозяйственных наук (Номер одобрения SAASPZ0522050). Экспериментальные процедуры соответствовали «Руководствам по благополучию экспериментальных животных» (GB/T 42011-2022) [12]. Были приняты все необходимые меры для обеспечения минимального дистресса у гусей в ходе этого исследования.
В этом исследовании было выбрано в общей сложности 240 трехдневных гусят Санхуа. Гусята содержались в поднятых вольерах, расположенных на высоте 50-60 см над землей. Каждый вольер имел длину 2,5 м, ширину 1,5 м и высоту 1 м, оснащенный пластиковыми сетчатыми матами с отверстиями 1 см х 1 см для предотвращения застревания ног гусят. Каждый вольер был оснащен кормушками и поилками, обеспечивая гусятам неограниченный доступ к корму и воде. Лампа накаливания была установлена в центре каждого вольера для локального обогрева, в то время как общая температура в помещении регулировалась с помощью тепловоздушного обогревателя. В первую неделю температура окружающей среды в помещении поддерживалась около 20 °C, с температурой непосредственно под лампой накаливания 30 °C. По мере продвижения исследования температура в помещении постепенно снижалась до 15 °C, с температурой под лампой накаливания, уменьшающейся до 21 °C. Уровни влажности контролировались между 60% и 65% для создания оптимальной среды для роста гусят. Программа освещения также тщательно управлялась на протяжении 28-дневного экспериментального периода. С 1 по 7 дни возраста гусята подвергались 23 ч света и 1 ч темноты ежедневно, с интенсивностью света 25 люкс. С 8 по 28 дни продолжительность света снижалась до 16 ч ежедневно, с интенсивностью 15 люкс. Эта программа освещения была разработана для оптимизации потребления корма в ранней фазе и симуляции естественных условий в поздней фазе, способствуя здоровому росту и развитию.
Количества порошка съедобного щавеля (EDP), премикса и ингредиентов корма точно рассчитывались на основе экспериментального дизайна. EDP был предоставлен Shanxi Sinuote Biotechnology Со., Ltd. (Сиань, Китай). Он сначала тщательно смешивался с премиксом в указанных пропорциях, а затем комбинировался с ингредиентами корма в механическом смесителе корма (Модель YS-B20101401, Weifang Youshun Environmental Technology Co., Ltd., Цинчжоу, Китай) для обеспечения однородности. Для поддержания воспроизводимости эксперимента и надежности данных все корма готовились свежими еженедельно в соответствии с экспериментальными требованиями.
Эксперимент проводился в выводковом помещении на базе Zhuanghang Шанхайской академии сельскохозяйственных наук в течение четырех недель. Все протоколы вакцинации и оценки здоровья проводились в соответствии с соответствующими стандартами объекта.
Для этого эксперимента 240 гусят Санхуа были получены от Xiangtian Ge Family Farm (Мааньшань, Китай), провинция Аньхой. Перед началом эксперимента все гусята были взвешены и случайным образом разделены на четыре группы обработки, каждая из которых содержала шесть повторений с 10 гусями на повторение. Диетические обработки определялись следующим образом: Группа А (контроль) получала рацион без добавки EDP, Группа В получала рацион с 1,00% EDP, Группа С получала рацион с 2,50% EDP, а Группа D получала рацион с 4,00% EDP. Формулы рационов для каждой группы были тщательно разработаны на основе питательных стандартов для коммерческих мясных гусей, рекомендованных DB37/T 2784-2016 [13], с учетом конкретных питательных свойств EDP.
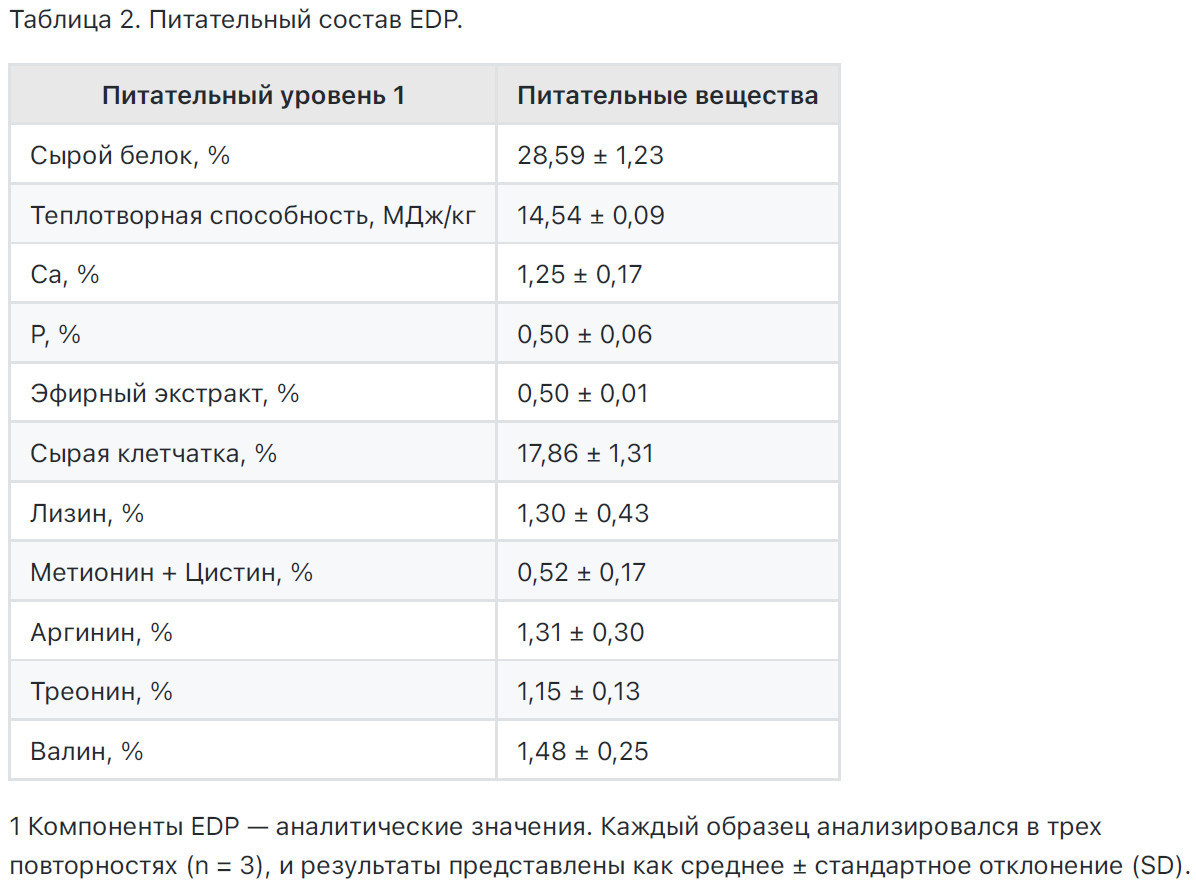
Содержание сырого белка (СР) измерялось в соответствии с методами, установленными АОАС, 2005 [14]. Метаболизируемая энергия (ME) определялась как низшая теплотворная способность (LHV) в исходном виде с использованием кислородной бомбовой калориметрии (U-THERM, YXZR9302, Чанша, Китай) в соответствии с Miller и Judd [15]. Образцы, высушенные в печи (105 °C), измельчались, сжигались (1,0 г, 2,5-3,0 МПа кислорода) и тестировались в трех повторностях. Результаты сообщались как среднее ± стандартное отклонение. Содержание сырой клетчатки (СЕ) анализировалось в соответствии с процедурами АОАС (2000) [16], в то время как содержание сырой жира (ЕЕ) оценивалось в соответствии с руководствами АОАС (1930) [17]. Уровни кальция (Са) анализировались с использованием процедуры, детализированной в АОАС (1985а) [18], а уровни фосфора (Р) определялись в соответствии с методом, описанным в АОАС (19855) [19]. Профиль аминокислот порошка съедобного щавеля (EDP) определялся Engel Testing Services (Shanghai) Co., Ltd. (Шанхай, Китай), используя методы, указанные в Китайском национальном стандарте (GB/T 18246-2019) [20]. Состав рационов и питательные значения для каждой группы обработки представлены в Таблице 1, в то время как профиль питательных веществ EDP представлен в Таблице 2.
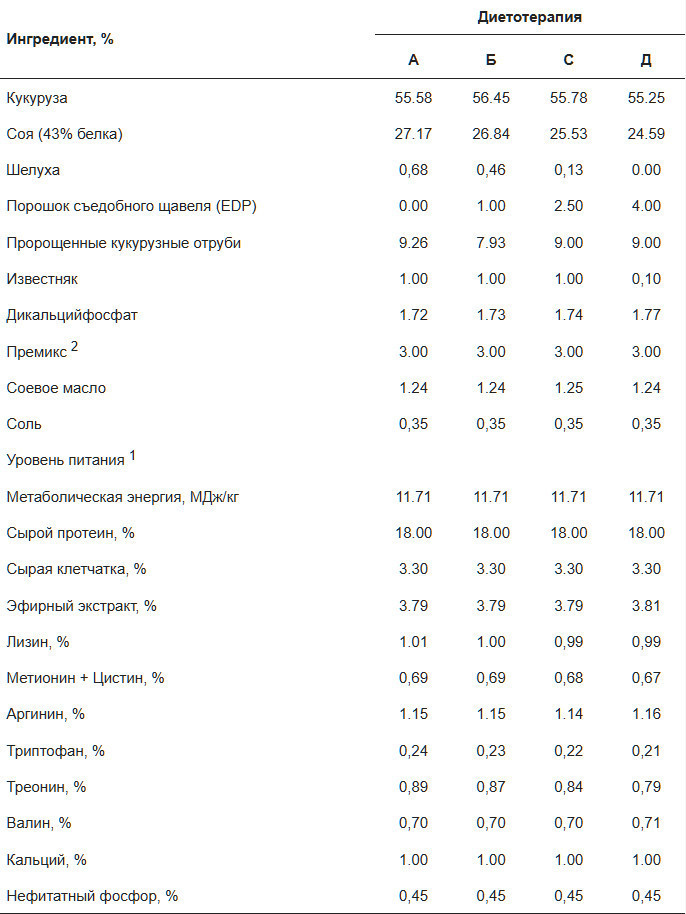
1 Расчетная концентрация питательных веществ: состав питательных веществ рациона является расчетным значением.
2 В одном килограмме корма в премиксе содержится: витамин А 7500 МЕ, витамин В1 1,0 мг, витамин В2 6 мг, пантотеновая кислота 9,2 мг, витамин В6 1,8 мг, витамин В12 0,10 мг, витамин D3 1600 МЕ, витамин Е 13,5 МЕ, витамин К3 2 мг, биотин 0,1 мг, фолиевая кислота 0,4 мг, ниацин 60 мг, холин 1400 мг, медь 6 мг, железо 80 мг, марганец 100 мг, цинк 80 мг, йод 0,42 мг, селен 0,3 мг, кальций 3 г и фосфор 0,99 г.
В начале эксперимента каждый гусь Санхуа взвешивался после 12-часового голодания для измерения начальной массы тела (IBW). Такая же процедура повторялась на 4-й неделе эксперимента для регистрации конечной массы тела (FBW) каждого гуся в конце периода выкармливания. Данные использовались для расчета среднего суточного прироста (ADG) для каждого гуся. На протяжении эксперимента потребление корма для каждого повторения тщательно отслеживалось для расчета среднего суточного потребления корма (ADFI) и коэффициента F/G. Кроме того, смертность и коэффициент выбраковки для каждого повторения отслеживались и регистрировались на протяжении эксперимента.
Формулы, используемые для оценки показателей роста, следующие:
ADG - (FBW - 1В\Л/)/Продолжительность эксперимента (дни)
F/G - Общее потребление корма/Общий прирост массы
ADFI - F/G х ADG
Коэффициент смертности и выбраковки - (Количество смертей и выбраковок в каждом повторении/Общее количество особей в каждом повторении) х 100%
На 4-й неделе эксперимента из каждого повторения группы выбирались два гуся с сопоставимыми массами тела, с шестью повторениями на группу обработки, что приводило к общему количеству 12 гусят, отобранных на группу обработки. Эти выбранные гусята подвергались 12-часовому голоданию. Анестезия вводилась через крыловую вену с использованием 30 мг/кг натрия пентобарбитала. После достижения полной анестезии профессиональный забойщик выполнял экссангуинацию путем перерезания сонной артерии.
После подтверждения отсутствия жизненно важных признаков собирались образцы. После убоя сердце, печень, селезенка, преджелудок, тимус, двенадцатиперстная кишка, тощая кишка и подвздошная кишка тщательно отделялись и взвешивались. Перед взвешиванием весь кишечный тракт промывался физиологическим раствором для удаления любого внутреннего содержимого.
Формула для определения относительной массы органа следующая:
Относительная масса органа - (Масса органа/Масса тела) х 100%
Во время процесса экссангуинации, выполняемого профессиональным забойщиком через сонную артерию, использовалась пробирка для коагуляции крови для сбора 5 мл крови от каждого гуся. После того, как кровь оставалась неподвижной в течение 1 ч, сыворотка отделялась путем центрифугирования при 4000 об/мин в течение 8 мин. Собранная сыворотка использовалась для биохимического анализа и отправлялась в Shanghai Pinyi Biotechnology Со., Ltd. (Шанхай, Китай) для дальнейшего тестирования. Биохимические параметры, оцениваемые, включали аланинаминотрансферазу (ALT), аспартатаминотрансферазу (AST), общий белок (ТР), альбумин (ALB), глобулин (GLB), азот мочевины крови (BUN), глюкозу (GLU), общий холестерин (CHOL), общие триглицериды (TG), холестерин липопротеинов высокой плотности (HDL-C) и холестерин липопротеинов низкой плотности (LDL-C). Все биохимические параметры анализировались с использованием автоматического биохимического анализатора (HITACHI 7180, HITACHI, Токио, Япония) в соответствии с руководствами производителя.
Во время процесса убоя содержимое слепой кишки собиралось от каждого гуся и немедленно помещалось в криогенные пробирки, которые сохранялись в жидком азоте для обеспечения целостности образцов. Затем образцы отправлялись в Suzhou PANOMICS Biomedical Technology Со., Ltd. (Сучжоу, Китай) для секвенирования 16S рРНК. Микробная ДНК извлекалась из содержимого слепой кишки с использованием набора Tianamp Stool DNA Kit (Tiangen Biotech Co., Ltd., Пекин, Китай) в соответствии с инструкциями производителя. После оценки качества ДНК подвергалась ПЦР-амплификации с использованием праймеров, специфичных для региона V3-V4 гена 16S рРНК (F: ACTCCTACGGGAGGCAGCA; R: GGACTACHVGGGTWTCTAAT). Амплифицированные продукты затем очищались, количественно определялись и секвенировались с использованием платформы высокопроизводительного секвенирования Illumina. Полученные данные последовательностей подвергались биоинформатическому анализу, включая сборку последовательностей, контроль качества, удаление шума и классификацию операционных таксономических единиц (OTU). Наконец, эти анализы использовались для оценки разнообразия, состава и относительного обилия микробных сообществ слепой кишки у гусят.
3. Статистика и анализ
Данные, собранные в эксперименте, первоначально обрабатывались с использованием Microsoft Excel 2007, за которым следовала дальнейшая статистическая обработка с помощью SPSS 19.0. Однофакторный дисперсионный анализ (ANOVA) выполнялся для оценки влияния различных уровней добавки EDP на измеряемые параметры. Для каждой группы обработки выполнялась описательная статистика, рассчитывая среднее и SEM, нормальность данных оценивалась с использованием теста Шапиро-Уилка, а гомогенность дисперсии подтверждалась тестом Левена. Если ANOVA выявлял значительные различия между группами (р < 0,05), применялся тест множественных сравнений Данкана для пост-хок анализа для выявления конкретных различий между группами. Результаты сообщались как среднее ± SEM, и значение р ниже 0,05 считалось статистически значимым. Анализ данных выполнялся с использованием следующей модели: где
4. Результаты
Результаты показателей роста представлены в Таблице 3. Не было значительных различий в IBW между группами обработки (р > 0,05), что указывает на то, что исходные условия соответствовали экспериментальному дизайну. Коэффициент F/G в Группах В и D был значительно ниже по сравнению с контрольной группой (р < 0,05). Хотя не было статистически значимых различий в коэффициентах смертности и выбраковки между группами обработки (р - 0,207), Группы В, С и D демонстрировали тенденцию к снижению, с уменьшениями на 13,02%, 6,84% и 6,08% соответственно по сравнению с контрольной группой.
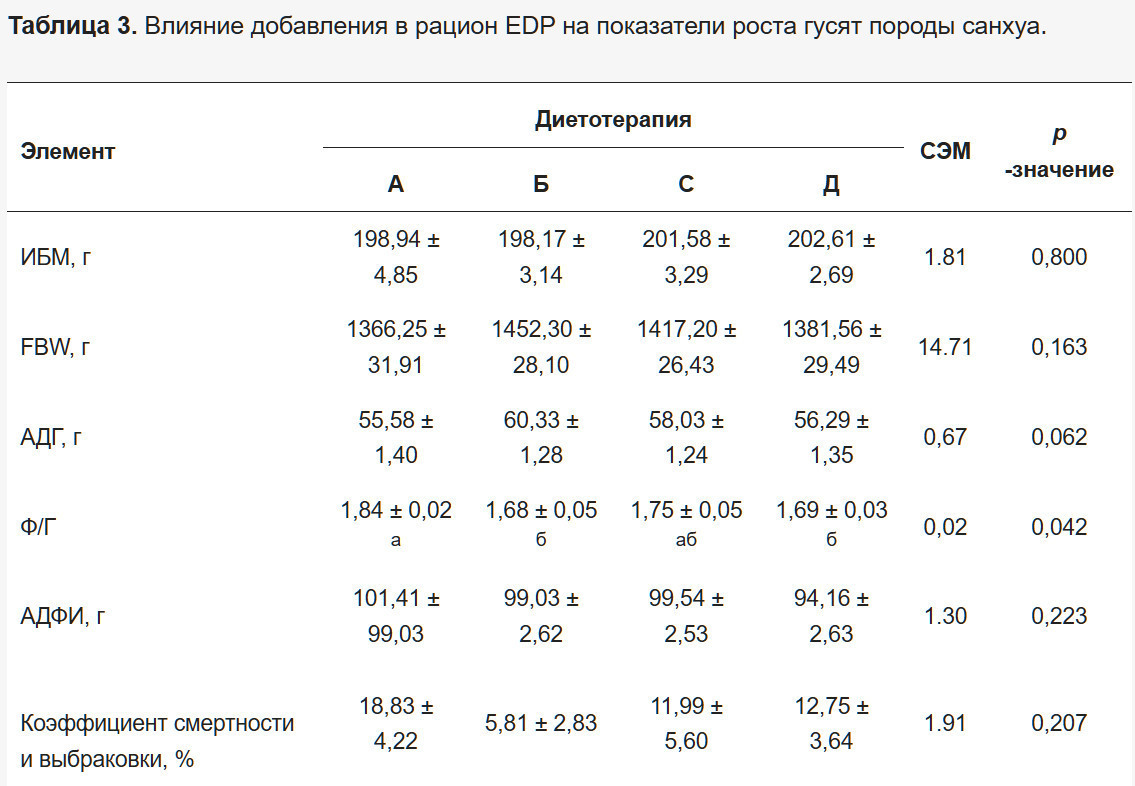
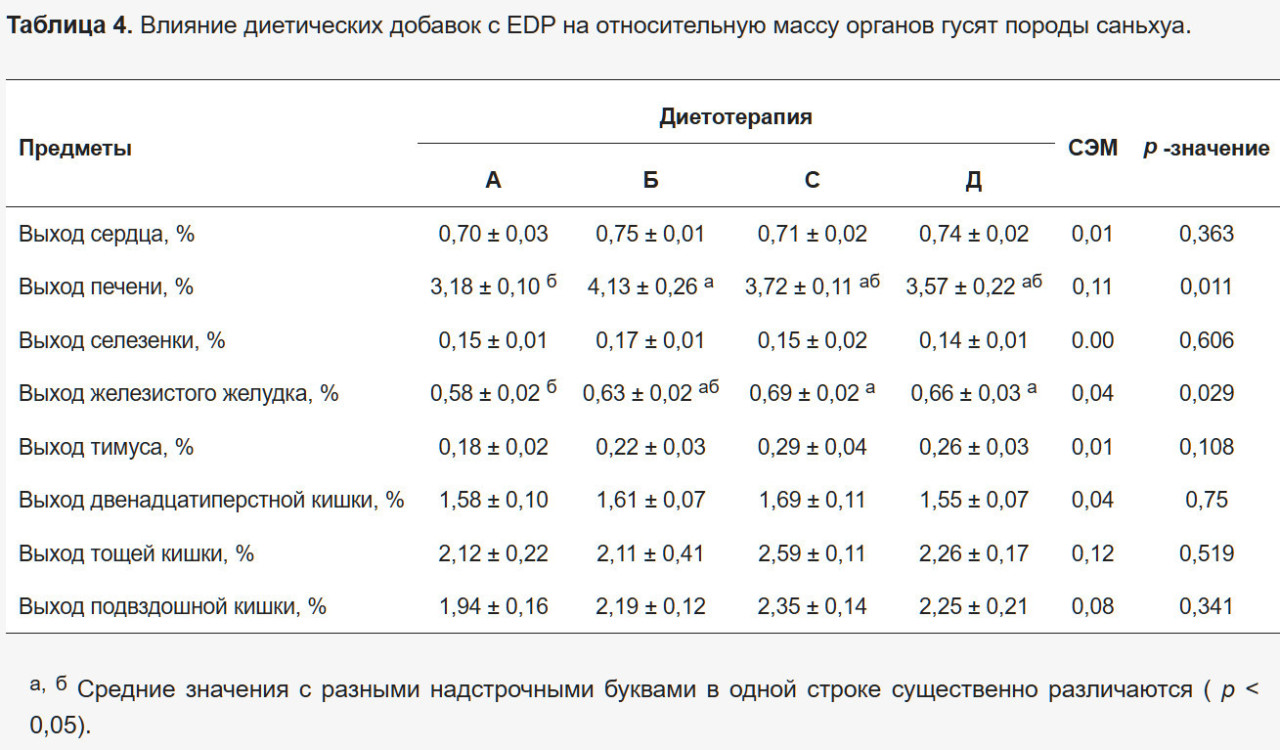
Результаты относительной массы органов представлены в Таблице 4. Группа В демонстрировала значительно более высокую относительную массу печени по сравнению с контрольной группой (р < 0,05), в то время как Группы С и D показывали значительно более высокую относительную массу железистого желудка (р < 0,05). Не было значительных различий в других параметрах (р > 0,05).
Биохимические параметры сыворотки крови суммированы в Таблице 5. Уровни AST были значительно ниже в Группах В, С и D по сравнению с контрольной группой (р < 0,05). Однако не было значительных различий между группами для уровней ALT, TP, ALB, GLB, BUN, CHOL, TG, HDL- с и LDL-c (р > 0,05). Кроме того, уровни GLU в Группах С и D были значительно снижены по сравнению с контрольной группой (р < 0,05).
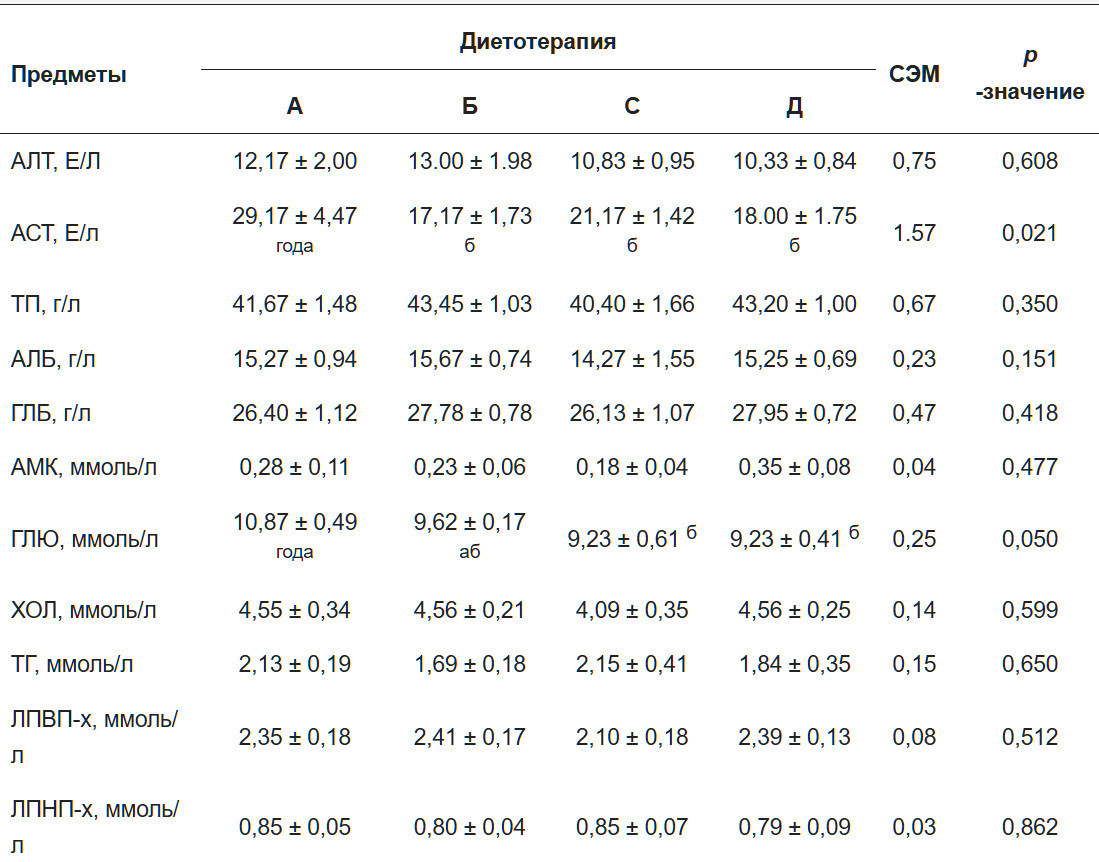
Примечания: ALT: аланинаминотрансфераза; AST: аспартатаминотрансфераза; ТР: общий белок; ALB: альбумин; GLB: глобулин; BUN: азот мочевины крови; GLU: глюкоза; CHOL: общий холестерин; TG: общие триглицериды; HDL-c: холестерин липопротеинов высокой плотности; LDL-c: холестерин липопротеинов низкой плотности; а,Ь средние с разными верхними индексами в одной строке значительно различаются (р < 0,05).
Результаты структуры и разнообразия микробного сообщества слепой кишки показаны на Рисунке 1. Как анализ главных координат (РСоА), так и немногомерное шкалирование (NMDS) продемонстрировали значительные различия в структурах микробных сообществ слепой кишки между группами обработки (Рисунок 1А,В). Анализ РСоА продемонстрировал четкое разделение микробного сообщества в Группе А от тех в Группах В, С и D, предполагая заметные межгрупповые различия (р < 0,05). Анализ NMDS®—подтвердил это открытие, раскрывая четкое разделение между Группой А и другими группами. Анализ диаграммы Венна показал, что Группы А, В, С и D имели 4570, 4513, 3817 и 3417 уникальных OTU соответственно, с только 109 OTU, общими для всех четырех групп (Рисунок 1L). Эти результаты указывают на то, что хотя есть некоторые общие микробные виды между группами, каждая группа обработки также содержала большое количество уникальных микробных сообществ. Результаты альфа-разнообразия (Рисунок 1D) показали, что индекс Chad и количество наблюдаемых видов в Группах А и В были значительно ниже, чем в Группе D (р < 0,05), в то время как индексы Симпсона и Шеннона не показывали значительных различий между группами (р > 0,05).
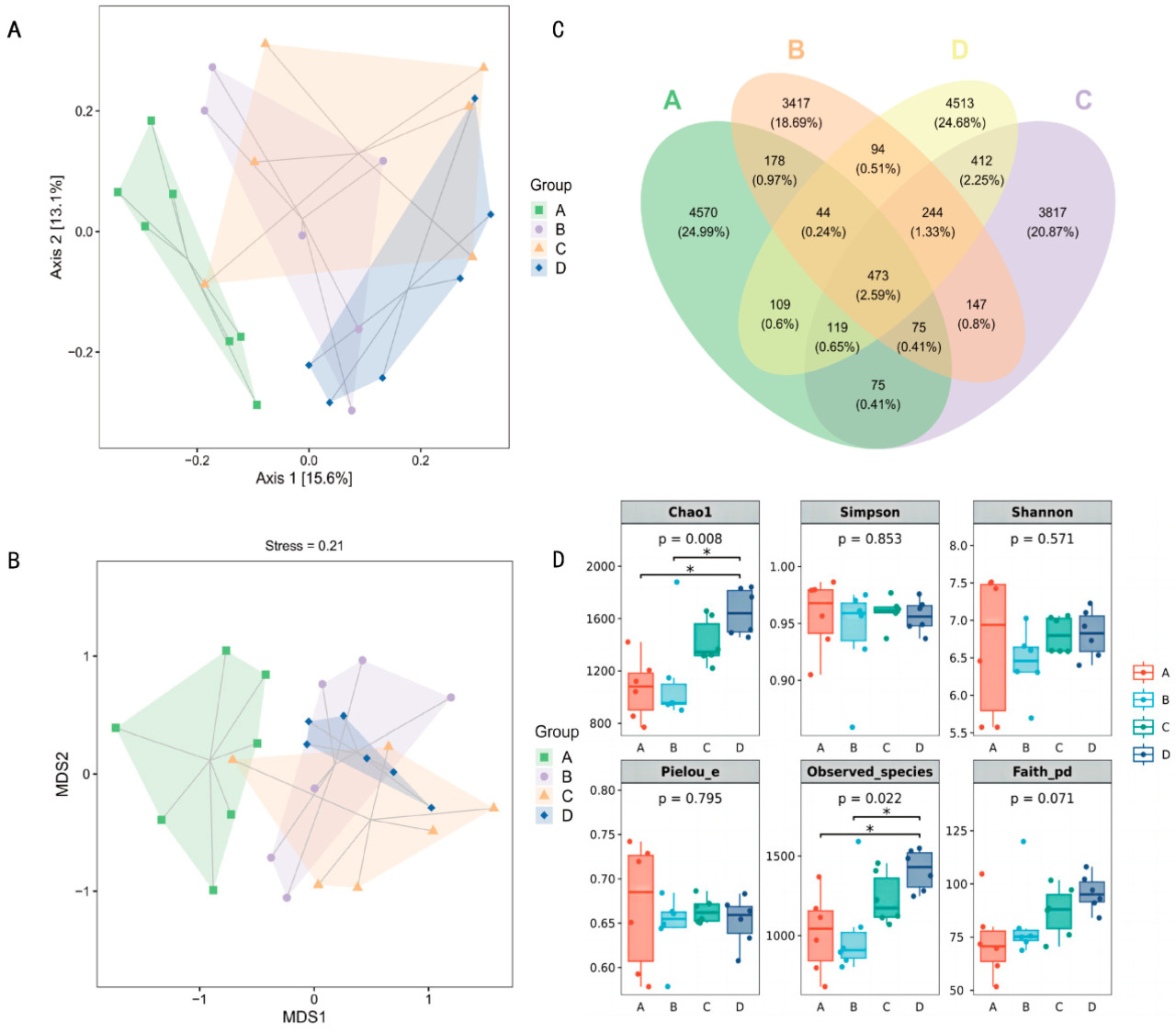
Рисунок 2 отображает состав и относительные пропорции микробных сообществ слепой кишки. Состав микробиоты слепой кишки на уровне филума был похожим во всех группах обработки, с топ-10 филумами: Bacteroidetes, Firmicutes, Proteobacteria, Verrucomicrobia, Actinobacteria, Deferribacteres, Tenericutes, Elusimicrobia, Lentisphaerae и Cyanobacteria (Рисунок 2A). На уровне рода состав микробиоты слепой кишки также был похожим между группами, с топ-20 родами: Bacteroides, Desulfovibrio, Faecalibacterium, Barnesiella, Streptococcus, Helicobacter, Oscillospira, Odoribacter, Phascolarctobacterium, [Ruminococcus], YRC22, Prevotella, Parabacteroides, Akkermansia, Subdoligranulum, Ruminococcus, Rikenella, Megamonas, Alistipes и Mucispirillum (Рисунок 2B). Для лучшей оценки вариаций в составе видов между образцами, визуализации тенденций обилия видов и выявления ключевых маркерных видов между группами были созданы кладограммы LEfSe (Рисунок 3). В Группе А значительно обогащенным филумом был Deferribacteres, с родом Mucispirillum, заметно обогащенным. В Группе В значительно обогащенными родами и таксонами были Prevotella и Streptococcaceae. В Группе С обогащенными таксонами были Desulfovibrio, Dehalobacterium и Enterococcus. В Группе D значительно обогащенным филумом был Cyanobacteria, с родом Alistipes, заметно обогащенным.
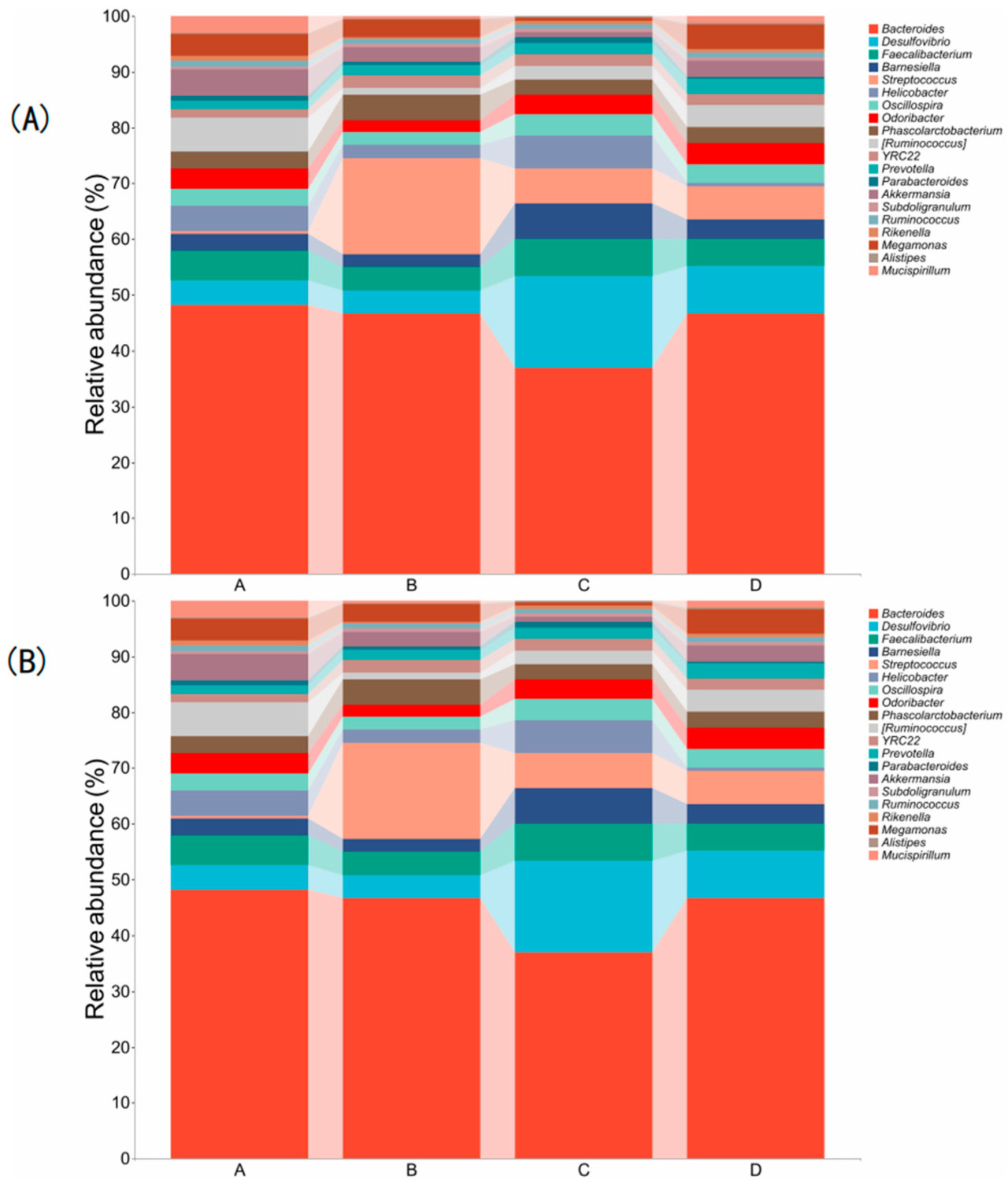
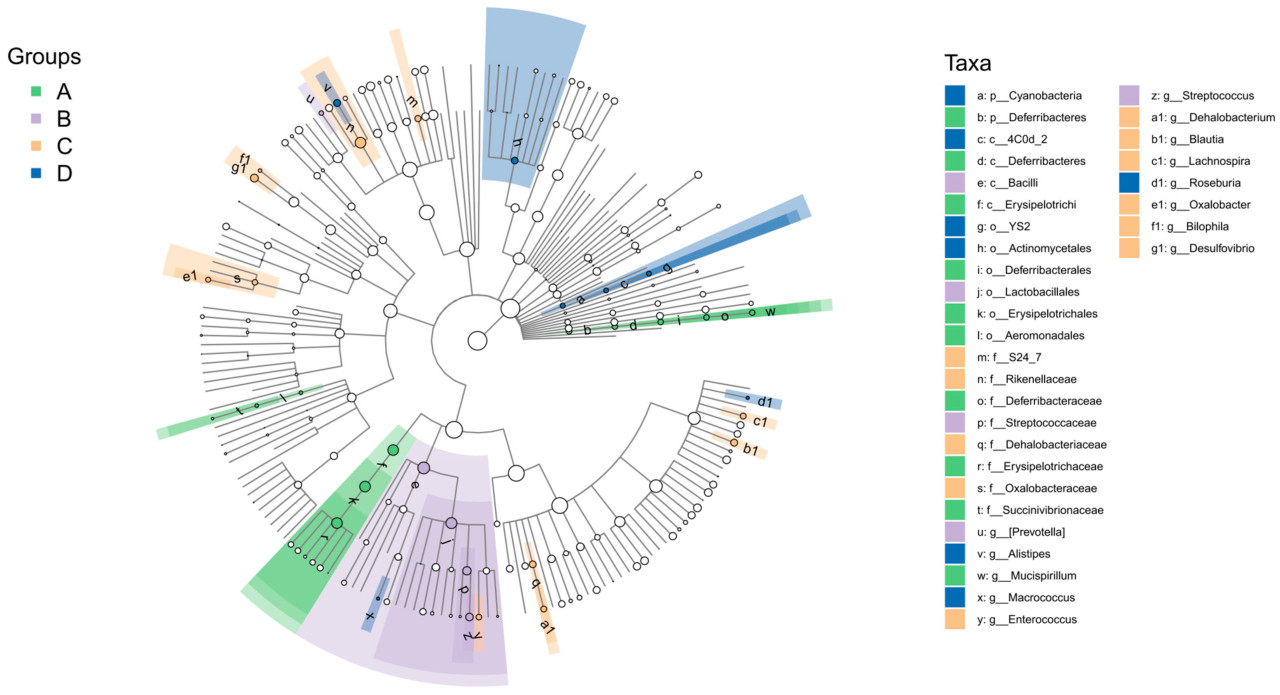
Рисунок 4 (А1,А2) отображает филумы с заметными различиями в относительном обилии между группами обработки на уровне филума. Группа D имела значительно более высокое относительное обилие Cyanobacteria по сравнению с другими группами (р < 0,05) (Рисунок 4 (А1)), в то время как Deferribacteres показывали значительно большее относительное обилие в Группе А по сравнению с остальными (р < 0,05) (Рисунок 4 (А2)). Рисунок 4 (В1-В6) отображает роды с значительными различиями в относительном обилии между группами обработки на уровне рода. Alistipes и Oxalobacter имели значительно более высокое относительное обилие в Группах С и D по сравнению с Группой А (р < 0,01) (Рисунок 4 (В1,В6)). Desulfovibrio, Dehalobacterium и Enterococcus показывали значительно более высокое относительное обилие в Группе С по сравнению с контрольной группой (р < 0,05) (Рисунок 4 (В2,В4,В5)). Относительное обилие Mucispirillum было значительно больше в Группе А по сравнению с другими группами обработки (р < 0,05) (Рисунок 4 (ВЗ)).
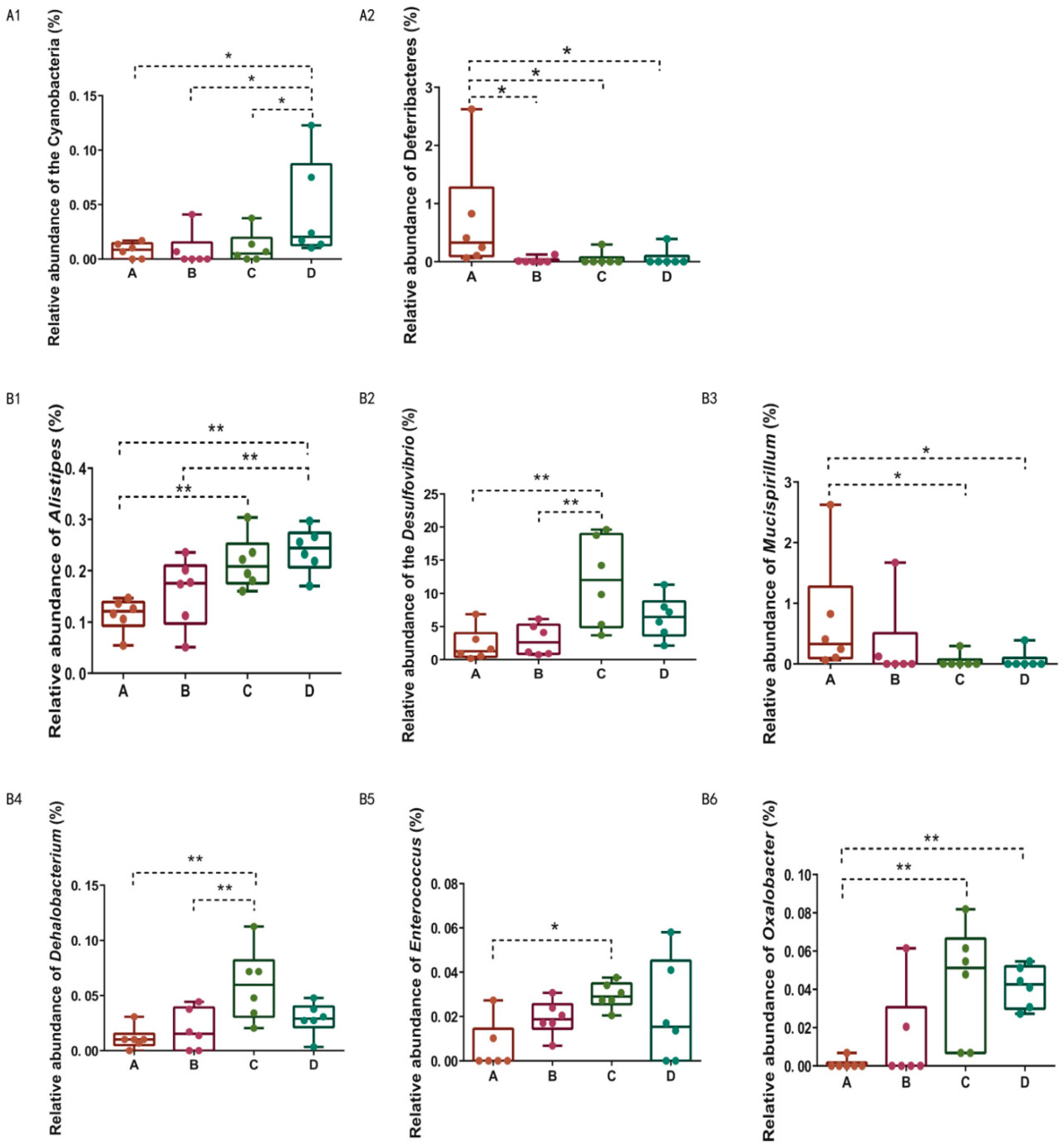
Примечание: Звездочки (*) указывают на статистически значимые различия между группами, р < 0,05 обозначается *, р < 0,01 обозначается **.
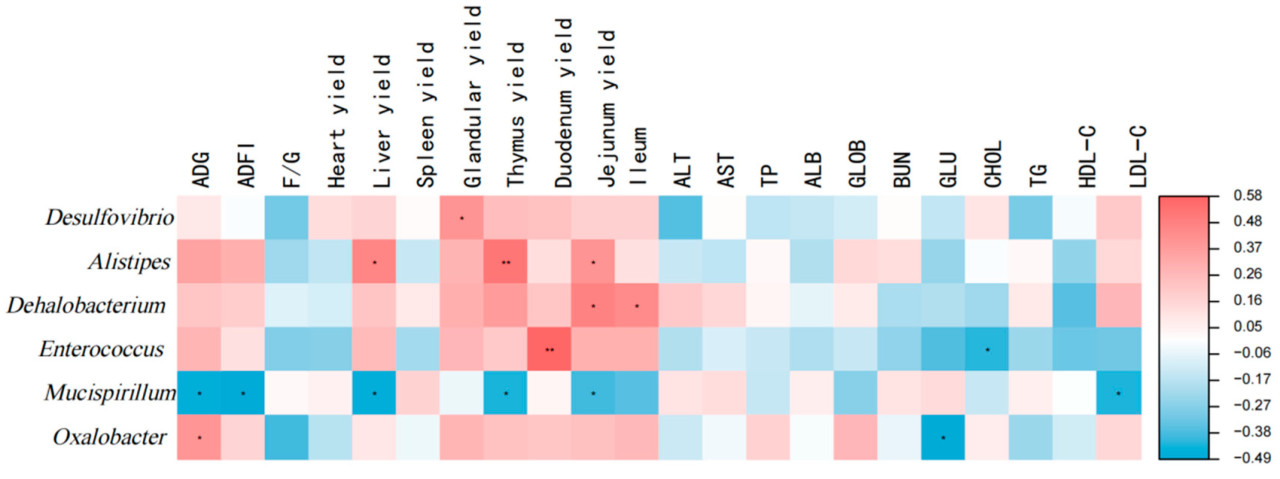
Результаты анализа корреляции отображены на Рисунке 5. Desulfovibrio демонстрировал значительную положительную корреляцию с относительной массой железистого желудка (р < 0,05). Alistipes демонстрировал значительную положительную ассоциацию с относительными массами печени, тимуса и тощей кишки (р < 0,05). Dehalobacterium показывал значительную положительную корреляцию с относительными массами тощей и подвздошной кишки (р < 0,05). Enterococcus демонстрировал значительную положительную ассоциацию с относительной массой двенадцатиперстной кишки и отрицательную корреляцию с уровнями сывороточного CHOL (р < 0,05). Mucispirillum демонстрировал значительную отрицательную корреляцию с ADG, ADFI и уровнями LDL-C, а также с относительными массами печени, тимуса и тощей кишки (р < 0,05). Oxalobacter демонстрировал сильную положительную корреляцию с ADG и обратную корреляцию с уровнями сывороточного GLU (р < 0,05).
5. Обсуждение
В последние годы, с продвижением исследований в питании птицы, потенциал натуральных растительных добавок в улучшении производственных показателей привлек широкое внимание [21, 22]. Порошок съедобного щавеля, как натуральная добавка, продемонстрировал значительную ценность применения в этом исследовании. Результаты показали, что добавка EDP эффективно улучшила эффективность конверсии корма, особенно в определенных группах обработки, где коэффициент конверсии корма был заметно снижен, указывая на улучшенное использование корма. Хотя различия в коэффициентах смертности и выбраковки между группами обработки не были статистически значимыми, наблюдалась тенденция к снижению в группах с EDP, предполагая его потенциальную роль в улучшении выживаемости и здоровья. Кроме того, EDP показал положительное влияние на развитие органов, с увеличением относительных масс печени и железистого желудка в некоторых группах, указывая на его потенциал в улучшении поглощения питательных веществ и метаболических функций через улучшенное развитие пищеварительных органов. Эти результаты предполагают, что соответствующие уровни EDP не только улучшают показатели роста, но и способствуют здоровью органов, внося вклад в общее благополучие водоплавающих птиц.
EDP содержит обильные необходимые аминокислоты, включая метионин, лизин, триптофан и валин, предлагая высококачественные источники азота, которые усиливают депонирование азота и способствуют ускоренному росту у гусей [23]. Кроме того, EDP богат полифенолами и флавоноидами, известными своими антиоксидантными, противовоспалительными и иммуномодулирующими эффектами. Эти вещества, вероятно, снижают окислительный стресс, защищают клетки от повреждения свободными радикалами и таким образом помогают поддерживать здоровье гусей [24].
Что касается развития органов, добавка EDP привела к заметному увеличению относительных масс печени и железистого желудка, указывая на то, что EDP положительно влияет на рост и функцию этих органов. Поскольку печень является ключевым метаболическим органом, богатые антиоксидантные компоненты EDP, такие как кверцетин и кемпферол, могут снижать окислительный стресс, таким образом защищая клетки печени и улучшая метаболизм липидов и углеводов для предоставления большего количества энергии для роста [25]. Кроме того, высококачественное содержание белка и аминокислот в EDP может поддерживать развитие печени и железистого желудка, поставляя необходимые питательные вещества, необходимые для их роста и активности. Развитие железистого желудка также может быть связано с высоким содержанием пищевых волокон в EDP, которые способствуют моторике желудочно-кишечного тракта и стимулируют секрецию пищеварительных жидкостей, тем самым улучшая усвояемость и использование питательных веществ в верхнем пищеварительном тракте [26]. Эти комбинированные эффекты предполагают, что разнообразные биоактивные соединения EDP улучшают как пищеварительные, так и метаболические функции в этих органах.
В этом исследовании добавка EDP значительно снизила уровни сывороточного AST и Glu у гусят, указывая на то, что EDP положительно влияет на печеночный и энергетический метаболизм. Как важный ферментативный маркер функции печени, повышенные уровни AST обычно ассоциируются с повреждением клеток печени. Поэтому снижение уровней AST обычно предполагает защиту клеток печени и снижение повреждения печени, что коррелирует с улучшенной функцией печени [27]. Снижение уровней AST может быть обусловлено антиоксидантными свойствами полифенолов и флавоноидов, присутствующих в EDP. Эти соединения хорошо документированы за их мощную антиоксидантную способность, которая позволяет им эффективно удалять свободные радикалы и снижать повреждение клеток печени, вызванное окислительным стрессом. Окислительный стресс является ключевым фактором, приводящим к перекисному окислению липидов и деградации белков в клетках печени. Путем смягчения этого процесса через свои антиоксидантные механизмы EDP помогает сохранять целостность клеток печени [28]. Это наблюдение согласуется с наблюдаемым увеличением относительной массы печени у гусят, предполагая, что EDP не только защищает функцию печени, но и способствует структурному росту органа. Кроме того, значительное снижение уровней сывороточного GLU указывает на то, что EDP также играет роль в регулировании метаболизма глюкозы у гусят. Поддержание соответствующих уровней глюкозы в крови необходимо для нормальных физиологических функций и роста у птицы. Регуляция глюкозы зависит не только от секреции инсулина, но и от чувствительности к инсулину. Полифенольные соединения в EDP могут усиливать чувствительность рецепторов инсулина, облегчая более эффективное поглощение глюкозы периферийными тканями, тем самым помогая в эффективной регуляции уровней глюкозы в крови [29]. У быстро растущих гусят этот улучшенный метаболизм глюкозы обеспечивает стабильный и непрерывный запас энергии, гарантируя удовлетворение высоких энергетических потребностей во время роста. Хотя не было наблюдаемо статистически значимых различий в росте (ADG или FBW) между группами, улучшенная эффективность корма (F/G) в группах с добавкой EDP может указывать на потенциальную тенденцию к лучшему использованию питательных веществ рациона, что требует дальнейшего исследования.
Это исследование тщательно оценило влияние EDP на структуру и разнообразие микробиоты слепой кишки у гусят Санхуа с использованием анализа секвенирования 16S рРНК. Результаты показали, что добавка EDP значительно изменила состав микробиоты слепой кишки. РСоА и NMDS раскрыли четкие разделения между контрольной группой и группами с EDP, предполагая, что EDP заметно изменил общую структуру внутри микробиоты слепой кишки. Эти изменения могут быть приписаны функциональным компонентам EDP, особенно кверцетину и кемпферолу, которые могли избирательно способствовать росту конкретных бактериальных групп путем модификации кишечной среды и доступности питательных веществ [30]. Этой—подтверждается диаграммой Венна, которая показывает, что было относительно мало общих OTU между группами, в то время как значительное количество уникальных OTU присутствовало в каждой группе. Это предполагает, что EDP способствует формированию конкретных микробных сообществ, которые могут играть решающие роли в пищеварении и поддержании здоровья у гусят. Кроме того, анализ альфа- разнообразия раскрыл, что более высокие дозы EDP значительно увеличивали видовое богатство и микробное разнообразие в слепой кишке. Увеличенное видовое разнообразие обычно ассоциируется с улучшенным здоровьем кишечника, поскольку более высокое разнообразие может усиливать стабильность микробного сообщества, помогая хозяину сопротивляться инвазии патогенов и поддерживать функцию кишечника [31].
Добавка EDP значительно изменила таксономический состав микробиоты слепой кишки у гусят Санхуа. Результаты указывали на значительное увеличение относительного обилия Cyanobacteria в группе с высокой дозой EDP, что может быть связано с содержанием пищевых волокон в EDP. Cyanobacteria, вероятно, используют пищевые волокна в EDP как субстрат для ферментации, расщепляя их на короткоцепочечные жирные кислоты (SCFAs), которые имеют решающее значение для поддержания здоровья кишечника и оптимизации энергетического метаболизма хозяина [32, 33]. EDP также заметно увеличил обилие родов Alistipes и Oxalobacter. Alistipes ассоциируется с уровнями пищевых волокон и здоровьем кишечника, эффективно метаболизируя сложные углеводы и производя SCFAs, которые улучшают среду кишечника хозяина [34]. Oxalobacter, с другой стороны, играет решающую роль в метаболизме оксалатов, снижая накопление оксалатов и смягчая их отрицательное влияние на здоровье кишечника. Увеличение Oxalobacter может быть связано с оксалатами, найденными в EDP [35]. Кроме того, относительное обилие Desulfovibrio и Enterococcus также увеличилось в группах с EDP. Desulfovibrio модулирует pH кишечника через редукцию сульфатов, ингибируя рост вредных бактерий [36]. Enterococcus в основном участвует в ферментации молочной кислоты, помогая поддерживать низкий pH в кишечнике, и также производит бактериоцины — антимикробные пептиды, которые ингибируют патогенные бактерии, тем самым улучшая барьерную функцию кишечника [37]. В отличие от этого, добавка EDP значительно снизила относительное обилие филума Deferribacteres и рода Mucispirillum. Высокие уровни Deferribacteres в кишечнике были связаны с воспалительными реакциями, потенциально усугубляя патологические состояния через свои метаболические побочные продукты [38]. Биоактивные соединения в EDP, такие как кверцетин и кемпферол, обладают мощными противовоспалительными и антиоксидантными свойствами, которые, вероятно, модулируют состав микробиоты кишечника, подавляя рост Deferribacteres, таким образом снижая воспаление. Mucispirillum часто ассоциируется с воспалением и патологией кишечника, с его увеличенным обилием обычно рассматриваемым как маркер дисбиоза или воспалительных реакций в кишечнике [39]. Снижение обилия Mucispirillum после добавки EDP предполагает, что EDP может иметь потенциал в смягчении или предотвращении патологий, связанных с воспалением кишечника.
Влияние EDP на микробиоту кишечника отражается не только в изменениях обилия микробов, но и в значительных корреляциях между конкретными микробами и различными физиологическими показателями, раскрывая потенциальные механизмы, лежащие в основе роста, развития и общего здоровья. Анализ корреляции подчеркивает критические роли этих дифференциально обильных родов в физиологическом метаболизме. Ассоциация между Desulfovibrio и функцией железистого желудка может проистекать из его участия в редукции сульфатов и производстве SCFAs. Сульфат- редуцирующие бактерии известны своим участием в метаболических активностях в кишечнике, особенно путем генерации сероводорода, который помогает регулировать пищеварительную функцию и поддерживать кислую среду, благоприятную для поглощения питательных веществ [40]. Увеличение Desulfovibrio предполагает, что EDP может поддерживать здоровье желудочно- кишечного тракта, улучшая пищеварительные функции и оптимизируя микробные сообщества. Значительная корреляция между Alistipes и развитием органов подчеркивает его существенную роль в иммунной регуляции и метаболизме печени. Alistipes производит SCFAs, такие как пропионат и бутират, которые не только обеспечивают энергию для эпителиальных клеток кишечника, но и поддерживают целостность барьера кишечника через противовоспалительные эффекты, поддерживая здоровье печени и иммунной системы [41]. Увеличенное обилие Alistipes, вероятно, отражает способность EDP способствовать здоровью кишечника и функциональности органов через модуляцию микробных метаболических путей. Enterococcus тесно связан с метаболизмом липидов. Исследования показали, что виды Enterococcus обладают пробиотическими свойствами, которые снижают поглощение холестерина, тем самым снижая уровни общего холестерина в сыворотке и улучшая метаболизм липидов [42]. Увеличивая обилие Enterococcus, EDP может улучшать метаболизм липидов у гусят, приводя к улучшенному общему здоровью. Напротив, отрицательная корреляция между Mucispirillum и показателями роста, а также состоянием здоровья, предполагает его ассоциацию с дисбиозом или воспалением кишечника. Этот род часто обогащается во время воспалительных состояний, и его снижение может указывать на улучшение здоровья кишечника, особенно через снижение воспаления и улучшение функций печени, тимуса и кишечника [43]. Добавка EDP могла подавлять чрезмерный рост вредных бактерий, таких как Mucispirillum, значительно улучшая общее здоровье у гусят. Увеличение Oxalobacter связано с его ролью в метаболизме оксалатов. Накопление оксалатов может нарушать поглощение минералов, но Oxalobacter эффективно метаболизирует оксалаты, снижая их накопление и помогая поддерживать баланс минералов и здоровье кишечника [44]. Этот механизм, вероятно, объясняет улучшенный ADG и сниженные уровни сывороточного GLU, наблюдаемые в группе с EDP.
6. Заключения
В заключение, добавление EDP в рацион гусят может улучшить коэффициент конверсии корма и показывает потенциальную тенденцию к снижению коэффициентов смертности и выбраковки, внося вклад в общее здоровье и производственные показатели. EDP регулирует функцию печени и метаболизм глюкозы, обеспечивая стабильный запас энергии, который способствует росту. Кроме того, EDP значительно изменяет микробиоту слепой кишки, стимулируя рост полезных бактерий (таких как Alistipes и Oxalobacter), в то же время ингибируя вредные бактерии (такие как Mucispirillum), тем самым улучшая здоровье кишечника и поддерживая физиологическое развитие. Как функциональная растительная кормовая добавка, это исследование предварительно подтвердило поддерживающие эффекты EDP на показатели роста и здоровье кишечника у гусят Санхуа.
Для дальнейшего подтверждения этих результатов будущие исследования должны изучить применимость EDP в других породах гусей и условиях разведения. Мультиомиксные подходы, включая метаболомику, микробиомику и транскриптомику, могли бы предоставить более глубокие insights в его механизмы путем выявления метаболических изменений, анализа динамики микробиоты кишечника и раскрытия изменений экспрессии генов в ключевых тканях, таких как печень и кишечник. На основе результатов этого исследования рекомендуется уровень включения в рацион 1,00-2,50% EDP во время периода выкармливания гусят для оптимизации показателей роста и результатов здоровья.
Вклады авторов
Концептуализация, X.W. и J.W.; методология, X.W., J.W. и Y.L.; валидация, X.W., J.W. и S.G.; формальный анализ, X.W.; исследование, X.W. и G.L.; ресурсы, D.H.; курация данных, H.W.; написание—оригинальный черновик, X.W.; написание—просмотр и редактирование, X.W. и D.H.; визуализация, G.L.; надзор, D.H.; управление проектом, D.H.; приобретение финансирования, H.W. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Это исследование было финансировано Системой сельскохозяйственных исследований Китая [CARS-42-35], программой построения отличных команд Шанхайской академии сельскохозяйственных наук [2022-021].
Заявление Институционального комитета по пересмотру
Протокол исследования животных был одобрен Комитетом по уходу и использованию животных Шанхайской академии сельскохозяйственных наук (SAASPZ0522050) и реализован в соответствии с «Экспериментальные животные—Общие руководства по благополучию» (GB/T 42011-2022) и Руководствами по уходу и использованию экспериментальных животных Китая (EACUGC2018-01). Были приложены все усилия для минимизации страданий гусей, участвующих в этом исследовании.
Заявление о доступности данных
Данные, поддерживающие выводы этого исследования, доступны на «figshare» через DOI: 10.6084/m9.figshare.26976109. Для дальнейших данных, пожалуйста, обращайтесь к соответствующему автору, Daqian Не, по разумному запросу.
Конфликты интересов
Авторы заявляют об отсутствии конфликтов интересов.
Ссылки
0. Zheng, J.; Liang, S.; Zhang, Y.; Sun, X.; Li, Y.; Diao, J.; Dong, L.; Ni, H.; Yin, Y.; Ren, J.; et al. Effects of Compound Chinese Herbal Medicine Additive on Growth Performance and Gut Microbiota Diversity of Zi Goose. Animals 2022,12, 2942. [Google Scholar] [CrossRef] [PubMed]
1. Ji, F.; Gu, L.; Rong, G.; Hu, C.; Sun, W.; Wang, D.; Peng, W.; Lin, D.; Liu, Q.; Wu, H.; et al. Using Extract From the Stems and Leaves of Yizhi (Alpiniae oxyphyllae) as Feed Additive Increases Meat Quality and Intestinal Health in Ducks. Front. Vet. Sci. 2022, 8, 793698. [Google Scholar] [CrossRef] [PubMed]
2. El-Garhy, O.; Soudy, F.A.; Alharbi, Y.M.; Alshanbari, F.A.; Almujaydil, M.S.; Alhomaid, R.M.; Ahmed- Farid, O.A.; Mohamed, S.A.; El-Garhy, H.A.S.; Barakat, H.; et al. Dietary Supplementation of Silybum marianum Seeds Improved Growth Performance and Upregulated Associated Gene Expression of Muscovy Ducklings (Cairina moschata). Antioxidants 2022,11, 2300. [Google Scholar] [CrossRef] [PubMed]
3. Li, Y.; Yang, R.; Pan, Y.; Geng, Y.; Sun, J.; Zhang, Z. Mechanisms of biochar effects on plant growth of Seepweed (Suaeda salsa) and hybrid sorrel (Rumex patientia x Rumex tianschanicus) in a coastal saline soil over two cropping seasons: Soil-plant-microbe interactions. J. Soil Sci. Plant Nutr. 2022, 23, 569-580. [Google Scholar] [CrossRef]
4. Liu, C.; Wang, J.; Hong, D.; Chen, Z.; Li, S.; Ma, A.; Jia, Y. Preparation, Isolation and Antioxidant Function of Peptides from a New Resource of Rumexpatientia L. x Rumextianshanicus A. Los. Foods 2024,13, 981. [Google Scholar] [CrossRef]
5. Li, Y.P.; Wang, Z.Y.; Yang, H.M.; Xu, L.; Xie, Y.J.; Jin, S.L.; Sheng, D.F. Effects of dietary fiber on growth performance, slaughter performance, serum biochemical parameters, and nutrient utilization in geese. Poult. Sci. 2017, 96,1250-1256. [Google Scholar] [CrossRef]
6. Li, X.; Ling, H.; He, Z.; Yang, Z.; Jiang, T.; Huang, P.; Zeng, J. Effects of Edible Grass (Rumex patientia L. x Rumex tianschanicus A. LOS) Leaf Powder on Growth Performance, Antioxidant Properties, Cecal Short-Chain Fatty Acids, and Microbial Community Levels in Broilers. Antioxidants 2024,13,1291. [Google Scholar] [CrossRef]
7. Banday, M.T.; Wani, M.A.; Othman, S.I.; Rudayni, H.A.; Allam, A.A.; Alshahrani, M.Y.; Ibrahim, E.H.; Nabi, S.; Adil, S. Impact of Rumex nepalensis on Performance, Blood Markers, Immunity, Intestinal Microbiology and Histomorphology in Broiler Chicken. Vet. Sci. 2024,11, 463. [Google Scholar] [CrossRef] [PubMed]
8. Xi, Y.; Huang, Y.; Li, Y.; Yan, J.; Shi, Z. Fermented Feed Supplement Relieves Caecal Microbiota Dysbiosis and Kidney Injury Caused by High-Protein Diet in the Development of Gosling Gout. Animals 2020,10, 2139. [Google Scholar] [CrossRef]
9. Wang, X.; Li, G.; Wang, H.; Liu, Y.; Yang, Y.; Wang, C.; Gong, S.; He, D. Feeding whole-plant ensiled corn stover affects growth performance, blood parameters, and Cecal microbiota of Holdobagy goose. Front. Vet. Sci. 2023,10,1210706. [Google Scholar] [CrossRef]
10. Yan, J.; Zhou, B.; Xi, Y.; Huan, H.; Li, M.; Yu, J.; Zhu, H.; Dai, Z.; Ying, S.; Zhou, W.; et al. Fermented feed regulates growth performance and the cecal microbiota community in geese. Poult. Sci. 2019, 98, 4673-4684. [Google Scholar] [CrossRef]
11. GB/T 42011-2022; Experimental Animals—General Guidelines for Welfare. Standardization Administration of China, State Administration for Market Regulation: Beijing, China, 2022.
12. DB37/T 2784-2016; Feeding Standards for Commercial Meat Geese. Shandong Bureau of Quality and Technical Supervision: Jinan, China, 2016.
13. AO AC. Official Methods of Analysis of AOAC International, Method 984.13. 'Protein (Crude) in Animal Feed and Pet Food'; AOAC International: Gaithersburg, MD, USA, 2005. [Google Scholar]
14. Miller, D.S.; Judd, P.A. The metabolisable energy value of foods. J. Sci. Food Agric. 1984, 35,111-116. [Google Scholar] [CrossRef] [PubMed]
15. AOAC. Official Methods of Analysis of AOAC International, Method 978.10. 'Fiber (Crude) in Animal Feed and Pet Food'; AOAC International: Gaithersburg, MD, USA, 2000. [Google Scholar]
16. AOAC. Official Methods of Analysis of AOAC International, Method 920.39. 'Crude Fat (Ether Extract) in Animal Feed'; AOAC International: Gaithersburg, MD, USA, 1930. [Google Scholar]
17. AOAC. Official Methods of Analysis of AOAC International, Method 983.19. 'Calcium (Ca) in Mechanically Separated Poultry and Beef'; AOAC International: Gaithersburg, MD, USA, 1985. [Google Scholar]
18. AOAC. Official Methods of Analysis of AOAC International, Method 995.11. 'Phosphorus (P) Colorimetric Method in Foods'; AOAC International: Gaithersburg, MD, USA, 1985. [Google Scholar]
19. GB/T 18246-2019; Determination of Amino Acids in Feed. Standardization Administration of China, State Administration for Market Regulation: Beijing, China, 2019.
20. Shen, S.-Y.; Lin, Y.-Y.; Liao, S.-С.; Wang, J.-S.; Wang, S.-D.; Ching-Yi, L. Effects of phytogenic feed additives on the growth, blood biochemistry, and caecal microorganisms of White Roman geese. Czech J. Anim. Sci. 2023, 68, 202-211. [Google Scholar] [CrossRef]
21. Dong, Z.; Liu, Z.; Xu, Y.; Tan, B.; Sun, W.; Ai, Q.; Yang, Z.; Zeng, J. Potential for the development of Taraxacum mongolicum aqueous extract as a phytogenic feed additive for poultry. Front. Immunol. 2024,15,1354040. [Google Scholar] [CrossRef]
22. Rolinec, M.; Rakhmetov, D.; Biro, D.; Juracek, M.; Simko, M.; Galik, B.; Hanusovsky, O. Nutritional value of hybrid Rumex patientia L. x Rumex tianschanicus A.Los (Rumex OK 2) in different periods. Acta Fytotech. Zootech. 2018, 21,197-200. [Google Scholar] [CrossRef]
23. Li, X.; He, T.; Mao, Y.; Mao, J.; Lai, X.; Tu, H.; Zhou, Y.; Sha, R. Changes in Physicochemical Properties, Metabolites and Antioxidant Activity of Edible Grass during Spontaneous Fermentation. Fermentation 2023, 9, 377. [Google Scholar] [CrossRef]
24. Rudrapal, M.; Rakshit, G.; Singh, R.P.; Garse, S.; Khan, J.; Chakraborty, S. Dietary Polyphenols: Review on Chemistry/Sources, Bioavailability/Metabolism, Antioxidant Effects, and Their Role in Disease Management. Antioxidants 2024,13, 429. [Google Scholar] [CrossRef]
25. Jha, R.; Mishra, P. Dietary fiber in poultry nutrition and their effects on nutrient utilization, performance, gut health, and on the environment: A review. J. Anim. Sci. Biotechnol. 2021,12, 51. [Google Scholar] [CrossRef] [PubMed]
26. Hou, L.; Gu, T.; Weng, K.; Zhang, Y.; Zhang, Y.; Chen, G.; Xu, Q. Effects of Oxidative Stress on the Autophagy and Apoptosis of Granulosa Cells in Broody Geese. I nt. J. Mol. Sci. 2023, 24, 2154. [Google Scholar] [CrossRef]
27. Song, Q.; Zou, Z.; Chen, X.; Ai, G.; Xiong, P.; Song, W.; Liu, G.; Zheng, A.; Chen, J. Effect of Moringa oleifera Leaf Powder Supplementation on Growth Performance, Digestive Enzyme Activity, Meat Quality, and Cecum Microbiota of Ningdu Yellow Chickens. Agriculture 2024,14,1523. [Google Scholar] [CrossRef]
28. Williamson, G.; Sheedy, K. Effects of Polyphenols on Insulin Resistance. Nutrients 2020,12, 3135. [Google Scholar] [CrossRef]
29. Liang, H.-X.; Dai, H.-Q.; Fu, H.-A.; Dong, X.-P.; Adebayo, A.H.; Zhang, L.-X.; Cheng, Y.-X. Bioactive compounds from Rumex plants. Phytochem. Lett. 2010, 3,181-184. [Google Scholar] [CrossRef]
30. Deng, C.; Zhai, Y.; Yang, X.; Chen, Z.; Li, Q.; Hao, R. Effects of grape seed procyanidins on antioxidant function, barrier function, microbial community, and metabolites of cecum in geese. Poult. Sci. 2023, 102,102878. [Google Scholar] [CrossRef]
31. Yang, H.; Xiao, Y.; Gui, G.; Li, J.; Wang, J.; Li, D. Microbial community and short-chain fatty acid profile in gastrointestinal tract of goose. Poult. Sci. 2018, 97,1420-1428. [Google Scholar] [CrossRef]
32. Hao, Y.; Ji, Z.; Shen, Z.; Xue, Y.; Zhang, B.; Yu, D.; Liu, T.; Luo, D.; Xing, G.; Tang, J.; et al. Increase Dietary Fiber Intake Ameliorates Cecal Morphology and Drives Cecal Species-Specific of Short-Chain Fatty Acids in White Pekin Ducks. Front. Microbiol. 2022,13, 853797. [Google Scholar] [CrossRef]
33. Guo, B.; Li, D.; Zhou, B.; Jiang, Y.; Bai, H.; Zhang, Y.; Xu, Q.; Zhao, W.; Chen, G. Comparative characterization of bacterial communities in geese consuming of different proportions of ryegrass. PLoS ONE 2019, 14, e0223445. [Google Scholar] [CrossRef] [PubMed]
34. Vasas, A.; Orban-Gyapai, O.; Hohmann, J. The Genus Rumex: Review of traditional uses, phytochemistry and pharmacology. J. Ethnopharmacol. 2015,175,198-228. [Google Scholar] [CrossRef] [PubMed]
35. Sayavedra, L.; Li, T.; Batista, M.B.; Seah, B.K.B.; Booth, C.; Zhai, Q.; Chen, W.; Narbad, A. Desulfovibrio diazotrophicus sp. nov., a sulfate-reducing bacterium from the human gut capable of nitrogen fixation. Environ. Microbiol. 2021, 23, 3164-3181. [Google Scholar] [CrossRef]
36. He, Y.; Liu, X.; Dong, Y.; Lei, J.; Ito, K.; Zhang, B. Enterococcus faecium PNC01 isolated from the intestinal mucosa of chicken as an alternative for antibiotics to reduce feed conversion rate in broiler chickens. Microb. Cell Factories 2021, 20,122. [Google Scholar] [CrossRef]
37. Li, Y.; Liu, M.; Liu, H.; Sui, X.; Liu, Y.; Wei, X.; Liu, C.; Cheng, Y.; Ye, W.; Gao, B.; et al. The Anti- Inflammatory Effect and Mucosal Barrier Protection of Clostridium butyricum RH2 in Ceftriaxone- Induced Intestinal Dysbacteriosis. Front. Cell. Infect. Microbiol. 2021,11, 647048. [Google Scholar]
[CrossRef]
38. Qin, N.; Liu, H.; Cao, Y.; Wang, Z.; Ren, X.; Xia, X. Polysaccharides from the seeds of Gleditsia sinensis Lam. attenuate DLL-induced colitis in mice via improving gut barrier homeostasis and alleviating gut microbiota dybiosis. Food Funct. 2022,14,122-132. [Google Scholar] [CrossRef] [PubMed]
39. Kushkevych, I.; Dordevic, D.; Vitezova, M. Analysis of pH Dose-dependent Growth of Sulfate-reducing Bacteria. Open Med. 2019,14, 66-74. [Google Scholar] [CrossRef] [PubMed]
40. Parker, B.J.; Wearsch, P.A.; Veloo, A.C.M.; Rodriguez-Palacios, A. The Genus Alistipes: Gut Bacteria With Emerging Implications to Inflammation, Cancer, and Mental Health. Front. Immunol. 2020,11, 906. [Google Scholar] [CrossRef]
41. Franz, C.M.; Huch, M.; Abriouel, H.; Holzapfel, W.; Galvez, A. Enterococci as probiotics and their implications in food safety. Int. J. Food Microbiol. 2011,151,125-140. [Google Scholar] [CrossRef]
42. Негр, S.; Raj, A.C.D.; Silva, M.S.; Woelfel, S.; Stecher, B. The human symbiont Mucispirillum schaedleri: Causality in health and disease. Med. Microbiol. Immunol. 2021, 210,173-179. [Google Scholar] [CrossRef]
43. Daniel, S.L.; Moradi, L.; Paiste, H.; Wood, K.D.; Assimos, D.G.; Holmes, R.P.; Nazzal, L.; Hatch, M.; Knight, J. Forty Years of Oxalobacter formigenes, a Gutsy Oxalate-Degrading Specialist. Appl. Environ. Microbiol. 2021, 87, AEM0054421. [Google Scholar] [CrossRef] [PubMed]
Exploring the Role of Edible Dock Powder (Rumex K-1) in Enhancing Growth Performance, Organ Health, and Cecal Microbiota in Sanhua Goslings
by Xianze WangORCID, Junliang Wang ORCID,Yi LiuORCID,Guangquan LiORCID,Shaoming Gong,Huiying WangORCID andDaqian He *ORCID
Institute of Animal Husbandry and Veterinary Science, Shanghai Academy of Agricultural Science, Shanghai 201106, China
Перевод статьи «Research on the Control System for the Conveying and Separation Experimental Platform of Tiger Nut Harvester Based on Sensing Technology and Control Algorithms» авторов Sirui Chen, Jiangtao Qi, Jianping Gao, Wenhui Chen, Jiaming Fei, Hewei Meng, Zhen Ma, оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык





























































































Комментарии (0)