Влияние целлюлазы и Lactiplantibacillus plantarum на химический состав, характеристики ферментации и бактериальное сообщество силоса Pennisetum gigant
Чтобы исследовать влияние добавок на химический состав, характеристики ферментации и бактериальное сообщество силоса Pennisetum giganteum zxlin, силосование Pennisetum giganteum zxlin проводили без добавок (CON), с целлюлазой (CE), Lactiplantibacillus plantarum (LP) или с комбинацией целлюлазы и Lactiplantibacillus plantarum (LPCE) при комнатной температуре в течение 60 дней соответственно.
Аннотация
Результаты показали, что LPCE имел самое высокое содержание сухого вещества (СВ). По сравнению с CON, LP показал более высокий ( p < 0,05) уровень водорастворимых углеводов (WSC), сырого протеина (CP) и молочной кислоты (LA), а также более высокое ( p < 0,05) соотношение LA/уксусной кислоты (AA). Между тем, силос, инокулированный целлюлазой (CE и LPCE), показал более низкое ( p < 0,05) содержание кислотно-детергентной клетчатки (ADF) и нейтрально-детергентной клетчатки (NDF), чем CON. Кроме того, обработка добавками улучшила состав бактериального сообщества силоса, и Lactobacillus была в изобилии в LPCE (оценка LDA > 4,0). По сравнению с CE и LP, LPCE более эффективно способствовала трансформации микробных функций, что привело к повышенной регуляции ( p < 0,05) углеводного обмена и пониженной регуляции ( p < 0,05) мембранного транспорта. В заключение, целлюлаза или Lactiplantibacillus plantarum улучшили качество силоса Pennisetum giganteum zxlin за счет снижения содержания клетчатки или усиления ферментации LA, а их комбинация продемонстрировала мощную способность устанавливать бактериальное сообщество, доминируемое Lactobacillus , что способствовало производству высококачественного силоса.
1. Введение
По мере повышения уровня жизни людей и непрерывного роста численности населения растет и спрос людей на высококачественные мясные и молочные продукты. Однако эффективное производство животноводческой продукции зависит от постоянного снабжения высококачественными кормами, которые недоступны во многих регионах мира. Например, на северо-западе Китая и юго-западе Ботсваны деградация земель затруднила производство кормов, что привело к дефициту местных высококачественных кормов [ 1 , 2 ]. Кроме того, засуха, ключевой фактор окружающей среды, угрожающий росту растений, становится все более частой и сильной из-за потепления климата [ 3 ]. Поэтому крайне важно разрабатывать новые кормовые ресурсы для решения текущих и будущих проблем нехватки кормов, вызванных факторами окружающей среды. Pennisetum giganteum zxlin — типичное растение C4 , характеризующееся высокой устойчивостью к стрессам окружающей среды, хорошо развитой корневой системой и высокой биомассой [ 4 ]. В настоящее время Pennisetum giganteum zxlin широко используется для улучшения качества почвы [ 5 ] и производства топлива из биомассы [ 6 ]. Между тем, Pennisetum giganteum zxlin также используется в качестве корма для скота благодаря своей высокой урожайности и высокой приспособляемости к окружающей среде [ 4 ]. Однако высокое содержание клетчатки, нестабильное снабжение и низкое содержание водорастворимых углеводов (ВРУ) в Pennisetum giganteum zxlin существенно ограничивают его применение в животноводстве.
Силосование является эффективным подходом к сохранению зеленого корма. Применение различных добавок еще больше диверсифицировало кормовые ресурсы и улучшило качество силоса. Инокулянты молочнокислых бактерий (МКБ) широко используются для улучшения ферментации молочнокислых бактерий (МКБ) и предотвращения порчи силоса. Например, доказано , что Lactiplantibacillus plantarum , которая относится к группе гомоферментативных МКБ, улучшает качество силоса из различных кормовых культур, включая люцерну [ 7 ]. Кроме того, было показано, что Lactiplantibacillus plantarum улучшает микробное сообщество силоса из цельного растения кукурузы, снижая уровни определенных микотоксинов и относительное обилие вредных бактерий [ 8 ]. Однако инокулянты МКБ мало влияют на усвояемость питательных веществ силоса с высоким содержанием клетчатки. Целлюлаза может расщеплять структурные углеводы на олигосахариды и моносахариды, которые могут использоваться молочнокислыми бактериями для получения LA и снижения pH силоса [ 9 ]. Подобно Pennisetum giganteum zxlin, Caragana korshinskii отличается хорошо развитой корневой системой, быстрым ростом и высоким содержанием клетчатки [ 10 ]. Предыдущее исследование показало, что инокуляция целлюлазой и Lactiplantibacillus plantarum может эффективно улучшить качество ферментации силоса из Caragana korshinskii [ 11 ]. Однако вкусовые качества и усвояемость силоса из Caragana korshinskii по-прежнему низкие из-за наличия шипов и других факторов [ 12 ]. Pennisetum giganteum zxlin широко выращивается и применяется на северо-западе Китая. Удивительно, но в районах, подверженных эрозии почв, урожайность Pennisetum giganteum zxlin в сыром весе может достигать 178 тонн с гектара [ 6 ]. Хотя некоторые характеристики Pennisetum giganteum zxlin не способствуют ферментации силоса, при применении соответствующих добавок он может стать практичным силосным материалом, особенно в регионах с бедными почвами и засушливым климатом. Однако лишь немногие исследования оценивали влияние целлюлазы и Lactiplantibacillus на качество силоса Pennisetum giganteum zxlin.
Качество силоса тесно связано с его бактериальным сообществом. Чтобы исследовать роль силосных добавок в процессе ферментации Pennisetum giganteum zxlin, необходим анализ бактериального сообщества. С развитием технологии секвенирования следующего поколения секвенирование гена 16s рРНК широко и глубоко применяется для анализа бактериального сообщества [ 13 ]. В настоящее время недостаточно данных о влиянии целлюлазы и Lactiplantibacillus plantarum на бактериальное сообщество силоса Pennisetum giganteum zxlin. Поэтому был проведен этот эксперимент, чтобы изучить влияние целлюлазы и Lactiplantibacillus plantarum на химический состав, характеристики ферментации и бактериальное сообщество силоса Pennisetum giganteum zxlin, с гипотезой, что обработка добавками может улучшить качество силоса.
2. Материалы и методы
2.1. Заготовка силоса
Pennisetum giganteum zxlin выращивался на участке (около 1000 м2 ) посадочной базы «JunCao» компании Shaanxi Fengqing Ecological Development Co., Ltd. (Сиань, Китай) (теплый умеренно-континентальный климат, с. ш. 33°44′50″–35°10′30″, в. д. 109°20′17″–109°54′48″, высота 554 м, Пучэн, Китай) без удобрений, орошения и гербицидов. Pennisetum giganteum zxlin, культивируемый у основания, достигал высоты около 2,5 м (фаза выхода в трубку) и был убран силосоуборочным комбайном (4QZ-18B; Henan Changjun Agricultural Machinery Co., Ltd., Синьсян, Китай), оставляя стерню высотой около 15 см. В процессе уборки Pennisetum giganteum zxlin измельчался силосоуборочным комбайном на куски толщиной 2–3 см для приготовления силоса. Начальные характеристики предварительно засилосованного Pennisetum giganteum zxlin представлены в таблице 1 .

Было установлено четыре варианта обработки: (i) контроль (CON), обработка 5 мл дважды дистиллированной воды/кг свежего материала (FM); (ii) целлюлаза (CE, с дозировкой внесения 100 МЕ/г FM) [ 14 ]; (iii) Lactiplantibacillus plantarum (LP, с дозировкой внесения 1,0 × 10 6 колониеобразующих единиц (КОЕ)/г FM) [ 13 ]; и (iv) целлюлаза + Lactiplantibacillus plantarum (LPCE, с дозировками внесения целлюлазы и Lactiplantibacillus plantarum 100 МЕ/г FM и 1,0 × 10 6 КОЕ/г FM соответственно). Целлюлазный порошок (5 × 10 5 МЕ/г) и Lactiplantibacillus plantarum (Lp194, нативный штамм, выделенный из содержимого рубца; 1 × 10 11 КОЕ/г) были получены от Guangdong VTR Bio-Tech Co., Ltd. (Чжухай, Китай) и Jiangsu Wecare Biotechnology Co., Ltd. (Сучжоу, Китай) соответственно. Добавки смешивали в 15 мл бидистиллированной воды и равномерно наносили на кучу силосного материала весом 3 кг. Затем каждую кучу корма тщательно перемешивали и помещали в полиэтиленовые пластиковые мешки размером 30 × 40 см по 1 кг корма на мешок. После этого из каждого полиэтиленового пакета удаляли воздух и запечатывали с помощью вакуумного ламинатора (DLYS891; Deli Group Co., Ltd., Нинбо, Китай). Затем 12 мешков (4 обработки × 3 повторности) выдерживали при комнатной температуре в течение 60 дней. После завершения ферментации каждый мешок с образцами силоса разделили на три равные части следующим образом: первая часть предназначалась для анализа питательной ценности, вторая – для анализа параметров ферментации, а третья – для анализа микробного разнообразия.
2.2 Химический анализ
Образцы силоса из первой порции высушивали в печи (DHG-9030A, Shanghai Yiheng Scientific Instruments Co., Ltd., Шанхай, Китай) при температуре 65 °C в течение 48 часов. Затем высушенные образцы силоса измельчали с помощью мельницы (HK-08B; Guangzhou Xulang Machinery Equipment Co., Ltd., Гуанчжоу, Китай) для пропускания через сито 1 мм. Сухое вещество (СВ; метод 930.15) и сырой протеин (СП; метод 990.03) образцов силоса оценивали в соответствии с руководящими принципами, установленными Ассоциацией официальных аналитических химиков [ 15 ]. Содержание СП пересчитывали на общий азот (ОН) с коэффициентом пересчета 6,25. Как описано Ван Соестом и др. [ 16 ], содержание нейтрально-детергентной клетчатки (НДК) измеряли с помощью термостабильной α-амилазы, а затем кислотно-детергентную клетчатку (КДК) – с помощью кислотного детергента. Содержание НДК и КДК определяли с учётом остаточной золы. Содержание гемицеллюлозы определяли путём вычитания АДК из НДК. Согласно инструкции производителя, содержание ВСК измеряли с помощью набора для определения содержания растворимых в растениях сахаров (A145-1-1; Нанкинский биоинженерный институт «Цзяньчэн», Нанкин, Китай).
Вторые порции образцов силоса (10 г) гомогенизировали в 90 мл бидистиллированной воды и хранили при температуре 4 °C в течение 24 часов [ 17 ]. После полного смешивания жидкие экстракты фильтровали через количественную фильтровальную бумагу. Значение pH каждого фильтрата оценивали с помощью pH-метра (HI 90s24C; HANNA Instruments, Вунсокет, Род-Айленд, США). Затем фильтрат пропускали через мембрану с размером пор 0,45 мкм, а затем анализировали концентрации уксусной кислоты (УК), пропионовой кислоты (ПК) и масляной кислоты (МК) с помощью газовой хроматографии (GC7890A; Agilent, Санта-Клара, Калифорния, США), как подробно описано Ваном и соавторами [ 18 ]. Концентрацию LA измеряли с помощью набора для анализа LA (A019-2-1; Нанкинский институт биоинженерии «Цзяньчэн», Нанкин, Китай). Содержание аммиачного азота (NH₂ -N ) оценивали в соответствии с рекомендациями Бродерика и Канга [ 19 ]. Содержание WSC, LA и NH₂ - N измеряли колориметрическим методом с помощью микропланшетного ридера (UV-2300; Shimadzu, Киото, Япония).
2.3 Анализ бактериального сообщества
Общую бактериальную ДНК из третьей порции экстрагировали с помощью набора MagAtrract PowerSoil Pro DNA Kit (Qiagen, Хильден, Германия) в соответствии с протоколом производителя. Затем качество ДНК оценивали с помощью электрофореза в 1% агарозном геле. После этого концентрацию и чистоту ДНК оценивали с помощью NanoDrop2000 (Thermo Fisher Scientific, Уолтем, Массачусетс, США). Затем проводили полимеразную цепную реакцию (ПЦР) для амплификации гена 16S рРНК (V5–V7) с парой специфических праймеров, 799F (5′-AACMGGATTAGATACCCKG-3′) и 1993R (5′-ACGTCATCCCCACCTTCC-3′), с использованием термоциклера T100 (Bio-Rad, Геркулес, Калифорния, США) [ 20 ]. Продукты ПЦР анализировали с помощью электрофореза в 2% агарозном геле, а затем обрабатывали с помощью набора PCR Clean-Up Kit (Shanghai Meiji Yuhua Biomedical Technology Co., Ltd., Шанхай, Китай). Затем амплифицированные фрагменты количественно определяли с помощью Qubit 4.0 (Thermo Fisher Scientific, Уолтем, Массачусетс, США) для последующего секвенирования на платформе NovaSeq (Illumina, Сан-Диего, Калифорния, США). Исходные прочтения гена 16S рРНК на основе QIIME2 [ 21 ] фильтровали, объединяли, скринировали и деноминировали с помощью DADA2 для получения репрезентативной последовательности и информации о распространенности вариантов последовательности ампликона (ASV). ASV анализировали для таксономической аннотации с помощью RDP Classifier (v11.5) и базы данных SILVA 16S рРНК (v138) с коэффициентом достоверности 0,7. Пять часто используемых индексов, связанных с альфа-разнообразием, включая индексы Чао, Эйса, Шеннона, Симпсона и Покрытия, были получены с использованием Mothur (v1.30.2) для оценки разнообразия и богатства бактериального сообщества. Основываясь на взвешенном расстоянии Unifrac, бета-разнообразие оценивалось с помощью анализа главных координат (PCoA) для выявления различий между структурами бактериальных сообществ среди вариантов обработки с помощью теста ANOSIM. По результатам таксономического анализа были построены столбчатые диаграммы состава бактериального сообщества по типу и роду с использованием R (v3.3.1). Бактериальные различия между вариантами обработки были выявлены с помощью линейного дискриминантного анализа размера эффекта (LEfSe). С использованием PICRUSt2 (v2.2.0) и базы данных Киотской энциклопедии генов и геномов (KEGG) были предсказаны функциональные гены, которые затем были сопоставлены с их соответствующими метаболическими путями.
2.4 Статистический анализ
Основные данные о химическом составе, характеристиках ферментации и бактериальном сообществе были организованы в Excel 2019 и оценены с помощью однофакторного дисперсионного анализа SPSS 27.0 (IBM Corp, Армонк, штат Нью-Йорк, США), при этом каждый ферментационный мешок рассматривался как экспериментальная единица ( n = 3 на обработку). Статистическая модель была следующей:
Y i = μ + α i + ε i
(1)
Где Y i – наблюдаемое значение, μ – общее среднее значение, α i – эффект обработки ( i = CON, CE, LP и LPCE), а ε i – экспериментальная ошибка. Для сравнения средних значений использовался критерий Тьюки. Данные о бактериальном сообществе обрабатывались с использованием ресурсов, доступных на облачной платформе Majorbio ( https://cloud.majorbio.com/page/tools/ , дата обращения: 10 мая 2024 г.). Статистическая значимость результатов считалась равной p < 0,05.
3. Результаты
3.1 Влияние добавок на химический состав и ферментационные характеристики силоса Pennisetum giganteum zxlin
Химический состав силоса Pennisetum giganteum zxlin приведен в Таблице 2. LP показал более высокое ( p < 0,05) содержание CP, чем CON, но более низкое ( p < 0,05) содержание DM, чем LPCE. Как CE, так и LPCE показали более низкое ( p < 0,05) содержание NDF по сравнению с CON и LP. Кроме того, CE, LP и LPCE показали более низкое ( p < 0,05) содержание ADF по сравнению с CON. Между тем LPCE показал более низкое ( p < 0,05) содержание ADF по сравнению с LP. Однако существенной разницы ( p > 0,05) в гемицеллюлозе среди четырех вариантов обработки не наблюдалось. Более того, LP показал более высокое ( p < 0,05) содержание WSC, чем CON.
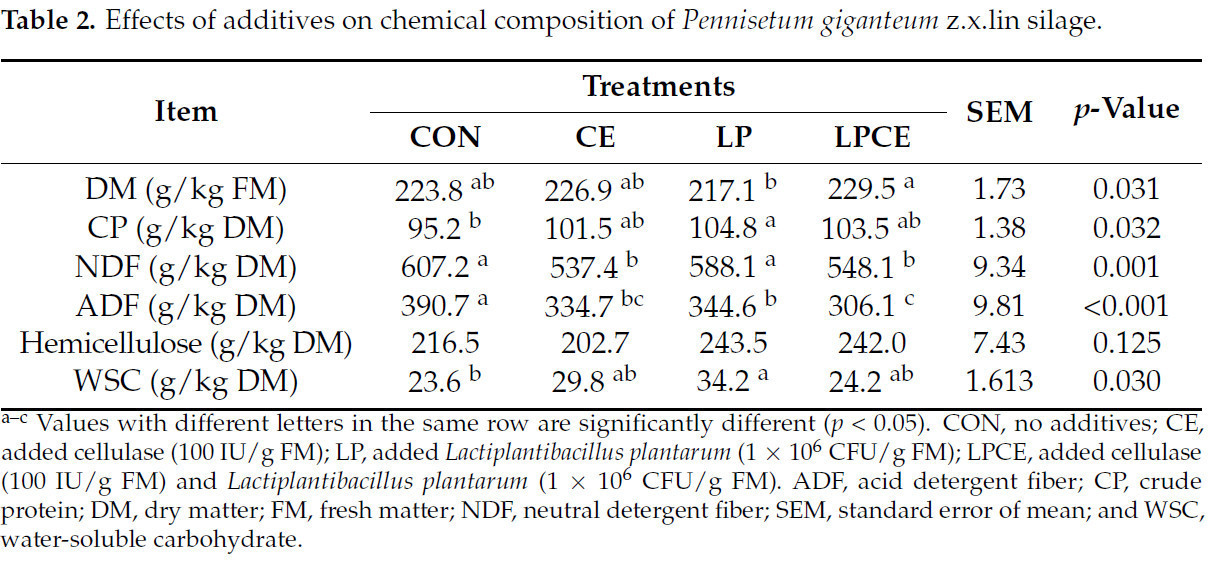
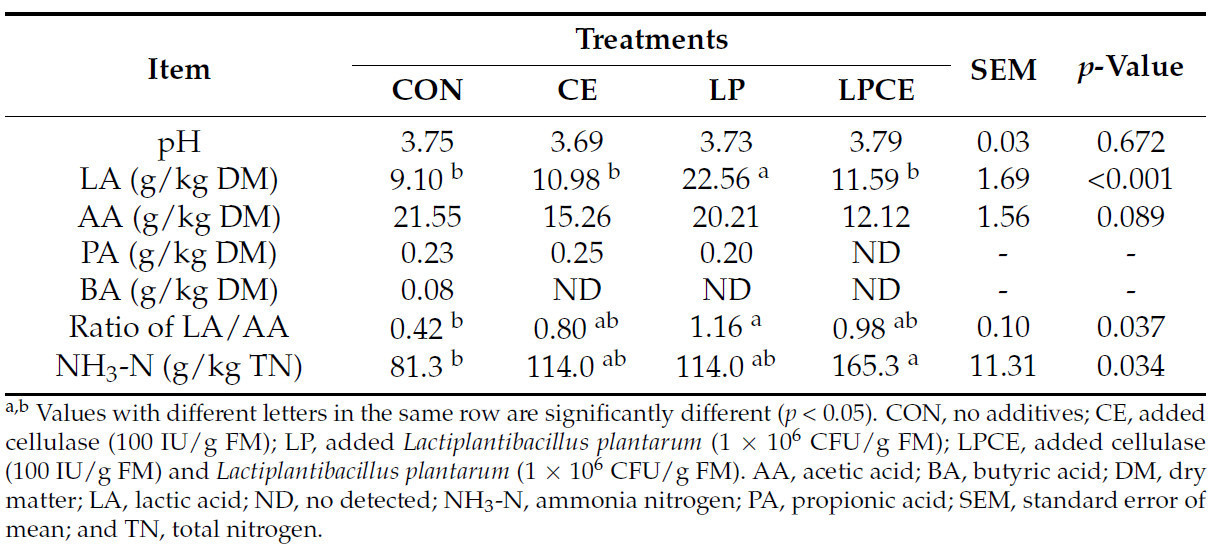
Характеристики ферментации силоса Pennisetum giganteum zxlin представлены в Таблице 3. Интересно, что не было значительной разницы ( p > 0,05) в pH между четырьмя обработками. Кроме того, LP имел самое высокое содержание LA ( p < 0,05) и более высокое ( p < 0,05) соотношение LA/AA, чем CON. Однако добавки оказали незначительное влияние ( p > 0,05) на содержание AA. LPCE показал более высокое ( p < 0,05) содержание NH 3 -N по сравнению с CON. В то же время содержание PA и BA было низким и даже неопределяемым во всех обработках.
3.2 Влияние добавок на микробное разнообразие силоса Pennisetum giganteum zxlin
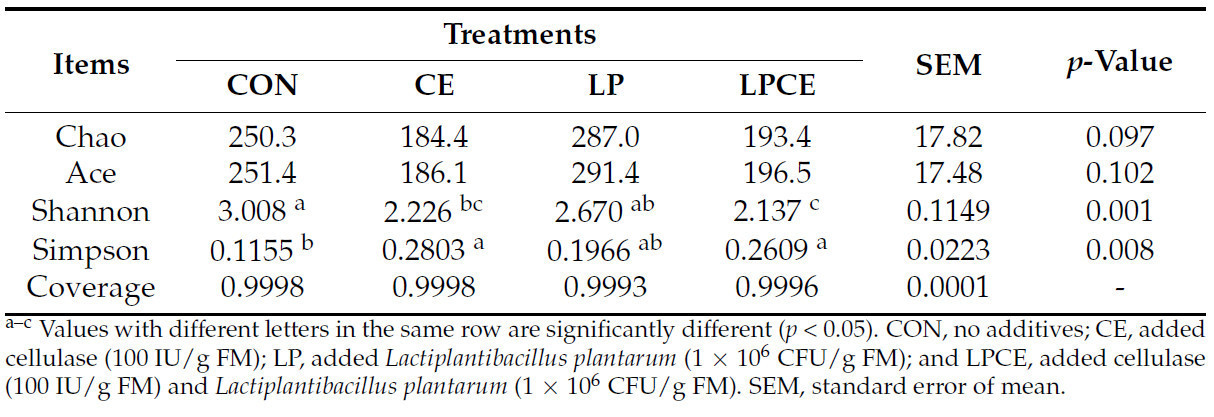
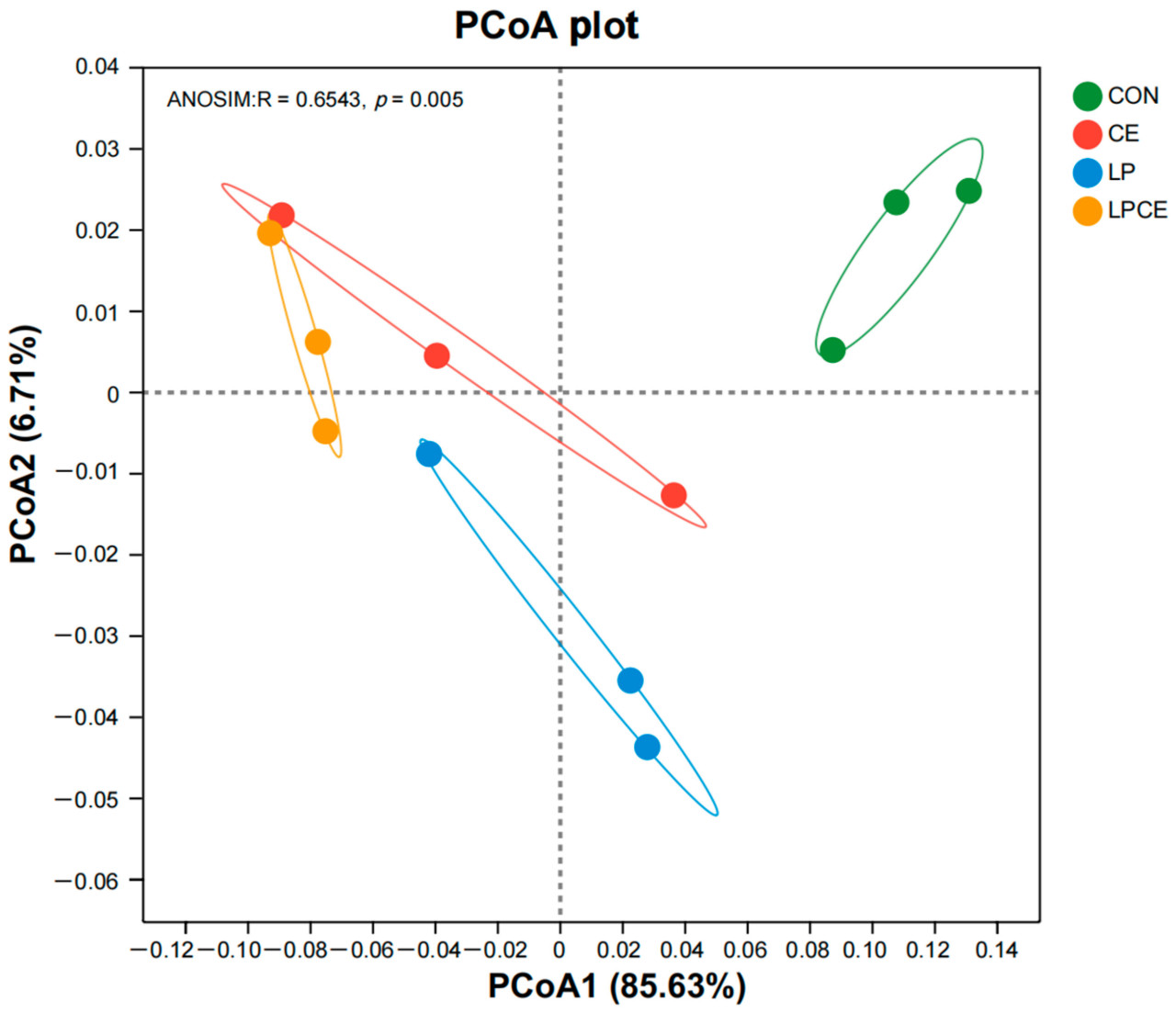
Индексы альфа-разнообразия бактерий, связанные с силосом Pennisetum giganteum zxlin, представлены в Таблице 4. Значения покрытия всех образцов силоса составили более 99,9%. Между тем, не было значительной разницы ( p > 0,05) в значениях Chao и Ace среди четырех обработок. Как CE, так и LPCE показали более низкое ( p < 0,05) значение Шеннона по сравнению с CON, в то время как LPCE также показал более низкое ( p < 0,05) значение Шеннона по сравнению с LP. Кроме того, как CE, так и LPCE показали более высокое ( p < 0,05) значение Симпсона, чем CON. График PCoA показал, что PCoA1 и PCoA2 объяснили изменения в структуре бактериального сообщества на 85,63% и 6,71% соответственно ( Рисунок 1 ). В тесте ANOSIM значения p = 0,005 и R = 0,6543 указывают на значительное изменение структуры бактериального сообщества силоса после внесения добавок. При этом структура бактериального сообщества силоса, полученного с использованием КОН, по-видимому, отличалась от структуры бактериального сообщества силоса, полученного с использованием других добавок, благодаря PCoA1.
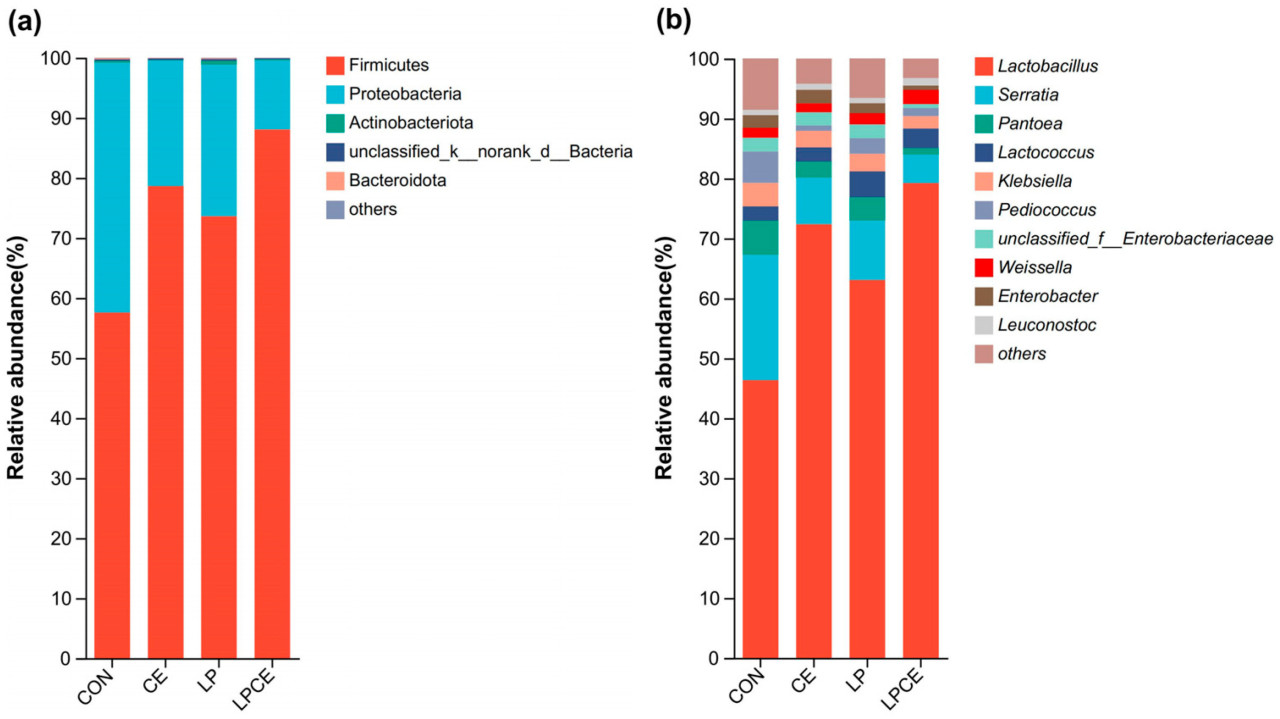
Состав бактериального сообщества силоса Pennisetum giganteum zxlin на уровне фил и родов показан на рисунке 2. В силосе Firmicutes (CON, 57,6%; CE, 78,6%; LP, 73,6%; и LPCE, 88,1%) и Proteobacteria (CON, 46,4%; CE, 72,4%; CE, 63,1%; и LPCE, 79,3%) были основными филами с общей относительной численностью >98,8% во всех вариантах обработки ( рисунок 2a ). Как и ожидалось, Lactobacillus (CON, 3,86%; CE, 5,08%; LP, 1,78%; и LPCE, 85,16%) стал доминирующим родом после силосования ( рисунок 2b ). По сравнению с CON, CE, LP и LPCE все показали снижение относительного обилия Serratia (CON, 20,9%; CE, 7,8%; LP, 9,9%; и LPCE, 4,8%), Pantoea (CON, 5,7%; CE, 2,7%; LP, 3,9%; и LPCE, 1,1%), Klebsiella (CON, 3,9%; CE, 2,8%; LP, 2,9%; и LPCE, 2,0%), и Pediococcus (CON, 5,2%; CE, 0,9%; LP, 2,6%; и LPCE, 1,4%), в то же время показывая увеличение относительного обилия Lactococcus (CON, 2,4%; CE, 2,4%; LP, 4,3%; и LPCE, 3,3%). Кроме того, в LPCE наблюдалась самая высокая численность Weissella (CON, 1,7%; CE, 1,5%; LP, 1,9%; и LPCE, 2,3%) и Leuconostoc (CON, 0,9%; CE, 1,0%; LP, 0,9%; и LPCE, 1,2%), а также самая низкая относительная численность unclassified_f__Enterobacteriaceae (CON, 2,3%; CE, 2,2%; LP, 2,3%; и LPCE, 0,7%) и Enterobacter (CON, 2,1%; CE, 2,3%; LP, 1,7%; и LPCE, 0,7%).
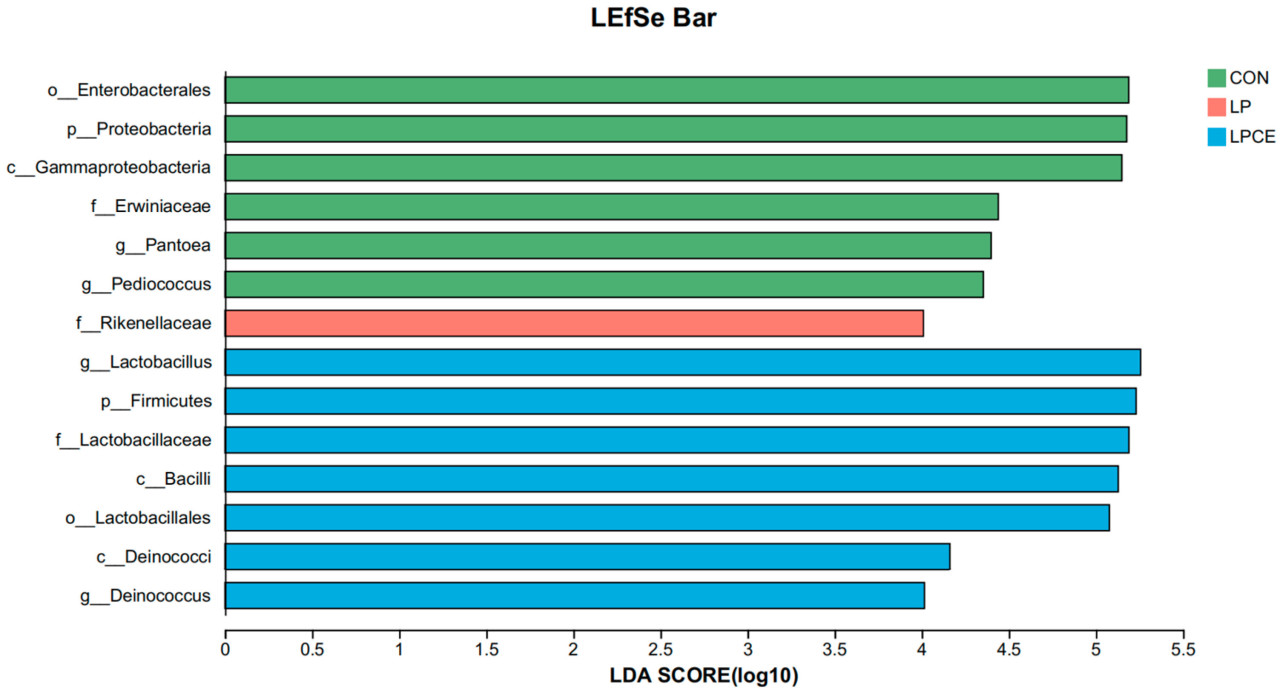
LEfSe показал, что несколько таксонов бактерий являются потенциальными биомаркерами (оценка LDA > 4,0, рисунок 3 ). Enterobacterales, Proteobacteria, Gammaproteobacteria, Erwiniaceae, Pantoea и Pediococcu были широко представлены в CON. Rikenellaceae были широко представлены в LP. Lactobacillus , Firmicutes, Lactobacillaceae, Bacilli, Lactobacillales, Deinococci и Deinococcus были широко представлены в LPCE.
3.3 Анализ корреляции между показателями качества силоса и бактериальным сообществом
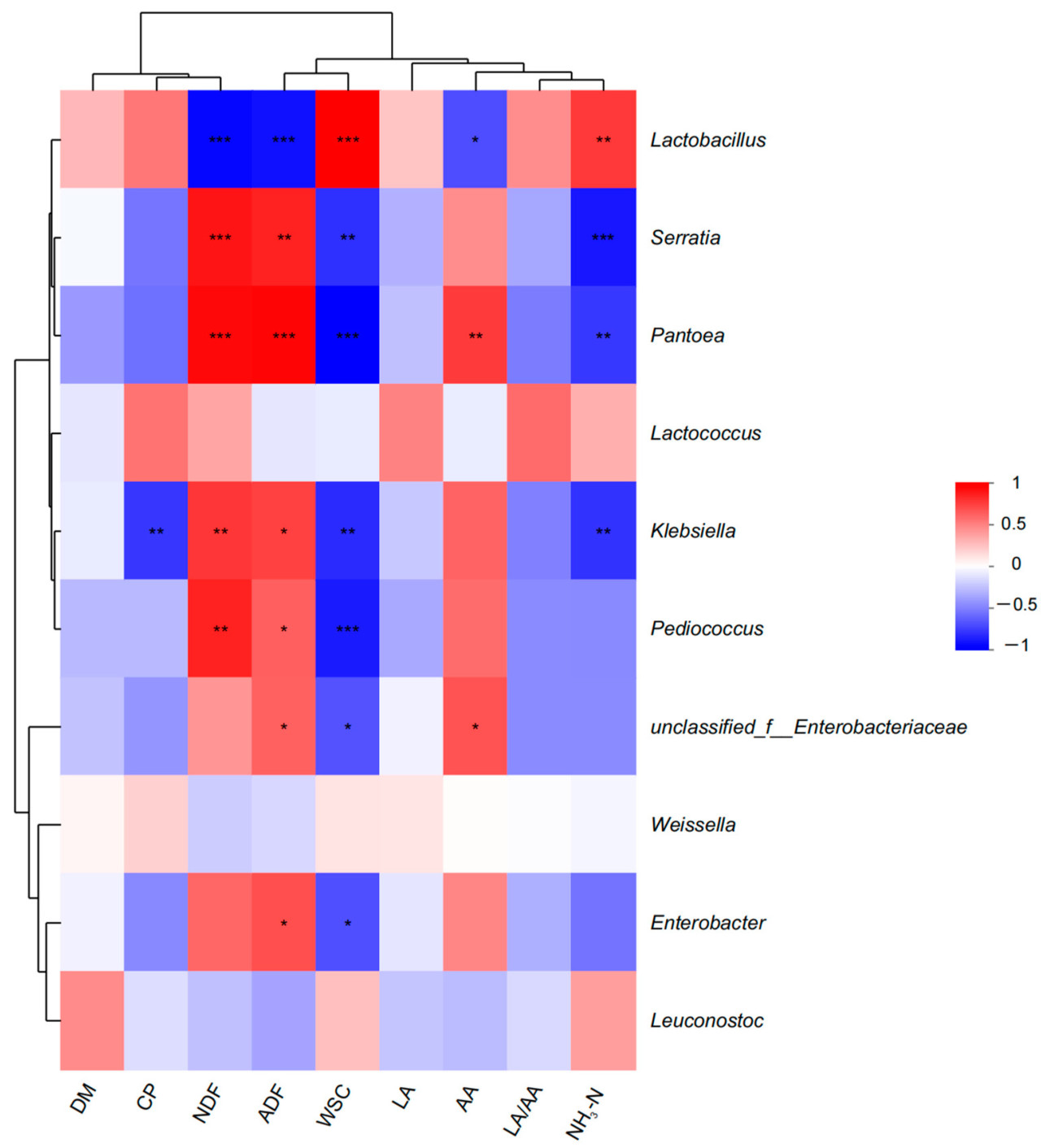
Корреляция между характеристиками качества силоса и бактериальным сообществом на уровне рода представлена на рисунке 4. CP показал отрицательную корреляцию ( p < 0,05) с Klebsiella . NDF показал отрицательную корреляцию ( p < 0,05) с Lactobacillus и положительную ассоциацию ( p < 0,05) с Serratia , Pantoea , Klebsiella и Pediococcus . ADF показал отрицательную корреляцию ( p < 0,05) с Lactobacillus и положительную ассоциацию ( p < 0,05) с Serratia , Pantoea , Klebsiella , Pediococcus , unclassified_f__Enterobacteriaceae и Enterobacter . WSC показал положительную корреляцию ( p < 0,05) с Lactobacillus и отрицательную корреляцию ( p < 0,05) с Serratia , Pantoea , Klebsiella , Pediococcus , unclassified_f__Enterobacteriaceae и Enterobacter . AA был обратно связан ( p < 0,05) с Lactobacillus и положительно коррелировал с Pantoea и unclassified_f__Enterobacteriaceae . NH 3 -N был положительно связан ( p < 0,05) с Lactobacillus и обратно связан ( p < 0,05) с Serratia , Pantoea и Klebsiella.
3.4. Функциональные профили силоса Pennisetum giganteum zxlin, предсказанные геном 16S рРНК
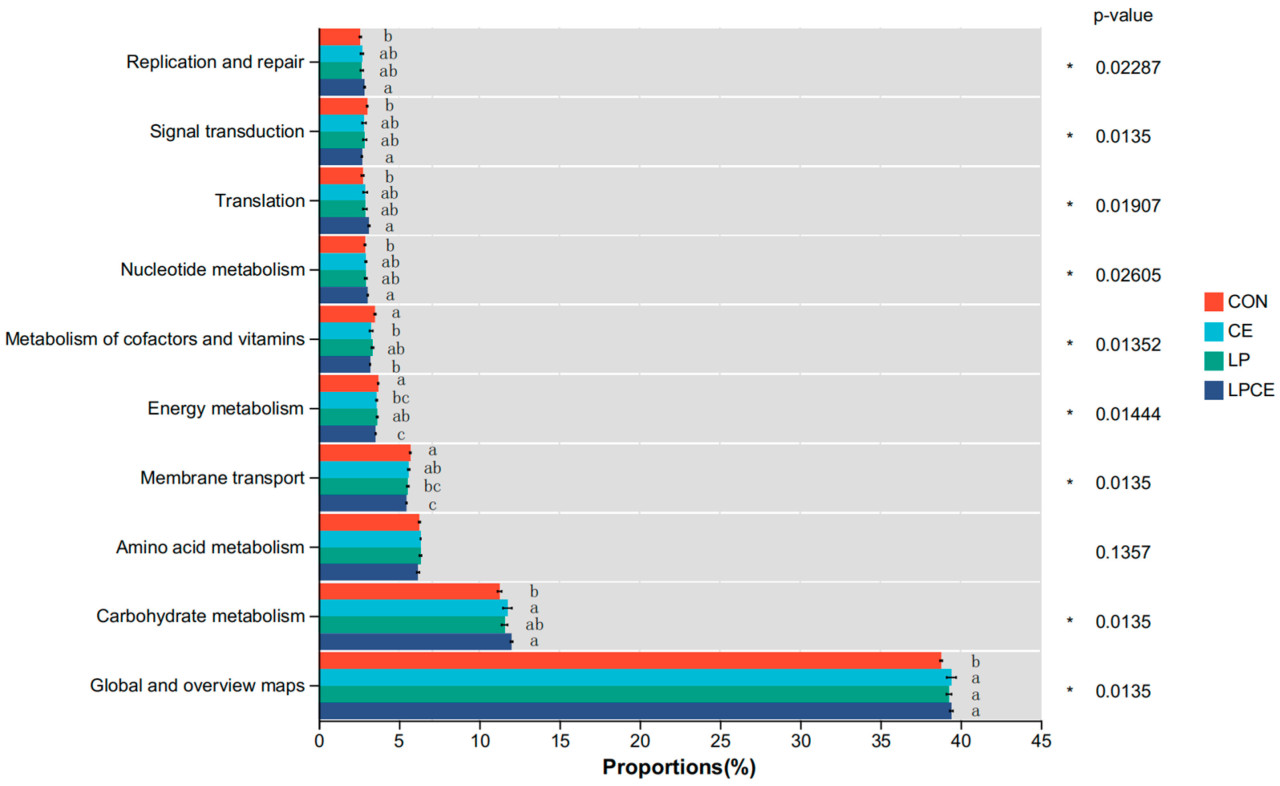
Основные метаболические пути KEGG в силосе показаны на рисунке 5. Доминирующие микробные метаболические пути состояли из глобальных и обзорных карт, метаболизма углеводов, метаболизма аминокислот и мембранного транспорта, с их долями > 5%. По сравнению с CON, другие обработки значительно повысили регуляцию ( p < 0,05) глобальных и обзорных карт. Между тем, CON был менее многочисленным ( p < 0,05), чем CE и LPCE в метаболизме углеводов и более многочисленным ( p < 0,05), чем LP и LPCE в мембранном транспорте. Кроме того, добавление добавок также снизило ( p < 0,05) обилие энергетического метаболизма и метаболизма кофакторов и витаминов, одновременно увеличив ( p < 0,05) обилие метаболизма нуклеотидов, трансляции, передачи сигнала, репликации и репарации в разной степени.
4. Обсуждение
4.1 Влияние добавок на качество силоса из Pennisetum giganteum zxlin
Благодаря своим превосходным биологическим характеристикам Pennisetum giganteum zxlin, как ожидается, смягчит нехватку кормов на северо-западе Китая в качестве потенциального кормового ресурса для жвачных животных, таких как козы [ 22 ]. При хорошей скорости сбора урожая и низком ущербе от погодных условий силосование может быть практичной стратегией для сохранения Pennisetum giganteum zxlin [ 23 ]. Для подходящих условий анаэробной ферментации силосное сырье должно содержать содержание WSC >6% [ 9 ]. Следовательно, низкое содержание WSC (38,0 г/кг DM) Pennisetum giganteum zxlin может быть недостаточным для обеспечения успешной ферментации LA. Как правило, жвачные животные предпочитают рационы с низким содержанием клетчатки [ 9 ]. Между тем, клетчатка является одним из самых сложных для переваривания питательных веществ в кормах. В предыдущем исследовании сообщалось, что содержание ADF влияет на усвояемость корма и имеет отрицательную корреляцию с усвояемостью DM [ 24 ]. В данном исследовании Pennisetum giganteum zxlin содержал высокие уровни НДК (608,4 г/кг СВ) и АДК (343,9 г/кг СВ), что может отрицательно влиять на его усвояемость. Следовательно, добавление целлюлазы и Lactiplantibacillus plantarum к Pennisetum giganteum zxlin может способствовать улучшению качества силоса и его кормовой ценности за счет расщепления клетчатки до ВСС.
Предыдущие исследования показали, что целлюлаза может снижать содержание DM силоса из-за ее функции деградации структурных углеводов [ 13 , 25 ]. Однако в настоящем исследовании LP имел самое низкое содержание DM, что согласуется с исследованием Xiao et al. [ 26 ], которые сообщили, что Lactiplantibacillus plantarum может снижать содержание DM силоса из фуражного овса из-за повышенной ферментации LA. Действительно, LP показала более высокое содержание LA, чем CON, но причина его пониженного содержания DM требует дальнейшего изучения. В этом исследовании было обнаружено более низкое содержание CP в CON, что может быть связано с деградацией белков микроорганизмами в процессе ферментации. Интересно, что содержание CP в группах обработки добавками увеличилось по сравнению с предварительно засилосованным кормом. Это было похоже на исследование Zhang et al. [ 12 ], которые сообщили, что инокуляция LAB и целлюлазой привела к более высокому содержанию CP в силосе по сравнению со свежим Caragana korshinskii , но основные причины этого требуют дальнейшего изучения. Как и ожидалось, силос, инокулированный целлюлазой (CE и LPCE), показал более низкое содержание NDF и ADF, чем CON, что указывает на то, что целлюлаза способствовала разложению компонентов клетчатки Pennisetum giganteum zxlin [ 9 ]. Это также может помочь улучшить усвояемость рубцом силоса Pennisetum giganteum zxlin [ 11 ]. Однако влияние целлюлазы на разложение гемицеллюлозы было ограничено в этом исследовании, что не согласуется с выводами Si и Iannaccone et al. [ 13 , 27 ], которые сообщили, что целлюлаза может эффективно разлагать гемицеллюлозу смешанного силоса люцерны и Leymus chinensis или промышленных кормов. Это может быть связано с различной способностью целлюлаз из разных источников к деградации гемицеллюлозы. Подходящее содержание WSC важно для ферментации LA. По сравнению с CON, содержание WSC CE, LP и LPCE увеличилось на 26,3%, 44,9% и 2,5% соответственно. Следовательно, целлюлаза и Lactiplantibacillus plantarum могут способствовать сохранению большего количества WSC во время силосования, что согласуется с выводами Го и соавторов [ 28 ], которые сообщили, что добавление этих двух добавок увеличило содержание WSC в смешанном силосе из кукурузы и голозерной соломы по сравнению с контрольным силосом. С одной стороны, целлюлаза может расщеплять некоторые структурные углеводы до WSC; с другой стороны, Lactiplantibacillus plantarum может способствовать ферментации LA и подавлять использование WSC нежелательными микроорганизмами [ 13 , 28 ].
pH является ключевым параметром для оценки качества силоса, и pH < 4,2 подходит для обычного силоса [ 1 ]. В процессе ферментации LA является ключевой полезной органической кислотой, в то время как AA является продуктом гетероферментации [ 29 ]. В этом исследовании. LP показал самое высокое содержание LA и соотношение LA/AA, что предполагает, что Lactiplantibacillus plantarum может способствовать гомоферментации и увеличивать выработку LA во время силосования [ 30 ]. Предыдущие исследования показали, что целлюлаза также может ингибировать гетероферментацию и снижать выработку AA за счет увеличения содержания WSC в силосе [ 13 , 31 ]. В этом исследовании не было обнаружено значительной разницы в содержании LA или соотношении LA/AA среди CON, CE и LPCE. Тем не менее, по сравнению с КОН, соотношение LA/AA в CE и LPCE возросло на 90,48% и 133,33% соответственно, что свидетельствует о том, что целлюлаза может в некоторой степени улучшить качество ферментации силоса. ПА образуется при вторичной ферментации LA клостридиями [ 32 ]. Предыдущие исследования показали, что целлюлаза и LAB могут снижать содержание ПА в силосе [ 12 , 33 ]. В этом исследовании все обработки имели низкое содержание ПА, и даже содержание ПА в LPCE не было обнаружено, что свидетельствует о том, что вторичная ферментация LA клостридиями была подавлена в силосе. Как правило, уровни NH 3 -N и BA в высококачественном силосе составляют <100 г/кг TN и 2,0 г/кг DM соответственно [ 34 ]. Интересно, что все обработки имели содержание BA ниже 2,0 г/кг DM, но только CON имел содержание NH 3 -N ниже 100 г/кг TN. NH 3 -N обычно рассматривается как важный показатель распада белка, вызванного микроорганизмами [ 35 ]. В этом исследовании, хотя не было значительной разницы в содержании CP между LPCE и CON, и уровень NH 3 -N в LPCE был значительно выше, чем в CON, предполагая, что комбинация целлюлазы и Lactiplantibacillus plantarum может способствовать образованию NH 3 -N независимо от распада белка. Учитывая, что LPCE показала наибольшую распространенность в метаболизме нуклеотидов, NH 3 -N может образовываться в результате распада нуклеотидов, но эта гипотеза требует дальнейшего изучения.
4.2 Влияние добавок на бактериальное сообщество силоса Pennisetum giganteum zxlin
Бактериальное сообщество силоса играет решающую роль в процессе анаэробной ферментации. В настоящем исследовании все обработки имели покрытие > 99,9%, что указывает на то, что секвенирование было достаточным для точного представления статуса бактериального сообщества. Чао и Эйс использовались для измерения богатства бактериального сообщества, в то время как Сэннон и Симпсон использовались для оценки разнообразия бактериального сообщества. Предыдущие исследования показали, что целлюлаза и Lactiplantibacillus plantarum могут снижать богатство и разнообразие бактериальных сообществ [ 9 , 36 ]. В настоящем исследовании добавление добавок не привело к значительному изменению богатства бактериального сообщества силоса, но как CE, так и LPCE имели более низкое разнообразие бактериального сообщества, чем CON, что позволяет предположить, что добавление добавок может способствовать ферментации LA, а затем подавлять рост нежелательных микроорганизмов во время силосования. Кроме того, PCoA показал, что структуры бактериальных сообществ LP, CE и LPCE были явно отделены от структур CON через PCoA1. Таким образом, целлюлаза и Lactiplantibacillus plantarum могут снизить разнообразие бактериального сообщества и изменить структуру бактериального сообщества силоса.
С точки зрения состава бактериального сообщества, Firmicutes был наиболее многочисленным типом, и его относительное обилие в разной степени увеличивалось из-за инокуляции добавок, что согласуется с исследованием, опубликованным Si et al. [ 13 ], который обнаружил, что целлюлаза, Lactiplantibacillus plantarum и их комбинация могут увеличить относительное обилие Firmicutes в смешанном силосе люцерны и Leymus chinensis . Firmicutes является важным кислотопродуцирующим гидролитическим типом, который способен быстро расти в кислых условиях [ 37 , 38 ]. В ходе силосования молочнокислые бактерии используют WSC для генерации LA, снижения pH и предотвращения размножения нежелательных микроорганизмов, благодаря чему питательные вещества силоса могут сохраняться в течение длительного периода [ 39 ]. Более того, молочнокислые бактерии являются важным компонентом Firmicutes. Таким образом, добавление добавок может способствовать размножению молочнокислых бактерий и увеличению относительной численности Firmicutes.
Как кислотоустойчивые молочнокислые бактерии, Lactobacillus играет важную роль в усилении накопления LA и улучшении качества силоса. Предыдущие исследования показали, что целлюлаза и Lactiplantibacillus plantarum могут увеличить относительное обилие Lactobacillus в силосе [ 13 , 25 , 40 ]. Ожидаемо, Lactobacillus стал основным родом во всех четырех обработках, причем его относительное обилие в CE, LP и LPCE было выше, чем в CON. В силосе были обнаружены представители Enterobacteriaceae , Serratia , Pantoea , Klebsiella , unclassified_f__Enterobacteriaceae и Enterobacter , что вредно для ферментации LA и сохранения питательных веществ. Интересно, что большинство из них были более многочисленны в CON, чем в других обработках, что позволяет предположить, что добавки способствовали ферментации LA и подавляли активность этих вредных бактерий. Между тем, Serratia была основной вредной бактерией, и ее относительное обилие уступало только Lactobacillus , что было похоже на выводы Ли и др. [ 35 ], которые сообщили, что относительное обилие Serratia было высоким в смешанном силосе из конских бобов с фуражной пшеницей. Примечательно, что LPCE имел самое высокое относительное обилие Lactobacillus , но самые низкие относительные обилия Serratia , Pantoea , Klebsiella , unclassified_f__Enterobacteriaceae и Enterobacter , что предполагает, что комбинация целлюлазы и Lactiplantibacillus plantarum могла более эффективно улучшать состав бактериального сообщества силоса Pennisetum giganteum zxlin. Другие молочнокислые бактерии, включая Lactococcus , Pediococcus , Weissella и Leuconostoc , также присутствовали в силосе. Хотя их относительное обилие было значительно ниже, чем у Lactobacillus , они могут играть важную роль в инициировании ферментации LA [ 41 , 42 ]. Из-за их низкой кислотоустойчивости эти LAB постепенно заменялись Lactobacillus во время силосования [ 41 , 43 ]. LEfSe широко применялся для дальнейшего изучения различий в бактериальных сообществах при различных обработках [ 12].В данном исследовании некоторые нежелательные микроорганизмы, такие как Enterobacterales, были в изобилии в среде CON, в то время как Lactobacillus – в среде LPCE, что позволяет предположить, что сочетание целлюлазы и Lactiplantibacillus plantarum может синергетически усиливать ферментацию LA и подавлять рост нежелательных микроорганизмов. Примечательно, что в среде CON было в изобилии обнаружено Pediococcus , что, вероятно, связано с тем, что pH среды CON снижался медленнее по сравнению с другими методами обработки; таким образом, в среде CON для Pediococcus были созданы более благоприятные условия для роста.
4.3 Влияние бактериального сообщества на качество силоса из Pennisetum giganteum zxlin
Бактериальное сообщество тесно связано с процессом ферментации и существенно влияет на качество силоса [ 29 ]. Как основная полезная бактерия, Lactobacillus сыграла незаменимую роль в подавлении активности вредных бактерий и улучшении качества силоса Pennisetum giganteum zxlin. В этом исследовании целлюлаза способствовала разложению клетчатки и сохранению WSC, тем самым обеспечивая больше субстратов ферментации для молочнокислых бактерий. Между тем, добавление Lactiplantibacillus plantarum способствовало гомоферментации и снижало выработку АК. Как и ожидалось, Lactobacillus была обратно пропорциональна НДФ, АДФ и АК и положительно пропорциональна WSC, что было похоже на исследование Бао и соавторов [ 41 ], которые сообщили, что Lactobacillus имела отрицательную корреляцию с АК и положительную корреляцию с WSC в силосе из люцерны. Как правило, содержание NH 3 -N низкое в высококачественном силосе, но есть также сообщения, что молочнокислые бактерии могут увеличивать содержание NH 3 -N [ 44 , 45 , 46 ]. Интересно, что в этом исследовании наблюдалась аналогичная ситуация, поскольку Lactobacillus продемонстрировали значительную положительную корреляцию с NH 3 -N. Будучи представителями Enterobacteriaceae , Serratia , Pantoea , Klebsiella , unclassified_f__Enterobacteriaceae и Enterobacter оказали аналогичное влияние на качество силоса, поскольку они ускорили потребление WSC и выработку АК. В этом исследовании Klebsiella отрицательно коррелировала с CP, что позволяет предположить, что это, вероятно, были основные бактерии, которые разрушали белки [ 47 ]. Кроме того, роль Pediococcus в качестве силоса, по-видимому, была противоположна роли Lactobacillus , что, возможно, связано с тем, что быстрый рост Lactobacillus оказывал ингибирующее действие на Pediococcus на поздней стадии силосования [ 43 , 46 ].
4.4 Влияние добавок на изменение функций бактериального сообщества
Во время силосования кластеры метаболических генов оказывают глубокое влияние на метаболизм и метаболиты микроорганизмов, участвуя в различных вторичных метаболических путях, тем самым влияя на качество силоса [ 48 ]. В этом исследовании глобальные и обзорные карты были наиболее распространенной метаболической категорией и были активированы добавочной обработкой. Это согласуется с исследованием Ду и др. [ 9 ], которые обнаружили, что глобальные и обзорные карты были основной метаболической категорией микроорганизмов в высокоцеллюлозном силосе, и их обилие можно было активировать комбинацией целлюлазы и Lactiplantibacillus plantarum. В глобальных и обзорных картах был ряд метаболических путей, таких как метаболизм нуклеотидов и биосинтез кофакторов [ 49 ], но причины активации глобальных и обзорных карт, вызванные добавочной обработкой, требуют дальнейшего изучения. В этом исследовании метаболизм углеводов, метаболизм аминокислот и мембранный транспорт также были важными метаболическими категориями. Бай и др. [ 50 ] сообщили, что метаболизм аминокислот должен быть подавлен в высококачественном силосе. Тем не менее, метаболизм аминокислот существенно не различался между четырьмя обработками. Это может быть связано с тем, что все обработки имели pH <4,2 [ 51 ], что эффективно ингибировало распад белка и использование аминокислот, вызванные нежелательными микроорганизмами. Предыдущие исследования показали, что относительное обилие общего количества LAB положительно связано с обилием метаболизма углеводов [ 12 , 52 ]. Как и ожидалось, по сравнению с CON, и LPCE и CE повысили регуляцию метаболизма углеводов, что, вероятно, было связано с тем, что деградация волокон, вызванная целлюлазой, могла обеспечить LAB большим количеством WSC для ферментации LA, тем самым повышая их активность метаболизма углеводов. Однако по сравнению с CON, и LP и LPCE понижали регуляцию мембранного транспорта, что могло быть связано с тем, что силос без добавок имел больше транспортеров [ 53 ]. Интересно, что по сравнению с CE и LP, LPCE оказал более сильное влияние на сдвиги функций в бактериальном сообществе, что позволяет предположить, что целлюлаза и Lactiplantibacillus plantarum, вероятно, оказали синергетическое действие на ускорение сукцессии бактериального сообщества и трансформацию метаболических функций в силосе с высоким содержанием клетчатки.
5. Выводы
Данное исследование было проведено с целью изучения роли целлюлазы и Lactiplantibacillus plantarum в процессе ферментации силоса Pennisetum giganteum zxlin. Инокуляция целлюлазой значительно снизила содержание НДФ и АДФ. Инокуляция Lactiplantibacillus plantarum эффективно увеличила соотношение LA/AA и содержание LA, что способствовало сохранению CP и WSC. Сочетание целлюлазы и Lactiplantibacillus plantarum показало наибольшую численность Lactobacillus и ускоренные сдвиги функций в бактериальном сообществе, что привело к наименьшему мембранному транспорту и наибольшему метаболизму углеводов. Подводя итог, можно сказать, что инокуляция целлюлазой или Lactiplantibacillus plantarum может улучшить качество силоса Pennisetum giganteum zxlin, а их комбинация показала большую способность изменять бактериальное сообщество.
Ссылки
References
1. Liu, X.; Li, D.; Ge, Q.; Yang, B.; Li, S. Effects of Harvest Period and Mixed Ratio on the Characteristic and Quality of Mixed Silage of Alfalfa and Maize. Anim. Sci. Technol. 2023, 306, 115796. [Google Scholar] [CrossRef]
2. Reed, M.S.; Stringer, L.C.; Dougill, A.J.; Perkins, J.S.; Atlhopheng, J.R.; Mulale, K.; Favretto, N. Reorienting Land Degradation towards Sustainable Land Management: Linking Sustainable Livelihoods with Ecosystem Services in Rangeland Systems. J. Environ. Manag. 2015, 151, 472–485. [Google Scholar] [CrossRef]
3. Cui, Y.; Ouyang, S.; Zhao, Y.; Tie, L.; Shao, C.; Duan, H. Plant Responses to High Temperature and Drought: A Bibliometrics Analysis. Front. Plant Sci. 2022, 13, 1052660. [Google Scholar] [CrossRef] [PubMed]
4. Zhou, J.; Chen, S.; Shi, W.; David-Schwartz, R.; Li, S.; Yang, F.; Lin, Z. Transcriptome Profiling Reveals the Effects of Drought Tolerance in Giant Juncao. BMC Plant Biol. 2021, 21, 2. [Google Scholar] [CrossRef] [PubMed]
5. Jia, Y.; Liao, Z.; Chew, H.; Wang, L.; Lin, B.; Chen, C.; Lu, G.; Lin, Z. Effect of Pennisetum giganteum z.x.lin Mixed Nitrogen-Fixing Bacterial Fertilizer on the Growth, Quality, Soil Fertility and Bacterial Community of Pakchoi (Brassica chinensis L.). PLoS ONE 2020, 15, e0228709. [Google Scholar] [CrossRef]
6. Qiu, Y.; Lei, Y.; Zhao, H.; He, X.; Liu, B.; Huang, Y. Mesophilic Anaerobic Digestion of Arundo donax Cv. Lvzhou No. 1 and Pennisetum giganteum for Biogas Production: Structure and Functional Analysis of Microbial Communities. Bioenerg. Res. 2023, 16, 1205–1216. [Google Scholar] [CrossRef]
7. Yang, F.; Wang, Y.; Zhao, S.; Wang, Y. Lactobacillus plantarum Inoculants Delay Spoilage of High Moisture Alfalfa Silages by Regulating Bacterial Community Composition. Front. Microbiol. 2020, 11, 1989. [Google Scholar] [CrossRef] [PubMed]
8. Dong, J.; Li, S.; Chen, X.; Sun, Z.; Sun, Y.; Zhen, Y.; Qin, G.; Wang, T.; Demelash, N.; Zhang, X. Effects of Lactiplantibacillus plantarum Inoculation on the Quality and Bacterial Community of Whole-Crop Corn Silage at Different Harvest Stages. Chem. Biol. Technol. Agric. 2022, 9, 57. [Google Scholar] [CrossRef]
9. Du, Z.; Yamasaki, S.; Oya, T.; Cai, Y. Cellulase-Lactic Acid Bacteria Synergy Action Regulates Silage Fermentation of Woody Plant. Biotechnol. Biofuels Bioprod. 2023, 16, 125. [Google Scholar] [CrossRef] [PubMed]
10. Zhong, C.; Wang, R.; Zhou, Z.; Jia, S.-R.; Tan, Z.-L.; Han, P.-P. Functional Properties of Protein Isolates from Caragana korshinskii Kom. Extracted by Three Different Methods. J. Agric. Food Chem. 2012, 60, 10337–10342. [Google Scholar] [CrossRef] [PubMed]
11. Ju, J.; Zhang, G.; Xiao, M.; Dong, C.; Zhang, R.; Du, L.; Zheng, Y.; Wei, M.; Wei, M.; Wu, B. Effects of Cellulase and Lactiplantibacillus Plantarum on the Fermentation Quality, Microbial Diversity, Gene Function Prediction, and in Vitro Rumen Fermentation Parameters of Caragana korshinskii Silage. Front. Food. Sci. Technol. 2023, 2, 1108043. [Google Scholar] [CrossRef]
12. Zhang, Y.; Wang, M.; Usman, S.; Li, F.; Bai, J.; Zhang, J.; Guo, X. Lignocellulose Conversion of Ensiled Caragana Korshinskii Kom. Facilitated by Pediococcus Acidilactici and Cellulases. Microb. Biotechnol. 2023, 16, 432–447. [Google Scholar] [CrossRef]
13. Si, Q.; Wang, Z.; Liu, W.; Liu, M.; Ge, G.; Jia, Y.; Du, S. Influence of Cellulase or Lactiplantibacillus plantarum on the Ensiling Performance and Bacterial Community in Mixed Silage of Alfalfa and Leymus chinensis. Microorganisms 2023, 11, 426. [Google Scholar] [CrossRef]
14. Hu, Z.; Niu, H.; Tong, Q.; Chang, J.; Yu, J.; Li, S.; Zhang, S.; Ma, D. The Microbiota Dynamics of Alfalfa Silage During Ensiling and After Air Exposure, and the Metabolomics After Air Exposure Are Affected by Lactobacillus casei and Cellulase Addition. Front. Microbiol. 2020, 11, 519121. [Google Scholar] [CrossRef] [PubMed]
15. AOAC. Official Methods of Analysis, 17th ed.; Association of Official Analytical Chemists: Washington, DC, USA, 2000. [Google Scholar]
16. Van Soest, P.J.; Robertson, J.B.; Lewis, B.A. Methods for Dietary Fiber, Neutral Detergent Fiber, and Nonstarch Polysaccharides in Relation to Animal Nutrition. J. Dairy Sci. 1991, 74, 3583–3597. [Google Scholar] [CrossRef]
17. Xu, J.; Zhang, K.; Lin, Y.; Li, M.; Wang, X.; Yu, Q.; Sun, H.; Cheng, Q.; Xie, Y.; Wang, C.; et al. Effect of Cellulase and Lactic Acid Bacteria on the Fermentation Quality, Carbohydrate Conversion, and Microbial Community of Ensiling Oat with Different Moisture Contents. Front. Microbiol. 2022, 13, 1013258. [Google Scholar] [CrossRef]
18. Wang, W.; Ungerfeld, E.M.; Degen, A.A.; Jing, X.; Guo, W.; Zhou, J.; Huang, X.; Mudassar, S.; Shi, F.; Bi, S.; et al. Ratios of Rumen Inoculum from Tibetan and Small-Tailed Han Sheep Influenced in Vitro Fermentation and Digestibility. Anim. Feed Sci. Technol. 2020, 267, 114562. [Google Scholar] [CrossRef]
19. Broderick, G.A.; Kang, J.H. Automated Simultaneous Determination of Ammonia and Total Amino Acids in Ruminal Fluid and in Vitro Media. J. Dairy Sci. 1980, 63, 64–75. [Google Scholar] [CrossRef] [PubMed]
20. Xu, F.; Liao, H.; Yang, J.; Zhang, Y.; Yu, P.; Cao, Y.; Fang, J.; Chen, S.; Li, L.; Sun, L.; et al. Auxin-Producing Bacteria Promote Barley Rhizosheath Formation. Nat. Commun. 2023, 14, 5800. [Google Scholar] [CrossRef]
21. Bolyen, E.; Rideout, J.R.; Dillon, M.R.; Bokulich, N.A.; Abnet, C.C.; Al-Ghalith, G.A.; Alexander, H.; Alm, E.J.; Arumugam, M.; Asnicar, F.; et al. Reproducible, Interactive, Scalable and Extensible Microbiome Data Science Using QIIME 2. Nat. Biotechnol. 2019, 37, 852–857. [Google Scholar] [CrossRef] [PubMed]
22. Qiu, Y.; Zhao, H.; He, X.; Zhu, F.; Zhang, F.; Liu, B.; Liu, Q. Effects of Fermented Feed of Pennisetum giganteum on Growth Performance, Oxidative Stress, Immunity and Gastrointestinal Microflora of Boer Goats under Thermal Stress. Front. Microbiol. 2022, 13, 1030262. [Google Scholar] [CrossRef] [PubMed]
23. Zhao, J.; Liu, H.-P.; Yin, X.-J.; Dong, Z.-H.; Wang, S.-R.; Li, J.-F.; Shao, T. Dynamics of Phyllosphere Microbiota and Chemical Parameters at Various Growth Stages and Their Contribution to Anaerobic Fermentation of Pennisetum giganteum. Microbiol. Spectr. 2023, 11, e02288-22. [Google Scholar] [CrossRef] [PubMed]
24. Lai, A.; Huang, Y.; Luo, H.; Jin, Y.; Wang, L.; Chen, B.; Deng, K.; Huang, W.; Zhang, Y. Ruminal Degradation Characteristics of Bagasse with Different Fermentation Treatments in the Rumen of Beef Cattle. Anim. Sci. J. 2024, 95, e13937. [Google Scholar] [CrossRef] [PubMed]
25. Wang, Q.; Wang, R.; Wang, C.; Dong, W.; Zhang, Z.; Zhao, L.; Zhang, X. Effects of Cellulase and Lactobacillus plantarum on Fermentation Quality, Chemical Composition, and Microbial Community of Mixed Silage of Whole-Plant Corn and Peanut Vines. Appl. Biochem. Biotechnol. 2022, 194, 2465–2480. [Google Scholar] [CrossRef]
26. Xiao, Y.; Sun, L.; Wang, Z.; Wang, W.; Xin, X.; Xu, L.; Du, S. Fermentation Characteristics, Microbial Compositions, and Predicted Functional Profiles of Forage Oat Ensiled with Lactiplantibacillus plantarum or Lentilactobacillus buchneri. Fermentation 2022, 8, 707. [Google Scholar] [CrossRef]
27. Iannaccone, F.; Alborino, V.; Dini, I.; Balestrieri, A.; Marra, R.; Davino, R.; Di Francia, A.; Masucci, F.; Serrapica, F.; Vinale, F. In Vitro Application of Exogenous Fibrolytic Enzymes from Trichoderma spp. to Improve Feed Utilization by Ruminants. Agriculture 2022, 12, 573. [Google Scholar] [CrossRef]
28. Guo, G.; Yuan, X.; Li, L.; Wen, A.; Shao, T. Effects of Fibrolytic Enzymes, Molasses and Lactic Acid Bacteria on Fermentation Quality of Mixed Silage of Corn and Hulless–Barely Straw in the Tibetan Plateau. Grassl. Sci. 2014, 60, 240–246. [Google Scholar] [CrossRef]
29. Kung, L.; Shaver, R.D.; Grant, R.J.; Schmidt, R.J. Silage Review: Interpretation of Chemical, Microbial, and Organoleptic Components of Silages. J. Dairy Sci. 2018, 101, 4020–4033. [Google Scholar] [CrossRef]
30. Li, F.; Ding, Z.; Ke, W.; Xu, D.; Zhang, P.; Bai, J.; Mudassar, S.; Muhammad, I.; Guo, X. Ferulic Acid Esterase-Producing Lactic Acid Bacteria and Cellulase Pretreatments of Corn Stalk Silage at Two Different Temperatures: Ensiling Characteristics, Carbohydrates Composition and Enzymatic Saccharification. Bioresour. Technol. 2019, 282, 211–221. [Google Scholar] [CrossRef]
31. Mu, L.; Xie, Z.; Hu, L.; Chen, G.; Zhang, Z. Lactobacillus plantarum and Molasses Alter Dynamic Chemical Composition, Microbial Community, and Aerobic Stability of Mixed (Amaranth and Rice Straw) Silage. J. Sci. Food Agric. 2021, 101, 5225–5235. [Google Scholar] [CrossRef] [PubMed]
32. Kung, J.R.L. Silage Fermentation End Products and Microbial Populations: Their Relationships to Silage Quality and Animal Productivity. In Proceedings of the Annual Conference of the American Association of Bovine Practitioners, Charlotte, NC, USA, 25–27 September 2008; Volume 25, p. 27. [Google Scholar]
33. Li, F.; Ke, W.; Ding, Z.; Bai, J.; Zhang, Y.; Xu, D.; Li, Z.; Guo, X. Pretreatment of Pennisetum sinese Silages with Ferulic Acid Esterase-Producing Lactic Acid Bacteria and Cellulase at Two Dry Matter Contents: Fermentation Characteristics, Carbohydrates Composition and Enzymatic Saccharification. Bioresour. Technol. 2020, 295, 122261. [Google Scholar] [CrossRef] [PubMed]
34. Guo, G.; Shen, C.; Liu, Q.; Zhang, S.L.; Wang, C.; Chen, L.; Xu, Q.F.; Wang, Y.X.; Huo, W.J. Fermentation Quality and in Vitro Digestibility of First and Second Cut Alfalfa (Medicago sativa L.) Silages Harvested at Three Stages of Maturity. Anim. Feed Sci. Technol. 2019, 257, 114274. [Google Scholar] [CrossRef]
35. Li, H.; Zeng, T.; Du, Z.; Dong, X.; Xin, Y.; Wu, Y.; Huang, L.; Liu, L.; Kang, B.; Jiang, D.; et al. Assessment on the Fermentation Quality and Bacterial Community of Mixed Silage of Faba Bean with Forage Wheat or Oat. Front. Microbiol. 2022, 13, 875819. [Google Scholar] [CrossRef] [PubMed]
36. Yang, L.; Yuan, X.; Li, J.; Dong, Z.; Shao, T. Dynamics of Microbial Community and Fermentation Quality during Ensiling of Sterile and Nonsterile Alfalfa with or without Lactobacillus plantarum Inoculant. Bioresour. Technol. 2019, 275, 280–287. [Google Scholar] [CrossRef] [PubMed]
37. Chen, L.; Bai, S.; You, M.; Xiao, B.; Li, P.; Cai, Y. Effect of a Low Temperature Tolerant Lactic Acid Bacteria Inoculant on the Fermentation Quality and Bacterial Community of Oat Round Bale Silage. Anim. Feed Sci. Technol. 2020, 269, 114669. [Google Scholar] [CrossRef]
38. Romero, J.J.; Zhao, Y.; Balseca-Paredes, M.A.; Tiezzi, F.; Gutierrez-Rodriguez, E.; Castillo, M.S. Laboratory Silo Type and Inoculation Effects on Nutritional Composition, Fermentation, and Bacterial and Fungal Communities of Oat Silage. J. Dairy Sci. 2017, 100, 1812–1828. [Google Scholar] [CrossRef] [PubMed]
39. Cai, Y.; Benno, Y.; Ogawa, M.; Ohmomo, S.; Kumai, S.; Nakase, T. Influence of Lactobacillus spp. from an Inoculant and of Weissella and Leuconostoc spp. from Forage Crops on Silage Fermentation. Appl. Environ. Microbiol. 1998, 64, 2982–2987. [Google Scholar] [CrossRef]
40. Tian, J.; Xu, N.; Liu, B.; Huan, H.; Gu, H.; Dong, C.; Ding, C. Interaction Effect of Silo Density and Additives on the Fermentation Quality, Microbial Counts, Chemical Composition and in Vitro Degradability of Rice Straw Silage. Bioresour. Technol. 2020, 297, 122412. [Google Scholar] [CrossRef] [PubMed]
41. Bao, X.; Feng, H.; Guo, G.; Huo, W.; Li, Q.; Xu, Q.; Liu, Q.; Wang, C.; Chen, L. Effects of Laccase and Lactic Acid Bacteria on the Fermentation Quality, Nutrient Composition, Enzymatic Hydrolysis, and Bacterial Community of Alfalfa Silage. Front. Microbiol. 2022, 13, 1035942. [Google Scholar] [CrossRef] [PubMed]
42. Ren, H.; Wang, C.; Fan, W.; Zhang, B.; Li, Z.; Li, D. Effects of Formic or Acetic Acid on the Storage Quality of Mixed Air-Dried Corn Stover and Cabbage Waste, and Microbial Community Analysis. Food Technol. Biotechnol. 2018, 56, 71–82. [Google Scholar] [CrossRef] [PubMed]
43. Cai, Y.; Benno, Y.; Ogawa, M.; Kumai, S. Effect of Applying Lactic Acid Bacteria Isolated from Forage Crops on Fermentation Characteristics and Aerobic Deterioration of Silage. J. Dairy Sci. 1999, 82, 520–526. [Google Scholar] [CrossRef] [PubMed]
44. Dong, Z.; Shao, T.; Li, J.; Yang, L.; Yuan, X. Effect of Alfalfa Microbiota on Fermentation Quality and Bacterial Community Succession in Fresh or Sterile Napier Grass Silages. J. Dairy Sci. 2020, 103, 4288–4301. [Google Scholar] [CrossRef] [PubMed]
45. Khota, W.; Pholsen, S.; Higgs, D.; Cai, Y. Natural Lactic Acid Bacteria Population of Tropical Grasses and Their Fermentation Factor Analysis of Silage Prepared with Cellulase and Inoculant. J. Dairy Sci. 2016, 99, 9768–9781. [Google Scholar] [CrossRef]
46. Li, P.; Liao, C.; Yan, L.; Zhang, C.; Chen, L.; You, M.; Cheng, Q.; Chen, C. Effects of Small-Scale Silo Types and Additives on Silage Fermentation and Bacterial Community of High Moisture Alfalfa on the Qinghai-Tibetan Plateau. Anim. Feed Sci. Technol. 2023, 299, 115594. [Google Scholar] [CrossRef]
47. Zheng, Y.; Li, M.; Xu, J.; Sun, H.; Cheng, Q.; Xie, Y.; Wang, C.; Chen, C.; Li, P. Effects of Different Cutting Methods and Additives on the Fermentation Quality and Microbial Community of Saccharum arundinaceum Silage. Front. Microbiol. 2022, 13, 999881. [Google Scholar] [CrossRef]
48. Slot, J.C. Fungal Gene Cluster Diversity and Evolution. Adv. Genet. 2017, 100, 141–178. [Google Scholar] [CrossRef]
49. Kanehisa, M.; Goto, S. KEGG: Kyoto Encyclopedia of Genes and Genomes. Nucleic Acids Res. 2000, 28, 27–30. [Google Scholar] [CrossRef] [PubMed]
50. Bai, J.; Franco, M.; Ding, Z.; Hao, L.; Ke, W.; Wang, M.; Xie, D.; Li, Z.; Zhang, Y.; Ai, L.; et al. Effect of Bacillus amyloliquefaciens and Bacillus Subtilis on Fermentation, Dynamics of Bacterial Community and Their Functional Shifts of Whole-Plant Corn Silage. J. Anim. Sci. Biotechnol. 2022, 13, 7. [Google Scholar] [CrossRef]
51. Wang, H.; Hao, W.; Ning, T.; Zheng, M.; Xu, C. Characterization of Culturable Yeast Species Associating with Whole Crop Corn and Total Mixed Ration Silage. Asian-Australas. J. Anim. Sci. 2017, 31, 198–207. [Google Scholar] [CrossRef]
52. Bai, J.; Ding, Z.; Ke, W.; Xu, D.; Wang, M.; Huang, W.; Zhang, Y.; Liu, F.; Guo, X. Different Lactic Acid Bacteria and Their Combinations Regulated the Fermentation Process of Ensiled Alfalfa: Ensiling Characteristics, Dynamics of Bacterial Community and Their Functional Shifts. Microb. Biotechnol. 2021, 14, 1171–1182. [Google Scholar] [CrossRef] [PubMed]
53. Kilstrup, M.; Hammer, K.; Ruhdal Jensen, P.; Martinussen, J. Nucleotide Metabolism and Its Control in Lactic Acid Bacteria. FEMS Microbiol. Rev. 2005, 29, 555–590. [Google Scholar] [CrossRef] [PubMed]
Вклад авторов
Концептуализация, LD, IK, JY и XL; методология, XZ, RL и JH; программное обеспечение, RL и JH; валидация, RL и JH; формальный анализ, ZW и XZ; исследование, ZW и XZ; ресурсы, JW, JY и XL; курирование данных, ZW, XZ, RL и JH; написание — подготовка первоначального черновика, ZW и XZ; написание — рецензирование и редактирование, ZW, XZ, RL, JH, LD, IK, JW, JY и XL; визуализация, ZW и XZ; руководство, XL; администрирование проекта, XL; получение финансирования, XL Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Данное исследование финансировалось в рамках проекта Shaanxi Livestock and Poultry Breeding Double-chain Fusion Key Project (2022GD-TSLD-46-0501), Научно-технологического проекта провинции Шэньси, Китай (2022ZDLNY01-09; 2023KJXX-132; 2024NC-YBXM-125) и Научно-технологического проекта города Сяньян, провинция Шэньси, Китай (L2022-QCYZX-NY-004).
Заявление Институционального наблюдательного совета
Непригодный.
Заявление о доступности данных
Данные предоставляются по запросу, направленному соответствующему автору.
Благодарности
Авторы выражают благодарность Ключевой лаборатории биологии животноводства Северо-Западного университета A&F, Янлин, Китай, за техническую помощь и использование исследовательского оборудования.
Конфликты интересов
Автор Цзе Вэй работал в компании Xi'an Architectural Design and Research Institute Co., Ltd. Остальные авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Effects of Cellulase and Lactiplantibacillus plantarum on Chemical Composition, Fermentation Characteristics, and Bacterial Community of Pennisetum giganteum z.x.lin Silage
by Zhili Wu1,2, Xiongfei Zhang1,2, Rongnuo Li1,2, Jingtao Hui1,2, Lu Deng1,2, Inho Kim 3ORCID, Jie Wei 4, Junhu Yao1,2 and Xinjian Lei1,2
1 College of Animal Science and Technology, Northwest A&F University, Xianyang 712100, China
2 Key Laboratory of Livestock Biology, Northwest A&F University, Xianyang 712100, China
3 Department of Animal Resource and Science, Dankook University, Cheonan 31116, Republic of Korea
4 Xi’an Architectural Design and Research Institute Co., Ltd., Xi’an 710000, China
Wu, Z.; Zhang, X.; Li, R.; Hui, J.; Deng, L.; Kim, I.; Wei, J.; Yao, J.; Lei, X. Влияние целлюлазы и Lactiplantibacillus plantarum на химический состав, характеристики ферментации и бактериальное сообщество силоса Pennisetum giganteum zxlin. Agriculture 2025 , 15 , 97. https://doi.org/10.3390/agriculture15010097
Wu, Z.; Zhang, X.; Li, R.; Hui, J.; Deng, L.; Kim, I.; Wei, J.; Yao, J.; Lei, X. Effects of Cellulase and Lactiplantibacillus plantarum on Chemical Composition, Fermentation Characteristics, and Bacterial Community of Pennisetum giganteum z.x.lin Silage. Agriculture2025, 15, 97.
Перевод статьи «Effects of Cellulase and Lactiplantibacillus plantarum on Chemical Composition, Fermentation Characteristics, and Bacterial Community of Pennisetum giganteum z.x.lin Silage» авторов Wu, Z.; Zhang, X.; Li, R.; Hui, J.; Deng, L.; Kim, I.; Wei, J.; Yao, J.; Lei, X., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык































































































Комментарии (0)