Влияние происхождения на формирование параметров стресса и селективного поведения кур
Целью данного исследования была оценка влияния происхождения кур локально адаптированных пород на уровни выбранных показателей стресса и нейротрансмиттера серотонина в крови, а также на выбранное поведение и состояние оперения.
Аннотация
В общей сложности 168 однодневных цыплят кур Леггорн H-22, Суссекс S-66 и Род-Айленд Красный R-11 были распределены на три экспериментальные группы, соответственно: 1, 2 и 3. Птицы выращивались на подстилке до 64-недельного возраста. В ходе эксперимента контролировали смертность птиц, измеряли продолжительность тонической неподвижности (ТИ), собирали кровь и определяли: соотношение гетерофилов к лимфоцитам (Г:Л), уровни кортикостерона, адреналина, норадреналина и серотонина. Также проводились поведенческие наблюдения и оценивалось состояние оперения кур. Изученные линии кур демонстрировали разный уровень страха и стресса в период выращивания, что отражалось в проведённом поведенческом тесте, а также в уровнях базального кортикостерона, норадреналина и соотношении H:L в крови. Также было показано, что с возрастом у птиц могут меняться стратегии реагирования на страх и стресс. Куры линии H-22 демонстрировали более высокий уровень страха и стресса как в молодом, так и во взрослом возрасте, а также характеризовались худшим оперением и более высокой смертностью в период выращивания. Результаты свидетельствуют о том, что линия H-22 имеет большую склонность к формированию стереотипов, таких как расклёв перьев, по сравнению с линиями S-66 и R-11.
1. Введение
Система содержания птицы включает в себя ряд экологических, технологических, пищевых и биологических факторов, которые вызывают стрессовую реакцию в организме [1,2], вызывая ухудшение благополучия животных и, как следствие, их здоровья и продуктивности, а также качества продукции [3,4]. Используя поведенческие и физиологические процессы, птицы пытаются справиться с действующими на них стрессорами с целью восстановления гомеостаза в организме. По Селье [5], во время стресса возникают типичные адаптивные (специфические) реакции и набор неспецифических симптомов стресса, называемых «общим адаптационным синдромом». В результате повышенной активности системы надпочечников и гипофиза в кровоток выбрасываются так называемые «гормоны стресса», в том числе кортикостерон, адреналин и норадреналин [6,7,8,9], длительный повышенный уровень которых отрицательно влияет на организм, вызывая, среди прочего, повышение артериального давления, учащенное сердцебиение, сердечно-сосудистые заболевания, гиперхолестеринемию, повреждение желудочно-кишечного тракта, изменение функции иммунной системы и изменение обменных процессов [3,8,10,11]. Стресс, действующий на птиц, увеличивает продолжительность тонической неподвижности [8,12], а также увеличивает количество базофилов, гетерофилов и моноцитов и уменьшает количество лимфоцитов в крови. Следовательно, соотношение гетерофилов и лимфоцитов увеличивается, когда птицы подвергаются воздействию стрессоров [6,8,13,14,15].Стресс, связанный с размножением, часто проявляется у птиц с патологическими формами поведения. И поэтому серьезной проблемой у кур, связанной как с благополучием, так и с большими экономическими потерями, является расклев перьев, проявляющийся выдергиванием перьев у других птиц [16,17,18]. Расстройство поведения расклев перьев является проблемой не только для взрослых кур-несушек, но также для цыплят и молодых кур [19,20]. Согласно обзору литературы, на это поведение влияет ряд факторов [16,18,21], однако несколько исследований предполагают тесную связь между пугливостью и стрессом у птиц и расклевом перьев [12,22,23,24,25,26], что связано, среди прочего, с функционированием нейроэндокринной системы [6,15,23,24,27,28]. Хуан и др. [17] сообщают, что уровень серотонина, локализующегося в желудочно-кишечном тракте, мозге и крови, может быть связан с патологическим поведением кур, таким как агрессия и расклёв перьев. Авторы сообщают, что у птиц с острой формой расклёва перьев уровень серотонина в крови был ниже, чем у кур без расклёва перьев. Напротив, Вестергаард и др. [29] обнаружили, что расклёв перьев положительно коррелировал с концентрацией кортикостерона в плазме.В научной литературе можно найти многочисленные исследования, указывающие на то, что устойчивость к факторам окружающей среды и восприимчивость к стрессу генетически детерминированы [4,30,31,32,33]. Однако эти исследования в основном касаются коммерческих линий цыплят-бройлеров или кур-несушек. Некоторые авторы также отмечают, что уровень стресса и робости у кур и возможность расклева перьев могут быть связаны с их генетическим фоном и наблюдаться как у чистокровных кур, так и у коммерческих гибридов [12,14,18,23,24,28,34,35]. Современные коммерческие линии и куры местных или адаптированных к местным условиям пород различаются не только по производительности и поведению [26,36,37], но и по физиологии, которая определяет поведение, навыки преодоления трудностей и восприимчивость к стрессу [38].Хотя различные виды домашней птицы были широко изучены на чувствительность к стрессу, эти исследования в основном касаются коммерческих линий цыплят-бройлеров или кур-несушек. Несколько исследований сравнивают физиологические и поведенческие показатели куропаток породы зеленая куропатка, леггорн и полбар [14,15]. Однако отсутствует информация о развитии уровней стресса и связанного с этим поведения у адаптированных к местным условиям пород кур, включенных в программу сохранения генетических ресурсов, таких как леггорн (H-22), сассекс (S-66) и RIR (R-11), которые рекомендуются и все чаще используются для содержания с доступом к свободному выгулу, включая органическую систему. Большая часть проводимых исследовательских работ в основном сосредоточена на сравнении этих штаммов с точки зрения производственных показателей, а также качества мяса и яиц [39,40,41,42,43].Куры пород, адаптированных к местным условиям, включенные в программу сохранения генетических ресурсов, использованную в нашем исследовании, предрасположены к содержанию на свободном выгуле, очень хорошо используют зеленые загоны, обладают хорошей устойчивостью и быстрой адаптацией к изменяющимся условиям в загонах [35,37], а содержание в обычных (крытых) условиях содержания может быть для них стрессором. По мнению Соколовича и др. [35], поведенческие потребности местных и адаптированных к местным условиям пород лучше всего удовлетворяются в условиях свободного выгула. С другой стороны, по мнению Гомеса и др. [44], ограничение или лишение возможности демонстрировать естественное поведение может привести к стрессу и проблемам со здоровьем у домашней птицы.Таким образом, целью исследования была оценка влияния происхождения адаптированных к местным условиям пород кур, включенных в программу сохранения генетических ресурсов (Леггорн-H-22, Сассекс-S-66 и RIR-R-11), на уровни выбранных показателей стресса (H:L, адреналин, норадреналин, кортикостерон) и нейротрансмиттера (серотонина) в крови, а также на выбранные поведенческие показатели и состояние оперения.
2. Материалы и методы
2.1 Экспериментальный участок
Исследование проводилось на Экспериментальной птицефабрике Национального научно-исследовательского института животноводства в Александровицах в Польше.
2.2 Птицы и экспериментальный дизайн
В эксперименте участвовали 168 однодневных цыплят местных адаптированных пород, включённых в программу сохранения генетических ресурсов, которых взвешивали и индивидуально маркировали. Птицы были получены с экспериментальной станции Chorzelów Sp. z oo Национального научно-исследовательского института животноводства. Цыплята были распределены на 3 группы: группа 1 — Леггорн H-22 (белые куры), группа 2 — Сассекс S-66 (белые с чёрными линиями накидки, маховых, серповидных и рулевых перьев) и группа 3 — Род-айленд красный (RIR) R-11 (тёмно-коричневые и махагоновые перья). В каждой группе 56 птиц были случайным образом разделены на 8 подгрупп (по 7 птиц в подгруппе). Размеры отсеков (реплик), в которых содержались подопытные куры, следующие: 1,46 м × 0,98 м = 1,43 м2. Птиц содержали на подстилке при плотности посадки 9 голов/м2(Законодательный вестник № 56, ст. 344 с изм.) [45] до достижения ими 64-недельного возраста и кормили стандартными кормовыми смесями на основе концентратов для кур-несушек (таблица 1).
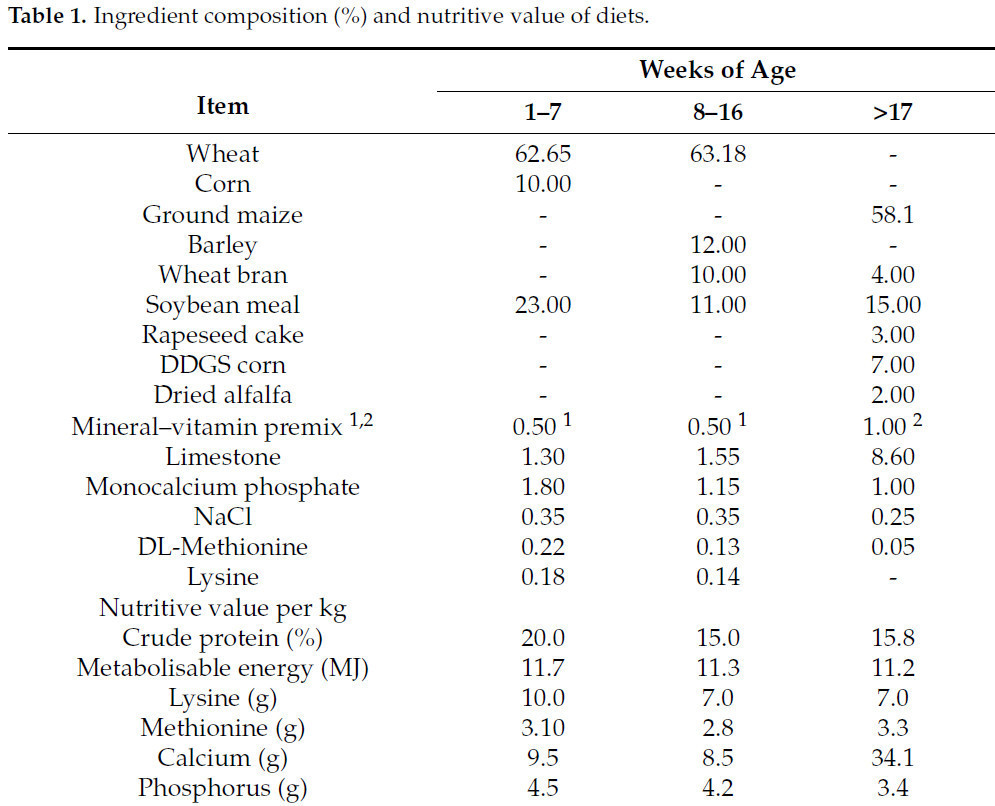
Таблица 1.Ингредиентный состав (%) и пищевая ценность рационов.
Птицы имели свободный доступ к поилкам на протяжении всего эксперимента. В первые дни выращивания птиц температура воздуха поддерживалась на уровне 33–31 °C и постепенно снижалась примерно до 16 °C на 11-й неделе выращивания, при этом влажность поддерживалась на уровне 65%. Все птицы выращивались в птичнике без окон, без доступа дневного света. Использовалась световая программа: в первую неделю – 21 час света, затем продолжительность светового дня постепенно сокращалась, и между 7-й и 16-й неделями выращивания продолжительность светового дня составляла 10 часов. В последующие недели световой день постепенно удлинялся до 14 часов на 20-й неделе. После этого световой день удлинялся каждую неделю на 30 и последовательно на 15 минут, так что на 26-й неделе жизни птиц он достиг 16 часов, и этот уровень поддерживался до конца эксперимента. Интенсивность освещения в период яйцекладки поддерживалась на уровне 15 люкс. Во всех экспериментальных группах использовалась одна и та же световая программа.
2.3. Данные, сбор образцов и лабораторные анализы
Во время эксперимента контролировалась смертность птиц, которая была представлена как общее количество потерь от смерти для каждой породы кур. На 1-й и 64-й неделе эксперимента измерялась продолжительность тонической неподвижности (TI) в соответствии с методологией Аксита и соавторов [46], и кровь собиралась у 10 птиц на группу. Кровь собиралась утром из вены крыла с помощью набора для вакуумного сбора крови. Кровь собиралась в пробирки с антикоагулянтом ЭДТА (соли этилендиаминтетрауксусной кислоты) и литий-гепарином. Из крови, собранной на ЭДТА, вручную готовили мазки с помощью двух предметных стекол, одно со скошенными краями (мазок). После приготовления и высушивания мазков применялось окрашивание по Майю-Грюнвальду-Гимзе (кат. № LO 001, LO 002, Alpha Diagnostics, Варшава, Польша). Окрашенные лейкоциты подсчитывали под микроскопом Nikon YS 100 (Nikon Co., Shinagawa, Токио, Япония) с использованием дифференциального метода Шиллинга (дифференциальный подсчет лейкоцитов). Подсчет клеток проводили с помощью гематологического счетчика клеток (SH 12/12, Торунь, Польша). На основании количества выделенных лейкоцитов рассчитывали соотношение гетерофилов и лимфоцитов (Г:Л).Кровь, собранную в пробирки с литий-гепарином, центрифугировали (центрифуга MPW-52, MPW Med. Instruments Spółdzielnia Pracy, Варшава, Польша). После центрифугирования полученную плазму пипетировали в пробирки Эппендорф и замораживали в течение 2 недель при температуре −80 °C для дальнейшего анализа. В плазме определяли уровни кортикостерона, адреналина, норадреналина и серотонина.Кортикостерон определяли методом конкурентного иммуноферментного анализа с использованием набора ELISA для определения кортикостерона курицы (Corticosterone), кат. № ELK8925 (ELK Biotechnology Co., Ltd., Денвер, штат Колорадо, США). Иммуноферментный анализ кортикостерона курицы (CV внутри анализа < 8%, CV между анализами < 10%) проводили в соответствии с рекомендациями производителя. Планшет в этом наборе был предварительно покрыт белком кортикостерона курицы. Стандарты и образцы пипетировали в соответствующие лунки планшета и добавляли конъюгированные с биотином антитела, специфичные к кортикостерону курицы. Затем в каждую лунку микропланшета добавляли конъюгированный с пероксидазой хрена (HRP) авидин и инкубировали. После этого добавляли раствор субстрата TMB. Реакцию фермента с субстратом останавливали добавлением раствора серной кислоты. Изменение цвета измеряли спектрофотометрически при 450 нм с помощью микропланшетного ридера MINDRAY MR-96A (Mindray Bio-Medical Electronics Co., Ltd., Шэньчжэнь, Китай).Уровни адреналина и норадреналина определяли с помощью набора ELISA Multi Parameter Kit 3-CAT ELISA Fast Track, кат. № BA E-6600 (LDN Labor Diagnostika Nord GmbH & Co. KG, Нордхорн, Германия). Иммуноферментный анализ адреналина (интратестовый CV 11,0–24,7%, межтестовый CV 11,1–14,5%) и норадреналина (интратестовый CV 11,1–14,3%, межтестовый CV 9,2–10,9%) проводили согласно инструкции производителя. Оба катехоламина, адреналин и норадреналин, были экстрагированы из одной партии образцов плазмы с использованием экстракционного планшета, покрытого гелем для цис-диоловой аффинности. Затем катехоламины модифицировались и ферментативно превращались в соответствующие N-ацильные производные, которые затем количественно определялись методом ИФА. Затем измеряли поглощение при длине волны 450 нм с помощью микропланшетного ридера SIRIO S (Next Level srl, Каленцано (Финляндия), Италия).Уровень серотонина определяли методом радиоиммунного анализа (РИА) с использованием готовых к использованию наборов для быстрого определения серотонина RIA Fast Track, каталожный номер BA R-8900 (LDN Labor Diagnostika Nord GmbH & Co. KG, Нордхорн, Германия), на автоматическом гамма-счетчике 2470 WIZARD2 (PerkinElmer, Inc., Уолтем, Массачусетс, США). Иммуноферментный анализ серотонина (интраанализный CV 4,18–4,74%, межанализный CV 4,6–5,6%) проводили в соответствии с рекомендациями производителя. Процедура анализа основана на основном принципе радиоиммунного анализа, который включает конкуренцию между радиоактивным и нерадиоактивным антигеном за фиксированное количество участков связывания антитела. Количество антигена, меченного 125I, связанного с антителом, обратно пропорционально концентрации аналита в образце. Когда система достигает равновесия, радиоактивность, связанная с антителом, осаждается вторым антителом в присутствии полиэтиленгликоля. Осадок подсчитывался в гамма-счётчике. Количественное определение неизвестных образцов проводилось путём сравнения их активности с эталонной кривой, построенной на основе известных стандартов.Поведенческие наблюдения проводились 3 раза в 1-ю и 64-ю неделю выращивания (понедельник, среда, пятница) с 9:00 до 11:00 утра с использованием широкоугольных камер видеонаблюдения Hikvision, модель: DS.-2CD2642FWD-IS (Hangzhou Hikvision Digital Technology Co., Ltd., Ханчжоу, Китай), установленных по одной в каждом отсеке (подгруппе). Наблюдения проводились в каждой группе, состоящей из 8 подгрупп (по 7 птиц в каждой подгруппе). Наблюдения включали следующее: количество агрессивных птиц, выщипывание и выщипывание перьев друг у друга. Агрессивное поведение определялось как расклев открытых частей тела (пальцы ног, клоака, гребень, сережки), взъерошивание перьев, готовность к нападению, драка и преследование другой птицы. Данные с камер записывались на носитель данных, а затем анализировались 1 наблюдателем путем подсчета количества птиц, демонстрирующих вышеуказанное поведение. Мониторинг проводился 4 раза (с интервалом 5 минут) в течение каждого часа наблюдений. Данные систематизированы, и результаты представлены в виде средней доли птиц, проявлявших агрессию, выщипывающих и выщипывающих перья друг у друга в течение 1-й и 64-й недель выращивания в зависимости от количества птиц в отсеке (подгруппе).Состояние оперения также оценивалось у 20 кур в группе в возрасте 64 недель. Куры были случайным образом отобраны и по отдельности переведены из курятника в соседнее помещение. Оценка состояния оперения (FCS) проводилась по методу Бильчика и Килинга [47], модифицированному Уитдехаагом и др. [48]. Оценка проводилась по 4 областям: шея, спина, крестец и живот, поскольку, по данным Бильчика и Килинга [47], именно в этих областях наблюдается наибольшее расклёвывание. Каждой обследованной области тела присваивалась оценка от 0 (целые перья) до 5 (полностью без перьев). Общая оценка состояния оперения в диапазоне от 0 до 20 рассчитывалась по формуле Сана и др. [49]:
Оценку оперения проводил один человек — специалист по оценке благополучия домашней птицы.
Исследование было одобрено Первым местным этическим комитетом по экспериментам на животных в Кракове (№ 58/2017).
2.4 Статистический анализ
Для оценки нормальности распределения данных применялся критерий Шапиро–Уилка. Результаты статистически обрабатывались с помощью однофакторного дисперсионного анализа (ANOVA) в программе Statistica 12 (StatSoft Inc., Талса, Оклахома, США, 2011). Значимость различий средних значений между экспериментальными группами определялась с помощью критерия Дункана. Эффекты считались значимыми при вероятностяхp< 0,05 иp< 0,01.
3. Результаты
3.1. Длительность тонической неподвижности (ТИ) и показатели стресса
Таблица 2показывает продолжительность TI и уровень выбранных параметров стресса в крови птиц на 1-й и 64-й неделе выращивания. В течение этого периода была отмечена разница в продолжительности TI между группой H-22 и группами S-66 и R-11 приp< 0,01 иp< 0,05 соответственно. Была обнаружена разница (p< 0,05) в 8,8% в уровне лимфоцитов между H-22 и R-11. Также была отмечена разница в соотношении H:L между этими группами приp< 0,05. В крови кур R-11 были самые низкие уровни норадреналина по сравнению с двумя другими экспериментальными группами приp< 0,01 иp< 0,05 соответственно. Птицы R-11 также имели более низкие уровни кортикостерона по сравнению с птицами H-22 приp< 0,05.
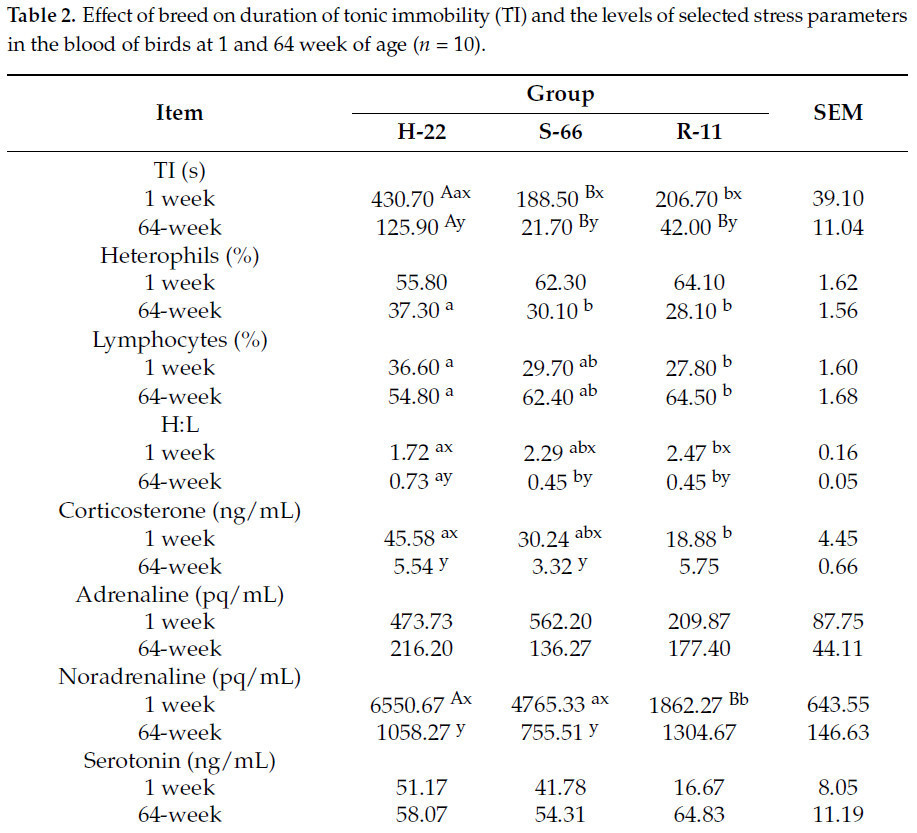
Таблица 2.Влияние породы на продолжительность тонической неподвижности (ТИ) и уровни выбранных параметров стресса в крови птиц в возрасте 1 и 64 недель (n= 10).
На 64-й неделе выращивания наблюдалась разница в продолжительности TI между группой H-22 и группами S-66 и R-11 приp< 0,01. Группа H-22 имела самый высокий уровень гетерофилов по сравнению с группами S-66 и R-11 приp< 0,05. Также наблюдалась разница в процентном содержании лимфоцитов в крови между группами H-22 и R-11 приp< 0,05. У кур H-22 в этот период наблюдалось самое высокое соотношение H:L по сравнению с двумя другими группами приp< 0,05.В крови 64-недельных кур линий H-22 и S-66 были обнаружены более низкие уровни кортикостерона и норадреналина по сравнению с недельными птицами этих линий приp< 0,01. У более старых птиц линий H-22, S-66 и R-11 время TI было короче, а соотношение H:L – уже, чем у недельных птиц (p< 0,01).
3.2. Наблюдения за поведением, смертностью и состоянием оперения
Поведенческие наблюдения показали самый высокий процент птиц, которые были агрессивны, клевали друг друга и выдергивали перья, для группы H-22 по сравнению с птицами S-66 и R-11 приp< 0,05 иp< 0,01 соответственно (таблица 3). С возрастом процент агрессивных птиц снижался во всех трех экспериментальных группах приp< 0,01. Процент кур, которые клюют друг друга, увеличился на 64-й неделе выращивания в группе H-22 (p< 0,01), тогда как в случае кур R-11 он снизился на 1,22% приp< 0,01. В группах S-66 и R-11 также наблюдалось снижение процента кур, которые клюют друг друга и выдергивают друг друга приp< 0,01 иp< 0,05 соответственно.
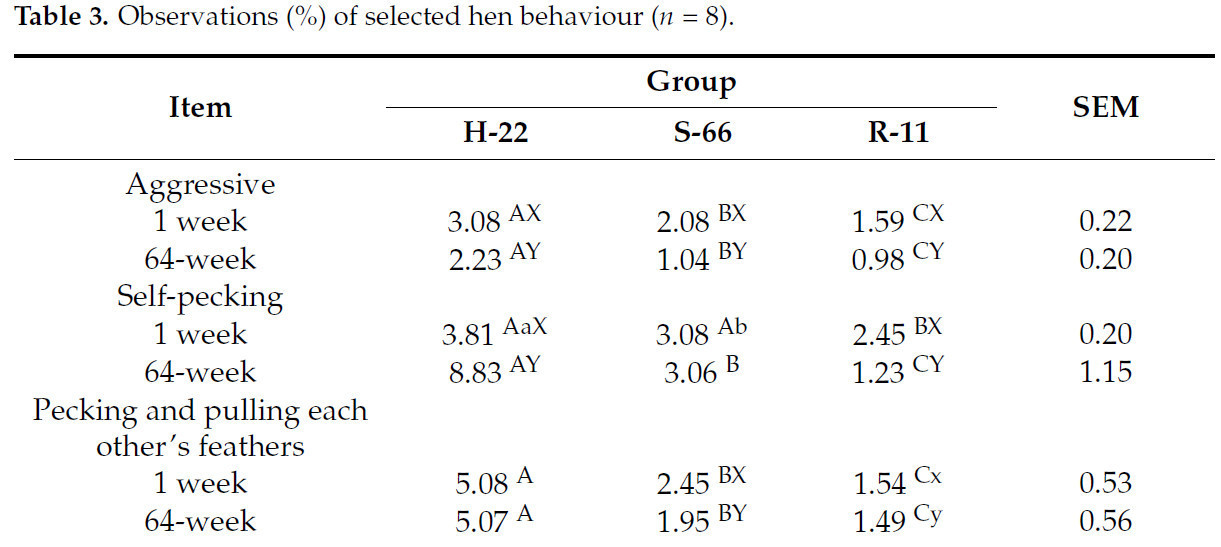
Таблица 3.Наблюдения (%) за поведением выбранных кур (n= 8).
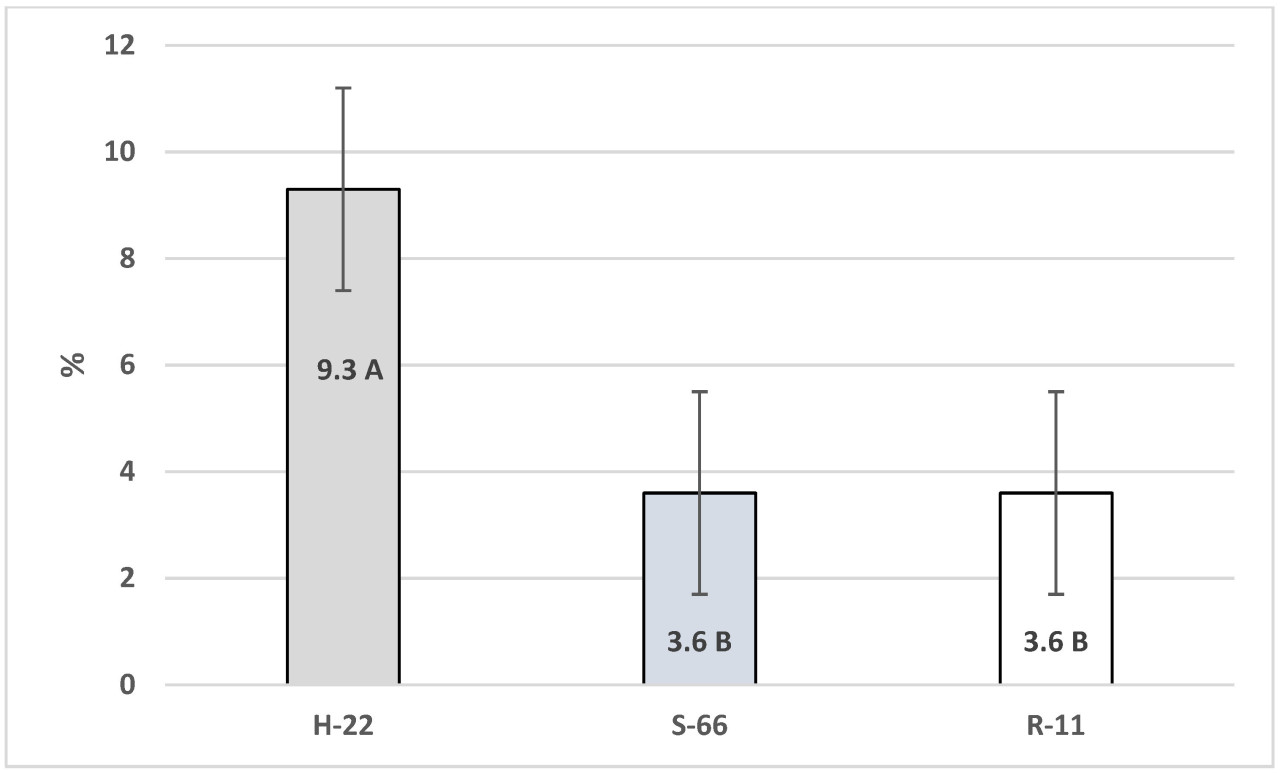
Все случаи гибели кур были зарегистрированы у кур старше 20 недель. Ветеринарный врач птицефермы провел вскрытие павших птиц для диагностики. Однако, помимо очевидных проявлений агрессии и выщипывания перьев, других причин гибели выявлено не было, поэтому все случаи падения кур были классифицированы как результат агрессии и выщипывания перьев. У птиц H-22 наблюдалась самая высокая смертность (p< 0,01) в период выращивания по сравнению с S-66 и R-11 (рисунок 1).
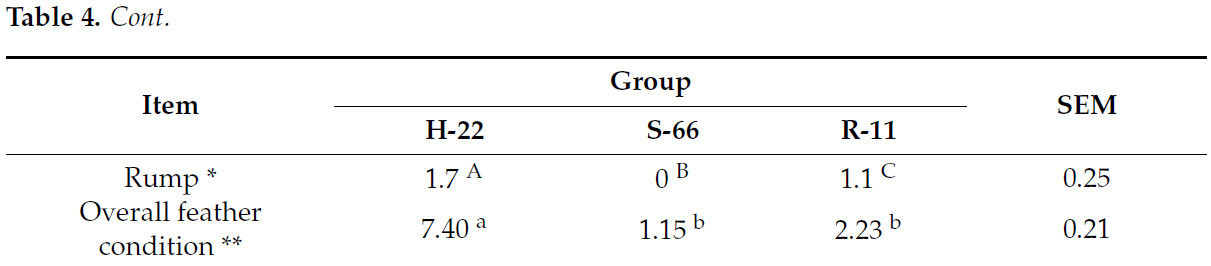
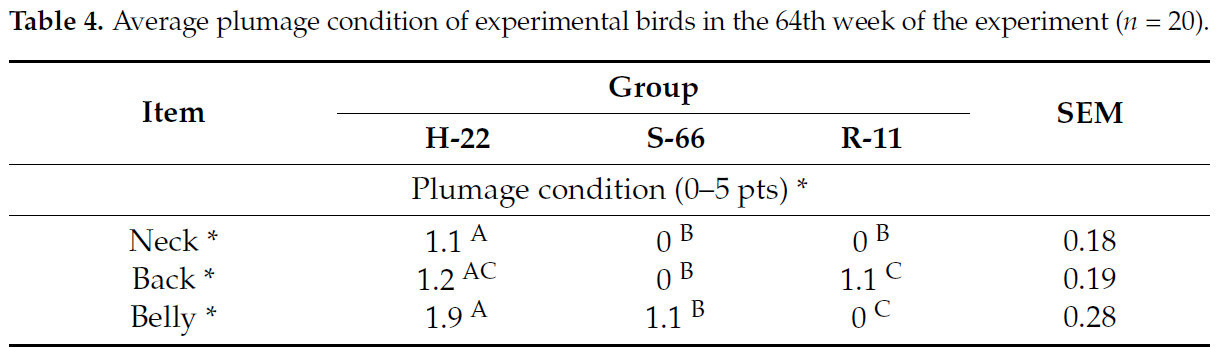
Куры H-22 также характеризовались худшим оперением отдельных частей тела, чем куры S-66 и R-11 приp< 0,01 (таблица 4). Также наблюдалась разница в среднем состоянии оперения всего тела между птицами H-22, S-66 и R-11 приp< 0,05.Таблица 4.Среднее состояние оперения подопытных птиц на 64-й неделе эксперимента (n= 20).
4. Обсуждение
Многие авторы показали различия в поведении кур разного происхождения в ответ на проведенные поведенческие тесты. Де Хаас и др. [12] сообщают, что коммерческие линии несушек с белым оперением показывают более длительную продолжительность TI и более высокие уровни кортикостерона после стрессового фактора по сравнению с линиями кур с коричневым оперением. Уйтдехааг и др. [23] показали более активные ответы от кур породы Род-Айленд Красный в проведенных поведенческих тестах, чем куры породы Белый Леггорн, что, вероятно, отражает их меньшую пугливость. Аналогичным образом, Нельсон и др. [50] показали четкие различия между курами породы Род-Айленд Красный и Белый Леггорн в реакциях на стресс и страх. Также в эксперименте Альбентоса и др. [51] белые леггорны показали более длительную продолжительность TI, чем другие протестированные линии кур. Браун и др. [11] сообщают, что реакция птиц разного происхождения на стресс варьируется и меняется с возрастом. В нашем исследовании были отмечены различия в продолжительности TI между изучаемыми штаммами как у очень молодых птиц, так и у взрослых птиц. Самая длинная TI, независимо от возраста, была характерна для кур H-22 по сравнению с курами S-66 и R-11. Наше исследование также показало более короткую продолжительность TI у взрослых птиц по сравнению с однонедельными птицами. Аналогичным образом, Bögelein и др. [52] обнаружили, что молодые птицы были более пугливыми, чем взрослые птицы, что было отражено, среди прочего, в тесте TI. Напротив, наблюдения Alm и др. [53] показывают, что куры, подвергнутые поведенческим тестам, становились более пугливыми с возрастом. Следовательно, можно сделать вывод, что с возрастом страх у кур может развиваться по-разному в зависимости от породы или линии, а также от особей внутри линии или породы.Ferrante et al. [54] сообщают, что соотношение гетерофилов к лимфоцитам (H:L) и концентрации кортикостерона в плазме обычно используются в качестве критериев оценки стресса у домашней птицы и в качестве физиологических показателей благополучия. Кроме того, катехоламины, такие как адреналин и норадреналин, могут быть использованы в качестве показателей навыков преодоления стресса [6,7]. В нашем исследовании недельные куры H-22 характеризовались более высокими уровнями базального кортикостерона и норадреналина в крови и более низким соотношением H:L, чем куры R-11. Напротив, в крови взрослых кур наблюдалась только значительная разница в уровнях гетерофилов и лимфоцитов, которая влияла на соотношение H:L. Штамм H-22 характеризовался самым широким соотношением H:L в этот период, что позволяет предположить, что в этом возрасте они были более чувствительны к длительному стрессу по сравнению с курами S-66 и R-11, что противоположно тому, что наблюдалось на 1-й неделе эксперимента. Кроме того, Ферранте и соавторы [54] предложили референтные значения для соотношения H:L в крови птиц приблизительно 0,2, 0,5 и 0,8, характерные для низкого, оптимального и высокого стресса соответственно. Можно сделать вывод, что изученные штаммы кур показали сильный стресс в очень молодом возрасте, в то время как 64-недельные птицы показали сужение соотношения H:L во всех группах. Штаммы S-66 и R-11 характеризовались оптимальными уровнями стресса, в то время как 64-недельные птицы H-22 все еще показывали высокий уровень стресса. Кроме того, анализируя уровни базального кортикостерона и норадреналина, было обнаружено, что их уровни были выше у птиц H-22 и S-66 в начальный период выращивания, чем в возрасте 64 недель. Эти результаты подтверждают представление о том, что изменения в стратегиях реагирования птиц на страх и стресс могут происходить с возрастом [11]. Rozempolska-Rucińska и соавторы. [14] показали различия в тестируемых параметрах крови, таких как лизоцим, лейкоциты, концентрации ионов Na+ и K+, а также соотношение H:L и содержание кортикостерона в перьях между курами пород Greenleg Parridge, Polbar и Leghorn. Породы также различались по поведенческим индексам. С другой стороны, Kasperek et al. [15], сравнивая кур Leghorn с местной породой Greenleg Parridge, наблюдали различия в концентрации дофамина, цинка и железа в мозге и в количестве нервных клеток в паравентрикулярном ядре и переднем гипоталамусе мозга, что, по мнению авторов, оказывает влияние на поведенческие различия у этих птиц. Поведенческие различия были также продемонстрированы Rieke et al. [18] между высокопродуктивными курами Lohmann Brown plus и курами общего назначения Lohman Dual.Роденбург и др. [55] обнаружили сильную отрицательную корреляцию между активностью молодых кур в тесте открытого поля и частотой серьезного расклева во взрослом возрасте. Аналогичным образом, Де Хаас и др. [56] и Грэмс и др. [57] показали, что страх у молодых птиц является фактором повреждения перьев во взрослом возрасте. В нашем исследовании цыплята породы Леггорн оказались самыми пугливыми, что может указывать на то, что у них будет больше шансов развить расклев перьев во взрослом возрасте по сравнению с породами Сассекс или RIR. Проведенные поведенческие наблюдения показали в целом низкий процент птиц, демонстрирующих патологическое поведение. Однако самый высокий процент кур, которые были агрессивны, клюют друг друга или выдергивают перья, наблюдался в стаде H-22. Напротив, самый низкий процент кур, демонстрирующих патологическое поведение, наблюдался в группе R-11. Лин и др. [26] сообщают, что как высокопродуктивные куры, так и местные или местные породы кур отличаются по поведению, что связано с их генетическим фоном. По мнению авторов, агрессивное поведение приводит к большему стрессу у птиц и более высоким показателям смертности, что подтверждается нашим собственным исследованием. В нашем исследовании мы выявили различия в поведении птиц в зависимости от возраста. У каждой из трех изученных пород было отмечено снижение агрессивного поведения с возрастом, что можно объяснить установлением иерархии в стаде и стабилизацией группы, что приводит к снижению агонистического поведения птиц [18,26,28]. С другой стороны, Рике и др. [18] продемонстрировали, что расклев перьев у наблюдаемых несушек Lohmann Brown plus (LB+) увеличивался с возрастом, чего авторы не наблюдали в случае кур Lohmann Dual (LD). Аналогичным образом, в нашем исследовании процент кур H-22, расклевывающих себя, увеличивался с возрастом. Для двух других изученных пород процент кур, расклевывающих свои перья, снизился на 64 неделе выращивания. Куры H-22 также характеризовались более плохим оперением на 64 неделе, чем птицы в двух других группах. Результаты нашего собственного исследования согласуются с данными, сообщенными Де Хаасом и соавторами [12], которые утверждали, что куры с белым оперением (Dekalb White) имели больше повреждений перьев, чем куры с коричневым оперением (ISA Brown). В нашем исследовании куры H-22 показали повреждения перьев во всех оцененных частях тела (шея, спина, живот, крестец). Худшее оперение наблюдалось на животе и в области крестца. У кур S-66 худшее оперение наблюдалось на животе, в то время как у кур R-11 оно наблюдалось на спине и в области крестца. Аналогичным образом, другие авторы показали различия в качестве оперения различных частей тела оцениваемых кур, на которые влияли генетические факторы, возраст птиц и условия выращивания [23,55,56,58]. Повреждения оперения в области живота, спины и крестца могут указывать на наличие стереотипии, такой как расклев перьев, у изученных пород кур [12,20,58].Uitdehaag et al. [23] показали, что куры породы белый леггорн демонстрируют более низкий уровень серотонина в крови по сравнению с курами породы RIR, что связано с большей пугливостью и предрасположенностью к расклеву перьев и агрессии [17]. Более низкие уровни серотонина в крови также были связаны с более низкими показателями выживаемости в результате патологического поведения, такого как расклев перьев и каннибализм [6,27]. В нашем исследовании не было обнаружено различий в уровнях серотонина в крови между изучаемыми штаммами. Тем не менее, более высокий уровень смертности был обнаружен у кур H-22 по сравнению с курами S-66 и R-11. Более высокий уровень смертности у кур H-22 мог быть связан с большей чувствительностью этой породы к стрессу, на что указывают изученные физиологические и поведенческие показатели стресса.
5. Выводы
В заключение следует отметить, что изученные линии кур демонстрировали разную степень страха и стресса в период выращивания, что отражалось в проведенном поведенческом тесте и уровнях базального кортикостерона, норадреналина и соотношения H:L в крови. Также было показано, что с возрастом могут меняться стратегии реагирования птиц на страх и стресс. Куры H-22 демонстрировали более высокий уровень страха и стресса как в молодом возрасте, так и во взрослом, что подтверждалось более высоким процентом птиц с патологическими формами поведения. Куры H-22 также характеризовались худшим оперением и более высокой смертностью в период выращивания. Таким образом, полученные результаты свидетельствуют о том, что линия H-22 демонстрирует большую склонность к развитию стереотипий, таких как расклёв перьев, по сравнению с линиями S-66 и R-11.Проведенное исследование предоставляет информацию о физиологическом и селективном поведении (агрессия, расклев перьев) кур трех пород, адаптированных к местным факторам окружающей среды, связанным с выращиванием, что открывает возможность более эффективного управления стадом и, следовательно, повышения благополучия кур-несушек. Однако необходимо провести аналогичные исследования на местных и адаптированных к местным условиям породах кур, выращиваемых на свободном выгуле, для чего они и рекомендуются.
Ссылки
1. Campo, J.L.; Cabezas, R.; Torres, O.; González Briones, I.; Alonso, C. Egg quality and welfare of white-tinted-, and brown-shell egg layers in three different non-cage housing systems. Arch. Geflügelkd. 2013, 77, 179–188. [Google Scholar]
2. Balakrishnan, K.N.; Ramiah, S.K.; Zulkifli, I. Heat shock protein response to stress in poultry: A Review. Animals 2023, 13, 317. [Google Scholar] [CrossRef] [PubMed]
3. Puvadolpirod, S.; Thaxton, J.P. Model of physiological stress in chickens. 4. Digestion and metabolism. Poult. Sci. 2000, 79, 383–390. [Google Scholar] [CrossRef]
4. Aboghanima, M. Strain variation to cold stress in growth performance, carcass traits, hematological, blood biochemical parameters and antioxidant enzymes in broilers. Damanhour J. Vet. Sci. 2020, 3, 17–22. [Google Scholar] [CrossRef]
5. Selye, H. A syndrome produced by diverse nocuous agents. Nature 1936, 138, 32. [Google Scholar] [CrossRef]
6. Cheng, H.W.; Dillworth, G.; Singleton, P.; Chen, Y.; Muirt, W.M. Effects of group selection for productivity and longevity on blood concentrations of serotonin, catecholamines, and corticosterone of laying hens. Poult. Sci. 2001, 80, 1278–1285. [Google Scholar] [CrossRef]
7. Skomorucha, I.; Sosnówka-Czajka, E. Effect of adding mixed herb extracts to drinking water on stress hormone levels in broiler chickens. Wiad. Zootech. 2013, 51, 14–18. (In Polish) [Google Scholar]
8. Scanes, C.G. Biology of stress in poultry with emphasis on glucocorticoids and the heterophil to lymphocyte ratio. Poult. Sci. 2016, 95, 2208–2215. [Google Scholar] [CrossRef] [PubMed]
9. Tilbrook, A.J.; Fisher, A.D. Stress, health and the welfare of laying hens. Anim. Prod. Sci. 2020, 61, 931–943. [Google Scholar] [CrossRef]
10. Virden, W.S.; Thaxton, J.P.; Corzo, A.; Dozier, W.A., III; Kidd, M. Evaluation of models using corticosterone and adrenocorticotropin to induce conditions mimicking physiological stress in commercial broilers. Poult. Sci. 2007, 86, 2485–2491. [Google Scholar] [CrossRef] [PubMed]
11. Brown, A.A.; Sobotik, E.B.; House, G.M.; Nelson, J.R.; Archer, G.S. Differences in fear response strategy and stress susceptibility amongst four different commercial layer strains reared cage free. Front. Physiol. 2022, 13, 943471. [Google Scholar] [CrossRef] [PubMed]
12. De Haas, E.N.; Kemp, B.; Bolhuis, J.E.; Groothuis, T.; Rodenburg, T.B. Fear, stress, and feather pecking in commercial white and brown laying hen parent-stock flocks and their relationships with production parameters. Poult. Sci. 2013, 92, 2259–2269. [Google Scholar] [CrossRef] [PubMed]
13. Lentfer, T.L.; Pendl, H.; Gebhardt-Henrich, S.G.; Fröhlich, E.K.F.; Von Borell, E. H/L ratio as a measurement of stress in laying hens—Methodology and reliability. Br. Poult. Sci. 2015, 56, 157–163. [Google Scholar] [CrossRef] [PubMed]
14. Rozempolska-Rucińska, I.; Czech, A.; Kasperek, K.; Zięba, G.; Ziemiańska, A. Behaviour and stress in three breeds of laying hens kept in the same environment. S. Afr. J. Anim. Sci. 2020, 50, 272–280. [Google Scholar] [CrossRef]
15. Kasperek, K.; Jaworska Adamu, J.; Krawczyk, A.; Rycerz, K.; Buszewicz, G.; Przygodzka, D.; Wójcik, G.; Blicharska, E.; Drabik, K.; Czech, A.; et al. Investigation of structural and neurobiochemical diferences in brains from high-performance and native hen breeds. Sci. Rep. 2023, 13, 224. [Google Scholar] [CrossRef] [PubMed]
16. Skomorucha, I.; Sosnówka-Czajka, E. Factors affecting the development of feather pecking in laying hens. Rocz. Nauk. Zootech. 2018, 45, 143–150. (In Polish) [Google Scholar]
17. Huang, C.; Hao, E.; Yue, Q.; Liu, M.; Wang, D.; Chen, Y.; Shi, L.; Zeng, D.; Zhao, G.; Chen, H. Malfunctioned inflammatory response and serotonin metabolism at the microbiota-gut-brain axis drive feather pecking behavior in laying hens. Poult. Sci. 2023, 102, 102686. [Google Scholar] [CrossRef] [PubMed]
18. Rieke, L.; Spindler, B.; Zylka, I.; Kemper, N.; Giersberg, M.F. Pecking behavior in conventional layer hybrids and dual-purpose hens throughout the laying period. Front. Vet. Sci. 2021, 8, 660400. [Google Scholar] [CrossRef]
19. Gilani, A.M.; Knowles, T.G.; Nicol, C.J. The effect of rearing environment on feather pecking in young and adult laying hens. Appl. Anim. Behav. Sci. 2013, 148, 54–63. [Google Scholar] [CrossRef]
20. Zepp, M.; Louton, H.; Erhard, M.; Schmidt, P.; Helmer, F. The influence of stocking density and enrichment on the occurrence of feather pecking and aggressive pecking behaviour in laying hen. J. Vet. Behav. 2018, 24, 9–18. [Google Scholar] [CrossRef]
21. Mellor, E.; Brilot, B.; Collins, S. Abnormal repetitive behaviours in captive birds: A Tinbergian review. Appl. Anim. Behav. Sci. 2018, 198, 109–120. [Google Scholar] [CrossRef]
22. Campo, J.L.; Gil, M.G.; Torres, O.; Davila, S.G. Association between plumage condition and fear and stress levels in five breeds of chickens. Poult. Sci. 2001, 80, 549–552. [Google Scholar] [CrossRef]
23. Uitdehaag, K.A.; Rodenburg, T.B.; Van Reenen, C.G.; Koopmanschap, R.E.; De Vries Reilingh, G.; Engel, B.; Buist, W.G.; Komen, H.; Bolhuis, J.E. Effects of genetic origin and social environment on behavioral response to manual restraint and monoamine functioning in laying hens. Poult. Sci. 2011, 90, 1629–1636. [Google Scholar] [CrossRef]
24. Kops, M.S.; Kjaer, J.B.; Güntürkün, O.; Westphal, K.G.C.; Korte-Bouws, G.A.H.; Olivier, B.; Korte, S.M.; Bolhuis, J.E. Brain monoamine levels and behaviour of young and adult chickens genetically selected on feather pecking. Behav. Brain Res. 2017, 327, 11–20. [Google Scholar] [CrossRef]
25. Van der Eijk, J.A.J.; Lammers, A.; Li, P.; Kjaer, J.B.; Rodenburg, T.B. Feather pecking genotype and phenotype affect behavioural responses of laying hens. Appl. Anim. Behav. Sci. 2018, 205, 141–150. [Google Scholar] [CrossRef]
26. Lin, J.H.; Daigle, C.L.; Tang, P.C.; Wang, C.K. Influence of sex hormones on the aggressive behavior during peck order establishment and stabilization in meat and egg type chickens. Poult. Sci. 2024, 103, 103669. [Google Scholar] [CrossRef]
27. Buitenhuis, A.J.; Kjaer, J.B.; Labouriau, R.; Juul-Madsen, H.R. Altered circulating levels of serotonin and immunological changes in laying hens divergently selected for feather pecking behavior. Poult. Sci. 2006, 85, 1722–1728. [Google Scholar] [CrossRef]
28. Birkl, P.; Franke, L.; Rodenburg, T.B.; Ellen, E.; Harlander-Matauschek, A. A role for plasma aromatic amino acids in injurious pecking behavior in laying hens. Physiol. Behav. 2017, 175, 88–96. [Google Scholar] [CrossRef]
29. Vestergaard, K.S.; Skadhauge, E.; Lawson, L.G. The stress of not being able to perform dustbathing in laying hens. Physiol. Behav. 1997, 62, 413–419. [Google Scholar] [CrossRef] [PubMed]
30. Al-Murrani, W.K.; Al-Rawi, A.J.; Al-Hadithi, M.F.; Al-Tikriti, B. Association between heterophil/lymphocyte ratio, a maker of “resistance” to stress, and some production and fitness traits in chockenc. Br. Poult. Sci. 2006, 47, 443–448. [Google Scholar] [CrossRef] [PubMed]
31. Campo, J.L.; Prieto, M.T.; Dávila, S.G. Effects of housing system and cold stress on heterophil-to-lymphocyte ratio, fluctuating asymmetry, and tonic immobility duration of chickens. Poult. Sci. 2008, 87, 621–626. [Google Scholar] [CrossRef] [PubMed]
32. Skomorucha, I.; Sosnówka-Czajka, E.; Muchacka, R. Effect of thermal conditions on welfare of broiler chickens of different orgin. Ann. Anim. Sci. 2010, 10, 489–497. [Google Scholar]
33. De Baets, R.; Buyse, K.; Antonissen, G.; Delezie, E. Betaine and feed restriction as potential mitigation strategies against heat stress in two strains of laying hens. Poult. Sci. 2024, 103, 104104. [Google Scholar] [CrossRef] [PubMed]
34. Giersberg, M.F.; Spindler, B.; Kemper, N. Assessment of plumage and integument condition in dual-purpose breeds and conventional layers. Animals 2017, 7, 97. [Google Scholar] [CrossRef] [PubMed]
35. Sokołowicz, Z.; Dykiel, M.; Topczewska, J.; Krawczyk, J.; Augustynska-Prejsnar, A. The effect of the type of non-caged housing system, genotype and age on the behaviour of Laying Hens. Animals 2020, 10, 2450. [Google Scholar] [CrossRef] [PubMed]
36. Kozak, A.; Kasperek, K.; Zięba, G.; Rozempolska-Rucińska, I. Variability of laying hen behaviour depending on the breed. Asian-Australas. J. Anim. Sci. 2019, 32, 1062–1068. [Google Scholar] [CrossRef] [PubMed]
37. Calik, J.; Obrzut, J. Influence of genotype on productivity and egg quality of three hen strains included in a Biodiversity Program. Animals 2023, 13, 1848. [Google Scholar] [CrossRef] [PubMed]
38. Pusch, E.A.; Bentz, A.B.; Becker, D.J.; Navara, K.J. Behavioral phenotype predicts physiological responses to chronic stress in proactive and reactive birds. Gen. Comp. Endocrinol. 2018, 255, 71–77. [Google Scholar] [CrossRef] [PubMed]
39. Krawczyk, J.; Calik, J. Comparison of performance in five generations of laying hens from Polish conservation flocks. Rocz. Nauk. Zootech. 2010, 37, 41–54. (In Polish) [Google Scholar]
40. Puchała, M.; Krawczyk, J.; Calik, J. Influence of origin of laying hens on the quality of their carcasses and meat after the first. laying period. Ann. Anim. Sci. 2014, 3, 685–696. [Google Scholar] [CrossRef]
41. Puchała, M.; Krawczyk, J.; Sokołowicz, Z.; Utnik-Bana’s, K. Effect of breed and production system on physicochemical characteristics of meat from multipurpose hens. Ann. Anim. Sci. 2015, 15, 247–261. [Google Scholar] [CrossRef]
42. Lewko, L.; Krawczyk, J.; Calik, J. Effect of genotype and some shell quality traits on lysozyme content and activity in the albumen of eggs from hens under the biodiversity conservation program. Poult. Sci. 2021, 100, 100863. [Google Scholar] [CrossRef]
43. Obrzut, J.; Calik, J.; Krawczyk, J. Temporal trends in performance and hatchability traits of eight strains of hens covered by the gene pool protection programme in Poland. Ann. Anim. Sci. 2021, 21, 1347–1366. [Google Scholar] [CrossRef]
44. Gomes, A.V.S.; Quinteiro-Filho, W.M.; Ribeiro, A.; Ferraz-de-Paula, V.; Pinheiro, M.L.; Baskeville, E.; Akamine, A.T.; Astolfi-Ferreira, C.S.; Ferreira, A.J.P.; Palermo-Neto, J. Overcrowding stress decreases macrophage activity and increases Salmonella Enteritidis invasion in broiler chickens. Avian Pathol. 2014, 43, 82–90. [Google Scholar] [CrossRef] [PubMed]
45. Regulation of the Ministry of Agriculture and Rural Development of 15 February 2010 on the Requirements and Management of Farm Animal Species for Which Standards of Protection are Laid Down in European Union Regulations (Journal of Laws No. 56, Item 344 as Amended). Available online: https://isap.sejm.gov.pl/isap.nsf/DocDetails.xsp?id=wdu20100560344 (accessed on 20 August 2024).
46. Akşit, M.; Yalçin, S.; Özkan, S.; Metin, K.; Özdemir, D. Effects of temperature during rearing and crating on stress parameters and meat quality of broilers. Poult. Sci. 2006, 85, 1867–1874. [Google Scholar] [CrossRef] [PubMed]
47. Bilčik, B.; Keeling, L.J. Changes in feather condition in relation to feather pecking and aggressive behaviour in laying hens. Br. Poult. Sci. 1999, 40, 444–451. [Google Scholar] [CrossRef]
48. Uitdehaag, K.A.; Komen, H.; Rodenburg, T.B.; Kemp, B.; van Arendonk, J.A.M. The novel object test as predictor of feather damage in cage-housed Rhode Island Red and White Leghorn laying hens. Appl. Anim. Behav. Sci. 2008, 109, 292–305. [Google Scholar] [CrossRef]
49. Sun, Y.; Ellen, E.D.; van der Poel, J.J.; Parmentier, H.K.; Bijma, P. Modelling of feather pecking behavior in beak-trimmed and non-beak-trimmed crossbred laying hens: Variance component and trait-based approach. Poult. Sci. 2014, 93, 773–783. [Google Scholar] [CrossRef]
50. Nelson, J.R.; Settar, P.; Berger, E.; Wolc, A.; O’Sullivan, N.; Archer, G.S. Brown and white egg-layer strain differences in fearfulness and stress measures. Appl. Anim. Behav. Sci. 2020, 231, 105087. [Google Scholar] [CrossRef]
51. Albentosa, M.J.; Kjaer, J.B.; Nicol, C.J. Strain and age differences in behaviour, fear response and pecking tendency in laying hens. Br. Poult. Sci. 2003, 44, 333–344. [Google Scholar] [CrossRef] [PubMed]
52. Bögelein, S.; Hurtado, D.M.; Kjaer, J.B.; Grashorn, M.A.; Bennewitz, J.; Bessei, W. The phenotypic interrelationships between feather pecking, being feather pecked and fear criteria in White Leghorn lines selected for high and low severe feather pecking and their F2- crosses. Eur. Poult. Sci. 2014, 78, 1. [Google Scholar] [CrossRef]
53. Alm, M.; Wall, H.; Holm, L.; Wichman, A.; Palme, R.; Tauson, R. Welfare and performance in layers following temporary exclusion from the litter area on introduction to the layer facility. Poult. Sci. 2015, 94, 565–573. [Google Scholar] [CrossRef] [PubMed]
54. Ferrante, V.; Mugnai, C.; Ferrari, L.; Marelli, S.P.; Spagnoli, E.; Lolli, S. Stress and reactivity in three Italian chicken breeds. Ital. J. Anim. Sci. 2016, 15, 303–309. [Google Scholar] [CrossRef]
55. Rodenburg, T.B.; Blokhuis, H.J.; Koopmanschap, R.E.; Ellen, E.D.; Decuypere, E. Maternal care and selection for low mortality affect post-stress corticosterone peripheral serotoninin laying hens. Physiol. Behav. 2009, 98, 519–523. [Google Scholar] [CrossRef] [PubMed]
56. De Haas, E.N.; Bolhuis, J.E.; de Jong, I.C.; Kemp, B.; Janczak, A.M.; Rodenburg, T.B. Predicting feather damage in laying hens during the laying period. Is it the past or is it the present? Appl. Anim. Behav. Sci. 2014, 160, 75–85. [Google Scholar] [CrossRef]
57. Grams, V.; Bögelein, S.; Grashorn, M.A.; Bessei, W.; Bennewitz, J. Quantitative genetic analysis of traits related to fear and feather pecking in laying hens. Behav. Genet. 2015, 45, 228–235. [Google Scholar] [CrossRef] [PubMed]
58. Campe, A.; Hoes, C.; Koesters, S.; Froemke, C.; Bougeard, S.; Staack, M.; Bessei, W.; Manton, A.; Scholz, B.; Schrader, L.; et al. Analysis of the influences on plumage condition in laying hens: How suitable is a whole body plumage score as an outcome? Poult. Sci. 2018, 97, 358–367. [Google Scholar] [CrossRef] [PubMed]
Skomorucha I, Sosnówka-Czajka E. The Effects of Origin on the Formation of Stress Parameters and Selected Behaviour of Hens. Agriculture. 2025; 15(1):95. https://doi.org/10.3390/agriculture15010095
Перевод статьи «The Effects of Origin on the Formation of Stress Parameters and Selected Behaviour of Hens.» авторов Skomorucha I, Sosnówka-Czajka E., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
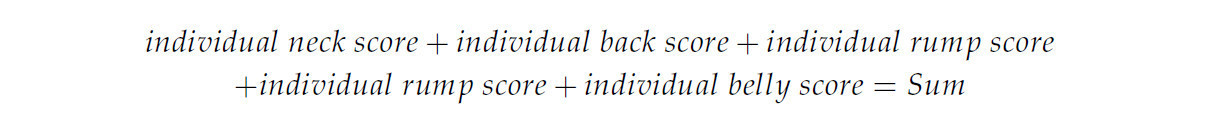
































































































Комментарии (0)