Влияние различных сахарных сиропов на развитие жирового тела у рабочих пчел (Apis mellifera macedonica)
Глобальное изменение климата, интенсивное сельское хозяйство и антропогенное загрязнение негативно сказываются на цветковых растениях и жизнеспособности пчелиных семей. В условиях пищевого стресса пчелы расходуют запасы питательных веществ своего жирового тела для поддержания жизни колонии. Критическую роль в этом играют пчеловоды, предоставляя дополнительные питательные растворы. В данном исследовании изучено влияние различных сахарных сиропов на развитие жирового тела у рабочих пчел (Apis mellifera macedonica).
Аннотация
Семьи были разделены на контрольную и пять экспериментальных групп: одну кормили сиропом 1:1 (сахар/вода), другую — сиропом 2:1 (сахар/вода), третью — инвертным сиропом (Апинверт), четвертую — кукурузным сиропом с высоким содержанием фруктозы (HFCS) (Изосвит) и пятую — сиропом 1:1 (мёд/вода). Развитие жирового тела оценивали методом тщательного диссектирования, а степени развития документировали с помощью USB-цифрового микроскопа (Bresser). Результаты свидетельствуют о значительных сезонных колебаниях в развитии жирового тела: его истощении зимой и последующем восстановлении, на которое влияет дополнительная подкормка. Апинверт и медовый сироп способствовали достижению более высоких стадий развития жирового тела, в то время как Изосвит приводил к увеличению доли пчел с пятой степенью развития, но вызывал опасения в отношении потенциальной токсичности из-за образования гидроксиметилфурфурола (ГМФ) в сиропах при неправильном хранении. На основании проведенного исследования можно заключить, что адекватная дополнительная подкормка легкоусвояемыми сахарами имеет критическое значение для стимуляции развития жирового тела, повышения выживаемости пчел в зимний период и обеспечения общего здоровья семьи. Полученные данные дают пчеловодам практические рекомендации по оптимизации стратегий кормления для поддержания устойчивых пчелиных семей.
1. Введение
Жизнь и выживание медоносных пчел ( Apis mellifera macedonica ) напрямую зависят от факторов окружающей среды, включая загрязнение и наличие достаточного количества и качества пищевых ресурсов. Для поддержания своих жизненных функций пчелам требуются углеводы, белки, липиды и вода. Естественными источниками пищи для пчел являются дикие луговые и лесные растения, а также цветущие культурные растения, такие как подсолнечник, рапс, лаванда и другие. Однако интенсивное сельское хозяйство, антропогенное загрязнение и изменение климата привели к сокращению доступности подходящей пищевой среды, что отрицательно сказывается на развитии и выживании пчелиных колоний [ 1 , 2 ]. Недостаточные запасы меда и пыльцы в пчелиных колониях способствуют зимней смертности. Исследования, такие как [ 3 ], продемонстрировали, что пищевой стресс изменяет липидный обмен веществ в жировом теле пчелы, увеличивая количество ненасыщенных триацилглицеролов и диацилглицеролов и уменьшая количество свободных жирных кислот. Одна из широко распространенных практик пчеловодства для смягчения такого стресса заключается в дополнении рациона пчел сахарными сиропами [ 4 , 5 ]. Обычно используемые растворы включают сахарозу, инвертированный сахарный сироп и кукурузный сироп с высоким содержанием фруктозы [ 6 , 7 , 8 ]. Роль добавления сахарного сиропа в поддержании и росте колонии привлекла значительный научный интерес, при этом получены неоднозначные результаты. В то время как добавление сахара предотвращает недоедание и связанные с ним риски ослабления иммунитета [ 9 ] и чувствительности к пестицидам [ 10 ], его влияние на модели потребления и развитие колонии остается различным. Например, [ 11 ] сообщили об умеренном потреблении и улучшенном развитии колонии после добавления сахарного сиропа. Тем не менее, приготовление, хранение, частота применения и дозировка сахарных сиропов имеют решающее значение для здоровья колонии. Возможные побочные эффекты на здоровье медоносных пчел образования гидроксиметилфурфурола (ГМФ) в домашнем инвертированном сахарном сиропе при высокой температуре приготовления и кислотности были исследованы [ 12 ].
Сравнительные исследования дают более глубокое понимание эффективности различных сахарных сиропов. Например, [ 13 ] обнаружили, что дополнительное питание инвертированными сахарами по сравнению с сахарозой имеет низкий потенциал для улучшения условий колонии весной и повышения продуктивности меда. Другие авторы, например, [ 14 ], изучали влияние различных температур и продолжительности хранения на физико-химические параметры различных сиропов. Интересное исследование предпочтений пчел в отношении различных углеводных продуктов в зависимости от температуры окружающей среды было представлено [ 15 ], которое продемонстрировало положительное влияние медовых леденцов и кремового меда. Сравнительный анализ крахмальных сиропов, сахарного сиропа и инвертированного сахарозного сиропа для зимнего питания выявил минимальные различия в развитии весенних колоний [ 16 , 17 ]. Однако [ 18 ] выявили более высокую распространенность Nosema в колониях, которых кормили сиропом из пшеничного крахмала, что подчеркивает важность выбора соответствующих добавок. Также были исследованы альтернативные сиропы, такие как биосахарный сироп [ 19 ], и экспериментальные корма, такие как экстракты трав и добавки животного происхождения [ 20 ]. Влияние различных кормов на эпителиальные клетки средней кишки медоносных пчел изучалось [ 21 ]. Другие авторы [ 22 ] исследовали, приводит ли кормление пчелиных семей конфетами к фальсификации мёда.
Доступность пищи напрямую влияет на физиологию медоносной пчелы, включая динамику жирового тела, которое играет ключевую роль в поддержании колонии и реагировании на стресс. Во время нехватки пищи пчелы полагаются на запасы жирового тела для выживания. Эти запасы, накопленные осенью, поддерживают метаболические потребности зимой [ 23 , 24 , 25 ]. Крайльсхайм [ 26 ] обнаружил, что молодые пчелы-кормилицы истощают свои запасы белков и липидов, хранящиеся в жировом теле, во время производства маточного молочка и кормления расплода. Когда пищи много, клетки жирового тела запасают избыточную энергию в виде жирных кислот [ 27 ]. Изменения в хранении запасов пищи в жировом теле напрямую влияют на деятельность, выполняемую пчелами.
В жировом теле пчёл происходит ряд физиологических процессов, включая синтез жиров, гликогена и белков, а также накопление и высвобождение энергии при необходимости [ 28 ]. Жировое тело также играет роль в детоксикации и служит центром метаболизма [ 29 , 30 ]. Некоторые авторы обнаружили, что оно также активно участвует в метаболических процессах других органов [ 31 , 32 , 33 , 34 ].
Дополнительное питание существенно влияет на эту динамику. Рацион с высоким содержанием сахара может повышать уровень углеводов в гемолимфе и способствовать накоплению липидов в жировой ткани [ 35 ]. Длительное кормление сахарозой или сахарным сиропом связано с изменениями в экспрессии генов, связанных с энергетическим обменом и иммунитетом [ 36 ].
Несмотря на растущую зависимость от сахарных сиропов из-за сокращения источников естественного нектара, их долгосрочное воздействие на развитие жирового тела и физиологию пчел остается недостаточно изученным.
Данное исследование восполняет эти пробелы в знаниях, изучая влияние различных типов сахарных сиропов на развитие и функционирование жирового тела у медоносных пчёл. Целью исследования является предоставление практических рекомендаций по оптимизации методов кормления пчёл в неблагоприятных условиях окружающей среды. Учитывая важнейшую роль жирового тела в иммунных реакциях, накоплении энергии и адаптации к стрессу, понимание этих эффектов крайне важно для повышения устойчивости и продуктивности колонии.
2. Материалы и методы
2.1 Место и подготовка эксперимента
Настоящее исследование проводилось в период 2023–2024 гг. на учебно-экспериментальной базе кафедры пчеловодства сельскохозяйственного факультета Фракийского университета, г. Стара-Загора, Болгария (географические координаты: 42°24′5.20″ с. ш., 25°34′21.65″ в. д.). Этот регион характеризуется умеренно-континентальным климатом, благоприятным для пчеловодства и позволяющим эффективно изучать колонии медоносных пчел в контролируемых условиях. По данным Руттнера [ 37 ], медоносная пчела, выведенная в Болгарии, относится к виду Apis mellifera macedonica .
В эксперименте участвовали 12 пчелиных семей, принадлежащих к местному подвиду медоносной пчелы ( Apis mellifera macedonica ). Эти семьи содержались в 10-рамочных ульях системы Даданта–Блатта, широко распространённой в пчеловодстве в Болгарии и других регионах с аналогичной практикой пчеловодства.
✓ Определение силы пчелиных семей
Для стандартизации условий эксперимента стандартные методы управления включали подкормку колоний весной и осенью. Перед началом экспериментальных процедур численность колоний была выровнена для обеспечения сопоставимости между группами. Для оценки численности колоний использовался визуальный метод, заключающийся в подсчете количества междоузлийных промежутков между рамками улья, занятых пчелами. Этот подход обеспечивает надежную оценку численности колонии, основанную на предположении, что каждое междоузлие в улье Дадана-Блатта вмещает приблизительно 250 г пчел, что эквивалентно примерно 2500 рабочим пчелам [ 38 ].
✓ Определение запечатанного расплода рабочих пчел
Площадь расплода каждой колонии оценивалась для определения количества запечатанного расплода рабочих пчел. Это достигалось с помощью измерительной рамки, разделенной на квадраты размером 5 × 5 см, каждый из которых покрывал площадь 25 см² . Исходя из предположения, что один квадратный сантиметр сота содержит приблизительно четыре рабочие ячейки, каждый квадрат размером 5 × 5 см² соответствует в общей сложности 100 ячейкам [ 38 , 39 ].
✓ Определение количества меда
Для расчета площади поверхности запечатанного мёда и оценки его веса над сотами помещают измерительную рамку, разделённую на квадраты размером 5 × 5 см. Каждый квадрат рамки представляет собой площадь поверхности 25 см² . Предполагается, что 1 дм² (100 см² ) сот , заполненных запечатанным мёдом с обеих сторон, содержит 0,350 кг мёда или 0,175 кг при заполнении с одной стороны [ 40 ]. После подсчёта занятых квадратов площадь поверхности запечатанного мёда рассчитывается по следующей формуле:
Определение количества пыльцы
Для оценки количества пыльцы, хранящейся в сотах, используется измерительная рамка, разделенная на квадраты размером 5 × 5 см. Каждый квадрат охватывает область, содержащую приблизительно 100 ячеек рабочих пчел. После подсчета количества квадратов, занятых пыльцой, вычисляется общее количество ячеек, заполненных пыльцой. Этот подход аналогичен методу, описанному Делаплейном и соавторами [ 38 ] для оценки запечатанного расплода, где измерительная рамка аналогичным образом используется для количественной оценки интересующей области на основе заранее определенного количества ячеек в квадрате.
Пчелиные матки в контрольной и всех экспериментальных колониях были отобраны по месту происхождения и на момент исследования достигли возраста одного года. Это обеспечило единообразие репродуктивного потенциала и генетической изменчивости между колониями, что критически важно для поддержания экспериментальной надежности и минимизации систематических ошибок.
Данная экспериментальная установка позволила провести контролируемую и стандартизированную оценку колоний медоносных пчел, предоставив надежные данные для последующего анализа.
2.2. Экспериментальная разработка и группировка пчелиных семей
Пчелиные семьи, отобранные для данного исследования, были систематически разделены на одну контрольную и пять экспериментальных групп, как описано ниже. Каждая группа состояла из двух семей, что обеспечивало возможность репликации внутри групп и статистическую достоверность последующих анализов. Схемы распределения по группам и кормления были следующими:
C—Контрольная группа (Контроль):
Колонии этой группы не получали дополнительного питания и служили исходной точкой для сравнения.
Первая экспериментальная группа: (Группа 1):
Колонии этой группы питались сахарным сиропом, приготовленным в соотношении сахара и воды 1:1.
Вторая экспериментальная группа (Группа 2):
Колонии подкармливали более концентрированным сахарным сиропом, приготовленным в соотношении сахара и воды 2:1.
Третья экспериментальная группа (Группа 3):
В рацион этой группы входил инвертный сироп, продаваемый под торговой маркой «Апиинверт». Этот сироп состоит в основном из глюкозы и фруктозы, которые легко усваиваются пчёлами.
Четвертая экспериментальная группа (группа 4):
Колонии этой группы получали глюкозо-фруктозный сироп, продающийся под торговой маркой «Isosweet». Это кукурузный сироп с высоким содержанием фруктозы (HFCS), ещё один легкоусвояемый источник углеводов для пчёл.
Пятая экспериментальная группа (Группа 5):
Эти колонии кормили медовым сиропом, приготовленным в соотношении 1:1 меда и воды, имитирующим натуральную пищевую добавку.
Каждая колония в каждой экспериментальной группе получала 2 литра соответствующего сиропа в неделю. Сироп давали в течение трёх отдельных кормлений в неделю (понедельник – 700 г, среда – 700 г, пятница – 600 г), чтобы обеспечить постоянное потребление и минимизировать вариабельность кормления. Чтобы обеспечить постоянное потребление и минимизировать вариабельность кормления, сироп давали в течение трёх отдельных кормлений в неделю. Кормление продолжалось в течение четырёх последовательных недель весной и осенью.
Данный экспериментальный дизайн позволил провести сравнительный анализ влияния различных стратегий кормления на степень развития жирового тела.
2.3. Определение степени развития жирового тела рабочих пчел.
✓ Оценка развития жирового тела у рабочих пчел
Для оценки степени развития жирового тела (DFBD) у рабочих пчел были собраны образцы от восьми до девяти ежедневно вылупляющихся нелетающих пчел из каждой колонии до и после кормления. В течение двух экспериментальных периодов — весной и осенью — было проанализировано развитие жирового тела в общей сложности у 1001 рабочей пчелы. Метод, использованный для этой оценки, основан на протоколе, описанном Маурицио [ 41 ], который специально ориентирован на молодых нелетающих пчел для точного определения развития жирового тела.
✓ Процедура отбора проб
Чтобы изолировать целевую популяцию недавно вылупившихся нелетающих пчел того же возраста после прекращения кормления сахарным сиропом, из каждого улья как контрольной, так и экспериментальной группы был выбран один сот, содержащий запечатанный расплод, близкий к вылуплению. Эти соты были помещены в изоляционные клетки, снабженные сеткой, чтобы предотвратить вылупление недавно вылупившихся пчел. Через 24 часа недавно вылупившиеся рабочие пчелы были помечены с помощью маркера для королевы пчел и возвращены в улей, из которого были взяты их соответствующие соты. Через семь дней после вылупления, чтобы собрать пчел для анализа жирового тела, помеченных пчел стряхивали с сот на бумагу, разложенную на земле перед ульем, а затем собирали в полиэтиленовый пакет со спиртом для обеспечения сохранности для последующего препарирования и анализа.
✓ Вскрытие и исследование жирового тела
Развитие жирового тела у отдельных пчёл оценивали путём тщательного препарирования. Каждую пчёлу клали на дорсальную сторону, и ножницами удаляли голову и грудь. Затем иссекали конечную конечность и делали два боковых разреза вдоль брюшка. С помощью тонкого пинцета аккуратно отделяли стерниты вместе со всеми внутренними органами брюшной полости, обнажая жировое тело, расположенное под тергитами.
Затем жировое тело промывали физиологическим раствором для удаления остатков тканей и загрязнений, обеспечивая чёткую видимость структуры. Высококачественные изображения жирового тела были получены с помощью цифрового USB-микроскопа BRESSER для документирования и дальнейшего анализа ( рис. 1 ).
✓ Методологические соображения
Описанный метод позволяет точно оценить развитие жирового тела, которое служит индикатором запаса энергии и общего физиологического состояния рабочих пчёл. Целевая группа – молодые, нелетающие пчёлы (восемь-девять суточных пчёл), что позволяет минимизировать вариабельность, обусловленную возрастными физиологическими изменениями, что обеспечивает надёжность данных.
На рисунке 1 показана степень изменения жирового тела от 1 до 5 по методологии Маурицио [ 41 ]. Были обнаружены следующие изменения:
На 1-й степени жировое тело (DFBD1) недоразвито и настолько прозрачно, что хорошо виден хитин дорсального тергита.
При 2-й степени жировая ткань (ДФБК2) однослойная, плоская. Клетки голубовато-белые, полупрозрачные, без видимых включений.
При 3-й степени (DFBD3) жировая ткань однослойная, с чёткими складками. Клетки округлые, белые, без включений.
При 4-й степени (DFBD4) жировая ткань многослойная, складчатая. Клетки белые, округлые, с хорошо заметными включениями.
При 5-й степени (DFBD5) жировая ткань многослойная, плотно складчатая. Клетки крупные, округлые, желтоватые, густо заполнены включениями.
2.4 Статистический анализ
Оценка показателей развития пчелиных семей (силы семьи, количества меда, пыльцы и запечатанного расплода) в начале эксперимента проводилась с помощью многомерного анализа с использованием постфактумного критерия Тьюки. Кроме того, для оценки ошибок дисперсии и однородности групп применялся критерий равенства Левена.
Для изучения влияния кормления пчелиных семей различными видами сиропов на развитие жирового тела рабочих пчел при весеннем и осеннем стимулирующем кормлении использовался метод «χ² - анализ» (хи-квадрат). Достоверные различия в распределении степени развития жирового тела для разных периодов рассчитывались с помощью критерия Краскела–Уоллиса. Для точного установления статистически значимых различий между группами по типу кормления были проведены дополнительные тесты Манна–Уитни. Величина влияния типа кормления на развитие жирового тела рассчитывается по следующей формуле:
Полученные данные были обработаны с использованием статистического программного обеспечения IBM SPSS Statistics 26.0 (Армонк, Нью-Йорк, США).
3. Результаты
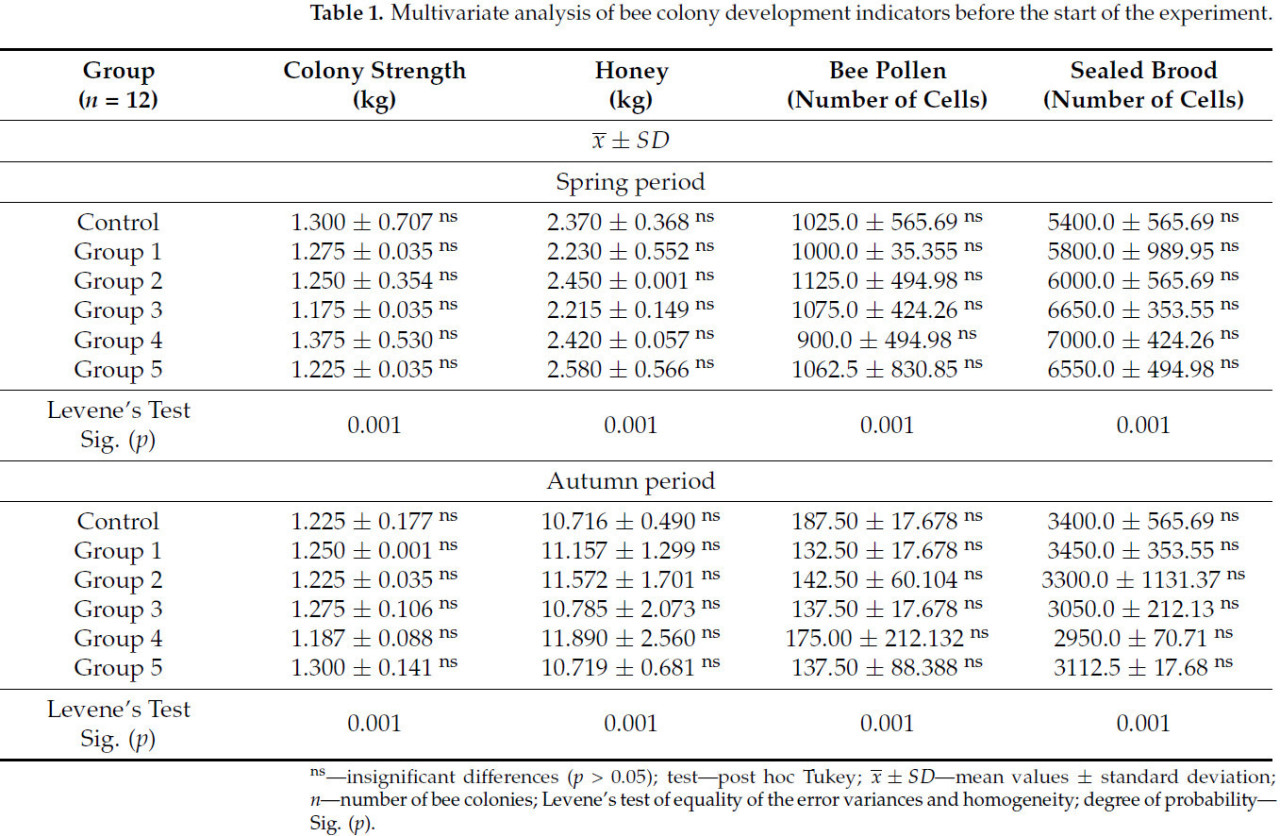
3.1 Оценка развития пчелиной семьи перед началом эксперимента
В таблице 1 представлены результаты многомерного анализа показателей развития пчелиных семей до начала эксперимента. Статистически значимых различий по всем измеряемым показателям (сила семьи, количество меда, обножки и запечатанного расплода) не выявлено ни в весенний, ни в осенний периоды. Тест Левена показал однородность данных в отдельных группах. Это свидетельствует о том, что до начала эксперимента пчелиные семьи были выровнены по всем измеряемым параметрам.
3.2. Краскела–Уоллиса для оценки значимых различий в распределении степени развития жирового тела рабочих пчел.
В таблице 2 представлены результаты теста Краскела–Уоллиса для определения достоверности различий в распределении степени развития жирового тела за исследуемые периоды. Выявлены достоверные различия в распределении степени развития жирового тела после весеннего нагула (p Asimp = 0,029), а также после осеннего нагула (p Asimp = 0,020).
3.3. Анализ хи-квадрат и тесты Манна-Уитни для оценки связи между типом кормления и стадиями развития жирового тела рабочих пчел
3.3.1 Весенний период
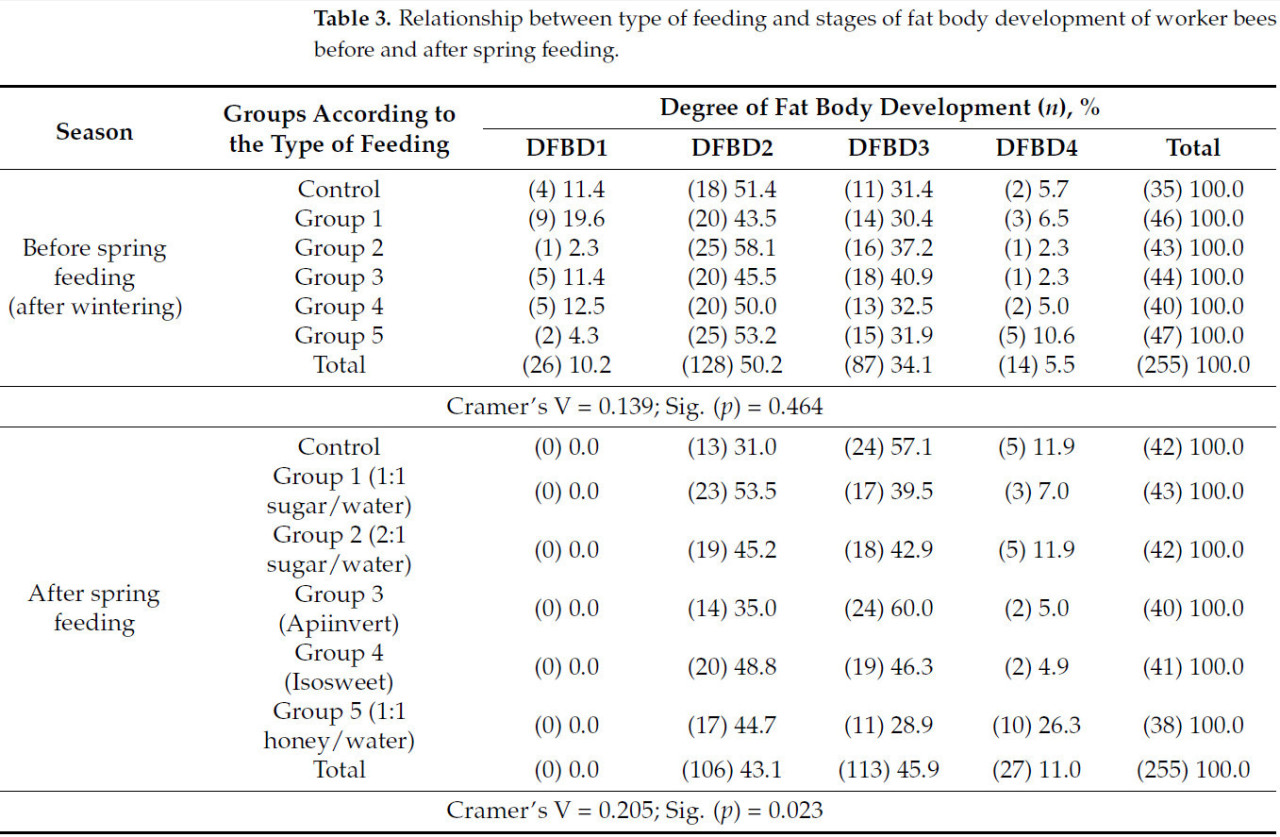
В таблице 3 представлены результаты развития жирового тела рабочих пчел перед весенней подкормкой (после зимовки) и после весенней подкормки пчелиных семей. Перед весенней подкормкой у наибольшего процента пчел наблюдается вторая стадия развития жирового тела. Этот процент варьирует от 43,5% до 58,1% в контрольной и опытной группах. Процент пчел с третьей стадией развития жирового тела ниже и варьирует от 30,4% до 40,9%. При анализе результатов сообщается об относительно небольшом проценте пчел (5,5%) с четвертой стадией развития жирового тела в исследуемых группах. Вероятной причиной этого является зимовка пчелиных семей и истощение запасов корма в жировом теле рабочих пчел. Анализ χ2 не показывает значимых различий между группами ( p = 0,464) перед весенней подкормкой. Пчелиные семьи в соответствующих группах равны по силе, что также подтверждается низким коэффициентом V Крамера (0,139). После зимовки жировое тело пчел уменьшается. Пчелы используют запасы, накопленные в жировом теле за зиму, для получения энергии и поддержания своей иммунной системы. После окончания зимы и начала нового сезона сбора нектара и пыльцы они начинают восстанавливать эти запасы. Похожих выводов придерживается Маурицио [ 24 ]. Многие исследователи разделяют мнение, что основная причина гибели пчелиных семей в зимний период — голодание пчел [ 42 , 43 ]. В этом смысле целесообразно расширить исследования, касающиеся дополнительного кормления пчелиных семей естественными и искусственными кормами в полевых экспериментах, чтобы оценить, как это влияет на зимовку пчелиных семей [ 44 ].
После весеннего кормления не было обнаружено ни одной пчелы с первой стадией развития жирового тела ( таблица 3 ). Для сравнения, перед весенним кормлением было зарегистрировано 10,2% всех исследованных пчел с этой стадией развития жирового тела. Этот факт косвенно показывает эффект дополнительного кормления. После кормления было обнаружено, что самый высокий процент в 60% пчел с третьей стадией развития жирового тела был обнаружен при кормлении пчелиных семей Апиинвертом. Для сравнения, перед весенним кормлением в этой группе процент пчел с третьей стадией развития жирового тела был ниже (40,9%). В эксперименте, проведенном с кормлением пчелиных семей сахарными растворами, Куинлан и др. [ 45 ] наблюдали схожие изменения в количестве жира и экспрессии генов среди пчел из семей, питавшихся различными углеводными диетами. По словам авторов, на уровне колонии наиболее развитые жировые тела наблюдались у пчел из колоний, питавшихся медом и инвертным сиропом, а наименее развитые жировые тела были зарегистрированы у пчел из колоний, питавшихся кукурузным сиропом с высоким содержанием фруктозы (HFCS).
Процент пчел, показывающих четвертую стадию развития жирового тела по сравнению с общим числом проанализированных пчел, составил 11% ( таблица 3 ). По этому показателю самая высокая эффективность кормления была обнаружена в группе, получавшей медовый раствор. У 26,3% пчел из этой группы наблюдалась четвертая стадия развития жирового тела. Этот результат снова совпадает с полученным [ 45 ]. В группе пчел, получавших Isosweet, было обнаружено, что в колониях, получавших этот сироп, процент пчел с развитием жирового тела на второй и третьей стадиях составил 48,8% и 46,3% соответственно. Эти значения выше у пчел второй экспериментальной группы, получавшей сахар/воду в соотношении 2:1. Из Таблицы 3 видно , что процент пчел, которых кормили Изосвитом, во второй и третьей группах развития жирового тела (48,8% и 46,3%) выше, чем в пчелиных семьях, которых кормили медовым сиропом (44,7% и 28,9%) соответственно. При кормлении Изосвитом было обнаружено, что процент пчел с четвертой степенью развития жирового тела составил всего 4,9%. Эффект применения этого типа сиропа, вероятно, проявляется в более низких степенях развития жирового тела. Коэффициент V Крамера (0,205) подтверждает эти результаты, показывая, что влияние типа кормления на развитие жирового тела рабочих пчел является умеренным и статистически значимым ( p = 0,023).
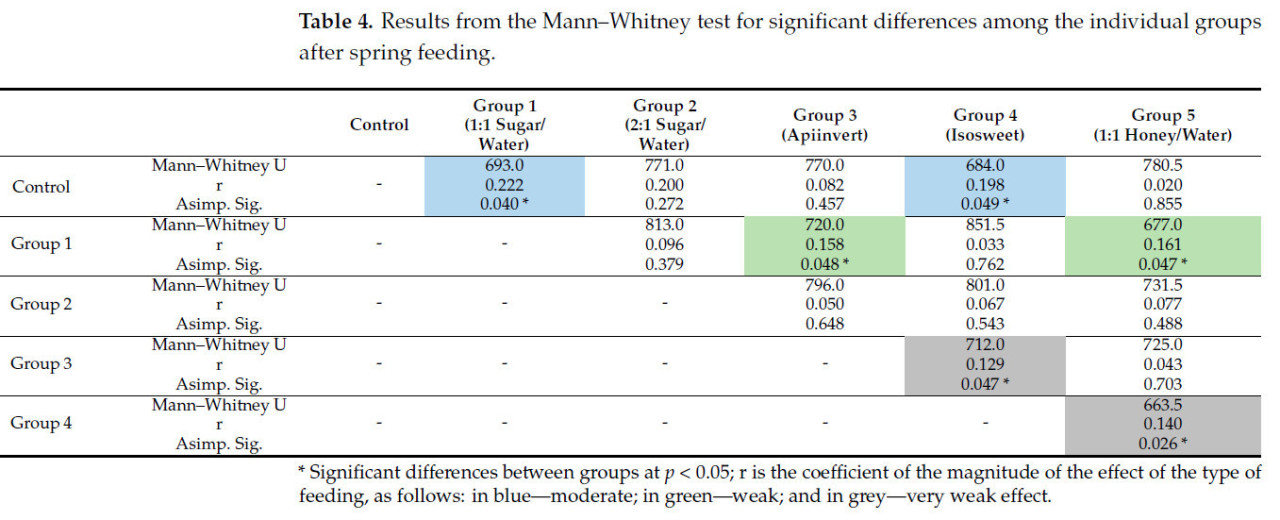
Значимые различия в распределении отдельных групп, которых кормили разными типами сиропов в весенний период, представлены в Таблице 4. После весеннего кормления наблюдаются умеренно значимые различия (r = 0,222 и 0,198) между контрольной группой и рабочими пчелами, которых кормили сиропом из сахара и воды 1:1 или Isosweet соответственно. Семьи пчел, которых кормили сиропом из сахара и воды 1:1, слабо отличались (r = 0,158 и 0,161) от тех, которые получали Апиинверт и раствор меда соответственно. Очень слабые значимые различия были получены между колониями, которых кормили Апиинвертом и Isosweet (0,129), и Isosweet и медовым сиропом (0,140) соответственно.
3.3.2 Осенний период
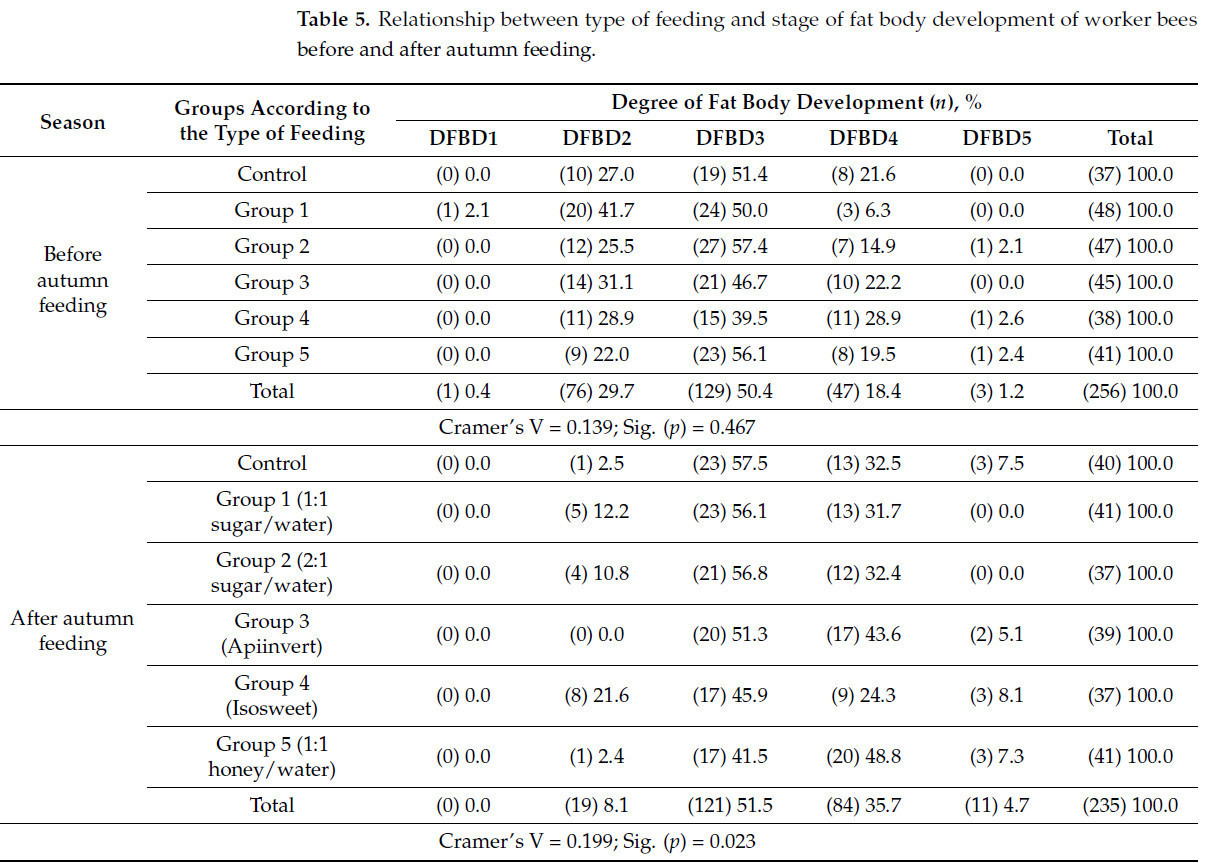
Результаты степени развития жирового тела рабочих пчел до и после осенней подкормки представлены в таблице 5. Видно, что в пчелиных семьях из группы, получавшей корм 1:1 сахаром/водой, 2,1% рабочих пчел находились в первой стадии развития жирового тела. В контрольной и других опытных группах рабочих пчел с этой стадией развития жирового тела не было. Вероятной причиной этого является то, что в осенний период пчелиные семьи выращивают пчел с хорошо развитым жировым телом на более высоких стадиях, что связано с успешной зимовкой. В этом смысле в контрольной и опытных группах процент рабочих пчел с третьей стадией развития жирового тела самый высокий и колеблется в диапазоне от 39,5% до 57,4%. Также наблюдается определенный процент пчел с пятой стадией развития, но он относительно невелик - от 2,1% до 2,6%. Аналогично результатам, представленным в таблице 3 , перед осенним нагулом значимых различий между группами не наблюдается ( p = 0,467), что также подтверждается низким коэффициентом V Крамера (0,139).
После осеннего кормления ( таблица 5 ) не было рабочих пчел с первой стадией развития жирового тела. Самый высокий процент рабочих пчел (21,6%) со второй стадией развития наблюдается в группе, которую кормили Isosweet. Разница по сравнению с контрольной группой составляет порядка 19,1%. В экспериментальных группах, которых кормили 1:1 сахаром/водой и 2:1 сахаром/водой, наблюдалось 12,2% и 10,8% рабочих пчел со второй стадией развития жирового тела, соответственно, по сравнению с 2,5% в контрольной группе. Генч и др. [ 46 ] рекомендуют использовать сахарный сироп 2:1 сахар/вода для зимнего кормления пчелиных семей. В группе, которую кормили Апиинвертом, нет пчел со второй стадией развития жирового тела. Что касается третьей стадии развития жирового тела, процент пчел в экспериментальных группах ниже по сравнению с процентом в контрольной группе. На четвертой стадии развития жирового тела значительно более высокий процент пчел был обнаружен в группах, питавшихся 1:1 медом/водой и Апиинвертом, соответственно - 48,8% и 43,6% по сравнению с контролем 32,5%. Указанные сахарные растворы отличаются содержанием легкоусвояемых для пчел сахаров, что, вероятно, является причиной положительного влияния на развитие их жирового тела. По данным [ 47 ], подкормка пчел, остающихся в ульях на зимовку, инвертированными сиропами предотвращает истощение их организма в связи с тем, что в этих сиропах сахароза предварительно расщепляется на глюкозу и фруктозу в процессе их производства. Подкормка пчелиных семей сиропами, которые содержат половину фруктозы и глюкозы, является лучшим способом подкормки пчел [ 5 ].
В контрольной группе у 7,5% исследованных пчел была обнаружена пятая стадия развития жирового тела. Более высокий процент наблюдался только у пчел из группы, получавшей Isosweet (8,1%). Ганновер и др. [ 48 ] в своем исследовании использовали высокое содержание фруктозы и глюкозы в кукурузном сиропе с высоким содержанием фруктозы: 55% и 42% соответственно. Этот высокий уровень легкоусвояемых для пчел сахаров, вероятно, является предпосылкой для развития пятой стадии развития жирового тела у пчел из колоний, получавших Isosweet, что является торговым названием HFCS. Следует иметь в виду, что по мнению некоторых авторов, при неправильном хранении HFCS может оказывать токсическое действие на пчел из-за образования гидроксиметилфурфурола (ГМФ) [ 49 ]. Это токсичное для пчел соединение (ГМФ) может также образовываться при несоблюдении правильной технологии производства инвертных сахарных сиропов [ 12 ].
В группах, получавших корм с использованием смеси сахара и воды 1:1 и смеси сахара и воды 2:1, не было рабочих пчел с пятой стадией развития жирового тела, а в группах, получавших Апиинверт и смесь меда и воды 1:1, процент пчел был ниже, чем в контрольной группе. Аналогично результатам, представленным в Таблице 5 , коэффициент V Крамера (0,199) показывает, что влияние типа кормления на развитие жирового тела рабочих пчел слабое, но статистически значимое ( p = 0,023). Около 20% дисперсии в развитии жирового тела рабочих пчел можно объяснить влиянием типа кормления.
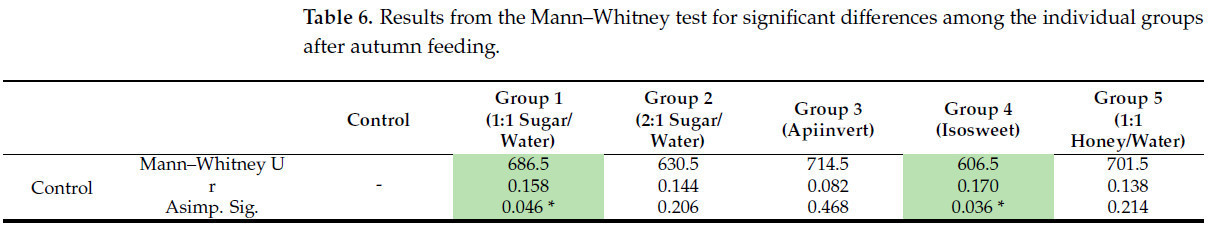
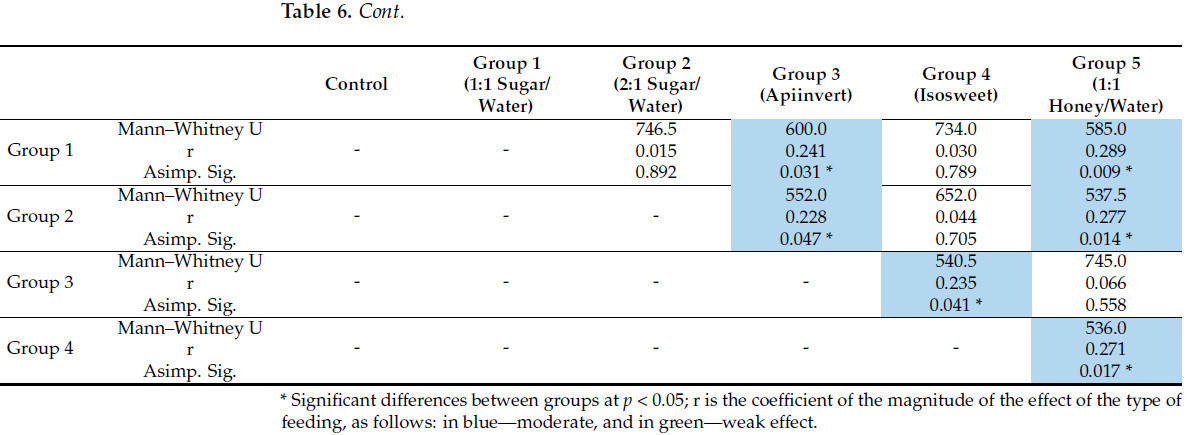
Значимые различия в распределении отдельных групп, которых кормили различными типами сиропов в осенний период, представлены в Таблице 6. После осеннего кормления наблюдаются слабые значимые различия (r = 0,158 и 0,170) между контрольной группой и пчелиными колониями, которых кормили сиропом сахара/воды 1:1 или Isosweet соответственно. Пчелиные семьи, которых кормили сиропом сахара/воды 1:1, умеренно отличаются (r = 0,241 и 0,289) от тех, которые получали Апиинверт и раствор меда. Пчелиные семьи, которых кормили сиропом сахара/воды 2:1, также умеренно отличаются (r = 0,228 и 0,277) от тех, которые получали Апиинверт и раствор меда. Умеренные значимые различия также были получены между колониями, которых кормили Апиинвертом и Isosweet (0,235), и Isosweet и медовым сиропом (0,271) соответственно.
4. Обсуждения
Использование сахарных растворов в практике пчеловодства широко применяется при подкормке пчелиных семей. Мнения ученых о пользе и вреде использования этих растворов противоречивы. По данным [ 6 ], добавление в пищу пчел растворов, содержащих сахарозу, глюкозу и фруктозу, приводит к продлению их жизни. Следует учитывать, что для расщепления сахарозы на глюкозу и фруктозу им необходимо вырабатывать значительное количество ферментов, истощая резервы собственного организма [ 50 ]. Этот факт нельзя упускать из виду, особенно при применении стимулирующей подкормки пчелиных семей в осенний период. Для успешной зимовки каждая семья должна быть заселена молодыми, неистощенными пчелами с хорошо развитым жировым телом. Установлено, что у старых рабочих пчел количество жировых запасов меньше, чем у молодых пчел [ 51 ]. В нашем эксперименте использовались молодые нелетающие рабочие пчелы, и на основании полученных результатов было обнаружено относительно большое количество пчел с третьей, четвертой и пятой стадиями развития жирового тела. Некоторые авторы сдержанно относятся к использованию коммерческих сахаров в пчеловодстве [ 52 ]. Для того чтобы установить влияние сахаров, используемых при кормлении пчелиных семей, был проведен ряд современных научных исследований [ 53 ]. Некоторые исследователи сообщают о гораздо большем количестве преимуществ при кормлении пчелиных семей медовыми растворами по сравнению с эффектом применения растворов сахарозы, глюкозы, фруктозы и HFCS [ 36 ]. В нашем исследовании аналогичная тенденция наблюдалась в отношении преимуществ медового сиропа перед другими сиропами. После весеннего и осеннего кормления пчелиных семей в группе, питавшейся медовым сиропом, был обнаружен относительно высокий процент пчел с четвертой (26,3% весной) и пятой (7,3% осенью) стадиями развития жирового тела. Вероятно, это связано со многими другими незаменимыми ингредиентами, содержащимися в меде, помимо сахаров. Основываясь на полученных нами результатах, нельзя не отметить тот факт, что после осенней подкормки наибольший процент пчёл с пятой стадией развития жирового тела был выявлен в группе, получавшей Изосвит (8,1%). В доступной научной литературе не обнаружено подобных результатов другими учёными, проводившими эксперименты по подкормке пчелиных семей КСВСФ. Эффект от применения этого сиропа в осенний период, вероятно, проявляется при наличии множества дополнительных факторов окружающей среды, таких как наличие пыльцы и некоторые климатические особенности. Необходимы более углублённые исследования по применению КСВСФ.
Подводя итог, можно сказать, что использование коммерческих сахаров для кормления пчелиных семей имеет как преимущества, так и недостатки. Эти сахара дешевле натурального корма и легкодоступны, однако они не могут служить полноценной заменой мёда. Их применение особенно целесообразно для стимуляции питания пчелиных семей весной и осенью, когда усиление яйцекладки маткой для увеличения численности пчелиных семей имеет решающее значение. Тем не менее, по-прежнему важно поддерживать запас мёда в гнёздах, а также обеспечивать постоянный приток нектара и пыльцы из окружающей среды в ульи.
5. Ограничения исследования
Это исследование дает ценную информацию о влиянии различных сахарных сиропов на развитие жирового тела у рабочих пчел вида Apis mellifera macedonica . Однако следует отметить несколько ограничений. Во-первых, эксперименты проводились в контролируемых условиях, которые могут не в полной мере отражать сложность естественной среды кормодобывания. Такие экологические переменные, как разнообразие флоры, климат и методы управления ульем, не учитывались, что могло повлиять на применимость результатов в полевых условиях. Во-вторых, исследование было сосредоточено исключительно на физиологическом развитии жирового тела и не оценивало потенциальное долгосрочное воздействие на здоровье или продуктивность колонии. Наконец, хотя мы использовали репрезентативный размер выборки, область применения была ограничена одним подвидом медоносной пчелы, и результаты не могут быть обобщены на другие подвиды или географические регионы.
6. Выводы
Данное исследование подчеркивает важность сезонных стратегий кормления для поддержки развития жирового тела рабочих пчел, критически важного фактора для выживания и здоровья колонии. Результаты показали, что наиболее положительное влияние на развитие жирового тела оказали Апиинверт и растворы меда и воды, в то время как при использовании Изосвита следует проявлять осторожность из-за потенциальных рисков, связанных с неправильным хранением сиропов. Наблюдаемое после зимовки истощение жировых запасов у рабочих пчел подчеркивает необходимость применения специальных стратегий дополнительного питания как весной, так и осенью для содействия восстановлению и готовности к сезонным нагрузкам.
Результаты показывают, что выбор режима кормления существенно влияет на физиологическое состояние рабочих пчёл, подчёркивая важность обеспечения их легкоусвояемыми сахарами для поддержания здоровья пчёл, повышения устойчивости колонии и снижения стрессовых факторов окружающей среды. Пчеловоды могут использовать эти данные для оптимизации методов кормления, повышения численности колоний и повышения их выживаемости в зимнее время.
Хотя данное исследование предоставляет надежные данные о влиянии различных сахарных сиропов на развитие жирового тела, важно отметить, что другие потенциальные факторы, такие как риск загрязнения такими веществами, как гидроксиметилфурфурол (ГМФ), в данном исследовании не учитывались. Дальнейшие исследования должны быть сосредоточены на долгосрочном влиянии различных стратегий кормления на продуктивность колоний и устойчивость к неблагоприятным факторам окружающей среды, а также на прямой оценке рисков, связанных с загрязнением сиропом, для разработки более безопасных протоколов кормления.
Ссылки
1. Lin, Z.; Shen, S.; Wang, K.; Ji, T. Biotic and abiotic stresses on honeybee health. Integr. Zool. 2024, 19, 442–457. [Google Scholar] [CrossRef]
2. El-Seedi, H.R.; Ahmed, H.R.; El-Wahed, A.A.A.; Saeed, A.; Algethami, A.F.; Attia, N.F.; Guo, Z.; Musharraf, S.G.; Khatib, A.; Alsharif, S.M.; et al. Bee Stressors from an Immunological Perspective and Strategies to Improve Bee Health. Vet. Sci. 2022, 9, 199. [Google Scholar] [CrossRef]
3. Castaños, C.E.; Boyce, M.C.; Bates, T.; Millar, A.H.; Flematti, G.; Lawler, N.G.; Grassl, J. Lipidomic features of honey bee and colony health during limited supplementary feeding. Insect Mol. Biol. 2023, 32, 658–675. [Google Scholar] [CrossRef] [PubMed]
4. Johansson, T.S.K.; Johansson, M.P. Feeding sugar to bees. 1. Feeders and syrup feeding. Bee World 1976, 57, 137–143. [Google Scholar] [CrossRef]
5. Paray, B.A.; Kumari, I.; Hajam, Y.A.; Sharma, B.; Kumar, R.; Albeshr, M.F.; Farah, M.A.; Khan, J.M. Honeybee nutrition and pollen substitutes: A review. Saudi J. Biol. Sci. 2021, 28, 1167–1176. [Google Scholar] [CrossRef]
6. Barker, R.J.; Lehner, Y. Laboratory comparison of high fructose corn syrup, grape syrup, honey, and sucrose syrup as maintenance food for caged honey bees. Apidologie 1978, 9, 111–116. [Google Scholar] [CrossRef]
7. Severson, D.; Erickson, E. Honey bee (Hymenoptera: Apidae) colony performance in relation to supplemental carbohydrates. J. Econ. Entomol. 1984, 77, 1473–1478. [Google Scholar] [CrossRef]
8. Graham, J.M. The Hive and the Honey Bee; Dadant & Sons: Hamilton, IL, USA, 1992. [Google Scholar]
9. Alaux, C.; Brunet, J.-L.; Dussaubat, C.; Mondet, F.; Tchamitchan, S.; Cousin, M.; Brillard, J.; Baldy, A.; Belzunces, L.P.; Le Conte, Y. Interactions between Nosema microspores and a neonicotinoid weaken honeybees (Apis mellifera). Environ. Microbiol. 2010, 12, 774–782. [Google Scholar] [CrossRef] [PubMed]
10. Wahl, O.; Ulm, K. Influence of pollen feeding and physiological condition on pesticide sensitivity of the honey bee Apis mellifera carnica. Oecologia 1983, 59, 106–128. [Google Scholar] [CrossRef] [PubMed]
11. Oliveira, G.P.; Kadri, S.M.; Benaglia, B.E.; Ribolla, P.M.; Orsi, R.O. Different energetic diets affect the maintenance of Apis mellifera L. colonies during off-season. bioRxiv 2019. [Google Scholar] [CrossRef]
12. Frizzera, D.; Del Fabbro, S.; Ortis, G.; Zanni, V.; Bortolomeazzi, R.; Nazzi, F.; Annoscia, D. Possible side effects of sugar supplementary nutrition on honey bee health. Apidologie 2020, 51, 594–608. [Google Scholar] [CrossRef]
13. Přidal, A.; Musila, J.; Svoboda, J. Condition and Honey Productivity of Honeybee Colonies Depending on Type of Supplemental Feed for Overwintering. Animals 2023, 13, 323. [Google Scholar] [CrossRef] [PubMed]
14. Szczęsna, T.; Waś, E.; Semkiw, P.; Skubida, P.; Jaśkiewicz, K.; Witek, M. Changes of Physicochemical Properties of Starch Syrups Recommended for Winter Feeding of Honeybees during Storage. Agriculture 2021, 11, 374. [Google Scholar] [CrossRef]
15. Abou-Shaara, H.F. Effects of various sugar feeding choices on survival and tolerance of honey bee workers to low temperatures. J. Entomol. Acarol. Res. 2017, 49, e6200. [Google Scholar] [CrossRef][Green Version]
16. Semkiw, P.; Skubida, P. Suitability of starch syrups for winter feeding of honeybee colonies. J. Apic. Sci. 2016, 60, 141–152. [Google Scholar] [CrossRef]
17. Ruiz-Matute, A.I.; Weiss, M.; Sammataro, D.; Finely, J.; Sanz, M.L. Carbohydrate composition of high-fructose corn syrups (HFCS) used for bee feeding: Effect on honey composition. J. Agric. Food Chem. 2010, 58, 7317–7322. [Google Scholar] [CrossRef]
18. Papežíková, I.; Palíková, M.; Syrová, E.; Zachová, A.; Somerlíková, K.; Kováčová, V.; Pecková, L. Effect of Feeding Honey Bee (Apis mellifera Hymenoptera: Apidae) Colonies with Honey, Sugar Solution, Inverted Sugar, and Wheat Starch Syrup on Nosematosis Prevalence and Intensity. J. Econ. Entomol. 2020, 113, 26–33. [Google Scholar] [CrossRef] [PubMed]
19. Hasan, A.; Qazi, I.I.; Tabssum, F.; Hussain, A. Development, gut health, and longevity of European bee on the provision of biosugar syrup. Biocatal. Agric. Biotechnol. 2023, 47, 102532. [Google Scholar] [CrossRef]
20. Eshbah, H.M.; Mohamed, A.A.; Hassan, A.R.; Mahmoud, M.E.; Shaban, M.M. Efficiency of feeding honey bee colonies, Apis mellifera L., with mixture of natural products and sugar syrup on brood and adult population. Sci Agric. 2018, 21, 14–18. [Google Scholar] [CrossRef]
21. Mirjanic, G.; Gajger, I.T.; Mladenovic, M.; Kozaric, Z. Impact of different feed on intestine health of honey bees. In Proceedings of the XXXXIII International Apicultural Congress, Kyiv, Ukraine, 29 September–4 October 2013; p. 113. [Google Scholar]
22. Kandolf Borovšak, A.; Ogrinc, N.; Lilek, N.; Korošec, M. Feeding honey-bee colonies (Apis mellifera carnica Poll.) and detection of honey adulteration. Acta Aliment. 2016, 46, 127–136. [Google Scholar] [CrossRef]
23. Warner, M.R.; Qiu, L.; Holmes, M.J.; Mikheyev, A.S.; Linksvayer, T.A. Convergent eusocial evolution is based on a shared reproductive groundplan plus lineage-specific plastic genes. Nat. Commun. 2019, 10, 2651. [Google Scholar] [CrossRef] [PubMed]
24. Maurizio, A. Fermentwirkung während der Ueberwinterung bei Bienen der Liguslica-Rasse. Insectes Sociaux 1961, 8, 125–175. [Google Scholar] [CrossRef]
25. Toth, A.L.; Robinson, G.E. Worker nutrition and division of labour in honeybees. Anim. Behav. 2005, 69, 427–435. [Google Scholar] [CrossRef]
26. Crailsheim, K. The flow of jelly within a honeybee colony. J. Comp. Physiol. 1992, 162, 681–689. [Google Scholar] [CrossRef]
27. Renne, M.F.; Hariri, H. Lipid Droplet-Organelle Contact Sites as Hubs for Fatty Acid Metabolism, Trafficking, and Metabolic Channeling. Front. Cell Dev. Biol. 2021, 9, 726261. [Google Scholar] [CrossRef]
28. Arrese, E.L.; Soulages, J.L. Insect fat body: Energy, metabolism, and regulation. Annu. Rev. Entomol. 2010, 55, 207–225. [Google Scholar] [CrossRef]
29. Skowronek, P.; Wójcik, Ł.; Strachecka, A. Fat Body—Multifunctional Insect Tissue. Insects 2021, 12, 547. [Google Scholar] [CrossRef] [PubMed]
30. Strachecka, A.; Olszewski, K.; Kuszewska, K.; Chobotow, J.; Wójcik, Ł.; Paleolog, J.; Woyciechowski, M. Segmentation of the subcuticular fat body in Apis mellifera females with different reproductive potentials. Sci. Rep. 2021, 11, 13887. [Google Scholar] [CrossRef] [PubMed]
31. Roma, G.C.; Bueno, O.C.; Camargo-Mathias, M.I. Morpho-physiological analysis of the insect fat body: A review. Micron 2010, 41, 395–401. [Google Scholar] [CrossRef] [PubMed]
32. Hoshizaki, D.K. Chapter 6. Fat body. In The Insects: Structure and Function; Simpson, S.J., Douglas, A.E., Eds.; Cambridge University Press: Cambridge, UK, 2013; pp. 132–146. [Google Scholar]
33. Aljedani, D.M. Comparing the histological structure of the fat body and malpighian tubules in different phases of honeybees Apis mellifera jemenatica (Hymenoptera: Apidae). J. Entomol. 2018, 15, 114–124. [Google Scholar] [CrossRef]
34. Negroni, M.A.; LeBoeuf, A.C. Metabolic division of labor in social insects. Curr. Opin. Insect Sci. 2023, 59, 101085. [Google Scholar] [CrossRef] [PubMed]
35. Baenas, N.; Wagner, A.E. Drosophila melanogaster as a Model Organism for Obesity and Type-2 Diabetes Mellitus by Applying High-Sugar and High-Fat Diets. Biomolecules 2022, 12, 307. [Google Scholar] [CrossRef]
36. Wheeler, M.M.; Robinson, G.E. Diet-dependent gene expression in honey bees: Honey vs. sucrose or high fructose corn syrup. Sci. Rep. 2014, 4, 5726. [Google Scholar] [CrossRef]
37. Ruttner, F. Biogeography and Taxonomy of Honey Bees; Springer: Berlin/Heidelberg, Germany, 1988; pp. 120–161. [Google Scholar]
38. Delaplane, K.S.; Van der Steen, J.; Guzman, E. Standard methods for estimating strength parameters of Apis mellifera colonies. J. Apic. Res. 2013, 52, 1–12. [Google Scholar] [CrossRef]
39. Lazarov, S.; Dineva, G. An innovative method for determining the area of the capped brood in bee colonies. J. Hyg. Eng. Des. 2022, 39, 236–241. [Google Scholar]
40. Lazarov, S.; Dineva, G. Determining the amount of capped honey in honeycombs with AutoCAD program. Bulg. J. Anim. Husb. 2022, 1, 23–31. [Google Scholar]
41. Maurizio, A. Pollenernarung und Lebensvorgange bei der Honigbiene (Apis mellifica L.). Landwirtschaftliche jahrbuch Schweiz 1954, 68, 115–182. [Google Scholar]
42. Brodschneider, R.; Moosbeckhofer, R.; Crailsheim, K. Surveys as a tool to record winter losses of honey bee colonies: A two year case study in Austria and South Tyrol. J. Apic. Res. 2010, 49, 23–30. [Google Scholar] [CrossRef]
43. Bruckner, S.; Wilson, M.; Aurell, D.; Rennich, K.; Engelsdorp, D.; Steinhauer, N.; Williams, G.R. A national survey of managed honey bee colony losses in the USA: Results from the Bee Informed Partnership for 2017–18, 2018–19, and 2019–20. J. Apic. Res. 2023, 62, 429–443. [Google Scholar] [CrossRef]
44. Gregorc, A.; Sampson, B.; Knight, P.R.; Adamczyk, J. Diet quality affects honey bee (Hymenoptera: Apidae) mortality under laboratory conditions. J. Apic. Res. 2019, 58, 492–493. [Google Scholar] [CrossRef]
45. Quinlan, G.; Döke, M.; Ortiz-Alvarado, Y.; Rodriguez-Gomez, N.; Koru, Y.; Underwood, R. Carbohydrate nutrition associated with health of overwintering honey bees. J. Insect Sci. 2023, 23. [Google Scholar] [CrossRef]
46. Genç, F.; Aksoy, A. Some of the correlations between the colony development and honey production on the honeybee (Apis mellifera L.) colonies. Apiacta 1993, 28, 33–41. [Google Scholar]
47. Ceksteryte, V.; Racys, J. The quality of syrups used for bee feeding before winter and their suitability for bee wintering. J. Apic. Sci. 2006, 50, 5–14. [Google Scholar]
48. Hanover, L.M.; White, J.S. Manufacturing, composition, and applications of fructose. Am. J. Clin. Nutr. 1993, 58 (Suppl. S5), 724S–732S. [Google Scholar] [CrossRef] [PubMed]
49. LeBlanc, B.W.; Eggleston, G.; Sammataro, D.; Cornett, C.; Dufault, R.; Deeby, T.; St. Cyr, E. Formation of hydroxymethylfurfural in domestic high-fructose corn syrup and its toxicity to the honey bee (Apis mellifera). J. Agric. Food. Chem. 2009, 57, 7369–7376. [Google Scholar] [CrossRef] [PubMed]
50. Simcock, N.K.; Gray, H.; Bouchebti, S.; Wright, G. Appetitive olfactory learning and memory in the honeybee depend on sugar reward identity. J. Insect Physiol. 2018, 106, 71–77. [Google Scholar] [CrossRef] [PubMed]
51. Ament, S.A.; Chan, Q.W.; Wheeler, M.M.; Nixon, S.E.; Johnson, S.P.; Rodriguez-Zas, S.L.; Robinson, G.E. Mechanisms of stable lipid loss in a social insect. J. Exp. Biol. 2011, 214, 3808–3821. [Google Scholar] [CrossRef]
52. Ross, A.P.; Bartness, T.J.; Mielke, J.G.; Parent, M.B. A high fructose diet impairs spatial memory in male rats. Neurobiol. Learn. Mem. 2009, 92, 410–416. [Google Scholar] [CrossRef]
53. Tawfik Amer, I.; Ahmed Zeinab, H.; Abdel-Rahman, M.F.; Moustafa, A.M. Influence of winter feeding on colony development and the antioxidant system of the honey bee. Apis mellifera. J. Apic. Res. 2020, 59, 752–763. [Google Scholar] [CrossRef]
Lazarov SB, Veleva PM, Atanasov AZ, Hristakov IS, Puškadija Z. Impact of Different Sugar Syrups on the Development of the Fat Body in Worker Bees (Apis mellifera macedonica).
Перевод статьи «Impact of Different Sugar Syrups on the Development of the Fat Body in Worker Bees (Apis mellifera macedonica)» авторов Lazarov SB, Veleva PM, Atanasov AZ, Hristakov IS, Puškadija Z., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
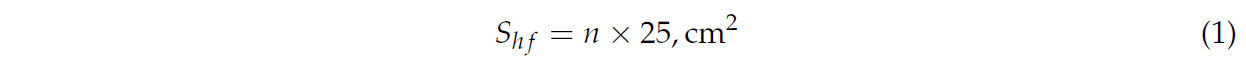
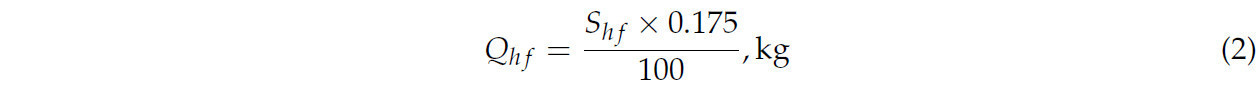

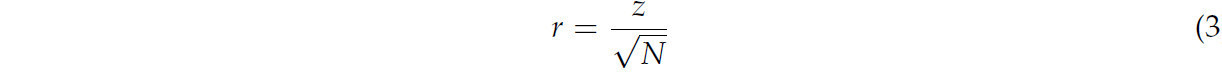































































































Комментарии (0)