Выделение и характеристика физико-химических свойств пивной дробины
Значительные объемы пивной дробины не находят полного применения даже в качестве корма для скота. Эти исходные материалы могут быть использованы для производства высокофункциональных биоматериалов, углеродистых материалов и добавок.
Аннотация
В данном исследовании были выделены и охарактеризованы четыре основные фракции: Гемицеллюлоза А, Гемицеллюлоза Б, целлюлозо-обогащенная фракция (CRF) и олигосахариды. В целом, из экстрагированной гексаном пивной дробины было получено 21,4% Гемицеллюлозы А, 18,5% Гемицеллюлозы Б, 17,4% целлюлозо-обогащенной фракции и 5,5% чистых олигосахаридов. Детальный физико-химический анализ каждой фракции показал, что эти фракции могут быть использованы для производства полезных продуктов, таких как эмульгаторы, углеродистые материалы, модифицированные целлюлозные волокна, добавки, а также азотированного угля.
Анализ компонентного состава показал, что Гемицеллюлоза А содержит наибольшее количество связанного углерода (20 мас.%), за ней следуют гексан-экстрагированный материал (17,1 мас.%), целлюлозо-обогащенная фракция (ЦОФ) (14,6 мас.%) и Гемицеллюлоза Б (14,5 мас.%). Стандартный технический анализ показал, что Гемицеллюлоза А обладает самым высоким содержанием белка (66 мас.%). Это позволяет использовать её в качестве возобновляемого твёрдого азотсодержащего прекурсора (донора азота) в процессе термохимической конверсии.
Анализ сахарного состава показал, что пивная зерновая дробина имеет типичную арабиноксилановую структуру с высоким содержанием арабинозы и ксилозы. Она также содержит высокий процент глюкозы, который может происходить из остаточного β-глюкана, присутствующего в дробине. ИК-Фурье (FTIR) анализ выявил структурные изменения в каждой из выделенных фракций.
Таким образом, пивная зерновая дробина и выделенные из неё фракции демонстрируют значительный потенциал для переработки отходов с целью получения ценных продуктов, внося существенный вклад в полную утилизацию продуктов пивоваренной промышленности.
1. Введение
Пиво является самым популярным алкогольным напитком в мире и входит в тройку наиболее потребляемых напитков в целом [1,2,3,4]. Как правило, для производства ферментированных напитков и пива используются солодовые зерна, вода, дрожжи и хмель [1,2,5]. Обычно зерна ячменя в пивоваренном процессе подвергаются ряду этапов, таких как солодоращение и затирание, перед тем как их подвергнут брожению в спирт. Последний процесс включает ферментативный гидролиз солодовых зерен, при котором длинные цепи углеводных молекул расщепляются на более простые сахара, способные к брожению [5,6,7,8]. Дрожжи легче всего потребляют простые сахара, такие как мальтоза и глюкоза, для брожения и производства спирта в готовом пиве. Процесс брожения produces сусло — сладкую жидкость, которую сливают через нерасщепленные зерна солодового ячменя, и затем используют в качестве питательной среды для брожения при производстве пива. Пивная зерновая дробина — это твердый остаток, остающийся после удаления сусла. Это наиболее abundant побочный твердый продукт пивоваренной промышленности. Она содержит 80% влаги и большое количество клетчатки (около 70%), включая целлюлозу, гемицеллюлозу, лигнин, белок, β-глюкан, крахмал и липиды [1,4,9,10]. Кроме того, на долю дробины приходится approximately 85% от общего объема побочных продуктов, производимых пивоваренной промышленностью. За последнее десятилетие мировое производство пива колебалось между 1,9 и 2 миллиардами гектолитров, что ежегодно приводило к образованию от 38 до 40 миллионов тонн дробины [11,12,13]. Пивоваренный бизнес имеет большое экономическое значение и оказывает на него существенное влияние. Но он также оказывает негативное влияние на окружающую среду из-за большого количества отходов дробины, образующихся в процессе брожения. Содержание белка в ней (18–30% мас./мас.) зависит от выбора сырья, добавок и технологий варения производителем. Целлюлоза (полимер глюкозы) и гемицеллюлоза (арабиноксилан) являются двумя основными полисахаридами в дробине [3,12,14]. Кроме того, хранение и транспортировка дробины являются сложными из-за ее сложного состава и чувствительности к микробному росту из-за высокого содержания влаги.
Поскольку дробина является недорогим побочным продуктом, производимым в больших ежегодных объемах, она может представлять значительный интерес для дальнейших исследований [12,15,16,17]. Хотя в литературе обсуждаются различные методы утилизации пищевых отходов, включая компостирование, захоронение на свалках, использование в качестве корма для животных и анаэробное сбраживание [2,9,12,18,19,20], каждый метод имеет недостатки, такие как потребность в больших площадях земли, длительное время реакции, низкая эффективность и выбросы парниковых газов. Кроме того, эти методы не являются устойчивыми и выделяют токсичные газы, вызывая загрязнение воды и почвы [9,21,22]. В литературе описаны различные предварительные обработки, включая кислотные, щелочные, органосольвентные и ионные жидкости, как эффективные методы в биорефайнинговой переработке дробины [2,5,21,23,24,25]. Переработка дробины с помощью термохимических процессов может давать продукты с широким спектром применений, такие как адсорбция CO2, катализаторы, суперконденсаторы и ремедиация почв [12,18,19,26,27]. Однако потребность в энергии с точки зрения энтальпии испарения, необходимой для удаления влаги, увеличивается, когда для пиролиза используется влажный образец дробины. С другой стороны, извлечение ценных фракций из этих отходов, которые имеют several применений, может быть перспективным подходом. Один из возможных подходов — разделение биополимеров, присутствующих в ее лигноцеллюлозной биомассе, с последующей характеристикой и изучением их функциональных свойств. Также, во время термохимического процесса, введение N и C из их богатых белком фракций может быть эффективной тактикой для повышения каталитической эффективности [26].
В литературе сообщается о various применениях гемицеллюлозы, выделенной из различных сельскохозяйственных источников, включая биологически активные соединения и функциональные компоненты [28,29,30]. Однако другие компоненты, включая целлюлозо-обогащенные фракции, не были хорошо изучены. Прежде чем выбирать технологии переработки и применения этих фракций, необходимо понять их физико-химические свойства. Поэтому основная цель данного исследования — экстракция, характеристика и изучение физико-химических свойств четырех основных фракций (Геми. А, Геми. Б, целлюлозо-обогащенной фракции и олигосахаридов) пивной зерновой дробины. Более того, предварительное понимание физических и химических особенностей этих фракций направляет нас в выборе альтернативных технологий для утилизации и переработки многочисленных отходов.
2. Материалы и методы
2.1. Материалы
Пивную зерновую дробину получили от местной пивоваренной компании (Iron Hill Brewery Facility) в Экстоне, Пенсильвания, США. Сначала собранную дробину сушили в вакуумной печи при 60 °C в течение двух дней, и, наконец, остаточную влагу удаляли при 105 °C в течение 2 ч. Высушенные образцы измельчали в порошок с помощью кофемолки. Размер частиц измельченных образцов составлял <0,5 мм. Измельченные образцы дробины обезжиривали с помощью гексана, как сообщалось ранее [31]. Вкратце, около 300 г измельченной дробины добавляли к 2 л гексана и перемешивали механической мешалкой при комнатной температуре в течение 1 ч. Затем суспензию дробины фильтровали под вакуумом для удаления гексана, и гексан-экстрагированную дробину собирали и сушили в вакуумной печи при 55 °C. Альфа-амилазу приобрели у Novozymes North America Inc. 77 Perry Chapel Church Rd. Box 576 Franklinton, NC 27525, USA. Обратите внимание, что препараты Novozymes являются биокатализаторами, используемыми в различных промышленных процессах в пищевом производстве. Физическое состояние образца было следующим: жидкость (плотность: 1,25 г/мл), коричневый цвет, pH при 25 °C = 5,23 и легкий ферментативный запах. Полученный образец был плотно запечатан и хранился при 4 °C.
2.2. Выделение Геми. А, Геми. Б, ЦОФ и олигосахаридов из гексан-экстрагированной дробины
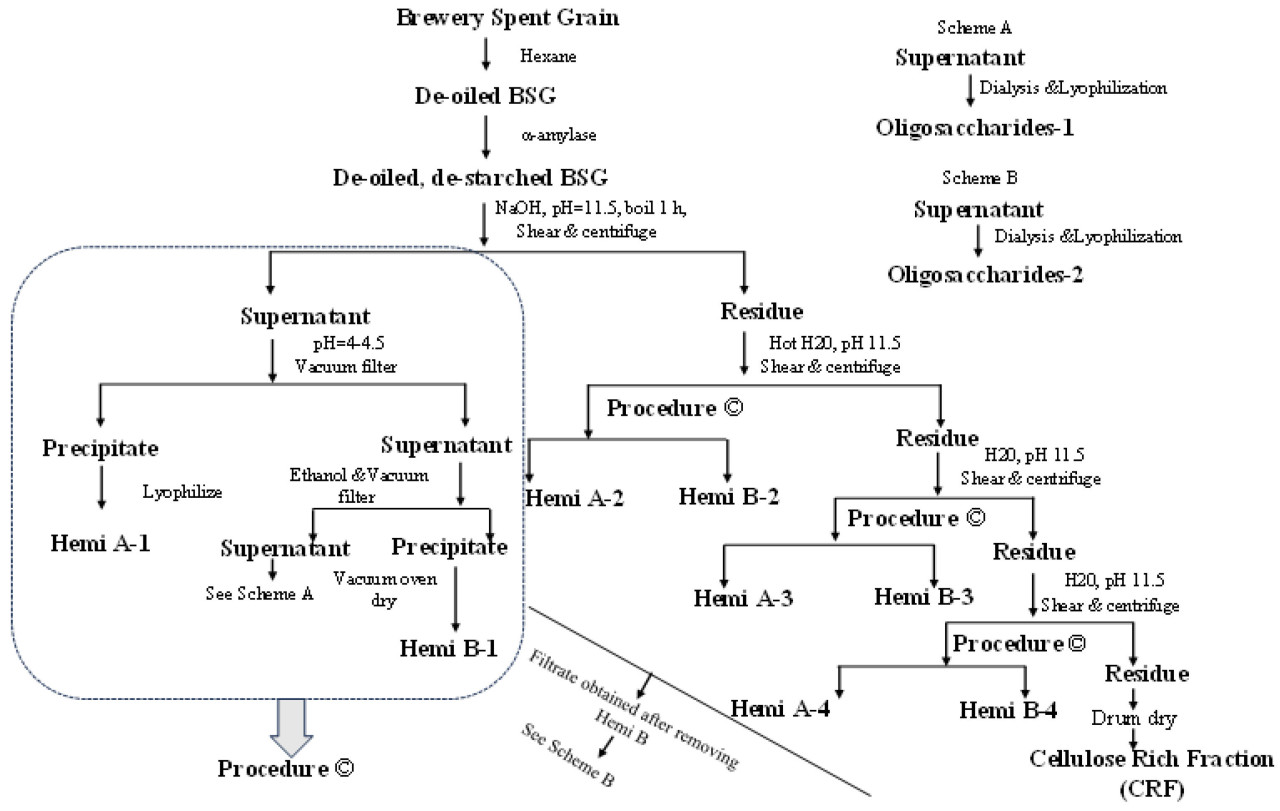
Различные функциональные фракции дробины выделяли с использованием технологии щелочной обработки, как показано на схеме ниже (Рисунок 1), следуя нашему ранее опубликованному методу с некоторыми модификациями [16]. Вкратце, обезжиренную дробину (200 г) механически перемешивали в воде и нагревали до 85 °C в присутствии α-амилазы в течение 1 ч. pH суспензии поддерживали на уровне 11,5 на протяжении всей процедуры путем добавления 50% (мас./об.) NaOH по мере необходимости. Горячую реакционную смесь охлаждали до комнатной температуры, а затем центрифугировали при 6000× g в течение 20 мин для отделения надосадочной жидкости от остаточного материала. pH щелочного супернатанта понижали до 4,0–4,5 путем добавления 6 M HCl для осаждения гемицеллюлозы А (Геми. А), которую собирали с помощью центрифугирования. К супернатанту постепенно добавляли два объема этанола при перемешивании для осаждения гемицеллюлозы Б (Геми. Б, также называемой арабиноксиланом). Осажденную Геми. Б хранили в холодильной камере overnight для достижения полного осаждения, которое оседало в виде белого хлопьевидного осадка на дне стакана. Прозрачную смесь спирта и воды над хлопьевидным осадком удаляли с помощью декантации. Белый хлопьевидный осадок переносили в другой стакан, перемешивали в 100% этаноле и фильтровали под вакуумом. Геми. Б, полученную на воронке Бюхнера, промывали 100% этанолом, переносили в стеклянный стакан и сушили в вакуумной печи при 55 °C overnight. Нерастворимый остаток, оставшийся после щелочной экстракции гексан-экстрагированного материала, повторно суспендировали в воде и further обрабатывали, как показано в процедуре C на Рисунке 1, чтобы получить дополнительно Геми. А (Геми. А 2–4), Геми. Б (Геми. Б 2–4) и олигосахариды (схемы A и B, Рисунок 1). Конечный остаток после всех экстракций Геми. А и Б суспендировали в воде и высушивали на барабанной сушилке; его назвали целлюлозо-обогащенной фракцией (ЦОФ). После удаления каждой фракции Геми. А и Геми. Б супернатант от каждой упаривали почти досуха, затем повторно растворяли в воде и диализовали с использованием диализных трубок с порогом отсечения по молекулярной массе 1 кДа против деионизированной воды в течение 4 дней, меняя воду 3 раза в день. После диализа раствор концентрировали до меньшего объема и лиофилизировали для получения чистого рыхлого материала, называемого олигосахаридами (Олиго.).
2.3. Элементный анализ
Для элементного анализа использовали анализатор Thermo Scientific flash EA 1112 CHNS/O. Нагружали около 1–5 мг образца и сжигали при температуре 950 °C. Содержание кислорода рассчитывали без учета золы в дифференциале. Принимая за 100%, вычитали общий вес C, H и N, как описано в литературе [32].
2.4. Определение влаги, связанного углерода, летучих веществ и зольности
Содержание влаги, связанного углерода, летучих веществ и золы в каждом образце определяли в соответствии с нашим ранее опубликованным методом [32]. Использовали термогравиметрический анализатор (TA Q500 V20.13 Build 39 — относится к конкретной модели термовесов TGA, производимых TA Instruments) производства США. Использовали approximately 5–10 мг каждого образца. Вкратце, 5–10 мг образца помещали в небольшую платиновую чашу и взвешивали в потоке азота (50 мл/мин) при комнатной температуре внутри прибора. Использовали следующую программу нагрева: от 25 до 120 °C, 50 °C/мин (N2 50 мл/мин), выдержка при 120 °C в течение 3 мин (N2 50 мл/мин); от 120 до 950 °C, 100 °C/мин в атмосфере азота, выдержка 5 мин, и последующее охлаждение до 450 °C для определения содержания летучих веществ. Зольность определяли путем нагрева образца от 450 °C до 600 °C, 100 °C/мин (воздух 50 мл/мин), выдержка при 600 °C в течение 5 мин (воздух, 50 мл/мин). Процент связанного углерода определяли путем вычитания % золы из % летучих веществ [32]. Каждый эксперимент проводили как минимум в трех повторностях, и регистрировали стандартные ошибки.
2.5. Определение сахарного состава
Сахара анализировали с помощью высокоэффективной анионообменной хроматографии с пульсамперометрическим детектированием (HPAEC-PAD) на колонке CarboPac PA-20 (Thermo Fisher Scientific, Уолтем, Массачусетс, США) после гидролиза образцов до моносахаридов с использованием метанолиза в сочетании с обработкой ТФУ, как сообщили Ядав и др. [30]. Вкратце, анализируемые образцы сначала растворяли в деионизированной воде до концентрации 1 мг/мл. Аликвоту 100 нмоль мио-инозитола (внутренний стандарт) добавляли к раствору образца и высушивали в стеклянном флаконе с тефлоновой прокладкой и винтовой крышкой, продувая очищенным азотом, с последующей сушкой в вакуумной печи при 50 °C overnight. Эти образцы подвергали метанолизу 1,5 M метанольным HCl в присутствии 20% (об./об.) метилацетата в течение 16 ч, охлаждали до комнатной температуры и высушивали продувкой очищенным N2 после добавления пяти капель т-бутанола. Метанолизованные образцы гидролизовали 0,5 мл 2 M ТФУ при 121 °C в течение 1 ч, упаривали продувкой очищенным N2 при 50 °C, и остаток промывали путем последовательного добавления и упаривания трех аликвот (0,5 мл) метанола. В пять отдельных стеклянных флаконов помещали 100, 200, 300, 500 и 1000 нмоль смеси стандартных сахаров, содержащей фукозу, арабинозу, рамнозу, галактозу, глюкозу и ксилозу. Затем к каждому флакону добавляли 100 нмоль мио-инозитола (внутренний стандарт), упаривали и сушили, как описано выше. Эти стандартные образцы также метанолизовали и гидролизовали, как описано выше, и использовали для количественного определения. Затем гидролизат образцов и смесь стандартных сахаров анализировали с помощью HPAEC-PAD на системе Dionex DX-500, которая включала колонку CarboPac PA20 и защитную колонку, градиентный насос GP 50, электрохимический детектор ED40 с использованием четверной потенциальной волны (золотой рабочий электрод и Ag/AgCl reference electrode), автодозатор AS3500 с термокамерой (нагрев колонки до 30 °C) и систему пневматического контроля PC10 для пост-колоночного добавления реагентов.
2.6. Технический анализ (Proximate Analysis)
Содержание белка (N *6.25), влаги и золы во всех образцах определяли с использованием «Одобренных методов AACC» 46-30, 44-19 и 08-01 соответственно. Подробности этой процедуры можно найти в наших предыдущих исследованиях [28]. Для определения белка (N*6.25) с использованием Одобренного метода AACC 46-30.01 использовали анализатор Flash 2000 Protein Analyzer от (CE Elantech, Inc., Нью-Джерси). Вкратце, образец взвешивали в оловянной капсуле и вводили в реактор сгорания через автодозатор вместе с необходимым количеством чистого кислорода. После сгорания образовавшиеся газы переносились постоянным потоком гелия во второй реактор, заполненный медным восстановителем, затем пропускались через ловушки CO2 и H2O, через GC колонку и, наконец, детектировались с помощью детектора теплопроводности. Полный отчет по N/Белку автоматически генерировался с использованием специализированного программного обеспечения Eager Xperience, встроенного в прибор. Условия анализа были следующими: температура сгорания 900 °C, температура восстановления 680 °C, температура печи 50 °C, скорость потока гелия 140 мл/мин, скорость потока кислорода 100 мл/мин и общее время анализа около 5 мин.
2.7. Анализ крахмала
Содержание крахмала определяли с использованием набора для определения общего крахмала (Megazyme, Inc., Уиклоу, Ирландия) на основе использования термостабильной α-амилазы и амилоглюкозидазы [30].
2.8. Статистический анализ
Все образцы измеряли как минимум в трех повторностях. Стандартные отклонения и среднее значение рассчитывали в таблице Excel. Значения в скобках представляют стандартную ошибку среднего.
2.9. FTIR анализ
Фурье-спектрометр инфракрасного диапазона (FTIR) использовали для изучения и идентификации функциональных групп в выделенных продуктах. Около 5 мг твердого образца зажимали в режиме измерения. Кристалл ATR-IR платина-алмаз был встроен в Фурье-спектрометр инфракрасного диапазона (FTIR). Спектры в диапазоне 4000–500 см−1 собирали с использованием 64 сканов при разрешении 4 см−1.
3. Результаты и обсуждение
3.1. Геми. А, Геми. Б, целлюлозо-обогащенная фракция (ЦОФ) и олигосахариды
Геми. А, Геми. Б, ЦОФ и олигосахариды экстрагировали из дробины согласно схеме, показанной на Рисунке 1. По сравнению с нашими предыдущими исследованиями, процедура экстракции была slightly различной. Основная цель экстракции этих продуктов — понять их физико-химические свойства до изучения их потенциального применения. Сначала жир и масло, присутствующие в исходной дробине, удаляли с помощью гексановой экстракции, и обезжиренную дробину использовали для экстракции ее четырех различных функциональных фракций. Выход всех фракций, выделенных из дробины по схеме, приведенной на Рисунке 1, приведен в Таблице 1. Всего для экстракции использовали 200 г обезжиренной дробины, из которых было получено в общей сложности 42,7 г (21,4%) Геми. А, 36,8 г (18,5%) Геми. Б, 34,8 г (17,4%) ЦОФ и 76,8 г (38,5%) олигосахаридов. В целом, 96% от общего количества сухого твердого материала в виде четырех различных фракций было извлечено из дробины. Фракция олигосахаридов, которую получали из фильтрата, собранного после осаждения Геми. Б, содержала большое количество соли. Поэтому эту фракцию диализовали с использованием диализной трубки с порогом отсечения по молекулярной массе 1 кДа, что удалило большую часть соли, уменьшив ее выход с 38,5% до 5,5%. В Таблицах 1 и 2 приведены детали по каждой фракции и их соответствующий выход из гексан-экстрагированной дробины. Таким образом, после диализа фракций олигосахаридов общий процент всех четырех функциональных фракций (Геми. А, Геми. Б, ЦОФ и олигосахаридов) составил лишь 62,8% (Таблица 2). Высокий выход экстрагированной гемицеллюлозы может быть использован для ее химической модификации как перспективного метода синтеза новых биополимеров. Целлюлозо-обогащенная фракция может быть использована в качестве функционального продукта с добавленной стоимостью в пищевых продуктах в качестве некалорийного наполнителя и текстурирующего агента [4]. Кроме того, функциональные олигосахариды, полученные из дробины, имеют потенциал для использования в качестве пребиотика во многих пищевых продуктах и напитках для улучшения здоровья кишечника человека. Геми. Б и ЦОФ являются растворимыми и нерастворимыми пищевыми волокнами соответственно. Эти пищевые волокна имеют вязкую и волокнистую структуру, и их можно использовать в качестве пищевых ингредиентов во многих пищевых продуктах, которые контролируют и высвобождают глюкозу в крови с течением времени [14,33]. Более того, выделенные фракции Геми. А и Геми. Б могут служить эффективной альтернативой источникам белка и источникам биологически активных веществ. Использование этих компонентов в хлебобулочных и макаронных изделиях снижает гликемический индекс и улучшает качество пищи [5]. Все эти экспериментальные наблюдения revealed, что фракции, экстрагированные из дробины, могут быть полностью утилизированы, повышая экономическую ценность этого низкоценного побочного продукта.
Таблица 1. Выход (% по сухому весу) фракций, выделенных из пивной зерновой дробины, до диализа фракций олигосахаридов.
Таблица 2. Выход (% по сухому весу) фракций, выделенных из дробины, после диализа фракций олигосахаридов.
3.2. Элементный анализ и определение влаги, зольности, летучих веществ и связанного углерода
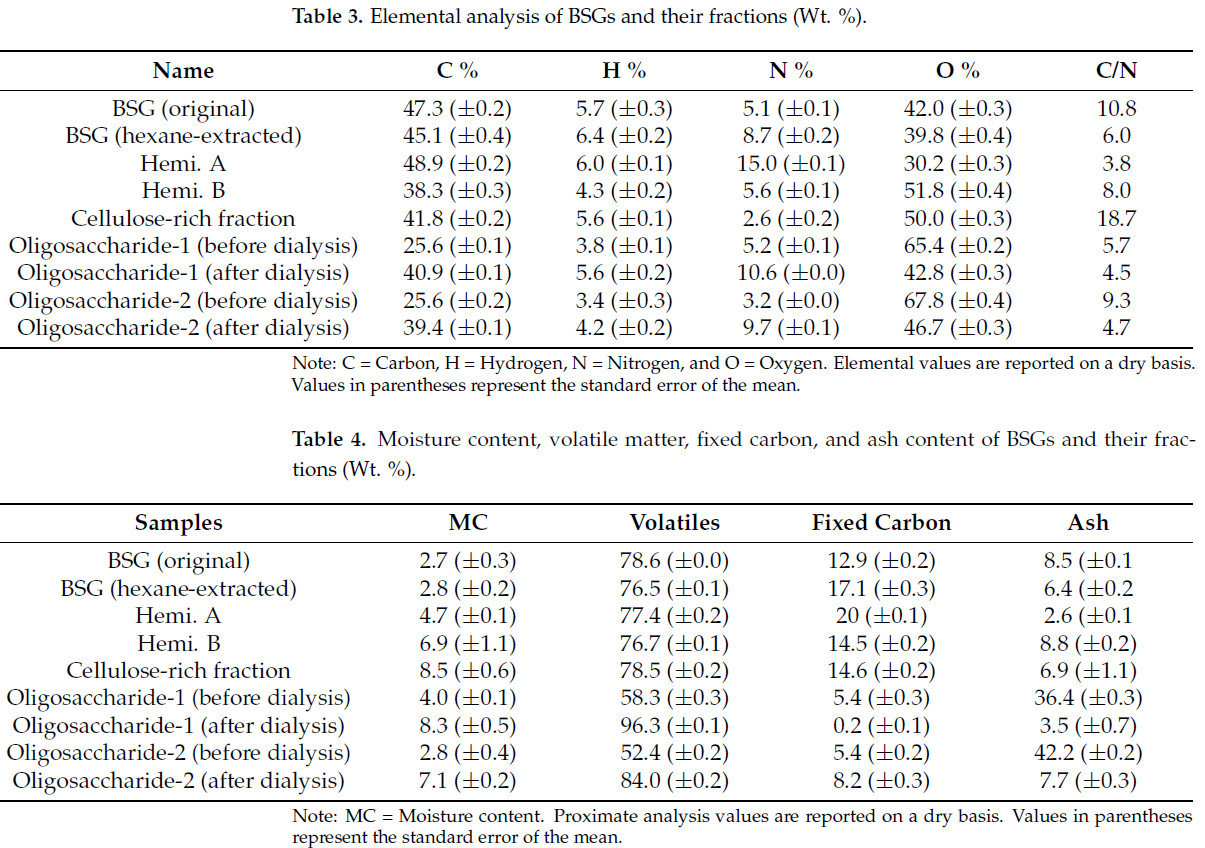
В Таблице 3 приведены данные элементного анализа дробины и функциональных фракций, выделенных из нее. Основная цель проведения элементного анализа — определение содержания углерода, водорода, азота и кислорода в этих образцах в пересчете на сухой вес биомассы. Компоненты, такие как влага, зола, летучие вещества и связанный углерод, присутствующие в дробине и ее фракциях, приведены в Таблице 4. Влажность представляет количество воды, связанной с биомассой. Она сильно влияет не только на транспортировку, хранение и переработку, но и на получаемые продукты [34,35]. Различия в содержании влаги в каждой фракции, экстрагированной из дробины, указывают на то, что в них присутствует inherent влага, несмотря на то, что они высушены в печи. Наибольшее содержание влаги наблюдалось в ЦОФ и диализованной фракции олигосахаридов. В целом, высокое содержание связанного углерода и низкая зольность являются желательными свойствами биомассы как альтернативного топлива [34,35]. Высокое содержание связанного углерода в гексан-экстрагированной дробине (17,1%), Геми. А (20%) и Геми. Б (14,5%) указывает на то, что эти фракции пригодны для термохимической конверсии с получением биоугля. Кроме того, recovered целлюлозная фракция может быть использована в качестве источника целлюлозного углерода как в термохимических процессах, так и в синтезе производных целлюлозы (например, водорастворимое карбоксиметилцеллюлозное волокно для различных применений) [36,37]. Значительное снижение зольности в олигосахаридах после диализа указывает на то, что основные примеси биомассы могут быть удалены, что помогает прогнозировать тенденцию термохимического процесса.
Таблица 3. Элементный анализ дробины и ее фракций (% мас.).
Таблица 4. Содержание влаги, летучих веществ, связанного углерода и золы в дробине и ее фракциях (% мас.).
Когда речь идет о топливной ценности, элементы C, H и O являются наиболее crucial. Более высокое содержание углерода и водорода и более низкое содержание кислорода в фракциях биомассы предпочтительны, поскольку они обеспечивают superior качество биотоплива [18,31,38]. Исходная дробина имеет содержание углерода около 47,3%, водорода — 5,7%, азота — 5,1%, а также содержание кислорода 42%. Однако тенденция в каждой фракции следует irregular картине. Среди четырех основных фракций Геми. А имеет самый высокий процент N (15%), тогда как дробина (гексан-экстрагированная) содержит только 8,7% N. В случае Геми. А высокое содержание углерода (48,9%) и азота (15%) указывает на то, что она может быть хорошим азотсодержащим субстратом для различных применений [22]. С другой стороны, Геми. Б имеет низкое содержание углерода (38,3%), водорода (4,3%) и азота (5,6%), но высокое содержание кислорода (51,8%). Примечательно, что пиролизованные фракции дробины, богатые азотом, могут быть легко преобразованы в биоуголь. Это пористое вещество, характеризующееся стабильными физическими и химическими свойствами и высокой концентрацией углерода и азота; этот процесс способствовал минимизации вымывания питательных веществ и служил мелиорантом почвы. Желаемые характеристики этих азотированных углей, включая повышенную зольность, стабильный ароматический углерод, низкую насыпную плотность и умеренную емкость катионного обмена, делают их жизнеспособной альтернативой синтетическим удобрениям [26,27,32,39]. Кроме того, средний диапазон соотношения C/N в каждой экстрагированной фракции demonstrated, что она пригодна для компостирования, что ускоряет процесс [2]. Углерод и азот являются essential питательными элементами для микробного роста. Углерод служит источником энергии, а азот необходим для синтеза белков и нуклеиновых кислот. Микроэлементы, необходимые для анаэробного digestion и компостирования, часто оценивают с помощью соотношения углерода к азоту (C/N). Оптимальное соотношение C/N для анаэробного сбраживания составляет 20–30, что определяется потребностями в питательных веществах для синтеза микробной биомассы [2,26].
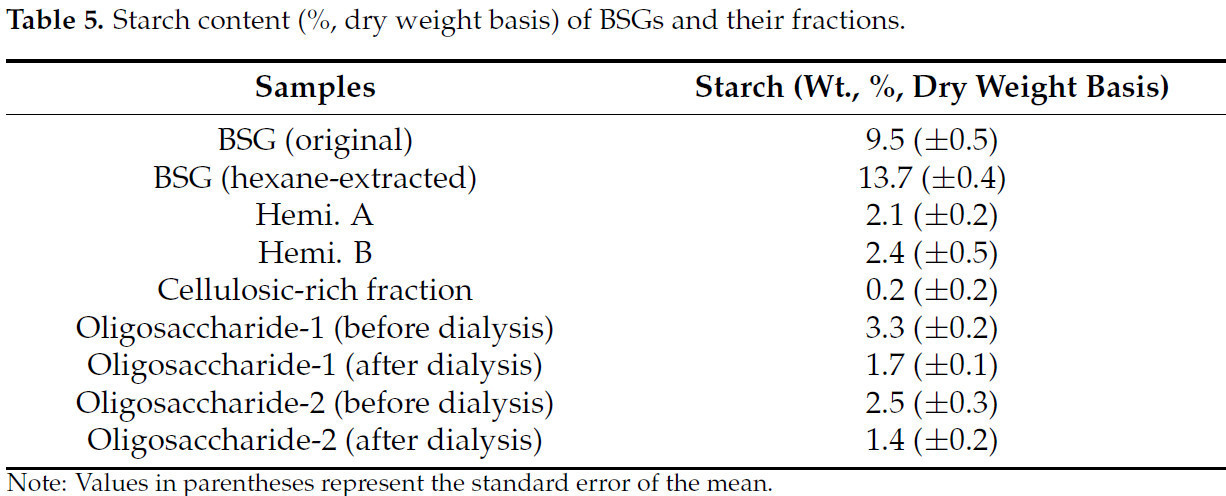
В Таблице 5 показано содержание крахмала в дробине и ее фракциях. После гексановой экстракции содержание крахмала увеличилось с 9,5% до 13,7% в дробине. Процесс н-гексановой экстракции, который концентрировал большинство растворимых полимеров в твердом остатке после процесса обезжиривания, ответственен за увеличение крахмала. Кроме того, высокое содержание белка в каждой фракции Геми. А и Геми. Б напрямую связано с низким содержанием крахмала. Более того, β-глюкан, содержащийся в крахмале этих фракций, обладает потенциалом в качестве диетического ингредиента. Он обладает способностью снижать уровень холестерина и глюкозы в крови, одновременно повышая чувствительность к инсулину [2,40]. Литература также suggests, что высокие уровни β-глюкана могут быть получены из злаков с использованием щелочи в качестве исходного растворителя для экстракции [25]. Содержание крахмала во фракциях Геми. А, Геми. Б и олигосахаридах варьировалось от 2,1 до 3,3%. Целлюлозо-обогащенная фракция содержала only about 0,2% остаточного крахмала.
Таблица 5. Содержание крахмала (%, по сухому весу) в дробине и ее фракциях.
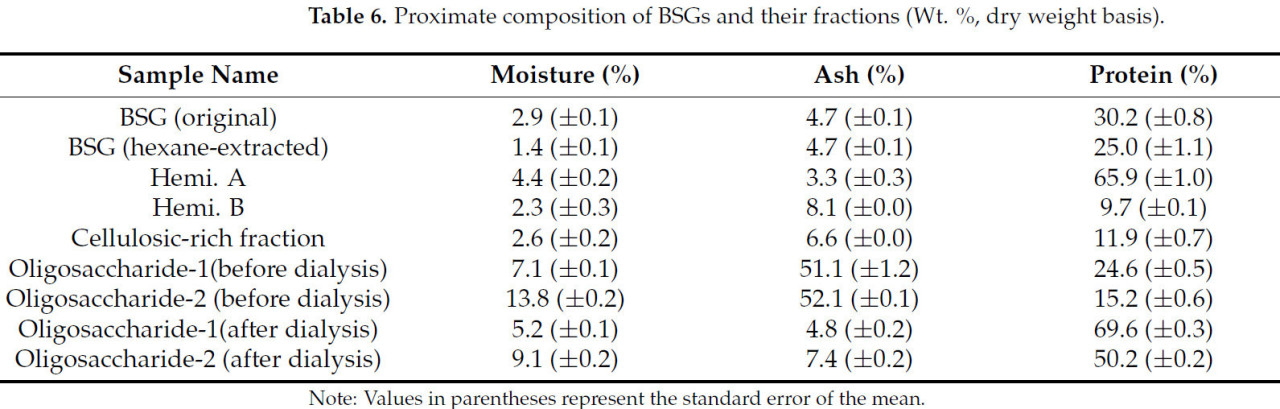
В Таблице 6 показан стандартный технический состав дробины и ее фракций. Эти данные somewhat соответствуют данным технического анализа, полученным с помощью TGA. Зольность была highest в случае олигосахаридов (51,1% и 52,1%) как в этанольной, так и в промывной фракциях ЦОФ соответственно. Содержание белка в каждой фракции варьировалось в диапазоне от 9,7 до 30,2%. Однако значительное количество белка накопилось в Геми. А из дробины (65,9%), Олиго-EtOH после диализа (69,6%) и Олиго-CAX после диализа (50,2%). Кроме того, после удаления солей путем диализы содержание белка в каждом олигосахариде значительно увеличилось. Повышенное содержание белка в Геми. А (66%) и Олиго.1 (70%) suggests, что эти фракции могут служить жизнеспособными заменителями традиционных источников белка, способствуя thus динамичному рынку растительных белков в последние годы.
Таблица 6. Технический состав дробины и ее фракций (% мас., по сухому весу).
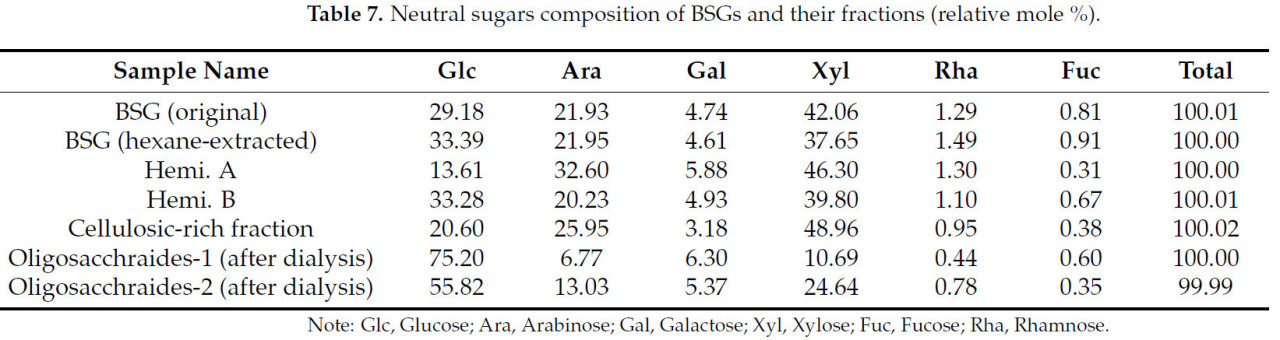
В Таблице 7 показан сахарный состав (относительное мольное процентное содержание) дробины и ее фракций. Глюкоза, ксилоза и арабиноза являются преобладающими сахарами в исходной дробине и ее фракциях по сравнению с другими остаточными компонентами, Геми. А, Геми. Б и целлюлозо-обогащенные фракции (ЦОФ), показывая, что они имеют типичную арабиноксилановую структуру с ксилановым остовом и арабинозой в боковых цепях, как и в большинстве зерновых отрубей [30,41]. Дробину обрабатывали α-амилазой для гидролиза любого оставшегося крахмала, чтобы получить фракционированные продукты из нее бескалорийным manner. Но дробина и ее фракции все еще содержат высокий процент глюкозы, что может быть связано с присутствием большого количества β-глюканов в ячмене [21]. β-глюканы являются полимерами глюкозы, подобно крахмалу, но они не гидролизуются α-амилазой. Таким образом, они попадают во все фракции во время фракционирования дробины. В исходной дробине и ее фракциях были обнаружены only следовые количества кислых сахаров, таких как галактуроновая кислота (GalA) и глюкуроновая кислота (GlcA), которые здесь не reported. Дробина и ее фракции показывают, что они содержат несколько процентов Rha, Fuc и галактозы. Xyl, Ara и Glc являются основными сахарами, присутствующими в дробине и ее фракциях, что хорошо согласуется с результатами, reported в литературе [3].
Таблица 7. Состав нейтральных сахаров в дробине и ее фракциях (относительное мольное %).
3.3. Анализ функциональных групп: Фурье-спектроскопия инфракрасного диапазона (FTIR)
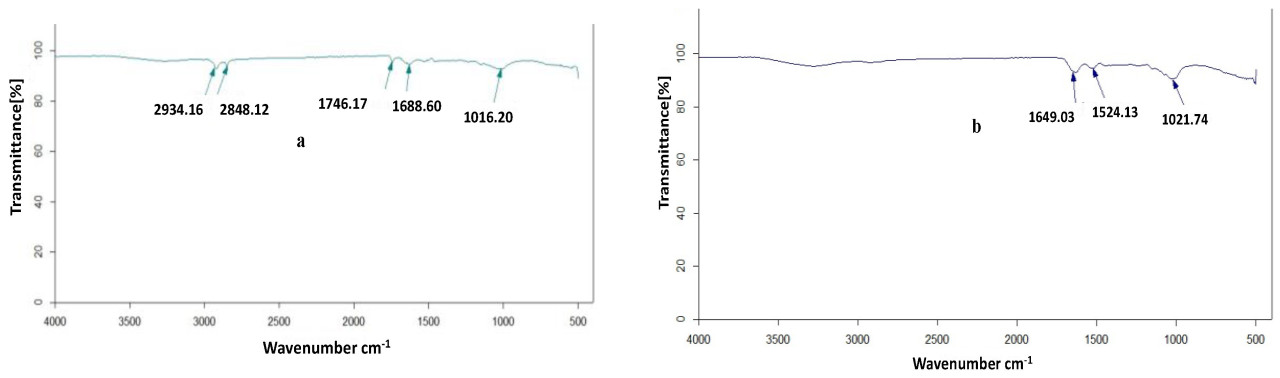
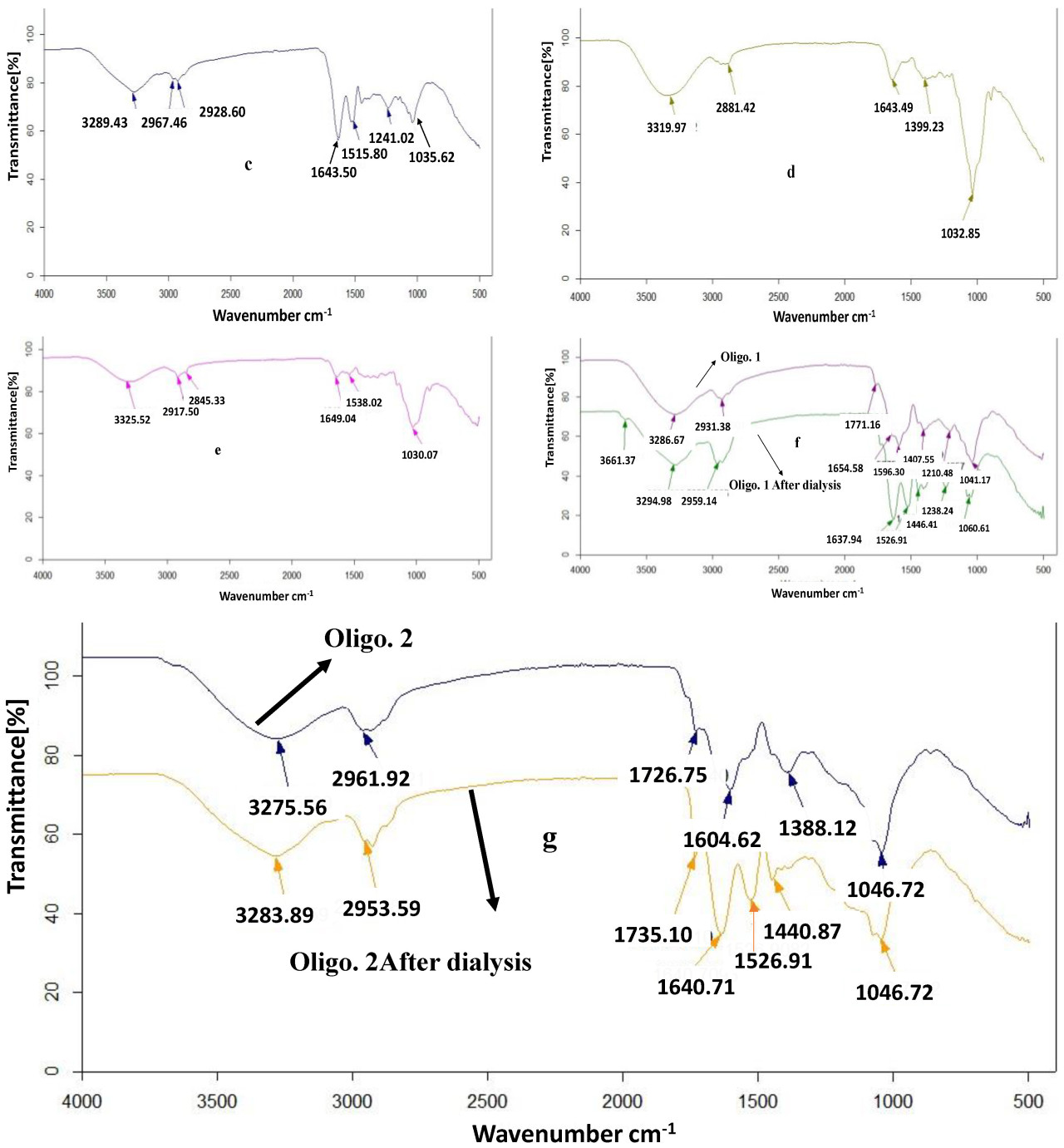
Функциональные группы, присутствующие в каждом образце, были идентифицированы с помощью FT-IR анализов. На Рисунке 2 показаны инфракрасные спектры пропускания пивной зерновой дробины и ее фракций. FTIR спектроскопия в ее различных формах является important и мощным методом, который дает полезную информацию о структурах. По сравнению с исходной и гексан-экстрагированной дробиной, фракции, выделенные из нее, показывают полосу растяжения в области длин волн 3200–3500 см−1, которая attributed к аминам-N, гидроксильным группам и карбоновым кислотам. Пики при 1020–1300 см−1 могут быть assigned к растяжению C-N [32,42]. Однако эти полосы интенсивны в Геми. А, Геми. Б, а также в олигосахаридах. Полосы растяжения C=O при 1643 см−1 были интенсивными в Геми. А и Геми. Б по сравнению с образцами исходной и гексан-экстрагированной дробины, что подтверждает присутствие альдегидной функциональной группы. Полосы около 2900 см−1 соответствуют валентным колебаниям C-H в каждом образце. Кроме того, сильный пик около 3286 см−1 в Геми. А, Геми. Б и олигосахаридах может быть attributed к растяжению N-H алкильных или ариламинов, которые могут присутствовать в аминокислотах белков. Характерный пик для каждой гемицеллюлозы был подтвержден появлением пика при about 1035 см−1 (который связан с гликозидной связью) [29]. С другой стороны, полосы при ~2900 см−1 и 1400 см−1 assigned к ароматическим валентным колебаниям CH и ароматическим скелетным колебаниям соответственно [43,44]. В случае диализованных Олиго. эти полосы показали intense увеличение, что suggests присутствие ароматических структур фенольных соединений, которые могут быть связаны в боковой цепи ее сахарного остова. В целом, область частот между 1200 см−1 и 800 см−1 может считаться областью отпечатков пальцев. В contrast с исходной дробиной, Геми. А, Геми. Б и Олиго. показали интенсивные полосы для гликозидных связей их сахарных единиц.
Рисунок 2. FTIR анализ дробины и ее фракций: (a) Исходная дробина, (b) Дробина — гексан-экстрагированная, (c) Геми. А, (d) Геми. Б, (e) ЦОФ, (f) Олиго.1 до и после диализа, и (g) Олиго. 2 до и после диализа.
4. Выводы
Это исследование демонстрирует, что пивная зерновая дробина состоит из четырех различных функциональных компонентов, которые могут быть извлечены для применения в пищевой и непищевой промышленности. Выход каждой фракции зависит от используемого процесса экстракции. В пересчете на сухой вес было получено 21,4% Геми. А, 18,5% Геми. Б, 17,4% ЦОФ и 38,5% олигосахаридов (включая присутствующую в них соль). Но когда олигосахариды диализовали, их количество уменьшилось с 38,5% до 5,5%, показывая, что в супернатанте, из которого выделяли олигосахариды, присутствовало значительное количество соли. Элементные анализы показали, что фракции Геми. А и диализованных олигосахаридов содержали значительные количества N (15% и 10,6% соответственно), которые могут быть использованы в качестве азот-содержащих прекурсоров в термохимическом процессе. Элементные анализы и стандартные технические анализы содержания N, в которых использовали множитель 6,25, показали хорошо скореллированные результаты. FT-IR анализы подтвердили наличие N-функциональных групп, particularly в богатых белком фракциях. Анализ сахарного состава показал, что дробина и ее фракции содержали ксилозу, арабинозу и глюкозу в качестве основных сахаров, указывая на их арабиноксилановую структуру с глюкозой, поступающей из остаточного β-глюкана. Пищевые волокна, а также богатые белком фракции (Геми. А и Геми. Б) могут быть использованы в качестве ингредиентов в хлебопечении и formulated foods. Интеграция этих экстрагированных компонентов в рецептуру различных зерновых пищевых продуктов может служить эффективной стратегией для апсайклинга отходов пивоваренной промышленности. Текущие исследования указывают на то, что отходы пивоваренной промышленности, в частности дробина и ее фракции, могут быть преобразованы в ценные товары с помощью термохимических и биотехнологических процессов. Богатые белком фракции могут служить добавками в термохимическом процессе.
Ссылки
1. Arauzo, P.J.; Du, L.; Olszewski, M.P.; Zavala, M.M.; Alhnidi, M.J.; Kruse, A. Effect of protein during hydrothermal carbonization of brewer’s spent grain. Bioresour. Technol. 2019, 293, 122117. [Google Scholar] [CrossRef]
2. Assandri, D.; Pampuro, N.; Zara, G.; Cavallo, E.; Budroni, M. Suitability of composting process for the disposal and valorization of brewer’s spent grain. Agriculture 2021, 11, 2. [Google Scholar] [CrossRef]
3. Ikram, S.; Huang, L.; Zhang, H.; Wang, J.; Yin, M. Composition and nutrient value proposition of brewers spent grain. J. Food Sci. 2017, 82, 2232–2242. [Google Scholar] [CrossRef] [PubMed]
4. Zeko-Pivač, A.; Tišma, M.; Žnidaršič-Plazl, P.; Kulisic, B.; Sakellaris, G.; Hao, J.; Planinić, M. The potential of brewer’s spent grain in the circular bioeconomy: State of the art and future perspectives. Front. Bioeng. Biotechnol. 2022, 10, 870744. [Google Scholar] [CrossRef] [PubMed]
5. Morán-Aguilar, M.; Costa-Trigo, I.; Calderón-Santoyo, M.; Aguilar-Uscanga, M.; Oliveira, R.P.d.S.; Domínguez, J. Enhancing the biorefinery of brewery spent grain by deep eutectic solvent pretreatment: Optimisation of polysaccharide enrichment through a response surface methodology. J. Ind. Eng. Chem. 2024. [Google Scholar] [CrossRef]
6. Jaeger, A.; Zannini, E.; Sahin, A.W.; Arendt, E.K. Barley Protein properties, extraction and applications, with a focus on brewers’ spent grain protein. Foods 2021, 10, 1389. [Google Scholar] [CrossRef]
7. McCarthy, A.L.; O’Callaghan, Y.C.; Piggott, C.O.; FitzGerald, R.J.; O’Brien, N.M. Brewers’ spent grain; bioactivity of phenolic component, its role in animal nutrition and potential for incorporation in functional foods: A review. Proc. Nutr. Soc. 2013, 72, 117–125. [Google Scholar] [CrossRef]
8. Olivares-Galván, S.; Marina, M.; García, M. Extraction of valuable compounds from brewing residues: Malt rootlets, spent hops, and spent yeast. Trends Food Sci. Technol. 2022, 127, 181–197. [Google Scholar] [CrossRef]
9. Chew, K.R.; Leong, H.Y.; Khoo, K.S.; Vo, D.-V.N.; Anjum, H.; Chang, C.-K.; Show, P.L. Effects of anaerobic digestion of food waste on biogas production and environmental impacts: A review. Environ. Chem. Lett. 2021, 19, 2921–2939. [Google Scholar] [CrossRef]
10. Chin, Y.L.; Keppler, J.K.; Dinani, S.T.; Chen, W.N.; Boom, R. Brewers’ spent grain proteins: The extraction method determines the functional properties. Innov. Food Sci. Emerg. Technol. 2024, 94, 103666. [Google Scholar] [CrossRef]
11. da Rosa Almeida, A.; Geraldo, M.R.F.; Ribeiro, L.F.; Silva, M.V.; de Oliveira Brisola Maciel, M.V.; Haminiuk, C.W.I. Bioactive compounds from brewer’s spent grain: Phenolic compounds, fatty acids and in vitro antioxidant capacity. Acta Scientiarum. Technol. 2017, 39, 269–277. [Google Scholar] [CrossRef]
12. Devnani, B.; Moran, G.C.; Grossmann, L. Extraction, composition, functionality, and utilization of brewer’s spent grain protein in food formulations. Foods 2023, 12, 1543. [Google Scholar] [CrossRef] [PubMed]
13. Jackowski, M.; Niedźwiecki, Ł.; Jagiełło, K.; Uchańska, O.; Trusek, A. Brewer’s spent grains—Valuable beer industry by-product. Biomolecules 2020, 10, 1669. [Google Scholar] [CrossRef] [PubMed]
14. Qin, F.; Johansen, A.Z.; Mussatto, S.I. Evaluation of different pretreatment strategies for protein extraction from brewer’s spent grains. Ind. Crops Prod. 2018, 125, 443–453. [Google Scholar] [CrossRef]
15. Hejna, A.; Barczewski, M.; Kosmela, P.; Aniśko, J.; Szulc, J.; Skórczewska, K.; Piasecki, A.; Kuang, T. More than just a beer—Brewers’ spent grain, spent hops, and spent yeast as potential functional fillers for polymer composites. Waste Manag. 2024, 180, 23–35. [Google Scholar] [CrossRef] [PubMed]
16. Saberian, H.; Yazdi, A.P.G.; Nejatian, M.; Bazsefidpar, N.; Mohammadian, A.H.; Rahmati, M.; Assadpour, E.; Jafari, S.M. Brewers’ spent grain as a functional ingredient in bakery, pasta, and cereal-based products. Future Foods 2024, 10, 100479. [Google Scholar] [CrossRef]
17. Siwal, S.S.; Sheoran, K.; Saini, A.K.; Vo, D.-V.N.; Wang, Q.; Thakur, V.K. Advanced thermochemical conversion technologies used for energy generation: Advancement and prospects. Fuel 2022, 321, 124107. [Google Scholar] [CrossRef]
18. Ahmed, A.; Bakar, M.S.; Razzaq, A.; Hidayat, S.; Jamil, F.; Amin, M.N.; Sukri, R.S.; Shah, N.S.; Park, Y.K. Characterization and thermal behavior study of biomass from invasive Acacia mangium species in Brunei preceding thermochemical conversion. Sustainability 2021, 13, 5249. [Google Scholar] [CrossRef]
19. Celaya, A.M.; Lade, A.T.; Goldfarb, J.L. Co-combustion of brewer’s spent grains and Illinois No. 6 coal: Impact of blend ratio on pyrolysis and oxidation behavior. Fuel Process. Technol. 2015, 129, 39–51. [Google Scholar] [CrossRef]
20. Manikandan, S.; Vickram, S.; Sirohi, R.; Subbaiya, R.; Krishnan, R.Y.; Karmegam, N.; Sumathijones, C.; Rajagopal, R.; Chang, S.W.; Ravindran, B.; et al. Critical review of biochemical pathways to transformation of waste and biomass into bioenergy. Bioresour. Technol. 2023, 372, 128679. [Google Scholar] [CrossRef]
21. Jin, Z.; Lan, Y.; Ohm, J.-B.; Gillespie, J.; Schwarz, P.; Chen, B. Physicochemical composition, fermentable sugars, free amino acids, phenolics, and minerals in brewers’ spent grains obtained from craft brewing operations. J. Cereal Sci. 2022, 104, 103413. [Google Scholar] [CrossRef]
22. Liu, L.-Y.; Xie, G.-J.; Xing, D.-F.; Liu, B.-F.; Ding, J.; Ren, N.-Q. Biological conversion of methane to polyhydroxyalkanoates: Current advances, challenges, and perspectives. Environ. Sci. Ecotechnol. 2020, 2, 100029. [Google Scholar] [CrossRef]
23. Awasthi, M.K.; Sar, T.; Gowd, S.C.; Rajendran, K.; Kumar, V.; Sarsaiya, S.; Li, Y.; Sindhu, R.; Binod, P.; Zhang, Z.; et al. A comprehensive review on thermochemical, and biochemical conversion methods of lignocellulosic biomass into valuable end product. Fuel 2023, 342, 127790. [Google Scholar] [CrossRef]
24. Olszewski, M.P.; Arauzo, P.J.; Maziarka, P.A.; Ronsse, F.; Kruse, A. Pyrolysis kinetics of hydrochars produced from brewer’s spent grains. Catalysts 2019, 9, 625. [Google Scholar] [CrossRef]
25. Zhu, F.; Du, B.; Xu, B. A critical review on production and industrial applications of beta-glucans. Food Hydrocoll. 2016, 52, 275–288. [Google Scholar] [CrossRef]
26. Mainali, K.; Mood, S.H.; Pelaez-Samaniego, M.R.; Sierra-Jimenez, V.; Garcia-Perez, M. Production and applications of N-doped carbons from bioresources: A review. Catal. Today 2023, 423, 114248. [Google Scholar] [CrossRef]
27. Xu, S.; Chen, J.; Peng, H.; Leng, S.; Li, H.; Qu, W.; Hu, Y.; Li, H.; Jiang, S.; Zhou, W.; et al. Effect of biomass type and pyrolysis temperature on nitrogen in biochar, and the comparison with hydrochar. Fuel 2021, 291, 120128. [Google Scholar] [CrossRef]
28. Qiu, S.; Yadav, M.P.; Chau, H.K.; Yin, L. Physicochemical characterization and rheological behavior of hemicelluloses isolated from sorghum bran, sorghum bagasse and sorghum biomass. Food Hydrocoll. 2019, 100, 105382. [Google Scholar] [CrossRef]
29. Thomas, K.R.; Rahman, P. Brewery wastes. Strategies for sustainability. A review. Asp. Appl. Biol. 2006, 80. [Google Scholar]
30. Yadav, M.P.; Hicks, K.B. Isolation, characterization and functionalities of bio-fiber gums isolated from grain processing by-products, agricultural residues and energy crops. Food Hydrocoll. 2018, 78, 120–127. [Google Scholar] [CrossRef]
31. Qiu, S.; Yadav, M.P.; Zhu, Q.; Chen, H.; Liu, Y.; Yin, L. The addition of corn fiber gum improves the long-term stability and retrogradation properties of corn starch. J. Cereal Sci. 2017, 76, 92–98. [Google Scholar] [CrossRef]
32. Mainali, K.; Garcia-Perez, M. Understanding organic N interactions with cellulose during pyrolysis to produce N-doped carbonaceous materials. J. Anal. Appl. Pyrolysis 2022, 169, 105791. [Google Scholar] [CrossRef]
33. Qiang, X.; YongLie, C.; QianBing, W. Health benefit application of functional oligosaccharides. Carbohydr. Polym. 2009, 77, 435–441. [Google Scholar] [CrossRef]
34. Cai, J.; He, Y.; Yu, X.; Banks, S.W.; Yang, Y.; Zhang, X.; Liu, R.; Bridgwater, A.V. Review of physicochemical properties and analytical characterization of lignocellulosic biomass. Renew. Sustain. Energy Rev. 2017, 76, 309–322. [Google Scholar] [CrossRef]
35. Castells, B.; Amez, I.; Medic, L.; Fernandez-Anez, N.; Garcia-Torrent, J. Study of lignocellulosic biomass ignition properties estimation from thermogravimetric analysis. J. Loss Prev. Process Ind. 2021, 71, 104425. [Google Scholar] [CrossRef]
36. Alizadeh, A.S.; Mousavi, M.; Labbafi, M. Synthesis and characterization of carboxymethyl cellulose from sugarcane bagasse. J. Food Process. Technol. 2017, 8, 687. [Google Scholar] [CrossRef]
37. Pasangulapati, V.; Ramachandriya, K.D.; Kumar, A.; Wilkins, M.R.; Jones, C.L.; Huhnke, R.L. Effects of cellulose, hemicellulose and lignin on thermochemical conversion characteristics of the selected biomass. Bioresour. Technol. 2012, 114, 663–669. [Google Scholar] [CrossRef]
38. Damartzis, T.; Zabaniotou, A. Thermochemical conversion of biomass to second generation biofuels through integrated process design—A review. Renew. Sustain. Energy Rev. 2011, 15, 366–378. [Google Scholar] [CrossRef]
39. Gao, W.; Lin, Z.; Chen, H.; Yan, S.; Huang, Y.; Hu, X.; Zhang, S. A review on N-doped biochar for enhanced water treatment and emerging applications. Fuel Process. Technol. 2022, 237, 107468. [Google Scholar] [CrossRef]
40. Bonifácio-Lopes, T.; José, A. Teixeira, and Manuela Pintado. Current extraction techniques towards bioactive compounds from brewer’s spent grain–A review. Crit. Rev. Food Sci. Nutr. 2020, 60, 2730–2741. [Google Scholar] [CrossRef]
41. Yadav, M.P.; Johnston, D.B.; Hotchkiss, A.T.; Hicks, K.B. Corn fiber gum: A potential gum arabic replacer for beverage flavor emulsion. Food Hydrocoll. 2007, 2, 1022–1030. [Google Scholar] [CrossRef]
42. Xu, F.; Yu, J.; Tesso, T.; Dowell, F.; Wang, D. Qualitative and quantitative analysis of lignocellulosic biomass using infrared techniques: A mini-review. Appl. Energy 2013, 104, 801–809. [Google Scholar] [CrossRef]
43. dos Santos Mathias, T.R.; de Mello, P.P.M.; Sérvulo, E.F.C. Solid wastes in brewing process: A review. J. Brew. Distill 2014, 5, 1–19. [Google Scholar]
44. El-Hendawy, A.-N.A. Variation in the FTIR spectra of a biomass under impregnation, carbonization and oxidation conditions. J. Anal. Appl. Pyrolysis 2006, 75, 159–166. [Google Scholar] [CrossRef]
Mainali K, Yadav MP, Sharma BK, Sarker MI, Ngo H, Hotchkiss A, Simon S. Isolation and Characterization of the Physiochemical Properties of Brewer’s Spent Grain. Agriculture. 2025; 15(1):47. https://doi.org/10.3390/agriculture15010047
Перевод статьи «Isolation and Characterization of the Physiochemical Properties of Brewer’s Spent Grain» авторов Mainali K, Yadav MP, Sharma BK, Sarker MI, Ngo H, Hotchkiss A, Simon S., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
































































































Комментарии (0)