Влияние Lactiplantibacillus plantarum на качество и микробиоту силоса из лядвенеца рогатого в карстовых регионах
С целью улучшения качества силоса из Lotus corniculatus L. (лядвенеца рогатого) и ускорения внедрения возделываемых сортов, в данном исследовании изучалось влияние Lactiplantibacillus plantarum на характеристики брожения, бактериальное сообщество и функциональные аспекты силоса.
Аннотация
Эксперимент включал контроль (CK) и обработку Lactiplantibacillus plantarum (LP). Отбор проб проводили на 3, 7, 15 и 45-й день ферментации для контроля питательной ценности и качества брожения, а также изменений в бактериальном сообществе на 3-й и 45-й день. Результаты показали, что по сравнению с контролем (CK) добавление LP значительно увеличило содержание молочной кислоты, сухого вещества и сырого протеина (p < 0,05), в то же время существенно снизив уровни водорастворимых углеводов, pH, NH3-N и уксусной кислоты (p < 0,05). Причем эффект от добавления LP был наиболее значительным после 45 дней ферментации. LP стимулировала рост полезных бактерий и подавляла вредные, и после 45 дней ферментации Lactiplantibacillus стала преобладающим родом и видом. Анализ метаболических путей выявил, что добавление LP усиливало метаболизм углеводов и улучшало функции репликации и репарации, трансляции, транскрипции и мембранного транспорта у бактериального сообщества. В заключение, добавление LP существенно повышает качество силоса из L. corniculatus и может служить эффективным методом для продвижения применения L. corniculatus в карстовых регионах.
1. Введение
Юго-Западный Китай является домом для одного из крупнейших сплошных карстовых регионов в мире [1,2]. Экологическая среда районов карстового каменистого опустынивания хрупкая, а серьезная эрозия почвы значительно затрудняет местное сельскохозяйственное развитие [3]. Преобладающий субтропический и тропический муссонный климат на юго-западе Китая способствует влажным условиям, которые благоприятствуют росту кормовых трав и развитию животноводства [4]. Возделывание многолетних кормовых трав не только увеличивает сельскохозяйственный доход, но и играет ключевую роль в сохранении почвы и воды в карстовых регионах, а также предотвращает опустынивание. Однако экстремальные экологические факторы, такие как опустынивание и эрозия почвы, приводят к нехватке кормов для травоядных в зимний и ранневесенний периоды, существенно ограничивая развитие животноводства в этих районах [5]. Приготовление сена и силоса служит эффективным средством для смягчения сезонной нехватки кормов. Однако производство сена часто страдает от осадков, грибковой контаминации и опадения листьев, что приводит к потерям сухого вещества (DM) и питательной ценности [5]. Силосование — это микробиологический процесс, который использует молочнокислые бактерии (LAB) для сбраживания растворимых углеводов в кормах в анаэробных условиях, преобразуя их в органические кислоты, в основном в молочную кислоту (LA). Этот процесс снижает pH силоса; когда pH достигает критического уровня (pH = 4,2), рост различных вредных микроорганизмов ингибируется, что позволяет сохранять питательные характеристики силоса в длительный период [6,7]. Силос не только позволяет максимально сохранить питательные вещества исходного сырья, но и обладает лучшей поедаемостью, что хорошо подходит для развития животноводства в карстовых регионах.
Микроорганизмы играют ключевую роль в улучшении качества силоса. Аэробные микроорганизмы, такие как клостридии и актиномицеты, остаются активными до тех пор, пока кислород не будет исчерпан, тем самым подавляя микробное брожение. На поздних стадиях производства силоса факультативно-анаэробные микроорганизмы снижают pH и способствуют росту кислотоустойчивых LAB, которые в конечном итоге доминируют в процессе брожения [8]. Добавление LAB увеличивает производство молочной кислоты, тем самым снижая уровень pH. Lactiplantibacillus plantarum, гомоферментативная LAB, сбраживает растворимые сахара через гликолиз, улучшая качество брожения силоса [7]. Учитывая, что процесс брожения в значительной степени зависит от взаимодействий между различными видами бактерий и что эти сообщества тесно связаны с качеством брожения, крайне важно анализировать изменения характеристик брожения и микробного состава во время производства силоса [6]. Развитие технологии секвенирования полноразмерных ампликонов третьего поколения способствует лучшему пониманию процесса силосования и улучшению качества силоса [9].
Lotus corniculatus L., также известный как лядвенец рогатый, является травянистым растением, принадлежащим к семейству Бобовые (Fabaceae). Он обладает высокой поедаемостью и устойчивостью к бедным почвенным условиям, что делает его одной из самых известных в мире многолетних бобовых кормовых культур [10,11]. Поскольку спрос на высококачественные бобовые корма в карстовых регионах увеличился, площадь возделывания Lotus corniculatus ежегодно расширяется. Хотя он богат сырым протеином (17,1% DM), Lotus corniculatus имеет низкое содержание растворимых сахаров (5,89% DM) и низкое количество молочнокислых бактерий, что затрудняет успешное силосование [12]. Исследования показывают, что роды LAB являются второстепенным компонентом в силосе из люцерны, но становятся доминирующими при добавлении коммерческих LAB [13,14]. Следовательно, мы предполагаем, что (1) добавление Lactiplantibacillus plantarum может улучшить качество силоса из Lotus corniculatus и (2) Lactiplantibacillus plantarum улучшает качество силоса, влияя на разнообразие и функциональность бактериальных сообществ внутри силоса. Результаты данного исследования предоставляют теоретическую основу для продвижения и использования Lotus corniculatus.
2. Материалы и методы
2.1. Приготовление силоса
Lotus corniculatus L. сорт «Цяньгуй № 1» возделывали в деревне Ронглей, уезд Чаншунь, провинция Гуйчжоу (долгота 106°26′48.14″, широта 25°58′45.92″), в районе, характеризующемся субтропическим муссонным климатом. 25 сентября 2023 года траву скосили на высоте 10 см над землей. Убранную массу в тот же день доставили в лабораторию и измельчили на кусочки длиной 1–2 см. Часть материала использовали для анализа химического состава и микробного разнообразия, а остальную часть засилосовали. Таблица 1 представляет химический состав свежего Lotus corniculatus.
Таблица 1. Химические характеристики свежего Lotus corniculatus.
Экспериментальные варианты включали (1) LP (добавление Lactiplantibacillus plantarum в дозе 10^5 КОЕ/г сырого веса) (Zhongke Jiayi Biotechnology, Шаньдун, Китай) и (2) CK (контроль, дистиллированная вода). Добавки растворяли в деионизированной воде, при этом на килограмм корма Lotus corniculatus добавляли 15 мл раствора; контрольная группа получала эквивалентный объем деионизированной воды. Примерно 300 г каждой смеси упаковывали в полиэтиленовый пакет размером 30 см × 25 см и вакуумировали, получив в общей сложности 24 пакета. Пробы из каждого варианта вскрывали на 3, 7, 15 и 45 день силосования. На каждом сроке для каждого варианта случайным образом отбирали три пакета для анализа химического состава и параметров брожения, а бактериальное сообщество анализировали в пробах, отобранных на 3 и 45 день.
2.2. Анализ качества брожения
Для оценки характеристик брожения силоса из каждого пакета брали 10 г свежего силоса, смешивали с 90 мл стерильной воды и хранили при 4 °C в течение 24 ч. Затем смесь фильтровали через четыре слоя медицинской марли. pH надосадочной жидкости немедленно измеряли с помощью pH-метра (PHS-3E, Shanghai INESA Scientific Instrument Co., Ltd., Шанхай, Китай). Впоследствии молочную кислоту (LA), уксусную кислоту (AA), пропионовую кислоту (PA) и масляную кислоту (BA) измеряли с помощью высокоэффективной жидкостной хроматографии (HPLC) с хроматографической колонкой KC-811 (Shodex; Shimadzu Co., Ltd., Токио, Япония); SPD составляла 210 нм, температура колонки — 50 °C, а скорость потока — 1 мл/мин [15]. Аммиачный азот (NH3-N) измеряли с помощью фенольного колориметрического метода [16].
2.3. Анализ химического состава
Оставшиеся образцы силоса из каждого пакета сушили в сушильном шкафу при 65 °C в течение 48 ч для определения веса сухого вещества (DM). После взвешивания высушенные образцы размалывали и просеивали через сито с размером ячеек 1 мм. Содержание сырого протеина (CP) измеряли с помощью азотного анализатора Кьельдаля (Kjeltec 8400, FOSS, Хиллерёд, Дания) [17]. Нейтрально-детергентную клетчатку (NDF, без α-амилазы) и кислотно-детергентную клетчатку (ADF) анализировали с использованием метода, описанного в [18]. Содержание водорастворимых углеводов (WSC) определяли с помощью антронового метода [19].
2.4. Анализ бактериального сообщества
Геномную ДНК из образцов экстрагировали с помощью метода CTAB. К пробирке Эппендорфа на 2 мл добавляли 1000 мкл лизирующего раствора CTAB, затем добавляли лизоцим. Затем 2 г свежих образцов добавляли в лизирующий раствор, и смесь инкубировали на водяной бане при 65 °C. Надосадочную жидкость центрифугировали при 12000 об/мин в течение 10 мин с фенолом (pH 8,0):хлороформом:изоамиловым спиртом (25:24:1). Этот этап экстракции повторяли с использованием хлороформа и изоамилового спирта. После этого к надосадочной жидкости добавляли изопропанол, и смесь инкубировали при -20 °C для осаждения ДНК. После центрифугирования надосадочную жидкость удаляли, а ДНК растворяли в деионизированной воде. Наконец, добавляли 1 мкл РНКазы А для переваривания РНК. Бактериальную 16S рРНК амплифицировали с помощью ПЦР с праймерами AGAGTTTGATCCTGGCTCAG и GNTACCTTGTTACGACTT (R). Секвенирование проводили на платформе PacBio, первоначальное секвенирование выполняла компания Inner Mongolia Baianle Biotechnology Co., Ltd. во Внутренней Монголии, Китай. Наконец, анализ α-разнообразия и β-разнообразия, а также анализ линейного дискриминантного анализа эффекта (LEfSe) (с использованием пороговых значений LDA > 3 и p < 0,05) были выполнены на платформе Novogene, и были спрогнозированы функциональные профили бактериальных сообществ.
2.5. Статистический анализ
Для статистического анализа данных использовали программное обеспечение IBM SPSS 26.0 (SPSS Inc., Чикаго, Иллинойс, США). Проводили однофакторный и двухфакторный дисперсионный анализ для оценки эффектов добавок и времени. К средним значениям для каждой добавки и временной точки применяли множественный сравнительный тест Дункана. Статистическую значимость определяли при p < 0,05. Коэффициент корреляции Спирмена между популяциями бактерий и качеством брожения рассчитывали с помощью SPSS. Все графики были созданы с использованием GraphPad Prism 9.5.
3. Результаты
3.1. Химический состав Lotus corniculatus L. после силосования
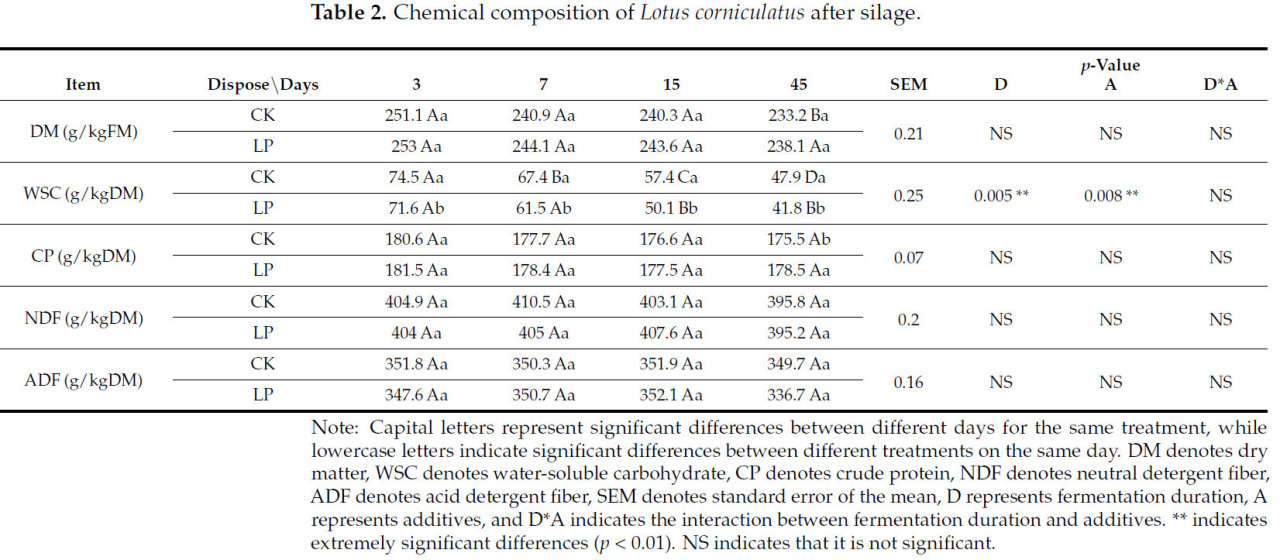
На химический состав силоса влияли продолжительность ферментации (D), добавки (A) и их взаимодействие (DA) (Таблица 2). Продолжительность ферментации (D) существенно влияла на водорастворимые углеводы (WSC) (p < 0,05), и добавки (A) также значительно влияли на WSC (p < 0,05). С увеличением времени брожения содержание сухого вещества (DM) в контрольном силосе (CK) постепенно снижалось, со значительным снижением на 45 день по сравнению с другими временными точками. Содержание сухого вещества (DM) в силосе, обработанном LP, стабильно было выше, чем в силосе CK во всех точках отбора проб.
Таблица 2. Химический состав Lotus corniculatus после силосования.
В течение всего периода брожения с 3 по 45 день содержание водорастворимых углеводов (WSC) во всех образцах силоса значительно снизилось (p < 0,05), при этом группа CK стабильно демонстрировала более высокий уровень WSC, чем группа, обработанная LP (p < 0,05). Самое низкое содержание WSC для обработки LP было зафиксировано на уровне 41,8 г/кгDM на 45 день, в то время как самое высокое содержание WSC для обработки CK наблюдалось на уровне 74,5 г/кгDM после 3 дней брожения (Таблица 2).
Что касается содержания сырого протеина (CP), силос LP стабильно показывал более высокие уровни, чем силос CK в течение всего процесса брожения (Таблица 2). В частности, содержание CP в силосе, обработанном LP, достигло 178,5 г/кгDM на 45 день, значительно превзойдя показатель при обработке CK. Однако существенных изменений в нейтрально-детергентной клетчатке (NDF) и кислотно-детергентной клетчатке (ADF) не наблюдалось во всех группах обработки в течение процесса силосования, что указывает на то, что добавление LP не значительно изменяло содержание NDF и ADF.
3.2. Характеристики брожения Lotus corniculatus L. после силосования
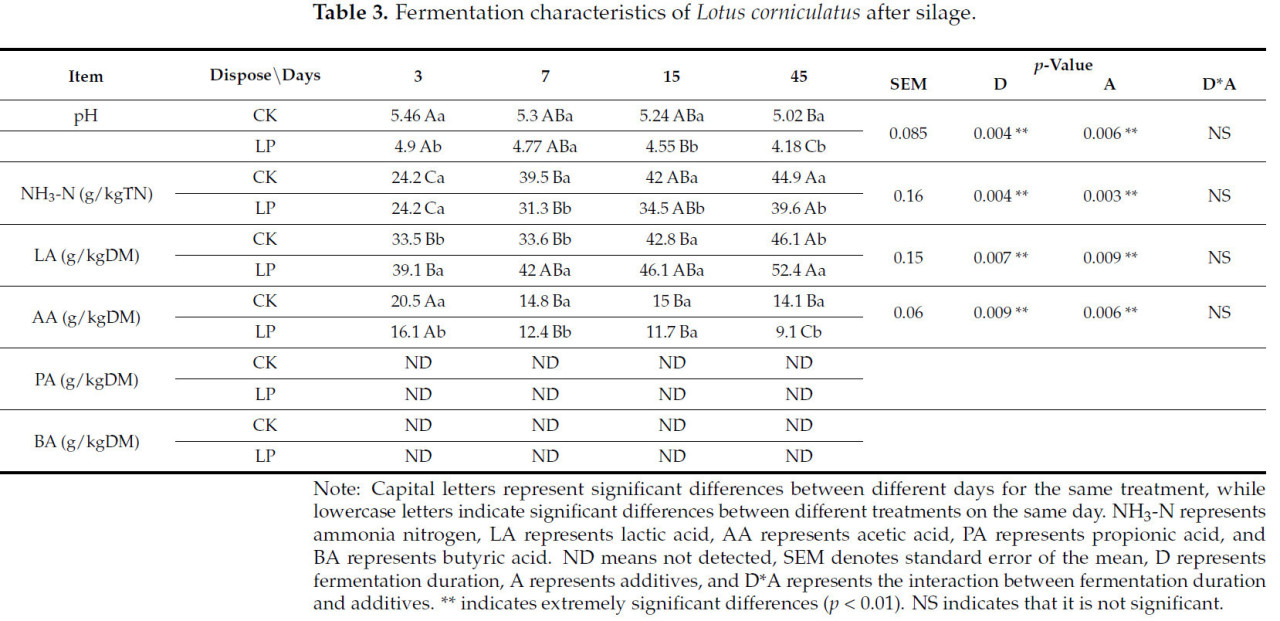
На характеристики брожения силоса из Lotus corniculatus влияли продолжительность ферментации (D), добавки (A) и их взаимодействие (DA) (Таблица 3). Как D, так и A оказывали чрезвычайно значительное влияние на pH, аммиачный азот (NH3-N), молочную кислоту (LA) и уксусную кислоту (AA) (p < 0,01). В процессе брожения с 3 по 45 день pH во всех вариантах показал значительную тенденцию к снижению (p < 0,05). На 3, 15 и 45 день брожения pH в группе LP был значительно ниже, чем в группе CK (p < 0,05), с самым низким pH 4,18, зарегистрированным для обработки LP на 45 день.
Таблица 3. Характеристики брожения Lotus corniculatus после силосования.
Уровни NH3-N показали значительно разные тенденции среди групп обработки (p < 0,05). По мере увеличения времени брожения уровни NH3-N во всех группах обработки показали значительную тенденцию к росту (p < 0,05). Уровень NH3-N в группе LP был значительно ниже, чем в группе CK (p < 0,05), достигнув наименьшего значения 39,6 г/кгTN на 45 день брожения (Таблица 3).
В течение периода брожения с 3 по 45 день как группа CK, так и группа LP показали значительное увеличение уровня LA (p < 0,05), причем содержание LA в группе LP было значительно выше, чем в группе CK (p < 0,05). Самое высокое содержание LA, зарегистрированное в группе LP, составило 52,4 г/кгDM на 45 день (Таблица 3).
И наоборот, содержание AA показало значительную тенденцию к снижению во всех группах обработки в течение всего периода брожения (p < 0,05). Содержание AA в группе LP было значительно ниже, чем в группе CK (p < 0,05). Группа CK имела самое высокое содержание AA 20,5 г/кгDM на 3 день, в то время как группа LP зафиксировала самое низкое содержание AA 9,1 г/кгDM на 45 день (Таблица 3).
3.3. Изменения в бактериальных сообществах во время силосования Lotus corniculatus L.
3.3.1. Альфа-разнообразие
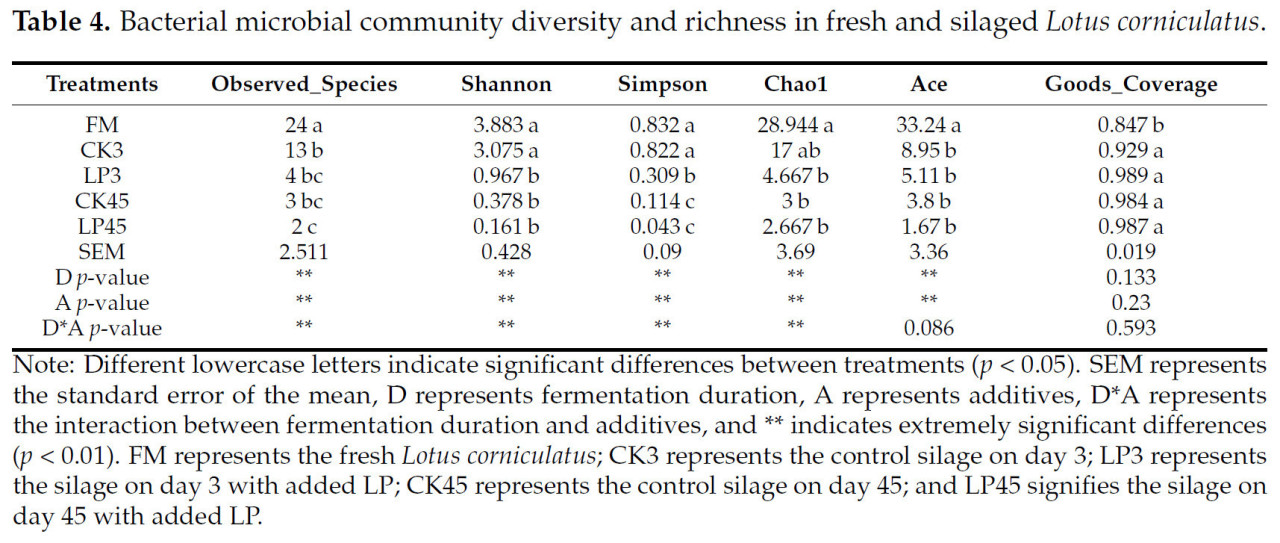
Индекс Goods coverage для всех групп обработки (исключая FM) был выше 0,97, что указывает на высокий уровень охвата при отборе проб (Таблица 4). Индексы микробного разнообразия, наблюдаемые в свежих образцах Lotus corniculatus (FM), были значительно выше, чем в вариантах силоса, с наибольшими значениями для наблюдаемых видов, Шеннона, Симпсона, Чао1 и Эйса. Во всех группах силоса эти индексы показали значительные изменения (p < 0,05). В частности, индексы для силоса на 3 день были выше, чем на 45 день. Дополнительно, индексы Шеннона и Симпсона для группы LP были значительно ниже, чем для группы CK.
Таблица 4. Разнообразие и богатство бактериального сообщества в свежем и засилосованном Lotus corniculatus.
3.3.2. Анализ PCoA
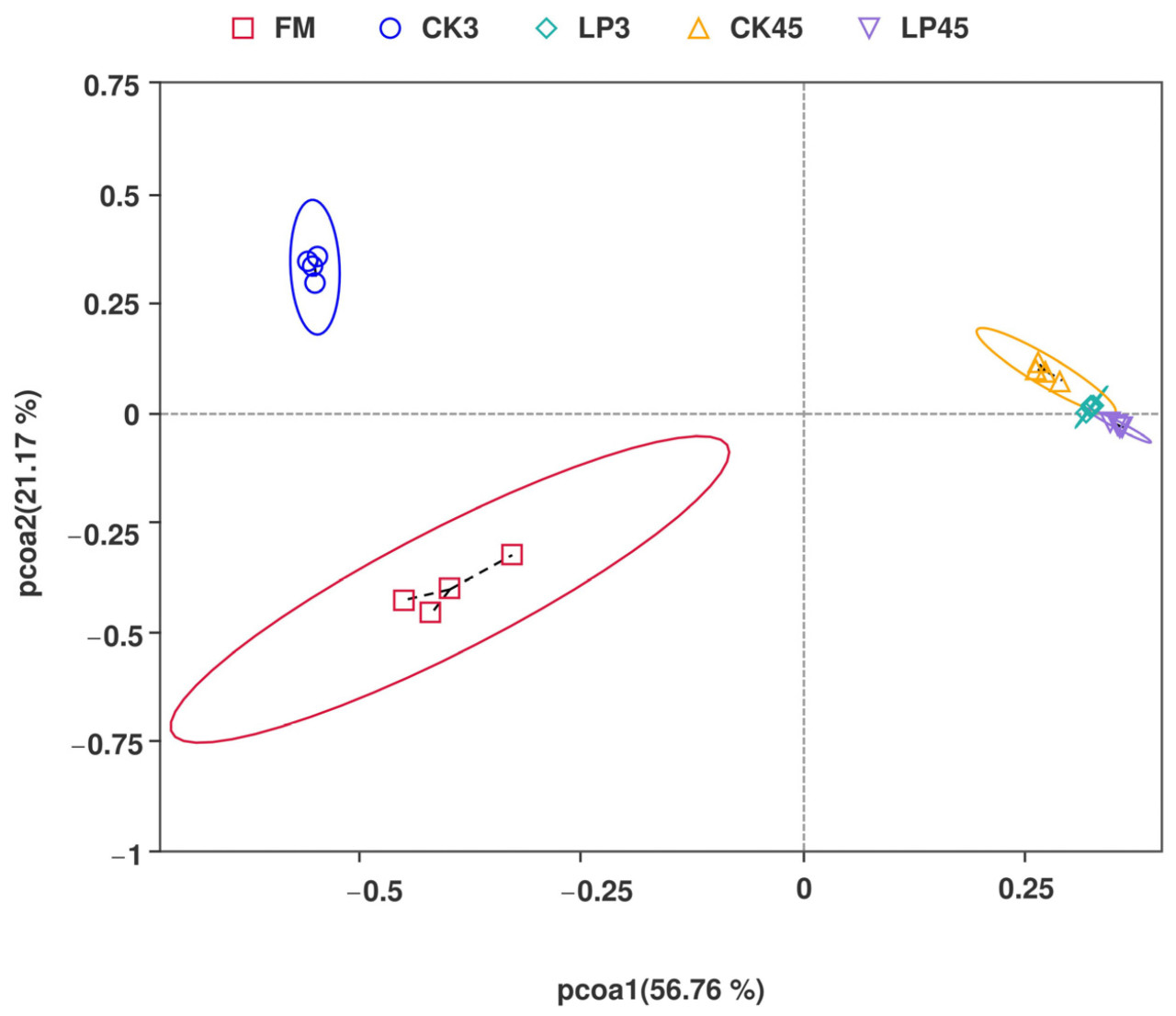
Анализ главных координат (PCoA) выявил, что первая главная координата (PCoA1) объясняла 56,76% дисперсии, а вторая главная координата (PCoA2) — 21,17%, что в сумме дало 77,93% общей дисперсии. Свежие образцы Lotus corniculatus (FM) в основном распределялись в третьем квадранте, в то время как контрольные образцы на 3 день (CK3) располагались во втором квадранте. Как образцы LP на 3 день (LP3), так и контрольные образцы на 45 день (CK45) в основном концентрировались в первом квадранте, демонстрируя четкое разделение. Примечательно, что образцы LP на 45 день (LP45) располагались в четвертом квадранте (Рисунок 1).
Рисунок 1. Анализ главных координат (PCoA) бактериальных сообществ в свежем и засилосованном Lotus corniculatus. FM представляет свежий Lotus corniculatus; CK3 представляет контрольный силос на 3 день; LP3 представляет силос на 3 день с добавлением LP; CK45 представляет контрольный силос на 45 день; и LP45 означает силос на 45 день с добавлением LP.
3.3.3. Состав бактериального сообщества
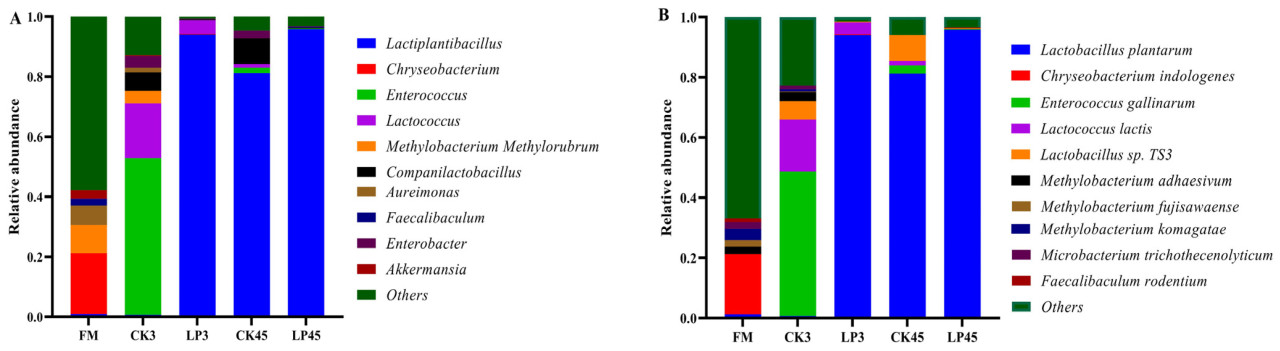
В процессе силосного брожения преобладающие микроорганизмы играют ключевую роль в определении качества брожения силосного корма. В этом исследовании основные роды, идентифицированные в свежем образце Lotus corniculatus (FM), включали Chryseobacterium (20,24%), Methylobacterium-Methylorubrum (9,38%) и Aureimonas (6,42%), в то время как количество Lactiplantibacillus plantarum было относительно низким и составляло 0,99%. В контрольной группе после 3 дней брожения (CK3) преобладающими родами были Enterococcus (52,1%), Lactococcus (18,27%), Companilactobacillus (6,18%), Methylobacterium-Methylorubrum (4,19%) и Enterobacter (3,95%). Примечательно, что добавление Lactiplantibacillus plantarum привело к значительному увеличению количества Lactiplantibacillus plantarum. В группе, обработанной Lactiplantibacillus plantarum, через 45 дней (LP45) количество Chryseobacterium, Methylobacterium-Methylorubrum и Aureimonas значительно снизилось до 0%, в то время как Lactiplantibacillus plantarum резко увеличилось с 0,99% до 95,8%. По сравнению с контрольной группой после 3 дней брожения (CK3), относительная численность Enterococcus, Lactococcus, Methylobacterium-Methylorubrum и Enterobacter заметно снизилась, уменьшившись с 52,1% до 0,25%, с 18,27% до 0%, с 4,19% до 0% и с 3,95% до 0,24% соответственно (Рисунок 2A).
Рисунок 2. Относительная численность бактериальных родов (A) и видов (B) в свежем и засилосованном Lotus corniculatus после 3 и 45 дней брожения. FM представляет свежий Lotus corniculatus; CK3 представляет контрольный силос на 3 день; LP3 представляет силос на 3 день с добавлением LP; CK45 представляет контрольный силос на 45 день; и LP45 означает силос на 45 день с добавлением LP.
На уровне видов основными видами в свежем образце Lotus corniculatus (FM) были Chryseobacterium indologenes (23,3%), Methylobacterium komagatae (3,7%) и Methylobacterium adhaesivum (2,46%). В контрольной группе после 3 дней брожения (CK3) преобладающими видами были Enterococcus gallinarum (47,9%), Lactococcus lactis (17,3%) и Lactobacillus sp. TS3 (6,17%). По сравнению со свежими образцами, количество Lactiplantibacillus plantarum значительно увеличилось в силосе LP45, увеличившись с 1,23% до 81,23% после 45 дней без добавления Lactiplantibacillus plantarum. И наоборот, относительная численность Chryseobacterium indologenes, Methylobacterium adhaesivum и Methylobacterium komagatae значительно снизилась, упав до 0% для всех трех.
По сравнению с контрольной группой после 3 дней брожения (CK3), количество Lactiplantibacillus plantarum значительно увеличилось в обработанных Lactiplantibacillus plantarum образцах после 45 дней, увеличившись с 0,7% до 95,8%. В то же время относительная численность Enterococcus gallinarum, Lactococcus lactis, Lactobacillus sp. TS3 и Methylobacterium adhaesivum значительно снизилась, уменьшившись с 47,9% до 0,24%, с 17,3% до 0%, с 6,17% до 0,24% и с 2,96% до 0% соответственно.
3.3.4. Анализ LEfSe
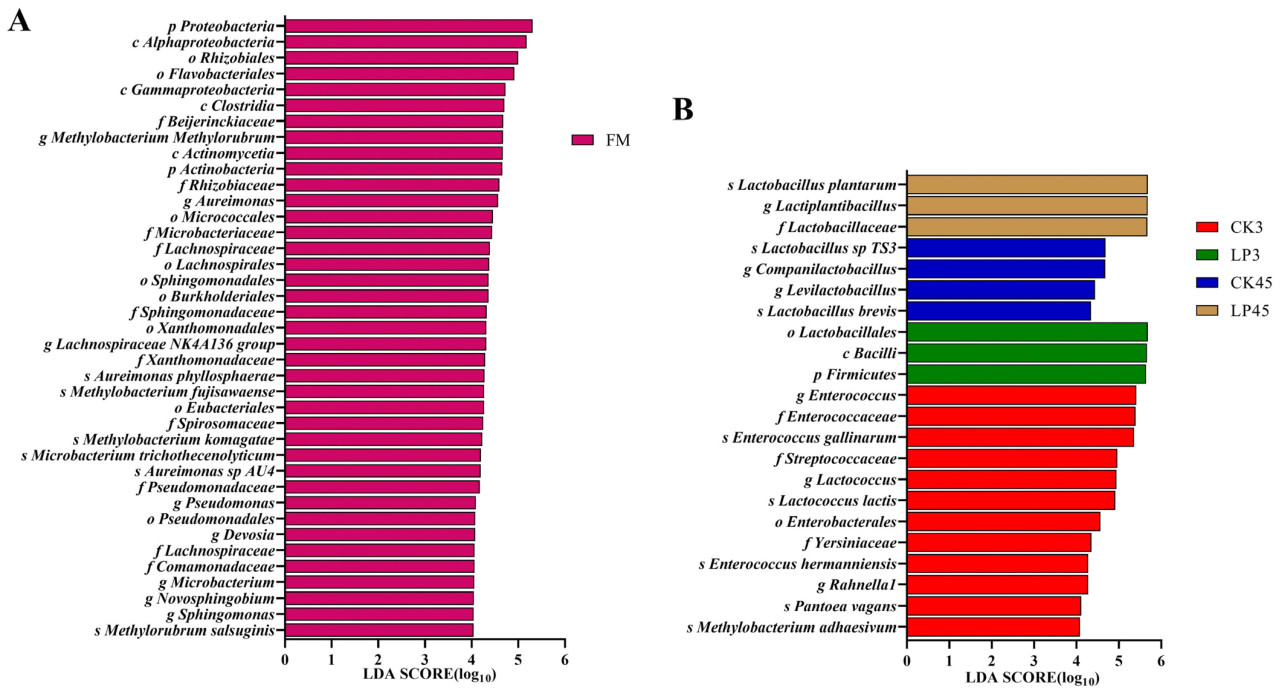
Анализ LEfSe был использован для оценки различий в бактериальных сообществах среди свежих образцов Lotus corniculatus и силоса после 3 и 45 дней брожения, идентифицируя специфические таксоны бактерий для каждой группы обработки (LDA score > 4). Присутствие Lactiplantibacillus plantarum значительно влияло на изменения в бактериальном сообществе силоса (Рисунок 3). В свежем материале (FM) 39 бактериальных таксонов были значительно обогащены, причем наивысший балл LDA был присвоен p_Proteobacteria. В обработке CK3 12 бактериальных таксонов были значительно обогащены, во главе с g_Enterococcus с наивысшим баллом LDA. Обработка LP3 показала обогащение тремя таксонами, причем o_Lactobacillales имел наивысший балл. Для CK45 четыре бактериальных таксона были значительно обогащены, причем s_Lactobacillus sp. TS3 записал наивысший балл. Обработка LP45 показала обогащение тремя таксонами, с заметным преобладанием s_Lactiplantibacillus plantarum с наивысшим баллом LDA. Эти результаты подчеркивают влияние разного времени брожения и добавления специфических добавок на структуру бактериального сообщества в силосе, в частности роль Lactiplantibacillus plantarum в усилении полезных бактериальных популяций во время брожения.
Рисунок 3. Сравнение микробных вариаций в свежих образцах Lotus corniculatus (A) и силосе после 3 дней и 45 дней (B) с использованием онлайн-инструмента LEfSe. Этот анализ идентифицирует индикаторные микроорганизмы в сообществе силоса с баллами линейного дискриминантного анализа (LDA) 4 или выше при разных обработках. FM представляет свежий Lotus corniculatus; CK3 представляет контрольный силос на 3 день; LP3 представляет силос на 3 день с добавлением LP; CK45 представляет контрольный силос на 45 день; и LP45 означает силос на 45 день с добавлением LP.
3.4. Взаимосвязь между качеством силоса и бактериальными сообществами
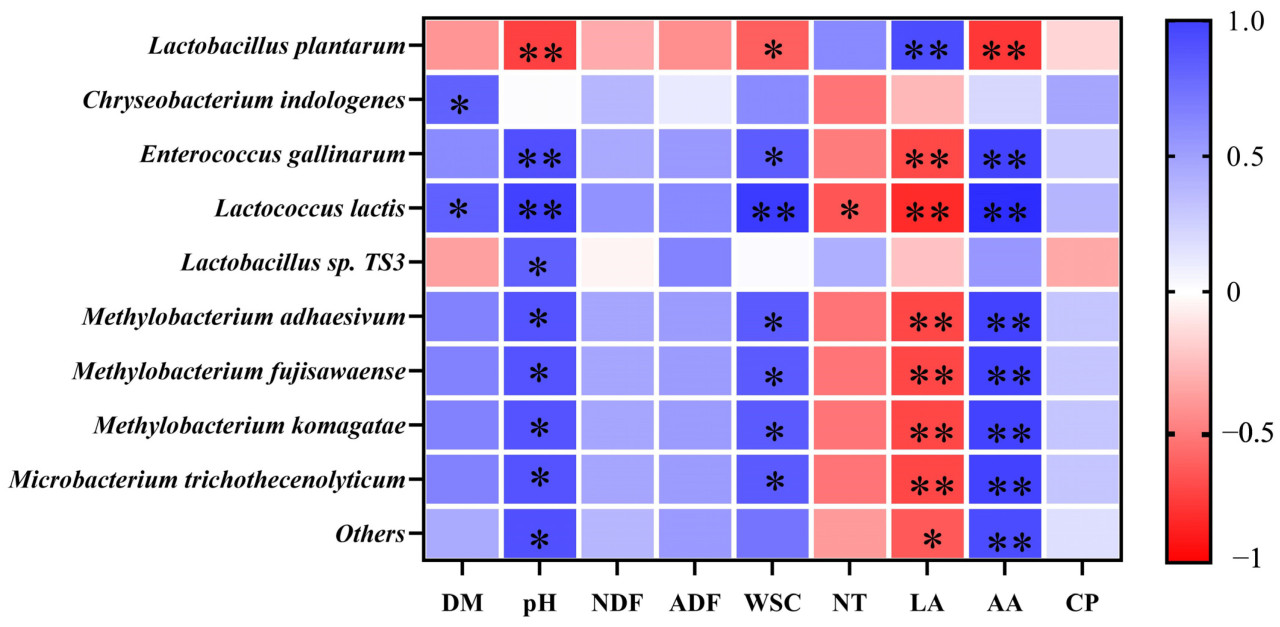
Продукты брожения обычно являются результатом взаимодействий между резидентными микроорганизмами. Корреляционный анализ между бактериальными сообществами и продуктами брожения помогает улучшить оценку эффективности силосования Lotus corniculatus. Взаимосвязь между качеством брожения силоса из Lotus corniculatus на 3 и 45 день и относительной численностью видов бактерий анализировали с помощью корреляции Спирмена (Рисунок 4). Результаты показали, что pH, уксусная кислота (AA) и водорастворимые углеводы (WSC) демонстрировали высоко значительную или значительную отрицательную корреляцию с Lactiplantibacillus plantarum (p < 0,01). В contrast, эти параметры показали значительную положительную корреляцию с другими видами бактерий (p < 0,05), за исключением Chryseobacterium indologenes. И наоборот, корреляция между молочной кислотой (LA) и численностью бактерий продемонстрировала противоположную тенденцию. LA была значительно положительно коррелирована с Lactiplantibacillus plantarum (p < 0,01), в то время как она показала значительную отрицательную корреляцию с большинством других бактерий, за исключением Chryseobacterium indologenes и Lactobacillus sp. TS3 (p < 0,01).
Рисунок 4. Тепловая карта, показывающая корреляцию между качеством брожения силоса и относительной численностью видов бактерий. DM представляет сухое вещество, NDF представляет нейтрально-детергентную клетчатку, ADF представляет кислотно-детергентную клетчатку, WSC представляет водорастворимые углеводы, NT представляет аммиачный азот, LA представляет молочную кислоту, AA представляет уксусную кислоту, а CP представляет сырой протеин. p < 0,05; p < 0,01.
3.5. Предсказание PICRUSt потенциальных функций бактериального сообщества
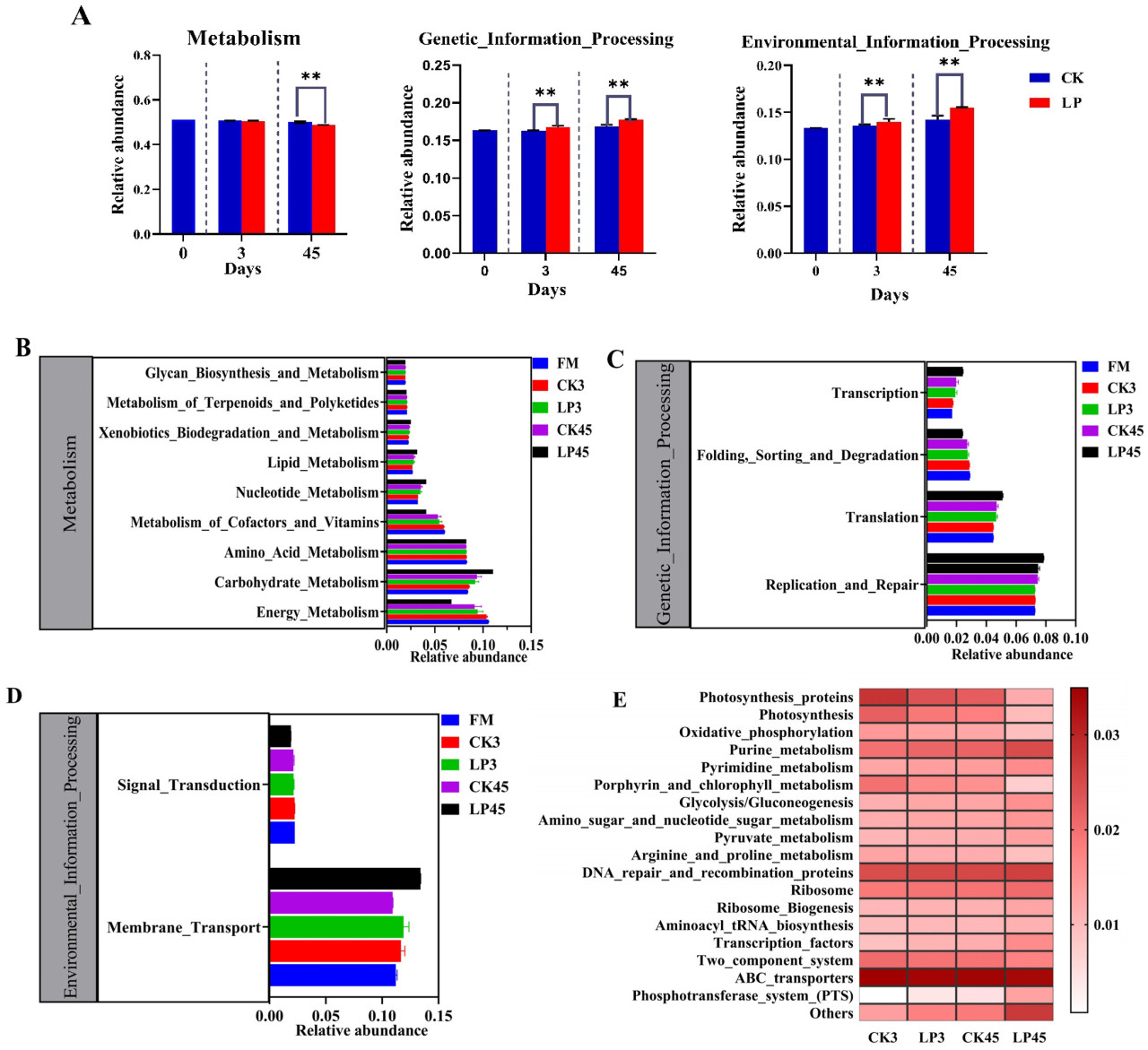
Это исследование использовало PICRUSt для прогнозирования потенциальных функций бактериального сообщества, классифицируя их на три уровня путей. На первом уровне путей категория метаболизма в группе LP45 была значительно ниже, чем в группе CK45 (p < 0,05). Как 3-дневные, так и 45-дневные группы LP показали значительно более высокие уровни обработки генетической информации и обработки экологической информации по сравнению с группами CK (Рисунок 5A).
Рисунок 5. Предсказание потенциальных функций бактериальных сообществ в свежих образцах Lotus corniculatus и силосе после 3 и 45 дней брожения с использованием PICRUSt. (A) Предсказанные пути KEGG первого уровня; (B–D) предсказанные пути KEGG второго уровня. (E) Тепловая карта относительной численности для предсказанных путей KEGG третьего уровня. Указывает на значительную разницу. (p < 0,05).
На втором уровне путей метаболизм силоса в основном был сосредоточен на энергетическом метаболизме, метаболизме углеводов и метаболизме аминокислот. Группа FM имела наибольшую численность энергетического метаболизма, в то время как группа LP45 имела самую низкую. И наоборот, группа LP45 показала наибольшую численность метаболизма углеводов, причем группа FM показала самые низкие уровни (Рисунок 5B). В рамках обработки генетической информации обработка LP45 продемонстрировала более высокую численность репликации и репарации и трансляции (Рисунок 5C). Для обработки экологической информации группа LP45 также показала повышенные уровни мембранного транспорта (Рисунок 5D).
На третьем уровне путей образцы силоса из обработок CK3, LP3, CK45 и LP45 были относительно обогащены ABC-транспортерами. Примечательно, что группа обработки LP45 показала более высокую относительную численность метаболизма пуринов, метаболизма пиримидинов, гликолиза/глюконеогенеза и белков репарации и рекомбинации ДНК по сравнению с другими обработками (Рисунок 5E).
4. Обсуждение
Чтобы улучшить качество силоса из Lotus corniculatus L. и ускорить продвижение возделываемых сортов, это исследование изучает влияние Lactiplantibacillus plantarum на характеристики брожения, состав бактериального сообщества и функциональную динамику силоса.
4.1. Изменения химического состава и характеристик брожения Lotus corniculatus L. во время силосования
Потеря сухого вещества (DM) в силосном корме объясняется разложением питательных веществ, при котором аэробные микроорганизмы преобразуют углеводы в воду, диоксид углерода и тепло. В этом исследовании DM стабильно снижалась с увеличением времени силосования. Примечательно, что содержание DM в группе, обработанной Lactiplantibacillus plantarum (LP), было выше, чем в контрольной группе (CK), что указывает на то, что добавление LP эффективно ограничивает рост нежелательных микроорганизмов в силосе из Lotus corniculatus и снижает потребление питательных веществ [20]. Предыдущие исследования показали, что для успешного силосного брожения требуется 5% водорастворимых углеводов (WSC) в DM [21]. В нашем исследовании содержание WSC в Lotus corniculatus составляло 75,3% DM, что обеспечивает необходимые условия для производства качественного силоса [22].
Силосное брожение зависит от молочнокислых бактерий, быстро разлагающих WSC до органических кислот, тем самым снижая pH и подавляя активность аэробных микроорганизмов [23]. Среди этих органических кислот молочная кислота (LA) является одним из основных продуктов брожения и наиболее важной органической кислотой для снижения pH [24]. В нашем исследовании, по мере увеличения времени брожения, содержание WSC в силосе из Lotus corniculatus показало значительное снижение, в то время как pH значительно снизился, а уровни LA заметно увеличились. Более того, группа LP показала значительно более низкие значения WSC и pH, чем группа CK, и уровни LA в группе LP были значительно выше (p < 0,05), что согласуется с выводами [25]. Это явление предполагает, что во время процесса силосования WSC в Lotus corniculatus быстро разлагаются, что приводит к значительному производству молочной кислоты. Добавление LP обычно приводит к более высокому потреблению WSC и большему производству молочной кислоты, быстро снижая pH для поддержания необходимой кислой анаэробной среды для брожения [20,26]. Этот вывод согласуется с более высоким содержанием сырого протеина (CP) в группе LP по сравнению с группой CK, что дальнейшим образом подтверждает, что добавление LP способствует более быстрому поддержанию необходимой кислой среды для брожения, тем самым подавляя протеолиз и снижая потерю сырого протеина [27]. Более того, pH силоса из Lotus corniculatus с добавлением LP через 45 дней достиг 4,18, что соответствует стандарту pH для качественного силоса [28,29].
В нашем исследовании не наблюдалось существенных изменений в уровнях нейтрально-детергентной клетчатки (NDF) и кислотно-детергентной клетчатки (ADF) среди различных групп обработки, что указывает на то, что добавление LP не значительно изменяет содержание NDF и ADF в Lotus corniculatus. Этот вывод согласуется с результатами, полученными в исследованиях силоса из бумажной шелковицы [25] и смешанного силоса из люцерны и востреца китайского [30], но противоречит выводам из силоса из многолетнего райграса [30], возможно, из-за различий в используемых силосных материалах.
Уксусная кислота (AA) служит промотором аэробной стабильности во время силосования и эффективным ингибитором грибов. В этом исследовании AA присутствовала на различных стадиях силосования, что согласуется с выводами из [31]. Начальные стадии силосования показали более высокие уровни AA, что может способствовать снижению численности нежелательных микроорганизмов в ранней фазе брожения [32]. В нашем исследовании содержание AA в группе CK3 было самым высоким, возможно, из-за повышенных уровней Enterococcus gallinarum и Lactococcus lactis, так как Enterococcus gallinarum может производить уксусную кислоту на ранних стадиях силосования, тем самым снижая рост нежелательных микроорганизмов.
Соотношение аммиачного азота (NH3-N) к общему азоту (TN) служит индикатором деградации белка. В силосном корме NH3-N обычно генерируется из декарбоксилирования и дезаминирования аминокислот, вызванных активностью микробных и растительных протеиназ. Накопление NH3-N снижает питательную ценность силосного корма [33]. В нашем исследовании уровни NH3-N в силосе из Lotus corniculatus были определены ниже порогового уровня 80 г/кгTN [19]. Примечательно, что после 7 дней силосования содержание NH3-N в группе LP было значительно ниже, чем в контрольной группе. Этот вывод указывает на то, что добавление LP может способствовать раннему производству значительных количеств молочной кислоты в силосе из Lotus corniculatus, тем самым подавляя протеолиз, а также активность микробных ферментов и Enterobacter, приводя к снижению концентрации NH3-N [34]. Это наблюдение было подтверждено с помощью анализа состава бактериального сообщества.
4.2. Уровни разнообразия бактериальных сообществ в Lotus corniculatus L. во время силосования
Ген 16S рРНК является высококонсервативным фрагментом, встречающимся как у бактерий, так и у архей, с определенной степенью изменчивости. Секвенирование гена 16S рРНК позволяет идентифицировать различные бактериальные роды и виды, присутствующие в микробном сообществе, а также оценить их относительную численность [24]. Альфа-разнообразие отражает бактериальную численность и видовое разнообразие в пределах одного образца. Observed_species представляет количество видов в образце. Для оценки бактериальной численности использовались индексы Chao1 и Ace, в то время как индексы Шеннона и Симпсона использовались для оценки видового разнообразия. Индекс Шеннона основан на информационной энтропии; больший индекс Шеннона указывает на большую неопределенность, предполагая большее разнообразие в сообществе из-за большего количества неизвестных факторов. Goods_coverage, который относится к охвату микробов, также используется для оценки полноты выборки. Более высокое значение указывает на меньшую вероятность того, что в образце существуют новые, неизмеренные виды [35]. Индекс Goods coverage для различных обработок силоса Lotus corniculatus стабильно был выше 0,97, что указывает на то, что процесс секвенирования достаточно охарактеризовал динамические изменения в бактериальном сообществе [36]. Было обнаружено, что свежие образцы (FM) благоприятствуют пролиферации аэробных микроорганизмов из-за их аэробной и нейтральной среды, что приводит к более высоким индексам наблюдаемых видов, Симпсона, Чао1 и Шеннона по сравнению с силосным кормом [29]. В течение силосования, с 3 по 45 день, индексы альфа-разнообразия непрерывно снижались. Добавление Lactiplantibacillus plantarum (LP) способствовало значительному развитию кислой и анаэробной среды в силосе, дальнейшим образом приводя к снижению бактериального разнообразия. К 45 дню силосования группа LP показала самые низкие индексы разнообразия, что указывает на стабилизацию процесса силосного брожения.
Анализ главных координат (PCoA) выявил, что добавление LP и продолжительность силосования значительно изменили разнообразие микробного сообщества. Примечательно, что степень разделения из-за времени силосования была значительно больше, чем вызванная добавлением LP, что предполагает, что продолжительность силосования оказала более выраженное влияние на бактериальное сообщество Lotus corniculatus, чем добавки [37].
Преобладающим бактериальным родом в свежих образцах Lotus corniculatus был Chryseobacterium, аэробная бактерия, обычно встречающаяся на поверхностях растений и известная своей способностью ингибировать некоторые фитопатогенные бактерии [38]. Основным видом был Chryseobacterium indologenes, способный разлагать сложные органические соединения, включая белки [39]. Другой важный род, идентифицированный, был Methylobacterium-Methylorubrum, розовый факультативный метилотроф, о котором сообщалось в различных силосных кормах [40]. Виды, такие как Methylobacterium komagatae и Methylobacterium adhaesivum в пределах этого рода, могут влиять на утилизацию и метаболизм метанола, классифицируя их как нежелательные бактерии в силосе [41].
После 3 дней брожения анаэробные условия подавили рост строго аэробного Chryseobacterium, позволив Enterococcus и Lactococcus стать доминирующими родами. Как Enterococcus, так и Lactococcus производят молочную кислоту, снижая pH и стимулируя брожение силосного корма. Однако при подходящих условиях Enterococcus может превращаться в патогенные симбионты, представляя потенциальный риск для здоровья. Несмотря на этот сдвиг, определенные нежелательные бактерии, такие как Methylobacterium-Methylorubrum, оставались присутствующими в силосе. Молочнокислые бактерии могут преобразовывать одну молекулу глюкозы в две молекулы молочной кислоты [42]. В силосе из Lotus corniculatus, обработанном LP, Lactiplantibacillus plantarum и Lactiplantibacillus plantarum стали доминирующими родами и видами после 3 дней брожения. pH в этой группе обработки был значительно ниже, чем в необработанной группе, в то время как уровни молочной кислоты (LA) были значительно выше. Эта комбинация более низкого pH и более высокой молочной кислоты эффективно снизила численность Enterococcus, тем самым смягчая потенциальные негативные воздействия токсинов, полученных из Enterococcus, на здоровье скота. Ref. [43] продемонстрировал, что добавление Lactiplantibacillus plantarum уменьшало рост нежелательных микроорганизмов и улучшало качество силоса из пшеницы. Аналогично, Ref. [44] сообщил, что добавление лактобацилл увеличивало содержание молочной кислоты и сырого протеина, улучшая качество силоса из люцерны. Эти выводы согласуются с результатами настоящего исследования.
По мере того как время силосования увеличилось до 45 дней, Lactiplantibacillus plantarum оставался доминирующим родом и видом в силосе. Lactiplantibacillus plantarum проявлял высоко значительную или значительную отрицательную корреляцию с pH, уксусной кислотой (AA) и WSC, в то же время показывая высоко значительную положительную корреляцию с LA. Это дальнейшим образом указывает на то, что гомоферментативная бактерия Lactiplantibacillus plantarum использует WSC для производства молочной кислоты, снижая pH и создавая кислую анаэробную среду, которая подавляет рост нежелательных микроорганизмов, в конечном итоге улучшая качество силоса из Lotus corniculatus [45]. В необработанном силосе на 45 день Methylobacterium-Methylorubrum больше не обнаруживался, что предполагает, что это может быть кислоточувствительная бактерия или что ее рост был подавлен конкуренцией с быстро пролиферирующими молочнокислыми бактериями.
4.3. Прогнозируемые метаболические функции бактериальных сообществ
Принцип PICRUSt заключается в том, чтобы вывести функциональный спектр их общих генов-предков (гомологичных генов) на основе полной последовательности 16S рРНК измеренного бактериального генома, вывести спектр генной функции других неизмеренных видов в базе данных Greengenes и построить спектр прогнозирования генной функции бактериального домена. Наконец, состав секвенированной флоры «отображался» на базу данных для прогнозирования метаболической функции флоры. Прогнозирование потенциальных функций бактериальных сообществ с использованием PICRUSt предоставляет подробное представление об изменениях в качестве силосного корма [46]. В этом исследовании относительная численность бактериальных сообществ в силосе из Lotus corniculatus была преимущественно связана с метаболизмом, обработкой генетической информации и обработкой экологической информации. Это похоже на метаболическую численность, идентифицированную в силосе из итальянского райграса [47], который наблюдал более высокую активность бактериального сообщества на 60 день цветения силоса райграса из-за более низких уровней NH3-N, приводя к увеличению численности в обработке экологической информации, клеточных процессах, метаболизме, биосистемах и обработке генетической информации. В нашем исследовании относительная численность обработки генетической информации и обработки экологической информации в группах LP силоса из Lotus corniculatus на 3 и 45 день была значительно выше, чем в контрольной группе, потенциально связанная с более низким содержанием NH3-N, наблюдаемым в обработке LP. Бактериальное сообщество в обработанном LP силосе из Lotus corniculatusпоказало усиленный метаболизм углеводов, который ускоряет преобразование водорастворимых углеводов (WSC) для облегчения достаточного накопления молочной кислоты. И наоборот, энергетический метаболизм был ниже, вероятно, из-за сниженного микробного разнообразия в силосе, связанного с добавлением LP.
Повышенные уровни репликации и репарации, трансляции и мембранного транспорта указывают на улучшенную пролиферативную способность полезных бактерий, способствуя улучшению качества силоса [39]. Примечательно, что функции репликации и репарации, трансляции, транскрипции и мембранного транспорта бактериальных сообществ в группе LP на 45 день были значительно повышены, что указывает на существенную пролиферацию полезных бактерий LP. Дополнительно, бактериальные сообщества показали заметное повышение в метаболизме пуринов, метаболизме пиримидинов, гликолизе/глюконеогенезе и белках репарации и рекомбинации ДНК, что дальнейшим образом поддерживает пролиферацию полезных бактерий LP.
Относительное обогащение ABC-транспортеров в силосе из Lotus corniculatus согласуется с выводами из [48], указывая на то, что мембранный транспорт бактериального сообщества в силосе из Lotus corniculatus может зависеть от ABC-транспортеров. Важно отметить, что эти результаты основаны на функциональных прогнозах, полученных из секвенирования 16S рРНК, и не представляют прямых измерений метаболических путей.
5. Выводы
Силос из Lotus corniculatus L., произведенный с добавлением Lactiplantibacillus plantarum, показал превосходное качество брожения, характеризующееся более низкими уровнями pH и NH3-N, наряду с более высоким содержанием молочной кислоты и отсутствием масляной кислоты. Интеграция технологии высокопроизводительного секвенирования с методологией PICRUSt выявила, что Lactiplantibacillus plantarum влияет на качество брожения и микробное сообщество силоса из Lotus corniculatus через различные метаболические пути. Следовательно, добавление Lactiplantibacillus plantarum может способствовать производству высококачественного силосного корма в карстовых регионах.
Ссылки
1. Ding, L.; Shang, Y.; Zhang, W.; Zhang, Y.; Li, S.; Wei, X.; Zhang, Y.; Song, X.; Chen, X.; Liu, J.; et al. Disentangling the effects of driving forces on soil bacterial and fungal communities under shrub encroachment on the Guizhou Plateau of China. Sci. Total Environ. 2020, 709, 136207. [Google Scholar] [CrossRef]
2. Wang, K.; Zhang, C.; Chen, H.; Yue, Y.; Zhang, W.; Zhang, M.; Qi, X.; Fu, Z. Karst landscapes of China: Patterns, ecosystem processes and services. Landsc. Ecol. 2019, 34, 2743–2763. [Google Scholar] [CrossRef]
3. Ding, L.; Wang, P. Afforestation suppresses soil nitrogen availability and soil multifunctionality on a subtropical grassland. Sci. Total Environ. 2021, 761, 143663. [Google Scholar] [CrossRef]
4. Liu, C.; Huang, Y.; Wu, F.; Liu, W.; Ning, Y.; Huang, Z.; Tang, S.; Liang, Y. Plant adaptability in karst regions. J. Plant Res. 2021, 134, 889–906. [Google Scholar] [CrossRef] [PubMed]
5. Fan, X.; Xie, Z.; Cheng, Q.; Li, M.; Long, J.; Lei, Y.; Jia, Y.; Chen, Y.; Chen, C.; Wang, Z. Fermentation quality, bacterial community, and predicted functional profiles in silage prepared with alfalfa, perennial ryegrass and their mixture in the karst region. Front. Microbiol. 2022, 13, 1062515. [Google Scholar] [CrossRef]
6. Jiang, H.; Wang, H.; Bao, B.; Qu, H.; Wang, J.; Sun, L.; Liu, B.; Gao, F. Effect of Compound Additives on Nutritional Composition, Fermentation Quality, and Bacterial Community of High-Moisture Alfalfa Silage. Fermentation 2023, 9, 453. [Google Scholar] [CrossRef]
7. Nazar, M.; Wang, S.; Zhao, J.; Dong, Z.; Li, J.; Kaka, N.A.; Shao, T. Abundance and diversity of epiphytic microbiota on forage crops and their fermentation characteristic during the ensiling of sterile sudan grass. World J. Microbiol. Biotechnol. 2021, 37, 27. [Google Scholar] [CrossRef]
8. Li, M.; Zi, X.; Sun, R.; Ou, W.; Chen, S.; Hou, G.; Zhou, H. Co-Ensiling Whole-Plant Cassava with Corn Stalk for Excellent Silage Production: Fermentation Characteristics, Bacterial Community, Function Profile, and Microbial Ecological Network Features. Agronomy 2024, 14, 501. [Google Scholar] [CrossRef]
9. Jia, T.; Luo, Y.; Wang, L.; Yu, Z. Effect of soil contamination and additives on fermentative profile, microbial community and iron bioaccessibility of alfalfa silage. Chem. Biol. Technol. Agric. 2024, 11, 55. [Google Scholar] [CrossRef]
10. Bao, A.; Wang, Y.; Xi, J.; Liu, C.; Zhang, J.; Wang, S. Co-expression of xerophyte Zygophyllum xanthoxylum ZxNHX and ZxVP1-1 enhances salt and drought tolerance in transgenic Lotus corniculatus by increasing cations accumulation. Funct. Plant Biol. 2014, 41, 203–214. [Google Scholar] [CrossRef] [PubMed]
11. Zhao, X.; Chen, K.; Wang, L.; Zhao, L.; Wang, P. Transcriptome analysis provides insights into the response of Lotus corniculatus roots to low-phosphorus stress. Front. Plant Sci. 2023, 14, 1089380. [Google Scholar] [CrossRef] [PubMed]
12. Dong, Q.; Xu, Q.; Yu, Z.; Sun, Q.; Bai, C.; Guan, S.; Zhu, X.; Sun, G. Effects of different additives on quality of Lotus corniculatus L. silage. Feed. Rev. 2012, 5, 27–30. (In Chinese) [Google Scholar]
13. Na, N.; Qili, M.; Wu, N.; Sun, L.; Xu, H.; Zhao, Y.; Wei, X.; Xue, Y.; Tao, Y. Bacterial Community and Fermentation Quality of Ensiling Alfalfa with Commercial Lactic Acid Bacterial Additives. Front. Microbiol. 2022, 13, 836899. [Google Scholar] [CrossRef]
14. Ling, W.; Zhang, L.; Feng, Q.; Degen, A.A.; Li, J.; Qi, Y.; Li, Y.; Zhou, Y.; Liu, Y.; Yang, F.; et al. Effects of Different Additives on Fermentation Quality, Microbial Communities, and Rumen Degradation of Alfalfa Silage. Fermentation 2022, 8, 660. [Google Scholar] [CrossRef]
15. Li, P.; Zhang, Y.; Gou, W.; Cheng, Q.; Bai, S.; Cai, Y. Silage fermentation and bacterial community of bur clover, annual ryegrass and their mixtures prepared with microbial inoculant and chemical additive. Anim. Feed. Sci. Technol. 2019, 247, 285–293. [Google Scholar] [CrossRef]
16. Broderick, G.A.; Kang, J.H. Automated Simultaneous Determination of Ammonia and Total Amino Acids in Ruminal Fluid and In Vitro Media. J. Dairy Sci. 1980, 63, 64–75. [Google Scholar] [CrossRef] [PubMed]
17. Xu, D.; Li, M.; Wang, Y.; Long, J.; Fan, X.; Lei, Y.; Li, P.; Cheng, Q.; Chen, Y.; Chen, C. Study on the effect of additives on microbial diversity, predicted functional profiles, and fermentation quality of Broussonetia papyrifera and Pennisetum sinese mixed ensilage in the karst region. Lett. Appl. Microbiol. 2023, 76, ovad39. [Google Scholar] [CrossRef]
18. Van Soest, P.J.; Robertson, J.B.; Lewis, B.A. Methods for Dietary Fiber, Neutral Detergent Fiber, and Nonstarch Polysaccharides in Relation to Animal Nutrition. J. Dairy Sci. 1991, 74, 3583–3597. [Google Scholar] [CrossRef] [PubMed]
19. Murphy, R.P. A method for the extraction of plant samples and the determination of total soluble carbohydrates. J. Sci. Food Agric. 1958, 9, 714–717. [Google Scholar] [CrossRef]
20. Ren, H.; Feng, Y.; Pei, J.; Li, J.; Wang, Z.; Fu, S.; Zheng, Y.; Li, Z.; Peng, Z. Effects of Lactobacillus plantarum additive and temperature on the ensiling quality and microbial community dynamics of cauliflower leaf silages. Bioresour. Technol. 2020, 307, 123238. [Google Scholar] [CrossRef]
21. Mu, L.; Xie, Z.; Hu, L.; Chen, G.; Zhang, Z. Cellulase interacts with Lactobacillus plantarum to affect chemical composition, bacterial communities, and aerobic stability in mixed silage of high-moisture amaranth and rice straw. Bioresour. Technol. 2020, 315, 123772. [Google Scholar] [CrossRef]
22. Wang, S.; Yuan, X.; Dong, Z.; Li, J.; Shao, T. Effect of ensiling corn stover with legume herbages in different proportions on fermentation characteristics, nutritive quality and in vitro digestibility on the Tibetan Plateau. Grassl. Sci. 2017, 63, 236–244. [Google Scholar] [CrossRef]
23. Woolford, M.K. Microbiological screening of food preservatives, cold sterilants and specific antimicrobial agents as potential Silage Additives. J. Sci. Food Agric. 1975, 26, 229–237. [Google Scholar] [CrossRef]
24. Ni, K.; Wang, F.; Zhu, B.; Yang, J.; Zhou, G.; Pan, Y.; Tao, Y.; Zhong, J. Effects of lactic acid bacteria and molasses additives on the microbial community and fermentation quality of soybean silage. Bioresour. Technol. 2017, 238, 706–715. [Google Scholar] [CrossRef]
25. Zhang, Y.; Yang, H.; Huang, R.; Wang, X.; Ma, C.; Zhang, F. Effects of Lactiplantibacillus plantarum and Lactiplantibacillus brevis on fermentation, aerobic stability, and the bacterial community of paper mulberry silage. Front. Microbiol. 2022, 13, 1063914. [Google Scholar] [CrossRef] [PubMed]
26. Kung, L.; Taylor, C.C.; Lynch, M.P.; Neylon, J.M. The Effect of Treating Alfalfa with Lactobacillus buchneri 40788 on Silage Fermentation, Aerobic Stability, and Nutritive Value for Lactating Dairy Cows. J. Dairy Sci. 2003, 86, 336–343. [Google Scholar] [CrossRef] [PubMed]
27. Li, X.; Tian, J.; Zhang, Q.; Jiang, Y.; Wu, Z.; Yu, Z. Effects of mixing red clover with alfalfa at different ratios on dynamics of proteolysis and protease activities during ensiling. J. Dairy Sci. 2018, 101, 8954–8964. [Google Scholar] [CrossRef] [PubMed]
28. Ren, H.; Sun, W.; Yan, Z.; Zhang, Y.; Wang, Z.; Song, B.; Zheng, Y.; Li, J. Bioaugmentation of sweet sorghum ensiling with rumen fluid: Fermentation characteristics, chemical composition, microbial community, and enzymatic digestibility of silages. J. Clean. Prod. 2021, 294, 126308. [Google Scholar] [CrossRef]
29. Xu, J.; Zhang, K.; Lin, Y.; Li, M.; Wang, X.; Yu, Q.; Sun, H.; Cheng, Q.; Xie, Y.; Wang, C.; et al. Effect of cellulase and lactic acid bacteria on the fermentation quality, carbohydrate conversion, and microbial community of ensiling oat with different moisture contents. Front. Microbiol. 2022, 13, 1013258. [Google Scholar] [CrossRef] [PubMed]
30. Si, Q.; Wang, Z.; Liu, W.; Liu, M.; Ge, G.; Jia, Y.; Du, S. Influence of Cellulase or Lactiplantibacillus plantarum on the Ensiling Performance and Bacterial Community in Mixed Silage of Alfalfa and Leymus chinensis. Microorganisms 2023, 11, 426. [Google Scholar] [CrossRef]
31. Nsereko, V.L.; Smiley, B.K.; Rutherford, W.M.; Spielbauer, A.; Forrester, K.J.; Hettinger, G.H.; Harman, E.K.; Harman, B.R. Influence of inoculating forage with lactic acid bacterial strains that produce ferulate esterase on ensilage and ruminal degradation of fiber. Anim. Feed. Sci. Technol. 2008, 145, 122–135. [Google Scholar] [CrossRef]
32. Nkosi, B.D.; Meeske, R.; Langa, T.; Motiang, M.D.; Modiba, S.; Mkhize, N.R.; Groenewald, I.B. Effects of ensiling forage soybean (Glycine max (L.) Merr.) with or without bacterial inoculants on the fermentation characteristics, aerobic stability and nutrient digestion of the silage by Damara rams. Small Rumin. Res. 2016, 134, 90–96. [Google Scholar] [CrossRef]
33. Zheng, Y.; Li, M.; Xu, J.; Sun, H.; Cheng, Q.; Xie, Y.; Wang, C.; Chen, C.; Li, P. Effects of different cutting methods and additives on the fermentation quality and microbial community of Saccharum arundinaceum silage. Front. Microbiol. 2022, 13, 999881. [Google Scholar] [CrossRef] [PubMed]
34. Yang, F.; Wang, Y.; Zhao, S.; Wang, Y. Lactobacillus plantarum Inoculants Delay Spoilage of High Moisture Alfalfa Silages by Regulating Bacterial Community Composition. Front. Microbiol. 2020, 11, 1989. [Google Scholar] [CrossRef]
35. Du, Z.; Sun, L.; Chen, C.; Lin, J.; Yang, F.; Cai, Y. Exploring microbial community structure and metabolic gene clusters during silage fermentation of paper mulberry, a high-protein woody plant. Anim. Feed. Sci. Technol. 2021, 275, 114766. [Google Scholar] [CrossRef]
36. Karnatam, K.S.; Mythri, B.; Un Nisa, W.; Sharma, H.; Meena, T.K.; Rana, P.; Vikal, Y.; Gowda, M.; Dhillon, B.S.; Sandhu, S. Silage maize as a potent candidate for sustainable animal husbandry development—Perspectives and strategies for genetic enhancement. Front. Genet. 2023, 14, 1150132. [Google Scholar] [CrossRef] [PubMed]
37. Li, M.; Yu, Q.; Xu, J.; Sun, H.; Cheng, Q.; Xie, Y.; Wang, C.; Li, P.; Chen, C.; Zheng, Y. Effect of different organic acid additives on the fermentation quality and bacterial community of paper mulberry (Broussonetia papyrifera) silage. Front. Microbiol. 2022, 13, 1038549. [Google Scholar] [CrossRef]
38. Ramírez-Reyes, T.I.; Aguilar-Colorado, Á.S.; Murrieta-León, D.L.; Licona-Velázquez, L.S.; Bonilla-Landa, I.; Durán-Espinosa, C.; Avendaño-Reyes, S.; Monribot-Villanueva, J.L.; Guerrero-Analco, J.A. Identification of Antibacterial Phenolics in Selected Plant Species from Mexican Cloud Forest by Mass Spectrometry Dereplication. Chem. Biodivers. 2019, 16, e1800603. [Google Scholar] [CrossRef] [PubMed]
39. Lei, Y.; Zhao, P.; Li, C.; Zhao, H.; Shan, Z.; Wu, Q. Isolation, identification and characterization of a novel elastase from Chryseobacterium indologenes. Appl. Biol. Chem. 2018, 61, 365–372. [Google Scholar] [CrossRef]
40. Wang, S.; Shao, T.; Li, J.; Zhao, J.; Dong, Z. Fermentation Profiles, Bacterial Community Compositions, and Their Predicted Functional Characteristics of Grass Silage in Response to Epiphytic Microbiota on Legume Forages. Front. Microbiol. 2022, 13, 830888. [Google Scholar] [CrossRef] [PubMed]
41. Guan, H.; Yan, Y.; Li, X.; Li, X.; Shuai, Y.; Feng, G.; Ran, Q.; Cai, Y.; Li, Y.; Zhang, X. Microbial communities and natural fermentation of corn silages prepared with farm bunker-silo in Southwest China. Bioresour. Technol. 2018, 265, 282–290. [Google Scholar] [CrossRef] [PubMed]
42. Yu, Q.; Li, M.; Zhang, Y.; Xu, J.; Li, P.; Sun, H.; Xie, Y.; Dong, R.; Zheng, Y.; Chen, C. Effects of Different Cutting Stages and Additives on the Fermentation Quality and Microbial Community of Sudangrass (Sorghum sudanense Stapf.) Silages. Fermentation 2023, 9, 777. [Google Scholar] [CrossRef]
43. Zhang, M.; Wu, G.; Wang, L.; Zhang, B.; Chen, J.; Liu, Y.; Pang, H.; Tan, Z. Characteristics of Lactobacillus plantarum QZW5 and its effects on wheat silage under multigelation. Chem. Biol. Technol. Agric. 2021, 8, 52. [Google Scholar] [CrossRef]
44. Si, H.; Liu, H.; Li, Z.; Nan, W.; Jin, C.; Sui, Y.; Li, G. Corrigendum to: Effect of Lactobacillus plantarum and Lactobacillus buchneri addition on fermentation, bacterial community and aerobic stability in lucerne silage. Anim. Prod. Sci. 2019, 59, 1584. [Google Scholar] [CrossRef]
45. Li, F.; Usman, S.; Huang, W.; Jia, M.; Kharazian, Z.A.; Ran, T.; Li, F.; Ding, Z.; Guo, X. Effects of inoculating feruloyl esterase-producing Lactiplantibacillus plantarum A1 on ensiling characteristics, in vitro ruminal fermentation and microbiota of alfalfa silage. J. Anim. Sci. Biotechnol. 2023, 14, 43. [Google Scholar] [CrossRef]
46. Hisham, M.B.; Hashim, A.M.; Mohd Hanafi, N.; Abdul Rahman, N.; Abdul Mutalib, N.E.; Tan, C.K.; Nazli, M.H.; Mohd Yusoff, N.F. Bacterial communities associated with silage of different forage crops in Malaysian climate analysed using 16S amplicon metagenomics. Sci. Rep. 2022, 12, 7107. [Google Scholar] [CrossRef] [PubMed]
47. Wang, S.; Wang, Y.; Zhao, J.; Dong, Z.; Li, J.; Nazar, M.; Kaka, N.A.; Shao, T. Influences of growth stage and ensiling time on fermentation profile, bacterial community compositions and their predicted functionality during ensiling of Italian ryegrass. Anim. Feed Sci. Technol. 2023, 298, 115606. [Google Scholar] [CrossRef]
48. Wang, S.; Li, J.; Zhao, J.; Dong, Z.; Shao, T. An investigation on fermentative profile, microbial numbers, bacterial community diversity and their predicted metabolic characteristics of Sudangrass (Sorghum sudanense Stapf.) silages. Anim. Biosci. 2022, 35, 1162–1173. [Google Scholar] [CrossRef]
Wang Y, Yang Y, Yang X, Huang L, Wang P, Zhao L. Effects of Lactiplantibacillus plantarum and Fermentation Time on the Quality, Bacterial Community, and Functional Prediction of Silage from Lotus corniculatus L. in Karst Regions. Agriculture. 2025; 15(1):16. https://doi.org/10.3390/agriculture15010016
Перевод статьи «Effects of Lactiplantibacillus plantarum and Fermentation Time on the Quality, Bacterial Community, and Functional Prediction of Silage from Lotus corniculatus L. in Karst Regions» авторов Wang Y, Yang Y, Yang X, Huang L, Wang P, Zhao L., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык































































































Комментарии (0)