Показатели мяса ягнят, получавших рационы с возрастающим уровнем включения жмыха подсолнечника высокоолеинового типа
Целью данного исследования была оценка влияния жмыха подсолнечника высокоолеинового типа на продуктивность, характеристики туши, качество мяса и состав внутримышечных жирных кислот у ягнят на откорме.
Аннотация
Тридцать шесть помесных ярочек были распределены на четыре экспериментальные группы (по 9 ягнят в группе) в соответствии с полностью рандомизированной схемой: 0 (контроль), 150, 300 и 450 г/кг сухого вещества жмыха высокоолеинового подсолнечника. Ягнят взвешивали еженедельно и отправляли на убой при живом весе 42,3 ± 0,18 кг и возрасте 270 ± 10,8 дней. Включение подсолнечного жмыха не оказало влияния на привесы, потребление сухого вещества и потребление метаболизируемой энергии (p > 0,05). Наблюдалось увеличение потребления нейтрально-детергентной клетчатки и сырого жира (p < 0,01) с увеличением уровня включения жмыха в рацион ягнят. Включение жмыха привело к снижению выхода горячих и охлажденных туш (p < 0,01). Содержание внутримышечного жира, показатель светлоты (L*), а также уровни олеиновой, руменовой и ЭПК (эйкозапентаеновой кислоты) достоверно линейно возрастали (p < 0,01) с увеличением доли жмыха высокоолеинового подсолнечника в рационе. Включение жмыха снизило содержание насыщенных жирных кислот (p < 0,01), за исключением стеариновой кислоты, уровень которой линейно увеличился (p < 0,01). Включение в рацион ягнят до 450 г/кг СВ жмыха высокоолеинового подсолнечника не повлияло на продуктивность животных, обеспечив при этом большее отложение жира с улучшенным составом жирных кислот, благоприятным для потребления человеком.
1. Введение
Поиск более продуктивных и устойчивых систем производства пищевых продуктов в дополнение к росту затрат на корма для животных, особенно в межсезонье, стал основным драйвером для использования альтернативных кормов в системах кормления животных. Побочные продукты производства биодизеля заняли видное место среди потенциальных источников питательных веществ для кормления животных, главным образом из-за их более низкой цены по сравнению с традиционными кормовыми ингредиентами и питательного состава [1,2].
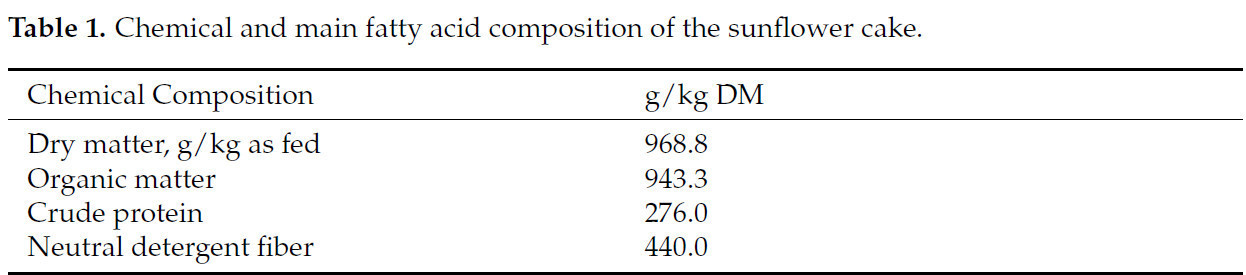
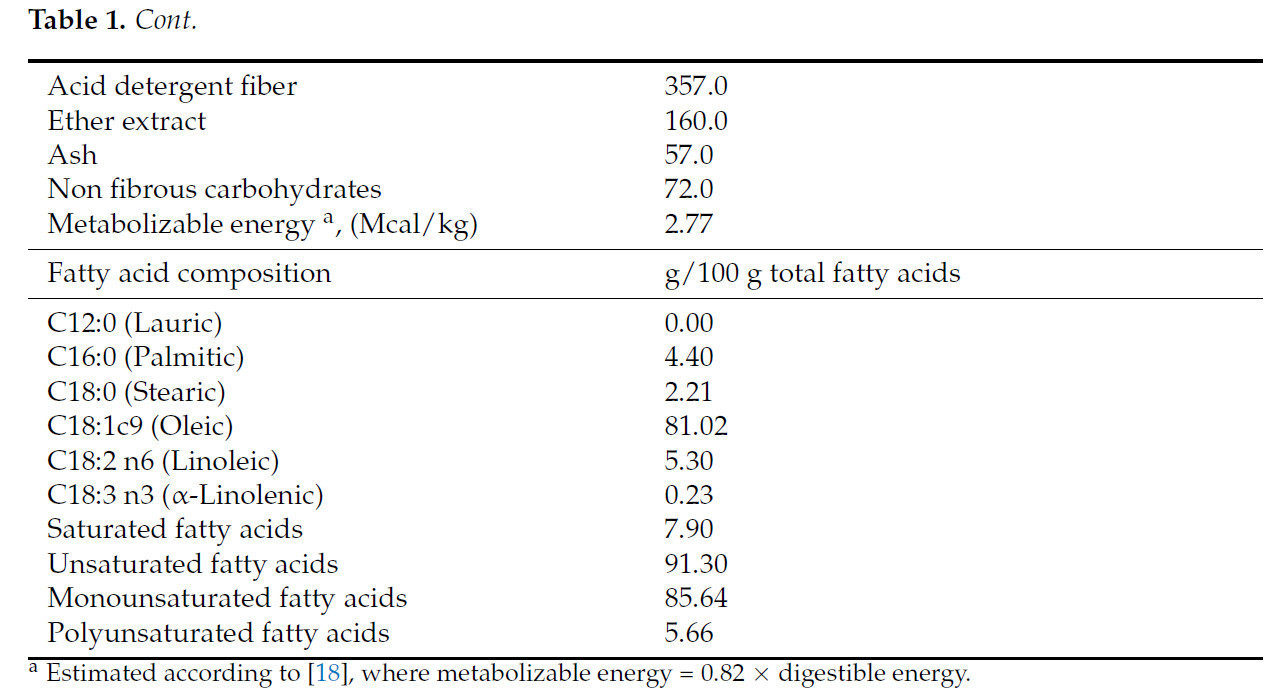
Подсолнечник (Helianthus annuus L.) — это масличная культура с потенциалом для производства биодизеля благодаря высокому содержанию масла [3]. В настоящее время высокоолеиновое подсолнечное масло наиболее широко используется в пищевом секторе и в качестве сырья для непищевых применений, таких как биотопливо, благодаря своим промышленным свойствам, в основном высокой окислительной стабильности [4,5]. Высокоолеиновый подсолнечник содержит приблизительно 80% олеиновой кислоты, но некоторое количество линолевой кислоты все еще присутствует в семянках [4]. В отличие от подсолнечного шрота, подсолнечный жмых является побочным продуктом с высоким содержанием жира. Он производится когда семена подсолнечника подвергаются механическому прессованию без использования тепла или растворителей [6,7].
Состав жирных кислот мяса является одним из определяющих факторов, влияющих на качество жира [8], особенно в отношении здоровья человека, с акцентом на рекомендации по снижению потребления насыщенных жирных кислот и увеличению потребления длинноцепочечных полиненасыщенных жирных кислот (ПНЖК) n3 в связи с их влиянием на болезни, связанные с липидами [9]. Включение альтернативных кормов для животных, богатых ненасыщенными жирными кислотами, является стратегией снижения насыщенных жирных кислот, депонируемых в тканях, и увеличения полиненасыщенных жирных кислот в красном мясе [9], в первую очередь изомеров конъюгированной линолевой кислоты (КЛК) [10,11,12]. Однако руминная биогидрогенизация жирных кислот затрудняет увеличение содержания ПНЖК в мясе жвачных животных через диету, в дополнение к активности ферментов, участвующих в синтезе жирных кислот в мышцах (например, Δ9-десатуразы и элонгазы) [13,14].
Прогресс в применении подсолнечного жмыха привлекает все больше внимания как жизнеспособного ингредиента в питании жвачных благодаря благоприятному питательному профилю и доступности. Высокоолеиновый подсолнечный жмых может быть высокоэнергетическим кормовым ингредиентом в рационе ягнят на откорме и улучшать профиль жирных кислот в мясе, обеспечивая прямое депонирование мононенасыщенных жирных кислот и, через биогидрогенизацию, превращаясь в стеариновую кислоту, которая оказывает защитный эффект против сердечно-сосудистых заболеваний [15]. Однако из-за содержания жира, связанного с количеством клетчатки в подсолнечном жмыхе, уровни включения этого побочного продукта в рацион могут снижать потребление сухого вещества и продуктивность животных [2,16], в то время как другие исследования показали, что включение подсолнечного жмыха может поддерживать потребление, баланс азота и параметры рубцового брожения [17]. Учитывая это, целью настоящего исследования была оценка эффектов возрастающих уровней высокоолеинового подсолнечного жмыха (0, 150, 300 и 450 г/кг СВ) в рационе помесных ягнят на откорме на их продуктивность, характеристики туши, качество мяса (pH, цвет, усилие сдвига и состав) и состав внутримышечных жирных кислот.
2. Материалы и методы
2.1. Условия и экспериментальные рационы
Это исследование проводилось в 2013 году на Овцеводческой ферме кафедры зоотехнии Федерального университета Лавраса. Процедуры с животными были одобрены и выполнялись в соответствии с руководством по содержанию животных (Протокол номер 105/12).
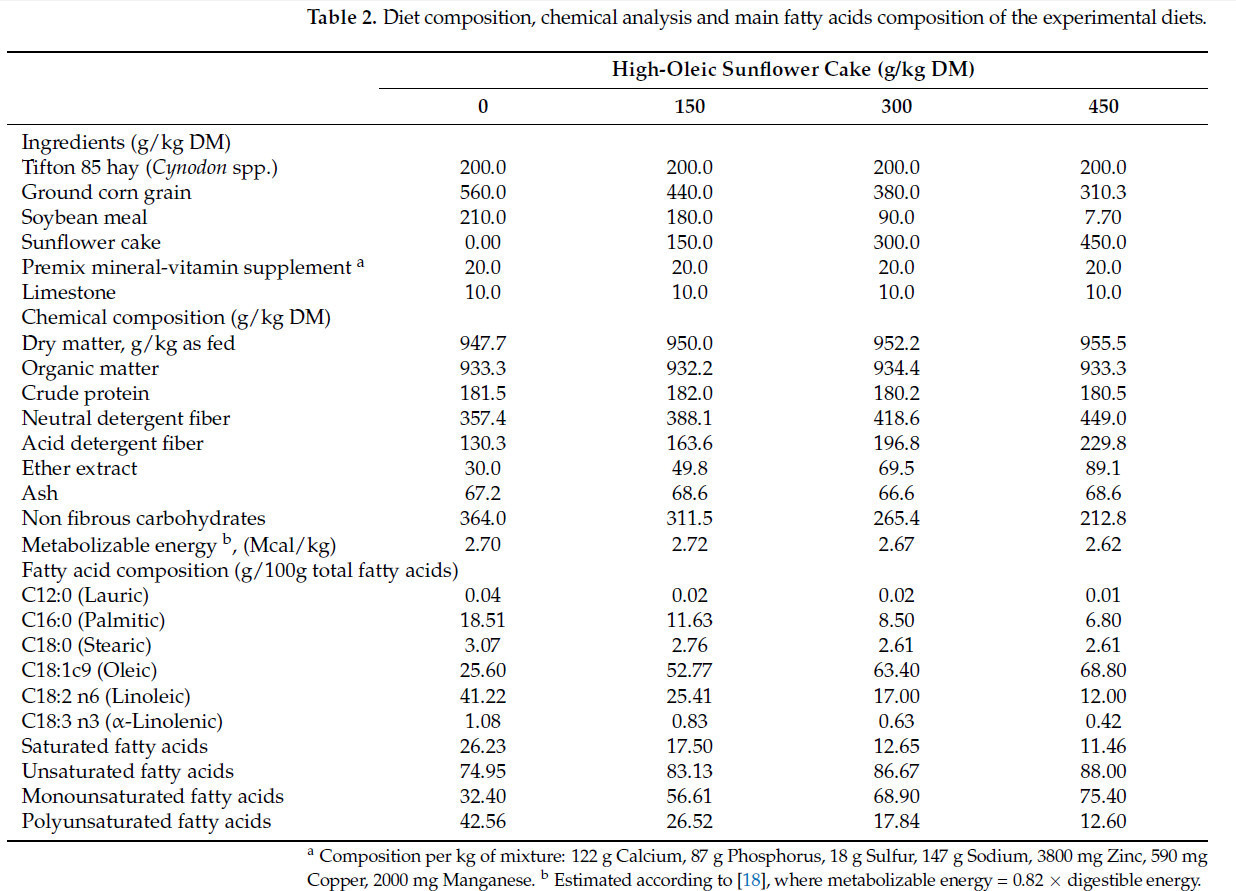
Тридцать шесть ярочек (½ Санта-Инес × ½ Дорпер, случайно отобранных из большего стада), с начальной живой массой 21,52 ± 0,27 кг и начальным возрастом 138 ± 2,62 дня, были индивидуально размещены в крытых загонах (1 м2). Эксперимент был проведен в соответствии с полностью рандомизированной схемой. Животные были распределены по четырем обработкам, всего по 9 повторностей на обработку, которые состояли из включения высокоолеинового подсолнечного жмыха (Таблица 1) в пропорциях 0, 150, 300 и 450 г/кг СВ (Таблица 2). Рационы были рассчитаны как изопротеиновые (181 г/кг СВ) с соотношением грубые корма:концентраты 20:80. Рационы были сформулированы для удовлетворения питательных потребностей ярочек с живой массой 20 кг и средним суточным приростом 250 г, в соответствии с National Research Council [18]. Подсолнечный жмых был получен методом холодного прессования семян высокоолеинового подсолнечника от бразильской компании (Parecis Alimentos S/A, Кампу-Нову-ду-Паресис, Бразилия).
Таблица 1. Химический и основной жирнокислотный состав подсолнечного жмыха.
Таблица 2. Состав рационов, химический анализ и основной жирнокислотный состав экспериментальных рационов.
2.2. Продуктивность животных, убой и характеристики туши
Ягнята прошли 15-дневный период адаптации к условиям и экспериментальным рационам. Полнорационный смешанный корм предлагался вволю два раза в день (07:00 и 15:00). Количество скармливаемого рациона ежедневно корректировалось в соответствии с зарегистрированным потреблением за предыдущий день, рассчитывалось для достижения 5% остатков. Остатки корма взвешивались ежедневно для определения среднего суточного потребления. Один образец остатков корма от каждого животного собирался ежедневно и объединялся в еженедельную выборку и помещался в сушильный шкаф с принудительной вентиляцией для высушивания с целью определения ежедневного потребления сухого вещества. Образцы измельчались на мельнице типа Уайли с размером сита 1 мм для определения содержания общего сухого вещества (СВ) (метод 967.03), золы (метод 942.05), сырого протеина (СП) (метод 981.10) и сырого жира (СЖ) (метод 920.29) [19]. Нейтрально-детергентная клетчатка (НДК) и кислото-детергентная клетчатка (КДК) определялись согласно методике, описанной Ван Сустом и др. [20], с поправкой НДК на золу (НДКз). Концентрация безазотистых экстрактивных веществ (БЭВ) рассчитывалась по следующему уравнению: БЭВ = 100 − (СП + НДК + СЖ + зола).
Ягнят взвешивали еженедельно до достижения живой массы 42,3 ± 0,18 кг. Животные подвергались голодной выдержке без корма и воды в течение 16 ч и взвешивались для определения предубойной живой массы (ПУМ). Затем животных транспортировали на коммерческую бойню, где их забивали в соответствии с правилами бойни. Не относящиеся к туше части тела удалялись и взвешивались для определения показателей не-туши (ПНТ). Содержимое желудка и кишечника взвешивалось для определения массы содержимого желудочно-кишечного тракта (ЖКТС), а масса пустого тела (МПТ) оценивалась по уравнению: МПТ = ПУМ − ЖКТС. Туши взвешивали для получения массы горячей туши (МГТ) и выхода горячей туши (ВГТ = МГТ/ПУМ × 100); затем туши охлаждались в течение 24 ч при 4 °C. После охлаждения туши снова взвешивали, получая массу холодной туши (МХТ) и выход холодной туши (ВХТ = МХТ/ПУМ × 100). Потери при охлаждении рассчитывались по уравнению: ПО = ((МГТ − МХТ)/МГТ) × 100. Затем туши разделяли продольно, и на левой полутуше делали разрез между 12-м и 13-м ребрами для обнажения длиннейшей мышцы спины. Толщина подкожного жира (ТПЖ) измерялась цифровым штангенциркулем. В той же точке площадь мышечного глазка (ПМГ) мышцы обводилась на прозрачной пленке с помощью перманентного маркера и измерялась с помощью программы Universal Desktop Ruler (AVPSoft®). Процентные выходы отрубов туши (корейка, ребра, окорок, лопатка, карбонад и шея) рассчитывались относительно массы холодной туши ягнят.
2.3. Анализ качества мяса
Длиннейшая мышца груди и поясницы отбиралась и делилась на три образца-стейка, вакуумировалась в полиэтиленовые пакеты и хранилась в холодильнике при 2 °C в течение 3 дней перед дальнейшим анализом. Один стейк использовался для измерения цвета мяса. Через 30 минут после вскрытия вакуумных пакетов при комнатной температуре проводились измерения цвета с помощью спектрофотометрического колориметра CM-700 Minolta (Konica Minolta, Осака, Япония). Три показания записывались для каждого стейка для расчета средних значений светлоты (L*), красности (a*) и желтизны (b*). Индекс насыщенности (Chroma) и угол цветового тона (hue) рассчитывались согласно Макдугаллу [21] по следующим уравнениям: Chroma = ((a*)^2 + (b*)^2)^0.5 и hue = arc tan (b*/a*). pH мяса измерялся в трех повторностях с помощью цифрового pH-метра (TESTO-205 pH meter, Кампинас, Бразилия). Кроме того, тот же образец стейка анализировался на влажность, СП, СЖ и концентрацию золы согласно AOAC [19]. Второй стейк использовался для измерения потерь при приготовлении. Вкратце, вес образцов записывался, и образцы помещались на решетку над стеклянной жаропрочной формой. Цифровой термометр вставлялся в геометрический центр образцов для контроля их внутренней температуры. Стейки готовились в электрической духовке, и как только внутренняя температура образца достигала 40 °C, стейк переворачивали и готовили дальше до достижения внутренней температуры 71 °C, как было описано ранее [22]. После приготовления образцы выдерживали при комнатной температуре в течение 15 минут, снова взвешивали для определения потерь при приготовлении и охлаждали при 4 °C в течение 24 ч. После охлаждения для определения усилия сдвига (УС) три подобразца размером 1 см2 каждый вырезались параллельно мышечному волокну. Подобразцы разрезались с помощью текстурометра (ModleTA-TX2, Stable Micro Systems Ltd., Годалминг, Суррей, Великобритания), снабженного ножом Уорнера-Братцлера и откалиброванного с использованием груза 2 кг с установленной скоростью 200 мм/мин. Результаты представлены в кгс/см2, и на каждый стейк проводилось пять повторных измерений.
Третий стейк использовался для количественного определения состава внутримышечных жирных кислот согласно Хара и Радин [23]. Профиль жирных кислот оценивался с использованием методов, описанных Родригес-Руис и др. [24]. После экстракции и метилирования каждый образец вводили в газовый хроматограф (модель Focus CG, Finnigan), оснащенный пламенно-ионизационным детектором и капиллярной колонкой CP-Sil 88 длиной 100 м (Varian) с внутренним диаметром 0,25 мкм и толщиной пленки 0,20 мкм. Водород использовался в качестве газа-носителя с расходом 1,8 мл/мин. Программа температуры термостата начиналась с 70 °C с выдержкой 4 мин. Впоследствии температура повышалась до 175 °C со скоростью 13 °C/мин, с выдержкой 27 мин, затем повышалась до 215 °C со скоростью 4 °C/мин, с выдержкой 9 мин. Температура повышалась на 7 °C/мин до достижения 230 °C, которая выдерживалась в течение 5 мин, в сумме 65 мин. Температура испарителя была установлена на 250 °C, а температура детектора — на 300 °C. Жирные кислоты идентифицировались путем сравнения времен удерживания метиловых эфиров с предопределенным стандартом, а затем количественно определялись путем нормализации площадей метиловых эфиров и выражались в процентах от общего количества метилированных жирных кислот.
Индексы ферментативной активности Δ9-десатуразы и элонгазы рассчитывались, как сообщалось Малау-Адули и др. [25], с использованием следующих уравнений: Δ9-Десатураза 16 = 100 [(C16:1 цис-9)/(C16:1 цис-9 + C16:0)]; Δ9-Десатураза 18 = 100 [(C18:1 цис-9)/(C18:1 цис-9 + C18:0)]; и Элонгаза = 100 [(C18:0 + C18:1 цис-9)/(C16:0 + C16:1 цис-9 + C18:0 + C18:1 цис-9)]. Атерогенный и тромбогенный индексы рассчитывались согласно Ульбрихту и Саутгейту [26], как показатели риска сердечно-сосудистых заболеваний: Атерогенность = {[C12:0 + 4 × (C14:0) + C16:0]/ (МНЖК + n3 + n6)} и Тромбогенность = {(C14:0 + C16:0 + C18:0)/[(0,5 × МНЖК) + (0,5 × n6) + (3 × n3) + (n3/n6)]}.
2.4. Статистический анализ
Данные анализировались с использованием процедуры GLM в SAS (SAS Version 9.1, SAS Institute, Кэри, NC, США) для определения значимых эффектов включения высокоолеинового подсолнечного жмыха в рацион. Начальная живая масса животных включалась как ковариата в соответствии со следующей моделью: Yij = μ + Ti + Pj + eij; где Yij — наблюдаемое значение, μ — константа, связанная с каждым наблюдением, Ti — эффект использования подсолнечного жмыха (i = 0 до 450 г/кг СВ), Pj — эффект ковариаты начальной живой массы и eij — экспериментальная ошибка. Когда обнаруживались значимые эффекты (p < 0,05), подбирались модели линейной регрессии с использованием процедуры REG в SAS, тестировались линейные и квадратичные модели (α − 0,05).
3. Результаты и обсуждение
3.1. Продуктивность роста и характеристики туши
Включение высокоолеинового подсолнечного жмыха до 450 г/кг СВ в рацион ягнят не повлияло на потребление сухого вещества, потребление сырого протеина, суточный прирост или соотношение прирост/корм (p > 0,05) (Таблица 3). Потребление СЖ и НДК линейно увеличивалось (p < 0,01) с включением высокоолеинового подсолнечного жмыха из-за высоких концентраций этих питательных веществ в побочном продукте. И наоборот, наблюдалось снижение потребления БЭВ. Эти результаты ожидались, так как включение подсолнечного жмыха в рацион снижало долю соевого шрота, тем самым поддерживая изопротеиновое условие. Подсолнечный жмых содержит более высокие уровни СЖ и НДК, но более низкие уровни БЭВ по сравнению с соевым шротом. Основное обоснование включения жира в рационы жвачных — увеличение потребления энергии без использования быстроферментируемых кормов. Однако снижение потребления сухого вещества и переваримости НДК часто регистрируется из-за ингибирующего эффекта жирных кислот на рубцовые микроорганизмы [27]. Эти жирные кислоты включают среднецепочечные (от 10 до 14 углеродов) и длинноцепочечные полиненасыщенные жирные кислоты [18,28]. Однако наблюдалось повышенное потребление СЖ, особенно в рационе с включением 450 г/кг СВ высокоолеинового подсолнечного жмыха (89 г/кг СВ). Побочный продукт, использованный в настоящем исследовании, состоит в основном из олеиновой кислоты (81,0 г/100 г общих жирных кислот), мононенасыщенной жирной кислоты, которая менее токсична для рубцовых микроорганизмов [29]. Предыдущие исследования показали, что антипротозойные и антибактериальные эффекты масел в кормах связаны со степенью ненасыщенности их жирных кислот [30,31]. Снижение detrimental эффектов ненасыщенных жирных кислот на переваримость при использовании олеиновой кислоты также наблюдали Велд и Армендано [32] при использовании высокоолеиновых соевых бобов Plenish, которые умеренно увеличивали содержание жира в молоке по сравнению с обычными соевыми бобами. Следовательно, продуктивность ягнят, получавших возрастающие уровни высокоолеинового подсолнечного жмыха, не была значительно затронута, за исключением увеличения потребления СЖ и НДК из-за их более высокой концентрации в рационе.
Таблица 3. Продуктивность ягнят, получавших рационы с возрастающими уровнями высокоолеинового подсолнечного жмыха.
Значительное линейное снижение массы пустого тела (p < 0,01) и линейное увеличение содержимого желудочно-кишечного тракта (p < 0,01) наблюдались с включением высокоолеинового подсолнечного жмыха (Таблица 3). Рационы, содержащие более высокие уровни НДК, могут продлевать время задержки в рубце и увеличивать общий объем химуса [33], что в конечном итоге приводит к пропорциональному снижению массы пустого тела после удаления содержимого желудочно-кишечного тракта [34].
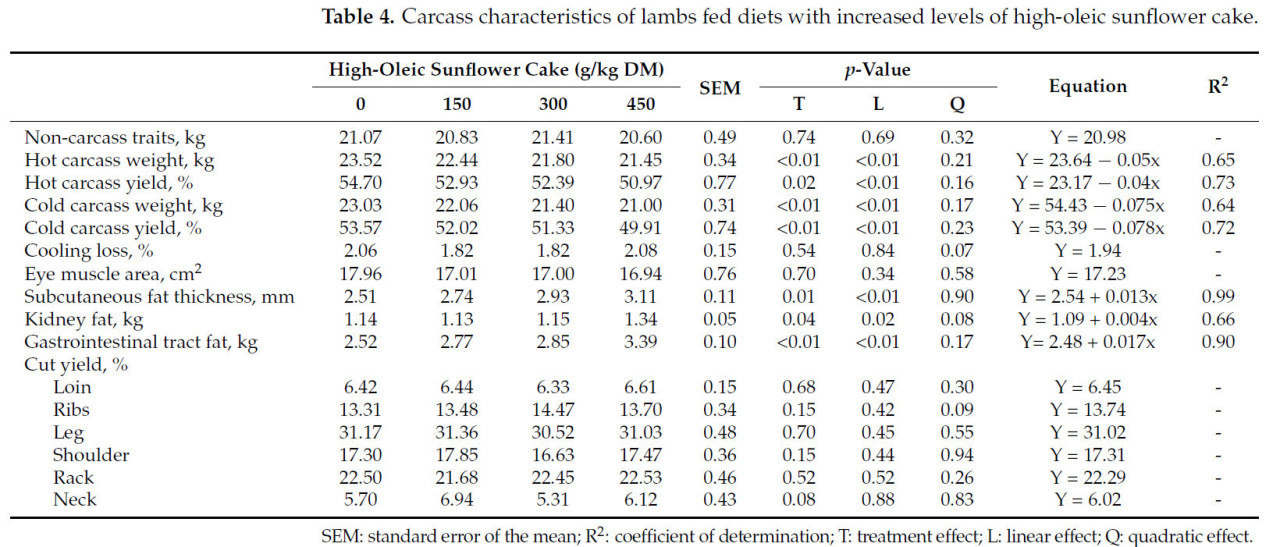
Масса горячих и холодных туш и их выход в процентах линейно снижались (p < 0,01) в результате наблюдаемого увеличения содержимого желудочно-кишечного тракта, даже though не было изменений в предубойной массе или в сумме не-тушевых компонентов с включением высокоолеинового подсолнечного жмыха в рацион ягнят (p > 0,05) (Таблица 4). Лима и др. [2] также сообщали о снижении выхода горячих и холодных туш с включением до 300 г/кг подсолнечного жмыха в рацион барашков Санта-Инес. Дополнительно, Лима и др. [2] наблюдали снижение привесов и предубойной массы ягнят с включением подсолнечного жмыха в рацион, что не подтверждается нашими данными. В рационах с содержанием до 9,5% СЖ, в которых хлопковый шрот заменялся подсолнечным жмыхом, Жуниор и др. [35] не наблюдали эффектов на прирост и массу пустого тела у ягнят на откорме, несмотря на снижение выхода горячих и холодных туш. Этот эффект можно объяснить различными уровнями включения подсолнечного жмыха в рацион, которые могут увеличивать наполнение желудочно-кишечного тракта. В результате большая доля живой массы животного состоит из химуса, оставляя меньшую долю для тканей туши после опорожнения желудочно-кишечного тракта при убое. Следовательно, как масса горячей, так и холодной туши снижается.
Таблица 4. Характеристики туш ягнят, получавших рационы с возрастающими уровнями высокоолеинового подсолнечного жмыха.
Включение до 450 г/кг СВ высокоолеинового подсолнечного жмыха в рацион ягнят не повлияло на площадь мышечного глазка и потери при охлаждении (p > 0,05) (Таблица 4). Площадь мышечного глазка является индикатором развития мышечной ткани у животных и сильно коррелирует с ценными коммерческими отрубами. В настоящем исследовании выходы коммерческих отрубов не были затронуты эффектом обработки (p > 0,05) (Таблица 4). Схожие результаты были зарегистрированы в литературе при использовании подсолнечного жмыха в рационе барашков Санта-Инес и козлов Бур [35,36]. Включение высокоолеинового подсолнечного жмыха в рацион линейно увеличивало толщину подкожного жира (p < 0,01), достигая 3,11 мм у ягнят, получавших 450 г/кг СВ высокоолеинового подсолнечного жмыха (Таблица 4). Независимо от обработки, толщина жира, предположительно, была недостаточной, чтобы повлиять на процент потерь при охлаждении. Христов и др. [37] не наблюдали эффектов на площадь мышечного глазка или толщину жира при добавлении 5% масла высокоолеинового сафлора в рацион мясного скота. Лима и др. [2] также не наблюдали эффекта на толщину подкожного жира у ягнят, получавших до 6% СЖ из подсолнечного жмыха. Почечное сало также увеличивалось с включением высокоолеинового подсолнечного жмыха в рацион ягнят (p < 0,01) (Таблица 4). Следовательно, увеличение толщины подкожного жира и почечного сала можно объяснить более высоким потреблением энергии из-за увеличения уровня липидов в рационах с высокоолеиновым подсолнечным жмыхом, что поддерживает запасание жира в организме [38]. Однако эти диетические изменения не изменили значительно площадь мышечного глазка или потери при охлаждении, что позволяет предположить, что включение высокоолеинового подсолнечного жмыха в рацион ягнят, по-видимому, влияет на депонирование жира больше, чем на рост мышц, из-за высокого содержания жира и высокой энергетической плотности подсолнечного жмыха.
3.2. Качество мяса
pH мяса не был значительно затронут экспериментальными рационами (p > 0,05), со средним значением 5,56 (Таблица 5). Наблюдаемые значения pH указывают на то, что доступная концентрация гликогена у животных была удовлетворительной при убое и не была затронута увеличенным потреблением СЖ, которое в противном случае может препятствовать снижению pH до оптимальных уровней [39]. Схожие результаты наблюдали Жуниор и др. [35] при включении подсолнечного жмыха в рационы ягнят, содержащие до 9,5% СЖ, и Оливейра и др. [40] в рационах коз.
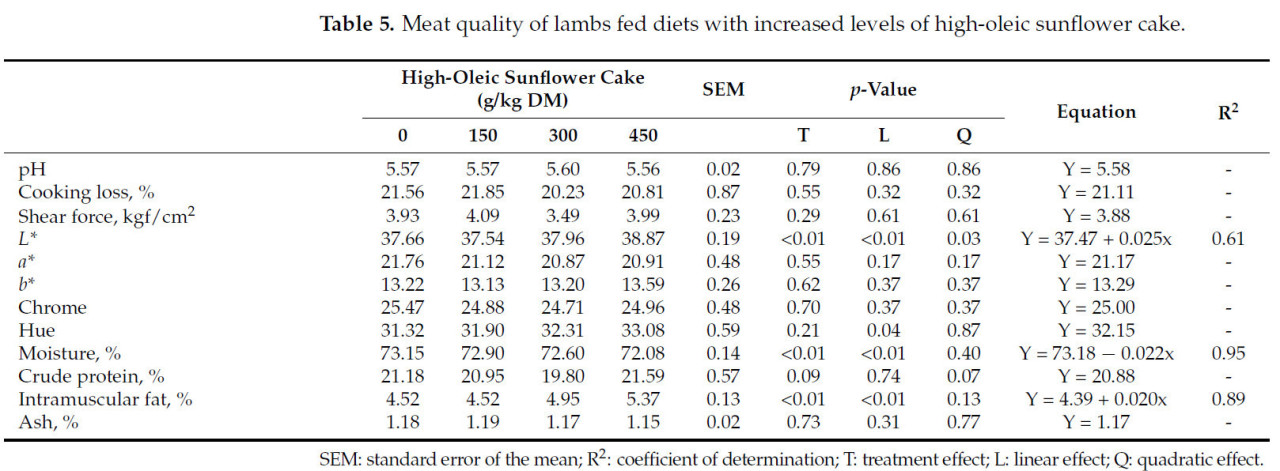
Таблица 5. Качество мяса ягнят, получавших рационы с возрастающими уровнями высокоолеинового подсолнечного жмыха.
Включение высокоолеинового подсолнечного жмыха не повлияло значительно на потери при приготовлении или значения усилия сдвига (p > 0,05) (Таблица 5). Усилие сдвига обычно используется как показатель жесткости мяса и связано с более высокими концентрациями внутримышечного жира [41]. Хотя разницы в усилии сдвига не наблюдалось, наблюдалось линейное увеличение концентрации внутримышечного жира и L* с включением до 450 г/кг СВ высокоолеинового подсолнечного жмыха в рацион ягнят (p < 0,01) (Таблица 5). Увеличение L* связано с увеличением содержания жира, так как этот компонент способствует более высокой светимости мяса [42]. Этот эффект на светлоту через добавление жира в мясо также сообщался Брито и др. [43] и Холманом и др. [44]. Более высокий уровень питания в период откорма ассоциируется с увеличением подкожного и внутримышечного жира. Показано, что повышенная концентрация внутримышечного жира снижает жесткость говядины, что, как предположил Накамура и др. [45], связано с изменениями в архитектуре коллагена. Дополнительно, это повышение может влиять на восприятие жесткости потребителем, улучшая сочность и вкус мяса. Не было эффекта обработки на значения a*, b*, Chroma и hue (p > 0,05) (Таблица 5). Включение высокоолеинового подсолнечного жмыха в рационы ягнят линейно снижало содержание влаги в мясе (p < 0,01). Этот результат связан с увеличением жира, так как содержание липидов в мясе отрицательно ассоциировано с содержанием влаги [46]. Не было эффекта обработки на концентрации золы и сырого протеина в мясе ягнят (p > 0,05) (Таблица 5). Оливейра и др. [40] наблюдали ту же закономерность у коз, получавших подсолнечный жмых. Значительное увеличение концентрации внутримышечного жира наблюдалось Квеле и др. [6] при включении 170 г подсолнечного жмыха в рацион коз.
3.3. Профиль жирных кислот
Включение до 450 г/кг СВ высокоолеинового подсолнечного жмыха в рацион ягнят не повлияло значительно на лауриновую (C12:0) и миристиновую (C14:0) жирные кислоты (p > 0,05) (Таблица 6). Чикванха и др. [12] показали, что жирные кислоты с четным числом атомов углерода часто встречаются в овечьем мясе, и их неблагоприятные эффекты на здоровье человека широко обсуждаются. Жирные кислоты с 12–16 углеродами нежелательны для здоровья человека, потому что они повышают сывороточную концентрацию липопротеинов низкой плотности, способствуя увеличению коагуляции, воспаления и инсулинорезистентности [47]. В настоящем исследовании концентрация пальмитиновой кислоты (C16:0) снижалась (p < 0,01) с включением высокоолеинового подсолнечного жмыха; с другой стороны, наблюдалось увеличение концентрации стеариновой кислоты (C18:0) (p < 0,01). Эти результаты полезны для здоровья человека, так как пальмитиновая кислота ассоциируется с развитием сердечно-сосудистых заболеваний (ССЗ) [48], а стеариновая кислота ассоциируется с защитой против ССЗ [15].
Таблица 6. Состав жирных кислот (г/100г метиловых эфиров жирных кислот) длиннейшей мышцы спины ягнят, получавших рационы с возрастающими уровнями высокоолеинового подсолнечного жмыха.
Руминная биогидрогенизация может негативно affected высоким включением полиненасыщенных жирных кислот в рацион [49]. Дополнительно, превращение C18:1 в C18:0 нарушается из-за снижения pH рубца, resulting из высокого потребления быстроферментируемых углеводов [50]. В настоящем исследовании источник жира и поставка волокнистых углеводов, оба обеспечиваемые подсолнечным жмыхом, способствовали поддержанию метаболизма рубца, благоприятствуя полной биогидрогенизации и образованию стеариновой кислоты, которая впоследствии депонировалась в мясе. Дополнительно, значительное увеличение диетического потребления C18:1 с повышенными уровнями высокоолеинового подсолнечного жмыха могло потенцировать заключительную стадию процесса руминальной биогидрогенизации, непрерывно обеспечивая высокую концентрацию предшественника C18:0.
Включение высокоолеинового подсолнечного жмыха в рацион значительно снизило сумму НЖК (p < 0,01). Наблюдалось увеличение концентрации олеиновой кислоты (C18:1 цис-9) в мясе с включением высокоолеинового подсолнечного жмыха (p < 0,01) как результат высокой концентрации этой жирной кислоты в используемом побочном продукте. Значительное снижение ферментативной активности Δ9-десатуразы 18 (p < 0,01) и Δ9-десатуразы 16 (p < 0,01) наблюдалось с включением высокоолеинового подсолнечного жмыха. Снижение Δ9-десатуразы 18 связано с модулирующим эффектом C18:1 цис-9 на связывающий элемент стеролов регуляторный белок-1c (SREBP-1c), транскрипционный фактор, кодирующий гены для фермента Δ9-десатуразы (SCD1) [51]. Чой и др. [52] сообщали, что олеиновая кислота downregulated экспрессию SCD1 в подкожных и внутримышечных преадипоцитах крупного рогатого скота.
Включение до 450 г/кг СВ высокоолеинового подсолнечного жмыха в рацион снизило концентрацию пальмитолеиновой кислоты (C16:1 цис-9) в мясе (p < 0,01). Эта мононенасыщенная жирная кислота ассоциируется с увеличением инсулинорезистентности [53]. Это явление могло вызвать линейное увеличение стеариновой кислоты (p < 0,01), которая является жирной кислотой с наибольшим рубцовым потоком для абсорбции в тонком кишечнике [54].
Незаменимые жирные кислоты серий n6 (линолевая) и n3 (линоленовая) являются основными жирными кислотами, которые способствуют благополучию и здоровью человека [55]. В настоящем исследовании включение высокоолеинового подсолнечного жмыха снижало концентрацию этих жирных кислот в рационах (Таблица 2), что resulted в снижении концентрации n6 в мясе (p < 0,01) (Таблица 6). Хотя наблюдалось снижение концентрации линолевой кислоты в рационах с включением высокоолеинового подсолнечного жмыха, этот результат не повлиял на концентрацию линоленовой кислоты в мясе (p > 0,05). Исследование с крупным рогатым скотом, получавшим подсолнечный жмых до 27% в СВ, подтверждает результаты для линоленовой кислоты в мясе; однако были противоположные находки для концентрации линолевой кислоты и ЭПК [56]. Включение высокоолеинового подсолнечного жмыха в рацион снизило сумму ПНЖК в мясе (p < 0,02) как результат внутренних характеристик используемого побочного продукта, который представлял небольшое количество ПНЖК (5,66 г/100 г).
Включение высокоолеинового подсолнечного жмыха в рацион привело к линейному увеличению руменовой кислоты (C18:2 цис-9 транс-11) и конъюгированной линолевой кислоты (КЛК), достигнув приблизительно 27% увеличения по сравнению с контрольным рационом. КЛК — это жирная кислота, ассоциированная с профилактикой таких заболеваний, как рак, атеросклероз, нарушения белкового и энергетического обмена и сниженный иммунный ответ [12,57]. КЛК может образовываться в процессе руминальной биогидрогенизации или под действием Δ9-десатуразы на вакценовую кислоту в тканях [58]. В настоящем исследовании наблюдалось снижение активности Δ9-десатуразы с включением высокоолеинового подсолнечного жмыха в рацион, что позволяет предположить, что наибольший вклад в увеличение КЛК в мясе был обусловлен процессом биогидрогенизации. Возможно, более высокая концентрация липидов в рационах с включением высокоолеинового подсолнечного жмыха по сравнению с контрольным рационом увеличила поставку промежуточных продуктов биогидрогенизации жирных кислот в рубце в тонкий кишечник. Во время биогидрогенизации ЖК, включая промежуточный продукт КЛК, ЖК постоянно покидают рубец, абсорбируются в тонком кишечнике и могут депонироваться в мышечной ткани [59].
Включение высокоолеинового подсолнечного жмыха в рацион ягнят не повлияло на ДГК (p > 0,05); однако оно увеличило ЭПК (p < 0,01) и снизило ДПК (p < 0,01). Превращение C18:2 и C18:3 в ПНЖК зависит от соотношения n6/n3 в рационе [60]. Активность элонгазы увеличивалась с включением высокоолеинового подсолнечного жмыха в рацион (p < 0,01); однако это не увеличило концентрацию ДПК и ДГК. Этот результат связан с большими долями C18:0 и меньшей долей C16:0 в мясе ягнят, получавших высокоолеиновый подсолнечный жмых, по сравнению с контрольным рационом. Сумма жирных кислот n3 и n6 снизилась (p < 0,01) с включением подсолнечного жмыха, снизив соотношение n6/n3 (p < 0,01). Омега-3 жирные кислоты являются предшественниками ряда биологически активных жирных кислот, важных для снижения риска сердечно-сосудистых, онкологических заболеваний и болезни Альцгеймера [61]. Желательные значения для соотношения n6/n3 в пищевых продуктах для потребления человеком находятся между 2 и 6 [62,63]. Хотя включение высокоолеинового подсолнечного жмыха снизило концентрацию жирных кислот n3 и n6 в мясе, наблюдалось линейное снижение атерогенного и тромбогенного индексов (p < 0,01). Более низкие значения атерогенного и тромбогенного индексов ассоциированы с большим количеством антиатерогенных жирных кислот [64]. Включение высокоолеинового подсолнечного жмыха в рацион ягнят улучшило профиль жирных кислот, что подтверждается снижением насыщенных жирных кислот в мясе.
4. Выводы
Добавка в рацион ягнят на откорме до 450 г/кг СВ подсолнечного жмыха, богатого олеиновой кислотой, не повлияла на продуктивность животных, даже у тех ягнят, которые потребляли рационы, содержащие приблизительно 9% сырого жира. Хотя возрастающие уровни высокоолеинового подсолнечного жмыха в рационе ягнят снижали выход туши и увеличивали жировые отложения, включение до 450 г/кг СВ высокоолеинового подсолнечного жмыха в рацион ягнят значительно снизило концентрацию гиперхолестеринемических жирных кислот (C14:0 и C16:0), увеличило концентрацию жирных кислот с нейтральным или защитным эффектом на сердечно-сосудистые заболевания (C18:0 и C18:1), а также ЭПК и КЛК в мясе. Это исследование демонстрирует потенциал использования до 450 г/кг СВ высокоолеинового подсолнечного жмыха в рационах для ягнят на откорме для улучшения питательных свойств красного мяса без ущерба для продуктивности животных.
Ссылки
1. Duca, D.; Toscano, G.; Riva, G.; Mengarelli, C.; Rossini, G.; Pizzi, A.; Pedretti, E.F. Quality of residues of the biodiesel chain in the energy field. Ind. Crops Prod. 2015, 75, 91–97. [Google Scholar] [CrossRef]
2. Lima, A.G.V.O.; Silva, T.M.; Bezerra, L.R.; Pereira, E.S.; Barbosa, A.M.; Ribeiro, R.D.X.; Rocha, T.C.; Trajano, J.S.; Oliveira, R.L. Intake, digestibility, nitrogen balance, performance and carcass traits of Santa Ines lamb fed with sunflower cake from biodiesel production. Small Rumin. Res. 2018, 168, 19–24. [Google Scholar] [CrossRef]
3. FAO. The State of Food and Agriculture. In FAO Biofuels: Prospects, Risks and Opportunities; FAO: Rome, Italy, 2008. [Google Scholar]
4. Ferfuia, C.; Vanozzi, G.P. Maternal effect on seed fatty acid composition in a reciprocal cross of high oleic sunflower (Helianthus annuus L.). Euphytica 2015, 205, 325–336. [Google Scholar] [CrossRef]
5. Melo, M.A.R.; Maria, A.M.F.; Silva, E.V.; Filho, J.R.C.; Souza, A.G. Study of the oxidative stability of oils vegetables for production of biodiesel. Rev. Verde Agroecologia Desenvolv. Sustent. 2014, 9, 84–88. [Google Scholar]
6. Qwele, K.; Hugo, A.; Oyedemi, S.O.; Moyo, B.; Masika, P.J.; Muchenje, V. Chemical composition, fatty acid content and antioxidant potential of meat from goats supplemented with Moringa (Moringa oleifera) leaves, sunflower cake and grass hay. Meat Sci. 2013, 93, 455–462. [Google Scholar] [CrossRef] [PubMed]
7. Selvam, T.A.; Manikantan, M.R.; Chand, T.; Sharma, R.; Seerangrayar, S. Compression loading behaviour of sunflower seeds and kernels. Int. Agrophys. 2014, 28, 543–548. [Google Scholar] [CrossRef]
8. Wood, J.D.; Richardson, R.I.; Nute, G.R.; Fisher, A.V.; Campo, M.M.; Kasapidou, E.; Sheard, P.R.; Enser, M. Effects of fatty acids on meat quality: A review. Meat Sci. 2004, 66, 21–32. [Google Scholar] [CrossRef]
9. Alvarenga, T.I.R.C.; Chen, Y.; Furusho-Garcia, I.F.; Perez, J.R.O.; Hopkins, D.L. Manipulation of Omega-3 PUFAs in lamb: Phenotypic and genotypic views. Compr. Rev. Food Sci. Food Saf. 2015, 14, 189–204. [Google Scholar] [CrossRef] [PubMed]
10. Daley, C.A.; Abbott, A.; Doyle, P.S.; Nader, G.A.; Larson, S. A review of fatty acid profiles and antioxidant content in grass-fed and grain-fed beef. Nutr. J. 2010, 9, 2891–2899. [Google Scholar] [CrossRef]
11. Shingfield, K.J.; Bonnet, M.; Scollan, N.D. Recent developments in altering the fatty acid composition of ruminant-derived foods. Animal 2013, 7, 132–162. [Google Scholar] [CrossRef]
12. Chikwanha, O.C.; Vahmani, P.; Muchenje, V.; Dugan, M.E.; Mapiye, C. Nutritional enhancement of sheep meat fatty acid profile for human health and wellbeing. Food Res. Int. 2018, 104, 25–38. [Google Scholar] [CrossRef]
13. Bressan, M.C.; Rossato, L.V.; Rodrigues, E.C.; Alves, S.P.; Bessa, R.J.B.; Ramos, E.M.; Gama, L.T. Genotype x environment interactions for fatty acid profiles in Bos indicus and Bos taurus finished on either pasture or grain. J. Anim. Sci. 2011, 89, 221–232. [Google Scholar] [CrossRef]
14. Wood, J.D.; Enser, M.; Fisher, A.V.; Nute, G.R.; Sheard, P.R.; Richardson, R.I.; Hughes, S.I.; Whittington, F.M. Fat deposition, fatty acid composition and meat quality: A review. Meat Sci. 2008, 78, 343–358. [Google Scholar] [CrossRef]
15. Hunter, J.E.; Zhang, J.; Kris-Etherton, P.M. Cardiovascular disease risk of dietary stearic acid compared with trans, other saturated, and unsaturated fatty acids: A systematic review. Am. J. Clin. Nutr. 2010, 91, 46–63. [Google Scholar] [CrossRef] [PubMed]
16. Jenkins, T.C. Lipid Metabolism in the Rumen. J. Dairy Sci. 1993, 76, 3851–3863. [Google Scholar] [CrossRef]
17. Moura, E.S.; Silva, L.D.F.; Peixoto, E.L.T.; Bumbieris Junior, V.H.; Ribeiro, E.L.A.; Mizubuti, I.Y.; Fortaleza, A.P.S. Sunflower cake in diets for lambs: Intake, digestibility, nitrogen balance and rumen parameters. Semina Ciênc. Agrár. 2015, 36, 2247–2258. [Google Scholar] [CrossRef]
18. NRC. Nutrient Requirements of Dairy Cattle, 7th ed.; National Academy Press: Washington, DC, USA, 2001. [Google Scholar]
19. AOAC. Association of Official Analytical Chemists, 18th ed; Official Methods of Analysis; AOAC: Gaithersburg, MD, USA, 1990. [Google Scholar]
20. Van Soest, P.V.; Robertson, J.B.; Lewis, B.A. Methods for dietary fiber, neutral detergent fiber, and no starch polysaccharides in relation to animal nutrition. J. Dairy Sci. 1991, 74, 3583–3597. [Google Scholar] [CrossRef]
21. MacDougall, D.B. Colour of meat. In Quality Attributes and Their Measurement in Meat, Poultry and Fish Products; Pearson, A.M., Dutson, T.R., Eds.; Advances in Meat Research Series; Blackie Academic and Professional: London, UK, 1994; pp. 79–93. [Google Scholar]
22. Wheeler, T.L.; Shackelford, S.D.; Koohmaraie, M. Sampling, Cooking, and Coring Effects on Warner-Bratzler Shear Force Values in Beef. J. Anim. Sci. 1996, 74, 1553–1562. [Google Scholar] [CrossRef] [PubMed]
23. Hara, A.; Radin, N.S. Lipid extraction of tissues with a low-toxicity solvent. Anal. Biochem. 1978, 90, 420–426. [Google Scholar] [CrossRef]
24. Rodríguez-Ruiz, J.; Belarbi, E.H.; Sánchez, J.L.G.; Alonso, D.L. Rapid simultaneous lipid extraction and transesterification for fatty acid analyses. Biotechnol. Tech. 1998, 12, 689–691. [Google Scholar] [CrossRef]
25. Malau-Aduli, A.E.O.; Siebert, B.D.; Bottema, C.D.K.; Pitchford, W.S. A comparison of the fatty acid composition of triacylglycerols in adipose tissue from Limousin and Jersey cattle. Aust. J. Agric. Res. 1997, 48, 715–722. [Google Scholar] [CrossRef]
26. Ulbricht, T.L.V.; Southgate, D.A.T. Coronary heart disease: Seven dietary factors. Lancet 1991, 338, 985–992. [Google Scholar] [CrossRef] [PubMed]
27. Palmquist, D.L.; Jenkins, T.C. A 100-Year Review: Fat feeding of dairy cows. J. Dairy Sci. 2017, 100, 10061–10077. [Google Scholar] [CrossRef]
28. Palmquist, D.L.; Mattos, W.R.S. Metabolismo de lipídeos. In Nutrição de Ruminantes; Funep: Jaboticabal, Brazil, 2006. [Google Scholar]
29. Maia, M.R.G.; Chaudhary, L.C.; Bestwick, C.S.; Richardson, A.J.; McKain, N.; Larson, T.R.; Graham, I.A.; Wallace, R.J. Toxicity of unsaturated fatty acids to the biohydrogenating ruminal bacterium, Butyrivibrio fibrisolvens. BMC Microbiol. 2010, 10, 52. [Google Scholar] [CrossRef]
30. Hristov, A.N.; Grandeen, K.L.; Ropp, J.K.; McGuire, M.A. Effect of sodium laurate on ruminal fermentation and utilization of ruminal ammonia nitrogen for milk protein synthesis in dairy cows. J. Dairy Sci. 2004, 87, 1820–1831. [Google Scholar] [CrossRef] [PubMed]
31. Oldick, B.S.; Firkins, J.L. Effects of degree of fat saturation on fiber digestion and microbial protein synthesis when diets are fed twelve times daily. J. Anim. Sci. 2000, 78, 2412–2420. [Google Scholar] [CrossRef] [PubMed]
32. Weld, K.; Armentano, L.E. Milk fat secretion in lactating dairy cattle is influenced by soybean particle size and fatty acid profile. J. Dairy Sci. 2016, 94, 344. [Google Scholar]
33. Kendall, C.; Leonardi, C.; Hoffman, P.C.; Combs, D.K. Intake and milk production of cows fed diets that differed in dietary neutral detergent fiber and neutral detergent fiber digestibility. J. Dairy Sci. 2009, 92, 313–323. [Google Scholar] [CrossRef]
34. Morril, J.L.; Van Horn, C.J.W. (Eds.) Large Dairy Herd Management; American Dairy Science Association: Savoy, IL, USA, 1992; pp. 401–410. [Google Scholar]
35. Junior, F.F.; Ribeiro, E.L.A.; Mizubuti, I.Y.; Silva, L.D.F.; Barbosa, M.A.A.F.; Prado, O.P.P.; Pereira, E.S.; Pimentel, P.G.; Constantino, C. Características de carcaça e qualidade da carne de cordeiros Santa Inês alimentados com torta de girassol em substituição ao farelo de algodão. Semin. Cienc. Agrar. 2013, 34, 3999–4014. [Google Scholar] [CrossRef]
36. Palmieri, A.D.; Oliveira, R.L.; Ribeiro, C.V.D.M.; Ribeiro, M.D.; Ribeiro, R.D.X.; Leão, A.G.; Agy, M.S.F.A.; Ribeiro, O.L. Effects of substituting soybean meal for sunflower cake in the diet on the growth and carcass traits of crossbred boer goat kids. Asian-Aust. J. Anim. Sci. 2012, 25, 59–65. [Google Scholar] [CrossRef] [PubMed][Green Version]
37. Hristov, A.N.; Kennington, L.R.; McGuire, M.A.; Hunt, C.W. Effect of diets containing linoleic acid- or oleic acid-rich oils on ruminal fermentation and nutrient digestibility, and performance and fatty acid composition of adipose and muscle tissues of finishing cattle. J. Anim. Sci. 2005, 83, 1312–1321. [Google Scholar] [CrossRef]
38. Torres, R.N.S.; Ghedini, C.P.; Chardulo, L.A.L.; Baldassini, W.A.; Curi, R.A.; Pereira, G.L.; Schoonmaker, J.P.; Almeida, M.T.C.; Costa, C.; Machado Neto, O.R. Potential of different strategies to increase intramuscular fat deposition in sheep: A meta-analysis study. Small Rumin. Res. 2024, 234, 107258. [Google Scholar] [CrossRef]
39. Apple, J.K.; Dikeman, M.E.; Minton, J.E.; McMurphy, R.M.; Fedde, M.R.; Leith, D.E.; Unruh, J.A. Effects of restraint and isolation stress and epidural blockade on endocrine and blood metabolite status, muscle glycogen metabolism, and incidence of dark-cutting Longissimus muscle of sheep. J. Anim. Sci. 1995, 73, 2295–2307. [Google Scholar] [CrossRef] [PubMed]
40. Oliveira, R.L.; Palmieri, A.D.; Carvalho, S.T.; Leão, A.G.; Abreu, C.L.; Ribeiro, C.V.D.M.; Pereira, E.S.; Carvalho, G.G.P.; Bezerra, L.R. Commercial cuts and chemical and sensory attributes of meat from crossbred Boer goats fed sunflower cake-based diets. Anim. Sci. J. 2015, 86, 557–562. [Google Scholar] [CrossRef]
41. Minick, J.A.; Dikeman, M.E.; Pollak, E.J.; Wilson, D.E. Heritability and correlation estimates of Warner-Bratzler shear force and carcass traits from Angus-, Charolais-, Hereford-, and Simmental-sired cattle. Can. J. Anim. Sci. 2004, 84, 599–609. [Google Scholar] [CrossRef]
42. Realini, C.E.; Duckett, S.K.; Brito, G.W.; Dalla Rizza, M.; De Mattos, D. Effect of pasture vs. concentrate feeding with or without antioxidants on carcass characteristics, fatty acid composition, and quality of Uruguayan beef. Meat Sci. 2004, 66, 567–577. [Google Scholar] [CrossRef] [PubMed]
43. Brito, G.F.; Ponnampalam, E.N.; Hopkins, D.L. The effect of extensive feeding systems on growth rate, carcass traits, and meat quality of finishing lambs. Compr. Rev. Food Sci. Food Saf. 2017, 16, 23–38. [Google Scholar] [CrossRef]
44. Holman, B.W.B.; Ven, R.V.; Mao, Y.; Coombs, C.E.O.; Hopkins, D.L. Using instrumental (CIE and reflectance) measures to predict consumers’ acceptance of beef colour. Meat Sci. 2017, 127, 57–62. [Google Scholar] [CrossRef] [PubMed]
45. Nakamura, Y.-N.; Tsuneishi, E.; Kamiya, M.; Yamada, A. Histological contribution of collagen architecture to beef toughness. J. Food Sci. 2020, 75, E73–E77. [Google Scholar] [CrossRef]
46. D’Alessandro, A.G.; Palazzo, M.; Petrotos, K.; Goulas, P.; Martemucci, G. Fatty acid composition of light lamb meat from Leccese and Comisana dairy breeds as affected by slaughter age. Small Rumin. Res. 2015, 127, 36–43. [Google Scholar] [CrossRef]
47. Calder, P.C. Functional roles of fatty acids and their effects on human health. J. Parenter. Enteral Nutr. 2015, 39, 18S–32S. [Google Scholar] [CrossRef] [PubMed]
48. Jiang, J.; Xiong, Y.L. Natural antioxidants as food and feed additives to promote health benefits and quality of meat products: A review. Meat Sci. 2016, 120, 107–117. [Google Scholar] [CrossRef] [PubMed]
49. Ladeira, M.M.; Schoonmaker, J.P.; Swanson, K.C.; Duckett, S.K.; Gionbelli, M.P.; Rodrigues, L.M.; Teixeira, P.D. Review: Nutrigenomics of marbling and fatty acid profile in ruminant meat. Animal 2018, 12, s282–s294. [Google Scholar] [CrossRef] [PubMed]
50. Fievez, V.; Vlaeminck, B.; Jenkins, T.; Enjalbert, F.; Doreau, M. Assessing rumen biohydrogenation and its manipulation in vivo, in vitro and in situ. Eur. J. Lipid Sci. Technol. 2007, 109, 740–756. [Google Scholar] [CrossRef]
51. Waters, S.M.; Kelly, J.P.; O’Boyle, P.; Moloney, A.P.; Kenny, D.A. Effect of level and duration of dietary n-3 polyunsaturated fatty acid supplementation on the transcriptional regulation of Δ9-desaturase in muscle of beef cattle. J. Anim. Sci. 2009, 87, 244–252. [Google Scholar] [CrossRef]
52. Choi, S.H.; Park, S.K.; Johnson, B.J.; Chung, K.Y.; Choi, C.W.; Kim, K.H.; Kim, W.Y.; Smith, S.B. AMPKα, C/EBPβ, CPT1β, GPR43, PPARγ, and SCD gene expression in single-and co-cultured bovine satellite cells and intramuscular preadipocytes treated with palmitic, stearic, oleic, and linoleic acid. Asian-Australas. J. Anim. Sci. 2015, 28, 411–419. [Google Scholar] [CrossRef] [PubMed]
53. Mozaffarian, D.; Micha, R.; Wallace, S. Effects on coronary heart disease of increasing polyunsaturated fat in place of saturated fat: A systematic review and meta-analysis of randomized controlled trials. PLoS Med. 2010, 7, e1000252. [Google Scholar] [CrossRef] [PubMed]
54. Bauman, D.E.; Lock, A.L. Milk fatty acid composition: Challenges and opportunities related to human health. In Proceedings of the 26th World Buiatrics Congress, Santiago, Chile, 14–18 November 2010; pp. 278–289. [Google Scholar]
55. Marangoni, F.; Agostoni, C.; Borghi, C.; Catapano, A.L.; Cena, H.; Ghiselli, A.; Poli, A. Dietary linoleic acid and human health: Focus on cardiovascular and cardiometabolic effects. Atherosclerosis 2020, 292, 90–98. [Google Scholar] [CrossRef]
56. Oliveira, V.S.; Oliveira, R.L.; Goes, R.H.T.B.; Silva, T.M.; Silva, L.F.; Freitas, L.S.; Pereira, E.S.; Bezerra, L.R. Physicochemical composition, fatty acid profile and sensory attributes of the meat of young Nellore bulls fed sunflower cake from the biodiesel industry. Livest. Sci. 2019, 227, 97–104. [Google Scholar] [CrossRef]
57. Jóźwiak, M.; Filipowska, A.; Fiorino, F.; Struga, M. Anticancer activities of fatty acids and their heterocyclic derivatives. Eur. J. Pharmacol. 2020, 871, 172937. [Google Scholar] [CrossRef]
58. Nute, G.R.; Richardson, R.I.; Wood, J.D.; Hughes, S.I.; Wilkinson, R.G.; Cooper, S.L.; Sinclair, L.A. Effect of dietary oil source on the flavour and the colour and lipid stability of lamb meat. Meat Sci. 2007, 76, 715–720. [Google Scholar] [CrossRef]
59. Enjalbert, F.; Combes, S.; Zened, A.; Meynadier, A. Rumen microbiota and dietary fat: A mutual shaping. J. Appl. Microbiol. 2017, 123, 782–797. [Google Scholar] [CrossRef]
60. Harnack, K.; Andersen, G.; Somoza, V. Quantitation of alpha-linolenic acid elongation to eicosapentaenoic and docosahexaenoic acid as affected by the ratio of n6/n3 fatty acids. Nutr. Metab. 2009, 19, 6–8. [Google Scholar] [CrossRef]
61. Nunes, B.; Pinho, C.; Sousa, C.; Melo, A.R.; Bandarra, N.; Silva, M.C. Relevance of omega-3 and omega-6/omega-3 ratio in preventing cognitive impairment. Acta Médica Portuguesa 2017, 30, 213–223. [Google Scholar] [CrossRef]
62. French, P.; Stanton, C.; Lawless, F.; O’riordan, E.G.; Monahan, F.J.; Caffrey, P.J.; Moloney, A.P. Fatty acid composition, including conjugated linoleic acid, of intramuscular fat from steers offered grazed grass, grass silage, or concentrate-based diets. J. Anim. Sci. 2000, 78, 2849–2855. [Google Scholar] [CrossRef]
63. Wood, J.D.; Enser, M. Factors influencing fatty acids in meat and the role of antioxidants in improving meat quality. Br. J. Nutr. 1997, 78, S49–S60. [Google Scholar] [CrossRef]
64. Turan, H.; Sönmez, G.; Kaya, Y. Fatty acid profile and proximate composition of the thornback ray (Raja clavata, L. 1758) from the Sinop coast in the Black Sea. J. Fish. Sci. 2007, 1, 97–103. [Google Scholar] [CrossRef]
Costa DM, Alvarenga TIRC, dos Santos IJ, Dias Junior PCG, Alvarenga FAP, Alves NG, Furusho-Garcia IF. Performance, Carcass Traits and Meat Quality of Lambs Fed with Increasing Levels of High-Oleic Sunflower Cake. Agriculture. 2025; 15(2):191. https://doi.org/10.3390/agriculture15020191
Перевод статьи «Performance, Carcass Traits and Meat Quality of Lambs Fed with Increasing Levels of High-Oleic Sunflower Cake» авторов Costa DM, Alvarenga TIRC, dos Santos IJ, Dias Junior PCG, Alvarenga FAP, Alves NG, Furusho-Garcia IF., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
































































































Комментарии (0)