Спектроскопия комбинационного рассеяния (Раман-спектроскопия) и её применение в оценке качества фруктов
Рамановская спектроскопия – это метод спектрального анализа, основанный на молекулярных колебаниях. В последние годы она получила широкое распространение в качестве практического инструмента для неинвазивной и быстрой характеристики или идентификации множества аналитов и соединений. В области контроля качества фруктов раман-спектроскопия используется для обнаружения органических соединений, таких как пигменты, фенолы и сахара, а также для анализа молекулярных структур специфических химических связей или функциональных групп, что обеспечивает ценную информацию для обнаружения заболеваний фруктов, анализа остатков пестицидов и определения происхождения.
Аннотация
Таким образом, методы Раман-спектроскопии продемонстрировали значительный потенциал в анализе пищевой сельскохозяйственной продукции в различных областях. Примечательно, что современный фронт исследований в Раман-спектроскопии переживает всплеск применения методов машинного обучения для повышения разрешения и качества получаемых спектров. В данной статье рассматриваются основные принципы и последние достижения в области Раман-спектроскопии, а также исследуются методы обработки данных с использованием машинного обучения в КР-спектроскопии, с особым акцентом на её применении для обнаружения болезней фруктов, анализа остатков пестицидов и идентификации происхождения. В заключение освещаются проблемы и будущие перспективы Раман-спектроскопии, предлагая эффективный ориентир для оценки качества фруктов.
1. Введение
С развитием современного сельского хозяйства фрукты стали важными источниками необходимых питательных веществ благодаря своему богатому содержанию минералов, витаминов и пищевых волокон [1]. Однако болезни плодов, вызываемые патогенными бактериями, и использование чрезмерного количества пестицидов привели к остаткам пестицидов во фруктах, что представляет значительную угрозу для жизни и здоровья человека, влияет на продажи фруктов в различных регионах и создает серьезную проблему для устойчивого развития фруктовой отрасли [2,3,4]. Для обнаружения и определения качества фруктов применялись различные методы, включая сенсорную оценку, ПЦР-анализ (Полимеразная Цепная Реакция), газовую хроматографию-масс-спектрометрию (ГХ-МС), спектральный анализ и другие. Сенсорная оценка подходит для оценки как внешних, так и определенных внутренних качеств фруктов, таких как свежесть, зрелость и внутренние дефекты, которые вызывают особую озабоченность [5]. ПЦР-анализ, известный своей высокой стабильностью и точностью, эффективно идентифицирует ДНК или РНК патогенов и обнаруживает мутации генов, связанные с генетическими заболеваниями. В последнее время ПЦР в реальном времени (кПЦР), мультиплексная ПЦР (мПЦР) и цифровая ПЦР (цПЦР) позволили амплифицировать специфические сегменты ДНК за более короткое время, открывая потенциал для точной диагностики и немедленного обнаружения [6]. ГХ-МС, известная своей высокой эффективностью разделения и быстрым анализом, в основном используется для обнаружения органических загрязнителей в воде или почве и анализа биологически активных соединений в растениях. Недавно внедрение ГХ-МС с тройным квадрупольным анализатором и ионного источника HES 2.0 позволило обнаруживать соединения при чрезвычайно низких уровнях концентрации, что имеет ключевое значение для применений, требующих исключительно высокой чувствительности [7].
Спектральный анализ широко используется в определении качества фруктов, биомедицинской идентификации и мониторинге окружающей среды благодаря своей высокой чувствительности, разрешающей способности и неразрушающему характеру. В зависимости от длины волны обнаружения и источника возбуждения, применяемые виды спектроскопии включают инфракрасную (ИК), ближнюю инфракрасную (БИК) и Раман-спектроскопию (РС) и другие. ИК- и БИК-спектроскопия облегчают как качественный, так и количественный анализ образцов. Развитие методов, таких как инфракрасная спектроскопия, усиленная поляритонами двумерных материалов, инфракрасная спектроскопия, усиленная фонон-поляритонами MoO3, и инфракрасная спектроскопия с поверхностным усилением, значительно усилило сигналы поглощения молекулярных колебаний, тем самым улучшив чувствительность обнаружения [8,9]. По сравнению с ИК- и БИК-спектроскопией, Раман-спектроскопия демонстрирует сильную применимость, включая устойчивость к помехам от влаги и минимальное потребление химических реагентов, особенно в сочетании с лазерными методиками, которые предлагают высокую монохроматичность и сильную направленность. Высокочувствительные детекторы и конфокальные микроскопы улучшили их возможности, поэтому РС стала широко принятым аналитическим инструментом в области определения качества фруктов [10]. Данный обзор посвящен применению Раман-спектроскопии в сочетании с машинным обучением для быстрого и неразрушающего анализа качества фруктов. В нем представлены принципы и последние достижения в методах обнаружения с помощью Раман-спектроскопии, которые используют алгоритмы машинного обучения, а затем предоставлен всесторонний обзор применений Раман-спектроскопии в выявлении болезней фруктов, анализе остатков пестицидов и идентификации происхождения. В заключение обсуждаются проблемы и будущие тенденции Раман-спектроскопии для неразрушающего и быстрого анализа качества фруктов. Этот обзор направлен на предоставление новых перспектив и прокладывание пути для будущего применения Раман-спектроскопии в определении качества фруктов.
2. Основные методики Раман-спектроскопии
2.1. Принцип методики Раман-спектроскопии
При спектроскопическом обнаружении фотоны, испускаемые лазером, взаимодействуют с электронными облаками и молекулярными связями в образце, приводя к релеевскому и рамановскому рассеянию. Возбужденные молекулы переходят из основного состояния на более высокий энергетический уровень, а затем возвращаются на другие колебательные уровни. Этот процесс делится на стоксово рамановское рассеяние, при котором энергия фотона уменьшается с hν₀ до hν₀ − hνm, и антистоксово рамановское рассеяние, при котором энергия фотона увеличивается с hν₀ до hν₀ + hνm. Переходы уровней электронной энергии для рамановского и релеевского рассеяния показаны на Рисунке 1 [11,12,13]. Согласно распределению Больцмана, молекулы в основном состоянии более стабильны в тепловом равновесии; таким образом, большинство молекул находятся в этом состоянии. Поскольку стоксово рамановское рассеяние включает переходы из основного состояния, его вероятность выше, чем у антистоксова рамановского рассеяния.
Интенсивность рамановского сигнала зависит от концентрации, что позволяет проводить количественный анализ [14]. Соотношение между этими параметрами может быть выражено как:
где ν — частота падающего лазерного излучения, I₀ — интенсивность падающего лазерного излучения, N — число рассеивающих молекул в данном состоянии, α — поляризуемость молекул, а φ — амплитуда молекулярных колебаний.
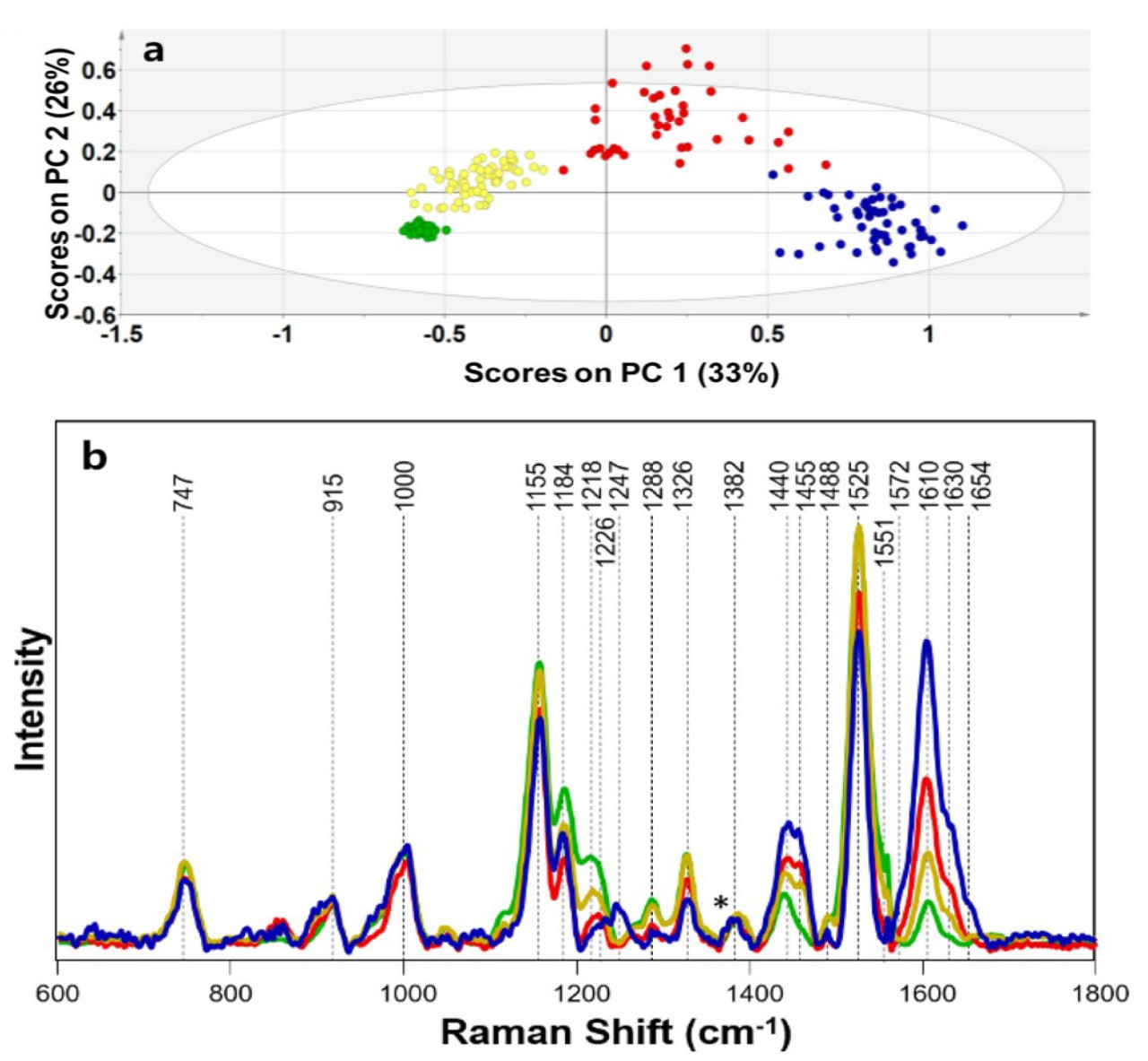
Во время рамановского рассеяния изменения энергии фотона производят рамановские сдвиги, которые возникают из-за изменений молекулярных колебаний или спиновых состояний. Соответственно, колебания растяжения и спиновые состояния химических связей молекул могут быть проанализированы с помощью Раман-спектроскопии. Изначально Раман-спектроскопия применялась для обнаружения водородных связей, но с тех пор усовершенствована для идентификации ковалентных связей, таких как C−C, −C=C−, N−O и C−H связи [15]. Например, каротиноиды в цитрусовых проявляют три выраженные характеристические пики Рамана при сдвигах 1003 см⁻¹, 1155 см⁻¹ и 1520 см⁻¹, соответствующие колебаниям растяжения связи −C=C−, колебаниям растяжения связи C−C и колебаниям CH3 в плоскости соответственно, как показано на Рисунке 2 [16]. Изменения в содержании органических соединений могут быть оценены путем анализа положения и интенсивности колебаний на этих пиках. Во время получения Раман-спектров помехи от окружающего света и колебания температуры заметно влияют на результаты. Фоновый свет вносит дополнительные сигналы в детектор, которые накладываются на истинный Раман-спектр, что приводит к увеличению фонового шума и снижению отношения сигнал/шум. Поэтому во время измерений следует экранировать источники фонового света и устранять помехи от фонового света в спектре. Оптические компоненты спектрометров должны работать при их расчетной рабочей температуре. Колебания температуры влияют на показатель преломления оптических элементов, оптический путь и производительность фокусировки. Таким образом, необходимо получать спектры в условиях постоянной температуры [17,18]. Процесс генерации рамановского сигнала включает фотоны, испускаемые лазером, которые преломляются на образце через дихроичное зеркало. Затем рассеянный свет фильтруется и передается в спектрометр через дихроичное зеркало и фильтр. Наконец, луч фокусируется на детекторе, где собранный сигнал преобразуется в электрический сигнал [19]. Конфигурация Раман-спектрометра проиллюстрирована на Рисунке 3.
Интенсивность сигнала Раман-спектра очень низка при отсутствии механизма усиления; таким образом, особенно трудно получить информацию Раман-спектра из внутренней части образца, так как Раман-спектры обычно генерируются, когда поверхность взаимодействует с падающим светом. Кроме того, поперечное сечение рассеяния большинства молекул очень мало, и они могут производить сильный флуоресцентный фон под лазерным излучением, который мешает рамановскому сигналу и затрудняет его захват [20]. Чтобы преодолеть эти проблемы в Раман-спектроскопии, все более широко применяются передовые спектральные методики, такие как Раман-спектроскопия с поверхностным усилением (SERS), Конфокальная микро-Раман-спектроскопия (CM-RS) и Раман-спектроскопия с пространственным смещением (SORS) [21].
2.2. Раман-спектроскопия с поверхностным усилением (SERS)
Для усиления интенсивности рамановского сигнала целевые молекулы адсорбируются на поверхности подложки из металлических наночастиц (НЧ) благодаря эффекту поверхностного плазмонного резонанса металлических НЧ и переносу заряда между молекулами и металлами, как показано на Рисунке 4, где как физические, так и химические механизмы усиления усиливают интенсивность рамановского рассеяния до 10¹⁴ раз. Однако интенсивность усиливается только в 10⁴–10⁶ раз при отсутствии НЧ [22,23]. Таблица 1. Оптимальные типы и морфологии металлических подложек для обнаружения соединений во фруктах с использованием методики SERS представляет оптимальные типы и морфологии металлических подложек для обнаружения соединений фруктов с использованием методики SERS. Металлические подложки играют ключевую роль в SERS, поэтому подготовка металлических подложек необходима для достижения усиления рамановского сигнала. Обычно подложки могут быть приготовлены с использованием методов, таких как электрохимическое осаждение, вакуумное испарение и металлические золи [24,25,26]. При приготовлении с использованием электрохимического осаждения такие подложки подходят для обнаружения загрязнителей и неадсорбируемых аналитов в воздухе, почве и воде, но они часто проявляют неравномерное распределение и ограниченную гибкость. Металлическая пленка, осажденная вакуумным испарением для подложек SERS, подходит для материалов, таких как полиметилметакрилат (ПММА), поливинилиденфторид (ПВДФ), полидиметилсилоксан (ПДМС), полиэтилентерефталат (ПЭТ) и белки. В качестве альтернативы, периодические складчатые наноструктуры золота SERS-подложки и гибкие SERS-подложки, приготовленные с использованием металлических золей, подходят для обнаружения добавок, остатков пестицидов, микотоксинов и других загрязнителей в пище.
Таблица 1.Оптимальные типы и морфологии металлических субстратов для SERS-детектирования различных фруктовых соединений.
Приготовление периодических складчатых наноподложек использует динамическую литографию АСМ (атомно-силовая микроскопия) и техники нанорезки для точного контроля периодов и ширины нанозазоров складчатых наноструктур, тем самым оптимизируя эффект поверхностного плазмонного резонанса для усиления рамановского сигнала. Методика SERS, основанная на периодических складчатых наночастицах золота, была применена в обнаружении органических соединений в подложке. Ye и др. [27] разработали подложки из периодических складчатых наноструктур золота, которые проявляют трехмерный нано-фокусирующий эффект, эффект "горячих точек" и эффект стоячей волны, создавая чрезвычайно высокое электромагнитное поле для усиления рамановского сигнала. Минимальный предел обнаружения для п-аминотиофенола (PATP) на подложке достиг 10–9 М. Когда эта подложка не применялась, Zhang и др. [28] использовали методику SERS с использованием IP6@Au с Fe³⁺ в качестве усилителя. Минимальный предел обнаружения 10⁻⁷ М для PATP на подложке был достигнут.
Приготовление гибких подложек осаждает плазменные наноматериалы на поверхность вспомогательных материалов, таких как поливиниловый спирт, целлюлоза и биопленка. Когда подложка изгибается и складывается, гибкость и термическая стабильность остаются отличными, позволяя применять ее в различных формах. SERS на основе гибких материалов широко применяется в обнаружении патогенов пищевого происхождения и витаминов в пище. Благодаря обилию гидроксильных групп на целлюлозе, наночастицы серебра легко связываются с целлюлозами, образуя гибкий SERS-чип. Pham и др. использовали этот SERS-чип для обнаружения остатков тирама в яблоках, достигнув минимального предела обнаружения 1.01 × 10⁻⁸ М. По мере уменьшения концентрации с 1.0 × 10⁻³ М до 1.0 × 10⁻⁹ М, интенсивность пика постепенно уменьшается на жестких подложках, тогда как интенсивность пика на гибких подложках остается четко наблюдаемой в этом диапазоне. Соответствующие Раман-спектры показаны на Рисунке 5 [29]. SERS может достигать обнаружения одиночных молекул, с пределами обнаружения до 1.0 × 10⁻⁹ М или даже ниже в определенных случаях, что делает его высоко подходящим для применений в биомедицинском и пищевом обнаружении безопасности.
2.3. Конфокальная микро-Раман-спектроскопия (CM-RS)
Конфокальная микро-Раман-спектроскопия (CM-RS) сочетает в себе возможность высокоразрешающей визуализации конфокальной микроскопии с возможностью химического анализа Раман-спектроскопии путем совмещения источника лазерного света, образца и детектора для эффективного отфильтровывания рассеянного света из расфокусированных областей образца. Изначально CM-RS имела пространственное разрешение в диапазоне от 0.5 до 1 мкм. С введением методов, таких как ближнепольная Раман-спектроскопия (NRS) и Раман-спектроскопия с временным разрешением (TRS), пространственное разрешение микро-Раман-спектрометров было значительно улучшено, достигая уровней всего в несколько нанометров и даже десятков нанометров [30], со структурой спектрометра, проиллюстрированной на Рисунке 6 [31]. Из-за ограниченной способности поляризации спектрометра CM-RS, спектрометр с возможностью поляризации предоставляет информацию о симметрии молекулярных колебаний внутри Раман-спектров, помогая в идентификации и характеристике молекулярных структур.
Acher и др. улучшили микроскоп с возможностью анализа поляризации, как показано на Рисунке 7. В экспериментах по Раман-поляризации, проведенных на кремнии, они наблюдали отношение I_X-Pol/I_Co-Pol 0.61 со стандартным отклонением 2%. Это устройство позволяет одновременно измерять как со-поляризационные, так и кросс-поляризационные Раман-спектры, позволяя получать "неполяризованные" Раман-спектры вместе с информацией о поляризации. Эта возможность особенно ценна для изучения кристаллической ориентации и напряженного состояния анизотропных образцов [32].
2.4. Раман-спектроскопия с пространственным смещением (SORS)
Для обнаружения рамановских сигналов во внутренней части образца, Раман-спектроскопия с пространственным смещением (SORS) получает информацию о молекулярной структуре на глубине путем регулировки пространственного смещения между фокальной точкой источника лазера и фокальной точкой линзы, как показано на Рисунке 8. Первая зарегистрированная глубина для SORS составляла 3 мм. Недавние достижения в методике показали, что глубина обнаружения теперь может достигать до 5 см. SORS может обнаруживать информацию во внутренней части образца без контакта с ним, но не может усиливать рамановский сигнал [33,34,35]. В отличие от этого, Обратная Раман-спектроскопия с пространственным смещением (ISORS) применяет коническую линзу для генерации кольцеобразного луча, с радиусом кольца, точно контролируемым путем варьирования расстояния между линзой и образцом, достигая усиления рамановского сигнала.
McMillan и др. применили методику ISORS для смещения точки сбора Раман-спектров от точки падения лазера, эффективно уменьшая флуоресцентные фоновые помехи, как показано на Рисунке 9 [36]. Используя эту методику, интенсивность рамановского сигнала и отношение сигнал/шум для образцов, загороженных стеклянными бутылками, увеличились в три раза по сравнению с исходным методом. Методика SORS позволяет обнаруживать Раман-информацию из более глубоких слоев внутри образцов, что делает ее подходящей для применений в биомедицинских исследованиях и анализе сельскохозяйственной продукции.
Кроме того, Раман-спектроскопия с Фурье-преобразованием, Раман-спектроскопия с усилением на острие и Стимулированная Раман-спектроскопия улучшают отношение сигнал/шум, усиливают интенсивность рамановского сигнала и достигают высокого пространственного разрешения. В последние годы были разработаны различные модели Раман-спектрометров, и подходящие Раман-спектрометры могут быть выбраны в соответствии с химическим составом образца, спектральным разрешением и экспериментальными условиями. Следовательно, различные Раман-спектрометры, как неразрушающие, высокочувствительные и универсальные аналитические инструменты, были широко применены в различных областях, таких как безопасность пищевых продуктов, наука о материалах и науки о жизни. Таблица 2. Сводка и сравнение принципов и применений методов, связанных с Раман-спектроскопией представляет несколько принципов и применений технологий, связанных с Раман-спектроскопией. Таблица 3. Сводка и сравнение возбуждающих длин волн, спектральных диапазонов и разрешений различных Раман-спектрометров представляет возбуждающие длины волн, спектральные диапазоны и разрешения различных Раман-спектрометров.
Различные длины волн источников возбуждения применяются в Раман-спектрометрах, которые варьируются от ультрафиолетового (УФ) до ближнего инфракрасного (БИК) диапазона и даже дальше. В соответствии с характеристиками поглощения образца и спектральным разрешением, следует применять различные длины волн возбуждения. На интенсивность рассеяния света, фоновую флуоресценцию и время сбора влияет длина волны возбуждения. Например, ультрафиолетовые длины волн возбуждения варьируются от 100 до 400 нм. Они обладают сильным рамановским рассеянием и подходят для органических биологических образцов, таких как белки, нуклеиновые кислоты и биопленки, благодаря их резонансу с ультрафиолетовым возбуждающим светом для усиления рамановского сигнала [37].
3. Обработка и анализ данных
Молекулярная структурная информация, полученная из данных Раман-спектров, способствует структурной характеристике и идентификации вещества, что полезно как для количественного, так и для качественного анализа. Предварительная обработка данных улучшает качество спектров, в то время как последующая обработка подчеркивает извлечение признаков и моделирование с предварительно обработанными данными, уменьшая вычислительную сложность и повышая аналитическую эффективность [44].
3.1. Предварительная обработка спектров
Флуоресцентные фоны и космические пики, вызванные оптическими эффектами и характеристиками отклика детектора Раман-спектрометра, приводят к множественным наложениям или схожим спектральным особенностям. Поэтому необработанные Раман-спектры требуют предварительной обработки, такой как коррекция выбросов, коррекция базовой линии и сглаживание, чтобы обеспечить точную идентификацию аналита [45,46].
3.1.1. Коррекция выбросов (Spike Correction)
Детектор в Раман-спектрометре представляет собой прибор с зарядовой связью (ПЗС), который может обнаруживать высокоэнергетические заряженные частицы из космоса, одновременно захватывая рассеянный свет. Это приводит к появлению в Раман-спектрах случайных, однонаправленных, узких и острых пиков, которые ошибочно интерпретируются как истинные рамановские пики. Поэтому необходима коррекция выбросов для Раман-спектров [47]. Коррекция выбросов делится на три категории. Первая категория включает повторяющийся сбор, такой как робастное суммирование и спектры верхней границы, которые требуют сбора по крайней мере двух спектров и не подходят для динамического обнаружения [48]. Вторая категория ориентирована на аппаратные улучшения для повышения производительности оптических detection устройств, и, по сравнению с теоретическими методами, эти подходы более сложны и дороги [49]. Последняя категория — это обнаружение по одному спектру, включая такие методы, как медианная фильтрация и интерполяционная фильтрация.
Медианная фильтрация и интерполяционная фильтрация заменяют пики рамановских сигналов медианными или интерполированными значениями точек в пределах заданного интервала, центрированного на целевой точке, чтобы устранить шум. Медианная фильтрация эффективно удаляет импульсный шум, так как ее принцип работы совпадает с характеристиками импульсного шума; однако она не справляется с сохранением деталей краев изображения. В отличие от этого, интерполяционная фильтрация сохраняет детали изображения путем увеличения точек пикселей без изменения особенностей изображения, решая проблему случайных импульсных помех и других типов шума с большей гибкостью [50]. Mosafapour и др. [46] выполнили предварительную обработку Раман-спектров шести веществ, включая этанол и ацетонитрил. Средние значения и стандартные отклонения спектров, обработанных с интерполяционной фильтрацией, были ниже, чем у необработанных спектров, и точность классификации шести веществ достигла 100% путем установления модели PCA-LDA.
3.1.2. Коррекция базовой линии (Baseline Correction)
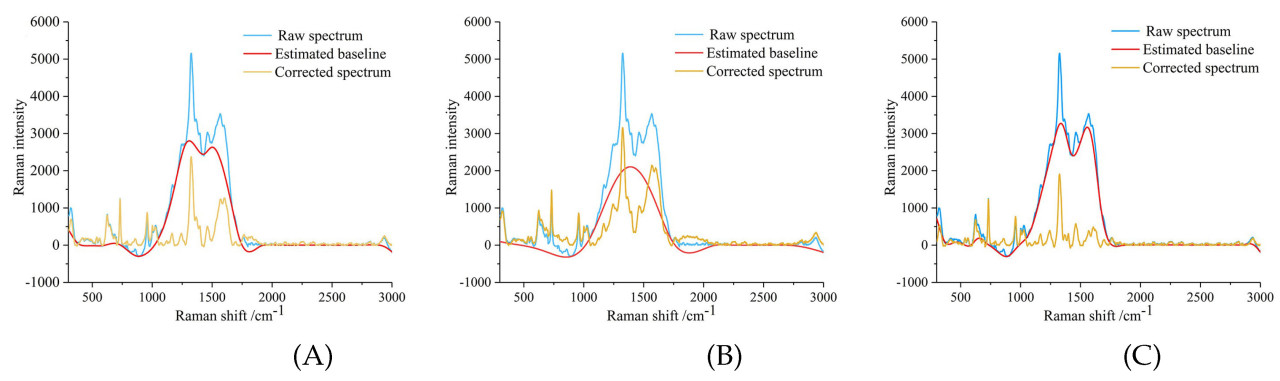
Когда лазерный свет облучает образец, флуоресцентные материалы внутри образца поглощают фотоны и испускают флуоресценцию, вызывая дрейф базовой линии в Раман-спектре. Флуоресцентные помехи затмевают правильное спектральное распределение, влияя на идентификацию и анализ рамановских пиков. Коррекция базовой линии используется для восстановления исходного спектра, с общими подходами, включая полиномиальную аппроксимацию и мультивариантную коррекцию рассеяния [51,52].
Полиномиальная аппроксимация и мультивариантная коррекция рассеяния удаляют базовую линию с помощью математических расчетов [53,54]. Однако, когда флуоресцентный сигнал чрезмерно сильный, флуоресцентный фон может перекрываться с рамановским сигналом, что затрудняет разделение этих двух, и только математических подходов может быть недостаточно для удаления базовой линии. В таких случаях должна быть выполнена оптимизация detection прибора до сбора спектра. Методы оптимизации включают Раман-спектроскопию с временным затвором [55], модулированную Раман-спектроскопию [56] и Раман-спектроскопию разности сдвинутых возбуждений (SERDS) [57]. Все три методики оптимизации улучшают отношение сигнал/шум, но есть различия: Раман-спектроскопия с временным затвором уменьшает флуоресцентные помехи, используя временные различия, модулированная Раман-спектроскопия усиливает рамановский сигнал путем модуляции источника света, а SERDS регулирует сдвиг длины волны для устранения флуоресцентного фона.
3.1.3. Сглаживание (Smoothing)
Фиксированный шум, шум эмиссии и фоновый шум в спектрометре вызывают случайные флуктуации рамановского сигнала, влияя на формы пиков и точность данных [58]. Спектральное сглаживание может уменьшить флуктуации сигнала и обеспечить непрерывность сигнала. Общие подходы к сглаживанию включают скользящее среднее, вейвлет-преобразование (WT) и алгоритм Савицкого–Голея (SG).
Скользящее среднее требует установки окна, которое движется от крайнего левого до крайнего правого края спектральной кривой. Однако этот метод субъективен в определении размера окна, и краевые эффекты возникают во время движения окна, приводя к несогласованным результатам сглаживания [59]. Вейвлет-преобразование (WT) — это техника анализа время-частота, в которой вейвлет-функции разлагают сигнал на вейвлет-коэффициенты, позволяя захватывать и восстанавливать особенности сигнала [49]. WT особенно эффективно справляется со сложным шумом. Например, Pan и др. [60] применили классификатор WT-DCNN к данным со смешанным шумом, содержащим гауссов шум и шум базовой линии, достигнув наивысшей точности классификации, превосходящей модели KNN и SVM. Алгоритм SG требует установки порядка полинома и размера окна. Он выполняет аппроксимацию методом наименьших квадратов на основе полиномиальной функции внутри окна фильтрации, сглаживая спектральные данные точка за точкой [61]. Yuan и др. [62] разработали модель классификации KNN для пластмасс, где точность улучшилась с 79.83% до 88.15% после применения SG-сглаживания к данным.
3.2. Последующая обработка данных
Последующая обработка данных извлекает характеристики и информацию, влияющую на изменение спектральной интенсивности из предварительно обработанных данных, и устанавливает качественную или количественную аналитическую модель. Машинное обучение может изучать шаблоны и ассоциации из данных, адаптируясь к сложным и постоянно меняющимся данным, поэтому оно эффективно выполняет процессы последующей обработки данных.
3.2.1. Извлечение признаков (Feature Extraction)
Предварительно обработанные спектральные данные обычно проявляют высокую размерность и содержат нерелевантную информацию. Алгоритмы извлечения признаков Раман-спектров могут идентифицировать изменения рамановской интенсивности внутри характеристических полос, значительно уменьшая избыточность данных и улучшая отношение сигнал/шум [63]. Обычно используемые методы извлечения признаков Раман-спектров включают анализ главных компонент (PCA), алгоритм последовательных проекций (SPA) и конкурентный адаптивный взвешенный отбор проб (CARS) [64]. Таблица 4. Сводка и сравнение трех алгоритмов извлечения признаков Раман-спектров представляет сводку и сравнение этих трех алгоритмов извлечения рамановских признаков, которые описаны следующим образом:
- Алгоритм анализа главных компонент (PCA)
PCA — это неконтролируемый алгоритм извлечения признаков, который проецирует высокоразмерные матрицы данных в пространство низкой размерности, выбирая независимые переменные с наибольшим вкладом дисперсии в качестве главных компонент. Этот алгоритм уменьшает размерность, сохраняя информацию из исходных данных [65]. При обнаружении язвы яблони (apple valsa canker), Zhao и др. [66] использовали алгоритм PCA для выполнения линейной комбинации независимых переменных из необработанных данных Раман-спектров и ранжировали их на основе их норм вклада дисперсии. Первые две главные компоненты достигли кумулятивной нормы вклада 99.38%. Путем анализа корреляции между главными компонентами и исходными переменными (x-нагрузки), характеристические волновые числа Раман-спектра были уменьшены с 994 до 5, тем самым извлекая волновые числа, тесно связанные с болезнью. Это сокращение размерности данных не только избежало переобучения модели, но и улучшило обобщающую способность и точность модели. Однако если данные содержат шум или набор данных велик, способность PCA вычислять дисперсию ухудшается, что приводит к увеличению вычислительных затрат.
Алгоритм Робастного PCA (RPCA) восстанавливает данные низкого ранга из исходных данных и используется для обработки зашумленных данных. Pulpito и др. применили этот алгоритм для онлайн-обнаружения движущихся целей в зашумленных океанских сценах. Когда полнота (recall rate) составляла 80%, точность алгоритма S-OMW-RPCA превзошла точность исходного алгоритма OMW-RPCA [67]. Для больших наборов данных алгоритм 2DPCA работает в двумерном пространстве данных без преобразования матрицы данных в одномерный вектор. Jiang и др. [68] использовали алгоритм 2DPCA для уменьшения размерности изображений распознавания лиц крупного масштаба. Результаты показали, что качество изображения, обработанного с помощью алгоритма 2DPCA, было значительно выше, чем обработанного со стандартным алгоритмом PCA.
- Алгоритм последовательных проекций (SPA)
SPA — это алгоритм извлечения признаков, основанный на прямом итеративном поиске, где на каждой итерации выбирается длина волны с максимальным значением проекции в качестве новой переменной, пока количество выбранных переменных не достигнет предопределенного значения [69]. Алгоритм SPA хорошо работает при обработке больших наборов данных и уменьшении избыточной информации. Однако, поскольку он выполняет только однослойную проекцию, его недостаточно для оптимизации прогнозной производительности модели.
Алгоритм DLV-SPA анализирует независимые и зависимые переменные на уровне проекции латентных переменных, минимизируя независимость или линейную корреляцию между двумя соседними длинами волн, тем самым улучшая производительность модели. Chen и др. [70] применили алгоритм DLV-SPA к модели количественного обнаружения золы в рыбной муке, и результаты показали, что стандартное отклонение модели составило 1.78 по сравнению с 2.82 для традиционного химического метода.
- Алгоритм конкурентного адаптивного взвешенного отбора проб (CARS)
CARS — это алгоритм извлечения переменных признаков, который сочетает выборку Монте-Карло с коэффициентами регрессии метода частичных наименьших квадратов (PLS). Он использует экспоненциальную функцию затухания и адаптивный взвешенный отбор проб для выбора оптимального подмножества характеристических длин волн, минимизируя ошибку перекрестной проверки. Алгоритм CARS может устранять неинформативные и коллинеарные перекрывающиеся переменные, улучшая прогнозную способность и интерпретируемость модели [71]. Однако данные, обработанные с помощью этого алгоритма, подвержены влиянию нерезонансных фоновых помех.
Преобразование Гильберта с дискретным обучением (LeDHT) генерирует аналитические сигналы из вещественных сигналов. Регулировка фазы сигнала в частотной области разрешает расхождения между измеренными и фактическими значениями, вызванные искажением. Camp и др. [72] применили LeDHT к проблеме восстановления Рамана для репрезентативных спектров функции Доусона, и результаты показали, что средняя квадратичная ошибка (MSE) алгоритма LeDHT составляла 10⁻⁸ у.е., что ниже, чем у традиционных алгоритмов DHT Pad и DHT.
3.2.2. Построение модели (Model Establishment)
Из-за взаимодействий между компонентами образца, полученные спектры не являются суперпозициями спектров отдельных компонентов, что делает спектральные данные трудными для классификации и регрессии. Машинное обучение раскрывает шаблоны и отношения внутри данных, охватывая три парадигмы обучения: контролируемое, неконтролируемое и полуконтролируемое обучение. Алгоритмы машинного обучения, используемые для построения модели, включают линейный дискриминантный анализ (LDA), дискриминантный анализ на частичных наименьших квадратах (PLS-DA) и метод опорных векторов (SVM), среди других [73]. Таблица 5. Сводка и сравнение трех алгоритмов построения моделей представляет сводку и сравнение этих трех алгоритмов построения моделей, которые описаны следующим образом:
- Алгоритм линейного дискриминантного анализа (LDA)
LDA — это контролируемый алгоритм классификации, который делит пространство признаков на две области и проецирует обучающий набор на линейную дискриминантную функцию, максимизируя межгрупповые различия и минимизируя внутригрупповые различия, тем самым достигая уменьшения размерности и классификации данных [74]. Однако, по мере увеличения сложности интегральных схем, алгоритм LDA не оптимизирует время тестирования или затраты.
Путем уменьшения собственных значений, ранжирования собственных векторов и выбора тех, которые связаны со значительными собственными значениями, в качестве входных данных, сокращаются как время тестирования, так и затраты. При обнаружении крупномасштабных интегральных схем, Huang и др. применили эту стратегию к алгоритму LDA, используя функции полиномиальной регрессии для выбора эффективных тестовых шаблонов, что привело к сокращению времени тестирования в 1.75 раза по сравнению с традиционными методами [75].
- Алгоритм дискриминантного анализа на частичных наименьших квадратах (PLS-DA)
PLS-DA — это контролируемый алгоритм классификации, основанный на регрессии частичных наименьших квадратов (PLSR). Он центрирует и стандартизирует исходные данные для получения независимых переменных и категорий, а затем извлекает главные компоненты путем отображения переменных. Алгоритм PLS-DA широко используется для классификации и прогнозирования высокоразмерных данных [76].
В последние годы Разреженный дискриминантный анализ наименьших квадратов (SLS-DA) применялся для выбора наиболее прогностических или дискриминационных признаков из данных. Применяя оптимизацию с мягким порогом для выбора признаков, SLS-DA улучшает точность классификации и сокращает время выполнения. Afshar и др. [77] применили алгоритм SLS-DA для анализа шести геномных наборов данных, эффективно идентифицируя и удаляя нерелевантные признаки, тем самым значительно сокращая время выполнения.
- Алгоритм метода опорных векторов (SVM)
SVM — это контролируемый бинарный линейный алгоритм классификации, который отображает линейные данные в пространство более высокой размерности и идентифицирует оптимальную гиперплоскость для классификации данных в исходном пространстве признаков. Для нелинейных данных гиперплоскость обычно определяется с использованием линейных, полиномиальных или радиально-базисных ядерных функций, которые позволяют классифицировать данные [78]. Однако алгоритм SVM находит оптимальное решение при определенных ограничениях, что ограничивает его применение в повседневных проблемах.
Алгоритм Гладкого метода опорных векторов (SSVM) определяет параметры модели путем решения задачи квадратичного программирования, упрощая процесс решения для практических применений. В попытке решить проблему чрезмерных ограничений в системах раннего предупреждения финансовых кризисов, Yuan и др. [79] применили PCA для уменьшения размерности и установили модель прогнозирования SSVM. Точность достигла 95%, превзойдя исходную модель прогнозирования SVM.
4. Применение Раман-спектроскопии в определении качества фруктов
Существуют значительные различия в типах питательных компонентов и уровнях остатков пестицидов между здоровыми и аномальными фруктами. Раман-спектроскопия может обнаруживать эти различия на основе молекулярных колебаний, обеспечивая высокоточное обнаружение и идентификацию [80]. Применение Раман-спектроскопии в определении качества фруктов в первую очередь включает обнаружение болезней фруктов, анализ остатков пестицидов и идентификацию происхождения.
4.1. Применение Раман-спектроскопии в обнаружении болезней фруктов
Фрукты, инфицированные конидиальными спорами патогенов, вызывают серьезные проблемы с болезнями. Конидии, переносимые инфицированными фруктами, распространяются в воздухе, увеличивая риск заболевания фруктов. Раннее обнаружение болезней фруктов обеспечивает качество фруктов и улучшает урожайность [81]. Например, язвенная болезнь (canker) и Хуанлунбин (HLB, "болезнь позеленения цитрусовых") стали распространенными болезнями сельскохозяйственных культур у цитрусовых, грейпфрутов, яблок и томатов. Высокие температуры и высокая влажность ускоряют передачу болезни, что приводит к значительным потерям урожая и широкомасштабной гибели культур [82,83]. Молекулярная структура и состав инфицированных культур претерпевают изменения, и Раман-спектроскопия может обнаруживать эти изменения. Поэтому Раман-спектроскопия широко применяется для раннего обнаружения язвенной болезни и Хуанлунбин сельскохозяйственных культур.
4.1.1. Раннее обнаружение Хуанлунбин цитрусовых с помощью Раман-спектроскопии
HLB — это разрушительное заболевание, вызываемое грамотрицательной бактерией. Инфицированные цитрусовые культуры испытывают быстрое ухудшение роста, значительное снижение урожайности плодов и, в некоторых случаях, гибель деревьев. Раннее обнаружение Хуанлунбин может улучшить урожай цитрусовых и минимизировать потери, вызванные болезнью [84]. Таблица 6. Применение Раман-спектроскопии в обнаружении цитрусового HLB подчеркивает, что Раман-спектроскопия привлекла значительное внимание для обнаружения цитрусового Хуанлунбин. Распределения характеристических полос для некоторых фруктов и пестицидов показаны в Таблице 7 и Таблице 8.
Традиционная Раман-спектроскопия используется для раннего обнаружения цитрусового Хуанлунбин (HLB), но она подвержена помехам от флуоресцентных веществ в кожуре цитрусовых, что приводит к сложному шуму в Раман-спектрах. В отличие от этого, Конфокальная микро-Раман-спектроскопия и Раман-спектроскопия с Фурье-преобразованием могут эффективно устранять флуоресцентные фоновые помехи, ускоряя обнаружение болезни. Kong и др. [85] собрали Раман-спектры здоровых (HE), бессимптомных по HLB (HA) и симптоматических по HLB (HS) образцов цитрусовых, как показано на Рисунке 10, с характеристическими рамановскими полосами, соответствующими перечисленным в Таблице 7. Они предварительно обработали спектры с использованием аппроксимации полиномом пятой степени и нормализации и разработали PCA-PLS и PCA-SVM модели раннего обнаружения HLB. Диагностическая точность для прогнозных наборов HE, HA и HS превысила 90%, в то время как точность традиционных методов случайного обнаружения составляла всего от 50% до 70%. Алгоритм PLS-DA эффективно обрабатывал высокоразмерные данные и идентифицировал ключевые переменные, что делало его подходящим для раннего обнаружения цитрусового HLB. Dai и др. [86] использовали интерполяцию кубическим сплайном и полиномиальную аппроксимацию для разделения спектров спонтанной флуоресценции от Раман-спектров в смешанных спектрах, установив модель PLS-DA для обнаружения цитрусового HLB и достигнув точности 86.08%, 98.17% и 64.75% соответственно. Среди этих спектров Раман-спектры продемонстрировали превосходный качественный анализ. Квадратичная полиномиальная аппроксимация может выбирать точки данных из внепиковых областей, улучшая качество спектра. Liu и др. [87] использовали данные, обработанные с квадратичной полиномиальной аппроксимацией, и разработали модель обнаружения PLS-DA, достигнув 100% точности. Диаграмма решения оптимального числа главных компонент (PC) и диаграмма рассеяния модели показаны на Рисунке 11.
4.1.2. Раннее обнаружение Хуанлунбин грейпфрута с помощью Раман-спектроскопии
Хуанлунбин грейпфрута — это бактериальное заболевание, передаваемое в основном насекомыми. Насекомые распространяют патоген на здоровые деревья, вызывая новые инфекции. Деревья грейпфрута, пораженные HLB, проявляют пожелтение листьев и корневую гниль, серьезно угрожая индустрии грейпфрутов. Поэтому раннее обнаружение HLB у грейпфрута необходимо [91].
Грейпфрут имеет большой объем, и платформа хранения традиционных Раман-спектрометров не может вместить весь плод, что препятствует сбору полного рамановского сигнала от целого фрукта. Однако портативные Раман-спектрометры, которые позволяют быстро сканировать образцы с помощью портативного лазерного зонда, могут быстро собирать Раман-спектры. Поэтому портативные Раман-спектрометры используются для раннего обнаружения Хуанлунбин у грейпфрута. На основе Раман-спектров стандартных веществ, Sanchez и др. [92] наблюдали, что вариация интенсивности характеристических пиков Рамана органических соединений в грейпфруте находится под влиянием HLB. Разработав модель обнаружения ортогонального дискриминантного анализа частичных наименьших квадратов (OPLS-DA), точность обнаружения HLB достигла 96.7%, превзойдя метод ПЦР. Диаграмма Раман-спектров и модели OPLS-DA грейпфрута в различных состояниях показана на Рисунке 12, в то время как характеристические рамановские полосы грейпфрута перечислены в Таблице 7. Обнаружение болезни служит основой для классификации болезней и предоставляет научную основу для управления болезнями растений. Используя Раман-данные грейпфрута, исследовательская группа разработала модель OPLS-DA, которая достигла 98% точности в различении здорового грейпфрута от инфицированного HLB и 100% точности в дифференциации ранней и поздней стадий инфекции HLB [93].
4.1.3. Раннее обнаружение язвенной болезни яблони и томата с помощью Раман-спектроскопии
Язвенная болезнь яблони, вызываемая Nectria galligena, приводит к увяданию или даже гибели инфицированных ветвей растений. Этот патоген имеет широкий диапазон хозяев и инфицирует различные древесные растения, такие как персики, вишни и томаты, приводя к снижению урожайности различных фруктов [94]. Раннее обнаружение язвенной болезни помогает предотвратить распространение патогенных конидий и улучшить урожайность фруктов.
Из-за значительных физиологических и биохимических различий между различными фруктами, а также различных стадий прогрессирования болезни, обнаружение болезней фруктов, вызванных одним и тем же патогеном в различных образцах, представляет проблему. Раман-спектроскопия может захватывать и идентифицировать биохимическую информацию, связанную с химическими связями, молекулярной симметрией и другими параметрами, позволяя проводить раннее обнаружение болезней фруктов, вызванных одним и тем же патогеном в различных образцах. Zhao и др. [66] применили PCA для извлечения спектральных полос из данных, предварительно обработанных алгоритмом air-PLS, с оценками первых трех главных компонент, показанными на Рисунке 13. Результаты показали, что модель Наименьших Квадратов SVM (LS-SVM), разработанная для обнаружения язвенной болезни яблони, достигла точности 89.33%. SERS улучшает точность раннего обнаружения болезни путем усиления рамановских сигналов. Fang и др. [95] использовали SERS для обнаружения язвенной болезни яблони и определили, с помощью корреляционного анализа, что алгоритм air-PLS был наиболее эффективным методом предварительной обработки, как показано на Рисунке 14. Характеристические рамановские полосы яблок соответствуют тем, что в Таблице 7, с точностью обнаружения для моделей BP-ANN, LS-SVM и других, превышающей 90%. Раман-спектроскопия также применима для классификации и обнаружения язвенной болезни томатов, вызванной Nectria galligena. Perez и др. [96] собрали Раман-спектры от инфицированных, бессимптомных и здоровых растений томатов, как показано на Рисунке 15, с характеристическими рамановскими полосами для томатов, совпадающими с теми, что в Таблице 7. После предварительной обработки спектральной стандартизацией была разработана PCA-основная LDA модель классификации, достигшая точности классификации 97% для язвенной болезни томатов.
Болезни фруктов сильно влияют как на урожайность, так и на качество фруктов. Хотя Раман-спектроскопия может идентифицировать болезни фруктов на ранней стадии, ложноотрицательные результаты могут возникать из-за неравномерного распределения патогенов внутри растений. Решение проблемы ложноотрицательных результатов в обнаружении болезней фруктов может улучшить точность. Глубокие исследования по обнаружению болезней фруктов могут быть оптимизированы путем предварительной обработки образцов, многотехнических методов обнаружения и улучшенной чувствительности оборудования [97,98].
4.2. Применение Раман-спектроскопии в обнаружении остатков пестицидов во фруктах
Фермеры используют различные пестициды для защиты фруктов от болезней и вредителей. Однако неправильное и чрезмерное использование пестицидов приводит к накоплению множественных остатков пестицидов во фруктах [113]. Чтобы защитить здоровье потребителей и улучшить качество сельскохозяйственной продукции, необходимо обнаруживать остатки пестицидов во фруктах с высокой точностью. Благодаря своей высокой чувствительности и сильному рамановскому сигналу, SERS широко применяется для обнаружения остатков пестицидов во фруктах. Эффективность обнаружения SERS зависит от используемой подложки, и результаты обнаружения могут варьироваться с различными подложками [114].
4.2.1. Применение методики SERS на основе AgNPs в обнаружении остатков пестицидов
Из-за высокой липофильности пестицидов они проникают во внутреннюю часть фруктов, что делает обнаружение остатков пестицидов сложной задачей. Методика SERS позволяет проводить неинвазивное обнаружение различных аналитов на следовых уровнях, причем нанометаллические материалы серебра обычно применяются в качестве SERS-подложек для обнаружения остатков пестицидов во фруктах благодаря их сильному эффекту интенсивности электромагнитного поля, resulting from плазмонного усиления [115].
Molnar и др. [116] использовали методику SERS на основе нанозоля серебра для обнаружения остатков тиабендазола в экстракте голубики. Результаты показали, что самый низкий предел обнаружения остатков пестицидов после предварительной обработки экстракта составил 0.09 мкМ. Необработанные и предварительно обработанные SERS-спектры экстракта показаны на Рисунке 16. Подложка предоставляет поверхность адсорбции, которая усиливает рамановский сигнал, и AgNPs с различными формами предлагают поверхности адсорбции разной формы для молекул в качестве SERS-подложек для обнаружения остатков пестицидов во фруктах. Alfredo и др. [117] использовали методику SERS на основе кольца AgNP для обнаружения остатков фунгицида пираклостробина в лимонах. Кольцо AgNP предоставляло большую поверхность адсорбции для молекул, позволяя обнаруживать рамановский сигнал, даже когда концентрация пираклостробина была как низкая как 6 × 10⁻⁵ М. Таблица 9. Методы на основе наночастиц серебра (Ag NPs) для обнаружения пестицидов во фруктах обобщает применение методики SERS на основе AgNPs в обнаружении остатков пестицидов во фруктах.
4.2.2. Применение методики SERS на основе AuNPs в обнаружении остатков пестицидов
Химические свойства AgNPs нестабильны и подвержены окислению и агрегации во время хранения и использования, что уменьшает сигнал SERS. В отличие от этого, химические свойства AuNPs стабильны, в значительной степени не подвержены влиянию других веществ в системе, и их поверхности легко модифицировать, усиливая адсорбцию и обнаружение специфических молекул. Поэтому AuNPs действуют как подложки для методики SERS в обнаружении остатков пестицидов во фруктах [25].
Xu и др. [139] использовали методику SERS на основе AuNPs для получения SERS-спектра стандартного раствора хлорпирифоса. Теоретический и экспериментальный спектры стандартного раствора показаны на Рисунке 17, с соответствующими характеристическими рамановскими полосами, подробно описанными в Таблице 8. Была продемонстрирована сильная линейная зависимость для концентраций хлорантранилипрола в цитрусовых в диапазоне 3–20 мг/кг, со значением R² 0.9979. Минимальная обнаруживаемая концентрация составляла приблизительно 3 мг/кг. Комбинирование структур наночастиц золота с полупроводниками или другими материалами облегчает перенос заряда на границах раздела, увеличивая поперечное сечение рамановского рассеяния молекул и усиливая эффект SERS. Xiao и др. [140] сочетали бактериальную целлюлозу с AuNPs и использовали методику SERS на основе этого композитного материала для обнаружения остатков тирама в яблоках, достигнув R² 0.99 и предела обнаружения 0.98 ppm. Таблица 10. Методы на основе наночастиц золота (Au NPs) для обнаружения пестицидов во фруктах обобщает применение методики SERS на основе AuNPs в обнаружении остатков пестицидов во фруктах.
4.2.3. Применение методики SERS на основе смешанных наночастиц золота и серебра в обнаружении остатков пестицидов
Ионное золото и серебро в хлорной кислоте или нитрате серебра могут быть химически восстановлены до их элементарного состояния. Однако морфология и размер монометаллических наноматериалов частиц влияют на их оптическое поглощение и SERS характеристики. Кроме того, в многокомпонентных наноматериалах существует синергетический эффект между различными компонентами, коллективно усиливая сигнал SERS [167]. Поэтому наночастицы сплава золото-серебро могут служить SERS-подложками для обнаружения остатков пестицидов во фруктах [168].
Asgari и др. [169] использовали методику SERS на основе наночастиц Au@Ag для обнаружения остатков тиабендазола и других пестицидов в клубнике. Раман-спектры четырех остатков пестицидов показаны на Рисунке 18. Модели PLS и PCA были установлены для предварительно обработанных спектров, и рамановские пики были отчетливо наблюдаемы, даже при низких концентрациях пестицидов 5 мкг/кг. В отличие от этого, Rizzato и др. [170] использовали методику SERS на основе AgNPs для обнаружения остатка тиабендазола в клубнике, с минимальным пределом обнаружения 500 мкг/кг. Тиабендазол, используемый для контроля грибковых заболеваний в культурах, также требуется в выращивании яблок. Yan и др. [171] применили методику SERS на основе наночастиц Au@Ag для обнаружения остатка тиабендазола в яблоках и обнаружили, что SERS активность была оптимальной, когда толщина серебряной оболочки составляла 7.3 нм, с минимальным пределом обнаружения 5 нг/см². Аналогично, Dayalan и др. [172] применили методику SERS с наночастицами золотое ядро-серебряная оболочка для обнаружения остатка тиабендазола на кожуре яблок. Результаты показали, что интенсивность подложки была оптимальной при pH 5, с самым низким пределом обнаружения 0.1 нг/см², как показано на Рисунке 19. Таблица 11. Методы на основе комбинации наночастиц золота и серебра (Au@Ag NPs) для обнаружения пестицидов во фруктах обобщает применение методики SERS на основе Au@Ag в обнаружении остатков пестицидов во фруктах.
Раман-спектроскопия используется для обнаружения остатков пестицидов во фруктах; однако она ограничена в своей способности равномерно обнаруживать множественные остатки пестицидов в одном и том же образце. Чтобы решить это ограничение, могут быть использованы методы ингибирования ферментов для маскировки помех от других пестицидов, или методы люминесцентного мечения для маркировки специфических пестицидов. Эти методы затем комбинируются с Раман-спектральным обнаружением для улучшения обнаружения остатков пестицидов [179,180].
4.3. Применение Раман-спектроскопии в идентификации происхождения фруктов
Многие регионы производят один и тот же тип фруктов, но фрукты из различных регионов могут значительно отличаться с точки зрения их питательного состава, вкуса и размера. Технология прослеживаемости происхождения фруктов помогает защищать известные местные specialties и обеспечивает подлинность продовольственного рынка [181]. Достаточное количество спектров из различных точек в образцах (таких как верх, середина и низ) должно быть собрано и предварительно обработано. Этот метод может получить средние спектры множественных точек отбора проб, что уменьшает влияние локальных вариаций на общие результаты обнаружения и улучшает стабильность спектральных данных. Поэтому Раман-спектроскопия применяется для идентификации происхождения фруктов [182].
В области идентификации происхождения фруктов традиционные методы не могут неразрушающе анализировать биохимическую информацию внутри фрукта. В отличие от этого, Раман-спектроскопия может неразрушающе получать внутреннюю информацию для идентификации происхождения фруктов [114]. Lu и др. [183] обнаружили, что после SG и MSC предварительной обработки, модель сети Долгой Краткосрочной Памяти (LSTM) для идентификации происхождения вишни достигла наивысшей точности, со средней точностью распознавания 99.12%. SVM также может служить моделью идентификации для происхождения вишни. Эта команда объединила SG и MSC спектральные алгоритмы предварительной обработки с алгоритмами отбора признаков дисперсии, чтобы установить модель различения GA-SVM, заключив, что обе модели достигли 100% точности в идентификации происхождения вишни [184]. SERS также может быть использована для идентификации происхождения фруктов благодаря своему сильному рамановскому сигналу. Traksele и др. [185] применили методику SERS на основе нанозоля серебра для классификации происхождения черники в Северной Европе. Средние SERS-спектры черники из каждой страны показаны на Рисунке 20. Результаты были согласованы с полученными с помощью высокоэффективной жидкостной хроматографии, подтверждая применимость метода SERS-PCA для определения происхождения черники.
Раман-спектроскопия может определять происхождение фрукта путем анализа различий в химических соединениях между образцами. Однако установление точной модели идентификации требует большого количества репрезентативных данных образцов, и обобщающая способность модели часто ограничена. Чтобы улучшить точность идентификации, интеллектуальное и автоматизированное оборудование используется в процессе идентификации происхождения, улучшая как скорость, так и точность идентификации [186,187].
5. Перспективы и проблемы
Раман-спектроскопия была систематически применена в области определения качества фруктов, характеризуясь своей быстрой, точной и неразрушающей природой. Однако традиционная Раман-спектроскопия сталкивается с несколькими проблемами, такими как слабые рамановские сигналы, неспособность обнаруживать информацию во внутренней части образцов и подверженность флуоресцентным фоновым помехам. Передовые спектральные методики, такие как SERS, CM-RS и SORS, были постепенно внедрены. Комбинирование этих методик с алгоритмами машинного обучения позволяет более эффективно применять их в таких областях, как определение качества сельскохозяйственной продукции, биомедицинская идентификация и мониторинг окружающей среды.
Раман-спектроскопия предлагает много преимуществ, но все еще сталкивается с несколькими проблемами, такими как трудности в многокомпонентном анализе и количественном анализе, а также необходимость в специфических процессах предварительной обработки образцов. С достижениями в компьютерных технологиях и хемометрике, вычислительная мощность значительно улучшилась, позволяя быстрее и эффективнее обрабатывать и анализировать большие наборы данных Раман-спектров. Прогресс в хемометрике также предоставил передовые инструменты для анализа данных Рамана, позволяя извлекать информацию из внутренней части образцов и улучшая точность и надежность обнаружения. Для образцов, требующих специфической предварительной обработки, соответствующая подготовка может быть сделана на основе физико-химических свойств образца, таких как нарезка, разбавление или сублимационная сушка. Для твердых образцов высокой плотности или порошковых образцов, измельчение или уплотнение может создать однородную поверхность, тогда как для жидких образцов высокой концентрации, разбавление может уменьшить фоновый сигнал от рамановского рассеяния. Полагают, что Раман-спектроскопия будет широко применяться в обнаружении безопасности пищевых продуктов, науке о материалах, науках о жизни, мониторинге окружающей среды и других исследовательских областях, особенно в определении качества фруктов, с более яркой перспективой применения. Она также распространится на различные междисциплинарные области, полностью используя свои уникальные преимущества.
Ссылки
1. Jaeger, S.R.; Antúnez, L.; Ares, G. An exploration of what freshness in fruit means to consumers. Food Res. Int. 2023, 165, 112491. [Google Scholar] [CrossRef]
2. Wu, J.P.; Huang, G.W.; LI, J. Research status and prospect of visual and spectral detection technology for fruit diseases. Chin. J. Agric. Mach. Chem. 2023, 44, 112–118. [Google Scholar]
3. de Andrade, J.P.; Galvan, D.; Kato, L.S.; Conte-Junior, C.A. Consumption of fruits and vegetables contaminated with pesticide residues in Brazil: A systematic review with health risk assessment. Chemosphere 2023, 322, 138244. [Google Scholar] [CrossRef] [PubMed]
4. Hidalgo, M.J.; Gaiad, J.E.; Goicoechea, H.C.; Mendoza, A.; Pérez-Rodríguez, M.; Pellerano, R.G. Geographical origin identification of mandarin fruits by analyzing fingerprint signatures based on multielemental composition. Food Chem. X 2023, 20, 101040. [Google Scholar] [CrossRef] [PubMed]
5. Zhao, M.; You, Z.; Chen, H.; Wang, X.; Ying, Y.; Wang, Y. Integrated Fruit Ripeness Assessment System Based on an Artificial Olfactory Sensor and Deep Learning. Foods 2024, 13, 793. [Google Scholar] [CrossRef]
6. Zhang, H.; Cao, L.; Brodsky, J.; Gablech, I.; Xu, F.; Li, Z.; Korabecna, M.; Neuzil, P. Quantitative or digital PCR? A comparative analysis for choosing the optimal one for biosensing applications. TrAC Trends Anal. Chem. 2024, 174, 117676. [Google Scholar] [CrossRef]
7. Ma, N.; Zhu, J.; Wang, H.; Qian, M.C.; Xiao, Z. Comparative Investigation of Aroma-Active Volatiles in (“Ruixue”,“Liangzhi”,“Crystal Fuji,” and “Guifei”) Apples by Application of Gas Chromatography–Mass Spectrometry–Olfactometry (GC–MS–O) and Two-Dimensional Gas Chromatography-Quadrupole Mass Spectrometry (GC × GC-qMS) Coupled with Sensory Molecular Science. J. Agric. Food Chem. 2024, 72, 25229–25250. [Google Scholar] [PubMed]
8. Fakhlaei, R.; Babadi, A.A.; Sun, C.; Ariffin, N.M.; Khatib, A.; Selamat, J.; Xiaobo, Z. Application, challenges and future prospects of recent nondestructive techniques based on the electromagnetic spectrum in food quality and safety. Food Chem. 2024, 441, 138042. [Google Scholar] [CrossRef] [PubMed]
9. Yu, Y.; Zhang, J.; Wang, L.; Ni, Z.; Lu, J.; Gao, L. Hot-carrier engineering for two-dimensional integrated infrared optoelectronics. InfoMat 2024, 6, e12556. [Google Scholar] [CrossRef]
10. Orlando, A.; Franceschini, F.; Muscas, C.; Pidkova, S.; Bartoli, M.; Rovere, M.; Tagliaferro, A. A comprehensive review on Raman spectroscopy applications. Chemosensors 2021, 9, 262. [Google Scholar] [CrossRef]
11. Lu, L.; Wang, Y.; Liang, C.; Fan, J.; Su, X.; Huang, M. A Novel Distributed Optical Fiber Temperature Sensor Based on Raman anti-Stokes Scattering Light. Appl. Sci. 2023, 13, 11214. [Google Scholar] [CrossRef]
12. Qing, B.L.; Lan, Y.M. Soliton resonances and soliton molecules of pump wave and Stokes wave for a transient stimulated Raman scattering system in optics. Eur. Phys. J. Plus 2022, 137, 1227. [Google Scholar]
13. Saletnik, A.; Saletnik, B.; Puchalski, C. Overview of popular techniques of Raman spectroscopy and their potential in the study of plant tissues. Molecules 2021, 26, 1537. [Google Scholar] [CrossRef] [PubMed]
14. Zhao, M.; Wu, B.; Liu, J.; Lei, L. Anti-Stokes/Stokes temperature calibration and its application in laser-heating diamond anvil cells. Chin. Phys. B 2023, 32, 090704. [Google Scholar] [CrossRef]
15. Kolesov, B.A. Hydrogen bonds: Raman spectroscopic study. Int. J. Mol. Sci. 2021, 22, 5380. [Google Scholar] [CrossRef] [PubMed]
16. FeNg, X.; ZhaNg, Q.; Zhu, Z. Rapid classification of citrus fruits based on Raman spectroscopy and pattern recognition techniques. Food Sci. Technol. Res. 2013, 19, 1077–1084. [Google Scholar] [CrossRef]
17. Lee, K.S.; Landry, Z.; Pereira, F.C.; Wagner, M.; Berry, D.; Huang, W.E.; Taylor, G.T.; Kneipp, J.; Popp., J.; Stocker, R.; et al. Raman microspectroscopy for microbiology. Nat. Rev. Methods Prim. 2021, 1, 80. [Google Scholar] [CrossRef]
18. Lin, S.; Cheng, Z.; Li, Q.; Wang, R.; Yu, F. Toward sensitive and reliable surface-enhanced Raman scattering imaging: From rational design to biomedical applications. ACS Sensors 2021, 6, 3912–3932. [Google Scholar] [CrossRef] [PubMed]
19. Silge, A.; Weber, K.; Cialla-May, D.; Müller-Bötticher, L.; Fischer, D.; Popp, J. Trends in pharmaceutical analysis and quality control by modern Raman spectroscopic techniques. TrAC Trends Anal. Chem. 2022, 153, 116623. [Google Scholar] [CrossRef]
20. Wang, L.; Tang, J.W.; Li, F.; Usman, M.; Wu, C.Y.; Liu, Q.H.; Kang, H.Q.; Liu, W.; Gu, B. Identification of bacterial pathogens at genus and species levels through combination of Raman spectrometry and deep-learning algorithms. Food Microbiol. Spectr. 2022, 10, e02580-22. [Google Scholar] [CrossRef]
21. Qu, C.; Li, Y.; Du, S.; Geng, Y.; Su, M.; Liu, H. Raman spectroscopy for rapid fingerprint analysis of meat quality and security: Principles, progress and prospects. Food Res. Int. 2022, 161, 111805. [Google Scholar] [CrossRef] [PubMed]
22. He, Q.F.; Zhang, Y.J.; Yang, Z.L.; Dong, J.C.; Lin, X.M.; Li, J.F. Surface-Enhanced Raman Spectroscopy: Principles, Methods, and Applications in Energy Systems. Chin. J. Chem. 2023, 41, 355–369. [Google Scholar] [CrossRef]
23. Liu, C.; Xu, D.; Dong, X.; Huang, Q. A review: Research progress of SERS-based sensors for agricultural applications. Trends Food Sci. Technol. 2022, 128, 90–101. [Google Scholar] [CrossRef]
24. Jones, T. Fabrication of nanostructured electrodes for electrochemical surface-enhanced Raman spectroscopy (E-SERS): A review. Mater. Sci. Technol. 2023, 39, 2287–2301. [Google Scholar] [CrossRef]
25. Lin, D.Y.; Yu, C.Y.; Ku, C.A.; Chung, C.K. Design, fabrication, and applications of SERS substrates for food safety detection. Micromachines 2023, 14, 1343. [Google Scholar] [CrossRef]
26. Du, M.; Sun, Z.; Xie, M.; Gu, S.; Chen, Y.; Wang, Q. A new method for rapid identification of traditional Chinese medicine based on a new silver sol: Using the SERS spectrum for quality control of flavonoids and flavonoid glycosides in Potentilla discolor Bge. J. Mater. Chem. C 2023, 11, 15138–15148. [Google Scholar] [CrossRef]
27. Ye, Y.; Wang, J.; Fang, Z.; Yan, Y.; Geng, Y. Periodic Folded Gold Nanostructures with a Sub-10 nm Nanogap for Surface-Enhanced Raman Spectroscopy. ACS Appl. Mater. Interfaces 2024, 16, 10450–10458. [Google Scholar] [CrossRef] [PubMed]
28. Zhang, L.; Weng, Y.J.; Liu, X.; Gu, W.; Zhang, X.; Han, L. Fe (III) mixed IP6@ Au NPs with enhanced SERS activity for detection of 4-ATP. Sci. Rep. 2020, 10, 5752. [Google Scholar] [CrossRef]
29. Pham, A.T.; Bui, H.N.; Mai, Q.D.; Le, A.T. Flexible, high-performance and facile PVA/cellulose/Ag SERS chips for in-situ and rapid detection of thiram pesticide in apple juice. Heliyon 2023, 9, e19926. [Google Scholar] [CrossRef] [PubMed]
30. Odetade, D.F.; Rickard, J.J.S.; Bai, H.; Goldberg Oppenheimer, P. Development and Optimization of Micro-Nanotopographical Platforms for Surface Enhanced Raman Scattering Biomolecular Detection. Adv. Mater. Interfaces 2024, 2024, 2400352. [Google Scholar] [CrossRef]
31. Liu, D.; Zheng, Y.; Chen, L.; Wen, D. Prevalence of small-sized microplastics in coastal sediments detected by multipoint confocal micro-Raman spectrum scanning. Sci. Total. Environ. 2021, 831, 154741. [Google Scholar] [CrossRef] [PubMed]
32. Olivier, A.; Artur, A.; Aurélien, T. Confocal Raman microscope with versatile dual polarization snapshot acquisition. Opt. Express 2022, 30, 46734–46748. [Google Scholar]
33. Nicolson, F.; Kircher, M.F.; Stone, N.; Matousek, P. Spatially offset Raman spectroscopy. Nat. Rev. Methods Prim. 2021, 50, 556–568. [Google Scholar]
34. Vardaki, M.Z.; Schulze, H.G.; Serrano, K.; Blades, M.W.; Devine, D.V.; Turner, R.F. Assessing the quality of stored red blood cells using handheld Spatially Offset Raman spectroscopy with multisource correlation analysis. Spectrochim. Acta Part A Mol. Biomol. Spectrosc. 2022, 276, 121220. [Google Scholar] [CrossRef]
35. Berry, M.E.; McCabe, S.M.; Sloan-Dennison, S.; Laing, S.; Shand, N.C.; Graham, D.; Faulds, K. Tomographic imaging and localization of nanoparticles in tissue using surface-enhanced spatially offset raman spectroscopy. ACS Appl. Mater. Interfaces 2022, 14, 31613–31624. [Google Scholar] [CrossRef]
36. Shillito, G.E.; McMillan, L.; Bruce, G.D.; Dholakia, K. To focus-match or not to focus-match inverse spatially offset Raman spectroscopy: A question of light penetration. Opt. Express 2022, 30, 8876–8888. [Google Scholar] [CrossRef] [PubMed]
37. Razzell Hollis, J.; Sharma, S.; Abbey, W.; Bhartia, R.; Beegle, L.; Fries, M.; Hein, J.D.; Monacelli, B.; Nordman, A.D. A deep ultraviolet Raman and fluorescence spectral library of 51 organic compounds for the SHERLOC instrument onboard Mars 2020. Astrobiology 2023, 23, 1–23. [Google Scholar] [CrossRef]
38. Ardini, B.; Bassi, A.; Candeo, A.; Genco, A.; Trovatello, C.; Liu, F.; Zhu, X.; Valentini, G.; Cerullo, G.; Manzoni, C.; et al. High-throughput multimodal wide-field Fourier-transform Raman microscope. Optica 2023, 10, 663–670. [Google Scholar] [CrossRef]
39. Petreanu, I.; Niculescu, V.C.; Enache, S.; Iacob, C.; Teodorescu, M. Structural characterization of silica and amino-silica nanoparticles by Fourier transform infrared (FTIR) and raman spectroscopy. Anal. Lett. 2023, 56, 390–403. [Google Scholar] [CrossRef]
40. Bailo, E.; Deckert, V. Tip-enhanced Raman scattering. Chem. Soc. Rev. 2024, 37, 921–930. [Google Scholar] [CrossRef] [PubMed]
41. Cai, Z.F.; Kumar, N.; Zenobi, R. Probing On-Surface Chemistry at the Nanoscale Using Tip-Enhanced Raman Spectroscopy. CCS Chem. 2023, 5, 55–71. [Google Scholar] [CrossRef]
42. Ferrara, M.A.; Ranjan, R.; Righini, G.C.; Sirleto, L. Stimulated Raman scattering: Towards applications in nano and biophotonics. In Advances in Nonlinear Photonics; Righini, G.C., Sirleto, L., Eds.; Woodhead Publishing: London, UK, 2023; pp. 489–515. [Google Scholar]
43. Brzozowski, K.; Matuszyk, E.; Pieczara, A.; Firlej, J.; Nowakowska, A.M.; Baranska, M. Stimulated Raman scattering microscopy in chemistry and life science–development, innovation, perspectives. Biotechnol. Adv. 2022, 60, 108003. [Google Scholar] [CrossRef]
44. Weng, S.; Yuan, H.; Zhang, X.; Li, P.; Zheng, L.; Zhao, J.; Huang, L. Deep learning networks for the recognition and quantitation of surface-enhanced Raman spectroscopy. Analyst 2020, 145, 4827–4835. [Google Scholar] [CrossRef] [PubMed]
45. Fang, S.; Wu, S.; Chen, Z.; He, C.; Lin, L.; Ye, J. Recent progress and applications of Raman spectrum denoising algorithms in chemical and biological analyses: A review. TrAC Trends Anal. Chem. 2024, 172, 4117578. [Google Scholar] [CrossRef]
46. Mostafapour, S.; Dörfer, T.; Heinke, R.; Rösch, P.; Popp, J.; Bocklitz, T. Investigating the effect of different pre-treatment methods on Raman spectra recorded with different excitation wavelengths. Spectrochim. Acta Part A Mol. Biomol. Spectrosc. 2023, 302, 123100. [Google Scholar] [CrossRef]
47. Mosca, S.; Sowoidnich, K.; Mehta, M.; Skinner, W.H.; Gardner, B.; Palombo, F.; Stone, N.; Matousek, P. 10 kHz Shifted-Excitation Raman Difference Spectroscopy with Charge-Shifting Charge-Coupled Device Read-Out for Effective Mitigation of Dynamic Interfering Backgrounds. Appl. Spectrosc. 2023, 77, 569–582. [Google Scholar] [CrossRef] [PubMed]
48. Oksenberg, E.; Shlesinger, I.; Tek, G.; Koenderink, A.F.; Garnett, E.C. Complementary Surface-Enhanced Raman Scattering (SERS) and IR Absorption Spectroscopy (SEIRAS) with Nanorods-on-a-Mirror. Adv. Funct. Mater. 2023, 8, 2211154. [Google Scholar] [CrossRef]
49. Sharan, T.S.; Sharma, S.; Sharma, N. Denoising and spike removal from Raman spectra using double density dual-tree complex wavelet transform. J. Appl. Spectrosc. 2021, 88, 117–124. [Google Scholar] [CrossRef]
50. A, M.A.; V, K. The estimation of signal in time domain analysis with a mean smoothening, gaussian smoothening and median filter. J. Crit. Rev. 2020, 7, 1180–1183. [Google Scholar]
51. Guo, Y.; Jin, W.; Wang, W.; He, Y.; Qiu, S. Baseline correction for Raman spectra using a spectral estimation-based asymmetrically reweighted penalized least squares method. Appl. Opt. 2023, 62, 4766–4776. [Google Scholar] [CrossRef]
52. Atiogbe, A.H.; Benjamin, A.; Alfred, O. Raman spectra recovery using a second derivative technique and range independent baseline correction algorithm. OSA Contin. 2021, 4, 2468–2480. [Google Scholar]
53. Sheehy, G.; Picot, F.; Dallaire, F.; Ember, K.; Nguyen, T.; Petrecca, K.; Trudel, D.; Leblond, F. Open-sourced Raman spectroscopy data processing package implementing a baseline removal algorithm validated from multiple datasets acquired in human tissue and biofluids. J. Biomed. Opt. 2023, 28, 025002. [Google Scholar] [CrossRef]
54. Wang, P.; Zhan, K.; Wang, X.; Peng, Y.; Liu, S. Comparison of NIR and Raman spectrometries as quantitative methods to monitor polyethylene content in recycled polypropylene. Polym. Test. 2023, 119, 107938. [Google Scholar] [CrossRef]
55. Mooij, B.J.; Schmidt, R.W.; Vijvers, W.A.; Ariese, F. A versatile Raman setup with time-gating and fast wide-field imaging capabilities. Spectrochim. Acta Part A Mol. Biomol. Spectrosc. 2024, 318, 124388. [Google Scholar] [CrossRef]
56. Menghrajani, K.; Mingzhou, C.; Dholakia, K.; Barnes, W. Probing vibrational strong coupling of molecules with Wavelength-modulated Raman spectroscopy (dataset). Adv. Opt. Mater. 2022, 10, 2102065. [Google Scholar] [CrossRef]
57. Tian, L.; Jiang, H.; Zhang, X. A rapid and non-destructive identification for paper cup evidence based on shifted-excitation Raman difference spectroscopy and SOM clustering. J. Forensic Sci. 2024, 69, 81–93. [Google Scholar] [CrossRef] [PubMed]
58. Ye, J.; Ma, X.; Zhang, Y.; Xu, J.; Zhang, H.; Yao, T.; Leng, J.; Zhou, P. Revealing the dynamics of intensity fluctuation transfer in a random Raman fiber laser. Photonics Res. 2022, 10, 618–627. [Google Scholar] [CrossRef]
59. Lin, L.; He, H.; Xue, R.; Zhang, Y.; Wang, Z.; Nie, S.; Ye, J. Direct and quantitative assessments of near-infrared light attenuation and spectroscopic detection depth in biological tissues using surface-enhanced Raman scattering. Med-X 2023, 1, 9. [Google Scholar] [CrossRef]
60. Pan, L.; Pipitsunthonsan, P.; Daengngam, C.; Channumsin, S.; Sreesawet, S.; Chongcheawchamnan, M. Method for classifying a noisy Raman spectrum based on a wavelet transform and a deep neural network. IEEE Access 2020, 8, 202716–202727. [Google Scholar] [CrossRef]
61. Wei, C.; Zhang, X.; Xu, L.; Ding, F.; Yang, E. Overall recursive least squares and overall stochastic gradient algorithms and their convergence for feedback nonlinear controlled autoregressive systems. Int. J. Robust Nonlinear Control. 2022, 32, 5534–5554. [Google Scholar] [CrossRef]
62. Yuan, N.Z.; Chen, S.H.; Mu, T.T. Research on plastic classification based on Raman spectroscopy combined with deep learning algorithm. Opt. Instrum. 2023, 45, 35–43. [Google Scholar]
63. Chen, X.; Fan, Y.; Ma, Z.; Tan, S.; Li, N.; Song, X.; Huang, Y.; Zhang, J.; Zhang, W. Feature Extraction of Oil–Paper Insulation Raman Spectroscopy Based on Manifold Dimension Transformation. Appl. Sci. 2023, 13, 7626. [Google Scholar] [CrossRef]
64. Ni, X.; Jiang, Y.; Zhang, Y.; Zhou, Y.; Zhao, Y.; Guo, F.; Wang, H. Identification of liquid milk adulteration using Raman spectroscopy combined with lactose indexed screening and support vector machine. Int. Dairy J. 2023, 146, 105751. [Google Scholar] [CrossRef]
65. Abdul, R.; Abhishek, D.B. PCA based feature extraction and MPSO based feature selection for gene expression microarray medical data classification. Meas. Sensors 2024, 31, 100945. [Google Scholar]
66. Zhao, Y.; Fang, S.; Ye, Y.; Yu, K. Chemometric development using portable molecular vibrational spectrometers for rapid evaluation of AVC (Valsa mali Miyabe et Yamada) infection of apple trees. Vib. Spectrosc. 2021, 114, 103231. [Google Scholar] [CrossRef]
67. Pulpito, O.; Acito, N.; Diani, M.; Ferri, G.; Grasso, R.; Zissis, D. Saliency-Aided Online RPCA for Moving Target Detection in Infrared Maritime Scenarios. Sensors 2023, 23, 6334. [Google Scholar] [CrossRef]
68. Jiang, K.; Song, Y.; Li, S.; Chen, K. Feature extraction and recognition of face image based on 2DPCA with LDA algorithm. IEEE 2024, 7, 1861–1866. [Google Scholar]
69. Wu, S.; Chen, J.; Li, L.; Zhang, C.; Huang, R.; Zhang, Q. Quantitative Inversion of Lunar Surface Chemistry Based on Hyperspectral Feature Bands and Extremely Randomized Trees Algorithm. Remote Sens. 2022, 14, 5248. [Google Scholar] [CrossRef]
70. Chen, Z.H.; Gu, J.; Chen, W.H.; Mo, L.N.; Q, H.L. SPA algorithm based on double latent variable technology is applied to NIR wavelength screening. Spectrosc. Spectr. Anal. 2018, S1, 111–112. [Google Scholar]
71. Qin, G.; Zhang, A.; Chen, F.; Man, H.; Liu, H.; Li, M.; Jia, Z. Identification of appetite suppressants through Fourier transform infrared spectroscopy and filtered spectral feature extraction. Microchem. J. 2024, 197, 109843. [Google Scholar] [CrossRef]
72. Camp, C.H., Jr. Raman signal extraction from CARS spectra using a learned-matrix representation of the discrete Hilbert transform. Opt. Express 2022, 30, 26057–26071. [Google Scholar] [CrossRef]
73. Malavi, D.; Nikkhah, A.; Alighaleh, P.; Einafshar, S.; Raes, K.; Van Haute, S. Detection of saffron adulteration with Crocus sativus style using NIR-hyperspectral imaging and chemometrics. Food Control 2024, 157, 110189. [Google Scholar] [CrossRef]
74. Boginskaya, I.; Safiullin, R.; Tikhomirova, V.; Kryukova, O.; Nechaeva, N.; Bulaeva, N.; Golukhova, E.; Ryzhikov, I.; Kost, O.; Kurochkin, I.; et al. Human Angiotensin I-Converting Enzyme Produced by Different Cells: Classification of the SERS Spectra with Linear Discriminant Analysis. Biomedicines 2022, 10, 1389. [Google Scholar] [CrossRef]
75. Liang, H.; Tai, S. VLSI test through an improved LDA classification algorithm for test cost reduction. Microelectron. J. 2022, 125, 105461. [Google Scholar]
76. Zhang, P.; Liu, B.; Mu, X.; Xu, J.; Du, B.; Wang, J.; Liu, Z.; Tong, Z. Performance of Classification Models of Toxins Based on Raman Spectroscopy Using Machine Learning Algorithms. Molecules 2023, 29, 197. [Google Scholar] [CrossRef]
77. Majid, A.; Hamid, U. Optimizing feature selection methods by removing irrelevant features using sparse least squares. Expert Syst. Appl.s 2022, 200, 116928. [Google Scholar]
78. Atin, R.; Subrata, C. Support vector machine in structural reliability analysis: A review. Reliab. Eng. Syst. Saf. 2023, 233, 109126. [Google Scholar]
79. Yuan, D.; Wang, X. Improved SVM Algorithm Financial Management Model for Data Mining. J. Inf. Knowl. Manag. 2024, 23, 2450020. [Google Scholar] [CrossRef]
80. Cai, J.; Zou, C.; Yin, L.; Jiang, S.; El-Seedi, H.R.; Guo, Z. Characterization and recognition of citrus fruit spoilage fungi using Raman scattering spectroscopic imaging. Vib. Spectrosc. 2023, 124, 103474. [Google Scholar] [CrossRef]
81. Henry, P.M.; Dilla-Ermita, C.J.; Goldman, P.; Jaime, J.; Ramos, G. Sporodochia formed by Fusarium oxysporum f. sp. fragariae produce airborne conidia and are ubiquitous on diseased strawberry plants in California. Phytopathology 2023, 113, 1399–1404. [Google Scholar] [CrossRef]
82. Zhou, C. The status of citrus Huanglongbing in China. Trop. Plant Pathol. 2020, 45, 279–284. [Google Scholar] [CrossRef]
83. Minas, I.S.; Blanco-Cipollone, F.; Sterle, D. Accurate non-destructive prediction of peach fruit internal quality and physiological maturity with a single scan using near infrared spectroscopy. Food Chem. 2021, 335, 127626. [Google Scholar] [CrossRef] [PubMed]
84. Morán, F.; Herrero-Cervera, M.; Carvajal-Rojas, S.; Marco-Noales, E. Real-time on-site detection of the three ‘Candidatus Liberibacter’species associated with HLB disease: A rapid and validated method. Front. Plant Sci. 2023, 14, 1176513. [Google Scholar] [CrossRef]
85. Kong, L.; Liu, T.; Qiu, H.; Yu, X.; Wang, X.; Huang, Z.; Huang, M. Early diagnosis of citrus Huanglongbing by Raman spectroscopy and machine learning. Laser Phys. Lett. 2023, 21, 015701. [Google Scholar] [CrossRef]
86. Dai, F.; Qiu, Z.Y.; Qiu, Q.; Liu, C.J.; Huang, G.Z.; Huang, Y.L.; Deng, X.L. Rapid detection method of citrus huanglongbing based on Raman spectroscopy and autofluorescence spectroscopy. Intell. Agric. 2019, 1, 10. [Google Scholar]
87. Liu, Y.; Xiao, H.; Hao, Y.; Ye, L.; Jiang, X.; Wang, H.; Sun, X. Diagnosis of citrus greening using raman spectroscopy-based pattern recognition. J. Appl. Spectrosc. 2020, 87, 150–158. [Google Scholar] [CrossRef]
88. Wang, K.; Liao, Y.; Meng, Y.; Jiao, X.; Huang, W.; Liu, T.C.Y. The early, rapid, and non-destructive detection of citrus Huanglongbing (HLB) based on microscopic confocal Raman. Food Anal. Methods 2019, 12, 2500–2508. [Google Scholar] [CrossRef]
89. Sanchez, L.; Pant, S.; Irey, M.; Mandadi, K.; Kurouski, D. Detection and identification of canker and blight on orange trees using a hand-held Raman spectrometer. J. Raman Spectrosc. 2019, 50, 1875–1880. [Google Scholar] [CrossRef]
90. Pérez, M.R.V.; Mendoza, M.G.G.; Elías, M.G.R.; González, F.J.; Contreras, H.R.N.; Servín, C.C. Raman spectroscopy an option for the early detection of citrus Huanglongbing. Appl. Spectrosc. 2016, 70, 829–839. [Google Scholar] [CrossRef] [PubMed]
91. Ferguson, K.; da Cruz, M.A.; Ferrarezi, R.; Dorado, C.; Bai, J.; Cameron, R.G. Impact of Huanglongbing (HLB) on grapefruit pectin yield and quality during grapefruit maturation. Food Hydrocoll. 2021, 113, 106553. [Google Scholar] [CrossRef]
92. Sanchez, L.; Pant, S.; Mandadi, K.; Kurouski, D. Raman spectroscopy vs quantitative polymerase chain reaction in early stage Huanglongbing diagnostics. Sci. Rep. 2020, 10, 10101. [Google Scholar] [CrossRef] [PubMed]
93. Sanchez, L.; Pant, S.; Xing, Z.; Mandadi, K.; Kurouski, D. Rapid and noninvasive diagnostics of Huanglongbing and nutrient deficits on citrus trees with a handheld Raman spectrometer. Anal. Bioanal. Chem. 2019, 411, 3125–3133. [Google Scholar] [CrossRef]
94. Feng, H.; Wang, C.; He, Y.; Tang, L.; Han, P.; Liang, J.; Huang, L. Apple Valsa canker: Insights into pathogenesis and disease control. Phytopathol. Res. 2023, 5, 45. [Google Scholar] [CrossRef]
95. Fang, S.; Zhao, Y.; Wang, Y.; Li, J.; Zhu, F.; Yu, K. Surface-enhanced Raman scattering spectroscopy combined with chemical imaging analysis for detecting apple Valsa canker at an early stage. Front. Plant Sci. 2022, 13, 802761. [Google Scholar] [CrossRef]
96. Vallejo-Pérez, M.R.; Sosa-Herrera, J.A.; Navarro-Contreras, H.R.; Álvarez-Preciado, L.G.; Rodríguez-Vázquez, Á.G.; Lara-Ávila, J.P. Raman spectroscopy and machine-learning for early detection of bacterial canker of tomato: The asymptomatic disease condition. Plants 2021, 10, 1542. [Google Scholar] [CrossRef]
97. Wang, K.; Li, Z.; Li, J.; Lin, H. Raman spectroscopic techniques for nondestructive analysis of agri-foods: A state-of-the-art review. Trends Food Sci. Technol. 2021, 118, 490–504. [Google Scholar] [CrossRef]
98. Guo, Z.; Wang, M.; Barimah, A.O.; Chen, Q.; Li, H.; Shi, J.; Zou, X. Label-free surface enhanced Raman scattering spectroscopy for discrimination and detection of dominant apple spoilage fungus. Int. J. Food Microbiol. 2021, 338, 108990. [Google Scholar] [CrossRef] [PubMed]
99. Weng, S.; Hu, X.; Wang, J.; Tang, L.; Li, P.; Zheng, S.; Zhang, L.; Huang, L.; Xin, Z. Advanced application of Raman spectroscopy and surface-enhanced Raman spectroscopy in plant disease diagnostics: A review. J. Agric. Food Chem. 2021, 69, 2950–2964. [Google Scholar] [CrossRef]
100. Li, D.; Zhu, Z.; Sun, D.W. Visualization of the in situ distribution of contents and hydrogen bonding states of cellular level water in apple tissues by confocal Raman microscopy. Analyst 2020, 145, 897–907. [Google Scholar] [CrossRef]
101. Campos, M.T.; Maia, L.F.; Dos Santos, H.F.; Edwards, H.G.; Oliveira, L.F. Revealing the chemical synergism in coloring tomatoes by Raman spectroscopy. J. Raman Spectrosc. 2023, 54, 1314–1326. [Google Scholar] [CrossRef]
102. Akpolat, H.; Barineau, M.; Jackson, K.A.; Akpolat, M.Z.; Francis, D.M.; Chen, Y.J.; Rodriguez-Saona, L.E. High-throughput phenotyping approach for screening major carotenoids of tomato by handheld raman spectroscopy using chemometric methods. Sensors 2020, 20, 3723. [Google Scholar] [CrossRef]
103. Mandrile, L.; Rotunno, S.; Miozzi, L.; Vaira, A.M.; Giovannozzi, A.M.; Rossi, A.M.; Noris, E. Nondestructive Raman spectroscopy as a tool for early detection and discrimination of the infection of tomato plants by two economically important viruses. Anal. Chem. 2019, 91, 9025–9031. [Google Scholar] [CrossRef] [PubMed]
104. Brezestean, I.A.; Tosa, N.; Falamas, A.; Cuibus, D.; Muntean, C.M.; Bende, A.; Cozar, B.; Berghian-Grosan, C.; Farcău, C. Silver nanoparticle films obtained by convective self-assembly for surface-enhanced Raman spectroscopy analyses of the pesticides thiabendazole and endosulfan. Front. Chem. 2022, 10, 915337. [Google Scholar] [CrossRef] [PubMed]
105. Nie, P.; Dong, T.; Xiao, S.; Lin, L.; He, Y.; Qu, F. Quantitative determination of thiabendazole in soil extracts by surface-enhanced Raman spectroscopy. Molecules 2018, 23, 1949. [Google Scholar] [CrossRef] [PubMed]
106. Lin, L.; Dong, T.; Nie, P.; Qu, F.; He, Y.; Chu, B.; Xiao, S. Rapid determination of thiabendazole pesticides in rape by surface enhanced Raman spectroscopy. Sensors 2018, 18, 1082. [Google Scholar] [CrossRef] [PubMed]
107. Dominguez, A.N.; Emmert, G.E.; Gil, D.M.; Alvarez, R.M.S. Experimental and theoretical vibrational study of the fungicide pyraclostrobin. Spectrochim. Acta Part A Mol. Biomol. Spectrosc. 2021, 259, 119888. [Google Scholar] [CrossRef]
108. Serin, S. Computational insights into E/Z isomerism of fluoxastrobin, an antifungal agent: A DFT/TD-DFT study. J. Mol. Struct. 2023, 1287, 135713. [Google Scholar] [CrossRef]
109. Zhu, X.; Li, W.; Wu, R.; Liu, P.; Hu, X.; Xu, L.; Xiong, Z.; Wen, Y.; Ai, S. Rapid detection of chlorpyrifos pesticide residue in tea using surface-enhanced Raman spectroscopy combined with chemometrics. Spectrochim. Acta Part A Mol. Biomol. Spectrosc. 2021, 250, 119366. [Google Scholar] [CrossRef] [PubMed]
110. Chen, Z.; Dong, X.; Liu, C.; Wang, S.; Dong, S.; Huang, Q. Rapid detection of residual chlorpyrifos and pyrimethanil on fruit surface by surface-enhanced Raman spectroscopy integrated with deep learning approach. Sci. Rep. 2023, 13, 18955. [Google Scholar] [CrossRef] [PubMed]
111. Zhai, W.; Cao, M.; Xiao, Z.; Li, D.; Wang, M. Rapid detection of malathion, phoxim and thiram on orange surfaces using Ag nanoparticle modified PDMS as surface-enhanced Raman spectroscopy substrate. Foods 2022, 11, 3579. [Google Scholar] [CrossRef]
112. Dao, T.C.; Luong, T.Q.N.; Cao, T.A.; Kieu, N.M. High-sensitive SERS detection of thiram with silver nanodendrites substrate. Adv. Nat. Sci. Nanosci. Nanotechnol. 2019, 10, 025012. [Google Scholar] [CrossRef]
113. El-Sheikh, E.S.A.; Ramadan, M.M.; El-Sobki, A.E.; Shalaby, A.A.; McCoy, M.R.; Hamed, I.A.; Ashour, M.B.; Hammock, B.D. Pesticide residues in vegetables and fruits from farmer markets and associated dietary risks. Molecules 2022, 27, 8072. [Google Scholar] [CrossRef]
114. Yan, Z.; Nie, J.; Cheng, Y.; Han, L.; Farooq, S. Method development, validation, and risk assessment of multiple pesticide residues of fruits in China. Environ. Sci. Pollut. Res. 2024, 31, 18826–18841. [Google Scholar] [CrossRef]
115. Zhao, H.; Li, W.; Li, J.; Sun, Y.; Yang, Q.; Sun, M. Advances of SERS applications in clinic samples analysis. Appl. Spectrosc. Rev. 2024, 59, 157–186. [Google Scholar] [CrossRef]
116. Müller Molnár, C.; Berghian-Groșan, C.; Măgdaș, D.A.; Cîntă Pînzaru, S. Surface-Enhance Raman Spectroscopy Detection of Thiabendazole in Frozen Food Products: The Case of Blueberries and Their Extracts. Chemosensors 2023, 11, 505. [Google Scholar] [CrossRef]
117. Dominguez, A.N.; Jimenez, L.E.; Álvarez, R.M.S. Rapid detection of pyraclostrobin fungicide residues in lemon with surface-enhanced Raman spectroscopy. J. Food Meas. Charact. 2023, 17, 6350–6362. [Google Scholar] [CrossRef]
118. Wang, K.; Huang, M.; Chen, J.; Lin, L.; Kong, L.; Liu, X.; Wang, H.; Lin, M. A “drop-wipe-test” SERS method for rapid detection of pesticide residues in fruits. J. Raman Spectrosc. 2018, 49, 493–498. [Google Scholar] [CrossRef]
119. Kang, Y.; Li, L.; Chen, W.; Zhang, F.; Du, Y.; Wu, T. Rapid in situ SERS analysis of pesticide residues on plant surfaces based on micelle extraction of targets and stabilization of Ag nanoparticle aggregates. Food Anal. Methods 2018, 11, 3161–3169. [Google Scholar] [CrossRef]
120. Tang, J.; Chen, W.; Ju, H. Rapid detection of pesticide residues using a silver nanoparticles coated glass bead as nonplanar substrate for SERS sensing. Sensors Actuators B Chem. 2019, 287, 576–583. [Google Scholar] [CrossRef]
121. Jiang, J.; Gao, J.M.; Guo, J.S.; Zhou, Q.H.; Liu, X.H.; Ouyang, W.J.; Zhang, P.; Fu, W.L.; Zhang, W.; He, S.X. Identification and analysis of triphenyltin chloride with surface enhanced Raman scattering spectroscopy. Chemosphere 2016, 161, 96–103. [Google Scholar] [CrossRef] [PubMed]
122. Liou, P.; Nayigiziki, F.X.; Kong, F.; Mustapha, A.; Lin, M. Cellulose nanofibers coated with silver nanoparticles as a SERS platform for detection of pesticides in apples. Carbohydr. Polym. 2017, 157, 643–650. [Google Scholar] [CrossRef]
123. Kumar, S.; Goel, P.; Singh, J.P. Flexible and robust SERS active substrates for conformal rapid detection of pesticide residues from fruits. Sensors Actuators B Chem. 2017, 241, 577–583. [Google Scholar] [CrossRef]
124. Zhai, C.; Peng, Y.; Li, Y.; Chao, K. Extraction and identification of mixed pesticides’ Raman signal and establishment of their prediction models. J. Raman Spectrosc. 2017, 48, 494–500. [Google Scholar] [CrossRef]
125. Wang, Y.; Wang, M.; Sun, X.; Shi, G.; Ma, W.; Ren, L. Rapid, simple and quantitative detection of metolcarb residues in apples by surface-enhanced Raman scattering. AIP Adv. 2018, 8, 075001. [Google Scholar] [CrossRef]
126. Zong, C.; Ge, M.; Pan, H.; Wang, J.; Nie, X.; Zhang, Q.; Zhao, W.; Liu, X.; Yu, Y. In situ synthesis of low-cost and large-scale flexible metal nanoparticle–polymer composite films as highly sensitive SERS substrates for surface trace analysis. RSC Adv. 2019, 9, 2857–2864. [Google Scholar] [CrossRef] [PubMed]
127. D’Agostino, A.; Giovannozzi, A.M.; Mandrile, L.; Sacco, A.; Rossi, A.M.; Taglietti, A. In situ seed-growth synthesis of silver nanoplates on glass for the detection of food contaminants by surface enhanced Raman scattering. Talanta 2020, 216, 120936. [Google Scholar] [CrossRef]
128. Sun, L.; Wang, C. Highly sensitive and rapid surface enhanced Raman spectroscopic (SERS) determination of thiram on the epidermis of fruits and vegetables using a silver nanoparticle-modified fibrous swab. Anal. Lett. 2020, 53, 973–983. [Google Scholar] [CrossRef]
129. Gong, X.; Tang, M.; Gong, Z.; Qiu, Z.; Wang, D.; Fan, M. Screening pesticide residues on fruit peels using portable Raman spectrometer combined with adhesive tape sampling. Food Chem. 2019, 295, 254–258. [Google Scholar] [CrossRef]
130. Shao, F.; Cao, J.; Ying, Y.; Liu, Y.; Wang, D.; Guo, X.; Wu, Y.; Wen, Y.; Yang, H. Preparation of hydrophobic film by electrospinning for rapid SERS detection of trace triazophos. Sensors 2020, 20, 4120. [Google Scholar] [CrossRef]
131. Dai, H.; Sun, Y.; Ni, P.; Lu, W.; Jiang, S.; Wang, Y.; Li, Z.; Li, Z. Three-dimensional TiO2 supported silver nanoparticles as sensitive and UV-cleanable substrate for surface enhanced Raman scattering. Sensors Actuators B Chem. 2017, 242, 260–268. [Google Scholar] [CrossRef]
132. Zhou, N.; Meng, G.; Huang, Z.; Ke, Y.; Zhou, Q.; Hu, X. A flexible transparent Ag-NC@ PE film as a cut-and-paste SERS substrate for rapid in situ detection of organic pollutants. Analyst 2016, 141, 5864–5869. [Google Scholar] [CrossRef]
133. Feng, J.; Hu, Y.; Grant, E.; Lu, X. Determination of thiabendazole in orange juice using an MISPE-SERS chemosensor. Food Chem. 2018, 239, 816–822. [Google Scholar] [CrossRef] [PubMed]
134. Alyami, A.; Quinn, A.J.; Iacopino, D. Flexible and transparent Surface Enhanced Raman Scattering (SERS)-Active Ag NPs/PDMS composites for in-situ detection of food contaminants. Talanta 2019, 201, 58–64. [Google Scholar] [CrossRef]
135. Wang, M.; Shi, G.; Zhu, Y.; Wang, Y.; Ma, W. Au-decorated dragonfly wing bioscaffold arrays as flexible surface-enhanced Raman scattering (SERS) substrate for simultaneous determination of pesticide residues. Nanomaterials 2018, 8, 289. [Google Scholar] [CrossRef]
136. Kang, Y.; Wu, T.; Chen, W.; Li, L.; Du, Y. A novel metastable state nanoparticle-enhanced Raman spectroscopy coupled with thin layer chromatography for determination of multiple pesticides. Food Chem. 2019, 270, 494–501. [Google Scholar] [CrossRef]
137. Shi, G.; Wang, M.; Zhu, Y.; Wang, Y.; Ma, W. Synthesis of flexible and stable SERS substrate based on Au nanofilms/cicada wing array for rapid detection of pesticide residues. Opt. Commun. 2018, 425, 49–57. [Google Scholar] [CrossRef]
138. Ma, P.; Wang, L.; Xu, L.; Li, J.; Zhang, X.; Chen, H. Rapid quantitative determination of chlorpyrifos pesticide residues in tomatoes by surface-enhanced Raman spectroscopy. Eur. Food Res. Technol. 2020, 246, 239–251. [Google Scholar] [CrossRef]
139. Wang, X.; Ai, S.; Xiong, A.; Zhou, W.; He, L.; Teng, J.; Geng, X.; Wu, R. SERS combined with QuEChERS using NBC and Fe3O4 MNPs as cleanup agents to rapidly and reliably detect chlorpyrifos pesticide in citrus. Anal. Methods 2023, 15, 6266–6274. [Google Scholar] [CrossRef] [PubMed]
140. Xiao, L.; Feng, S.; Hua, M.Z.; Lu, X. Rapid determination of thiram on apple using a flexible bacterial cellulose-based SERS substrate. Talanta 2023, 254, 124128. [Google Scholar] [CrossRef] [PubMed]
141. Xie, J.; Li, L.; Khan, I.M.; Wang, Z.; Ma, X. Flexible paper-based SERS substrate strategy for rapid detection of methyl parathion on the surface of fruit. Spectrochim. Acta Part A Mol. Biomol. Spectrosc. 2020, 231, 118104. [Google Scholar] [CrossRef]
142. Jiang, L.; Gu, K.; Liu, R.; Jin, S.; Wang, H.; Pan, C. Rapid detection of pesticide residues in fruits by surface-enhanced Raman scattering based on modified QuEChERS pretreatment method with portable Raman instrument. SN Appl. Sci. 2019, 1, 1–9. [Google Scholar] [CrossRef]
143. Huang, D.; Zhao, J.; Wang, M.; Zhu, S. Snowflake-like gold nanoparticles as SERS substrates for the sensitive detection of organophosphorus pesticide residues. Food Control 2020, 108, 106835. [Google Scholar] [CrossRef]
144. Hou, R.; Pang, S.; He, L. In situ SERS detection of multi-class insecticides on plant surfaces. Anal. Methods 2015, 7, 6325–6330. [Google Scholar] [CrossRef]
145. Chen, J.; Huang, Y.; Kannan, P.; Zhang, L.; Lin, Z.; Zhang, J.; Chen, T.; Guo, L. Flexible and adhesive surface enhance Raman scattering active tape for rapid detection of pesticide residues in fruits and vegetables. Anal. Chem. 2016, 88, 2149–2155. [Google Scholar] [CrossRef] [PubMed]
146. Luo, H.; Huang, Y.; Lai, K.; Rasco, B.A.; Fan, Y. Surface-enhanced Raman spectroscopy coupled with gold nanoparticles for rapid detection of phosmet and thiabendazole residues in apples. Food Control 2016, 68, 229–235. [Google Scholar] [CrossRef]
147. Zhu, J.; Liu, M.J.; Li, J.J.; Li, X.; Zhao, J.W. Multi-branched gold nanostars with fractal structure for SERS detection of the pesticide thiram. Spectrochim. Acta Part A Mol. Biomol. Spectrosc. 2018, 189, 586–593. [Google Scholar] [CrossRef]
148. Wu, H.; Luo, Y.; Hou, C.; Huo, D.; Wang, W.; Zhao, J.; Lei, Y. Rapid and fingerprinted monitoring of pesticide methyl parathion on the surface of fruits/leaves as well as in surface water enabled by gold nanorods based casting-and-sensing SERS platform. Talanta 2019, 200, 84–90. [Google Scholar] [CrossRef] [PubMed]
149. Wu, H.; Luo, Y.; Hou, C.; Huo, D.; Zhou, Y.; Zou, S.; Zhao, J.; Lei, Y. Flexible bipyramid-AuNPs based SERS tape sensing strategy for detecting methyl parathion on vegetable and fruit surface. Sensors Actuators B Chem. 2019, 285, 123–128. [Google Scholar] [CrossRef]
150. Fu, G.; Sun, D.W.; Pu, H.; Wei, Q. Fabrication of gold nanorods for SERS detection of thiabendazole in apple. Talanta 2019, 195, 841–849. [Google Scholar] [CrossRef]
151. Lee, H.; Liao, J.D.; Sivashanmugan, K.; Liu, B.H.; Fu, W.E.; Chen, C.C.; Chen, G. D; Juang, Y.D. Gold nanoparticle-coated ZrO2-nanofiber surface as a SERS-active substrate for trace detection of pesticide residue. Nanomaterials 2018, 8, 402. [Google Scholar] [CrossRef]
152. Lin, S.; Li, X.; Fang, G.; Zhao, H.; Wang, L.; Dong, B. Tetragonal superlattice of elongated rhombic dodecahedra for sensitive SERS determination of pesticide residues in fruit. ACS Appl. Mater. Interfaces 2020, 12, 56350–56360. [Google Scholar] [CrossRef]
153. Chen, J.; Dong, D.; Ye, S. Detection of pesticide residue distribution on fruit surfaces using surface-enhanced Raman spectroscopy imaging. RSC Adv. 2018, 8, 4726–4730. [Google Scholar] [CrossRef]
154. Tran, M.; Fallatah, A.; Whale, A.; Padalkar, S. Utilization of inexpensive carbon-based substrates as platforms for sensing. Sensors 2018, 18, 2444. [Google Scholar] [CrossRef]
155. Dowgiallo, A.M.; Guenther, D.A. Determination of the limit of detection of multiple pesticides utilizing gold nanoparticles and surface-enhanced Raman spectroscopy. J. Agric. Food Chem. 2019, 67, 12642–12651. [Google Scholar] [CrossRef] [PubMed]
156. Zhang, H.; Sun, L.; Zhang, Y.; Kang, Y.; Hu, H.; Tang, H.; Du, Y. Production of stable and sensitive SERS substrate based on commercialized porous material of silanized support. Talanta 2017, 174, 301–306. [Google Scholar] [CrossRef]
157. Chang, F.C.; Huang, J.W.; Chen, C.H. Au–Pt–Pd spherically self-assembled nano-sieves as SERS sensors. J. Alloy. Compd. 2020, 843, 155885. [Google Scholar] [CrossRef]
158. Hu, B.; Sun, D.W.; Pu, H.; Wei, Q. Rapid nondestructive detection of mixed pesticides residues on fruit surface using SERS combined with self-modeling mixture analysis method. Talanta 2020, 217, 120998. [Google Scholar] [CrossRef]
159. Kong, L.; Huang, M.; Chen, J.; Lin, M. In situ detection of thiram in fruits and vegetables by colorimetry/surface-enhanced Raman spectroscopy. Laser Phys. 2020, 30, 065602. [Google Scholar] [CrossRef]
160. Yu, F.; Su, M.; Tian, L.; Wang, H.; Liu, H. Organic solvent as internal standards for quantitative and high-throughput liquid interfacial SERS analysis in complex media. Anal. Chem. 2018, 90, 5232–5238. [Google Scholar] [CrossRef] [PubMed]
161. Ouyang, L.; Dai, P.; Yao, L.; Zhou, Q.; Tang, H.; Zhu, L. A functional Au array SERS chip for the fast inspection of pesticides in conjunction with surface extraction and coordination transferring. Analyst 2019, 144, 5528–5537. [Google Scholar] [CrossRef] [PubMed]
162. Hong, J.; Kawashima, A.; Hamada, N. A simple fabrication of plasmonic surface-enhanced Raman scattering (SERS) substrate for pesticide analysis via the immobilization of gold nanoparticles on UF membrane. Appl. Surf. Sci.e 2017, 407, 440–446. [Google Scholar] [CrossRef]
163. Xu, Q.; Guo, X.; Xu, L.; Ying, Y.; Wu, Y.; Wen, Y.; Yang, H. Template-free synthesis of SERS-active gold nanopopcorn for rapid detection of chlorpyrifos residues. Sensors Actuators B Chem. 2017, 241, 1008–1013. [Google Scholar] [CrossRef]
164. Zhang, L.; Li, X.; Liu, W.; Hao, R.; Jia, H.; Dai, Y.; Amin, M.; You, H.; Li, T.; Fang, J. Highly active Au NP microarray films for direct SERS detection. J. Mater. Chem. C 2019, 7, 15259–15268. [Google Scholar] [CrossRef]
165. Cui, H.; Li, S.; Deng, S.; Chen, H.; Wang, C. Flexible, transparent, and free-standing silicon nanowire SERS platform for in situ food inspection. ACS Sensors 2017, 2, 386–393. [Google Scholar] [CrossRef]
166. Chen, M.; Luo, W.; Liu, Q.; Hao, N.; Zhu, Y.; Liu, M.; Wang, L.; Yang, H.; Chen, X. Simultaneous in situ extraction and fabrication of surface-enhanced Raman scattering substrate for reliable detection of thiram residue. Anal. Chem. 2018, 99, 13647–13654. [Google Scholar] [CrossRef]
167. Zhao, Z.; Huang, Y.; Fan, Y.; Lai, K. Rapid detection of flusilazole in pears with Au@ Ag nanoparticles for surface-enhanced Raman scattering. Nanomaterials 2018, 8, 94. [Google Scholar] [CrossRef] [PubMed]
168. Liu, K.; Bai, Y.; Zhang, L.; Yang, Z.; Fan, Q.; Zheng, H.; Yin, Y.; Gao, C. Porous Au–Ag nanospheres with high-density and highly accessible hotspots for SERS analysis. Nano Lett. 2016, 16, 3675–3681. [Google Scholar] [CrossRef] [PubMed]
169. Asgari, S.; Wu, G.; Aghvami, S.A.; Zhang, Y.; Lin, M. Optimisation using the finite element method of a filter-based microfluidic SERS sensor for detection of multiple pesticides in strawberry. Food Addit. Contam. Part A 2021, 38, 646–658. [Google Scholar] [CrossRef] [PubMed]
170. Rizzato, M.L.; Picone, A.L.; Romano, R.M. A facile method for in-situ detection of thiabendazole residues in fruit and vegetable peels using Surface-Enhanced Raman Spectroscopy. Talanta Open 2023, 7, 10023. [Google Scholar] [CrossRef]
171. Li, X.; Zhang, Y.; Awais, M.; Zhang, H.; Naqvi, S.M.Z.A.; Li, L.; Xiong, Y.; Hu, J. Analysis and experimental assessment of an optimized SERS substrate used to detect thiabendazole in apples with high sensitivity. Anal. Bioanal. Chem. 2024, 416, 497–508. [Google Scholar] [CrossRef] [PubMed]
172. Dayalan, S.; Sudewi, S.; Zulfajri, M.; Kao, C.L.; Huang, G.G. Effect of pH on the optimization of cysteine-functionalized gold core-silver shell nanoparticles for surface-enhanced Raman scattering-based pesticide detection on apple peels. J. Chin. Chem. Soc. 2023, 70, 1821–1834. [Google Scholar] [CrossRef]
173. Pu, H.; Huang, Z.; Xu, F.; Sun, D.W. Two-dimensional self-assembled Au-Ag core-shell nanorods nanoarray for sensitive detection of thiram in apple using surface-enhanced Raman spectroscopy. Food Chem. 2021, 343, 128548. [Google Scholar] [CrossRef]
174. Hussain, N.; Pu, H.; Hussain, A.; Sun, D.W. Rapid detection of ziram residues in apple and pear fruits by SERS based on octanethiol functionalized bimetallic core-shell nanoparticles. Spectrochim. Acta Part A Mol. Biomol. Spectrosc. 2020, 236, 118357. [Google Scholar] [CrossRef]
175. Wang, K.; Sun, D.W.; Pu, H.; Wei, Q. Shell thickness-dependent Au@ Ag nanoparticles aggregates for high-performance SERS applications. Talanta 2019, 195, 506–515. [Google Scholar] [CrossRef] [PubMed]
176. Wang, K.; Sun, D.W.; Pu, H.; Wei, Q. Surface-enhanced Raman scattering of core-shell Au@ Ag nanoparticles aggregates for rapid detection of difenoconazole in grapes. Talanta 2019, 191, 449–456. [Google Scholar] [CrossRef]
177. Yaseen, T.; Pu, H.; Sun, D.W. Rapid detection of multiple organophosphorus pesticides (triazophos and parathion-methyl) residues in peach by SERS based on core-shell bimetallic Au@ Ag NPs. Food Addit. Contam. Part A 2019, 36, 762–778. [Google Scholar] [CrossRef]
178. Yaseen, T.; Pu, H.; Sun, D.W. Fabrication of silver-coated gold nanoparticles to simultaneously detect multi-class insecticide residues in peach with SERS technique. Talanta 2019, 196, 537–545. [Google Scholar] [CrossRef]
179. Zhang, D.; Liang, P.; Chen, W.; Tang, Z.; Li, C.; Xiao, K.; Jin, S.; Ni, D.; Yu, Z. Rapid field trace detection of pesticide residue in food based on surface-enhanced Raman spectroscopy. Microchim. Acta 2021, 188, 1–28. [Google Scholar] [CrossRef]
180. Wang, T.; Wang, S.; Cheng, Z.; Wei, J.; Yang, L.; Zhong, Z.; Hu, H.; Wang, Y.; Zhou, B.; Li, P. Emerging core–shell nanostructures for surface-enhanced Raman scattering (SERS) detection of pesticide residues. Chem. Eng. J. 2021, 424, 130323. [Google Scholar] [CrossRef]
181. Louppis, A.P.; Kontominas, M.G. Analytical insights for ensuring authenticity of Greek agriculture products: Unveiling chemical marker applications. Food Chem. 2024, 445, 138758. [Google Scholar] [CrossRef]
182. Ali, A.H. High-performance liquid chromatography (HPLC): A review. Ann. Adv. Chem. 2022, 6, 010–020. [Google Scholar]
183. Lu, S.Y.; Zhang, L.L.; Pan, J.R.; Yang, D.H.; Sui, Y.N.; Zhu, C. Cherry origin identification based on Raman spectroscopy combined with LSTM long short-term memory network. Spectrosc. Spectr. Anal. 2021, 41, 1177–1181. [Google Scholar]
184. Lu, S.Y. Study on Origin Traceability of Cherry Based on Raman Spectrum and Pattern Recognition. Master’s Thesis, China University of Metrology, Hangzhou, China, 2021. [Google Scholar]
185. Traksele, L.; Snitka, V. Surface-enhanced Raman spectroscopy for the characterization of Vaccinium myrtillus L. bilberries of the Baltic–Nordic regions. Eur. Food Res. Technol. 2022, 248, 427–435. [Google Scholar] [CrossRef]
186. Arndt, M.; Rurik, M.; Drees, A.; Bigdowski, K.; Kohlbacher, O.; Fischer, M. Comparison of different sample preparation techniques for NIR screening and their influence on the geographical origin determination of almonds (Prunus dulcis MILL.). Food Control. 2020, 115, 107302. [Google Scholar] [CrossRef]
187. Wadood, S.A.; Boli, G.; Xiaowen, Z.; Hussain, I.; Yimin, W. Recent development in the application of analytical techniques for the traceability and authenticity of food of plant origin. Microchem. J. 2020, 152, 104295. [Google Scholar] [CrossRef]
Huang Y, Wang H, Huang H, Tan Z, Hou C, Zhuang J, Tang Y. Raman Spectroscopy and Its Application in Fruit Quality Detection. Agriculture. 2025; 15(2):195. https://doi.org/10.3390/agriculture15020195
Перевод статьи «Raman Spectroscopy and Its Application in Fruit Quality Detection. Agriculture» авторов Huang Y, Wang H, Huang H, Tan Z, Hou C, Zhuang J, Tang Y., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
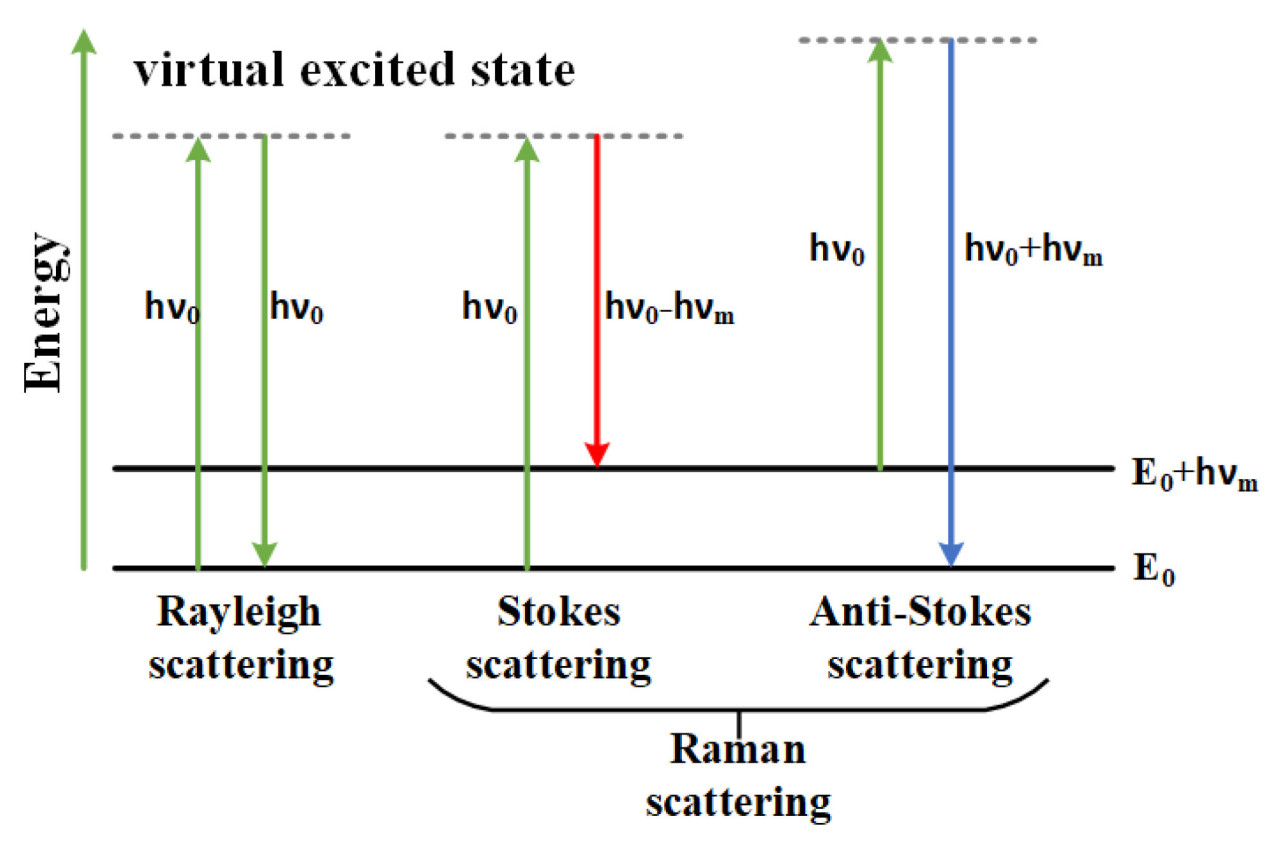
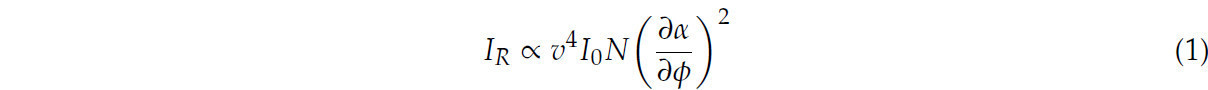
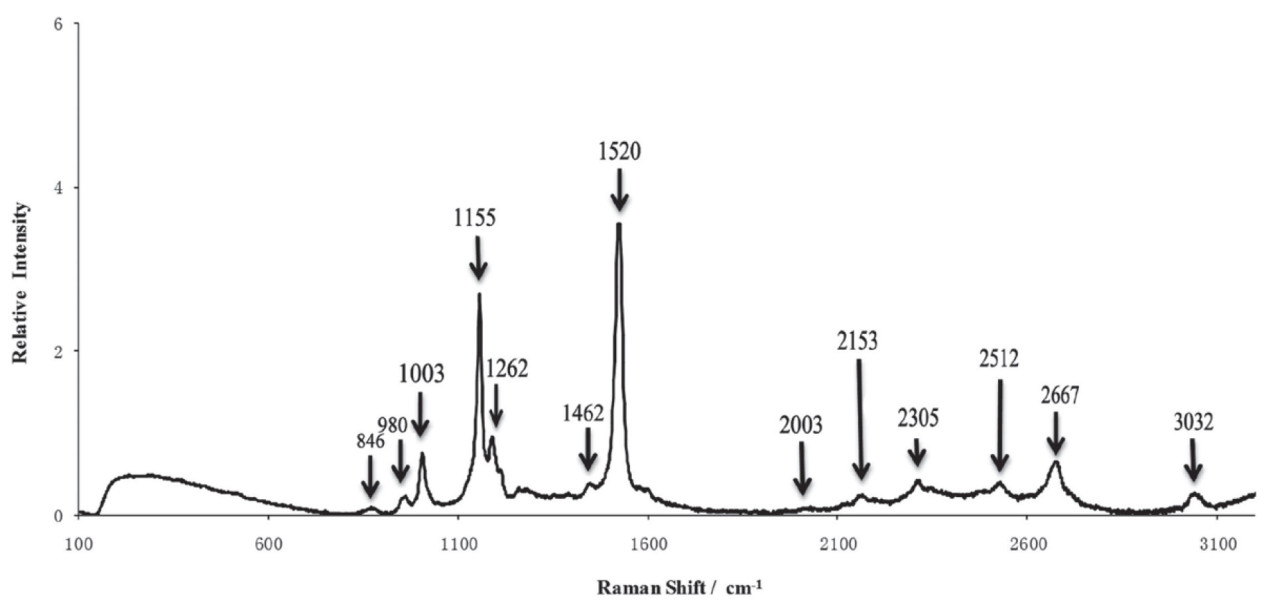
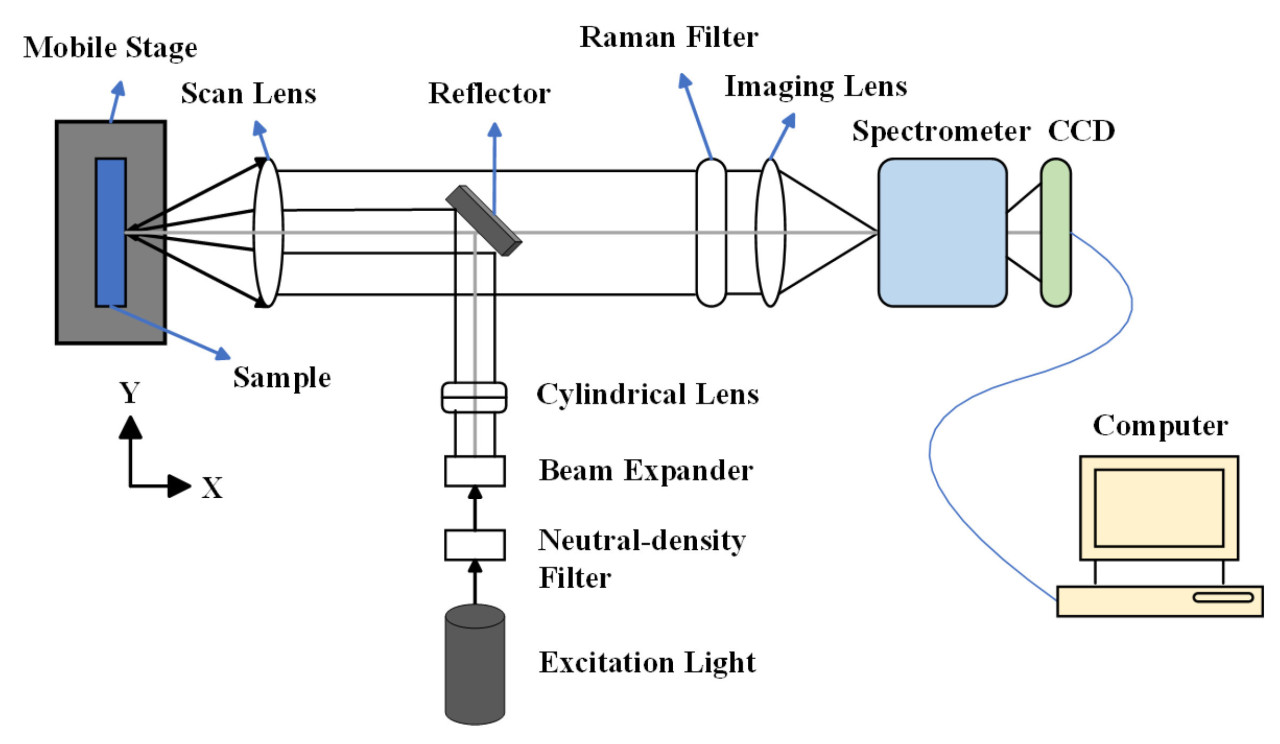
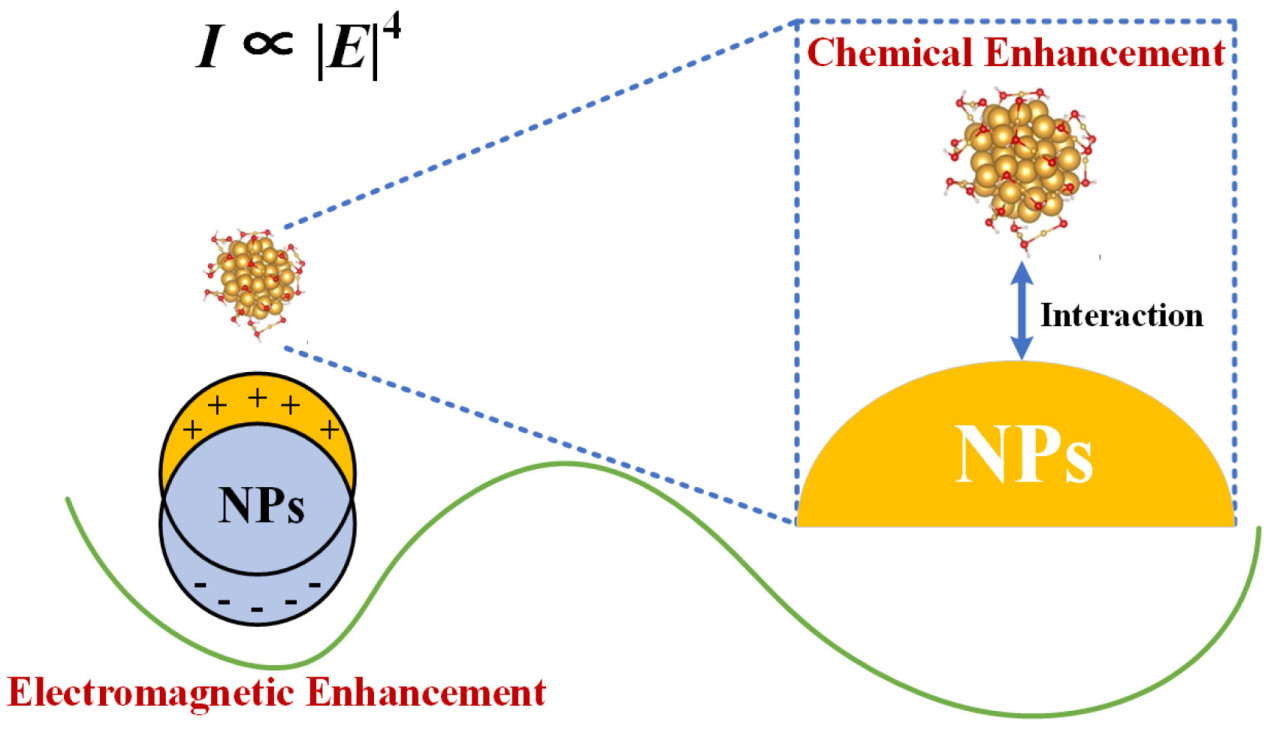
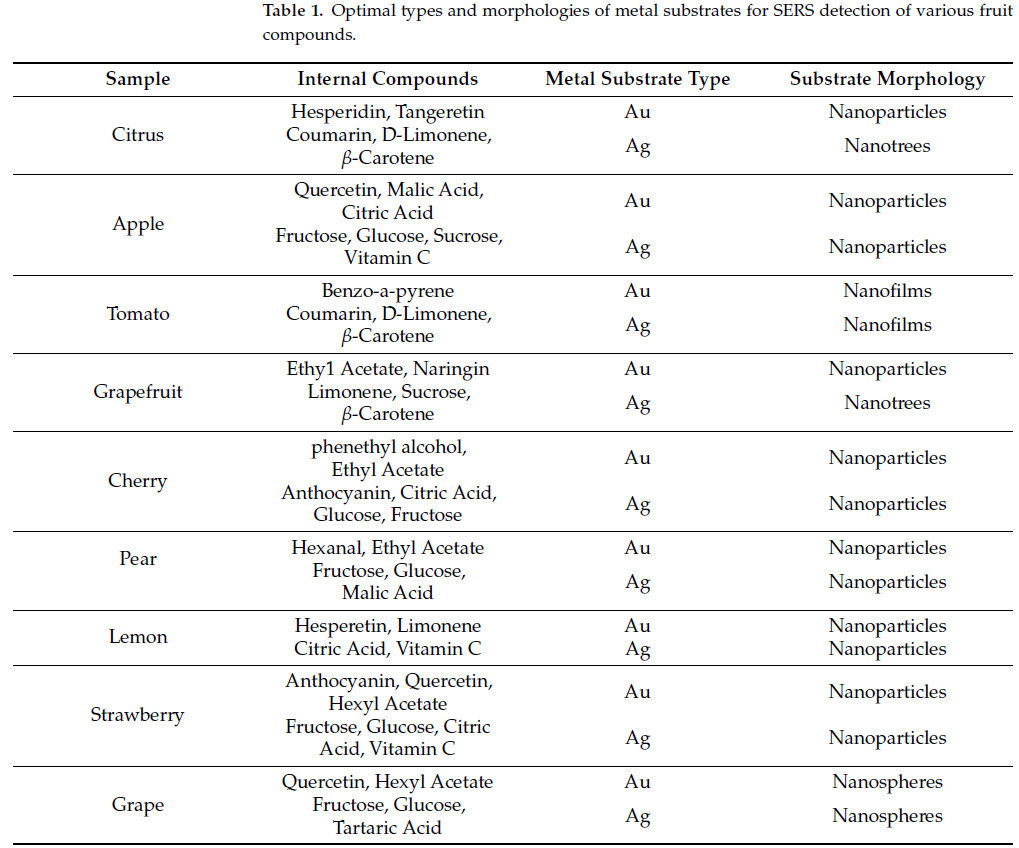
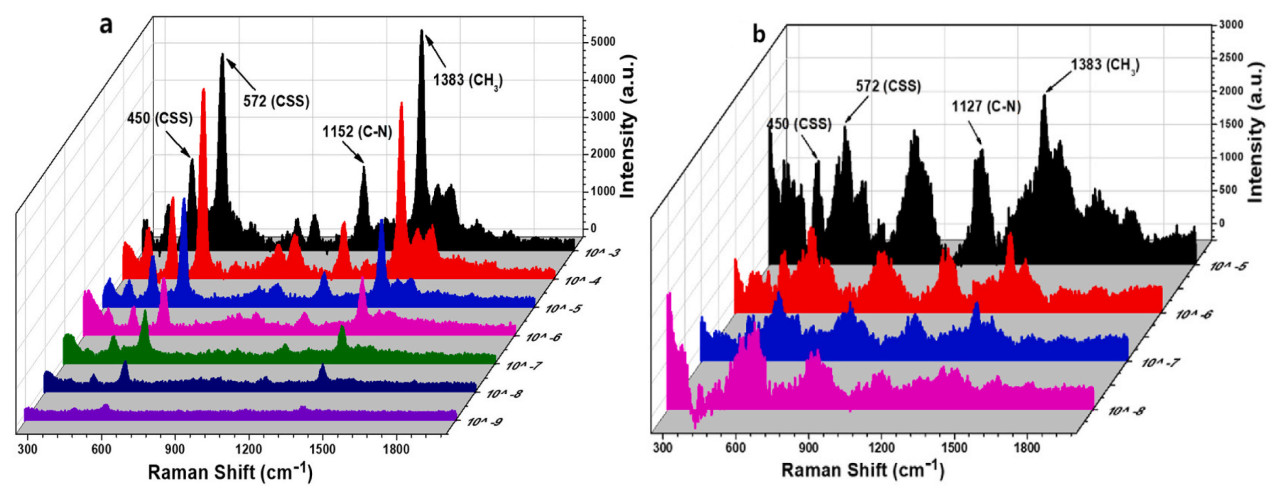
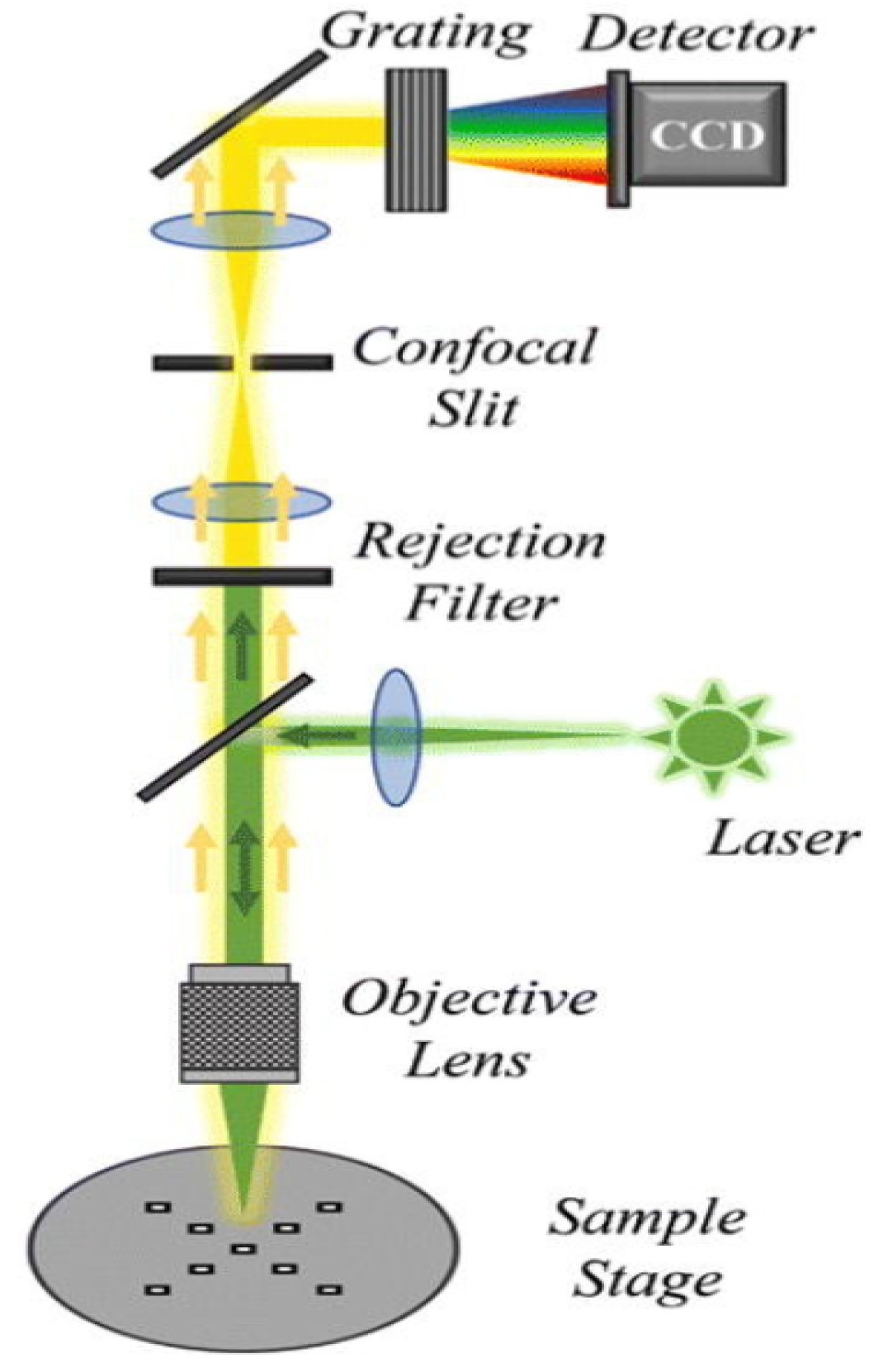
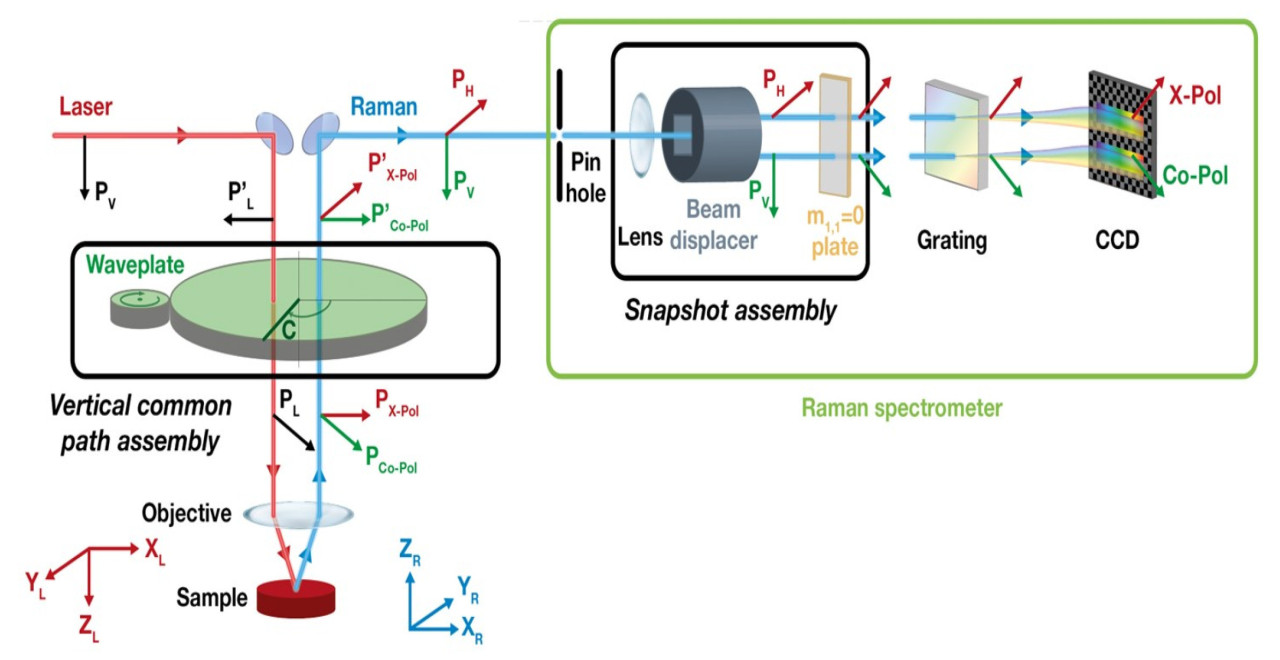
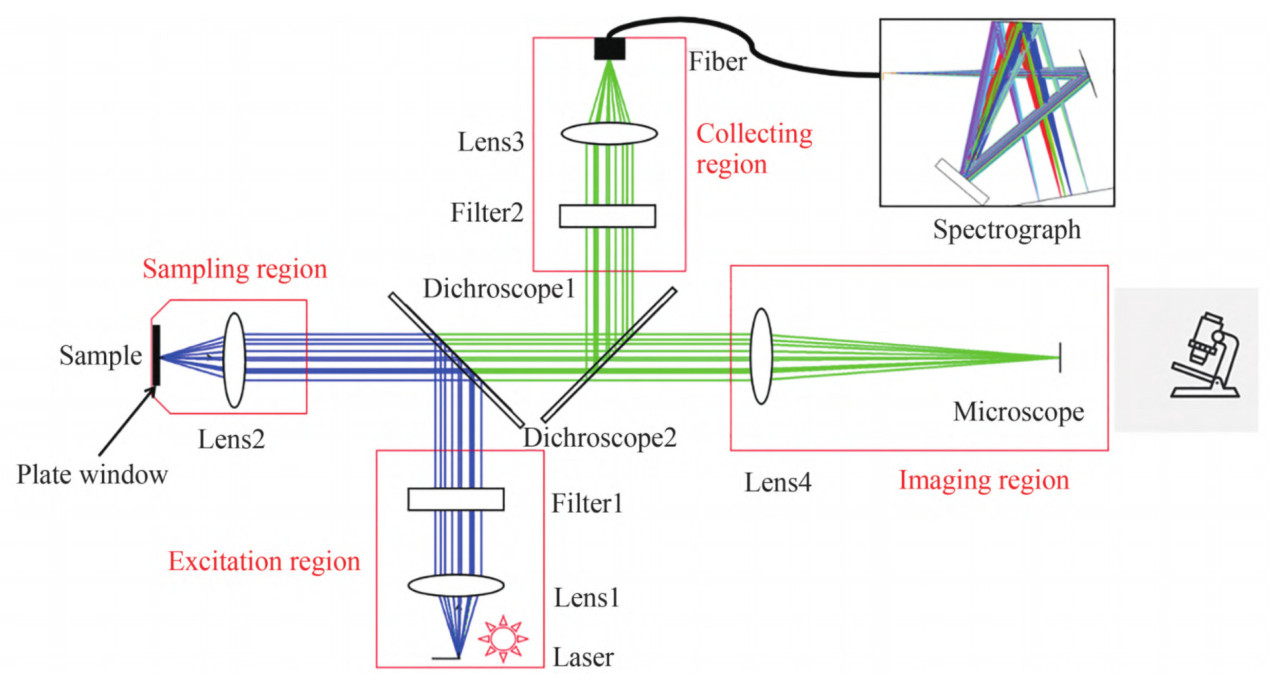
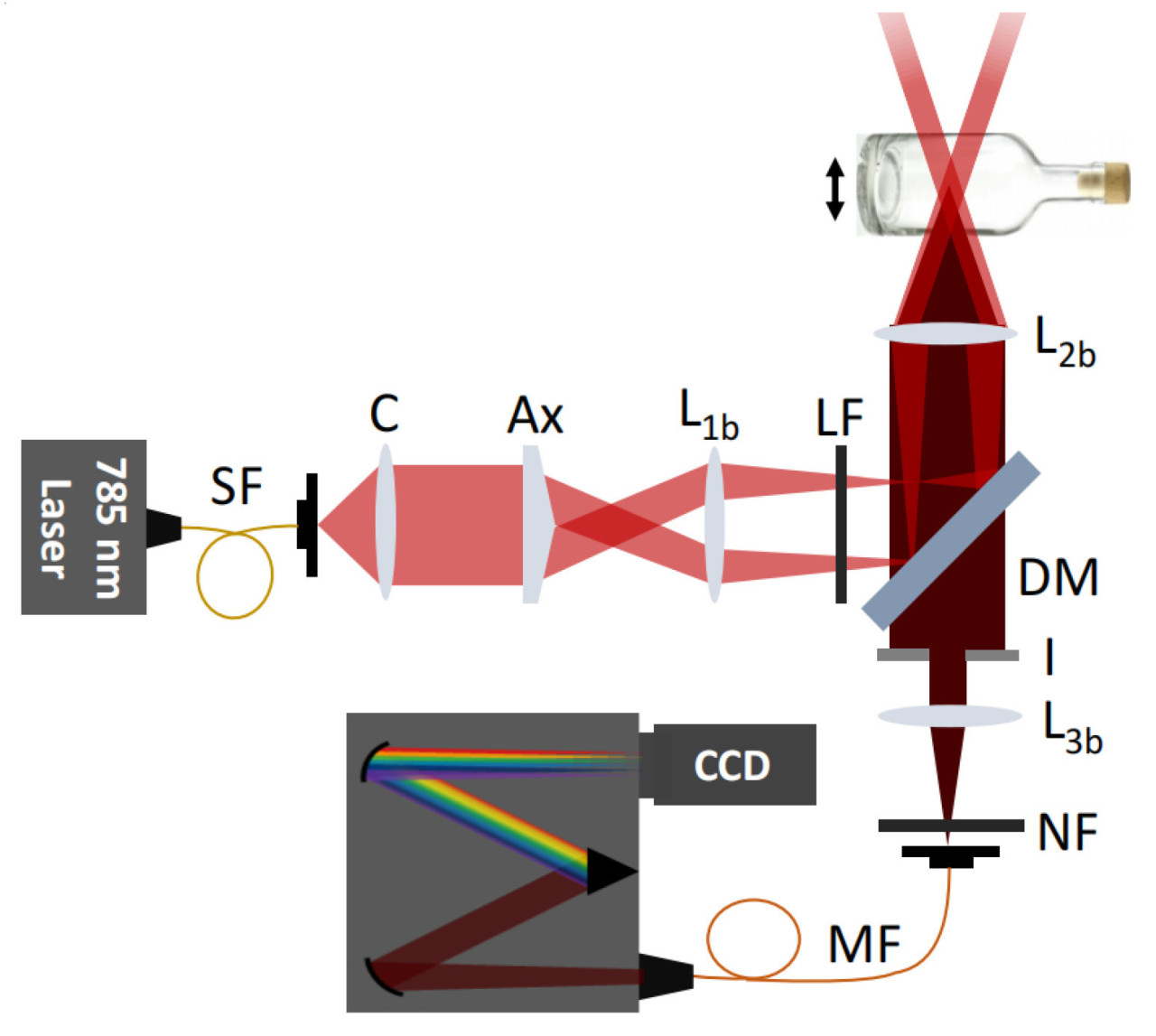
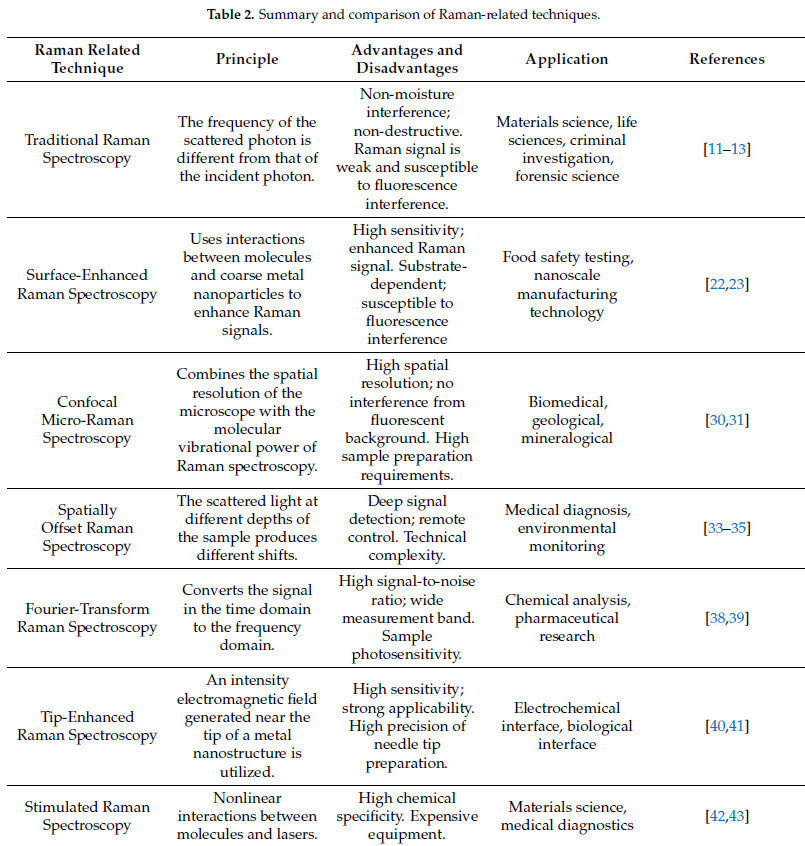
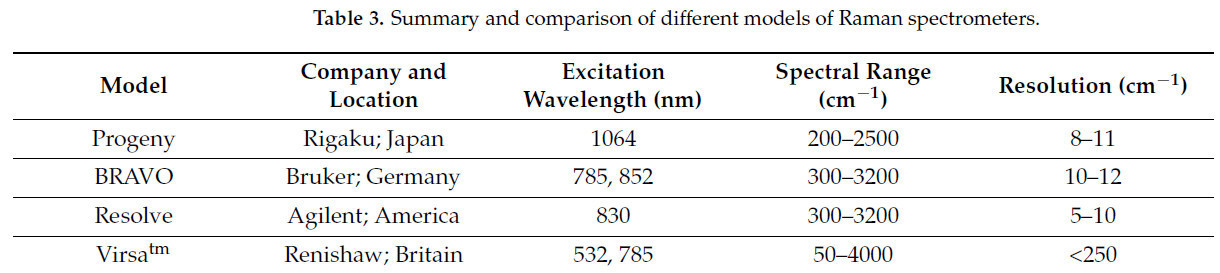
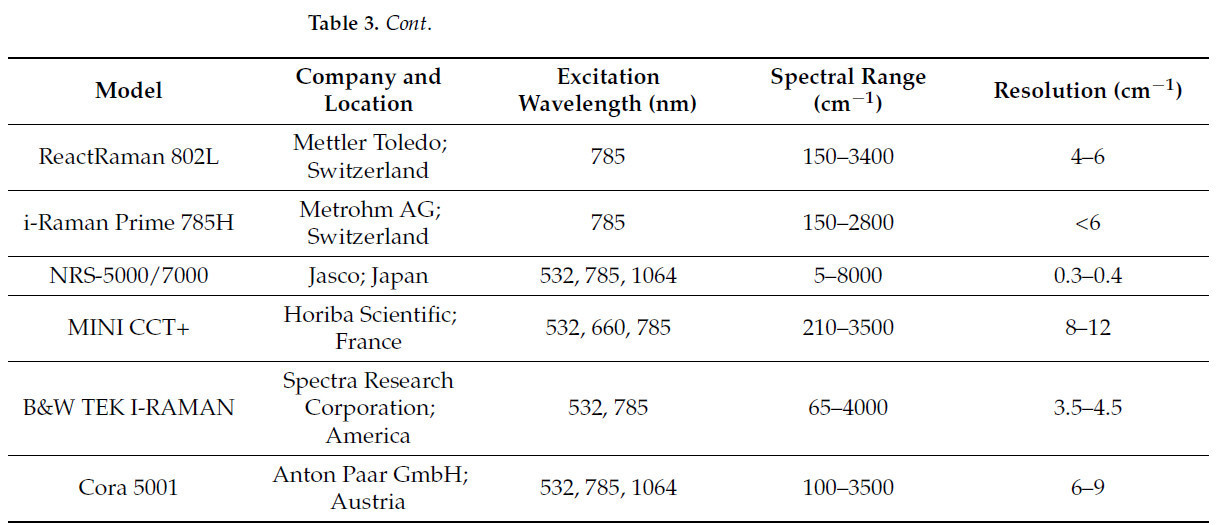
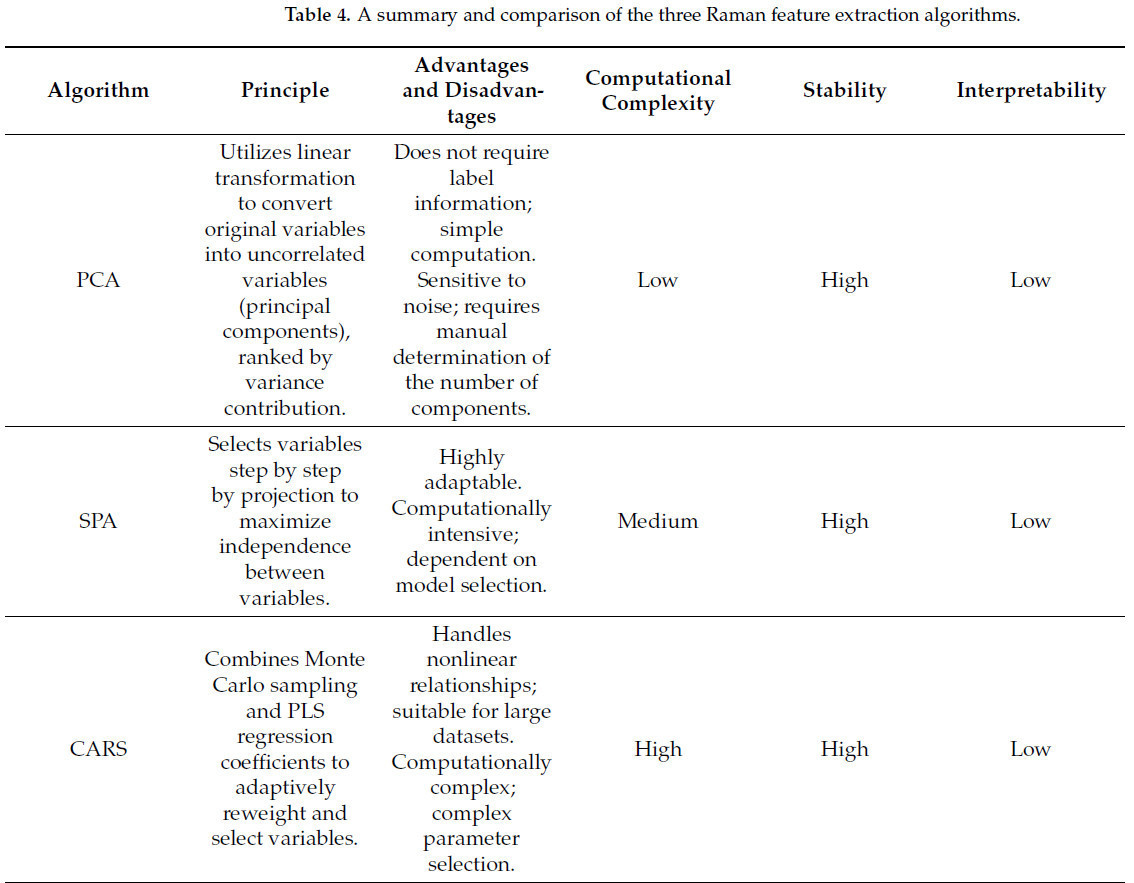

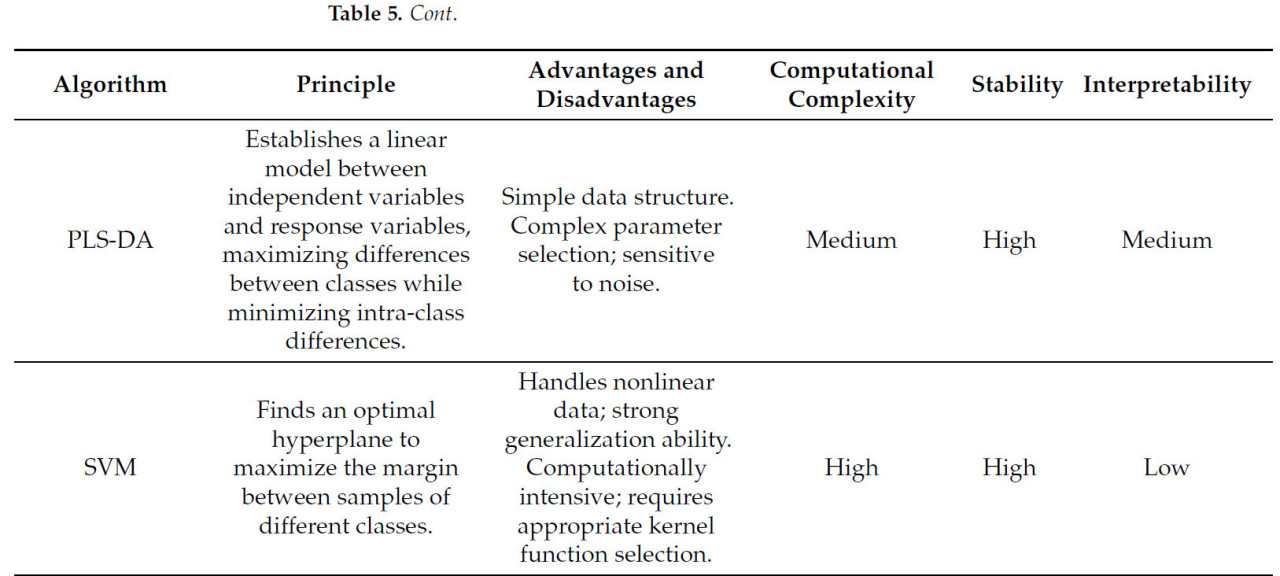

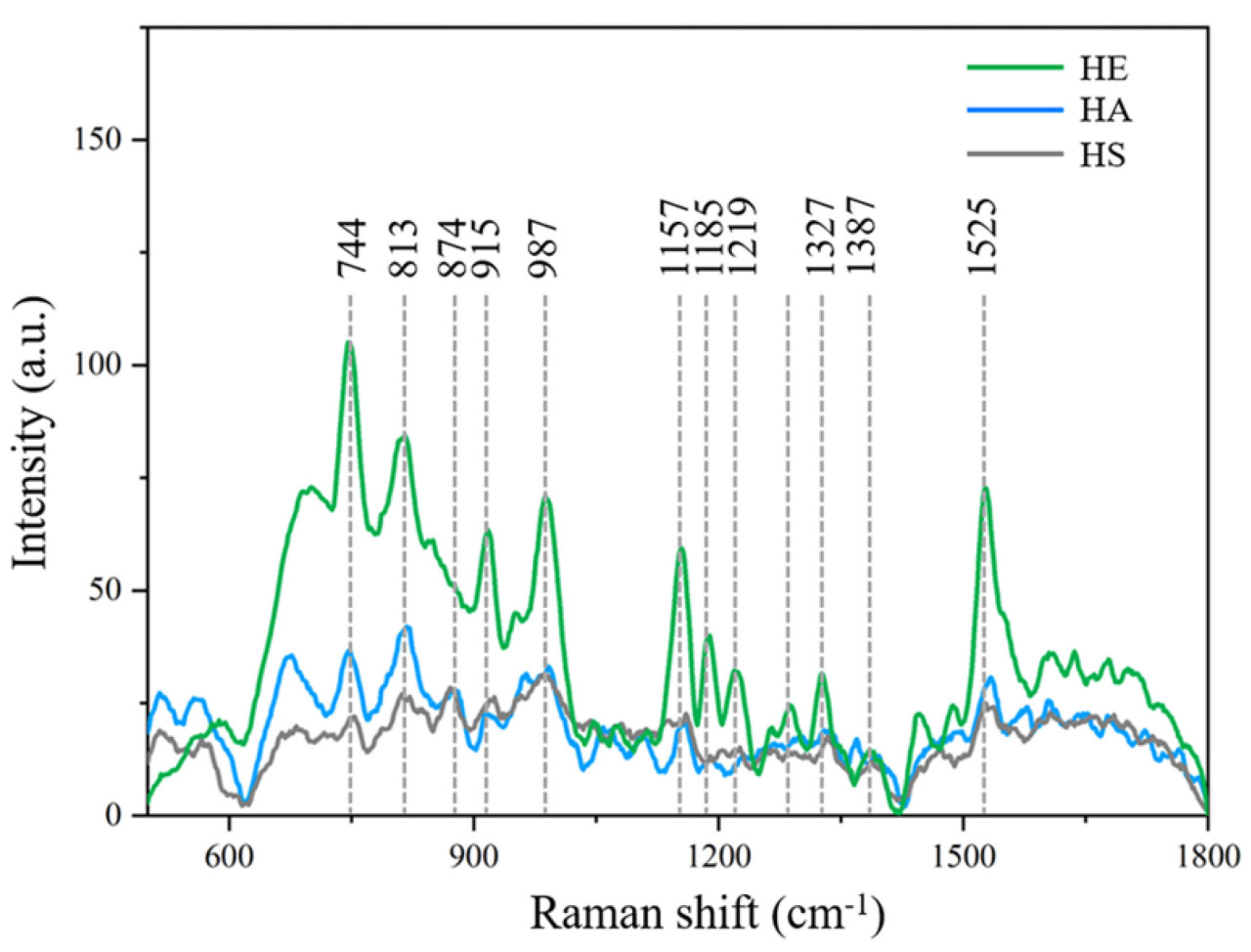
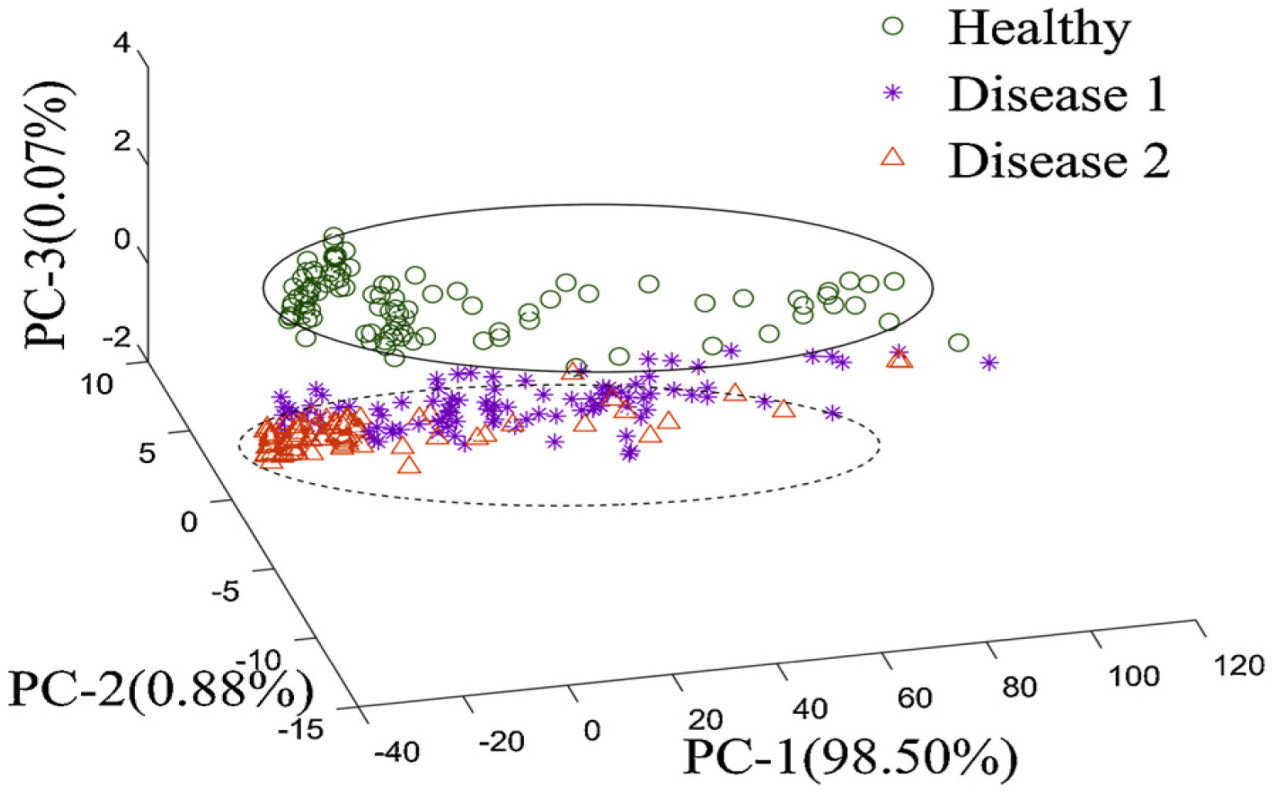
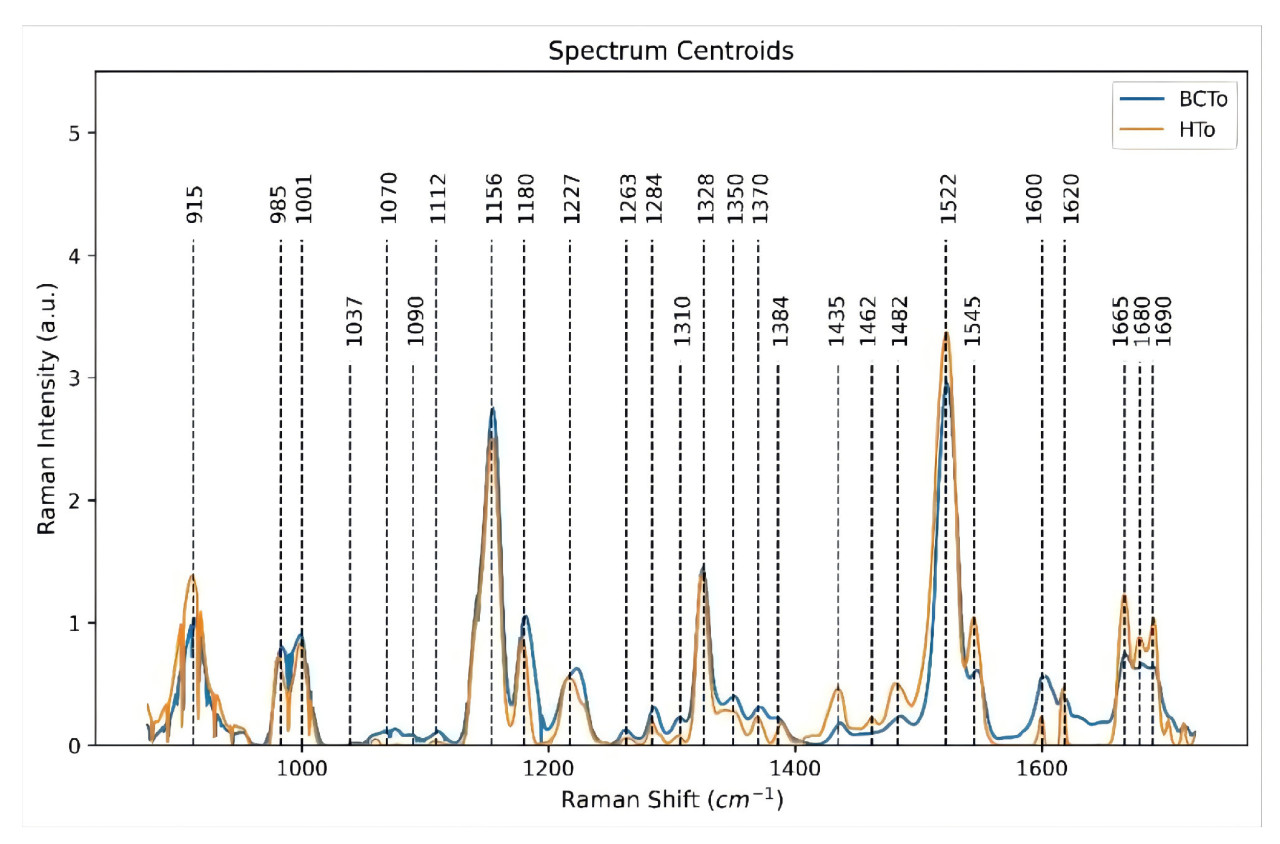
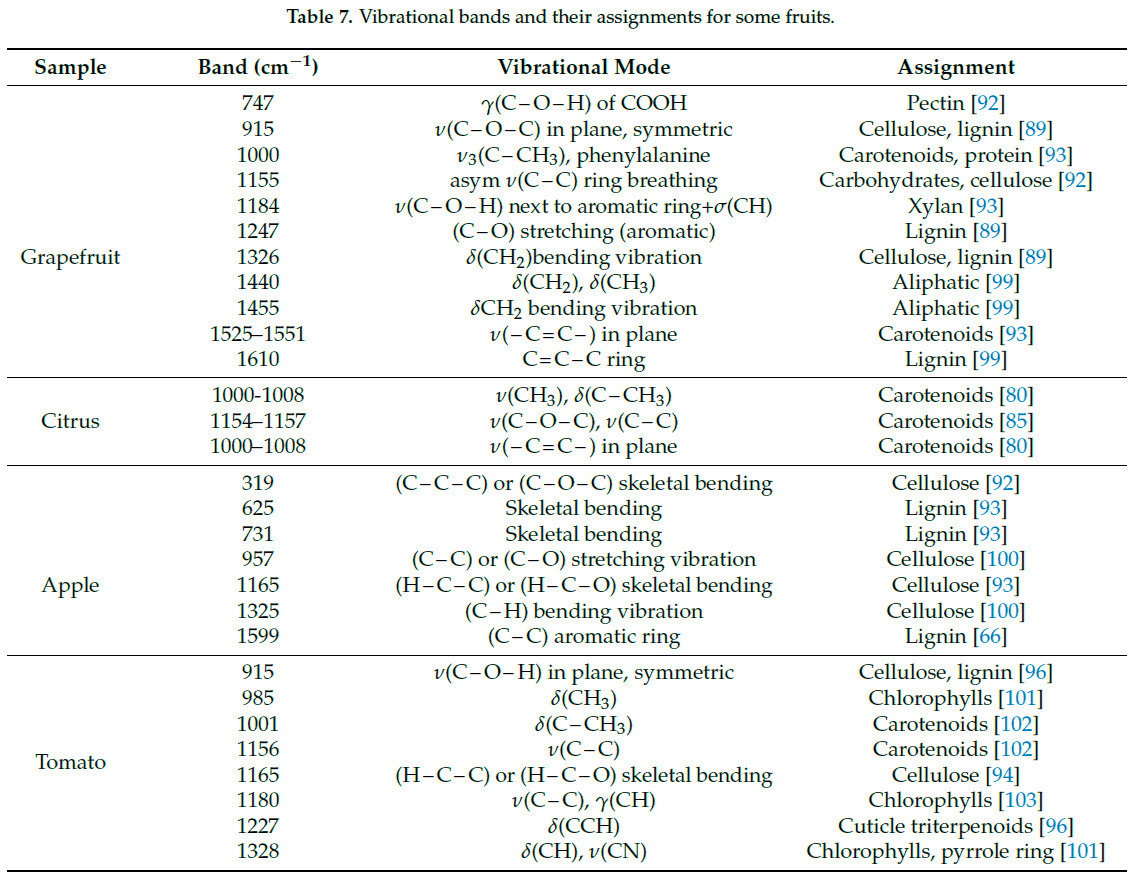

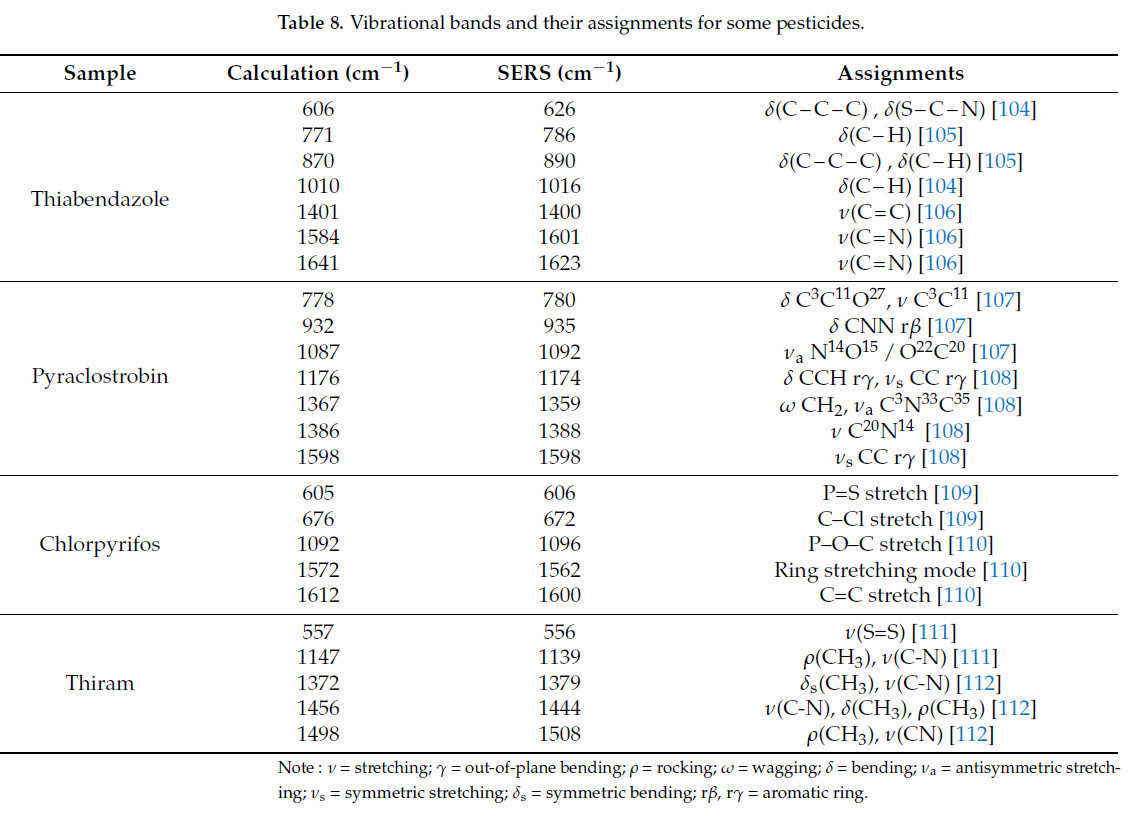
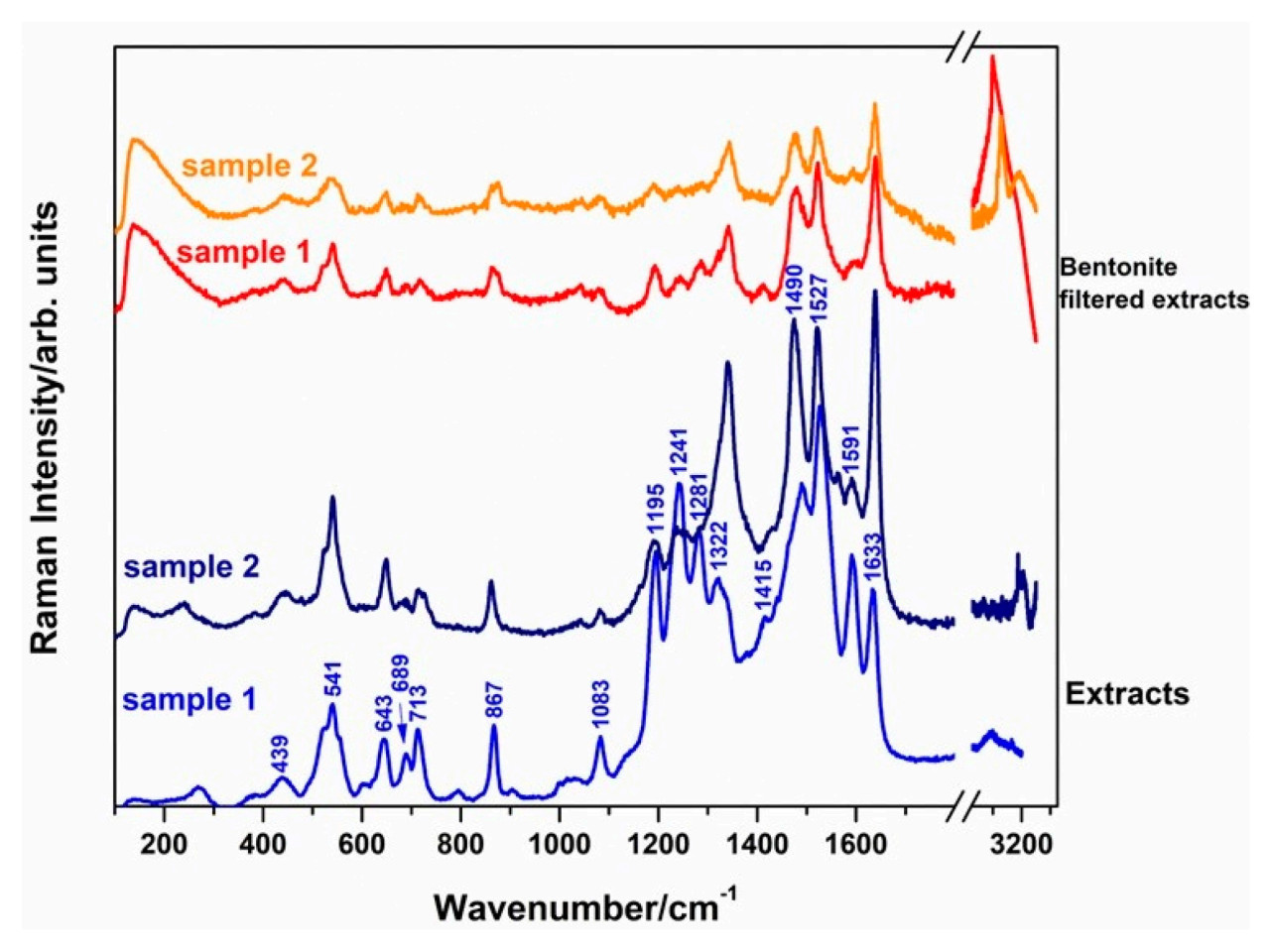
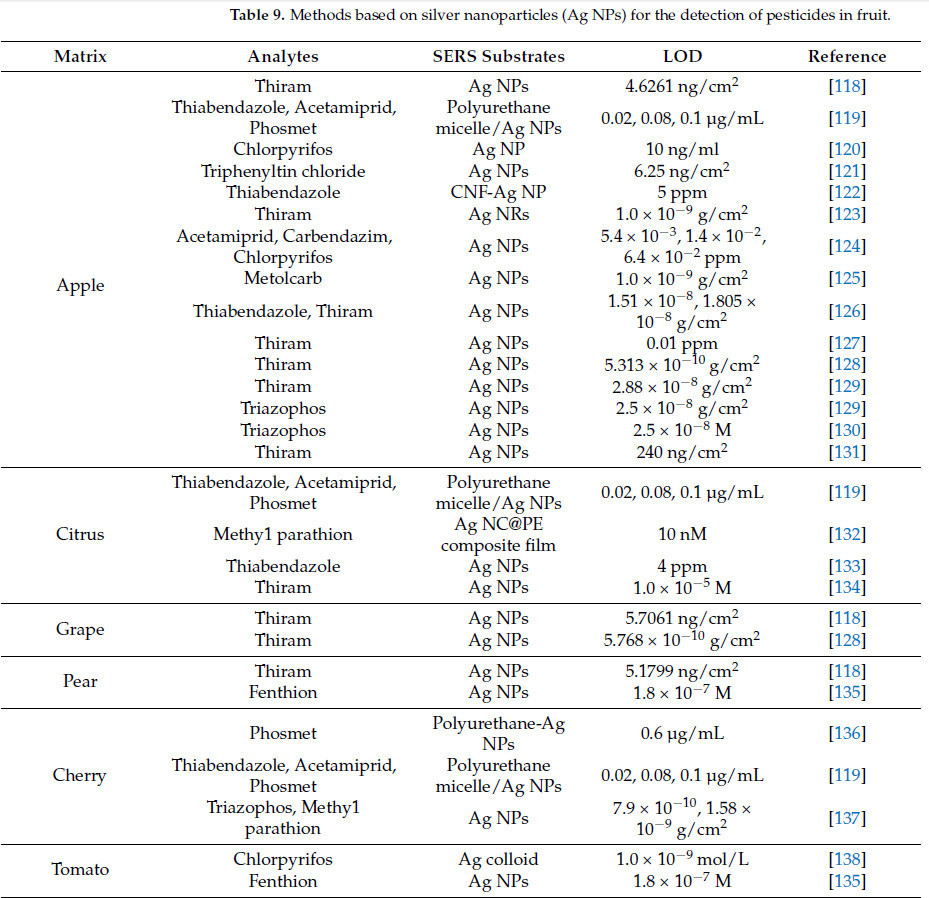
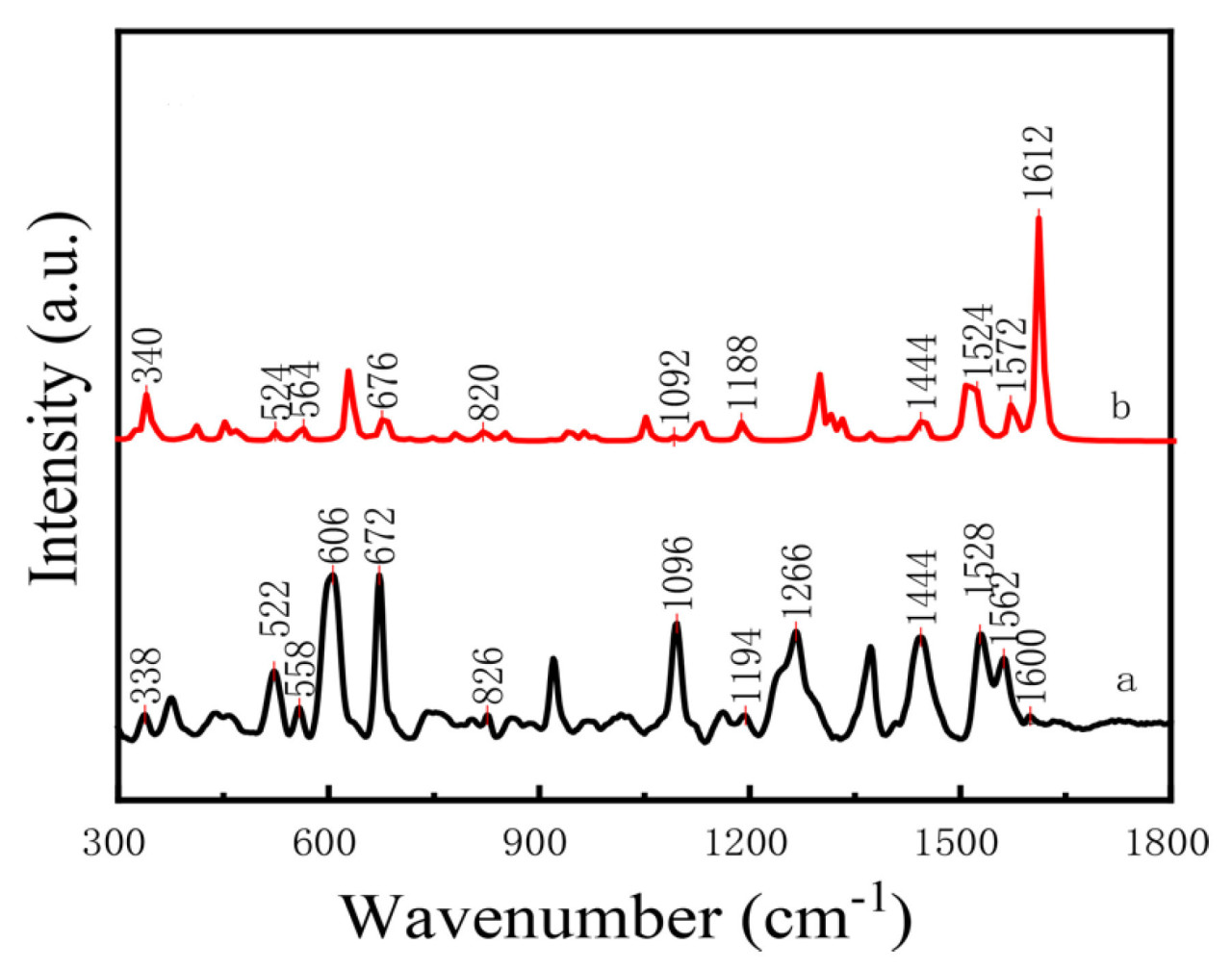
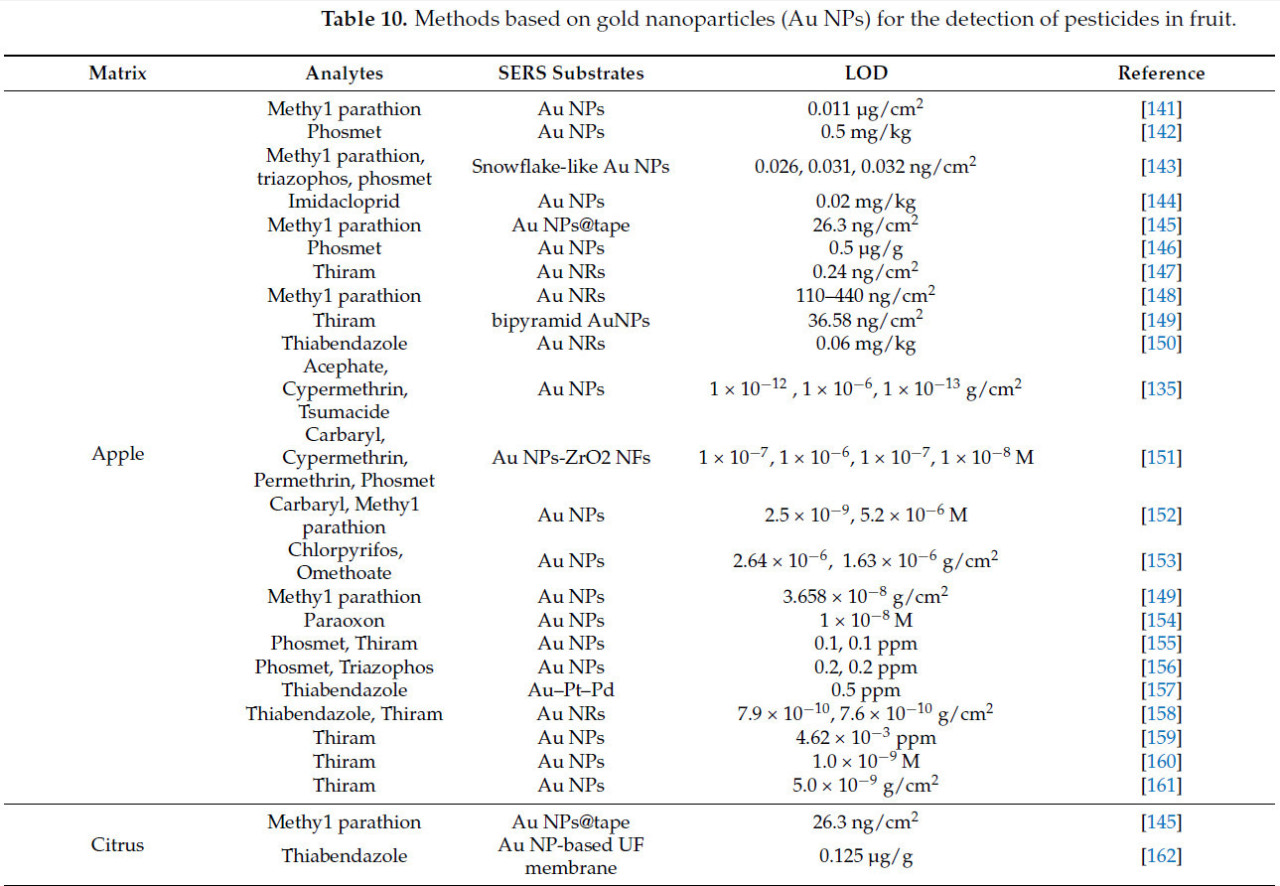
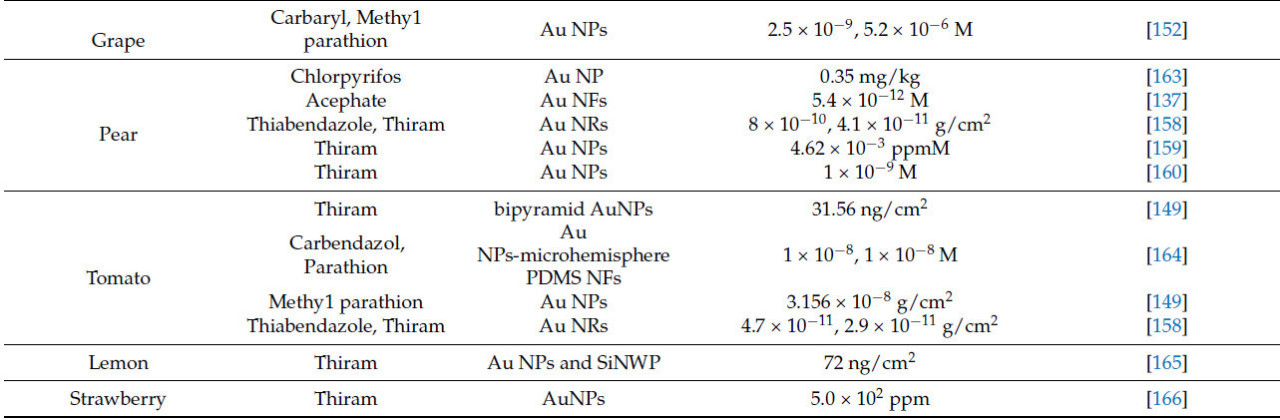
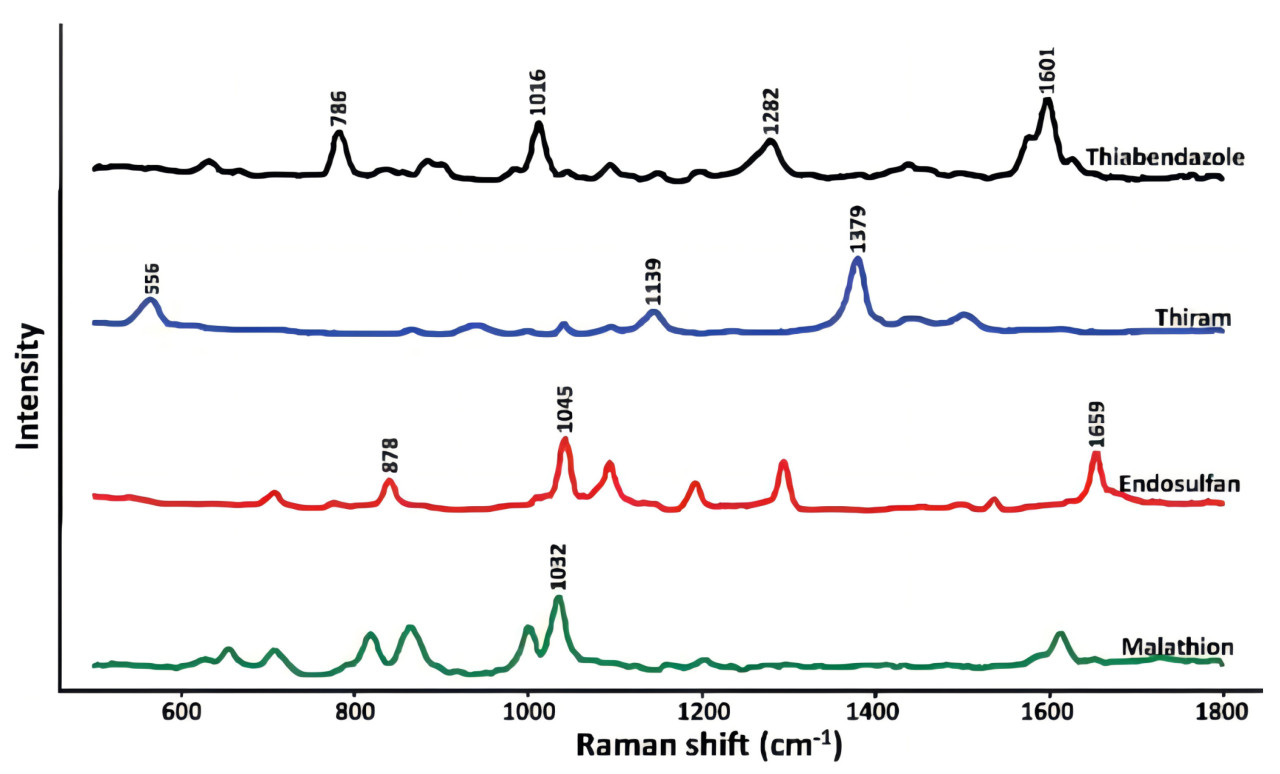
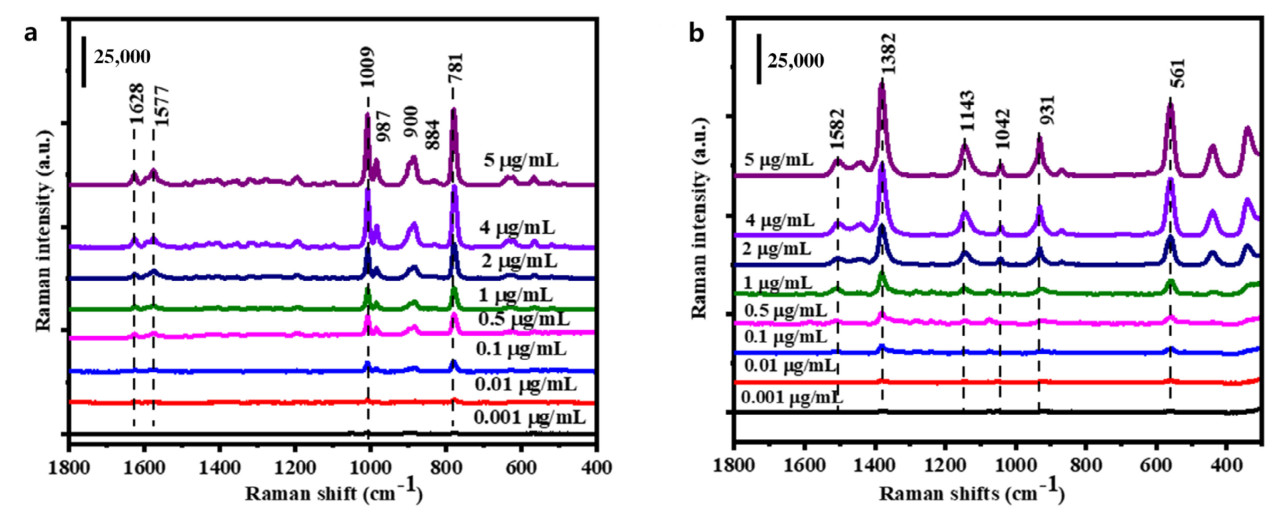
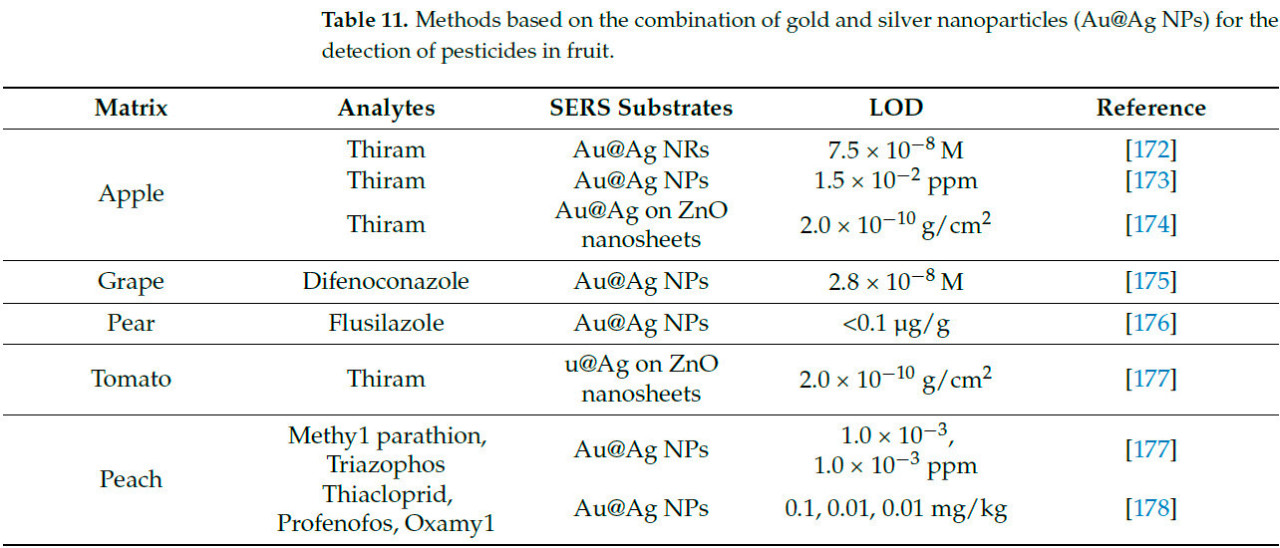






























































































Комментарии (0)