Адаптивность растений к улучшенному донному осадку
Традиционные методы утилизации донного ила характеризуются низкой степенью утилизации ресурсов и высокими выбросами углерода, что приводит к серьезному загрязнению окружающей среды.
Аннотация
Адаптивность растений к улучшенной почве была всесторонне оценена с использованием таких факторов, как индекс всхожести семян (GI). Содержание щелочного азота в улучшенной почве увеличилось на 78,61% по сравнению с донным илом, а содержание других питательных веществ, таких как доступный калий, также возросло в разной степени. Индекс всхожести семян райграса увеличился на 51,06% в улучшенной почве (IS1) по сравнению с донным илом. Основными доминирующими грибами в улучшенной почве (IS1) были Tausonia, Trichoderma (Триходерма) и Cystoflobasidium, которые способствуют активации питательных веществ в почве и антагонизируют патогенные бактерии, делая среду более благоприятной для роста растений. Донный ил был успешно преобразован в почву, пригодную для посадок. Полное использование азота, фосфора и других веществ, содержащихся в донном иле, для обеспечения питательными веществами роста растений является эффективным методом достижения утилизации донного ила в качестве ресурса.
1.Введение
Донный ил обычно рассматривается как отход. Традиционные методы утилизации донного ила из внутренних рек включают сброс в море и размещение на суше [1]. Размещение на суше предполагает использование специальных участков в качестве накопительных площадок и строительство дамб, позволяющих размещать донный ил в качестве насыпного материала. Этот традиционный метод утилизации сталкивается с многочисленными проблемами, наиболее значительной из которых является его бессистемный характер, характеризующийся низкими коэффициентами использования ресурсов, значительными выбросами углерода и серьезным загрязнением окружающей среды [2].
Методы утилизации донного ила как ресурса включают использование в строительстве, для обратной засыпки и для землепользования. Донный ил, используемый в качестве строительного и насыпного материала, имеет высокое содержание воды и пористость, что затрудняет его прямое использование и требует предварительного обезвоживания [3]. Использование щелочно-активированного порошка из переработанного бетона для стабилизации ила уменьшает выщелачивание общих тяжелых металлов кадмия (Cd) и хрома (Cr) на 48,1–66,3% и 68,8–77,5% соответственно [4]. Несмотря на усилия по стабилизации, сохраняются опасения относительно деградации стабилизирующих агентов и потенциальной ремобилизации тяжелых металлов. Донный ил преимущественно состоит из неорганических минералов, включая силикаты со значительным содержанием SiO₂ и Al₂O₃ [5], и близок по составу к наземным почвам и глинистым матрицам. Этот состав способствует формированию гранулярной структуры, удержанию микроэлементов и сохранению питательных веществ, что делает его ценным биологическим ресурсом.
Землеприменение представляет собой эффективный путь рекуперации питательных веществ, а снижение токсичности достижимо с помощью протоколов компостирования или выщелачивания [6]. Однако эти методы remediation демонстрируют ограниченную эффективность в полном удалении стойких органических загрязнителей и тяжелых металлов. Экспериментальные исследования с пшеницей указывают, что контролируемое внесение ила значительно усиливает все вегетативные и связанные с урожайностью параметры. Тем не менее, по мере увеличения нормы внесения пивоваренного ила тяжелые металлы, включая общий цинк (Zn) и общую медь (Cu), показали повышенную биоаккумуляцию в тканях растений [7]. Прямое использование донного ила в сельскохозяйственном производстве может привести к попаданию металлов в пищевую цепь и причинить вред человеку [8]. Превращение донного ила в почву для посадок до его использования не только предотвращает экологические риски, но и позволяет эффективно использовать обогащенные в нем питательные вещества (азот, фосфор и другие) для роста растений, что является действенным методом достижения утилизации донного ила как ресурса.
Проведя физико-химический анализ субстратов, данное исследование использовало донный ил, компостированный свиной навоз (КСН) и опилки в качестве сырья для приготовления почвы для посадок путем добавления биологических препаратов для улучшения в соответствии с установленными стандартами [9]. Для улучшенных почв с разными пропорциями индекс всхожести семян (GI) был использован для комплексной оценки их потенциального токсического воздействия на растения. Микробное разнообразие в донном иле до и после улучшения было проанализировано для изучения адаптивности растений к улучшенной почве, обеспечивая техническую поддержку для преобразования донного ила в почву для посадок.
2. Материалы и методы
2.1. Материалы и приборы
2.1.1. Испытательные материалы
Семена пак-чой (Brassica chinensis L.) были приобретены у China Guangdong Xingyan Seed Co., Ltd. (Гуанчжоу, Китай), а семена райграса (Lolium perenne L.) и бермудской травы (Cynodon dactylon L. Pers.) были приобретены на рынке цветов Чанша Красная Звезда (Чанша, Китай). Донный ил и верхний слой почвы под эвкалиптом (0–20 см, местная почва), использованные для приготовления улучшенной почвы, были отобраны из проекта Пинлунского канала в городе Хэнчжоу, город Наньнин, Гуанси-Чжуанский автономный район. КСН был приготовлен в лабораторных условиях путем контролируемого разложения сырого свиного навоза, смешанного с опилками, суперфосфатом и микробными инокулянтами от China Hunan Aojun Technology Co., Ltd. (Чанша, Китай). Композитный биологический агент (КБА) был изготовлен путем смешивания двух биологических агентов, Trichoderma harzianum AJ-11 и Bacillus velez AJ-14, в соотношении 1:1 (по массе), оба были приобретены у Hunan Aojun Technology Co., Ltd.
Реагенты, использованные в эксперименте, такие как концентрированная серная кислота (H₂SO₄), соляная кислота (HCl), хлорид калия (KCl), хлорид кальция (CaCl₂), дихромат калия (K₂Cr₂O₇), гидроксид натрия (NaOH), антимонил-тартрат калия (KSbC₄H₄O₇·½H₂O), молибдат аммония ((NH₄)₆Mo₇O₂₄·4H₂O), дигидрофосфат калия (KH₂PO₄), безводный этанол (C₂H₅OH) и аскорбиновая кислота (C₆H₈O₆), были высокой степени чистоты и приобретены у Sinopharm Chemical Reagent Co., Ltd. (Шанхай, Китай).
2.1.2. Испытательные приборы и оборудование
Биохимический инкубатор (SPX-250B) был приобретен у Shanghai Lichen Instrument Technology Co., Ltd. (Шанхай, Китай). Электронные аналитические весы (AUY120) и УФ-видимый спектрофотометр (UV-2600) были приобретены у Shimadzu Testing Equipment Co., Ltd. (Шанхай, Китай). pH-метр (PHSJ-3F) и кондуктометр (LC-DDB-1A) были приобретены у Ray-Magnetic Co., Ltd. (Дунгуань, Китай). Атомно-эмиссионный спектрометр с индуктивно-связанной плазмой (5110 ICP-OES) был приобретен у Agilent Technologies Co., Ltd. (Шанхай, Китай). Масс-спектрометр с индуктивно-связанной плазмой (ICP-MS NexlON 1000G) был приобретен у PerkinElmer Instrument Co., Ltd. (Сучжоу, Китай).
2.2. План эксперимента
2.2.1. Приготовление улучшенной почвы
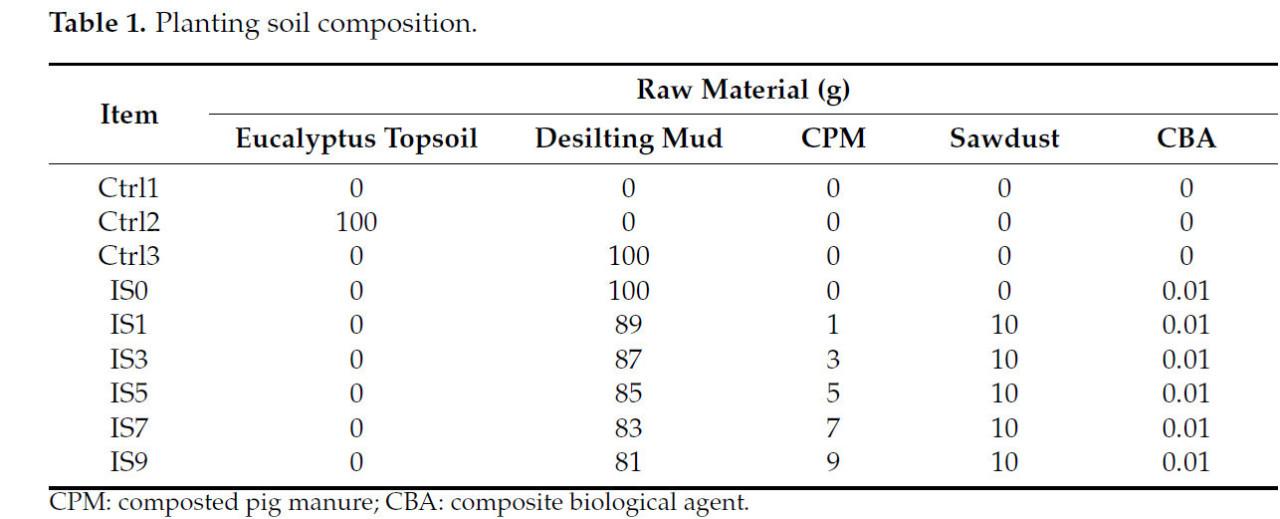
Верхний слой почвы под эвкалиптом, донный ил и КСН были высушены естественным образом в прохладной и сухой среде, размолоты через нейлоновое сито с размером пор 2 мм и дополнительно размолоты через нейлоновое сито с размером пор 0,149 мм для получения сырья для приготовления улучшенной почвы. В данном исследовании под почвой для посадок подразумевается улучшенная почва, донный ил и верхний слой почвы под эвкалиптом, а M обозначает общую сырую массу почвы для посадок.
Используя различные соотношения смеси материалов (Таблица 1), были созданы девять групп образцов — Ctrl1 (деионизированная вода), Ctrl2 (верхний слой почвы под эвкалиптом), Ctrl3 (донный ил), IS0 (улучшенная почва с 0% M КСН), IS1, IS3, IS5, IS7 и IS9 — для проверки всхожести семян пак-чой. Было три контрольные группы (Ctrl1, Ctr2 и Ctrl3) и шесть тестовых групп (IS0–IS9, содержащих 0%, 1%, 3%, 5%, 7% и 9% M КСН соответственно). Каждая экспериментальная группа была дополнена 0,01% M КБА.
Таблица 1. Состав почвы для посадок.
2.2.2. Тест на всхожесть семян
Для приготовления культуральной среды 2,5 г почвы для посадок смешивали с 25 мл деионизированной воды и помещали в центрифужную пробирку на 50 мл. Пробирку помещали в термостатируемый шейкер, установленный на 298,15 K и 180 об/мин, встряхивали в течение 30 минут и давали отстояться 10 минут перед фильтрацией супернатанта с использованием среднескоростной количественной фильтровальной бумаги. Этот фильтрат и был требуемой для исследования культуральной средой.
Для культивирования 5 мл культурального раствора пипетировали в сухую, стерильную чашку Петри диаметром 9 см с двумя слоями фильтровальной бумаги на дне, следя за тем, чтобы фильтровальная бумага была полностью пропитана культуральным раствором и пузырьки воздуха отсутствовали. Пятьдесят семян равномерного размера и наполненности отбирали и равномерно размещали в чашке Петри, обеспечивая их нахождение в культуральном растворе и прикрепление к фильтровальной бумаге, чтобы избежать всплытия. Чашку Петри накрывали пластиковой пленкой с двумя-тремя равномерными отверстиями для воздуха и аккуратно помещали в инкубатор при 303,15 K. Для каждой группы обработки было установлено по три биологических повторности.
После двух дней инкубации неразрушающим методом измеряли длину корня семени с помощью штангенциркуля. Значения показателей рассчитывали согласно ранее выведенным уравнениям [10], используя деионизированную воду (Ctrl1) в качестве контрольной группы:
2.3. Аналитические методы
Cd, Cu, свинец (Pb), Zn, ртуть (Hg) и Cr измеряли с помощью масс-спектрометрии с индуктивно-связанной плазмой и микроволновой пробоподготовкой [11]. Содержание общего мышьяка (As) измеряли с помощью атомно-флуоресцентной спектрометрии (AFS) [12]. pH и электропроводность (EC) измеряли с помощью pH-метра и кондуктометра при соотношении почва:вода 1:5 (по массе) соответственно. Объемную плотность (ρ) измеряли методом режущего кольца. Общий азот (TN) измеряли с помощью анализатора Кьельдаля, общий фосфор (TP) — с помощью спектрофотометра, а общий калий (TK) — с помощью атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой. Азот щелочной гидролиза (AN) определяли методом щелочной диффузии. Доступный калий (AK) измеряли с помощью пламенной фотометрии. Доступный фосфор (AP) измеряли молибдено-сурьмяным колориметрическим методом. Доступное железо (AFe), эффективный кальций (ECa), эффективный магний (EMg) и экстрагируемый марганец (EMn) измеряли с помощью атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой [13].
2.4. Определение биоразнообразия
Образцы были отобраны из Ctrl2, Ctrl3 и IS1 в пяти точках (IS1 была выбрана в соответствии с результатами теста на всхожесть семян [Раздел 2.3]). Геномную ДНК экстрагировали из образцов с использованием набора E.Z.N.A.® soil DNA Kit (Omega Bio-tek, Норкросс, Джорджия, США). Чистоту и концентрацию ДНК измеряли на спектрофотометре NanoDrop2000 (Thermo Scientific, Уолтем, Массачусетс, США), а целостность определяли с помощью электрофореза в агарозном геле (1,0%). Гипервариабельный участок V3–V4 гена бактериальной 16S рРНК амплифицировали с использованием праймеров 338F (5′-ACTCCTACGGGAGGCAGCAG-3′) и 806R (5′-GGACTACHVGGGTWTCTAAT-3′) на ПЦР-системе (GeneAmp 9700, ABI, Фостер-Сити, Калифорния, США). Формальное ПЦР-тестирование проводили с использованием системы TransGen AP221-02: TransStart Fastpfu DNA polymerase в реакционной смеси объемом 20 мкл. Секвенирование было выполнено на платформе Illumina Miseq PE300 (Shanghai Meiji Biomedical Technology Co., Ltd., Шанхай, Китай) [14].
2.5. Анализ данных
Все данные в данном исследовании были статистически обработаны с помощью Microsoft Excel 2016 и построены в Origin 2022 (Origin Lab, Нортгемптон, Массачусетс, США). IBM SPSS Statistics 26 был использован для анализа стандартного отклонения и значимости различных показателей (p < 0,05).
3. Результаты и обсуждение
3.1. Анализ содержания тяжелых металлов
Избыточное содержание тяжелых металлов снижает обилие и разнообразие почвенных микроорганизмов. Тяжелые металлы также легко накапливаются в растениях, особенно в сельскохозяйственных культурах, угрожая росту растений и продовольственной безопасности. Анализ тяжелых металлов в почве для посадок показан на Рисунке 1:
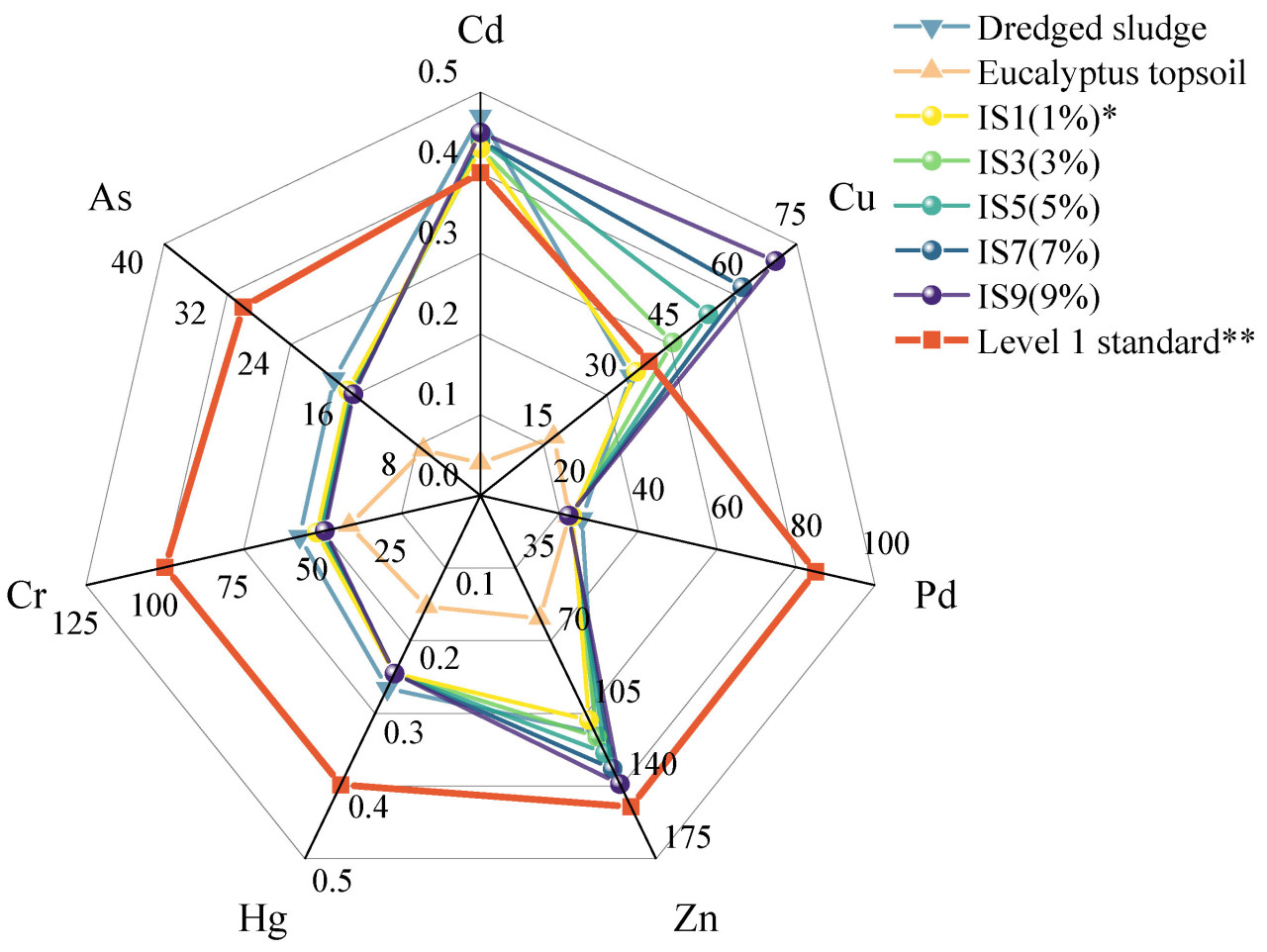
Рисунок 1. Содержание тяжёлых металлов в искусственной почве. * В зависимости от количества внесённого КПМ: 1% — содержание КПМ в соответствующей посадочной почве. ** Из насаждения: посадочная почва для озеленения [9]. Содержание каждого тяжёлого металла выражено в мг·кг⁻¹.
Содержание тяжелых металлов в верхнем слое почвы под эвкалиптом было значительно ниже стандарта первого сорта для почвы для посадок (Рисунок 1). Уровни большинства тяжелых металлов в донном иле и улучшенной почве также были ниже. Общее содержание кадмия в почве было выше стандарта первого сорта (0,4 мг·кг⁻¹), как и общее содержание меди в улучшенной почве (40 мг·кг⁻¹). Это может быть связано с применением пестицидов и сбросом в притоки реки Юйцзян (район водохранилища Сицзинь) сточных вод животноводческих хозяйств, содержащих кадмий, медь и другие тяжелые металлы. Эти металлы обогащались в донном иле, что делало содержание тяжелых металлов в улучшенной почве и донном иле выше, чем в верхнем слое почвы под эвкалиптом.
Растения поглощают металлы из почвы и затем транспортируют их по своей системе. Содержание тяжелых металлов в корнях растений является самым высоким по сравнению с другими частями растения, так как после накопления тяжелых металлов корни препятствуют их миграции. При стрессе, вызванном накопленными тяжелыми металлами, эффективность поглощения питательных веществ корнями нарушается, разрушается антиоксидантная система и затрагивается рост и развитие растений [15]. Тяжелые металлы могут попадать в организм человека при употреблении в пищу растений, которые их биоаккумулировали, причиняя вред здоровью человека [16].
Уровни общего кадмия и меди в улучшенной почве и донном иле были ниже соответствующих стандартов второго сорта (общий кадмий < 0,6 мг·кг⁻¹, общая медь < 150 мг·кг⁻¹). В целом, уровни тяжелых металлов в улучшенной почве, верхнем слое почвы под эвкалиптом и донном иле были относительно низкими и не должны были вызывать загрязнения окружающей среды тяжелыми металлами.
3.2. Основные контрольные показатели и питательный состав
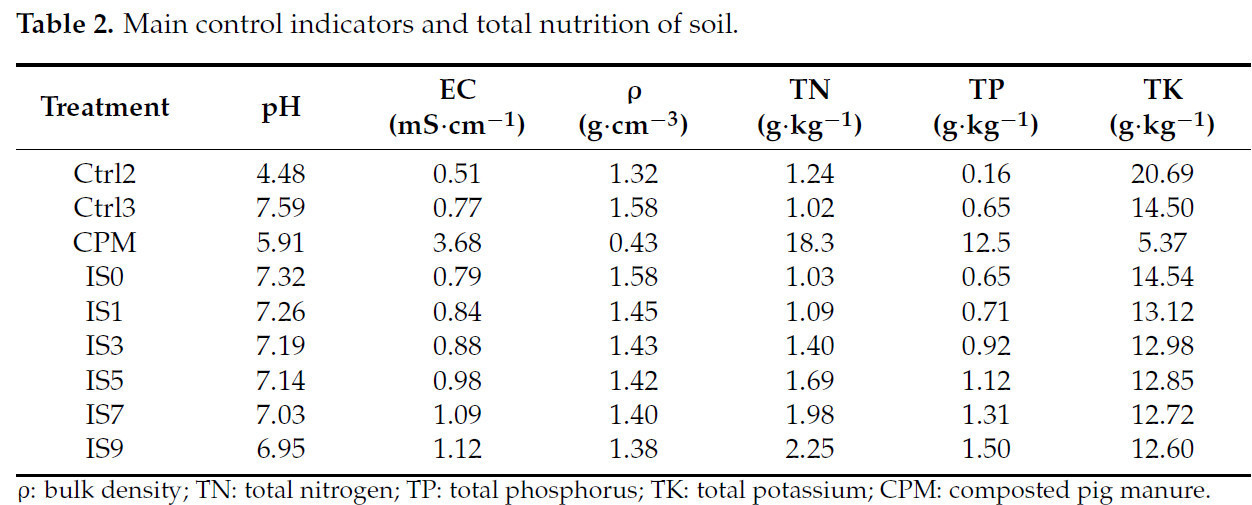
Основные контрольные показатели почвы включают pH, EC и объемную плотность (Таблица 2). Ctrl2 имеет красный цвет, вызванный богатым содержанием соединений железа и алюминия. В Наньнине субтропический муссонный климат с обильными осадками. Это приводит к вымыванию многих соединений из почвы, включая большинство щелочных и щелочноземельных металлов, оставляя нерастворимые оксиды железа и алюминия, которые придают кислую красную окраску.
Таблица 2. Основные контрольные показатели и общая питательность почвы.
Из-за добавления суперфосфата и опилок в процессе разложения КСН имел кислую реакцию и низкую объемную плотность, что alleviating проблему уплотнения почвы, вызванную большой объемной плотностью донного ила (Таблица 2). В определенном диапазоне значение EC может указывать на концентрацию растворимых солей в почве [17,18]. Ctrl2 имел самое низкое значение EC, указывая на недостаток элементов питания в этом типе почвы. Это согласуется с Таблицей 3, которая наглядно показывает, что Ctrl2 был беден доступными питательными веществами, за исключением эффективного железа.
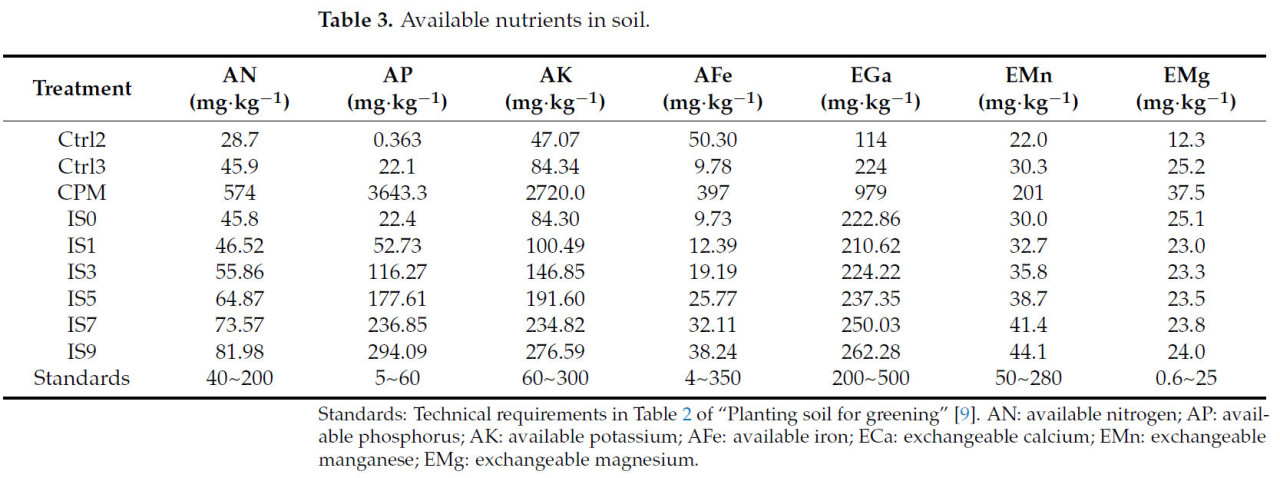
Таблица 3. Доступные питательные вещества в почве.
Содержание общего азота, фосфора и калия в почве отражает ее потенциальное плодородие. Общий азот и фосфор в улучшенной IS1 показали почти нет изменений по сравнению с Ctrl3, так как добавленные опилки имели низкое содержание N и P. Из-за этого эффект небольшого количества добавленного КСН (1% M) был разбавлен. Когда количество добавляемого КСН постепенно увеличивалось, общий азот и фосфор в DN2–IS9 увеличивались значительно по сравнению с Ctrl3.
Эффективные питательные вещества могут напрямую поглощаться растениями из почвы и использоваться для роста и развития растений [19]. Хотя Ctrl2 имел высокое содержание общего азота и калия, у него было низкое содержание азота щелочной гидролиза (эффективный азот) и доступного калия, что указывает на то, что большая часть азота и калия не была биологически доступной. Дополнительно, большинство его эффективных элементов, включая азот щелочной гидролиза и эффективный фосфор, не соответствовали стандартам (Таблица 3). Большинство показателей Ctrl3 (донный ил) соответствовали стандартам, но его эффективный магний был низким. После улучшения общий азот в IS1–IS9 увеличился значительно на 6,8%, 37,3%, 65,7%, 94,1% и 120,6% соответственно по сравнению с исходным донным илом. Соответствующее содержание эффективного питательного вещества — азота щелочной гидролиза — увеличилось на 1,4%, 21,7%, 41,3%, 60,3% и 78,6% соответственно. Содержание эффективного фосфора в IS1, которая содержала наименьшее количество КСН, увеличилось на 138,6% по сравнению с донным илом. По сравнению с донным илом, эффективный магний в IS1–IS9 увеличился на 7,8%, 18,3%, 27,7%, 36,6% и 45,6% соответственно. Хотя все еще ниже стандартов, содержание питательных веществ в донном иле было улучшено за счет модификации.
В целом, объемная плотность улучшенной почвы с добавлением КСН была значительно снижена по сравнению с донным илом, и большинство эффективных питательных веществ, включая азот щелочной гидролиза, а также эффективные фосфор, калий и магний, были увеличены. По сравнению с донным илом и верхним слоем почвы под эвкалиптом, улучшенная почва была более пригодна для прорастания и роста растений.
3.3. Анализ всхожести семян
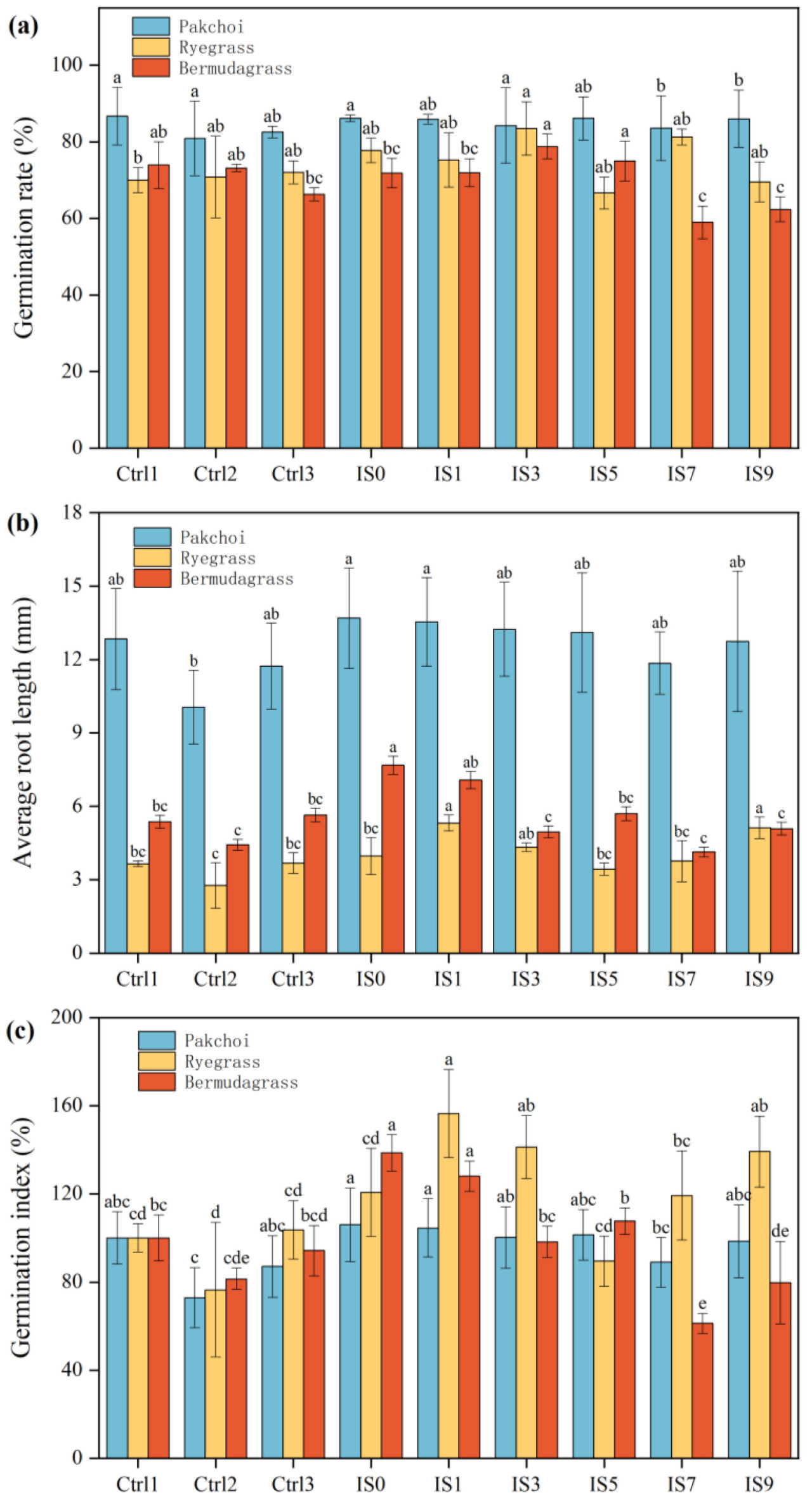
GI является важным показателем для оценки зрелости компоста и также отражает токсичность почвы [20]. В данном исследовании GI рассчитывали из скорости прорастания семян и средней длины корня. Как показано на Рисунке 2, скорость прорастания и средняя длина корня разных семян различались в данном исследовании. Скорость прорастания, средняя длина корня и индексы всхожести семян пак-чой в экспериментальных группах были выше, чем в Ctrl2 и Ctrl3. Группа IS0 была наиболее значительно улучшена по сравнению с Ctrl3: на 4,29%, 16,66% и 21,66% выше соответственно. Средние длины корня семян райграса в экспериментальных группах IS0, IS1, IS3 и IS9 были значительно выше, чем в Ctrl3. Индекс всхожести райграса IS1 был на 50,97% выше, чем у Ctrl3, что было наиболее значительным различием. В экспериментальных группах семян бермудской травы, по мере увеличения количества КСН, скорость прорастания сначала увеличивалась, а затем уменьшалась, а длина корня постепенно снижалась. По индексу всхожести, IS0 увеличилась наиболее значительно, за ней следовала IS1, на 47,18% и 35,85% выше, чем Ctrl3, соответственно. Улучшение скорости прорастания, средней длины корня и индекса всхожести в улучшенной почве может быть связано с такими факторами, как ферменты, полисахариды и гормоны роста растений, производимые микробным метаболизмом в добавленных биологических инокулянтах, которые могут способствовать прорастанию и росту [21].
Рисунок 2. Влияние разных почв для посадок на всхожесть семян. (a) Скорость прорастания. (b) Средняя длина корня. (c) Индекс всхожести. Разные буквы (a, b, c, d, e) над столбцами указывают на значимые различия между обработками (p < 0,05) на основе теста множественного диапазона Дункана.
Рассматривая прорастание трех типов семян, IS1 продемонстрировала наиболее значительный стимулирующий эффект на прорастание семян и развитие корней среди всех обработок, указывая на ее оптимальные характеристики в качестве среды для посадок. Основываясь на этих перспективных результатах, IS1 была выбрана для дальнейшего анализа биоразнообразия вместе с Ctrl2 и Ctrl3.
3.4. Анализ грибного разнообразия в почве для посадок
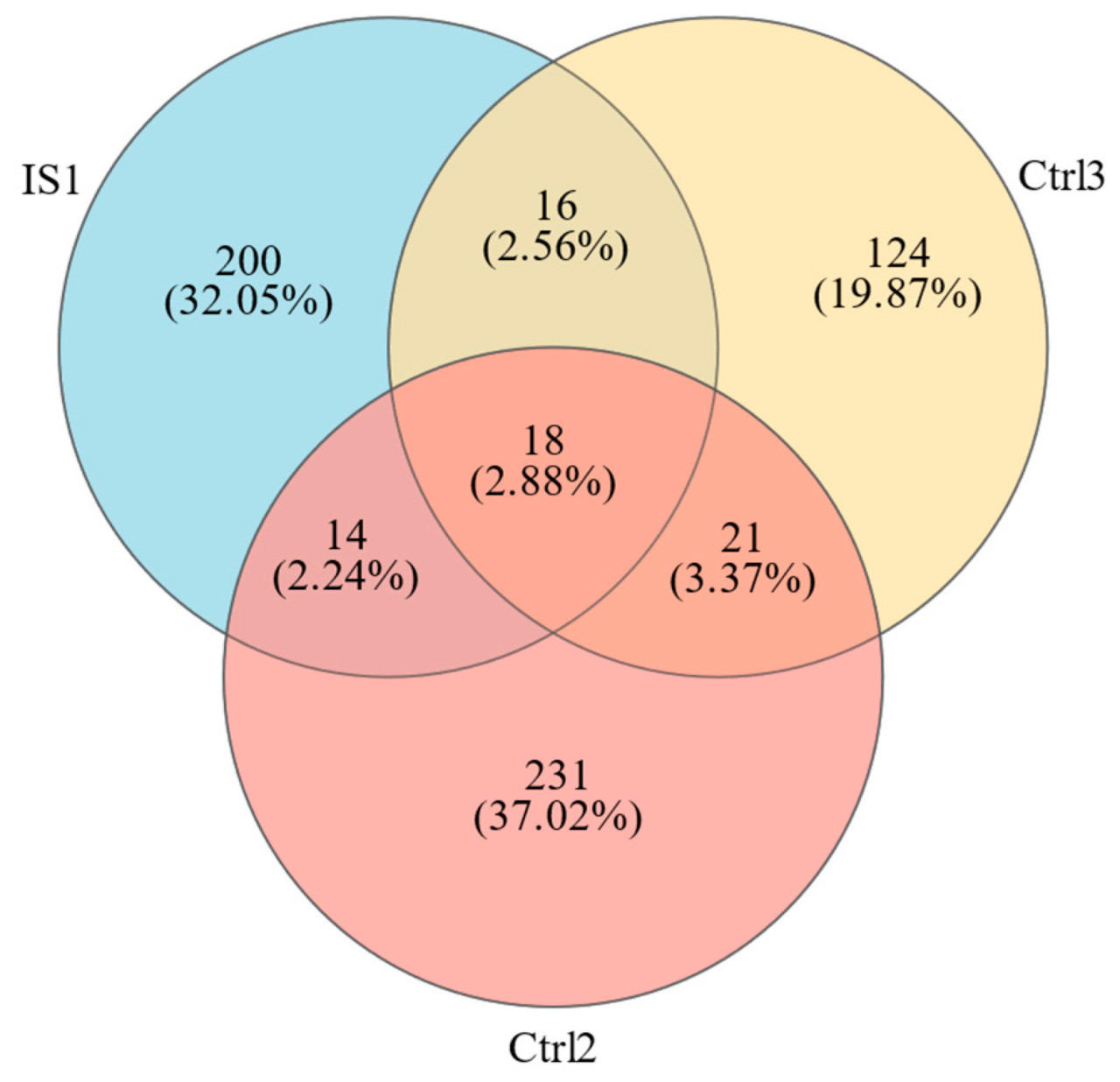
После анализа было получено 624 грибных операционных таксономических единиц (OTU) из трех почв для посадок. Ctrl2 (верхний слой почвы под эвкалиптом) имел наибольшее количество (284), в то время как IS1 (улучшенный донный ил) имела 248 OTU, что на 38,5% больше, чем 179 OTU в Ctrl3 (донный ил) (Рисунок 3). Количество OTU в трех почвах для посадок постепенно уменьшалось с увеличением pH, что схоже с результатами Shi [22]. После улучшения почвы количество грибных OTU значительно увеличилось, и грибное разнообразие возросло.
Рисунок 3. Диаграмма Венна распределения грибных OTU в почве для посадок.
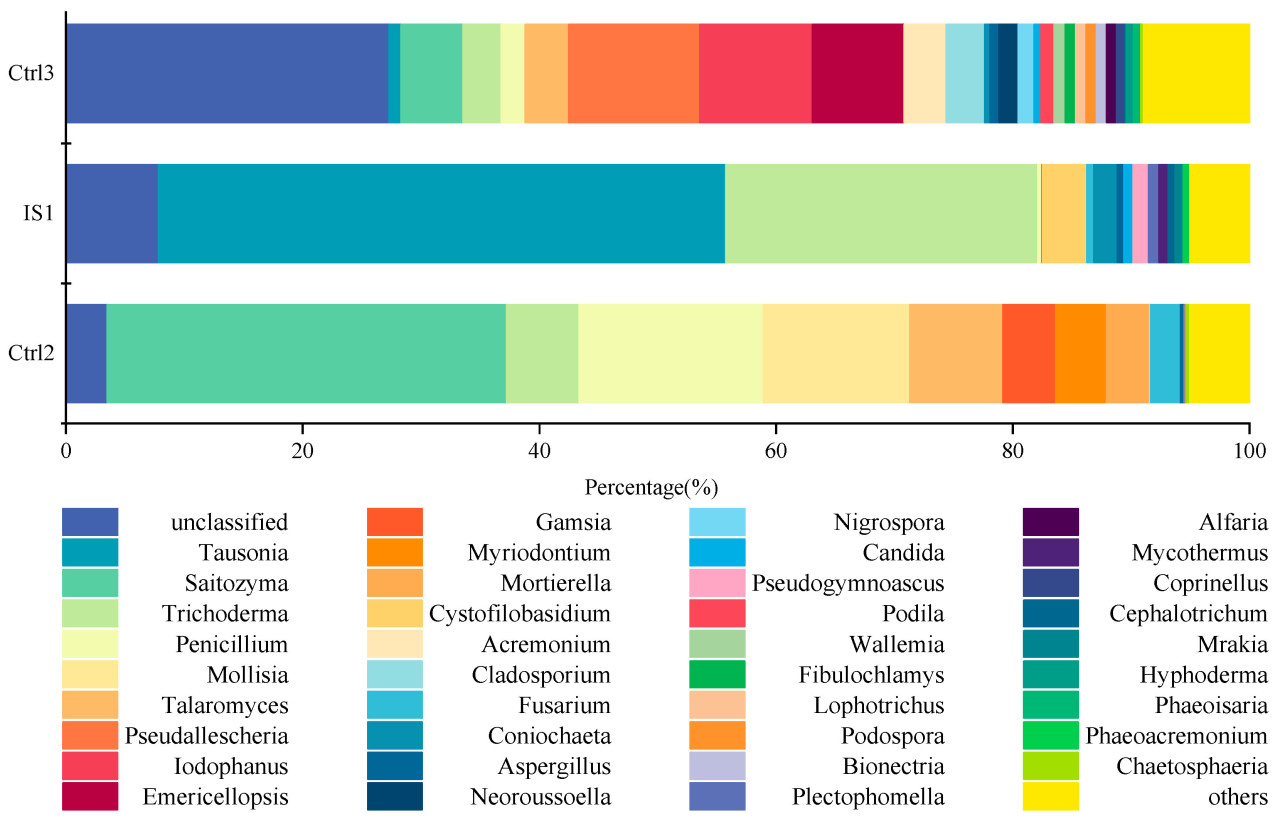
Чтобы дополнительно понять изменения в грибных сообществах почвы и видовом составе, был проведен анализ обилия сообщества на уровне рода для IS1, Ctrl2 и Ctrl3 (Рисунок 4). Топ-10 грибных родов по средней относительной обилия в IS1 были Tausonia, Trichoderma, Cystofilobasidium, Coniochaeta, Pseudogymnoascus, Plectophomella, Mycothermus, Candida, Mrakia и Cephalotrichum, составляя 47,68%, 26,22%, 3,67%, 1,97%, 1,32%, 0,87%, 0,76%, 0,76%, 0,67% и 0,58% от общей грибной обилия соответственно. Tausonia и Coniochaeta важны для разложения органического вещества почвы [23], синтезируя ключевые ферменты, которые разлагают целлюлозу и ускоряют разложение лигноцеллюлозы [24]. Это благоприятствует минерализации питательных веществ в почве и производству гумуса для улучшения структуры почвы.
Рисунок 4. Относительная abundance и состав грибного сообщества разных почв для посадок на уровне типа.
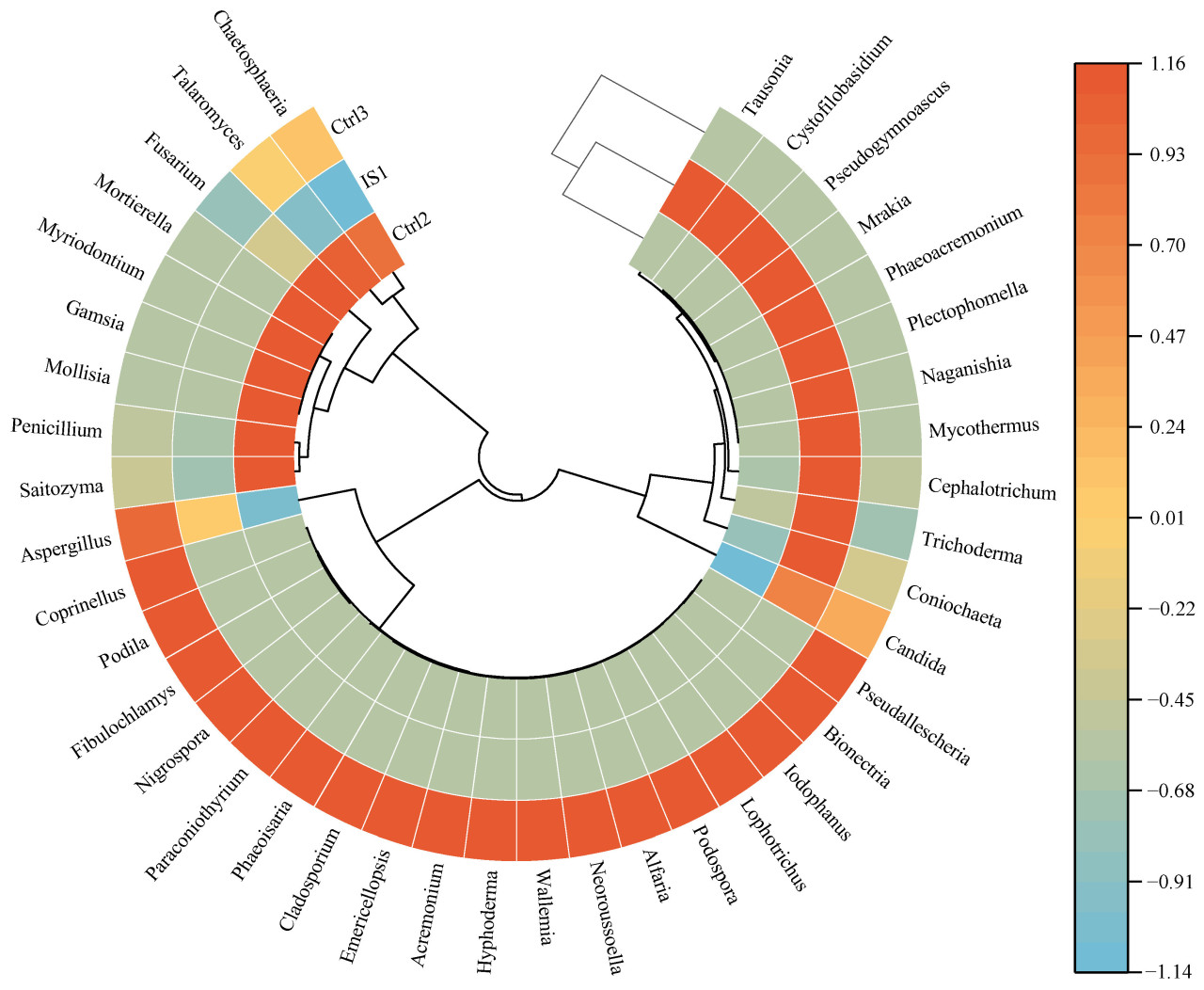
Чтобы дополнительно проанализировать корреляцию между грибными сообществами и почвой для посадок на уровне рода, характеристики грибных ассамблей были сравнены в различных обработках (Рисунок 5). Saitozyma проявляла высокую относительную обилие в обоих Ctrl2 и Ctrl3 (33,76% и 5,23% соответственно). Хотя она не вызывает напрямую патогенез растений, она значительно влияет на трансформацию питательных веществ в почве: сниженная ферментативная активность, связанная с Saitozyma, может приводить к уменьшению содержания биодоступных питательных веществ и снижению грибного разнообразия в почве [25]. В IS1 относительная обилие Saitozyma значительно снизилась по сравнению с контролями до 0,02%.
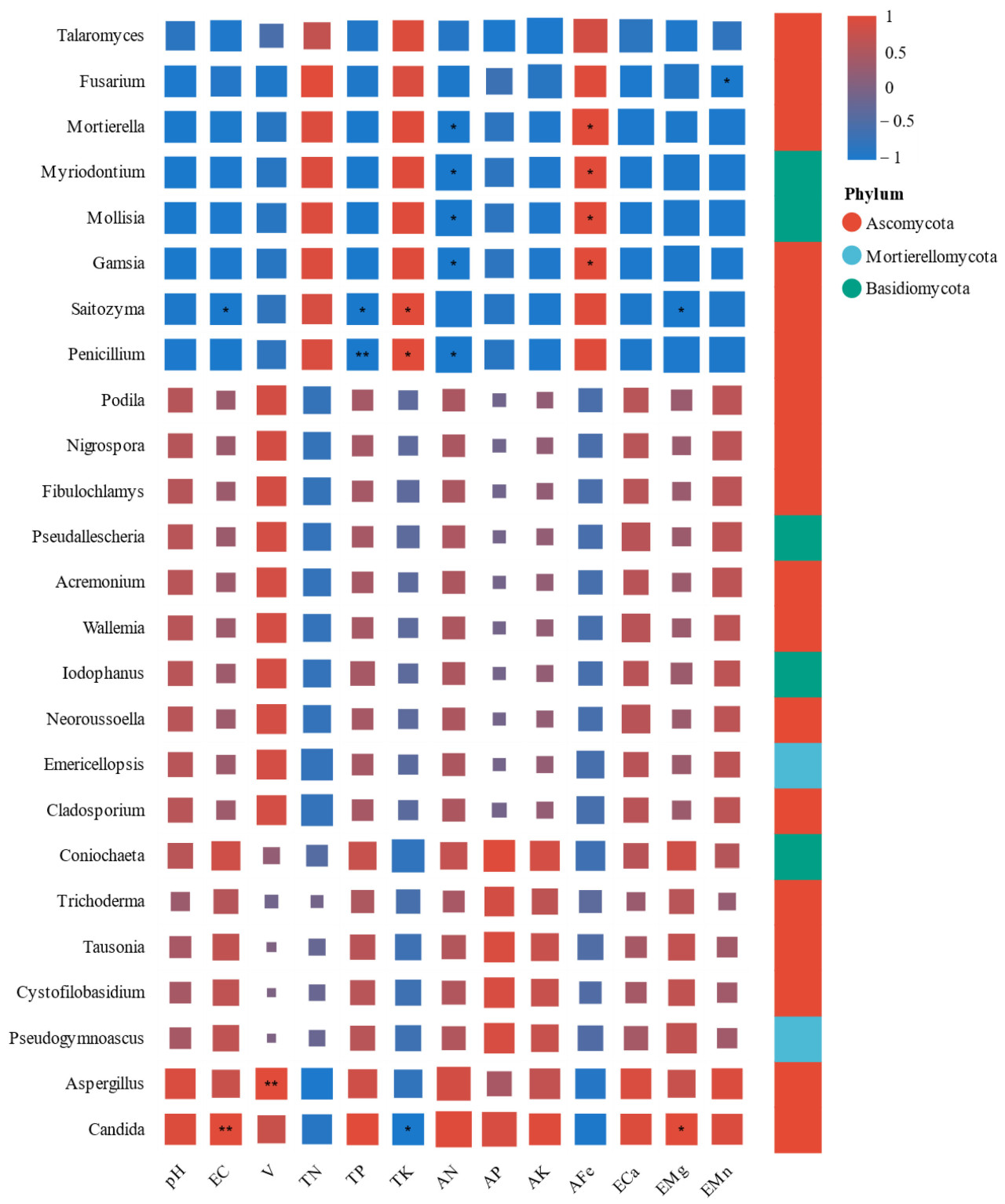
Рисунок 5. Тепловая карта сообщества почвы для посадок и грибов на уровне рода.
По сравнению с контролями, IS1 продемонстрировала более высокую обилие полезных грибов, включая Trichoderma, Cystofilobasidium и Plectophomella. Trichoderma показала особенно высокую относительную обилие (26,22%). Trichoderma признана обычной ризобактерией, способствующей росту растений, которая синтезирует фитогормоны для улучшения прорастания семян и развития растений [26,27], что свидетельствует об их потенциальной роли в стимулировании преобразования, положительно коррелирующего с доступным азотом. Метаболиты Trichoderma обладают антагонистическим действием против почвенных патогенов и способствуют мобилизации питательных веществ в почве. Cystofilobasidium демонстрирует антагонистические свойства против дрожжей и эффективно подавляет послеуборочные заболевания различных фруктов, включая черешню и яблоки [28].
Тепловая карта на Рисунке 6 предоставляет визуальное представление корреляций между различными грибными родами и факторами окружающей среды. Роды, включая Saitozyma, Penicillium и Mollisia, отрицательно коррелировали с pH, указывая на их предпочтение кислым условиям роста. Saitozyma продемонстрировала значительные отрицательные корреляции с EC и эффективным Mg, а также с большинством доступных элементов питания, таких как азот, фосфор и калий. Это наблюдение согласуется с предыдущими выводами, показывающими, что Saitozyma может приводить к снижению ферментативной активности, связанной с трансформацией питательных веществ, что приводит к уменьшению содержания доступных питательных веществ.
Рисунок 6. Тепловая карта корреляций между грибными родами и физико-химическими свойствами почвы. \ 0,01 < p ≤ 0,05; \\ 0,001 < p ≤ 0,01. p указывает на статистическую значимость, причем меньшие значения представляют более сильное evidence корреляции.
Mollisia, Gamsia, Myriodontium и Mortierella были значительно положительно коррелированы с доступным железом. Это может быть объяснимо их статусом как репрезентативных родов в Ctrl2 (верхний слой почвы под эвкалиптом), где содержание доступного железа было самым высоким среди всех почв для посадок. Tausonia, Trichoderma и Cystofilobasidium проявляли положительные корреляции с большинством физико-химических свойств почвы, особенно с общими и доступными питательными веществами. Хотя эти роды отрицательно коррелировали с общим азотом, они были положительно коррелированы с доступным азотом, что свидетельствует об их потенциальной роли в стимулировании преобразования общего азота в его более доступные формы. Эти три рода также были самыми многочисленными грибными таксонами в IS1.
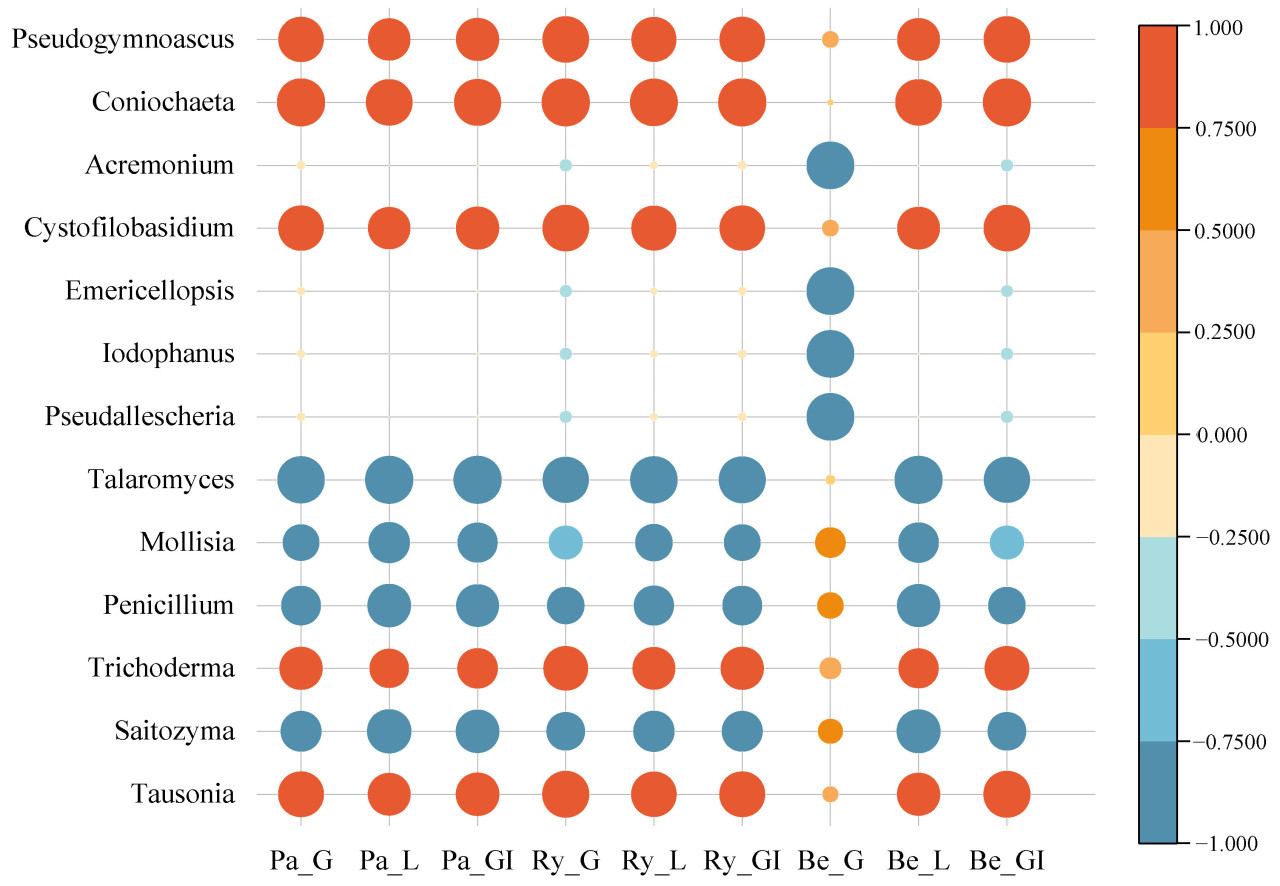
Пять самых многочисленных грибных родов на пузырьковой диаграмме IS1 были Tausonia, Trichoderma, Cystofilobasidium, Coniochaeta и Pseudogymnoascus (Рисунок 7). Эти роды были положительно коррелированы со скоростью прорастания, средней длиной корня и GI у всех трех видов семян. Эта картина свидетельствует, что эти роды могут способствовать прорастанию семян и стимулировать развитие корней.
Рисунок 7. Пузырьковая диаграмма корреляции грибных родов с параметрами прорастания семян. Размер пузырьков пропорционален абсолютному значению корреляций. Роды были выбраны из пяти самых многочисленных таксонов в группах IS1, Ctrl2 и Ctrl3. Pa_G: Скорость прорастания пак-чой; Pa_L: средняя длина корня пак-чой; Pa_GI: индекс всхожести пак-чой; Ry_G: скорость прорастания райграса; Ry_L: средняя длина корня райграса; Ry_GI: индекс всхожести райграса; Be_G: скорость прорастания бермудской травы; Be_L: средняя длина корня бермудской травы; Be_GI: индекс всхожести бермудской травы.
В целом, улучшенная почва для посадок IS1 продемонстрировала значительное увеличение грибной обилия по сравнению с неулучшенной Ctrl3. По сравнению с обоими Ctrl2 и Ctrl3, IS1 показала существенное увеличение полезных почвенных микроорганизмов. Доминирующие грибные роды в IS1 были положительно коррелированы как с общим и доступным содержанием питательных веществ, так и с параметрами прорастания семян, указывая на то, что она была благоприятна для роста растений.
4. Выводы
Данное исследование использовало верхний слой почвы под эвкалиптом, донный ил и компост свиного навоза для преобразования донного ила в почву для посадок. Были проведены эксперименты по прорастанию семян, а также проанализированы тяжелые металлы в почве, основные контрольные показатели и питательные вещества, а также микробное разнообразие почвы. Содержание тяжелых металлов в улучшенной почве для посадок было низким, указывая на то, что они не будут вызывать токсичности для окружающей среды. По сравнению с верхним слоем почвы под эвкалиптом и донным илом, улучшенная почва имела более нейтральный pH и более богатые эффективные питательные вещества. В тесте на всхожесть семян скорость прорастания и средняя длина корня пак-чой в почве для посадок каждой экспериментальной группы были значительно лучше, чем в контрольных группах Ctrl2 и Ctrl3. Рассматривая эти параметры, было обнаружено, что IS1 является наиболее подходящей для роста растений.
Доминирующими грибными родами в почве для посадок IS1 были Tausonia, Trichoderma и Cystofilobasidium. Tausonia играет важную роль в разложении органического вещества, и вместе с Trichoderma способствует активации почвенных питательных веществ через метаболизм. Trichoderma и Cystofilobasidium могут антагонировать патогенные бактерии, снижать концентрацию патогенных бактерий в почве и благоприятствовать росту растений [29].
Результаты данного исследования показывают, что улучшение донного ила до почвы для посадок является хорошим методом для достижения его утилизации как ресурса и снижения объема. Однако все еще необходимо дальнейшее изучение механизма того, как разные грибы способствуют росту растений на микроскопическом уровне, а также исследование влияния улучшенной почвы из донного ила на рост растений в течение более длительного периода.
Ссылки
1. Xiao, Z.; Hou, B.; Chang, Z.; Wei, X.; Song, Z.; Li, H. The Properties of Cement Stabilized Dredged Sludge Solidifying in Seawater and Its Application in the Protection of Subsea Pipelines. Appl. Ocean Res. 2024, 153, 104264. [Google Scholar] [CrossRef]
2. Crocetti, P.; González-Camejo, J.; Li, K.; Foglia, A.; Eusebi, A.L.; Fatone, F. An Overview of Operations and Processes for Circular Management of Dredged Sediments. Waste Manag. 2022, 146, 20–35. [Google Scholar] [CrossRef] [PubMed]
3. Huang, S.; Zhou, X.; Zhou, L.; Huang, Z.; Shen, J. Constant-Current Electro-Dewatering of Sewage Sludge: Effect of Anthracite Modification on Dehydration Performance and Economic Benefit. J. Environ. Chem. Eng. 2022, 10, 107087. [Google Scholar] [CrossRef]
4. Gao, Y.; Wang, Z.; Zhao, J.; Cui, X.; Liang, C.; Hou, S. Mechanical, Freeze-Thaw Resistance and Heavy Metals Leaching Properties of Alkali-Activated Recycled Concrete Powder Solidified Sludge. Constr. Build. Mater. 2024, 447, 138154. [Google Scholar] [CrossRef]
5. Lang, L.; Liu, N.; Chen, B. Strength Development of Solidified Dredged Sludge Containing Humic Acid with Cement, Lime and Nano-SiO2. Constr. Build. Mater. 2020, 230, 116971. [Google Scholar] [CrossRef]
6. Cai, S.; Liu, M.; Zhang, Y.; Hu, A.; Zhang, W.; Wang, D. Molecular Transformation of Dissolved Organic Matter and Formation Pathway of Humic Substances in Dredged Sludge under Aerobic Composting. Bioresour. Technol. 2022, 364, 128141. [Google Scholar] [CrossRef] [PubMed]
7. Jebesa, W.T.; Astatkie, T.; Zerfu, A.; Kenea, H.D.; Abamecha, N.; Shumuye, M.; Abera, G.; Kidane, A.; Hirko, M.; Assefa, F. Impact of Brewery Sludge Application on Heavy Metal Build-up, Translocation, Growth and Yield of Bread Wheat (Triticum aestivum L.) Crop in Northern Ethiopia. Heliyon 2024, 10, e32559. [Google Scholar] [CrossRef] [PubMed]
8. Angon, P.B.; Islam, M.S.; Kc, S.; Das, A.; Anjum, N.; Poudel, A.; Suchi, S.A. Sources, Effects and Present Perspectives of Heavy Metals Contamination: Soil, Plants and Human Food Chain. Heliyon 2024, 10, e28357. [Google Scholar] [CrossRef] [PubMed]
9. Ministry of Housing and Urban-Rural Development of the People’s Republic of China. Planting Soil for Greening; Standards Press of China: Beijing, China, 2016. [Google Scholar]
10. Kong, Y.; Zhang, J.; Yang, Y.; Liu, Y.; Zhang, L.; Wang, G.; Liu, G.; Dang, R.; Li, G.; Yuan, J. Determining the Extraction Conditions and Phytotoxicity Threshold for Compost Maturity Evaluation Using the Seed Germination Index Method. Waste Manag. 2023, 171, 502–511. [Google Scholar] [CrossRef] [PubMed]
11. Hoshyari, E.; Hassanzadeh, N.; Keshavarzi, B.; Jaafarzadeh, N.; Rezaei, M. Spatial Distribution, Source Apportionment, and Ecological Risk Assessment of Elements (PTEs, REEs, and ENs) in the Surface Soil of Shiraz City (Iran) under Different Land-Use Types. Chemosphere 2023, 311, 137045. [Google Scholar] [CrossRef] [PubMed]
12. Li, H.; Wang, Z.; Feng, B.; Shi, J.; Liao, M.; He, K.; Tian, H.; Megharaj, M.; He, W. Arsenic Stress on Soil Microbial Nutrient Metabolism Interpreted by Microbial Utilization of Dissolved Organic Carbon. J. Hazard. Mater. 2024, 470, 134232. [Google Scholar] [CrossRef] [PubMed]
13. Bao, S.D. Soil Agricultural Chemical Analysis, 3rd, ed.; Agriculture Press: Beijing, China, 2000. [Google Scholar]
14. Yu, G.; Chen, H.; Chen, J.; Chen, S.; Long, Y.; Huang, J.; Wang, Y.; He, S. Enhanced Nitrogen Removal through Aerobic Denitrifying Bacteria in Horizontal Subsurface Flow Constructed Wetlands: Influencing Factors and Microbial Community Structure. Chem. Eng. J. 2024, 481, 148654. [Google Scholar] [CrossRef]
15. Dong, S.; Li, L.; Chen, W.; Chen, Z.; Wang, Y.; Wang, S. Evaluation of Heavy Metal Speciation Distribution in Soil and the Accumulation Characteristics in Wild Plants: A Study on Naturally Aged Abandoned Farmland Adjacent to Tailings. Sci. Total Environ. 2024, 917, 170594. [Google Scholar] [CrossRef] [PubMed]
16. Liu, J.; Qiu, G.; Liu, C.; Lin, Y.; Chen, X.; Li, H.; Fu, Q.; Guo, B. Intercropping of Euonymus Japonicus with Photinia × Fraseri Improves Phytoremediation Efficiency in Cd/Cu/Zn Contaminated Field. Biology 2022, 11, 1133. [Google Scholar] [CrossRef] [PubMed]
17. Li, Y.; Li, Z.; Gong, P.; He, X.; Liu, H.; Li, L.; Wang, C.; Li, P.; Wei, J.; Yu, X. Enhanced Irrigation Volume Reduces Salinity and Improves Deep Root Zone Soil Nutrients, Phosphatase Activity and Changes Root Traits of Fruit Trees. Agric. Water Manag. 2024, 302, 109001. [Google Scholar] [CrossRef]
18. Sun, X.; Niu, L.; Zhang, M.; Zhang, H.; Liu, H.; Zhao, M.; Zhang, X.; Zhang, Q.; Zhang, Y. Application of Carbon-Based Nutrient Fertilizer Improved Soil Fertility and Seed Yield of Paeonia Ostii ‘Feng Dan’. Ind. Crops Prod. 2024, 212, 118348. [Google Scholar] [CrossRef]
19. Lv, Y.Z.; Li, B.G. Soil Science; China Agriculture Press: Beijing, China, 2006; ISBN 978-7-109-10593-8. [Google Scholar]
20. Wang, L.; Wang, Z.; Wang, Z.; Zheng, J. Integrated Aerobic-Anaerobic Digestion of Highly Solids-Loaded Corn Stover and Swine Manure under Dynamic Aeration: Temperature Rise, Physicochemical Characteristics, and Methane Production. J. Environ. Manag. 2024, 366, 121864. [Google Scholar] [CrossRef] [PubMed]
21. Magaña Ugarte, R.; Hurtado Martínez, M.; Díaz-Santiago, E.; Pugnaire, F.I. Microbial Controls on Seed Germination. Soil Biol. Biochem. 2024, 199, 109576. [Google Scholar] [CrossRef]
22. Shi, Y.; Li, Y.; Yang, T.; Chu, H. Threshold Effects of Soil pH on Microbial Co-Occurrence Structure in Acidic and Alkaline Arable Lands. Sci. Total Environ. 2021, 800, 149592. [Google Scholar] [CrossRef]
23. Wang, Q.; Liang, A.; Chen, X.; Zhang, S.; Zhang, Y.; McLaughlin, N.B.; Gao, Y.; Jia, S. The Impact of Cropping System, Tillage and Season on Shaping Soil Fungal Community in a Long-Term Field Trial. Eur. J. Soil Biol. 2021, 102, 103253. [Google Scholar] [CrossRef]
24. Mondo, S.J.; Jiménez, D.J.; Hector, R.E.; Lipzen, A.; Yan, M.; LaButti, K.; Barry, K.; Van Elsas, J.D.; Grigoriev, I.V.; Nichols, N.N. Genome Expansion by Allopolyploidization in the Fungal Strain Coniochaeta 2T2.1 and Its Exceptional Lignocellulolytic Machinery. Biotechnol. Biofuels 2019, 12, 229. [Google Scholar] [CrossRef] [PubMed]
25. Wang, Y.-H.; Hong, L.; Li, J.-J.; Zhang, Q.-X.; Wang, A.-Q.; Lin, S.-X.; Hu, M.-Y.; Chen, Y.-L.; Lin, W.-X.; Wang, H.-B.; et al. Analysis of Growth Inhibition of Continuously Planted Casuarina Equisetifolia in Relation to Characteristic Soil Microbial Functions and Nutrient Cycling. Appl. Soil Ecol. 2024, 202, 105607. [Google Scholar] [CrossRef]
26. Neme, A.; Leta, A.; Yones, A.M.; Tahir, M. Seedborne Mycoflora of Faba Bean (Vicia fabae L.) and Evaluation of Plant Extract and Trichoderma Species against Mycelium Growth of Selected Fungi. Heliyon 2023, 9, e17291. [Google Scholar] [CrossRef] [PubMed]
27. Rocha, T.M.; Marcelino, P.R.F.; Antunes, F.A.F.; Sánchez-Muñoz, S.; dos Santos, J.C.; da Silva, S.S. Biocompatibility of Brazilian Native Yeast-Derived Sophorolipids and Trichoderma Harzianum as Plant-Growth Promoting Bioformulations. Microbiol. Res. 2024, 283, 127689. [Google Scholar] [CrossRef]
28. Hu, Y.; Jia, F.; Liu, Z.; Zhang, Y.; Li, L. Impact of Storage Time on Microbial Communities and Flavor Profiles in Highland Barley Grains. J. Stored Prod. Res. 2024, 107, 102321. [Google Scholar] [CrossRef]
29. Anckaert, A.; Declerck, S.; Poussart, L.-A.; Lambert, S.; Helmus, C.; Boubsi, F.; Steels, S.; Argüelles-Arias, A.; Calonne-Salmon, M.; Ongena, M. The Biology and Chemistry of a Mutualism between a Soil Bacterium and a Mycorrhizal Fungus. Curr. Biol. 2024, 34, 4934–4950.e8. [Google Scholar] [CrossRef] [PubMed]
Zhang S, Mo R, Shi H, Li Y, Zhou Y, Wang C, Yu G. Plant Adaptability to Improved Dredged Sediment. Agriculture. 2025; 15(2):218. https://doi.org/10.3390/agriculture15020218
Перевод статьи «Plant Adaptability to Improved Dredged Sediment» авторов Zhang S, Mo R, Shi H, Li Y, Zhou Y, Wang C, Yu G., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык































































































Комментарии (0)