Влияние эндофитов злаков на пятнистость листьев у райграса пастбищного, вызываемую Bipolaris sorokiniana, и последующие пищевые предпочтения тли
Эндофиты злаков (Epichloë) являются важными симбиотическими микроорганизмами райграса пастбищного, играющими ключевую роль в устойчивости растения к различным стрессам. В данном исследовании изучалось влияние эндофитов злаков на пятнистость листьев, вызываемую грибковым патогеном Bipolaris sorokiniana, и последующие пищевые предпочтения тли (Rhopalosiphum maidis) на райграсе пастбищном, с особым вниманием к тому, как эндофиты влияют на взаимодействия между патогенами и тлёй. Результаты показали, что эндофиты достоверно повышали чистую эффективность фотосинтеза райграса пастбищного.
Аннотация
Взаимодействия между эндофитами, патогеном и тлёй влияли на активность супероксиддисмутазы (SOD), пероксидаз (POD) и каталазы (CAT). Эндофиты усиливали активность SOD и CAT у инфицированного патогеном райграса. В то время как заражение патогеном и инвазия тли снижали концентрации жасмоновой кислоты (JA) и салициловой кислоты (SA), эндофиты повышали уровень SA. Корреляционный анализ выявил отрицательную связь между сухой массой побегов и скоростью транспирации растений, а также активностью SOD и CAT. Исследование пищевого выбора тли показало, что эндофиты привлекали больше тли для питания при ко-инфекции с патогенами. Это предпочтение положительно коррелировало с уровнями H2O2 и SA, но отрицательно — с концентрациями NO и JA. В целом, эндофиты злаков повышают устойчивость райграса пастбищного к возбудителям пятнистости листьев и тли, предлагая новую стратегию борьбы с вредителями и болезнями в сельском хозяйстве.
1. Введение
Райграс пастбищный ( Lolium perenne L.), характеризующийся энергичным ростом и обширным кущением, является популярным во всем мире видом газонной травы и пастбищ прохладного сезона (C 3 ) и одним из самых популярных сортов для газонов во всем мире [ 1 , 2 , 3 ]. Он растет в диком виде почти по всей Европе, Северной Африке, умеренной Азии, Северной Америке и Австралии [ 4 ]. Он широко используется в качестве зеленого удобрения для стабилизации почв и предотвращения эрозии [ 4 , 5 ], а также как альтернативное возобновляемое растение-источник биоэнергии [ 6 ]. Райграс пастбищный также ценится за его способность образовывать устойчивый дерн для спортивных площадок и полей для гольфа, что делает его популярным выбором для строительства газонов в городах [ 7 , 8 ].
Грибковые заболевания являются основным ограничивающим фактором в производстве и использовании райграса пастбищного [ 9 ]. К распространенным болезням, поражающим райграс, относятся такие биотрофные патогены, как стеблевая ржавчина ( Puccinia graminis subsp. graminicola ), корончатая ржавчина ( Puccinia coronata f.sp. lolii ) [ 10 ] и мучнистая роса ( Blumeria graminis DC.), а также некротрофные патогены, такие как долларовая пятнистость ( Sclerotinia homoeocarpa FT Bennett ), сосудистое увядание ( Fusarium oxysporum ) [ 11 ] и пятнистость листьев ( Bipolaris sorokiniana ). Грибок B. sorokiniana является патогенным для многих растений, симптомы его поражения варьируются от некротических поражений до увядания или гибели [ 12 ]. Сообщается, что заболевания, вызываемые B. sorokiniana, приводят к значительному снижению урожайности сельскохозяйственных культур в таких странах, как Индия, Непал, Канада, Шотландия и Бразилия [ 13 ].
Заражения насекомыми являются еще одним значительным ограничивающим фактором, влияющим на рост райграса пастбищного, особенно те, которые связаны с засухой и чрезмерным выпасом, которые оказывают серьезное воздействие на устойчивость райграса пастбищного [ 14 ]. Например, личинки африканского черного жука ( Heteronychus arator ) в начальной стадии питаются корнями травы вблизи всходов райграса пучкового, нанося серьезный ущерб, когда популяция превышает 20 на квадратный метр [ 15 , 16 ]. Кроме того, корневая тля ( Aploneura lentisci ) присутствует в течение всего года в Новой Зеландии и может значительно снизить урожайность райграса [ 17 , 18 , 19 , 20 ]. Нападение личинок аргентинского стеблевого долгоносика ( Aploneura lentisci ) привело к снижению сухого вещества двулетнего райграса ( Lolium multiflorum ) более чем на 40% в Чили [ 21 ].
Эндофиты злаковых трав ( Epichloë ) представляют собой разнообразную группу грибов, которые проводят весь или большую часть своего жизненного цикла внутри злаковых трав, часто не вызывая видимых симптомов. Большое количество злаковых трав заражено эндофитами злаковых трав [ 22 ]. Инфицированные растения могут положительно влиять на рост и размножение, а также могут повышать устойчивость к абиотическим и биотическим факторам и стрессорам [ 23 ]. Убедительные полевые данные свидетельствуют о том, что инфицированная эндофитами овсяница тростниковая ( Festuca arundinacea ) проявляет повышенную устойчивость к засухе [ 24 ], а исследования в теплицах продемонстрировали повышенную устойчивость к вредным насекомым [ 25 , 26 ]. На протяжении своей длительной эволюции эндофитные грибы развили взаимные симбиотические отношения со своими растениями-хозяевами, способствуя усвоению питательных веществ и повышению устойчивости к биотическим стрессам, таким как вредители и болезни [ 27 ].
Инфицирование эндофита злака активирует деятельность защитных ферментов и накопление активных форм кислорода (АФК), таких как пероксидазы (ПОД), супероксиддисмутаза (СОД) и каталаза (КАТ), и эти защитные ферменты оказывают положительное влияние на реакцию растений на заражение грибковыми патогенами [ 28 ]. Кроме того, эндофиты злаков продуцируют алкалоиды с антигельминтной активностью: алкалоиды спорыньи, алкалоиды райграса, повидоновые алкалоиды и индольные дитерпеноидные алкалоиды, причем алкалоиды райграса и повидоновые алкалоиды являются наиболее токсичными [ 29 ]. Было обнаружено, что колонизация эндофита злака снижает выживаемость насекомых-вредителей [ 30 ] и снижает тяжесть грибкового заболевания райграса. Например, эндофит злака Epichloë festucae var. lolii способствует росту многолетнего райграса, обеспечивая защиту от болезней на довсходовой стадии и на стадии листвы [ 28 ].
Пятнистость листьев райграса, вызываемая B. sorokiniana и тлёй, является специализированной и имеет всемирное распространение, что может нанести серьезный ущерб райграсу. Чтобы справиться со специализированным повреждением и характером питания патогенов и тли, растения используют отличительные стратегии распознавания, сигнализации и защиты [ 31 , 32 , 33 ]. Когда растение повреждено патогенной инфекцией или питанием тлей, растение активирует свои собственные механизмы устойчивости, которые включают изменение в ROS, питательных веществах, вторичных метаболитах и фитогормонах. Эти изменения работают вместе, чтобы усилить защиту растения от патогенов и тли. Например, Epichloë festucae var. lolii может уменьшить тяжесть пятнистости листьев, вызываемой B. sorokiniana , изменяя уровни POD, SOD, CAT, малонового диальдегида (MDA) и перекиси водорода (H 2 O 2 ) [ 34 ].
Болезни растений и вредители часто возникают одновременно, усугубляя ущерб растениям-хозяевам [ 35 , 36 ]. В предыдущих исследованиях в основном изучалось индивидуальное воздействие эндофитов злаков на заражение растений патогенными грибами или насекомыми-вредителями [ 10 , 14 , 27 , 28 , 29 ]. Однако исследования, изучающие воздействие эндофитов злаков на эффекты коинфекции болезней и насекомых-вредителей на райграсе пастбищном, ограничены. Кроме того, исследования показали, что предшествующее заражение патогенами будет привлекать [ 37 , 38 ] или отталкивать [ 39 , 40 ] приоритет питания насекомых-вредителей, например, заражение Phoma medicaginis арбускулярными микоризными грибами на люцерне привлекло питание тли ( Acyrthosiphon pisum ) [ 41 ]. Исследования Эллсбери показывают заражение патогеном Phytophthora sp. подавляет заражение гороховой тлей Acyrthosiphon pisum на клевере пузырчатом ( Trifolium vesiculosum ) [ 42 ].
Это исследование было разработано для изучения эффектов эндофита злаков на реакцию райграса пастбищного на совместное заражение B. sorokiniana и тлёй ( Rhopalosiphum maidis , Fitch). В то же время, чтобы определить влияние фитопатогенов, заражающих растения, на последующие пищевые предпочтения тли на райграсе пастбищном, мы оценили предпочтение тли инфицированных и незаражённых растений. Мы также исследовали, влияют ли патоген и эндофит злаков на пищевые предпочтения тли. Мы предположили, что (1) эндофит злаков может смягчить комбинированные эффекты заражения патогеном и тлёй райграса пастбищного, изменяя определённую активность ферментов защиты растений и сигнальных веществ райграса пастбищного. (2) Совместное заражение патогеном и колонизация эндофитом злаков изменят последующие пищевые предпочтения тли и могут привлечь скопление тли.
2. Материалы и методы
2.1. Растения и грибы, использованные в исследовании
Сорт райграса пастбищного – Lolium perenne cv. Samson, без эпихлоэ (Nil) или с эпихлоэ -инфицированным (AR37). Семена предоставлены компанией Grasslanz Technology Ltd., Палмерстон-Норт, Новая Зеландия. Патоген Bipolaris sorokiniana предоставлен Государственной ключевой лабораторией улучшения травяного покрова и пастбищных агроэкосистем Университета Ланьчжоу. Rhopalosiphum maidis (Fitch) предоставлен компанией Quanying Insect Biology Inc., Цзиюань, Китай.
2.2. Почвенная смесь
Питательная среда для выращивания растений содержала 25% почвы и 75% песка. Почва была собрана на поле кампуса Юйчжун Ланьчжоуского университета в Ланьчжоу, Китай, а песок был приобретён на местном рынке. Оба компонента были просеяны через сито с размером ячеек 2 мм и высушены при комнатной температуре. Затем смесь песка и почвы стерилизовали в автоклаве при температуре 121 °C в течение 1 часа, повторяли процедуру дважды в течение 3 дней, а затем высушивали в сушильном шкафу при температуре 110 °C в течение 36 часов.
2.3 Экспериментальный дизайн
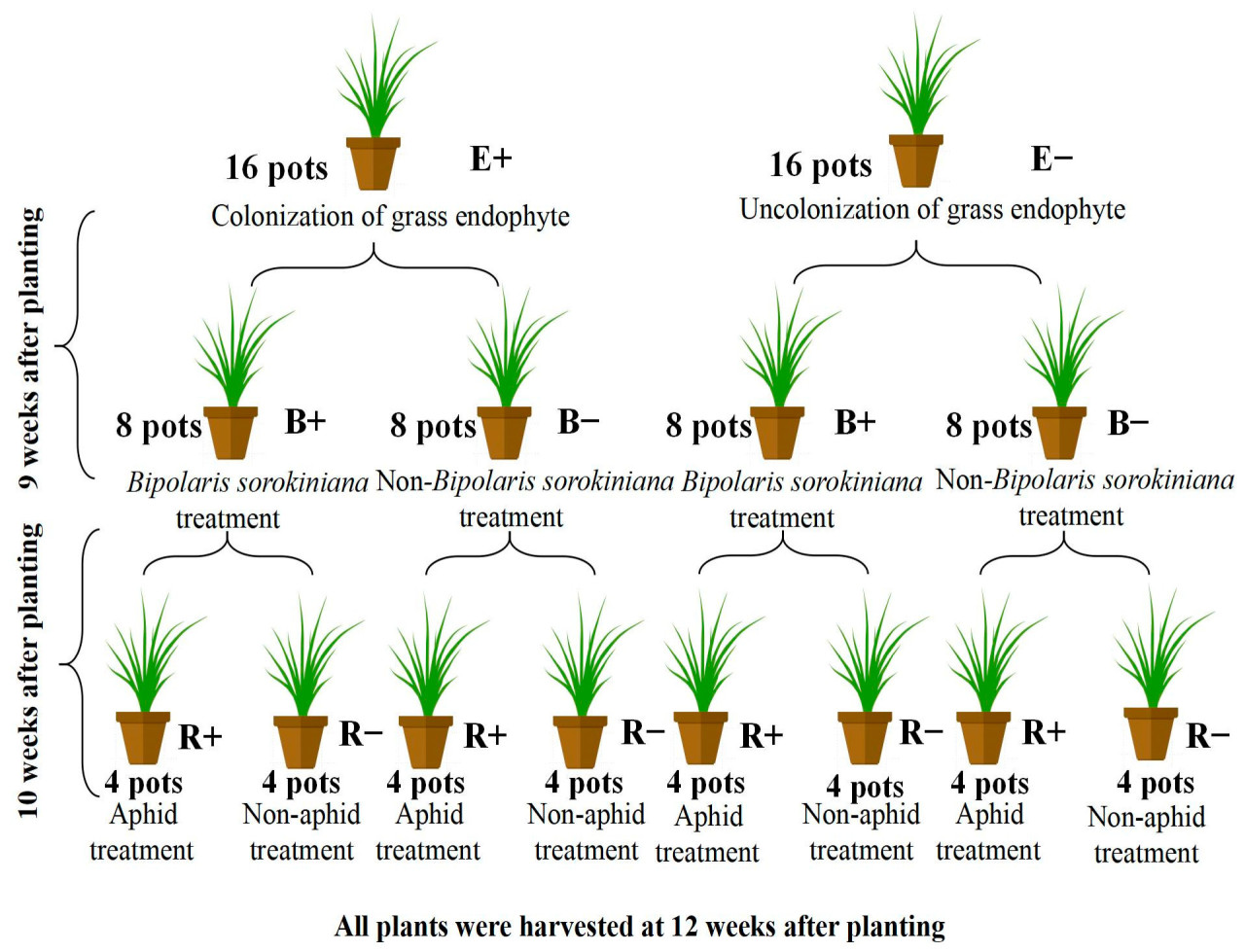
Был разработан полностью скрещенный трехфакторный эксперимент: эндофит злаков (инфицированный или неинфицированный) × B. sorokiniana (инокулированный или неинокулированный) × R. maidis (Fitch) (с или без) = восемь обработок, каждая обработка с четырьмя повторностями. Патоген B. sorokiniana был инокулирован на половину каждой обработки эндофитом злаков через 9 недель после появления всходов растений. Семена райграса пастбищного были поверхностно стерилизованы в 10% NaClO в течение 10 минут и трижды промыты стерилизованной дистиллированной водой. Мы поместили стерилизованные семена на стерилизованную влажную фильтровальную бумагу и инкубировали их в темноте при температуре 25 °C в течение 48 часов для прорастания. В каждый горшок было высажено шесть пророщенных семян райграса пастбищного с заражением злаковыми эндофитами (E+) или без заражения злаковыми эндофитами (E−). Размер горшка составлял 19 см в высоту и 15 см в ширину, и в него помещалось 1,5 кг вышеупомянутой смеси почвы и песка. Через неделю после появления всходов растения проредили, оставив в каждом горшке по пять сеянцев примерно одинакового размера.
После 9 недель выращивания в теплице половина растений была использована для создания обработок против патогена. Десять мл суспензии B. sorokiniana , содержащей споры 1 × 10 6 мл −1, были опрысканы на каждое растение райграса пастбищного (B+). Другую половину растений для разработки контрольных обработок (B−) опрыскали десятью мл стерилизованной воды. Горшки с растениями накрыли черным полиэтиленовым пакетом на следующие 36 часов для сохранения влаги, необходимой для заражения патогеном.
Через неделю после проведения обработок патогеном (B+ и B−) на растения райграса пастбищного было помещено по 10 особей тли на горшок (по две тли на растение) для проведения обработок R+ (E−B−R+, E−B+R+, E+B−R+ и E+B+R+) против тли ( Rhopalosiphum maidis (Fitch)). Остальные четыре горшка в каждой группе не были заражены тлёй и прошли обработку R- (E−B−R−, E−B+R−, E+B−R- и E+B+R−). Каждый горшок был отдельно помещен в трубчатую пластиковую клетку, по одной клетке на горшок, на неделю.
За неделю до заражения патогеном, через неделю после заражения патогеном и через неделю после заражения тлей чистая скорость фотосинтеза (P n , мкмоль·м −2 ·с −1 ) и устьичная проводимость (G s , мкмоль·м −2 ·с −1 ) райграса пастбищного измерялись с помощью портативного фотосинтезатора Li-6400 (LI-COR Inc., Линкольн, Небраска, США) при нормальных условиях воздуха с 9:00 до 11:00 в солнечные дни. Из каждого горшка случайным образом выбиралось одно растение, и для измерения выбирались листья около новых побегов растения. Для каждого горшка подсчитывался один лист с интервалом в 15 секунд, и в каждом горшке регистрировалось в общей сложности пять листьев. Для каждой обработки измерялось четыре горшка, а затем рассчитывалось среднее значение.
Эксперимент проводился в теплице кампуса Юйчжун Ланьчжоуского университета. Плотность потока фотонов фотосинтеза во время эксперимента находилась в диапазоне 480–850 ммоль/м² · с. Средняя температура составляла 20–28 °C. Растения поливали водопроводной водой через день до достижения постоянного веса 10% от сухого веса почвы. Растения собирали через 14 дней после заражения тлей R. maidis (Fitch), то есть через 12 недель после появления всходов райграса пастбищного ( рисунок 1 ).
Рисунок 1. Блок-схема, показывающая экспериментальный дизайн исследования.
2.4. Сбор и измерение растений
При сборе урожая побеги срезались с растений, одна часть проб использовалась для определения активности растительных ферментов, включая пероксидазу (POD), супероксиддисмутазу (SOD), каталазу (CAT) и полифенолоксидазу (PPO). Другая часть пробы использовалась для анализа сигнальных соединений растений, включая перекись водорода (H 2 O 2 ), салициловую кислоту (SA), жасмоновую кислоту (JA) и оксид азота (NO), а остальные листья высушивались в духовке для получения сухих масс, которые использовались для расчета общей надземной части общего сухого веса каждого растения в каждом горшке. Две части пробы защитных ферментов растений и сигнальных химических веществ рассматривались для соотношения сырого и сухого веса, подлежащего подсчету в общем сухом надземном весе. Кроме того, корни из каждого горшка промывались и собирались для определения их сырого и сухого веса в духовке при температуре 80 °C в течение 48 часов.
Активность SOD побегов растений определяли методом фотохимического восстановления азотного синего тетразолия (NBT) [ 43 ], активность POD измеряли гваяколовым колориметрическим методом [ 44 ], активность CAT определяли методом титрования перманганатом калия, а активность PPO определяли колориметрическим методом [ 45 ]. Концентрацию H2O2 в листьях измеряли на основе изменения поглощения комплекса пероксида титана при 412 нм (УФ-видимый фотометр, UV-2102PC, Unico Instrument Co., Ltd., Шанхай, Китай) [ 46 ] . Иммуноферментный анализ (ИФА) использовали для определения содержания оксида азота (NO), салициловой кислоты (SA) и жасмоновой кислоты (JA) [ 47 ].
2.5. Тест с использованием ольфактометра
Тля оценила тропизм летучих органических соединений (ЛОС) райграса, выделяемых растениями при шести обработках (E−B−R−, E+B−R−, E−B+R−, E+B+R−, E−B−R+ и E+B−R+). Аппарат для отбора тли показан на рисунке 2. Два горшка с растениями райграса из каждой обработки были помещены в четыре отдельных стеклянных колпака с источниками запаха. Воздух забирался насосом, очищался путем пропускания через фильтры с силикагелем и активированным углем и увлажнялся бутылками с дистиллированной водой перед поступлением в стеклянные колпаки. Поток воздуха из стеклянного кожуха направлялся в стеклянный диск, который регулируется расходомером воздуха в системе для поддержания потока воздуха 100 миллилитров в минуту. Десять особей тли помещали в центр стеклянного диска, и за их перемещением наблюдали в трёх повторностях по 25 минут каждая. Если тля за период наблюдения проползала более чем на 2/3 любой стороны, движение этой тли в направлении запаха регистрировалось как выбор этой стороны. Если 2/3 не достигались, регистрировалось «нет выбора».
Рисунок 2. Схема аппарата для отбора запахов тли. Экспериментальная установка для направления воздуха из свободного пространства над растениями в ольфактометр. Для экспериментов с тлей использовался четырёхрычажный ольфактометр. Насекомое помещалось в центральную область ольфактометра, а воздух втягивался через аппарат всасывающим насосом. Воздух из обонятельной камеры растений откачивался и направлялся в плечи ольфактометра. В центре арены ольфактометра откачивался воздух, создавая постоянный поток из каждого плеча к середине. Поток воздуха в системе контролировался расходомерами, настроенными на поддержание расхода 200 мл/мин через каждое боковое плечо ольфактометра. Левая сторона установки — всасывающий насос и расходомеры, правая сторона — ольфактометр, а середина — камера для определения запахов растений.
2.6 Статистический анализ
Все данные представлены в виде средних значений и стандартных ошибок среднего значения четырех повторов. Для организации и суммирования данных использовались Microsoft Excel 2016 и Prism 10.0 Software (GraphPad, Сан-Диего, Калифорния, США). Статистическую значимость между группами обработки и контроля анализировали с помощью однофакторного дисперсионного анализа (ANOVA) с помощью SPSS 26.0 (SPSS Institute Inc., Чикаго, Иллинойс, США). Эффекты взаимодействия анализировали с помощью одномерного анализа общих линейных моделей в SPSS 26.0 (SPSS Institute Inc., Чикаго, Иллинойс, США). Все попарные сравнения Тьюки HSD использовались для сравнения средних значений обработки при p < 0,05. Чтобы определить, влияют ли эндофиты злаков, патогены и повреждения, нанесенные до появления тли, на привлечение или отталкивание тли, данные по выбору насекомых анализировали с помощью одного t -теста в SPSS 26.0. (SPSS Institute Inc., Чикаго, Иллинойс, США).
3. Результаты
3.1 Рост растений
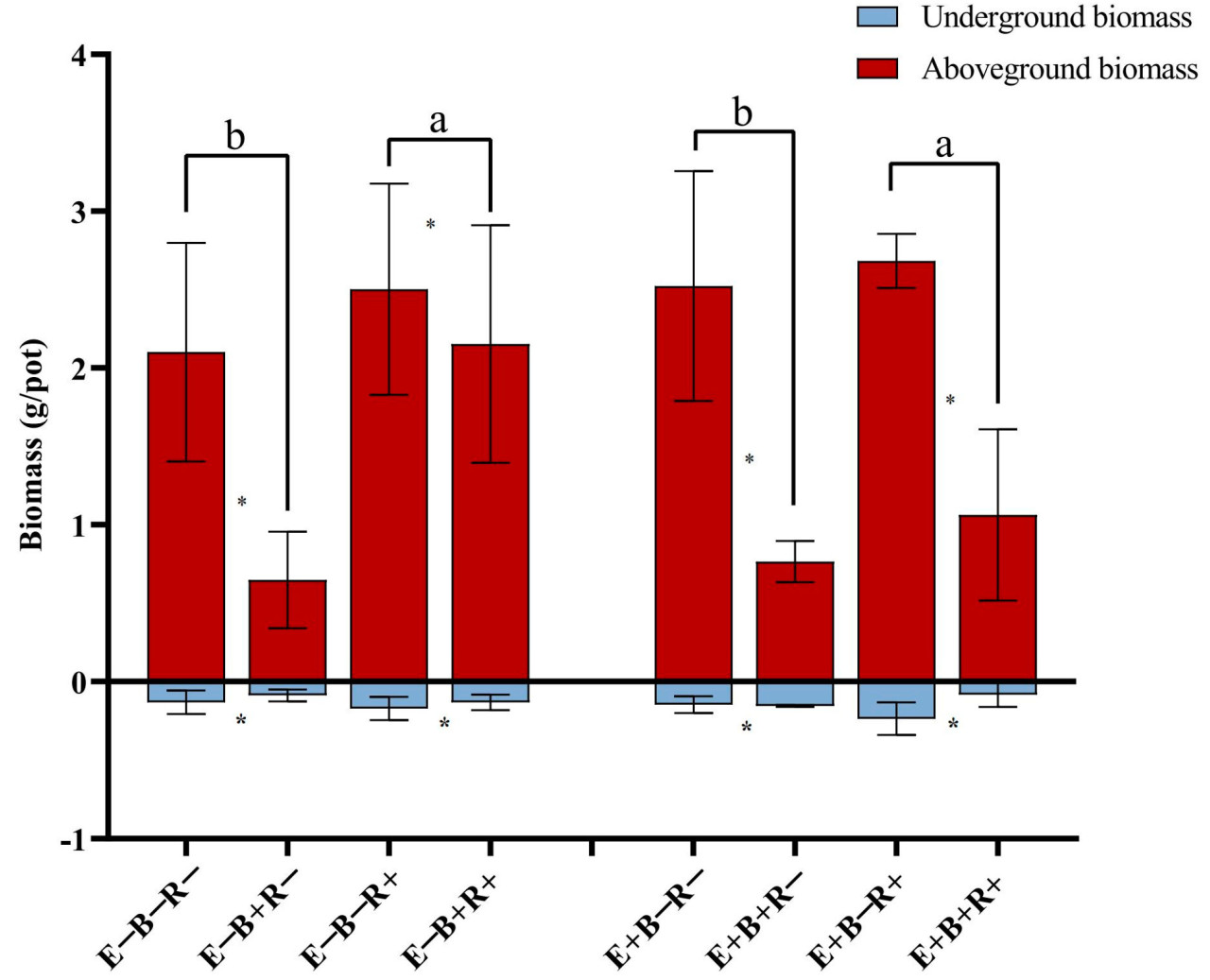
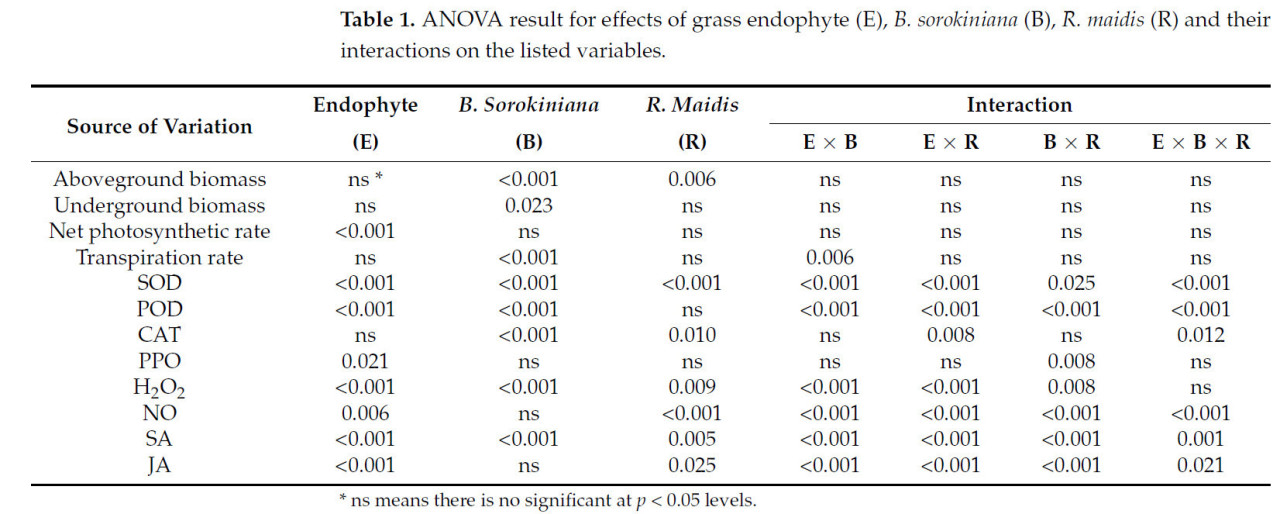
При сборе урожая заражение патогеном B. sorokiniana вызвало типичную пятнистость листьев на райграсе, растение E+ было успешно заражено эндофитом злаков. Патоген значительно повлиял на надземную биомассу и значительно повлиял на подземную биомассу. Инокуляция R. maidis оказала очень значительное влияние на надземный рост райграса пастбищного ( таблица 1 ). Напротив, заражение B. sorokiniana (B+) значительно снизило надземную биомассу райграса пастбищного на 69,18%, в то время как колонизация эндофитом злаков (E+) увеличила надземную биомассу на 20,02% ( рисунок 3 ). Подземная биомасса не показала реакции на эндофит злаков (E+) независимо от инокуляции B. sorokiniana или инокуляции R. maidis (R+) ( рисунок 3 ).
Рисунок 3. Сухой вес побегов и корней (DW) райграса пастбищного ( L. perenne ) без (E−) или с (E+) эндофитом злаков, неинокулированного (B−) или инокулированного (B+) B. sorokiniana , а также незаражённого (R−) или заражённого (R+) тлёй. Разные строчные буквы над чертой указывают на существенную разницу между обработками тли при уровне p < 0,05 для сухого веса побегов. Звездочка означает существенную разницу между обработкой патогеном при уровне p < 0,05 для сухого веса побегов или корней.
Таблица 1. Результат дисперсионного анализа влияния эндофита травы (E), B. sorokiniana (B), R. maidis (R) и их взаимодействия с перечисленными переменными.
3.2 Параметры фотосинтеза растений
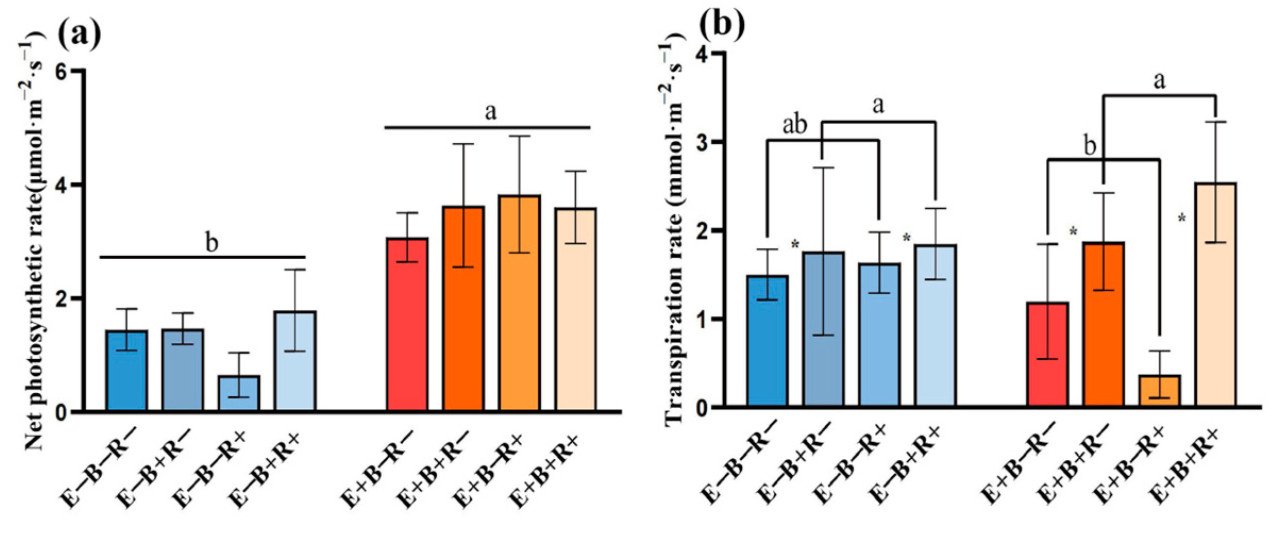
Взаимодействия между эндофитом злаков и B. sorokiniana значительно повлияли на скорость транспирации ( таблица 1 ). Райграс пастбищный с эндофитом злаков (E+) показал значительное увеличение чистой скорости фотосинтеза, увеличившись на 112,01–164,07%. В частности, сочетание колонизации эндофитом злаков и заражения тлей дало самое высокое значение чистой скорости фотосинтеза 164,07%. Не было обнаружено существенных различий в скорости транспирации растений между контролем (E−B−R−) и другими обработками. Однако скорость транспирации при обработке E+B−R+ была на 75,15% меньше, чем в контроле. В случае заражения тлей райграс пастбищный с эндофитом злаков (E+), зараженный B. sorokiniana (B+), увеличил скорость транспирации на 69,38% ( рисунок 4 ).
Рисунок 4. Чистая скорость фотосинтеза ( a ) и скорость транспирации ( b ) у райграса пастбищного ( L. perenne ) без эндофита злака (E−) или с эндофитом злака (E+), неинокулированного B. sorokiniana (B−) или инокулированного B. sorokiniana ( B + ) , и незаражённого тлей (R−) или заражённого тлей (R+). Разные строчные буквы над столбцом указывают на то, что существует значительная разница между обработками эндофитом злака при уровне p < 0,05 для чистой скорости фотосинтеза ( a ); разные строчные буквы над группой столбца указывают на то, что существует значительная разница между обработками эндофитом злака и патогеном при уровне p < 0,05 для скорости транспирации ( b ). Звездочка означает, что существует значительная разница между обработкой патогеном на уровне p < 0,05 для скорости транспирации ( b ).
3.3. Активность ферментов защиты растений
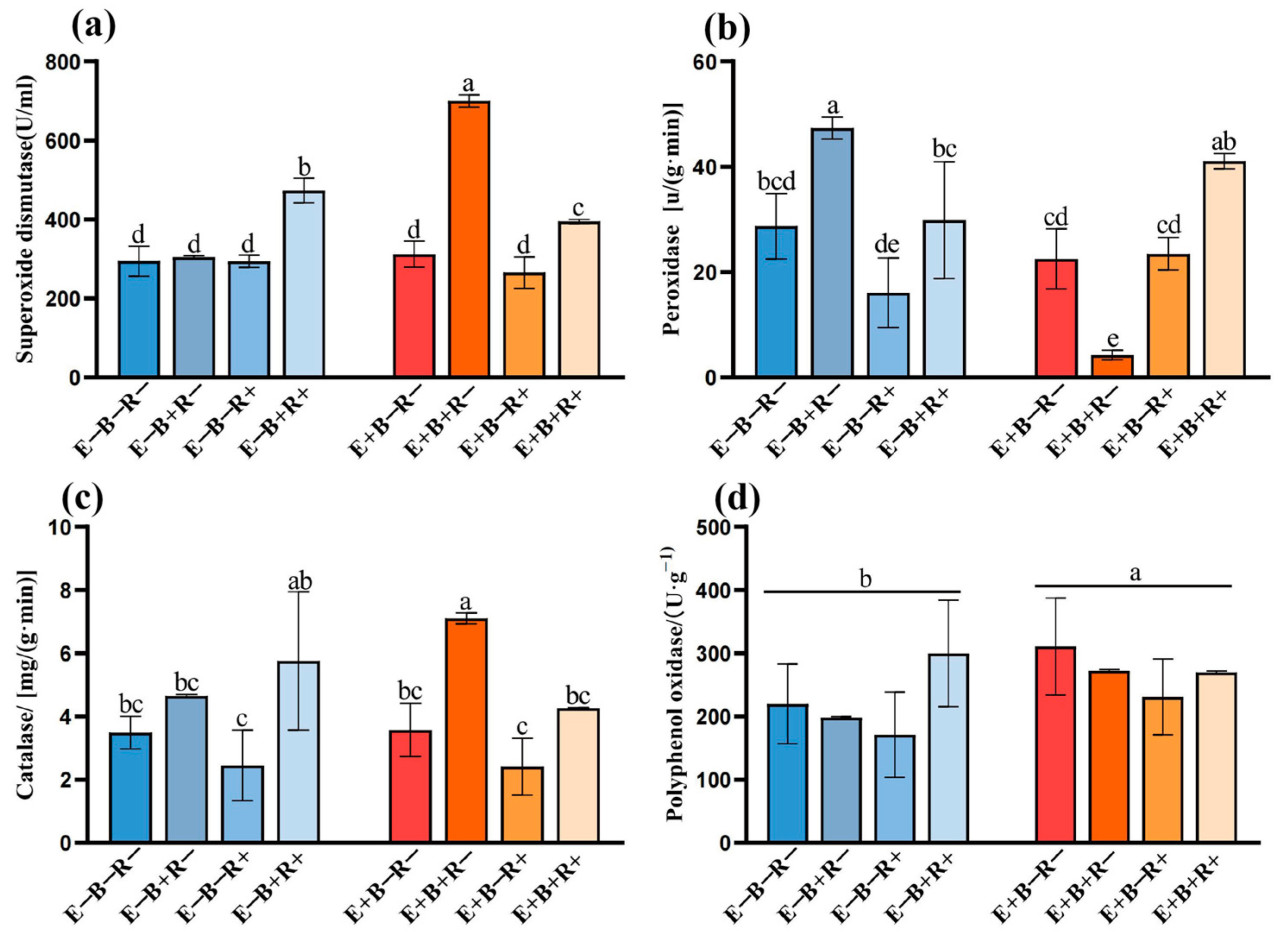
Трехфакторное взаимодействие эндофита злаков, B. sorokiniana и тли чрезвычайно значительно повлияло на содержание СОД, ПОД и КАТ райграса ( таблица 1 ). Райграс пастбищный, коинфицированный эндофитом злаков (E+) и B. sorokiniana (B+), значительно увеличил активность СОД и КАТ, но значительно снизил активность ПОД. Значения активности СОД в вариантах с E−B+R+, E+B+R− и E+B+R+ были на 60,78%, 137,75% и 34,13% выше, чем в контрольной группе (E−B−R−). Значение ПОД в E−B+R− было на 64,86% выше, чем в контрольной группе, тогда как в E+B+R− оно было на 85,22% ниже, чем в контрольной группе. Колонизация эндофита злаков (E+) увеличила содержание ППО в райграсе пастбищном на 5,02–41,39% ( рисунок 5 ).
Рисунок 5. Защитная ферментативная активность супероксиддисмутазы (СОД) ( a ), пероксидазы (ПОД) ( b ), каталазы (КАТ) ( c ) и полифенолоксидазы (ПОД) ( d ) у многолетнего райграса ( L. perenne ) без эндофита злаков (E−) или с эндофитом злаков (E+), неинокулированного B. sorokiniana (B−) или инокулированного B. sorokiniana (B+), и не зараженного тлёй (R−) или зараженного тлёй (R+). Разные строчные буквы над чертой указывают на существенную разницу между обработками при уровне p < 0,05 для супероксиддисмутазы ( a ), пероксидазы ( b ), каталазы ( c ); Другая строчная буква над чертой указывает на то, что существует значительная разница между обработками эндофитами травы на уровне p < 0,05 для полифенолоксидазы ( d ).
3.4. Сигнальные соединения фитогормонов
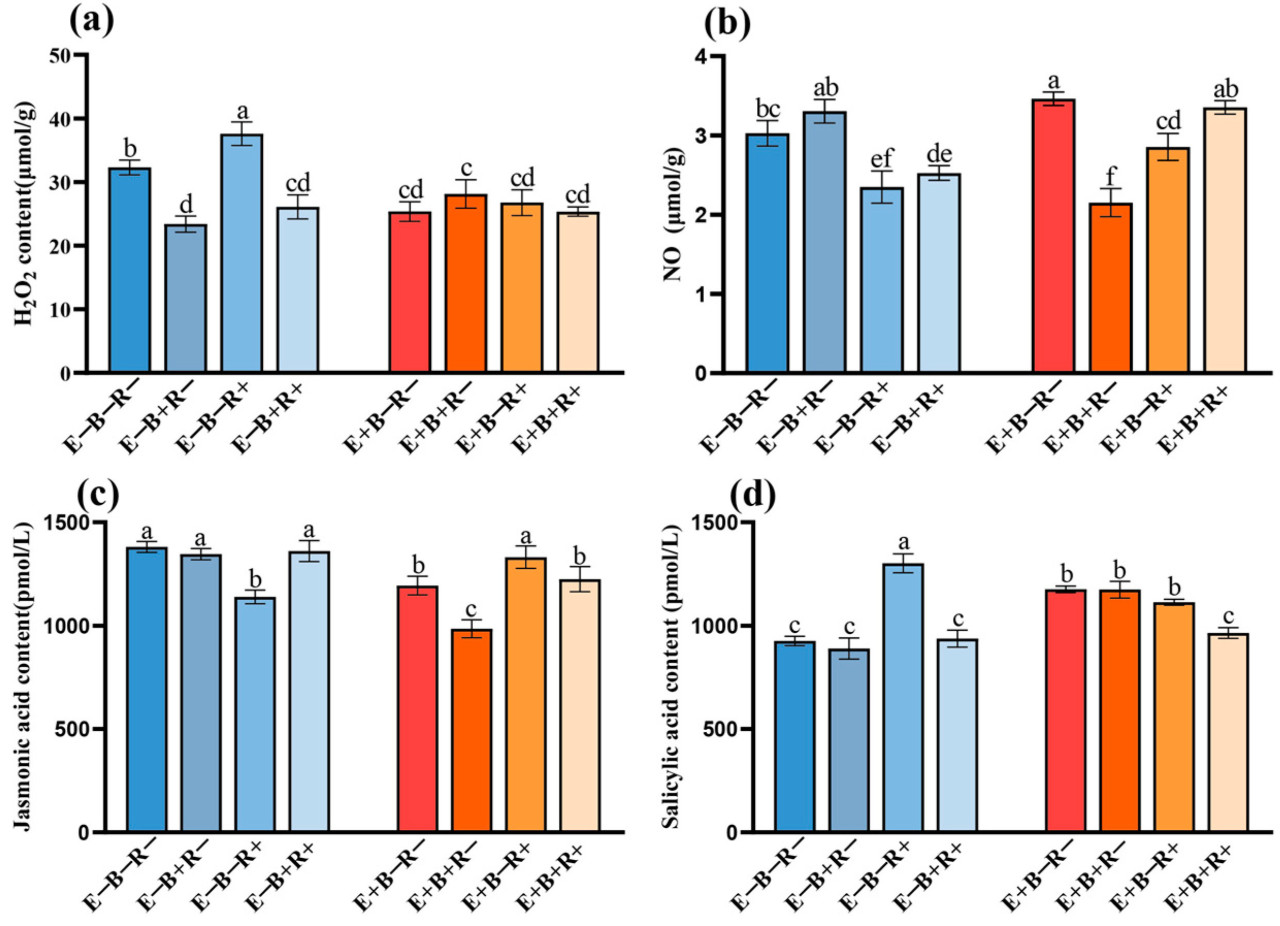
Трехфакторное взаимодействие эндофита злаков, B. sorokiniana и тли чрезвычайно значительно повлияло на содержание NO, SA и JA в райграсе ( таблица 1 ). Эндофит злаков, B. sorokiniana и тли значительно влияют на концентрацию H 2 O 2 в райграсе пастбищном. Концентрация H 2 O 2 была на 16,39% выше в райграсе, зараженном тлей (E−B−R+), по сравнению с контролем (E−B−R−). Патоген B. sorokiniana отдельно или в сочетании с тлёй значительно снизил концентрацию H 2 O 2 на 27,56% и 19,14% соответственно. Присутствие эндофита злаков (E+) значительно снизило концентрацию H 2 O 2 на 12,83~21,52%. Не было выявлено существенных различий в концентрации H 2 O 2 в райграсе, колонизированном эндофитами злаковых трав, независимо от наличия патогенной инфекции или заражения тлей ( рисунок 6 ).
Рисунок 6. Концентрации ( a ) перекиси водорода (H2O2 ) , ( b ) оксида азота (NO), ( c ) жасмоновой кислоты (JA) и ( d ) салициловой кислоты ( SA ) в райграсе пастбищном ( L. perenne ) , не инокулированном эндофитом злаков (E−) или инокулированном эндофитом злаков (E+), не инокулированном B. sorokiniana ( B− ) или инокулированном B. sorokiniana (B+), и незаражённом тлёй (R−) или заражённом тлёй (R+). Разные строчные буквы над чертой указывают на существенную разницу между обработками при уровне p < 0,05.
Эндофит травы (E+) значительно увеличил активность NO на 14,40%. Значения активности NO в вариантах E−B−R+, E-B+R+, E+B+R− и E+B-R+ были на 22,42%, 16,62%, 28,92% и 5,74% ниже, чем у контрольной группы (E−B−R−) ( p < 0,05) ( Рисунок 6 ). Активность JA в вариантах E−B−R+, E+B−R− и E+B+R− была на 17,51%, 13,54% и 28,66% ниже, чем у контрольной группы (E−B−R−). Взаимодействие эндофита злаков, B. sorokiniana и тли привело к значительному снижению концентрации СА на 11,31% ( рисунок 6 ).
Заражение тлей значительно увеличило активность СК на 40,63% у растения E−, которое получило наивысшее значение активности СК среди всех вариантов обработки. Изменение прямо противоположно изменению концентрации салициловой кислоты. Колонизация эндофитов злаковых трав, как изолированных, так и совместно с патогеном или тлёй, значительно увеличила активность СК на 26,97%, 26,84% и 20,25% соответственно ( рисунок 6 ).
3.5 Корреляционный анализ
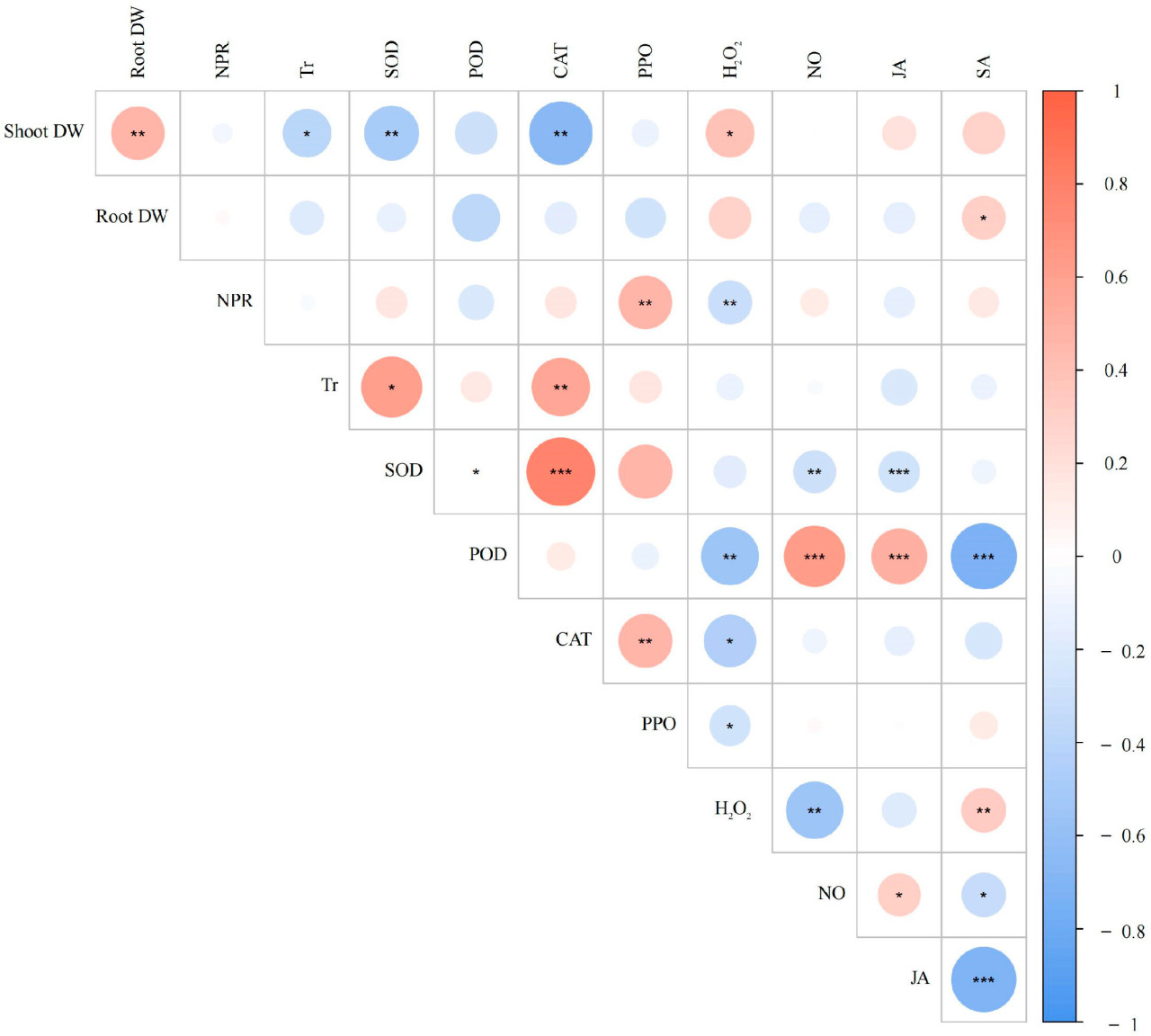
Корреляционный анализ показал, что сухой вес побегов демонстрировал значительную отрицательную корреляцию с интенсивностью транспирации, активностью СОД и активностью КАТ. Напротив, сухой вес побегов демонстрировал значительную положительную корреляцию с сухой массой корней и содержанием перекиси водорода. Кроме того, сухой вес корней положительно коррелировал с содержанием СК. Чистая скорость фотосинтеза демонстрировала значительную положительную корреляцию с содержанием ППО, в то время как она демонстрировала значительную отрицательную корреляцию с уровнем перекиси водорода. Более того, скорость транспирации положительно коррелировала с активностью как СОД, так и КАТ ( рисунок 7 ).
Рисунок 7. График корреляционного анализа показателей измерений. Положительная корреляция между двумя факторами выделена красным цветом, отрицательная корреляция между двумя факторами выделена синим цветом. Значимые различия отмечены звёздочкой (* p < 0,05; ** p < 0,01; *** p < 0,001).
3.6 Избирательное поведение тли
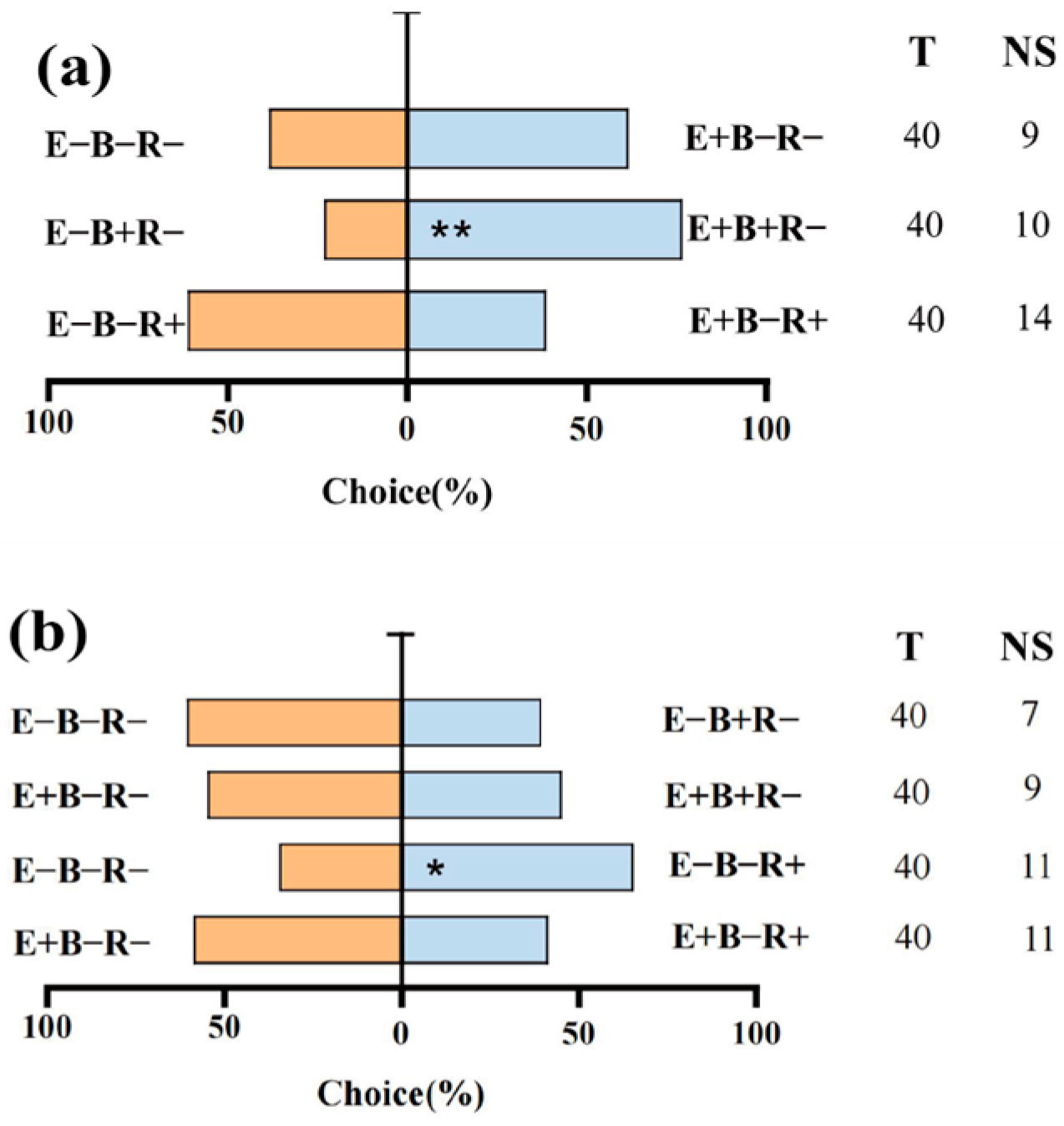
В обонятельном тесте выбора 74,64% протестированной тли сделали выбор среди различных обработок, предложенных для отбора по аромату воздушного потока. Колонизация эндофита злаков с заражением растений B. sorokiniana (E+B+) значительно привлекла тлю по сравнению с растениями E−B+ (23,33% против 76,67%). Аналогичным образом, тлю предпочитали растения E+ по сравнению с растениями E− (34,48% против 65,52%). Однако тля не проявила предпочтения к растению, колонизированному эндофитом злаков. Вместо этого они отдают предпочтение райграсу, который был предварительно заражен тлёй. Кроме того, тля также не проявила предпочтения к райграсу без эндофита злаков независимо от того, был ли он заражен патогеном или нет ( Рисунок 8 ).
Рисунок 8. ( a ) Селективное поведение тли по отношению к группам E−B−R− против E+B−R−, E−B+R− против E+B+R−, E−B−R+ против E+B−R+ райграс пастбищный ( L. perenne ). ( b ) Селективное поведение тли по отношению к группам E−B−R− против E−B+R−, E+B−R− против E+B+R−, E−B−R− против E−B−R+, E+B−R− против E+B−R+ райграс пастбищный. Столбцы T и NS показывают общее количество протестированной тли и количество тли, не сделавшей выбор, соответственно. E−, райграс пастбищный без эндофита злаков; E+, райграс пастбищный с эндофитом злаков; B−, райграс пастбищный, не зараженный патогеном ( B. sorokiniana ); B+, райграс пастбищный, зараженный патогеном ( B. sorokiniana ); R−, райграс пастбищный, не зараженный тлёй ( R. maidis ); R+, райграс пастбищный, зараженный тлёй ( R. maidis ). Значимое различие отмечено звездочкой (* p < 0,05; ** p < 0,01).
3.7. Корреляционный анализ избирательного поведения тли
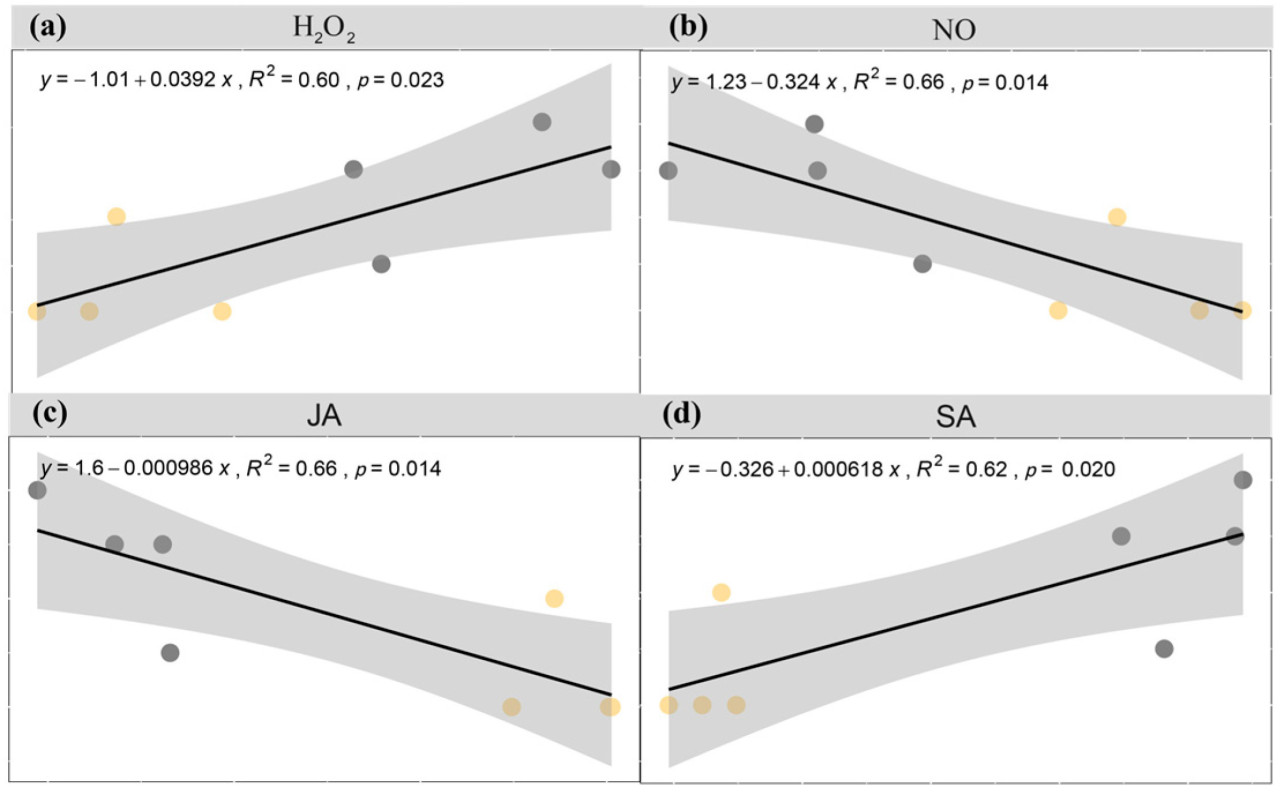
Тля проявила значительное предпочтение к предварительно зараженному райграсу в селекционных тестах E−B−R− и E−B−R+. Корреляционный анализ показал, что это предпочтение положительно коррелировало с содержанием перекиси водорода и СК, в то время как оно демонстрировало значительную отрицательную корреляцию с уровнями NO и JA ( рисунок 9 ).
Рисунок 9. Корреляционный анализ селективного поведения тли по отношению к E − B −R− и E − B− R + с перекисью водорода (H₂O₂ ) , оксидом азота (NO₂), жасмоновой кислотой (JA) ( c ) и салициловой кислотой (SA) ( d ). Две разноцветные точки представляют значения данных для райграса пастбищного на горшок для этих двух обработок.
4. Обсуждение
Чтобы понять, как эндофит травы влияет на устойчивость райграса пастбищного к заражению патогенами и последующему заражению насекомыми-вредителями, мы оценили физиологические и биохимические показатели, включая биомассу, активность защитных ферментов растений, показатели фотосинтеза и сигнальные соединения. Используя патоген B. sorokiniana , тлю R. maidis и райграс пастбищный с эндофитом травы Epichloë и без него в эксперименте в теплице, мы выявили, что эндофит травы снижал негативное воздействие патогена, тли или их комбинации на активность SOD, POD, CAT, PPO и концентрации H 2 O 2 , NO, SA и JA в райграсе пастбищном. Кроме того, эндофиты травы, ко-инфицированные патогенами, значительно привлекали пищевые предпочтения тли, причем райграс, предварительно зараженный тлёй, был более привлекательным для последующего питания тли. Кроме того, предпочтение тли предварительно заражённому райграсу показало положительную корреляцию с уровнями H₂O₂ и СА , а также значимую отрицательную корреляцию с концентрацией оксида азота (NO) и JA. Наша гипотеза о том , что эндофиты злаков могут смягчать комбинированное воздействие патогенов и тли на райграс пастбищный, изменяя активность защитных ферментов растений и сигнальных веществ, в то время как коинфекция эндофитов злаков патогенами влияет на пищевые предпочтения тли, подтвердилась.
Возбудитель пятнистости листьев B. sorokiniana значительно повлиял на рост райграса, что привело к значительному сокращению надземной биомассы. Это согласуется с данными Ли и соавторов [ 48 ], которые также обнаружили, что B. sorokiniana значительно снижала сухую массу райграса при разных вариантах обработки. Заражение тлей не оказало существенного влияния на биомассу райграса, что, вероятно, было связано с кратковременностью питания тли и их низкой численностью на растение.
Эндофит злаков значительно увеличил скорость фотосинтеза райграса, и это увеличение еще больше усилилось при заражении патогеном или заражении тлёй. Это указывает на то, что колонизация эндофитами злаков приводит к повышению эффективности фотосинтеза, тем самым повышая устойчивость к болезням и вредителям. Результаты согласуются с данными Ли и соавторов, которые обнаружили, что микоризные грибы, а также эндофит злаков Epichloë , значительно увеличили чистую скорость фотосинтеза райграса более чем на 172,5% при всех содержаниях влаги в почве [ 49 ]. Колонизация эндофитом Epichloë typhina увеличивает эффективность фотосинтеза Dactylis glomerata за счет повышения скорости усвоения углерода и фотохимии ФСII для удовлетворения более высокой потребности в энергии D. glomerata [ 50 ]. Напротив, взаимодействие эндофитов злаков, патогенов и насекомых привело к снижению эффективности фотосинтеза по сравнению с двумя предыдущими группами. Предполагается, что роль эндофитов злаков снижается из-за двойного воздействия вредителей и болезней.
Инфицирование B. sorokiniana увеличило содержание СОД и КАТ, которое еще больше увеличилось в присутствии эндофита злака. Это показывает, что эндофит злака помогает растению-хозяину противостоять заражению патогеном, увеличивая содержание СОД и КАТ. Тянь и др. аналогичным образом обнаружили, что активность СОД райграса была увеличена эндофитом злака под воздействием грибковых патогенов Alternaria alternata , Bipolaris sorokiniana , Curvularia lunata и Fusarium acuminatum . Патогены C. lunata и B. sorokiniana также вызывали значительно более высокую активность защитных ферментов ПОД в растениях, инфицированных эндофитом злака, чем в незараженных растениях [ 51 ].
Активность защитных ферментов райграса увеличивалась при совместном заражении патогеном и тлёй. Интересно, что при совместном заражении патогеном и тлёй райграса с эндофитом злаков активность защитных ферментов райграса снижалась по сравнению с предыдущим повышением, что позволяет предположить, что эндофит злаков мог повысить устойчивость райграса, устраняя необходимость в дальнейшем повышении активности защитных ферментов для защиты от двойного стресса, вызванного патогеном и тлёй. Корреляционный анализ выявил значимую отрицательную связь между сухой массой побега и скоростью транспирации, активностью СОД и КАТ, что позволяет предположить, что эндофиты злаков изменяют баланс между ростом и защитой растения в ответ на атаки патогена и тли.
Кроме того, эндофит злаков проявляет большее сродство к своему хозяину, чем грибы из почвы или других сред. Они с большей вероятностью колонизируют и размножаются внутри тела растения, тем самым обеспечивая растению повышенную защиту и пользу [ 52 ]. Взаимодействия между растением и патогеном динамичны и развиваются, при этом успешность заражения определяется комбинацией нескольких сигнальных путей [ 33 ], включая накопление аэробного метаболизма, которое нарушает окислительно-восстановительное состояние белков и других молекул, которые необходимы для клеточной сигнализации [ 53 , 54 ]. Наши результаты показали, что концентрации перекиси водорода (H 2 O 2 ) были значительно снижены во всех райграсах, колонизированных эндофитом злаков. Нассими и Тахери обнаружили, что эндофит Piriformospora indica снизил содержание перекиси водорода в рисе, тем самым повысив устойчивость к возбудителю гниения обвертки Rhizoctonia solani AG1-IA [ 55 ]. Примечательно, что коинфекция эндофитом злаков и B. sorokiniana привела к самому значительному снижению активности NO – на 28,92%. Во всех других вариантах обработки содержание оксида азота было значительно выше в растениях E+, чем в растениях E−. Сье и др. обнаружили, что эндофит Phomopsis liquidambari может усиливать взаимодействие арахиса и Bradyrhizobium, усиливая перекрестные сигналы, зависящие от H2O2 /NO, что способствует устранению барьеров, связанных с культурой, за счет усиления клубенькового образования арахиса и фиксации N2 [ 56 ] .
Растительные гормоны салициловая кислота (SA) и жасмоновая кислота (JA) играют решающую роль в защитных реакциях растений на патогены и насекомых-травоядных [ 57 , 58 , 59 , 60 ]. В этом эксперименте уровни JA были значительно ниже в многолетнем райграсе, колонизированном эндофитом злаков, когда патоген присутствовал, во время взаимодействия патогена с тлёй и даже при отсутствии заражения. Напротив, исследование, проведенное Хе и соавторами, показало, что многолетнее дерновинное злак, содержащее эндофитный гриб Epichloe gansuensis, противодействовало пути SA, увеличивая уровни JA во время питания тли Rhopalosiphum padi [ 61 ]. Отключая механизм SA ингибирования роста растений, опосредованный травоядными, эндофит индуцировал толерантность растений к травоядным. Предполагается, что причина различий может быть связана с видами эндофитов и растений злаков.
Биотрофные патогены и сосущие насекомые считаются эффективным механизмом модуляции содержания СА для изменения устойчивости растений [ 57 , 62 , 63 ]. В этом эксперименте содержание СА в райграсе было значительно повышено, когда эндофит травы взаимодействовал с патогеном и тлей, а также когда не было взаимодействия со стрессорами. Интересно, что когда тля заражала райграс, содержание СА значительно увеличивалось, однако, когда эндофит травы взаимодействовал с тлей, это повышение ослабевало, что указывает на то, что эндофиты смягчали влияние заражения тлей на уровни СА в райграсе. Коу и др. Также было обнаружено, что при заражении Achnatherum inebrians, содержащего эндофит травы Epichloë gansuensis, биотрофным патогеном Blumeria graminis , эндофит травы увеличивал содержание СА и уровни экспрессии генов в ответ на гормоны СА для повышения устойчивости к патогену [ 64 ]. Скотт и др. обнаружили, что тля ( Rhopalosiphum padi ) вызывала более высокие концентрации СА, которые подавляли концентрации ЖАК в модельной траве Brachypodium distachyon . Как колонизация эндофитов травы, так и заражение тлей увеличивали содержание СА в райграсе пастбищном, но взаимодействие между эндофитами и тлёй замедляло тенденцию к увеличению содержания СА [ 65 ].
Результаты теста на селекцию тли показали, что райграс, содержащий эндофит злаков, значительно привлекал тлю при инокуляции B. sorokiniana . Аналогичным образом, райграс с эндофитом злаков предпочитался тлёй при инокуляции патогенными грибами. Исследование Ганжа показало, что Acer pseudoplatanus , который является носителем эндофитного гриба Rhytisma acerinum , положительно влиял на популяции тли, что приводило к увеличению количества тли на зараженных листьях в конце лета [ 66 ]. Хэммон и Фэт предположили, что травоядные животные позднего сезона могут адаптироваться к химическим веществам, вызываемым или производимым эндофитами в растении-хозяине, тем самым показывая лучшие результаты на зараженных листьях [ 67 ]. Наше исследование также показало, что тля отдавала значительное предпочтение предварительно зараженному райграсу. Это предпочтение положительно коррелировало с содержанием перекиси водорода и СК, а также значительно отрицательно коррелировало с содержанием оксида азота и ДЖК. Это свидетельствует о том, что индуцированная защитная реакция растения-хозяина, вызванная предшествующим заражением тлей, играет решающую экологическую роль в формировании последующих пищевых предпочтений вредителя.
Исследования показали, что мух Botanophila привлекает сесквитерпеновый спирт chokol K, выделяющийся из стромы Anthoxanthum odoratum, колонизированного Epichloë sylvatica [ 68 ]. Более высокие уровни 1-октен-3-ола были получены в листовых влагалищах колонизированной овсяницы тростниковой ( Festuca arundinacea Schreb.), колонизированной эндофитами [ 69 ]. С точки зрения растения, одним из защитных последствий установления симбиотических взаимодействий с этими микроорганизмами является то, что симбиотические растения часто более уязвимы для биотрофных патогенов и определенных видов насекомых, сосущих сок [ 70 , 71 ]. Результаты теста на селекцию тли также согласуются с этими результатами. Однако исследований, посвященных влиянию эндофитных грибов на питание насекомых после заражения патогенами, меньше. Необходимы дальнейшие исследования для выяснения механизма влияния эндофитов злаков на взаимодействие патогенов и насекомых-вредителей. В будущих исследованиях следует также сосредоточиться на изучении взаимодействия между динамикой эндофитов растений и злаков, в частности, на влиянии симбиотических эндофитов злаков на механизмы устойчивости райграса к взаимодействию патогенов и тли. Это позволит лучше понять оптимизацию стратегий защиты растений. Кроме того, изучение экологических последствий индуцированных защитных реакций на предпочтения вредителей в питании улучшит наше понимание комплексных подходов к борьбе с вредителями в сельскохозяйственных системах.
5. Выводы
В настоящем исследовании подчеркивается влияние эндофита злаков ( Epichloë ) на защитные ферменты, гормоны и другие показатели райграса в ответ на пятнистости листьев, тли и их комбинации. Наши результаты показали, что эндофиты злаков значительно повышают устойчивость райграса пастбищного к пятнистости листьев и влияют на пищевые предпочтения тли. Эндофиты злаков заметно повышают чистую эффективность фотосинтеза и активность защитных ферментов растений (СОД и КАТ). В то время как инфекции патогенов и тли снижают уровни JA и SA, эндофит злаков увеличивает концентрацию SA, что указывает на изменение в защитной стратегии растения. Кроме того, тля показывают предпочтение райграсу, предварительно зараженному тлёй, что коррелирует с концентрациями перекиси водорода, NO, SA и JA, что позволяет предположить, что индуцированная защитная реакция растения-хозяина, вызванная предшествующим заражением тлёй, играет решающую экологическую роль в формировании последующих пищевых предпочтений вредителей. В целом, эндофиты злаков не только смягчают физиологическое воздействие патогенов и тли, но и изменяют пищевое поведение вредителей, что предполагает потенциальную стратегию борьбы с вредителями и болезнями в сельскохозяйственной практике.
Ссылки
1. Zhang, L.Y.; Huang, X.; Liu, Y.R.; Ma, N.; Li, D.Y.; Hu, Q.N.; Zhang, W.J.; Wang, K.H. MicroRNA164 regulates perennial ryegrass (Lolium perenne L.) adaptation to changing light intensity. Agronomy 2024, 14, 1142. [Google Scholar] [CrossRef]
2. Ahloowalia, B.S. Hybrids between tetraploid Italian and perennial ryegrass. Theor. Appl. Genet. 1977, 49, 229–235. [Google Scholar] [CrossRef] [PubMed]
3. Taleb, M.H.; Majidi, M.M.; Pirnajmedin, F.; Maibody, S.A.M.M. Plant functional trait responses to cope with drought in seven cool-season grasses. Sci. Rep. 2023, 13, 5285. [Google Scholar] [CrossRef] [PubMed]
4. Kulczycki, G.; Sacała, E.; Koszelnik-Leszek, A.; Milo, Ł. Perennial Ryegrass (Lolium perenne L.) response to different forms of sulfur fertilizers. Agriculture 2023, 13, 1773. [Google Scholar] [CrossRef]
5. Ying, C.Y.; Li, L.X.; Makeen, G.M.H.; Liu, Y.B. Erosion control of Chinese loess using polymer SH and ryegrass. J. Mt. Sci. 2024, 21, 2043–2058. [Google Scholar] [CrossRef]
6. Scordia, D.; Cosentino, S.L. Perennial energy grasses: Resilient crops in a changing European agriculture. Agriculture 2019, 9, 169. [Google Scholar] [CrossRef]
7. Dąbrowski, P.; Pawluśkiewicz, B.; Kalaji, H.M.; Baczewska, A.H. The effect of light availability on leaf area index, biomass production and plant species composition of park grasslands in Warsaw. Plant Soil. Environ. 2013, 59, 543–548. [Google Scholar] [CrossRef]
8. Żurek, G.; Wiewiórka, B.; Rybka, K.; Prokopiuk, K. Different response of perennial ryegrasss–Epichloë endophyte symbiota to the elevated concentration of heavy metals in soil. J. Appl. Gen. 2022, 63, 47–59. [Google Scholar] [CrossRef]
9. Altpeter, F. Perennial ryegrass (Lolium perenne L.). Agrobacterium Protoc. 2007, 2, 55–64. [Google Scholar]
10. Jo, Y.K.; Barker, R.; Pfender, W.; Warnke, S.; Sim, S.C.; Jung, G.H. Comparative analysis of multipledisease resistance in ryegrass and cereal crops. Theor. Appl. Genet. 2008, 117, 531–543. [Google Scholar] [CrossRef]
11. Boutaj, H.; Meddich, A.; Roche, J.; Mouzeyar, S.; Modafar, C.E. The effects of mycorrhizal fungi on vascular wilt diseases. Crop. Prot. 2022, 155, 105938. [Google Scholar] [CrossRef]
12. Smiley, R.W.; Gourlie, J.A.; Easley, S.A.; Patterson, L.M. Pathogenicity of fungi associated with the wheat crown rot complex in Oregon and Washington. Plant Dis. 2005, 89, 949–957. [Google Scholar] [CrossRef]
13. Iftikhar, S.; Asad, S.; Munir, A.; Sultan, A.; Ahmad, I. Hosts of Bipolaris sorokiniana, the major pathogen of spot blotch of wheat in Pakistan. Pak. J. Bot. 2009, 41, 1433–1436. [Google Scholar]
14. Hewitt, K.G.; Hofmann, R.W.; Ball, O.J.; Cox, N.; Bryant, R.H.; Finch, S.C.; Popay, A.J. Root aphid (Aploneura lentisci) population size on perennial ryegrass is determined by drought and endophyte strain. J. Pest. Sci. 2024, 97, 369–384. [Google Scholar] [CrossRef]
15. Bell, N.L.; Townsend, R.J.; Popay, A.I.; Mercer, C.F.; Jackson, T.A. Black beetle: Lessons from the past and options for the future. Pasture Persistence Symp. 2011, 15, 119–124. [Google Scholar] [CrossRef]
16. Ferguson, C.M.; Barratt, B.I.P.; Bell, N.; Goldson, S.L.; Hardwick, S.; Jackson, M.; Jackson, T.A.; Phillips, C.B.; Popay, A.J.; Rennie, G.; et al. Quantifying the economic cost of invertebrate pests to New Zealand’s pastoral industry. N. Z. J. Agric. Res. 2019, 62, 255–315. [Google Scholar] [CrossRef]
17. Popay, A.J.; Gerard, P.J. Cultivar and endophyte effects on a root aphid Aploneura lentisci in perennial ryegrass. N. Z. Plant Prot. 2007, 60, 223–237. [Google Scholar] [CrossRef]
18. Popay, A.J.; Cox, N.R. Aploneura lentisci (Homoptera: Aphididae) and its interactions with fungal endophytes in perennial ryegrass (Lolium perenne). Front. Plant Sci. 2016, 7, 1395. [Google Scholar] [CrossRef] [PubMed]
19. Muller, J.L. A Study of Root Aphid Aploneura lentisci Pass. Biology and Root Aphid-Host Interactions with Perennial Ryegrass/Endophyte Associations in New Zealand. Doctoral Dissertation, Massey University, Palmerston North, New Zealand, 2019. [Google Scholar]
20. Popay, A.J.; Hume, D.E.; Mace, W.J.; Faville, M.J.; Finch, S.C.; Cave, V. A root aphid Aploneura lentisci is affected by Epichloë endophyte strain and impacts perennial ryegrass growth in the field. Crop Pasture Sci. 2021, 72, 155–164. [Google Scholar] [CrossRef]
21. Cisternas, E. Plagas claves en la producción de praderas. In Seminario Praderas: Haciaunnuevo Estilo Productivo; Serie Actas; Instituto de Investigaciones Agropecuarias, Centro Regional de Investigación Remehue: Osorno, Chile, 2001; Volume 9, pp. 48–57. [Google Scholar]
22. Siegel, M.R.; Latch, G.C.M.; Johnson, M.C. Fungal endophytes of grasses. Annu. Rev. Phytopathol. 1987, 25, 293–315. [Google Scholar] [CrossRef]
23. Clay, K.; Schardl, C. Evolutionary origins and ecological consequences of endophyte symbiosis with grasses. Am. Nat. 2002, 160, S99–S127. [Google Scholar] [CrossRef] [PubMed]
24. West, C.P.; Izekor, E.; Turner, K.E.; Elmi, A.A. Endophyte effects on growth and persistence of tall fescue along a water-supply gradient. Agron. J. 1993, 85, 264–270. [Google Scholar] [CrossRef]
25. Barker, G.M. Mycorrhizal infection influences Acremonium-induced resistance to argentine stem weevil inryegrass. In Proceedings of the New Zealand Weed and Pest Control Conference, Wellington, New Zealand, 1–13 August 1987; pp. 199–203. [Google Scholar]
26. Vicari, M.; Hatcher, P.E.; Ayres, P.G. Combined effect of foliar and mycorrhizal endophytes on an insect herbivore. Ecology 2002, 83, 2452–2464. [Google Scholar] [CrossRef]
27. Tian, Z. Effects of Epichloë Festucae Fungal Endophyte Infection in Strong Creeping Red Fescue on Abiotic and Biotic Stresses; Rutgers The State University of New Jersey, School of Graduate Studies: New Brunswick, NJ, USA, 2017. [Google Scholar]
28. Ma, M.Z.; Christensen, M.J.; Nan, Z.B. Effects of the endophyte Epichloë festucae, var. lolii, of perennial ryegrass (Lolium perenne) on indicators of oxidative stress from pathogenic fungi during seed germination and seedling growth. Eur. J. Plant Pathol. 2015, 141, 571–583. [Google Scholar] [CrossRef]
29. Scott, B. Epichloë endophytes: Fungal symbionts of grasses. Curr. Opin. Microbiol. 2001, 4, 393–398. [Google Scholar] [CrossRef]
30. Shymanovich, T.; Saari, S.; Lovin, M.E.; Jarmusch, A.K.; Jarmusch, S.A.; Musso, A.M.; Charlton, N.D.; Young, C.A.; Cech, N.B.; Faeth, S.H. Alkaloid variation among epichloid endophytes of sleepygrass (Achnatherum robustum) and consequences for resistance to insect herbivores. J. Chem. Ecol. 2015, 41, 93–104. [Google Scholar] [CrossRef] [PubMed]
31. Züst, T.; Agrawal, A.A. Mechanisms and evolution of plant resistance to aphids. Nat. Plants 2016, 2, 15206. [Google Scholar] [CrossRef] [PubMed]
32. Upadhyay, R.; Saini, R.; Shukla, P.K.; Tiwari, K.N. Role of secondary metabolites in plant defense mechanisms: A molecular and biotechnological insights. Phytochem. Rev. 2024, 1–31. [Google Scholar] [CrossRef]
33. Gogoi, K.; Gogoi, H.; Borgohain, M.; Saikia, R.; Chikkaputtaiah, C.; Hiremath, S.; Basu, U. The molecular dynamics between reactive oxygen species (ROS), reactive nitrogen species (RNS) and phytohormones in plant’s response to biotic stress. Plant Cell Rep. 2024, 43, 263. [Google Scholar] [CrossRef] [PubMed]
34. Li, F.; Guo, Y.E.; Christensen, M.J.; Gao, P.; Li, Y.Z.; Duan, T.Y. An arbuscular mycorrhizal fungus and Epichloë festucae var. lolii reduce Bipolaris sorokiniana disease incidence and improve perennial ryegrass growth. Mycorrhiza 2018, 28, 159–169. [Google Scholar] [CrossRef]
35. Li, Y.D.; Duan, T.Y.; Li, Y.Z. Research progress in the interactions of fungal pathogens and insect pests during host plant colonization. J. Plant Dis. Protect. 2021, 128, 633–647. [Google Scholar] [CrossRef]
36. Jindřichová, B.; Rubil, N.; Rezek, J.; Ourry, M.; Hauser, T.P.; Burketová, L. Does fungal infection increase the palatability of oilseed rape to insects? Pest. Manag. Sci. 2024, 80, 2480–2494. [Google Scholar] [CrossRef] [PubMed]
37. Cardoza, Y.J.; Tumlinson, J.H. Compatible and incompatible Xanthomonas infections differentially affect herbivore-induced volatile emission by pepper plants. J. Chem. Ecol. 2006, 32, 1755–1768. [Google Scholar] [CrossRef]
38. Mann, R.S.; Ali, J.G.; Hermann, S.L.; Tiwari, S.; Pelz-Stelinski, K.S.; Alborn, H.T.; Stelinski, L.L. Induced release of a plant-defense volatile ‘deceptively’attracts insect vectors to plants infected with a bacterial pathogen. PLoS Pathog. 2012, 8, e1002610. [Google Scholar] [CrossRef] [PubMed]
39. Yang, K.; Guo, S.S.; Zhang, W.J.; Wang, C.F.; HAN, J.; Geng, Z.F.; Wu, Y.; Du, S.S.; Deng, Z.W. Repellent activity of Glycosmis plant extracts against two stored product insects. In Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas; Universidad de Santiago de Chile: Santiago, Chile, 2015; Volume 14, pp. 462–469. [Google Scholar]
40. Meyling, N.V.; Pell, J.K.; Eilenberg, J. Dispersal of Beauveria bassiana by the activity of nettle insects. J. Invertebr. Pathol. 2006, 93, 121–126. [Google Scholar] [CrossRef]
41. Li, Y.D.; Nan, Z.B.; Matthew, C.; Wang, Y.J.; Duan, T.Y. Arbuscular mycorrhizal fungus changes alfalfa (Medicago sativa) metabolites in response to leaf spot (Phoma medicaginis) infection, with subsequent effects on pea aphid (Acyrthosiphon pisum) behavior. New Phytol. 2023, 239, 286–300. [Google Scholar] [CrossRef]
42. Ellsbury, M.M.; Pratt, R.G.; Knight, W.E. Effects of single and combined infection of arrowleaf clover with bean yellow mosaic virus and a Phytophthora sp. on reproduction and colonization by pea aphids (Homoptera: Aphididae). Environ. Entomol. 1985, 14, 356–359. [Google Scholar] [CrossRef]
43. Cakmak, I.; Marschner, H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase, and glutathione reductase in bean leaves. Plant Physiol. 1992, 98, 1222–1227. [Google Scholar] [CrossRef]
44. Zhao, Y.; Li, Y.S.; Gao, X.F. A new method for accurate determination of peroxidase activity based on fluorescence decrease of guaiacol. Chin. J. Anal. Chem. 2015, 43, 1040–1046. [Google Scholar]
45. Jiang, Z.; Weng, B.; Lei, J.; Wang, Y.; Tang, X.; Xiao, S. Effect of exogenous zinc addition on cell protective enzyme activities in the fruit bodies of Lentinus giganteus. Acta Microb. Sin. 2009, 49, 1121–1125. [Google Scholar]
46. Willekens, H.; Chamnongpol, S.; Davey, M.; Schraudner, M.; Langebartels, C.; Montagu, M.V.; Inzé, D.; Camp, W.V. Catalase is a sink for H2O2 and is indispensable for stress defence in C3 plants. EMBO J. 1997, 16, 4806–4816. [Google Scholar] [CrossRef] [PubMed]
47. Sofy, A.R.; Sofy, M.R.; Hmed, A.A.; Dawoud, R.A.; Refaey, E.E.; Mohamed, H.I.; El-Dougdoug, N.K. Molecular characterization of the Alfalfa mosaic virus infecting Solanum melongena in Egypt and the control of its deleterious effects with melatonin and salicylic acid. Plants 2021, 10, 459. [Google Scholar] [CrossRef]
48. Li, F.; Duan, T.Y.; Li, Y.Z. Effects of the fungal endophyte Epichloë festucae var. lolii on growth and physiological responses of perennial ryegrass cv. fairway to combined drought and pathogen stresses. Microorganisms 2020, 8, 1917. [Google Scholar] [CrossRef] [PubMed]
49. Li, F.; Deng, J.; Nzabanita, C.; Li, Y.Z.; Duan, T.Y. Growth and physiological responses of perennial ryegrass to an AMF and an Epichloë endophyte under different soil water contents. Symbiosis 2019, 79, 151–161. [Google Scholar] [CrossRef]
50. Rozpądek, P.; Wężowicz, K.; Nosek, M.; Ważny, R.; Tokarz, K.; Lembicz, M.; Miszalski, Z.; Turnau, K. The fungal endophyte Epichloë typhina improves photosynthesis efficiency of its host orchard grass (Dactylis glomerata). Planta 2015, 242, 1025–1035. [Google Scholar] [CrossRef] [PubMed]
51. Tian, P.; Nan, Z.B.; Li, C.J.; Spangenberg, G. Effect of the endophyte Neotyphodium lolii on susceptibility and host physiological response of perennial ryegrass to fungal pathogens. Eur. J. Plant Pathol. 2008, 122, 593–602. [Google Scholar] [CrossRef]
52. Backman, P.A.; Sikora, R.A. Endophytes: An emerging tool for biological control. Biol. Control. 2008, 46, 1–3. [Google Scholar] [CrossRef]
53. Hoye, A.T.; Davoren, J.E.; Wipf, P.; Fink, M.P.; Kagan, V.E. Targeting mitochondria. Acc. Chem. Res. 2008, 41, 87–97. [Google Scholar] [CrossRef] [PubMed]
54. Spoel, S.H.; Loake, G.J. Redox-based protein modifcations: The missing link in plant immune signalling. Curr. Opin. Plant Biol. 2011, 14, 358–364. [Google Scholar] [CrossRef] [PubMed]
55. Nassimi, Z.; Taheri, P. Endophytic fungus Piriformospora indica induced systemic resistance against rice sheath blight via affecting hydrogen peroxide and antioxidants. Biocontrol Sci. Technol. 2017, 27, 252–267. [Google Scholar] [CrossRef]
56. Xie, X.G.; Fu, W.Q.; Zhang, F.M.; Shi, X.M.; Zeng, Y.T.; Li, H.; Zhang, W.; Dai, C.C. The endophytic fungus Phomopsis liquidambari increases nodulation and N2 fixation in Arachis hypogaea by enhancing hydrogen peroxide and nitric oxide signalling. Microb. Ecol. 2017, 74, 427–440. [Google Scholar] [CrossRef] [PubMed]
57. Ballaré, C.L. Light regulation of plant defense. Annu. Rev. Plant Biol. 2014, 65, 335–363. [Google Scholar] [CrossRef] [PubMed]
58. Bari, R.; Jones, J.D.G. Role of plant hormones in plant defence responses. Plant Mol. Biol. 2009, 69, 473–488. [Google Scholar] [CrossRef]
59. Pieterse, C.M.J.; Van der Does, D.; Zamioudis, C.; Leon-Reyes, A.; Van Wees, S.C.M. Hormonal modulation of plant immunity. Annu. Rev. Cell Dev. Biol. 2012, 28, 489–521. [Google Scholar] [CrossRef]
60. Thaler, J.S.; Humphrey, P.T.; Whiteman, N.K. Evolution of jasmonate and salicylate signal crosstalk. Trends Plant Sci. 2012, 17, 260–270. [Google Scholar] [CrossRef] [PubMed]
61. He, Y.L.; Chen, T.X.; Zhang, H.J.; White, J.F.; Li, C.J. Fungal endophytes help grasses to tolerate sap-sucking herbivores through a hormone-signaling system. J. Plant Growth Regul. 2022, 41, 2122–2137. [Google Scholar] [CrossRef]
62. Schwartzberg, E.G.; Tumlinson, J.H. Aphid honeydew alters plant defence responses. Funct. Ecol. 2014, 28, 386–394. [Google Scholar] [CrossRef]
63. Schweiger, R.; Heise, A.M.; Persicke, M.; Müller, C. Interactions between the jasmonic and salicylic acid pathway modulate the plant metabolome and affect herbivores of different feeding types. Plant Cell Environ. 2014, 37, 1574–1585. [Google Scholar] [CrossRef]
64. Kou, M.Z.; Bastías, D.A.; Bastías, M.J.; Zhong, R.; Nan, Z.B.; Zhang, X.X. The plant salicylic acid signalling pathway regulates the infection of a biotrophic pathogen in grasses associated with an Epichloë endophyte. J. Fungi 2021, 7, 633. [Google Scholar] [CrossRef] [PubMed]
65. Johnson, S.N.; Rowe, R.C.; Hall, C.R. Aphid feeding induces phytohormonal cross-talk without affecting silicon defense against subsequent chewing herbivores. Plants 2020, 9, 1009. [Google Scholar] [CrossRef] [PubMed]
66. Gange, A.C. Positive effects of endophyte infection on sycamore aphids. Oikos 1996, 75, 500–510. [Google Scholar] [CrossRef][Green Version]
67. Hammon, K.E.; Faeth, S.H. Ecology of plant-herbivore communities: A fungal component? Nat. Toxins 1993, 1, 197–208. [Google Scholar] [CrossRef] [PubMed]
68. Schiestl, F.P.; Steinebrunner, F.; Schulz, C.; Von Reuss, S.; Francke, W.; Weymuth, C.; Leuchtmann, A. Evolution of ‘pollinator’-attracting signals in fungi. Biol. Lett. 2006, 2, 401–404. [Google Scholar] [CrossRef]
69. Yue, Q.; Wang, C.; Gianfagna, T.J.; Meyer, W.A. Volatile compounds of endophyte-free and infected tall fescue (Festuca arundinacea Schreb.). Phytochemistry 2001, 58, 935–941. [Google Scholar] [CrossRef]
70. Hartley, S.E.; Gange, A.C. Impacts of plant symbiotic fungi on insect herbivores: Mutualism in a multitrophic context. Annu. Rev. Entomol. 2009, 54, 323–342. [Google Scholar] [CrossRef] [PubMed]
71. Pineda, A.; Dicke, M.; Pieterse, C.M.J.; Pozo, M.J. Beneficial microbes in a changing environment: Are they always helping plants to deal with insects? Funct. Ecol. 2013, 27, 574–586. [Google Scholar] [CrossRef]
Ma Z, He J, Shen Y, Li Y, Wang P, Duan T. Impact of Grass Endophyte on Leaf Spot in Perennial Ryegrass Caused by Bipolaris sorokiniana and Subsequent Aphids’ Feeding Preference. Agriculture. 2025; 15(2):116. https://doi.org/10.3390/agriculture15020116
Перевод статьи «Impact of Grass Endophyte on Leaf Spot in Perennial Ryegrass Caused byBipolaris sorokinianaand Subsequent Aphids’ Feeding Preference» авторов Ma Z, He J, Shen Y, Li Y, Wang P, Duan T., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык































































































Комментарии (0)