Прогресс в изучении механизмов смягчения селеном стресса от тяжелых металлов у сельскохозяйственных культур
В условиях быстрой индустриализации и модернизации сельского хозяйства проблема загрязнения тяжелыми металлами стала серьезной проблемой, представляющей существенную угрозу для здоровья человека и оказывающей глубокое влияние на сельскохозяйственное производство. Селен (Se), полезный микроэлемент для роста и развития сельскохозяйственных культур, оказывает множество благотворных эффектов, включая стимулирование фотосинтеза, улучшение физиологических характеристик, повышение питательной ценности, усиление антиоксидантных систем и модуляцию экспрессии генов, отвечающих на стресс. Примечательно, что селен играет ключевую роль в ослаблении стресса от тяжелых металлов у культур и эффективно снижает накопление последних в съедобных частях растений.
Аннотация
В данном исследовании изучаются физиологические и молекулярные механизмы, лежащие в основе способности селена смягчать стресс от тяжелых металлов у сельскохозяйственных культур. Кроме того, мы обсуждаем применение селеновых удобрений в сельскохозяйственной практике, а также влияние факторов окружающей среды на их эффективность. Наша цель — внести вклад в устойчивое развитие сельского хозяйства и производство безопасной, высококачественной сельскохозяйственной продукции, тем самым предоставив ценные идеи для развития функциональных селеновых отраслей и направляя сельскохозяйственную практику в регионах, пострадавших от загрязнения тяжелыми металлами.
1. Введение
Селен (Se) — незаменимый микроэлемент для человека и полезное питательное вещество для растений. Исследования показали, что в умеренных концентрациях Se способствует прорастанию семян [ 1 ], ускоряет рост рассады [ 2 ], усиливает развитие корневой системы, а также стимулирует цветение и плодоношение [ 3 ], тем самым повышая урожайность и качество сельскохозяйственных культур.
Более того, Se обладает способностью усиливать скорость фотосинтеза растений. Этот эффект в первую очередь обусловлен способностью Se регулировать активность и уровни экспрессии ферментов, связанных с фотосинтезом в листьях растений [ 4 ]. Следовательно, Se стимулирует синтез хлорофилла, одновременно снижая его деградацию, защищая фотосистему II от фотоокислительного повреждения. Это, в свою очередь, повышает как максимальный фотохимический квантовый выход (Fv/Fm), так и фактический фотохимический квантовый выход (ΦPSII), тем самым улучшая фотосинтетическую способность и общий потенциал роста растений [ 5 ]. Между тем, Кунья и соавторы обнаружили, что Se также может усиливать фотосинтез, увеличивая синтез хлорофилла, каротиноидов и феофитина посредством снижения уровня малонового диальдегида (МДА) и увеличения активности каталазы (КАТ) и аскорбатпероксидазы (АПХ) [ 6 ].
Между тем, Se играет ключевую роль в транспорте питательных веществ и метаболизме в растениях. Тамаоки и др. наблюдали, что Se может влиять на транспорт и усвоение серы в Arabidopsis thaliana [ 7 ]. Шахид и др. обнаружили, что Se способствует накоплению растворимых сахаров в картофеле, регулируя активность метаболизма сахара, метаболизма азота и гликолитических ферментов [ 8 ]. Это не только повышает устойчивость растений к стрессу, но и способствует накоплению питательных веществ. Более того, Ван и др. наблюдали, что внекорневое внесение удобрения Se положительно влияет на метаболизм углерода и азота в тканях листьев, что приводит к заметному снижению содержания Cd в зернах [ 9 ]. Это явление дополнительно способствует транслокации соответствующих метаболитов к корням, тем самым улучшая распределение и численность микроорганизмов почвы, связанных с метаболизмом азота.
Загрязнение сельскохозяйственных тяжелых металлов (ТМ) является серьезной экологической проблемой, с которой сталкивается современный мир. Свинец (Pb), кадмий (Cd) и ртуть (Hg) являются одними из основных ТМ, проникающих в сельскохозяйственные экосистемы различными путями, такими как сброс промышленных сточных вод [ 10 ], горнодобывающая деятельность [ 11 ], чрезмерное внесение удобрений и пестицидов [ 12 ] и атмосферные осаждения [ 13 ]. Это загрязнение представляет значительную угрозу для производительности сельского хозяйства, затрудняя развитие корней и усвоение питательных веществ в сельскохозяйственных культурах [ 14 ], нарушая фотосинтетические процессы в хлоропластах [ 15 ] и, в конечном итоге, приводя к снижению урожайности и качества сельскохозяйственных культур. Более того, накопление ТМ в сельскохозяйственных культурах может проникать в пищевую цепь, создавая риски для здоровья животных и людей, включая нейротоксичность [ 16 ], почечную недостаточность [ 17 ] и рак [ 18 ], среди прочих [ 19 ]. Экологические последствия загрязнения тяжелыми металлами имеют длительный характер, а естественные процессы восстановления часто занимают десятилетия [ 20 ], особенно для таких устойчивых и стойких металлов, как Cd и Hg [ 21 ].
Из-за таких факторов, как добыча полезных ископаемых и прогресс урбанизации, почва в центральных, южных и юго-западных регионах Китая страдает от относительно сильного загрязнения тяжелыми металлами [ 22 ]. Среди них, выборочное обследование, проведенное в рисопроизводящих районах бассейна реки Янцзы, показывает, что среди собранных образцов рисового зерна примерно 37% имеют загрязнение кадмием, а доли образцов, загрязненных свинцом и хромом (Cr), достигают 60% и 70% соответственно [ 23 ]. Сообщается, что Китай теряет 1 000 000 тонн продукции растениеводства каждый год из-за загрязнения тяжелыми металлами [ 24 ]. Поэтому решение проблемы загрязнения тяжелыми металлами в сельском хозяйстве является крайне важным и безотлагательным.
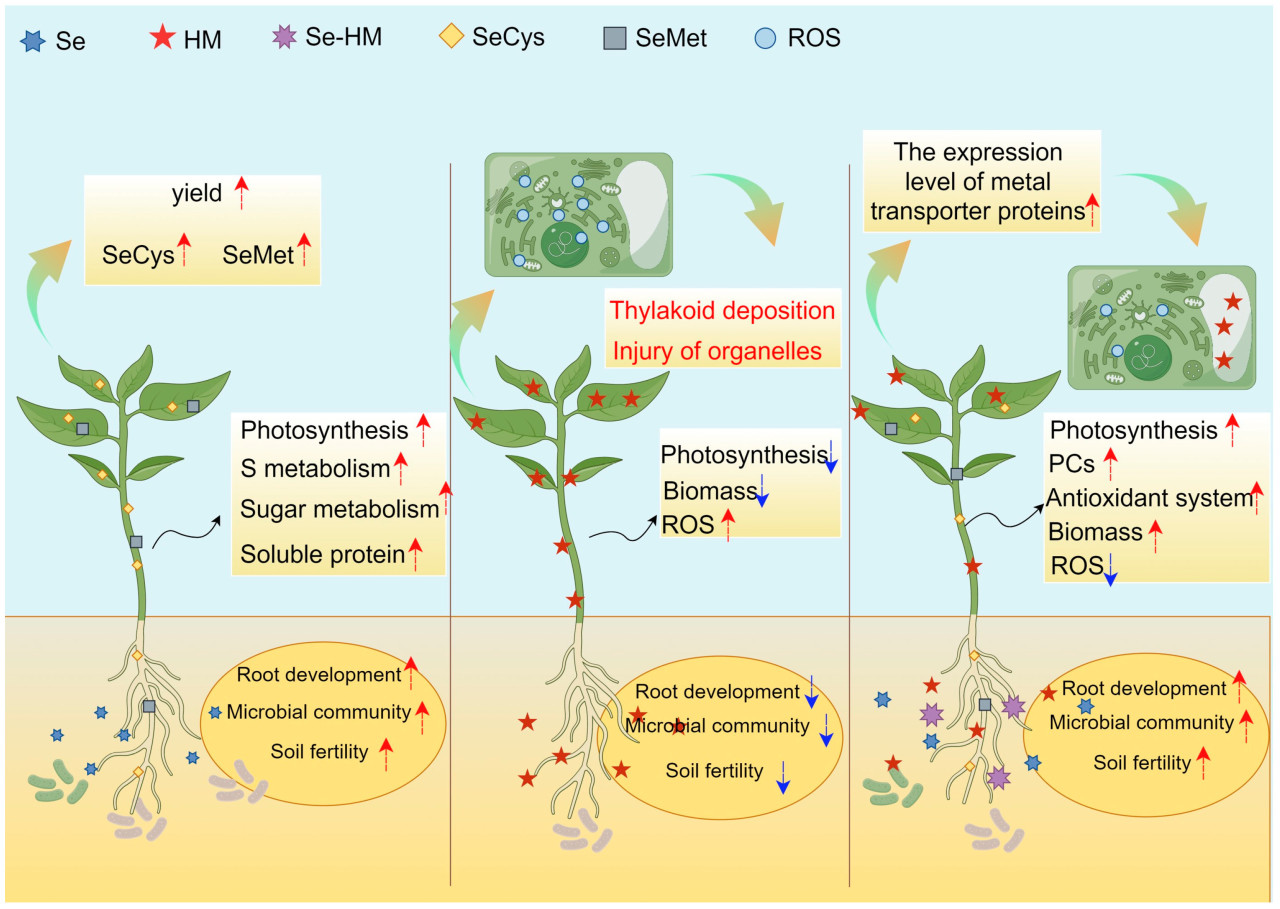
В условиях стресса от тяжелых металлов внесение соответствующего количества Se в сельскохозяйственные культуры усиливает метаболизм серы [ 25 ], метаболизм сахара и содержание растворимого белка, в конечном итоге повышая урожайность и уровень селенопротеина [ 8 ]. Кроме того, адекватное количество Se стимулирует экспрессию антиоксидантной системы сельскохозяйственных культур, удаляет избыток активных форм кислорода и повышает относительную экспрессию PC и белков-переносчиков металлов [ 26 ]. Кроме того, Se улучшает структуру микробного сообщества в почве и увеличивает микробное разнообразие и численность, дополнительно обогащая плодородие почвы и способствуя росту и развитию корней [ 27 ]. Эти механизмы в совокупности снижают токсичность тяжелых металлов в сельскохозяйственных культурах ( рисунок 1 ).
Рисунок 1. Повышение качества урожая и смягчение стресса ТМ с помощью Se. (Se–ТМ: комплексы, образованные Se и тяжелыми металлами; SeCys: селеноцистеин; SeMet: селенометионин; ROS: активные формы кислорода; PCs: фитохелатины).
2. Физиологический механизм действия Se в облегчении стресса HM
2.1. Se снижает биодоступность тяжелых металлов
Взаимодействие между Se и ТМ оказывает благотворное влияние на смягчение стресса ТМ в растениях. Se снижает транслокацию ТМ из почвы в растения, влияя на их модели поглощения и накопления [ 28 ]. Сообщалось, что внесение удобрения Se для сельскохозяйственных культур, находящихся в состоянии стресса ТМ, может снизить содержание ТМ в различных частях растения, уменьшить коэффициент перехода Cd в растении и уменьшить поглощение, транспортировку и накопление ТМ растениями [ 29 , 30 ]. Это может быть связано с образованием нетоксичных нерастворимых комплексов между Se и ТМ, таких как Cd–Se и Hg–Se в растении, что снижает подвижность ТМ в растении [ 31 , 32 ]. С другой стороны, некоторые исследования показали, что экзогенное внесение удобрения Se способствует биосинтезу фитохелатинов (ФХ) [ 33 ]. Благодаря обилию тиоловых групп эти ФС обладают высоким сродством к тяжёлым металлическим металлам и образуют с ними хелатные соединения, снижая коэффициент переноса тяжёлых металлов в растения. Кроме того, экссудаты ризосферы, pH и электропроводность также могут влиять на поглощение тяжёлых металлов растениями, влияя на их высвобождение [ 34 , 35 ], например, гуминовой кислоты, которая может снижать высвобождение Pb, Cu и Cd [ 36 ]. Аналогичным образом, экзогенное внесение Se изменяет ризосферные секреции, тем самым изменяя распределение метаболитов в почве, улучшая её качество и снижая биодоступность тяжёлых металлов [ 9 ].
Более того, Se оказывает смягчающее действие на токсичность ТМ в растениях, модулируя метаболические пути. Исследования показали, что Se способствует образованию железных бляшек в корневых клетках растений с высоким сродством к ТМ. Эти бляшки действуют как хелаторы для секвестрирования ТМ, уменьшая их транслокацию в надземные части и уменьшая их вред для растений [ 31 , 37 ]. Кроме того, исследования показали, что применение Se может активировать PC-синтазу и стимулировать биосинтез предшественника растительного хелатора GSH, тем самым увеличивая синтез растительных хелаторов и снижая стресс, вызванный ТМ [ 32 ]. Исследования показали, что сверхэкспрессия гена хелатор-синтазы растений ( AtPCS2 ) может улучшить стрессоустойчивость A. thaliana [ 38 ], но вопрос о том, может ли Se стимулировать экспрессию этого гена, требует дальнейших исследований. Кроме того, металлотионеин также играет важную роль в смягчении токсического воздействия ТМ на растения. Сообщалось, что низкие концентрации Se могут способствовать экспрессии генов металлотионеина, тем самым помогая растениям переносить стресс, вызванный ТМ [ 39 ].
2.2. Регуляция антиоксидантных систем растений с помощью Se
В ответ на стресс, вызванный ТМ, растения накапливают значительное количество активных форм кислорода (АФК), что приводит к пагубному воздействию на клеточные белки, липиды и ДНК [ 40 ]. Было показано, что низкие концентрации Se усиливают антиоксидантные ферменты растений, такие как супероксиддисмутаза (СОД), каталаза (КАТ) и глутатионпероксидаза (ГП), уменьшая накопление АФК [ 33 ], тем самым защищая их от повреждений, вызванных окислительным стрессом [ 41 ] ( таблица 1 ). Усиливая механизмы антиоксидантной защиты, Se играет ключевую роль в защите растений от пагубного воздействия ТМ [ 42 ].
Se также обладает способностью повышать содержание неферментативных антиоксидантов в растениях. Исследования показали, что обработка Se значительно увеличивает уровни антиоксидантов, таких как GSH, ацетилсалициловая кислота, пролин и флавоноиды, в тканях растений [ 33 ]. Кроме того, исследования показали, что внесение удобрений Se значительно увеличивает содержание неферментативных антиоксидантов, таких как феруловая кислота, трегалоза, кетогексоза и галактинол, которые взаимодействуют с антиоксидантной системой для устранения избыточных свободных радикалов [ 9 ]. Эти согласованные усилия поддерживают окислительно-восстановительный баланс в растениях и защищают клетки от окислительного повреждения, вызываемого тяжелыми металлами.
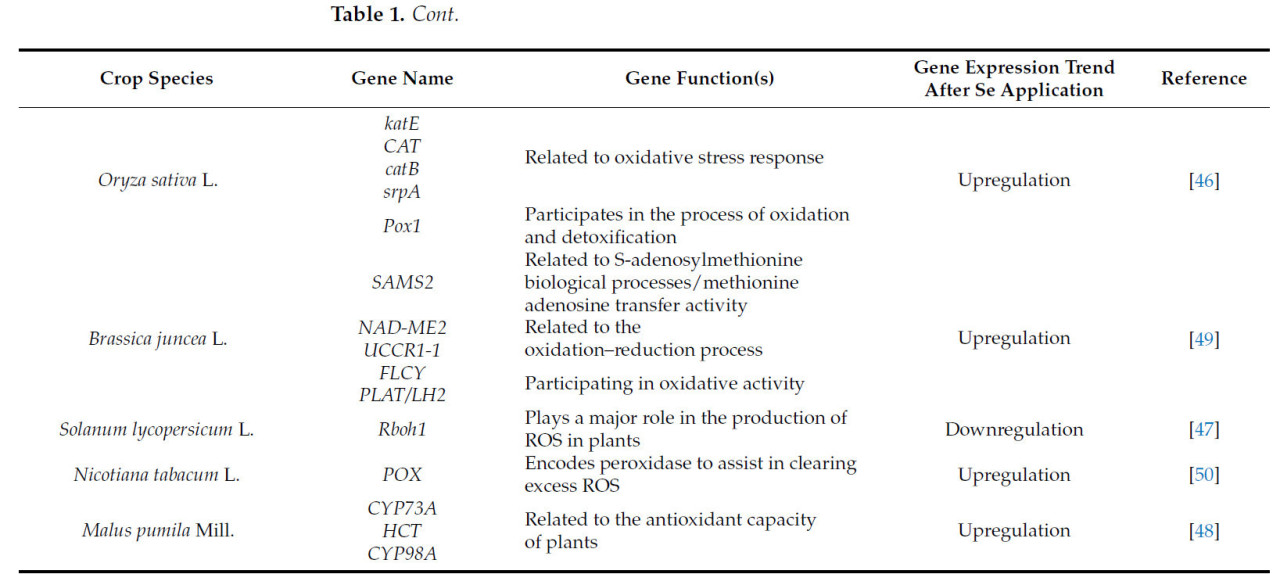
Кроме того, Se повышает устойчивость растений к стрессу HM, регулируя экспрессию генов, чувствительных к стрессу [ 43 ] и генов, кодирующих антиоксидантные белки [ 44 ], таких как SOD , POD и CAT . Эта регуляция впоследствии повышает антиоксидантную активность растительных клеток [ 45 ]. В исследовании транскриптома, проведенном Чжу и соавторами на Oryza sativa L., было выявлено, что применение 1 мг/кг Se повысило экспрессию генов, связанных с окислительным стрессом, включая katE , CAT , catB и Pox1 , тем самым способствуя устранению избыточных ROS [ 46 ]. Кроме того, Чжу и соавторы наблюдали в своем исследовании на Solanum lycopersicum L., что применение Se снизило экспрессию гена Rboh1 , который играет ключевую роль в продукции ROS растениями [ 47 ]. Кроме того, Лю и соавторы в своих исследованиях Malus pumila Mill. обнаружили, что применение Se повышает экспрессию генов CYP73A , HCT и CYP98A . Это повышение регуляции способствовало синтезу антиоксидантов, таких как хлорогеновая кислота, 5-O-кофеилхинная кислота и 1-синапоил-β-D-глюкоза, что дополнительно увеличивает антиоксидантную активность растения [ 48 ].
Таблица 1. Влияние экзогенной обработки Se на уровни экспрессии и функциональность генов, связанных с антиоксидантной системой, в культурах, подвергнутых стрессу ТМ.
2.3 Влияние Se на стабильность мембран растительных клеток
Стресс от ТМ может вызывать окислительный стресс, приводящий к образованию избыточных АФК, что в свою очередь приводит к снижению уровня ненасыщенных жирных кислот, повышению перекисного окисления липидов и нарушению структурной и функциональной целостности клеточных мембран [ 51 ]. Кроме того, ТМ также могут влиять на ионный баланс клеточных мембран, еще больше снижая их стабильность [ 52 ]. В последние годы все больше исследований продемонстрировали, что Se может в определенной степени смягчать повреждения, вызванные ТМ мембранам растительных клеток, тем самым повышая устойчивость растений к стрессу [ 53 , 54 ]. Исследования показали, что применение Se снижает накопление супероксид-ионов в клетках корней рапса, защищая кончики корней от атаки АФК и тем самым поддерживая целостность и стабильность клеточных мембран [ 54 ]. Этот защитный эффект в первую очередь объясняется усилением активности антиоксидантных ферментов после применения Se. Эти ферменты эффективно удаляют чрезмерно накопленные ROS, смягчают перекисное окисление липидов, вызванное тяжелыми металлами, и в конечном итоге обеспечивают стабильность клеточных мембран [ 55 ].
Было сообщено, что ионы ТМ (Zn2 + , Pb2 + , Cd2 + , Hg2 + ) могут проникать в клетки растений через аквапорины (AQP) и AQP-контролирующие, снижая проницаемость воды, и что порядок токсичности ТМ по отношению к AQP был определен как Hg > Cd > Pb > Zn [ 56 ]. Ван и др. обнаружили, что органические удобрения Se, в частности SeMet и SeOMet, могут усваиваться растениями через AQP [ 57 ]. Однако специфические эффекты Se на AQP еще полностью не выяснены. Некоторые исследования предполагают, что определенные AQP могут опосредовать отток и вакуолярную секвестрацию ТМ, тем самым смягчая стресс ТМ в растениях [ 58 ]. Таким образом, предполагается, что Se может также способствовать экспрессии определенных AQP для смягчения стресса ТМ. Кроме того, в транспорте тяжелых металлов участвуют мембранные транспортеры, и влияние Se на эти транспортеры требует дальнейшего изучения. Более того, роль Se в метаболизме фосфолипидов представляет собой важнейший путь защиты клеточных мембран. Исследования показали, что стресс, вызванный тяжелыми металлами, нарушает процессы синтеза и деградации мембранных фосфолипидов, что приводит к снижению содержания липидов в клеточных мембранах, повышению уровня фосфатидной кислоты и свободных жирных кислот, снижению текучести мембран и, в конечном итоге, к нестабильности мембран [ 59 ]. Se, с другой стороны, может регулировать ферменты и метаболические пути, связанные с метаболизмом фосфолипидов, тем самым поддерживая гомеостаз фосфолипидов и способствуя восстановлению и регенерации клеточных мембран.
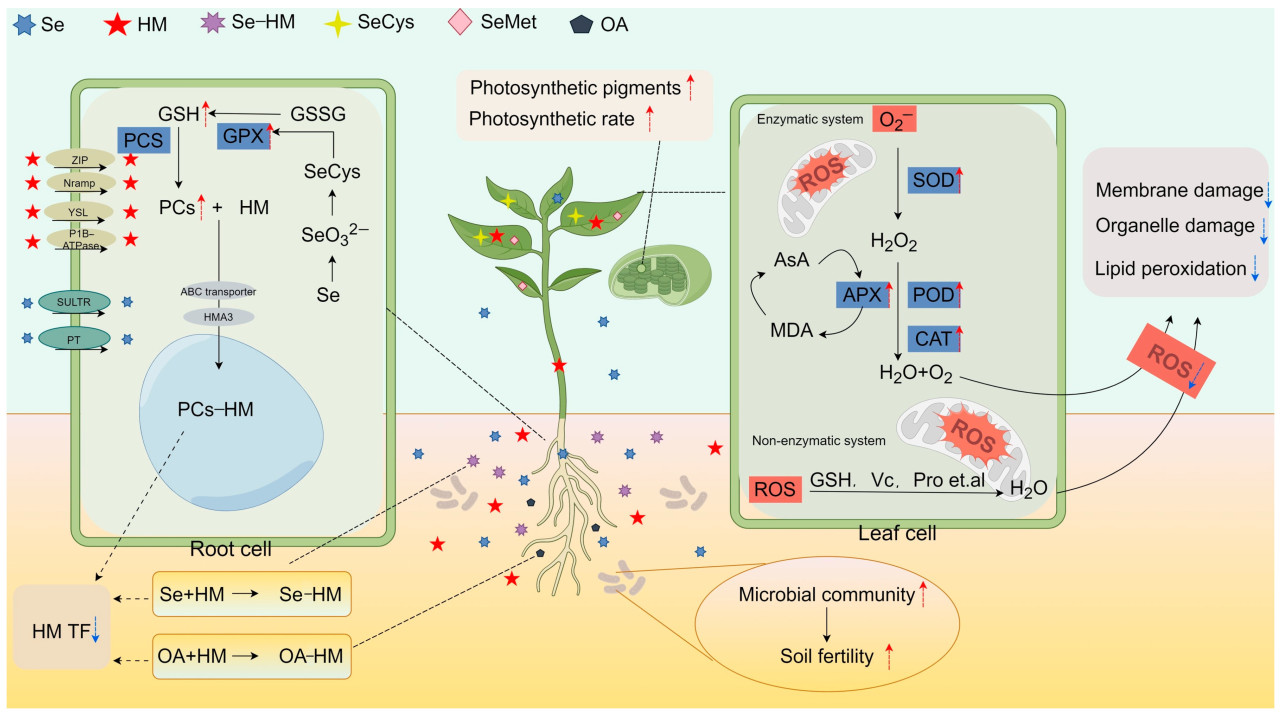
В заключение следует отметить, что физиологический механизм Se в смягчении стресса, вызванного ТМ, охватывает несколько аспектов: (1) снижение коэффициента переноса ТМ путем комплексообразования с ТМ в почве через Se и выделяемые корнями органические кислоты и усиление синтеза ФХ в клетках корней для секвестрирования ТМ в вакуолях. (2) увеличение содержания фотосинтетических пигментов и повышение эффективности фотосинтеза. (3) стимуляция экспрессии антиоксидантной системы путем регулирования ферментативной активности и увеличения содержания неферментативных антиоксидантов для удаления АФК и смягчения связанных с этим повреждений. (4) улучшение структуры микробного сообщества почвы, что способствует доминированию полезных микроорганизмов, повышению плодородия почвы и, следовательно, ускорению роста сельскохозяйственных культур ( рисунок 2 ).
Рисунок 2. Физиологический механизм действия Se при смягчении повреждений ТМ. (Se–HM: комплексы, образованные Se и тяжелыми металлами; SeCys: селеноцистеин; SeMet: селенометионин; OA: органическая кислота; PCs: фитохелатины; PCS: фитохелатинсинтаза; GSH: глутатион; GSSG: окисленный глутатион; GPX: глутатионпероксидаза; ZIP: белок-транспортер, регулируемый цинком/железо-регулируемый транспортер; Nramp: белок макрофагов, ассоциированный с естественной резистентностью; YSL: транспортер, подобный желтой полоске; SULTR: транспортер сульфата; PT: транспортер фосфата; HMA3: HM ATPase3; HMTF: фактор переноса HM; ROS: активные формы кислорода; SOD: супероксиддисмутаза; AsA: аскорбиновая кислота; APX: аскорбатпероксидаза; MDA: малоновый диальдегид; POD: пероксидаза; CAT: каталаза).
3. Молекулярные механизмы селена в снижении стресса HM
3.1 Se и регуляция экспрессии генов растений
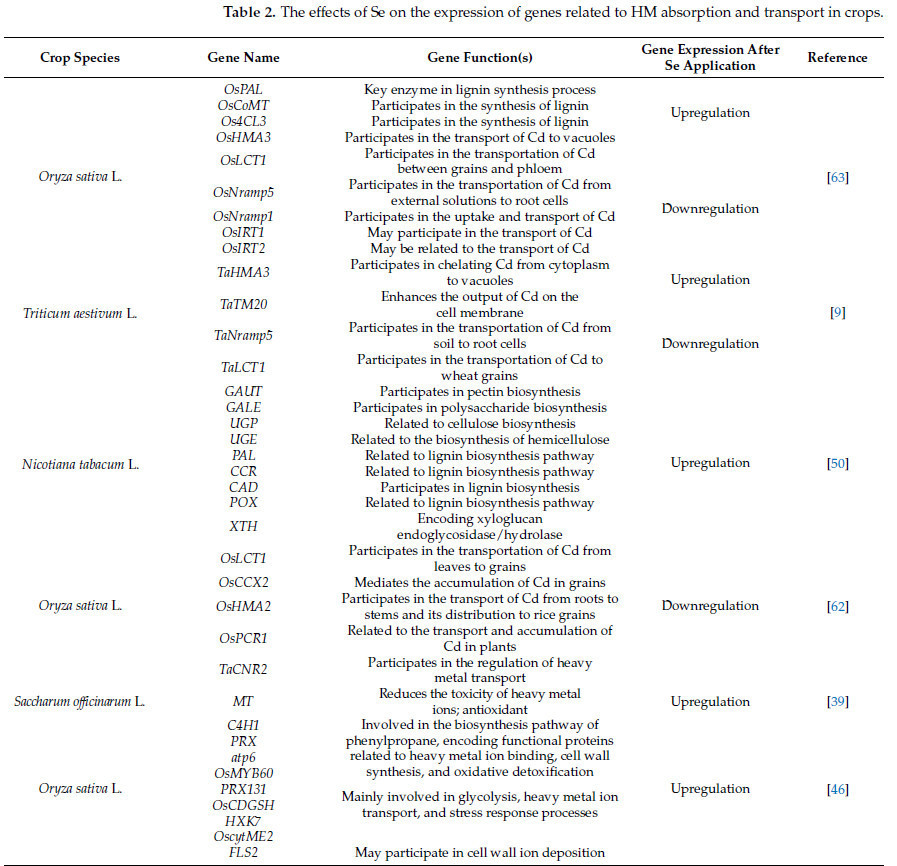
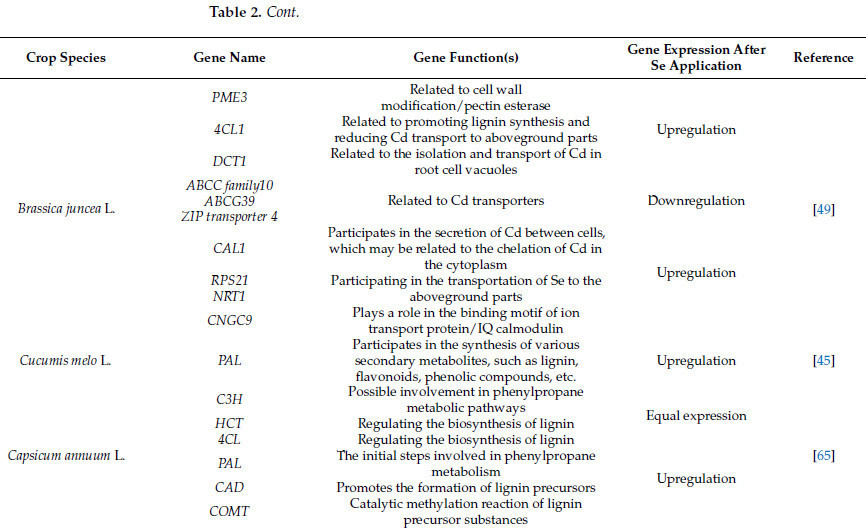
В сельскохозяйственных культурах Se не только регулирует экспрессию генов, связанных с антиоксидантными ферментами и путями метаболизма антиоксидантов, но и защищает сельскохозяйственные культуры от токсичности ТМ, регулируя секвестрацию ТМ, содержание фитогормонов и фотосинтез [ 9 , 42 , 48 ]. Исследования показали, что Se может модулировать уровни экспрессии различных семейств переносчиков металлов, включая членов семейства транспортеров АТФ-связывающей кассеты (ABC) [ 60 ], АТФазы ТМ (HMA) [ 61 ], семейства ZIP [ 49 ], семейства транспортеров LCT [ 62 ], семейства макрофагальных белков, ассоциированных с естественной резистентностью (Nramp) [ 63 ], семейства катионно-водородных обменников (CAX) и семейства катионных оттоков (CE) [ 64 ]. Кроме того, Se повышает экспрессию генов, связанных с лигнином, целлюлозой и гемицеллюлозой, способствуя секвестрации избыточных ионов ТМ в вакуолях или клеточных стенках растений [ 50 ]. Сообщалось, что Se может повышать экспрессию генов, связанных с синтезом лигнина ( Os4CL3 , OsHMA3 и др.), и понижать экспрессию генов, связанных с поглощением и транспортировкой Cd ( OsLCT1 , OsPAL, OsNramp5 и др.), тем самым снижая содержание Cd в семенах риса [ 63 ]. Регулируя эти гены ( TaHMA3 , TaTM20 , TaNramp5 и др.), ТМ могут фиксироваться в вакуолях и клеточных стенках, снижая скорость их транспорта и миграции в растениях, тем самым смягчая ущерб, наносимый растениям ТМ [ 9 , 50 ]. Ван и др. обнаружили, что нанесение композитного золя Se и кремния на листья риса подавляло экспрессию генов, связанных с переносчиками Cd, такими как OsLCT1 , OsCCX2 и OsHMA2 , что впоследствии снижало содержание Cd и Pb в листьях и зернах [ 62 ]. При изучении Brassica juncea L. Ли и соавторы обнаружили, что в условиях стресса, вызванного Cd, нанесение Na2SeO3 повышало экспрессию генов PME3 , 4CL1 и DCT1 , способствуя фиксации Cd в вакуолях и клеточных стенках, и снижало экспрессию генов, связанных с переносчиками Cd, такими как семейство ABCC10 , ABCG39 и транспортер ZIP 4 [ 49 ] ( таблица 2 , рисунок 2 ). Этот процесс снижает концентрацию этих ионов ТМ в цитоплазме, тем самым смягчая их токсические эффекты.
Таблица 2. Влияние Se на экспрессию генов, связанных с поглощением и транспортом ТМ в сельскохозяйственных культурах.
Более того, исследования показали, что удобрение Se усиливает экспрессию генов-переносчиков сульфата в брокколи, стимулируя метаболизм серы в растениях [ 66 ]. Примечательно, что Сан и др. в своем исследовании мутанта astol1 в рисе обнаружили, что этот мутант проявляет усиленный метаболизм серы и способности к накоплению Se. Этот усиленный метаболизм серы, в свою очередь, приводит к усилению синтеза серосодержащих соединений, таких как GSH и PCs, которые эффективно ингибируют транслокацию As — другого токсичного металлоида — внутри растения [ 67 ]. Однако влияние экзогенного Se на экспрессию этих генов и то, может ли Se действительно способствовать метаболизму серы посредством активации этих генов для смягчения токсичности ТМ, остаются в значительной степени неизученными и ожидают дальнейшей проверки.
Кроме того, Se модулирует экспрессию генов, связанных с защитными реакциями растений. Эти гены кодируют защитные белки, такие как металлотионеины и PC, которые могут напрямую связываться с ионами ТМ, снижая их биологическую активность и, следовательно, смягчая их токсичность для растений [ 39 ]. Повышая экспрессию этих защитных генов, Se усиливает внутренние защитные механизмы растений, повышая их выживаемость в условиях стресса, вызванного ТМ. Кроме того, исследования показали, что применение Se может регулировать экспрессию генов, участвующих в метаболизме углерода, азота, аминокислот и сахара, тем самым повышая устойчивость растений к ТМ [ 48 ].
3.2. Se и пути передачи сигналов в растениях
Se модулирует метаболические пути и системы передачи сигналов, а также регулирует гормональный баланс (ауксин, абсцизовая кислота, этилен) и передачу сигнальных молекул (оксид азота, ионы кальция, сероводород), тонко настраивая физиологические реакции растений на стресс HM [ 68 ]. Согласно отчетам, Se может повышать экспрессию ответов ауксина, АБК и ЖАК, активируя межклеточную синергию, которая совместно поддерживает гомеостаз в растении [ 46 ]. Кроме того, Se регулирует биосинтез этилена, и исследования показали, что этилен может участвовать в защитных реакциях, вызванных Se, тем самым усиливая положительный ответ антиоксидантной системы и улучшая рост растений в условиях стресса Cd [ 69 ]. Несколько исследований показали, что Se может изменять экспрессию генов, связанных со стрессом, влияя на сигнальные пути фитогормонов, например, с участием ИУК, абсцизовой кислоты (АБК) и жасмоновой кислоты (ЖК) [ 46 ]. Продуктами этих генов часто являются факторы транскрипции, которые дополнительно регулируют экспрессию нижестоящих генов, формируя сложные сети экспрессии генов, которые способствуют ответу на токсичность ТМ.
Кроме того, Se регулирует ионные каналы или белковые каналы на мембранах растительных клеток, тем самым влияя на абсорбцию и транслокацию тяжелых металлов. Например, Se может модулировать кальциевые ионные каналы, белки калиевых ионных каналов, AQP [ 57 ] и несколько белков-переносчиков тяжелых металлов [ 60 , 61 ], в конечном итоге снижая поглощение тяжелых металлов и одновременно способствуя их выведению ( рисунок 3 ).
Рисунок 3. Молекулярные механизмы смягчения стресса, вызванного тяжелыми металлами, с помощью Se. (Se–HM: комплексы, образованные Se и тяжелыми металлами; SeCys: селеноцистеин; SeMet: селенометионин; OA: органическая кислота; ABA: абсцизовая кислота; IAA: индол-3-уксусная кислота; ETH: этилен; SA: салициловая кислота; ROS: активные формы кислорода; Nramp5: белок макрофагов, ассоциированный с естественной резистентностью; IRT1: транспортер 1, регулируемый железом; ZIP: транспортер, регулируемый цинком/железорегулируемый транспортер; LCT1: транспортер лактата 1; SULTR: транспортер сульфата; HMA3: АТФаза 3 тяжелых металлов; ABCC: подсемейство C АТФ-связывающей кассеты). Молекулярный механизм смягчения стресса, вызванного тяжелыми металлами, с помощью Se включает несколько аспектов. Он регулирует метаболические пути фитогормонов, экспрессию генов антиоксидантной системы, гены транспортных белков, прочность клеточной стенки и элементы, связанные с фотосинтезом, тем самым помогая сельскохозяйственным культурам справляться со стрессом, вызванным тяжелыми металлами, и поддерживать нормальный рост.
3.3. Регулирование метаболических путей растений с помощью Se
Модуляция метаболических путей селена в сельскохозяйственных культурах играет ключевую роль в смягчении стресса, вызванного тяжелыми металлами. Способность селена регулировать метаболизм серы в растениях обусловлена химическим сходством между селеном и серой. Исследования показали, что стресс, вызванный тяжелыми металлами, нарушает нормальный метаболизм серы в растениях [ 70 ], тогда как введение селена может частично поддерживать метаболический баланс серы [ 71 ]. Se попадает в растения через сульфатные транспортеры и метаболизируется в SeCys или SeMet через путь ассимиляции серы в хлоропластах [ 72 ]. Этот процесс снижает связывание тяжелых металлов с серосодержащими лигандами, тем самым снижая токсичность тяжелых металлов.
Кроме того, многочисленные исследования продемонстрировали, что применение Se влияет на метаболизм N, метаболизм C, метаболизм сахара и метаболизм аминокислот в растениях, способствуя повышению устойчивости к стрессу. Se играет регуляторную роль в модуляции уровней экспрессии генов, связанных с фотосинтезом в растениях, включая Lhcb1 , RbcL и OsBTF3 [ 62 ]. В исследовании Чжао и соавторов на Oryza sativa L. было отмечено, что применение Se привело к повышению регуляции таких генов, как HEMA1 , OsBCH3 и GUN4, при одновременном снижении регуляции OsRCCR1 и PsaC . Это привело к усилению синтеза и снижению деградации фотосинтетических пигментов, тем самым оптимизируя профиль пигментов и потенциально повышая производительность фотосинтеза [ 4 ] ( таблица 3 ). Кроме того, Se повышает регуляцию синтеза белков, участвующих в процессах переноса энергии в фотосистеме I и фотосистеме II, включая psbQ , psbO , psaG , atpG и др. [ 46 ] или поддерживает их стабильность [ 7 ]. Эти действия в совокупности повышают эффективность фотосинтеза и смягчают стресс ТМ у растений ( Таблица 3 ). Ван и др. обнаружили, что внекорневое применение Se усиливает метаболизм азота как в листьях, так и в корнях риса, увеличивая синтез азотсодержащих органических соединений. Это, в свою очередь, способствует росту полезных микроорганизмов в ризосфере, тем самым смягчая токсичность Cd для риса [ 9 ]. Кроме того, Рафаэль и др. наблюдали, что применение Se облегчает метаболизм углерод-азот и другие метаболические пути в растениях перца, усиливая их толерантность к Cd [ 73 ]. Подводя итог, можно сказать, что воздействие Se на метаболизм N, метаболизм C, метаболизм сахара и метаболизм аминокислот является значительным, хотя подробные основные механизмы еще ждут дальнейшего выяснения.
Таблица 3. Влияние экзогенной обработки Se на экспрессию генов, связанных с фотосинтезом, в сельскохозяйственных культурах, находящихся под воздействием ТМ.
4. Влияние факторов окружающей среды почвы и селена на снижение стресса от тяжелых металлов
Видообразование и биодоступность Se в почве зависят от различных факторов. В зависимости от его химической формы Se в почве можно разделить на две основные категории: органический и неорганический Se. Среди неорганического Se существуют четыре основные формы: элементарный Se (Se0 ) , неорганические селениды (Se2− ) , селенит (SeO32− ) и селенат (SeO42− ) . Органический Se в основном состоит из SeCys, SeMet и их производных [ 74 ]. pH почвы оказывает многогранное влияние на способность Se смягчать стресс ТМ в растениях. Во-первых, pH почвы модулирует видообразование и доступность Se в почве. В кислых почвах Se в основном существует в растворимых неорганических формах, таких как селенит, тогда как селенат преобладает в щелочных почвах [ 75 ].
И селенит, и селенат могут напрямую усваиваться растениями, хотя селенит является основной формой, предпочтительной для использования растениями. Сравнительные исследования по применению селенита натрия (Na 2 SeO 3 ) и селената натрия (Na 2 SeO 4 ) для сельскохозяйственных культур показали, что растения могут лучше усваивать Na 2 SeO 3 , что приводит к повышению содержания Se в культурах [ 76 , 77 ]. Однако предпочтительное использование этих двух видов Se растениями и их соответствующая эффективность в смягчении стресса ТМ остаются спорными. Ю и др. сравнили влияние Na 2 SeO 3 и Na 2 SeO 4 на смягчение стресса Cd в Brassica rapa subsp. chinensis и обнаружили, что Na 2 SeO 3 значительно превзошел Na 2 SeO 4 после 19 дней прорастания [ 78 ]. Аналогичным образом, Ляо и др. наблюдали, что Na 2 SeO 3 был более эффективен в смягчении стресса Cd и As в рисе, что привело к большему снижению содержания ТМ в зернах, хотя и с немного худшим сохранением питательной ценности по сравнению с Na 2 SeO 4 [ 79 ], в то время как некоторые исследования показывают, что Na 2 SeO 4 превосходит Na 2 SeO 3 в смягчении абиотического стресса в табаке [ 80 ]. Тем не менее, обе формы могут быть использованы для смягчения стресса ТМ в сельскохозяйственных системах. Na 2 SeO 3 снижает накопление Cd в первую очередь за счет снижения экспрессии генов поглощения Cd, тогда как Na 2 SeO 4 не только модулирует экспрессию генов, но и усиливает секвестрацию Cd в вакуолях [ 81 ]. Кроме того, исследования показывают, что селенит быстрее восстанавливается и биологически трансформируется в растениях, что способствует его превосходной эффективности в смягчении стресса ТМ [ 82 ]. Эти результаты подчеркивают сложность смягчения стресса, вызванного HM, с помощью Se и указывают на необходимость дальнейших исследований для выяснения точных механизмов, лежащих в основе этих эффектов.
Одновременно с этим, pH почвы оказывает сильное влияние на видообразование и биодоступность ТМ. Сообщалось, что подкисление почвы заметно увеличивает подвижность ТМ, причем Cd особенно чувствителен к этому эффекту [ 83 ]. Исследования показали, что в диапазоне pH от 3,40 до 8,97 содержание биодоступного Cd в карбонатных почвах уменьшается с увеличением pH [ 84 ]. Это явление объясняется тем, что в кислых условиях ТМ в почве легче растворяются в ионных формах, тем самым повышая их подвижность и биодоступность. Наоборот, при более высоких значениях pH концентрация гидроксильных ионов в почве увеличивается, что способствует образованию нерастворимых гидроксидных осадков с ионами ТМ, что впоследствии снижает их биодоступность.
Более того, pH почвы также модулирует структуру сообщества и функции почвенных микроорганизмов. Почвенные микроорганизмы играют ключевую роль в изменении физико-химических свойств почвы, круговороте питательных веществ и преобразовании материалов [ 85 ]. Изменения pH почвы могут влиять на распределение полезных микробных сообществ, а также на поглощение и использование Se растениями. В частности, почва содержит микроорганизмы, участвующие в восстановлении, окислении и усвоении Se, которые могут преобразовывать органический Se и элементарный Se в селенит [ 86 ] или восстанавливать селенит до элементарного Se [ 73 ]. Эта микробная деятельность влияет на видообразование и биодоступность Se, впоследствии влияя на поглощение и использование Se удобрений растениями. Следовательно, pH почвы, благодаря его влиянию как на видообразование ТМ, так и на микробную активность, играет решающую роль в определении эффективности смягчения стресса ТМ, опосредованного Se, в сельскохозяйственных системах. Дальнейшие исследования должны быть направлены на более глубокое изучение сложных механизмов, управляющих поглощением, трансформацией и использованием различных форм селена различными видами растений в условиях различного уровня pH почвы. Это включает в себя выяснение того, как можно точно регулировать эти процессы для более эффективного снижения стресса, вызванного тяжелыми металлами.
5. Применение Se для смягчения стресса, вызванного тяжелыми металлами, в сельском хозяйстве
5.1 Технология применения Se-удобрений
Обычно используемые удобрения Se включают селенит, селенат, органический Se и нано-Se удобрения. Методы внесения этих удобрений Se в первую очередь включают внесение в почву, опрыскивание листьев, гидропонное внесение и обработку семян. Среди этих методов внесение в почву включает прямое внесение удобрений — преимущественно селенита, селената и органических удобрений Se — в почву в качестве основных удобрений, тем самым позволяя растениям напрямую усваивать и использовать их. Этот подход может изменить структуру и распределение микробных сообществ почвы, которые посредством своей метаболической активности дополнительно влияют на физико-химические свойства и плодородие почвы. Например, исследования продемонстрировали, что внесение Se в почву может регулировать экспрессию генов, связанных с ризобиями и круговоротом азота у бобовых растений, тем самым увеличивая их биомассу и накопление азота [ 87 ]. Однако при внесении в почву селеновых удобрений крайне важно учитывать множество факторов, включая естественное содержание селена, плодородие и физико-химические свойства почвы, поскольку они могут существенно повлиять на эффективность удобрения.
Внекорневое внесение удобрений Se включает в себя приготовление раствора определенной концентрации и распыление его как на верхнюю, так и на нижнюю поверхность листьев растения на определенной стадии роста. Затем растение поглощает удобрение Se через устьица на поверхности листа. В настоящее время удобрения Se в наномасштабе наиболее широко изучаются для внекорневого внесения, так как принято считать, что этот метод обеспечивает максимальную эффективность нано-Se. Однако есть также исследования, указывающие на то, что внесение в почву нано-Se, а не внекорневое внесение или замачивание семян, может более эффективно смягчить стресс Cd у пшеницы [ 88 ]. Внекорневое внесение удобрений Se обходит влияние почвенных факторов на эффективность удобрения, значительно снижая количество требуемого удобрения Se и обеспечивая более быстрое поглощение и использование растениями через устьица и кутикулу, тем самым ускоряя проявление полезных эффектов. Кроме того, исследования показали, что внекорневое внесение Se может модулировать распределение микробного сообщества почвы через метаболиты листьев и ризосферы, повышая устойчивость растений к ТМ и вредителям [ 9 , 89 ]. В настоящее время многочисленные исследования подтвердили, что внекорневое внесение является эффективной агрономической мерой, помогающей культурам снять стресс от тяжелых металлов, стимулируя антиоксидантную защиту и улучшая питательные качества съедобных частей с помощью биообогащения. Оливейра и др. сравнили почвенное и внекорневое внесение селенита и селената. Они обнаружили, что оба могут увеличить содержание Se в корнях, причем внекорневое внесение селенита оказалось наиболее эффективным [ 90 ]. Чжан и др. обнаружили, что при выращивании пшеницы селенат был более эффективен, чем селенит, при фертигации и внекорневой подкормке, а внекорневое удобрение превзошло фертигацию [ 91 ]. Ли и др. обнаружили, что внекорневое внесение нано-Se увеличивает содержание Se в съедобных частях Brassica chinensis L., повышая его питательную ценность [ 92 ]. Чжан и др. применяли селенит и селенат на листьях во время расширения клубней картофеля и обнаружили, что селенит может значительно увеличить содержание органического Se в съедобных частях. Однако чрезмерная концентрация Se на листьях может повредить листья и повлиять на рост урожая [ 93 ]. Ребекка и др. обнаружили, что когда концентрация Se при внекорневом опрыскивании превышала 50 ppm, урожайность Helianthus annus L. снижалась [ 94 ]. В то время как внекорневое внесение удобрений Se в значительной степени не зависит от почвенных условий, оно восприимчиво к погодным факторам, таким как высокие температуры, осадки и интенсивный солнечный свет, которые могут отрицательно повлиять на эффективность удобрения.
Гидропонное внесение удобрений Se в сельскохозяйственные культуры аналогичным образом обходит влияние почвенных факторов на эффективность удобрений, способствуя быстрому усвоению и использованию благодаря прямому контакту корней растений с питательным раствором. Недавние исследования показывают, что добавление селенита, селената и нано-Se в гидропонные системы может смягчить стресс ТМ на сельскохозяйственные культуры и улучшить их питательные качества [ 77 , 95 , 96 ]. Однако практическая реализация гидропонного внесения Se требует значительных инвестиций в затраты и технических знаний. Более того, стабильность системы является проблемой, требующей постоянного мониторинга и корректировки концентрации Se в питательном растворе для поддержания оптимальных условий. Эти факторы ограничивают широкое внедрение гидропонного внесения Se в коммерческих производственных условиях.
Обработка семян включает замачивание семян в растворе, содержащем определенную концентрацию удобрения Se, чтобы позволить семенам поглотить определенное количество Se, тем самым повышая приспособляемость культуры к стрессу ТМ. Согласно отчетам, замачивание семян до прорастания в растворах Se может повысить концентрацию Se в сеянцах растений на несколько порядков, что приводит к увеличению содержания микроэлементов и урожайности сельскохозяйственных культур. [ 97 , 98 ]. Кроме того, обработанные Se семена проявляют устойчивость к различным воздействиям окружающей среды и положительно способствуют смягчению стресса ТМ у растений [ 99 ]. Тем не менее, обработка семян также имеет свои ограничения. Эффективность этого метода может зависеть от внутренних свойств семян растений, чтобы гарантировать, что Se приносит пользу семенам, время обработки и концентрация должны устанавливаться в зависимости от типа культуры, чтобы избежать нанесения вреда прорастанию и сеянцам.
5.2. Комбинированное применение Se и других биотехнологий
Se может быть интегрирован с различными биотехнологическими подходами для улучшения его применения в сельском хозяйстве. Во-первых, микробный синтез частиц nano-Se дает такие преимущества, как низкая токсичность, высокая биодоступность и минимальное загрязнение окружающей среды [ 100 ]. Эти частицы nano-Se при внесении такими методами, как опрыскивание листьев или внесение в ризосферу, могут не только улучшить питательные качества сельскохозяйственных культур, но и модулировать метаболическую активность растений, тем самым повышая их устойчивость к стрессу [ 101 ]. Более того, использование носителей, таких как липосомы и галлат эпигаллокатехина Se, может еще больше повысить эффективность частиц nano-Se, оптимизируя их роль в улучшении качества сельскохозяйственной продукции [ 102 , 103 ]. Кроме того, Se можно сочетать с технологиями микробной ремедиации. Исследования показали, что экзогенное внесение Se в сочетании с Se-толерантными бактериями может эффективно инактивировать Cd в почве, уменьшая его накопление и перенос в рисе [ 104 ]. Кроме того, было обнаружено, что бактерии, связанные с ризосферами растений-гипераккумуляторов селена, способствуют накоплению селена в растениях, не являющихся его аккумуляторами, тем самым повышая качество урожая [ 104 ]. Совместное применение грибов арбускулярной микоризы и селеновых удобрений не только улучшает распределение микробного сообщества почвы, но и способствует снижению стресса пшеницы от кадмия, что подчеркивает потенциал этого комбинированного подхода в устойчивом сельском хозяйстве [ 105 ].
Было сообщено, что Se в сочетании с СЭС Lysini bacillus fusiformis оказывает синергетический эффект, привлекая в почву популяции микроорганизмов, обладающих способностью стимулировать рост растений и устойчивостью к ризосферным ТМ. Этот совместный механизм усиливает ремедиацию почвы, загрязненной композитом Cu-Cd-Cr, райграсом [ 106 ]. Помимо его синергии с микроорганизмами, недавние исследования изучали комбинированное применение Se и модифицированного биоугля. Было обнаружено, что эта интеграция увеличивает содержание растворенного органического углерода, доступного кремния и обменного магния в почве, одновременно снижая биодоступность ТМ, таких как Cd, Pb, Zn и Cu. Следовательно, этот подход способствует росту китайской капусты [ 107 ]. Кроме того, практика совмещения культур была предложена в качестве средства для достижения ремедиации загрязнения ТМ [ 108 ]. Однако необходимы дальнейшие исследования, чтобы определить, может ли Se повысить эффективность таких методов ремедиации. Потенциальная роль Se в повышении эффективности систем совмещенного выращивания культур для очистки от тяжелых металлов остается областью активных исследований.
6. Существующие проблемы и вызовы
Достигнуты значительные успехи в выяснении роли селена в смягчении стресса, вызванного тяжелыми металлами, у сельскохозяйственных культур, однако сохраняется множество проблем, требующих дальнейшего изучения. Хотя предыдущие исследования подтверждали способность селена смягчать стресс, вызванный тяжелыми металлами, посредством различных механизмов, таких как укрепление антиоксидантных систем растений, стабилизация структур клеточных мембран и модуляция уровня фитогормонов [ 26 , 53 ], подтверждение этого на молекулярном уровне пока не удалось.
Более того, хотя модулирующие эффекты факторов окружающей среды почвы на смягчение стресса ТМ, вызванного Se, были кратко изучены в существующих исследованиях, систематические исследования остаются скудными [ 75 , 109 ]. Например, к вопросам, которые не были полностью выяснены, относятся влияние pH почвы, содержания органического вещества и присутствия других микроэлементов на доступность Se, а также механизмы, посредством которых Se изменяет валентное состояние ионов ТМ, влияет на их биодоступность, взаимодействует с ТМ посредством комплексообразования и различается по своим смягчающим эффектам в зависимости от типа почвы. Кроме того, крайне важно проводить исследования в моделируемых сельскохозяйственных условиях, чтобы изучить эффективность и механизмы Se в смягчении множественного совместного загрязнения ТМ, тем самым предоставляя более практические рекомендации для сельскохозяйственного производства.
Влияние Se на рост растений подобно «палке о двух концах», где низкие концентрации способствуют росту и устойчивости растений, тогда как высокие концентрации могут вызывать токсичность [ 110 ]. Сообщается, что внекорневая подкормка селенитом в дозе более 50 г∙га⁻ 1 на растениях коровьего гороха вызывает поражения листьев, нарушает физиологические процессы и снижает урожайность и качество [ 111 ]. Сообщалось, что 1,5 мМ селената вызывает задержку роста риса, снижает содержание фотосинтетических пигментов, ухудшает антиоксидантный метаболизм и вызывает хлороз [ 112 ]. Салем и др. обнаружили, что 40 или 80 мкМ Se вызывают окислительное повреждение в томатах, что приводит к отравлению Se [ 113 ]. Кабрал и др. Также обнаружено, что при концентрации Se 1,5 мМ рис страдает от снижения биомассы и урожайности, что сопровождается очевидными фенотипическими нарушениями, влияющими на его рост и продуктивность [ 114 ]. Следовательно, норму внесения Se-удобрений необходимо тщательно контролировать в пределах, приемлемых для растений. Устойчивость растений к ТМ можно повысить более эффективно, адаптируя внесение Se-удобрений поэтапно в соответствии с конкретными потребностями и циклами роста различных культур и разумно распределяя соотношение основного и подкормочного внесения.
7. Выводы
При выращивании сельскохозяйственных культур Se смягчает стресс, вызванный тяжелыми металлами, посредством нескольких механизмов: (1) Se образует комплексы с тяжелыми металлами, такими как Cd и Hg, в почве, тем самым снижая их биодоступность; (2) Se стимулирует экспрессию антиоксидантных систем для противодействия окислительному стрессу, вызванному стрессом, вызванным тяжелыми металлами; (3) Se регулирует экспрессию генов, связанных с транспортировкой тяжелых металлов, уменьшая перемещение тяжелых металлов внутри растений; (4) Повышая экспрессию генов, связанных с синтезом клеточной стенки, Se повышает механическую прочность клеточных стенок; (5) Se модулирует экспрессию генов, участвующих в фотосинтезе, повышая эффективность фотосинтеза; (6) Se регулирует метаболические пути, включая метаболизм азота, углерода и аминокислот, для повышения устойчивости растений к стрессу; и (7) через корневые выделения Se влияет на состав и распределение микробных сообществ почвы, помогая растениям справляться со стрессом, вызванным тяжелыми металлами. С развитием функционального сельского хозяйства, посредством глубоких исследований и технологических инноваций, можно повысить содержание Se в сельскохозяйственной продукции, эффективно снижая при этом стресс от тяжелых металлов и их накопление в сельскохозяйственных культурах, тем самым способствуя устойчивому развитию сельского хозяйства и обеспечивая безопасность и высокое качество производства сельскохозяйственной продукции.
Ссылки
1. Tendenedzai, J.T.; Chirwa, E.M.; Brink, H.G. Harnessing selenium nanoparticles (SeNPs) for enhancing growth and germination, and mitigating oxidative stress in Pisum sativum L. Sci. Rep. 2023, 13, 20379. [Google Scholar] [CrossRef] [PubMed]
2. Li, S.; Chen, H.; Jiang, S.; Hu, F.; Xing, D.; Du, B. Selenium and nitrogen fertilizer management improves potato root function, photosynthesis, yield and selenium enrichment. Sustainability 2023, 15, 6060. [Google Scholar] [CrossRef]
3. Cheng, B.; Wang, C.; Cao, X.; Yue, L.; Chen, F.; Liu, X.; Wang, Z.; Xing, B. Selenium nanomaterials induce flower enlargement and improve the nutritional quality of cherry tomatoes: Pot and field experiments. Environ. Sci. Nano 2022, 9, 4190–4200. [Google Scholar] [CrossRef]
4. Zhao, P.; Wu, Z.; Zheng, Y.; Shen, J.; Zhu, Y.; Chen, Q.; Wang, B.; Yang, F.; Ding, Y.; Liu, H. Selenite affected photosynthesis of Oryza sativa L. exposed to antimonite: Electron transfer, carbon fixation, pigment synthesis via a combined analysis of physiology and transcriptome. Plant Physiol. Biochem. 2023, 201, 107904. [Google Scholar] [CrossRef]
5. Auobi Amirabad, S.; Behtash, F.; Vafaee, Y. Selenium mitigates cadmium toxicity by preventing oxidative stress and enhancing photosynthesis and micronutrient availability on radish (Raphanus sativus L.) cv. Cherry Belle. Environ. Sci. Pollut. Res. 2020, 27, 12476–12490. [Google Scholar] [CrossRef] [PubMed]
6. Cunha, M.L.O.; Oliveira, L.C.A.; Silva, V.M.; Agathokleous, E.; Vicente, E.F.; Reis, A.R.D. Selenium promotes hormesis in physiological, biochemical, and biological nitrogen fixation traits in cowpea plants. Plant Soil 2024, 501, 555–572. [Google Scholar] [CrossRef]
7. Tamaoki, M.; Freeman, J.L.; Pilon-Smits, E.A. Cooperative ethylene and jasmonic acid signaling regulates selenite resistance in Arabidopsis. Plant Physiol. 2008, 146, 1219–1230. [Google Scholar] [CrossRef]
8. Shahid, M.A.; Balal, R.M.; Khan, N.; Zotarelli, L.; Liu, G.D.; Sarkhosh, A.; Fernandez-Zapata, J.C.; Nicolás, J.J.M.; Garcia-Sanchez, F. Selenium impedes cadmium and arsenic toxicity in potato by modulating carbohydrate and nitrogen metabolism. Ecotoxicol. Environ. Saf. 2019, 180, 588–599. [Google Scholar] [CrossRef] [PubMed]
9. Wang, M.; Mu, C.; Lin, X.; Ma, W.; Wu, H.; Si, D.; Ge, C.; Cheng, C.; Zhao, L.; Li, H. Foliar Application of Nanoparticles Reduced Cadmium Content in Wheat (Triticum aestivum L.) Grains via Long-Distance “Leaf–Root–Microorganism” Regulation. Environ. Sci. Technol. 2024, 58, 6900–6912. [Google Scholar] [CrossRef]
10. Azimi, A.; Azari, A.; Rezakazemi, M.; Ansarpour, M. Removal of heavy metals from industrial wastewaters: A review. ChemBioEng Rev. 2017, 4, 37–59. [Google Scholar] [CrossRef]
11. Qin, S.; Li, X.; Huang, J.; Li, W.; Wu, P.; Li, Q.; Li, L. Inputs and transport of acid mine drainage-derived heavy metals in karst areas of Southwestern China. Environ. Pollut. 2024, 343, 123243. [Google Scholar] [CrossRef] [PubMed]
12. Liu, Z.; Bai, Y.; Gao, J.; Li, J. Driving factors on accumulation of cadmium, lead, copper, zinc in agricultural soil and products of the North China Plain. Sci. Rep. 2023, 13, 7429. [Google Scholar] [CrossRef] [PubMed]
13. Cui, H.; Zhao, Y.; Hu, K.; Xia, R.; Zhou, J.; Zhou, J. Impacts of atmospheric deposition on the heavy metal mobilization and bioavailability in soils amended by lime. Sci. Total Environ. 2024, 914, 170082. [Google Scholar] [CrossRef] [PubMed]
14. Vezza, M.E.; Llanes, A.; Travaglia, C.; Agostini, E.; Talano, M.A. Arsenic stress effects on root water absorption in soybean plants: Physiological and morphological aspects. Plant Physiol. Biochem. 2018, 123, 8–17. [Google Scholar] [CrossRef] [PubMed]
15. Sorrentino, M.; Capozzi, F.; Amitrano, C.; Giordano, S.; Arena, C.; Spagnuolo, V. Performance of three cardoon cultivars in an industrial heavy metal-contaminated soil: Effects on morphology, cytology and photosynthesis. J. Hazard. Mater. 2018, 351, 131–137. [Google Scholar] [CrossRef] [PubMed]
16. Sugiyama, T.; Ishii, N.; Ebihara, Y.; Shiomi, K.; Mochizuki, H. Detailed analysis of neurological symptoms and sensory disturbances due to chronic arsenic exposure in Toroku, Japan. Int. J. Environ. Res. Public Health 2021, 18, 10749. [Google Scholar] [CrossRef]
17. Chen, X.-X.; Xu, Y.-M.; Lau, A.T. Metabolic effects of long-term cadmium exposure: An overview. Environ. Sci. Pollut. Res. 2022, 29, 89874–89888. [Google Scholar] [CrossRef]
18. Nishijo, M.; Nakagawa, H.; Suwazono, Y.; Nogawa, K.; Sakurai, M.; Ishizaki, M.; Kido, T. Cancer mortality in residents of the cadmium-polluted Jinzu River Basin in Toyama, Japan. Toxics 2018, 6, 23. [Google Scholar] [CrossRef]
19. Mwelwa, S.; Chungu, D.; Tailoka, F.; Beesigamukama, D.; Tanga, C. Biotransfer of heavy metals along the soil-plant-edible insect-human food chain in Africa. Sci. Total Environ. 2023, 881, 163150. [Google Scholar] [CrossRef] [PubMed]
20. Fu, W.; Huang, K.; Cai, H.-H.; Li, J.; Zhai, D.-L.; Dai, Z.-C.; Du, D.-L. Exploring the potential of naturalized plants for phytoremediation of heavy metal contamination. Int. J. Environ. Res. 2017, 11, 515–521. [Google Scholar] [CrossRef]
21. Kumar, A.; Subrahmanyam, G.; Mondal, R.; Cabral-Pinto, M.; Shabnam, A.A.; Jigyasu, D.K.; Malyan, S.K.; Fagodiya, R.K.; Khan, S.A.; Yu, Z.-G. Bio-remediation approaches for alleviation of cadmium contamination in natural resources. Chemosphere 2021, 268, 128855. [Google Scholar] [CrossRef]
22. Wu, Y.; Li, X.; Yu, L.; Wang, T.; Wang, J.; Liu, T. Review of soil heavy metal pollution in China: Spatial distribution, primary sources, and remediation alternatives. Resour. Conserv. Recycl. 2022, 181, 106261. [Google Scholar] [CrossRef]
23. Liu, Z.; Zhang, Q.; Han, T.; Ding, Y.; Sun, J.; Wang, F.; Zhu, C. Heavy Metal Pollution in a Soil-Rice System in the Yangtze River Region of China. Int. J. Environ. Res. Public Health 2015, 13, ijerph13010063. [Google Scholar] [CrossRef] [PubMed]
24. Wu, G.; Kang, H.; Zhang, X.; Shao, H.; Chu, L.; Ruan, C. A critical review on the bio-removal of hazardous heavy metals from contaminated soils: Issues, progress, eco-environmental concerns and opportunities. J. Hazard. Mater. 2010, 174, 1–8. [Google Scholar] [CrossRef] [PubMed]
25. Zhu, S.; Sun, S.; Zhao, W.; Sheng, L.; Mao, H.; Yang, X.; Chen, Z. Metagenomics and metabolomics analysis revealed that Se-mediated Cd precipitation and nutrient cycling regulated soil-rice (Oryza sativa L) microenvironmental homeostasis under cadmium stress. Environ. Exp. Bot. 2024, 228, 105958. [Google Scholar] [CrossRef]
26. Zhu, Y.; Dong, Y.; Zhu, N.; Jin, H. Foliar application of biosynthetic nano-selenium alleviates the toxicity of Cd, Pb, and Hg in Brassica chinensis by inhibiting heavy metal adsorption and improving antioxidant system in plant. Ecotoxicol. Environ. Saf. 2022, 240, 113681. [Google Scholar] [CrossRef]
27. Sun, C.; Sun, B.; Chen, L.; Zhang, M.; Lu, P.; Wu, M.; Xue, Q.; Guo, Q.; Tang, D.; Lai, H. Harnessing biosynthesized selenium nanoparticles for recruitment of beneficial soil microbes to plant roots. Cell Host Microbe 2024, 32, 2148–2160.e7. [Google Scholar] [CrossRef]
28. Hu, Y.; Norton, G.J.; Duan, G.; Huang, Y.; Liu, Y. Effect of selenium fertilization on the accumulation of cadmium and lead in rice plants. Plant Soil 2014, 384, 131–140. [Google Scholar] [CrossRef]
29. Nie, X.; Luo, D.; Ma, H.; Wang, L.; Yang, C.; Tian, X.; Nie, Y. Different effects of selenium speciation on selenium absorption, selenium transformation and cadmium antagonism in garlic. Food Chem. 2024, 443, 138460. [Google Scholar] [CrossRef]
30. Xu, H.; Yan, J.; Qin, Y.; Xu, J.; Shohag, M.J.I.; Wei, Y.; Gu, M. Effect of Different Forms of Selenium on the Physiological Response and the Cadmium Uptake by Rice under Cadmium Stress. Int. J. Environ. Res. Public Health 2020, 17, 6991. [Google Scholar] [CrossRef] [PubMed]
31. Feng, R.; Wang, L.; Yang, J.; Zhao, P.; Zhu, Y.; Li, Y.; Yu, Y.; Liu, H.; Rensing, C.; Wu, Z. Underlying mechanisms responsible for restriction of uptake and translocation of heavy metals (metalloids) by selenium via root application in plants. J. Hazard. Mater. 2021, 402, 123570. [Google Scholar] [CrossRef] [PubMed]
32. Lai, X.; Yang, X.; Rao, S.; Zhu, Z.; Cong, X.; Ye, J.; Zhang, W.; Liao, Y.; Cheng, S.; Xu, F. Advances in physiological mechanisms of selenium to improve heavy metal stress tolerance in plants. Plant Biol. 2022, 24, 913–919. [Google Scholar] [CrossRef] [PubMed]
33. Lei, D.; Cao, H.; Zhang, K.; Mao, K.; Guo, Y.; Huang, J.; Yang, G.; Zhang, H.; Feng, X. Coupling of different antioxidative systems in rice under the simultaneous influence of selenium and cadmium. Environ. Pollut. 2023, 337, 122526. [Google Scholar] [CrossRef] [PubMed]
34. Pan, P.; Liu, H.; Liu, A.; Zhang, X.; Chen, Q.; Wang, G.; Liu, B.; Li, Q.; Lei, M. Rhizosphere environmental factors regulated the cadmium adsorption by vermicompost: Influence of pH and low-molecular-weight organic acids. Ecotoxicol. Environ. Saf. 2023, 266, 115593. [Google Scholar] [CrossRef] [PubMed]
35. Yan, Z.; Ding, W.; Xie, G.; Yan, M.; Li, J.; Han, Y.; Xiong, X.; Wang, C. Identification of cadmium phytoavailability in response to cadmium transformation and changes in soil pH and electrical conductivity. Chemosphere 2023, 342, 140042. [Google Scholar] [CrossRef] [PubMed]
36. Yao, W.-b.; Huang, L.; Yang, Z.-h.; Zhao, F.-P. Effects of organic acids on heavy metal release or immobilization in contaminated soil. Trans. Nonferrous Met. Soc. China 2022, 32, 1277–1289. [Google Scholar] [CrossRef]
37. Liu, H.; Xiao, C.; Qiu, T.; Deng, J.; Cheng, H.; Cong, X.; Cheng, S.; Rao, S.; Zhang, Y. Selenium regulates antioxidant, photosynthesis, and cell permeability in plants under various abiotic stresses. Plants 2023, 12, 44. [Google Scholar] [CrossRef] [PubMed]
38. Kim, Y.-O.; Kang, H.; Ahn, S.-J. Overexpression of phytochelatin synthase AtPCS2 enhances salt tolerance in Arabidopsis thaliana. J. Plant Physiol. 2019, 240, 153011. [Google Scholar] [CrossRef] [PubMed]
39. Jain, R.; Verma, R.; Singh, A.; Chandra, A.; Solomon, S. Influence of selenium on metallothionein gene expression and physiological characteristics of sugarcane plants. Plant Growth Regul. 2015, 77, 109–115. [Google Scholar] [CrossRef]
40. Mittler, R.; Zandalinas, S.I.; Fichman, Y.; Van Breusegem, F. Reactive oxygen species signalling in plant stress responses. Nat. Rev. Mol. Cell Biol. 2022, 23, 663–679. [Google Scholar] [CrossRef]
41. Silva, V.M.; Tavanti, R.F.R.; Gratão, P.L.; Alcock, T.D.; Dos Reis, A.R. Selenate and selenite affect photosynthetic pigments and ROS scavenging through distinct mechanisms in cowpea (Vigna unguiculata L. walp) plants. Ecotoxicol. Environ. Saf. 2020, 201, 110777. [Google Scholar] [CrossRef] [PubMed]
42. Moulick, D.; Ghosh, D.; Chandra Santra, S. Evaluation of effectiveness of seed priming with selenium in rice during germination under arsenic stress. Plant Physiol. Biochem. 2016, 109, 571–578. [Google Scholar] [CrossRef] [PubMed]
43. Jia, Y.; Kang, L.; Wu, Y.; Zhou, C.; Cai, R.; Zhang, H.; Li, J.; Chen, Z.; Kang, D.; Zhang, L. Nano-selenium foliar intervention-induced resistance of cucumber to Botrytis cinerea by activating jasmonic acid biosynthesis and regulating phenolic acid and cucurbitacin. Pest Manag. Sci. 2024, 80, 554–568. [Google Scholar] [CrossRef] [PubMed]
44. Qi, W.; Li, Q.; Chen, H.; Liu, J.; Xing, S.; Xu, M.; Yan, Z.; Song, C.; Wang, S. Selenium nanoparticles ameliorate Brassica napus L. cadmium toxicity by inhibiting the respiratory burst and scavenging reactive oxygen species. J. Hazard. Mater. 2021, 417, 125900. [Google Scholar] [CrossRef] [PubMed]
45. Kang, L.; Wu, Y.; Zhang, J.; An, Q.; Zhou, C.; Li, D.; Pan, C. Nano-selenium enhances the antioxidant capacity, organic acids and cucurbitacin B in melon (Cucumis melo L.) plants. Ecotoxicol. Environ. Saf. 2022, 241, 113777. [Google Scholar] [CrossRef] [PubMed]
46. Zhu, S.; Sun, S.; Zhao, W.; Yang, X.; Mao, H.; Sheng, L.; Chen, Z. Utilizing transcriptomics and proteomics to unravel key genes and proteins of Oryza sativa seedlings mediated by selenium in response to cadmium stress. BMC Plant Biol. 2024, 24, 360. [Google Scholar] [CrossRef] [PubMed]
47. Zhu, Z.; Chen, Y.; Shi, G.; Zhang, X. Selenium delays tomato fruit ripening by inhibiting ethylene biosynthesis and enhancing the antioxidant defense system. Food Chem. 2017, 219, 179–184. [Google Scholar] [CrossRef]
48. Liu, C.; Zhou, G.; Qin, H.; Guan, Y.; Wang, T.; Ni, W.; Xie, H.; Xing, Y.; Tian, G.; Lyu, M.; et al. Metabolomics combined with physiology and transcriptomics reveal key metabolic pathway responses in apple plants exposure to different selenium concentrations. J. Hazard. Mater. 2024, 464, 132953. [Google Scholar] [CrossRef] [PubMed]
49. Li, L.; Wang, S.; Wu, S.; Rao, S.; Li, L.; Cheng, S.; Cheng, H. Morphological and Physiological Indicators and Transcriptome Analyses Reveal the Mechanism of Selenium Multilevel Mitigation of Cadmium Damage in Brassica juncea. Plants 2023, 12, 1583. [Google Scholar] [CrossRef] [PubMed]
50. Qu, L.; Xu, Z.; Huang, W.; Han, D.; Dang, B.; Ma, X.; Liu, Y.; Xu, J.; Jia, W. Selenium-molybdenum interactions reduce chromium toxicity in Nicotiana tabacum L. by promoting chromium chelation on the cell wall. J. Hazard. Mater. 2024, 461, 132641. [Google Scholar] [CrossRef] [PubMed]
51. Wang, L.; Zhou, Q.; Zhao, B.; Huang, X. Toxic effect of heavy metal terbium ion on cell membrane in horseradish. Chemosphere 2010, 80, 28–34. [Google Scholar] [CrossRef] [PubMed]
52. Osyczka, P.; Rola, K. Integrity of lichen cell membranes as an indicator of heavy-metal pollution levels in soil. Ecotoxicol. Environ. Saf. 2019, 174, 26–34. [Google Scholar] [CrossRef] [PubMed]
53. Azizi, I.; Esmaielpour, B.; Fatemi, H. Effect of foliar application of selenium on morphological and physiological indices of savory (Satureja hortensis) under cadmium stress. Food Sci. Nutr. 2020, 8, 6539–6549. [Google Scholar] [CrossRef] [PubMed]
54. Tang, Y.; Zhao, Y.; Zhou, Y.; Li, S.; Wu, C.; Shi, G.; Hu, C.; Zhao, X. Se Ameliorates Cd Toxicity in Oilseed rape (Brassica napus L.) Seedlings by Inhibiting Cd Transporter Genes and Maintaining root Plasma Membrane Integrity. Bull. Environ. Contam. Toxicol. 2023, 111, 42. [Google Scholar] [CrossRef] [PubMed]
55. Dai, H.; Wei, S.; Skuza, L.; Jia, G. Selenium spiked in soil promoted zinc accumulation of Chinese cabbage and improved its antioxidant system and lipid peroxidation. Ecotoxicol. Environ. Saf. 2019, 180, 179–184. [Google Scholar] [CrossRef] [PubMed]
56. Przedpelska-Wasowicz, E.M.; Wierzbicka, M. Gating of aquaporins by heavy metals in Allium cepa L. epidermal cells. Protoplasma 2011, 248, 663–671. [Google Scholar] [CrossRef]
57. Wang, Q.; Kong, L.; Huang, Q.; Li, H.; Wan, Y. Uptake and translocation mechanisms of different forms of organic selenium in rice (Oryza sativa L.). Front. Plant Sci. 2022, 13, 970480. [Google Scholar] [CrossRef]
58. Vats, S.; Sudhakaran, S.; Bhardwaj, A.; Mandlik, R.; Sharma, Y.; Kumar, S.; Tripathi, D.K.; Sonah, H.; Sharma, T.R.; Deshmukh, R. Targeting aquaporins to alleviate hazardous metal(loid)s imposed stress in plants. J. Hazard. Mater. 2021, 408, 124910. [Google Scholar] [CrossRef] [PubMed]
59. Malik, D.; Sheoran, I.S.; Singh, R. Lipid composition of thylakoid membranes of cadmium treated wheat seedlings. Indian J. Biochem. Biophys. 1992, 29, 350–354. Available online: http://europepmc.org/abstract/MED/1427962 (accessed on 1 August 1992). [PubMed]
60. Wang, Q.; Zhang, Y.; Hu, H.; Hu, J.; Xiang, M.; Yang, Q. Comparative proteomics analysis of the responses to selenium in selenium-enriched alfalfa (Medicago sativa L.) leaves. Plant Physiol. Biochem. 2021, 165, 265–273. [Google Scholar] [CrossRef] [PubMed]
61. Ismael, M.A.; Elyamine, A.M.; Zhao, Y.Y.; Moussa, M.G.; Rana, M.S.; Afzal, J.; Imran, M.; Zhao, X.H.; Hu, C.X. Can selenium and molybdenum restrain cadmium toxicity to pollen grains in Brassica napus? Int. J. Mol. Sci. 2018, 19, 2163. [Google Scholar] [CrossRef] [PubMed]
62. Wang, C.; Rong, H.; Zhang, X.; Shi, W.; Hong, X.; Liu, W.; Cao, T.; Yu, X.; Yu, Q. Effects and mechanisms of foliar application of silicon and selenium composite sols on diminishing cadmium and lead translocation and affiliated physiological and biochemical responses in hybrid rice (Oryza sativa L.) exposed to cadmium and lead. Chemosphere 2020, 251, 126347. [Google Scholar] [CrossRef]
63. Cui, J.; Liu, T.; Li, Y.; Li, F. Selenium reduces cadmium uptake into rice suspension cells by regulating the expression of lignin synthesis and cadmium-related genes. Sci. Total Environ. 2018, 644, 602–610. [Google Scholar] [CrossRef] [PubMed]
64. Han, L.; Wu, X.; Zhang, X.; Hou, K.; Zhang, H.; Shen, C. Identification and functional analysis of cation-efflux transporter 1 from Brassica juncea L. BMC Plant Biol. 2022, 22, 174. [Google Scholar] [CrossRef] [PubMed]
65. Li, D.; Zhou, C.; Ma, J.; Wu, Y.; Kang, L.; An, Q.; Zhang, J.; Deng, K.; Li, J.; Pan, C. Nanoselenium transformation and inhibition of cadmium accumulation by regulating the lignin biosynthetic pathway and plant hormone signal transduction in pepper plants. J. Nanobiotechnol. 2021, 19, 316. [Google Scholar] [CrossRef] [PubMed]
66. Hsu, F.; Wirtz, M.; Heppel, S.C.; Bogs, J.; Krämer, U.; Khan, M.S.; Bub, A.; Hell, R.; Rausch, T. Generation of Se-fortified broccoli as functional food: Impact of Se fertilization on S metabolism. Plant Cell Environ. 2011, 34, 192–207. [Google Scholar] [CrossRef] [PubMed]
67. Sun, S.; Xu, X.; Tang, Z.; Tang, Z.; Huang, X.; Wirtz, M.; Hell, R.; Zhao, F. A molecular switch in sulfur metabolism to reduce arsenic and enrich selenium in rice grain. Nat. Commun. 2021, 12, 1392. [Google Scholar] [CrossRef] [PubMed]
68. Nazir, F.; Kumari, S.; Mahajan, M.; Khan, M.I.R. An explicit story of plant abiotic stress resilience: Overtone of selenium, plant hormones and other signaling molecules. Plant Soil 2023, 486, 135–163. [Google Scholar] [CrossRef]
69. Alves, L.R.; Rodrigues dos Reis, A.; Prado, E.R.; Lavres, J.; Pompeu, G.B.; Azevedo, R.A.; Gratão, P.L. New insights into cadmium stressful-conditions: Role of ethylene on selenium-mediated antioxidant enzymes. Ecotoxicol. Environ. Saf. 2019, 186, 109747. [Google Scholar] [CrossRef] [PubMed]
70. Ernst, W.H.; KRAUSS, G.J.; Verkleij, J.A.; Wesenberg, D. Interaction of heavy metals with the sulphur metabolism in angiosperms from an ecological point of view. Plant Cell Environ. 2008, 31, 123–143. [Google Scholar] [CrossRef] [PubMed]
71. Mao, S.; Wang, J.; Wu, Q.; Liang, M.; Yuan, Y.; Wu, T.; Liu, M.; Wu, Q.; Huang, K. Effect of selenium–sulfur interaction on the anabolism of sulforaphane in broccoli. Phytochemistry 2020, 179, 112499. [Google Scholar] [CrossRef] [PubMed]
72. Gupta, M.; Gupta, S. An overview of selenium uptake, metabolism, and toxicity in plants. Front. Plant Sci. 2017, 7, 2074. [Google Scholar] [CrossRef] [PubMed]
73. Pérez-Millán, R.; Alfosea-Simón, M.; Simón-Grao, S.; Cámara-Zapata, J.M.; Zavala-González, E.A.; Aranda-Martinez, A.; Shahid, M.A.; García-Sánchez, F. Effects of Se Application on Polyamines and Carbon–Nitrogen Metabolism of Pepper Plants Suffering from Cd Toxicity. Agronomy 2021, 11, 2535. [Google Scholar] [CrossRef]
74. Mehdi, Y.; Hornick, J.L.; Istasse, L.; Dufrasne, I. Selenium in the environment, metabolism and involvement in body functions. Molecules 2013, 18, 3292–3311. [Google Scholar] [CrossRef] [PubMed]
75. Jacobs, L.W. Selenium in Agriculture and the Environment; Soil Science Society of America: Madison, WI, USA, 1990; Volume 149, p. 121. [Google Scholar]
76. Li, Y.; Xiao, Y.; Hao, J.; Fan, S.; Dong, R.; Zeng, H.; Liu, C.; Han, Y. Effects of selenate and selenite on selenium accumulation and speciation in lettuce. Plant Physiol. Biochem. 2022, 192, 162–171. [Google Scholar] [CrossRef] [PubMed]
77. Di, X.; Qin, X.; Zhao, L.; Liang, X.; Xu, Y.; Sun, Y.; Huang, Q. Selenium distribution, translocation and speciation in wheat (Triticum aestivum L.) after foliar spraying selenite and selenate. Food Chem. 2023, 400, 134077. [Google Scholar] [CrossRef]
78. Yu, Y.; Fu, P.; Huang, Q.; Zhang, J.; Li, H. Accumulation, subcellular distribution, and oxidative stress of cadmium in Brassica chinensis supplied with selenite and selenate at different growth stages. Chemosphere 2019, 216, 331–340. [Google Scholar] [CrossRef] [PubMed]
79. Liao, G.; Xu, Y.; Chen, C.; Wu, Q.; Feng, R.; Guo, J.; Wang, R.; Ding, Y.; Sun, Y.; Xu, Y.; et al. Root application of selenite can simultaneously reduce arsenic and cadmium accumulation and maintain grain yields, but show negative effects on the grain quality of paddy rice. J. Environ. Manag. 2016, 183, 733–741. [Google Scholar] [CrossRef] [PubMed]
80. Han, D.; Tu, S.; Dai, Z.; Huang, W.; Jia, W.; Xu, Z.; Shao, H. Comparison of selenite and selenate in alleviation of drought stress in Nicotiana tabacum L. Chemosphere 2022, 287, 132136. [Google Scholar] [CrossRef]
81. Di, X.; Jing, R.; Qin, X.; Wei, Y.; Liang, X.; Wang, L.; Xu, Y.; Sun, Y.; Huang, Q. Transcriptome analysis reveals the molecular mechanism of different forms of selenium in reducing cadmium uptake and accumulation in wheat seedlings. Chemosphere 2023, 340, 139888. [Google Scholar] [CrossRef] [PubMed]
82. Yu, Y.; Wang, Q.; Wan, Y.; Huang, Q.; Li, H. Transcriptome analysis reveals different mechanisms of selenite and selenate regulation of cadmium translocation in Brassica rapa. J. Hazard. Mater. 2023, 452, 131218. [Google Scholar] [CrossRef] [PubMed]
83. Kicińska, A.; Pomykała, R.; Izquierdo-Diaz, M. Changes in soil pH and mobility of heavy metals in contaminated soils. Eur. J. Soil Sci. 2022, 73, e13203. [Google Scholar] [CrossRef]
84. Gu, J.; Zou, G.; Su, S.; Li, S.; Liu, W.; Zhao, H.; Liu, L.; Jin, L.; Tian, Y.; Zhang, X.; et al. Effects of pH on Available Cadmium in Calcareous Soils and Culture Substrates. Eurasian Soil Sci. 2022, 55, 1714–1719. [Google Scholar] [CrossRef]
85. Thakur, M.P.; Geisen, S. Trophic Regulations of the Soil Microbiome. Trends. Microbiol. 2019, 27, 771–780. [Google Scholar] [CrossRef] [PubMed]
86. Luo, X.; Wang, Y.; Lan, Y.; An, L.; Wang, G.; Li, M.; Zheng, S. Microbial oxidation of organic and elemental selenium to selenite. Sci. Total Environ. 2022, 833, 155203. [Google Scholar] [CrossRef] [PubMed]
87. Lei, Z.; Li, Q.; Tang, Y.; Zhang, H.; Han, C.; Wang, X.; Zhao, X.; Shi, G. Selenium enhanced nitrogen accumulation in legumes in soil with rhizobia bacteria. J. Clean. Prod. 2022, 380, 134960. [Google Scholar] [CrossRef]
88. Wu, T.; Zhou, J.; Zhou, J. Comparison of soil addition, foliar spraying, seed soaking, and seed dressing of selenium and silicon nanoparticles effects on cadmium reduction in wheat (Triticum turgidum L.). Chemosphere 2024, 362, 142681. [Google Scholar] [CrossRef] [PubMed]
89. Jiang, Z.; Wang, J.; Cao, K.; Liu, Y.; Wang, B.; Wang, X.; Wang, Y.; Jiang, D.; Cao, B.; Zhang, Y. Foliar application of selenium and gibberellins reduce cadmium accumulation in soybean by regulating interplay among rhizosphere soil metabolites, bacteria community and cadmium speciation. J. Hazard. Mater. 2024, 476, 134868. [Google Scholar] [CrossRef] [PubMed]
90. Oliveira, V.C.D.; Faquin, V.; Guimarães, K.C.; Andrade, F.R.; Pereira, J.; Guilherme, L.R.G. Agronomic biofortification of carrot with selenium. Ciência E Agrotecnol. 2018, 42, 138–147. [Google Scholar] [CrossRef]
91. Zhang, D.; Zhang, N.; Hou, Z.; Lou, D.; Ye, J. Effects of different application methods of selenite and selenate on selenium distribution within wheat. J. Plant Nutr. 2018, 41, 2729–2740. [Google Scholar] [CrossRef]
92. Li, W.; Ma, L.; Ye, Y.; Tang, Q.; Shen, Y.; Zou, Z.; Zhou, H.; Liang, C.; Wang, G. Selenium absorption, translocation and biotransformation in pak choi (Brassica chinensis L.) after foliar application of selenium nanoparticles. Food Chem. 2025, 463, 141439. [Google Scholar] [CrossRef] [PubMed]
93. Zhang, H.; Zhao, Z.; Zhang, X.; Zhang, W.; Huang, L.; Zhang, Z.; Yuan, L.; Liu, X. Effects of foliar application of selenate and selenite at different growth stages on Selenium accumulation and speciation in potato (Solanum tuberosum L.). Food Chem. 2019, 286, 550–556. [Google Scholar] [CrossRef] [PubMed]
94. Rebecca, A.J.; Babu, P.S.; Patnaik, M.C.; Hussain, S. Effect of Selenium, Sulphur and Their Interaction on Yield, Contents and Uptake by Sunflower (Helianthus annus L.). Int. J. Pure App. Biosci. 2017, 5, 1356–1363. [Google Scholar] [CrossRef]
95. Wang, K.; Wang, Y.; Wan, Y.; Mi, Z.; Wang, Q.; Wang, Q.; Li, H. The fate of arsenic in rice plants (Oryza sativa L.): Influence of different forms of selenium. Chemosphere 2021, 264, 128417. [Google Scholar] [CrossRef] [PubMed]
96. Arı, B.; Öz, E.; Can, S.Z.; Bakırdere, S. Bioaccessibility and bioavailability of selenium species in Se-enriched leeks (Allium Porrum) cultivated by hydroponically. Food Chem. 2022, 372, 131314. [Google Scholar] [CrossRef]
97. Deng, B.; Tian, S.; Li, S.; Guo, M.; Liu, H.; Li, Y.; Wang, Q.; Zhao, X. A simple, rapid and efficient method for essential element supplementation based on seed germination. Food Chem. 2020, 325, 126827. [Google Scholar] [CrossRef] [PubMed]
98. Nawaz, F.; Ashraf, M.Y.; Ahmad, R.; Waraich, E.A.; Shabbir, R.N.; Bukhari, M.A. Supplemental selenium improves wheat grain yield and quality through alterations in biochemical processes under normal and water deficit conditions. Food Chem. 2015, 175, 350–357. [Google Scholar] [CrossRef] [PubMed]
99. Sardar, R.; Ahmed, S.; Shah, A.A.; Yasin, N.A. Selenium nanoparticles reduced cadmium uptake, regulated nutritional homeostasis and antioxidative system in Coriandrum sativum grown in cadmium toxic conditions. Chemosphere 2022, 287, 132332. [Google Scholar] [CrossRef] [PubMed]
100. Jadoun, S.; Chauhan, N.P.S.; Zarrintaj, P.; Barani, M.; Varma, R.S.; Chinnam, S.; Rahdar, A. Synthesis of nanoparticles using microorganisms and their applications: A review. Environ. Chem. Lett. 2022, 20, 3153–3197. [Google Scholar] [CrossRef]
101. Chen, X.; Jiang, Y.; Wang, C.; Yue, L.; Li, X.; Cao, X.; White, J.C.; Wang, Z.; Xing, B. Selenium Nanomaterials Enhance Sheath Blight Resistance and Nutritional Quality of Rice: Mechanisms of Action and Human Health Benefit. ACS Nano 2024, 18, 13084–13097. [Google Scholar] [CrossRef] [PubMed]
102. Viltres-Portales, M.; Sánchez-Martín, M.-J.; Boada, R.; Llugany, M.; Valiente, M. Liposomes as selenium nanocarriers for foliar application to wheat plants: A biofortification strategy. Food Chem. 2024, 448, 139123. [Google Scholar] [CrossRef] [PubMed]
103. Zhang, X.; Yang, X.; Ruan, J.; Chen, H. Epigallocatechin gallate (EGCG) nanoselenium application improves tea quality (Camellia sinensis L.) and soil quality index without losing microbial diversity: A pot experiment under field condition. Sci. Total Environ. 2024, 914, 169923. [Google Scholar] [CrossRef] [PubMed]
104. Zhang, H.; Yang, D.; Hu, C.; Du, X.; Liang, L.; Wang, X.; Shi, G.; Han, C.; Tang, Y.; Lei, Z.; et al. Bacteria from the rhizosphere of a selenium hyperaccumulator plant can improve the selenium uptake of a non-hyperaccumulator plant. Biol. Fertil. Soils 2024, 60, 987–1008. [Google Scholar] [CrossRef]
105. Liu, H.; Wang, H.; Nie, Z.; Tao, Z.; Peng, H.; Shi, H.; Zhao, P.; Liu, H. Combined application of arbuscular mycorrhizal fungi and selenium fertilizer increased wheat biomass under cadmium stress and shapes rhizosphere soil microbial communities. BMC Plant Biol. 2024, 24, 359. [Google Scholar] [CrossRef]
106. Nie, M.; Wu, C.; Tang, Y.; Shi, G.; Wang, X.; Hu, C.; Cao, J.; Zhao, X. Selenium and Bacillus proteolyticus SES synergistically enhanced ryegrass to remediate Cu–Cd–Cr contaminated soil. Environ. Pollut. 2023, 323, 121272. [Google Scholar] [CrossRef] [PubMed]
107. Li, X.; Yu, Y.; Zhang, Y.; Wang, J.; She, D. Synergistic effects of modified biochar and selenium on reducing heavy metal uptake and improving pakchoi growth in Cd, Pb, Cu, and Zn–contaminated soil. J. Environ. Chem. Eng. 2024, 12, 113170. [Google Scholar] [CrossRef]
108. Liu, Y.; Huang, L.; Wen, Z.; Fu, Y.; Liu, Q.; Xu, S.; Li, Z.; Liu, C.; Yu, C.; Feng, Y. Effects of intercropping on safe agricultural production and phytoremediation of heavy metal-contaminated soils. Sci. Total Environ. 2023, 875, 162700. [Google Scholar] [CrossRef] [PubMed]
109. Liu, Y.; Schäffer, A.; Martinez, M.; Lenz, M. Environmental selenium volatilization is possibly conferred by promiscuous reactions of the sulfur metabolism. Chemosphere 2023, 345, 140548. [Google Scholar] [CrossRef]
110. Silva, M.A.; Sousa, G.F.d.; Van Opbergen, G.A.Z.; Van Opbergen, G.G.A.Z.; Corguinha, A.P.B.; Bueno, J.M.M.; Brunetto, G.; Leite, J.M.; Santos, A.A.d.; Lopes, G.; et al. Foliar Application of Selenium Associated with a Multi-Nutrient Fertilizer in Soybean: Yield, Grain Quality, and Critical Se Threshold. Plants 2023, 12, 2028. [Google Scholar] [CrossRef] [PubMed]
111. Lanza, M.; Silva, V.M.; Montanha, G.S.; Lavres, J.; Pereira de Carvalho, H.W.; Reis, A.R.D. Assessment of selenium spatial distribution using μ-XFR in cowpea (Vigna unguiculata (L.) Walp.) plants: Integration of physiological and biochemical responses. Ecotoxicol. Environ. Saf. 2021, 207, 111216. [Google Scholar] [CrossRef] [PubMed]
112. Mostofa, M.G.; Hossain, M.A.; Siddiqui, M.N.; Fujita, M.; Tran, L.-S.P. Phenotypical, physiological and biochemical analyses provide insight into selenium-induced phytotoxicity in rice plants. Chemosphere 2017, 178, 212–223. [Google Scholar] [CrossRef]
113. Saleem, M.; Fariduddin, Q. Novel mechanistic insights of selenium induced microscopic, histochemical and physio-biochemical changes in tomato (Solanum lycopersicum L.) plant. An account of beneficiality or toxicity. J. Hazard. Mater. 2022, 434, 128830. [Google Scholar] [CrossRef] [PubMed]
114. Cabral Gouveia, G.C.; Galindo, F.S.; Dantas Bereta Lanza, M.G.; Caroline da Rocha Silva, A.; Pereira de Brito Mateus, M.; Souza da Silva, M.; Rimoldi Tavanti, R.F.; Tavanti, T.R.; Lavres, J.; Reis, A.R.D. Selenium toxicity stress-induced phenotypical, biochemical and physiological responses in rice plants: Characterization of symptoms and plant metabolic adjustment. Ecotoxicol. Environ. Saf. 2020, 202, 110916. [Google Scholar] [CrossRef]
Jia S, Guan Q, Niu Y, Wang Y, Li L, Cheng H. Progress in Elucidating the Mechanism of Selenium in Mitigating Heavy Metal Stress in Crop Plants. Agriculture. 2025; 15(2):204. https://doi.org/10.3390/agriculture15020204
Перевод статьи «Progress in Elucidating the Mechanism of Selenium in Mitigating Heavy Metal Stress in Crop Plants» авторов Jia S, Guan Q, Niu Y, Wang Y, Li L, Cheng H., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык

































































































Комментарии (0)