Влияние органического земледелия на качество винограда: взаимосвязь между элементарным профилем почвы и биологически активными свойствами винограда.
Виноградарство переходит на органическое управление для снижения воздействия на окружающую среду. Виноград, собранный на органических виноградниках (ORG), может иметь лучший профиль полифенолов, чем виноград с традиционных виноградников (CON). Целью было оценить взаимосвязь между системой земледелия, элементарным профилем почвы и биологически активными соединениями в винограде (сорта Syrah и Tempranillo). Компоненты почвы из виноградников CON и ORG были определены и соотнесены с биологически активными соединениями в кожице и семенах винограда с помощью анализа главных компонент (PCA).
Аннотация
Виноградник ORG показал более высокие значения: влажности (4.50–5.72%), содержания глины (31.70–40.55%), органического вещества (OM) (9.44–11.01%), P (108.72–122.16 мг/кг), N (0.27 мг/кг) и оксидов (Fe₂O₃, SiO₂, MnO, TiO₂) в почве, а также фенольных соединений (мирицетин, кверцетин, ресвератрол, эллаговая кислота и другие) и антиоксидантной активности в кожице и семенах винограда.
Согласно PCA (>74.20% дисперсии), первая компонента показала положительные корреляции (>0.60) между pH, влажностью, глиной и оксидами почвы (MgO, K₂O, Al₂O₃), которые способствовали биосинтезу фенолов в кожице и семенах винограда (катехин, галловая кислота, ванилиновая кислота и рутин). Вторая компонента показала положительные корреляции между OM, илом, оксидами почвы, антиоксидантной активностью и фенолами в кожице и семенах винограда.
В заключение, почвенные условия виноградника ORG позволили получать оптимальный для виноделия виноград благодаря его более высокому содержанию фенолов.
1. Введение
В настоящее время мировое производство винограда и вина оказывает положительное влияние на экономику, технологии и науку [ 1 , 2 ]. Международная организация винограда и вина (OIV) указала, что к 2023 году виноградные плантации во всем мире превысят 7 миллионов га [ 3 ]. Таким образом, предполагается, что в период 2023–2024 годов для виноделия будет произведено около 281 миллиона тонн винограда [ 4 ]. В этом смысле в Мексике 16 штатов, занимающихся производством винограда и вина, что ставит ее на 33-е место в мире по производству [ 5 , 6 , 7 ]. В 2023 году сообщалось, что виноградные посадки превысили 35 000 га, что привело к производству около 452 000 тонн винограда [ 6 ].
В 2023 году OIV указал на глобальное снижение производства вина на 10% по сравнению с 2022 годом. Эта тенденция объясняется изменением климата и эрозией почвы, которые напрямую повлияли на производство винограда [ 8 ]. В ответ на это виноделы начали внедрять устойчивое управление сельским хозяйством, чтобы смягчить свое негативное воздействие на окружающую среду [ 9 , 10 ]. В этом контексте органическое управление сельским хозяйством в виноградарстве помогает снизить негативное воздействие на биоразнообразие, сводит к минимуму использование потенциально токсичных агрохимикатов, усиливает контроль местных дрожжей и способствует развитию круговой экономики [ 11 ]. Однако различные авторы упоминают, что внедрение органических практик позволяет оказывать положительное социально-экономическое воздействие на местном и региональном уровнях [ 12 ]. Кроме того, органическое сельское хозяйство в основном характеризуется типами используемых удобрений (компост, вермикомпост, навоз и другие), которые позволяют больше добавлять и сохранять питательные вещества. В этом смысле органические виноградники обычно имеют более высокий уровень необходимых питательных веществ для правильного роста лозы [ 13 , 14 ]. Аналогичным образом, не используя пестициды в качестве защитной реакции на фитопатогены, растение обеспечивает большую выработку вторичных метаболитов в винограде, которые имеют высокую технологическую ценность в виноградарстве [ 11 ].
В настоящее время в Мексике существует ограниченное количество научных исследований, изучающих влияние агротехнического управления виноградниками или элементного профиля почв на содержание фенольных соединений в винограде [ 15 , 16 , 17 ]. В этом контексте биосинтез биологически активных соединений зависит от сорта винограда и различных факторов, определяющих терруар региона [ 18 ]. Эти соединения в основном развиваются в кожице и косточках винограда и имеют значительную технологическую ценность в виноградарстве, поскольку они влияют на сенсорные свойства, включая цвет и вкус производимого вина [ 18 , 19 ]. Аналогичным образом, более высокое содержание биологически активных соединений тесно связано с функциональными свойствами винограда, такими как антиоксидантная активность.
Исходя из вышеизложенного, углублённых исследований влияния агротехники на виноградниках и элементного состава почв на биосинтез биологически активных соединений в кожице и косточках винограда не проводилось. В связи с этим внедрение органического агротехники в виноградарство может положительно повлиять на качество винограда, используемого для виноделия. Целью данного исследования является оценка взаимосвязи между агротехникой (органической и традиционной) на виноградниках, элементным составом почв и качеством собранного винограда сортов Сира и Темпранильо, с особым акцентом на фенольный профиль и антиоксидантную активность кожицы и косточек.
2. Материалы и методы
2.1. Химикаты и реагенты
Реагенты и аналитические химикаты, использованные в данном исследовании, были получены от Karal (Леон, Мексика), Sigma-Aldrich (Сент-Луис, Миссури, США), Thermo Fisher (Уолтем, Массачусетс, США) и Merck (Дармштадт, Германия).
2.2. Зона обучения
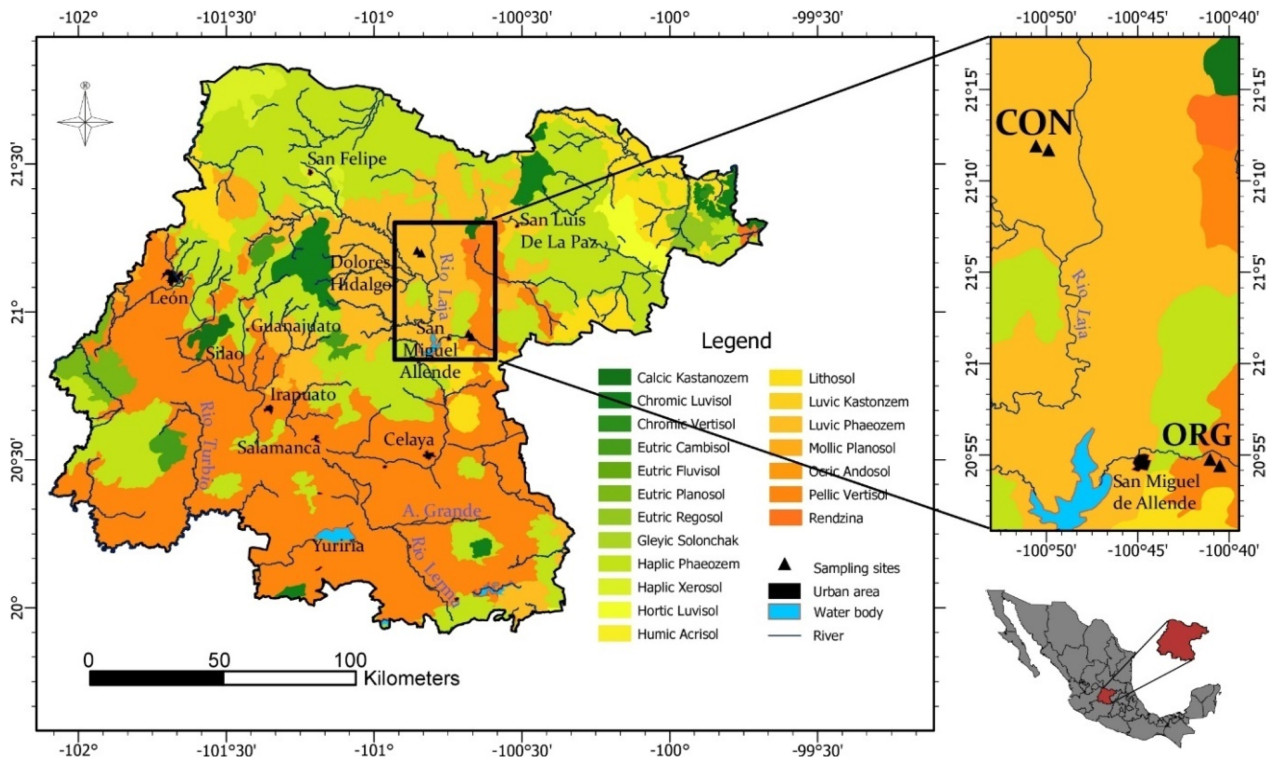
Два виноградника были выбраны в штате Гуанахуато, Мексика, с различным агрохозяйственным управлением: традиционным (CON) (21°12′29″ LN 100°51′08″ LO; Долорес Идальго Куна де ла Индепенденсия Насиональ) и органическим (ORG) (20°54′33″ LN 100°40′45″ LO; Сан-Мигель-де-Альенде) ( Рисунок 1 ). Что касается агротехнических условий, виноградник CON использовал систему капельного орошения, химическое удобрение и химическую фумигацию. В то же время виноградник ORG имеет систему капельного орошения, удобрение из компоста и навоза, а также сетку для защиты от птиц и насекомых. В случае изучаемых сортов винограда для обоих виноградников были выбраны сорта винограда Сира (SY) и Темпранильо (TE). Виноград SY характеризуется сине-черным оттенком и средним размером; он также хорошо адаптирован к разным климатам [ 18 ]. В то же время виноград TE характеризуется высоким содержанием сахара и сине-черным оттенком; кроме того, он рано созревает и лучше развивается в местах с высокой солнечной радиацией [ 18 ]. С другой стороны, почвы, отобранные из CON, относятся к физико-географической провинции Сьерра-Мадре-Ориентал со средней высотой 2200 м над уровнем моря. Доминирующими породами в этом районе являются песчаники, отложенные на плиоценовых риолитовых туфах, в то время как в окружающих регионах доминируют четвертичные аллювиальные отложения. Напротив, почвы ORG находятся в физико-географической провинции Трансмексиканского вулканического пояса [ 20 ], геологической среде, характеризующейся вулканическими куполами с высотами, достигающими 2000 м над уровнем моря. Доминирующая литология представлена излившимися породами, в основном миоценовыми базальтами и андезитами, а также обширными отложениями песчаников и конгломератов неогенового (плиоценового) возраста. На рисунке 1 представлена почвенная карта штата Гуанахуато. Так, на винограднике CON представлен Luvic Phaeozem, а на винограднике ORG – Pellic Vertisol. Результаты, полученные при изучении физико-химических свойств различных почв в данном исследовании, совпадают с характеристиками обоих почвенных отделов, классифицированных для штата [ 21 ].
Рисунок 1. Почвенная карта штата Гуанахуато с указанием образцов почвы, полученных на обычных (CON) и органических (ORG) виноградниках.
Среднегодовые значения температуры, количества осадков и испарения для виноградника CON составляют 16,77 °C, 403,38 мм и 1191,31 мм соответственно, а годовой водный баланс – −788,52 мм. Для виноградника ORG среднегодовые значения температуры, количества осадков и испарения составляют 16,47 °C, 473,26 мм и 1467,01 мм соответственно, а годовой водный баланс – −993,75 мм. Кроме того, в течение вегетационного периода (март–август) на винограднике CON средняя температура составила 18,87 ± 1,30 °C, количество осадков – 44,57 ± 30,53 мм, испаряемость – 116,65 ± 12,97 мм, а водный баланс – −72,08 ± 36,73 мм. В то же время на винограднике ORG средняя температура составила 18,50 ± 1,19 °C, количество осадков – 52,20 ± 36,27 мм, испаряемость – 146,90 ± 14,82 мм, а водный баланс – −94,70 ± 49,40 мм.
2.3 Отбор проб винограда и почвы
Отбор проб почвы и винограда проводился в июле и августе 2023 года, поскольку в эти месяцы виноград достигает своей оптимальной зрелости для сбора урожая. Отбор проб почвы и их подготовка проводились в соответствии с NOM-021-SEMARNAT-2000 [ 22 ]. Для каждого виноградника и исследуемого участка применялась зигзагообразная схема отбора проб с тремя составными образцами (каждый из которых состоял из 20 подвыборок), собранными на глубине 0–30 см от поверхности. С другой стороны, виноград сортов SY и TE собирался случайным образом с лоз, расположенных на поверхности, где брались образцы почвы. Виноград с обоих виноградников не показал присутствия Botrytis cinerea . Кроме того, лозы, с которых был собран виноград, были посажены в 2016 году (7 лет).
2.4 Анализ почвы
2.4.1 Физико-химические свойства
Физико-химические свойства почвы определялись по NOM-021-SEMARNAT-2000 [ 22 ]. Содержание влаги определялось гравиметрическим методом при температуре 105 °C в течение 24 часов. Цвет почвы получали с помощью таблицы Манселла. Фракции размера частиц (% глины, ила и песка) определялись методом Боюкоса. Аналогичным образом, насыпная плотность и истинная плотность определялись методами пробирки и пикнометра соответственно. pH и электропроводность (EC) измерялись при соотношении 1:5 вес / объем с дистиллированной водой с помощью потенциометра Orion Star A214 (Thermo Scientific™, Waltham, MA, USA) и кондуктометра PC45 (Conductronic, Puebla, Mexico) соответственно. Процентное содержание органического вещества (ОВ) и карбоната кальция (CaCO 3 ) определяли методом потери массы при прокаливании (ППП) при 550 °C в течение 3 ч и 950 °C в течение 2 ч [ 23 ]. Кроме того, процентное содержание общего азота (N) определяли методом Кьельдаля, предложенным в NOM-021-SEMARNAT-2000 [ 22 ]. Наконец, извлекаемый фосфор (P) определяли спектрофотометрическим методом при длине волны 882 нм, используя методологию, предложенную Бреем и Курцем [ 24 ].
2.4.2. Элементный состав профиля
Химический состав почвы анализировали с помощью рентгенофлуоресцентного спектрометра X NEX CG (Rigaku, Токио, Япония) с энергодисперсионным анализом (ЭДРФ). Анализ проводили с помощью рентгеновской трубки с Pd-анодом, максимальной мощностью 50 Вт, напряжением 50 кВ и силой тока 2 мА в атмосфере гелия. Калибровка проводилась по стандартному МКА® . Образцы почвы анализировали при размере частиц <75 мкм.
2.5 Анализ винограда
2.5.1 Определение биологически активных соединений
Извлечение биологически активных соединений
Метанольный экстракт, используемый для определения общего содержания биологически активных соединений, был получен путем ручного разделения кожицы и косточек винограда. Затем кожицу и косточки измельчали по отдельности. Образец массой 5 г добавляли к 50 мл метанола (80% об. / об. ) и перемешивали в течение 1 часа без доступа света с помощью шейкера KS 3000 i control shaker (IKA, Уилмингтон, Делавэр, США). Затем смесь помещали в центрифугу C-40 (SOL-BAT, Пуэбла, Мексика) на 15 минут при 3500 об./мин и собирали надосадочную жидкость [ 25 , 26 ].
Общее содержание фенолов
Определение общего содержания фенолов (ОСФ) проводилось на основе методологии, предложенной Gulcü et al. [ 27 ], с некоторыми модификациями. Образец экстракта объемом 20 мкл смешивали с 480 мкл дистиллированной воды и 250 мкл 1 N реагента Фолина-Чокальтеу, и смесь оставляли реагировать в течение 8 мин. Затем добавляли 1250 мкл карбоната натрия (7,5%), и образцы оставляли на 1 ч в темноте. Наконец, измеряли поглощение при 765 нм с помощью спектрофотометра Genesys 10S UV-vis (Thermo Scientific™, Waltham, MA, USA). Результаты выражали в миллиграммах эквивалента галловой кислоты на грамм сухого образца (мг ГАЭ/г DW).
Общее содержание антоцианов
Общее содержание антоцианов (TAC) определяли методом дифференциального pH, следуя методологии, предложенной Ли и соавторами [ 28 ], с некоторыми модификациями. Брали аликвоту экстракта объемом 500 мкл и добавляли 1750 мкл буфера с pH 1. Аналогичным образом брали еще 500 мкл экстракта, к которому добавляли 1750 мкл буфера с pH 4,5. Оба раствора затем оставляли на 15 минут в отсутствие света. Наконец, показания поглощения снимали при 520 нм и 700 нм с помощью спектрофотометра Genesys 10S UV–vis (Thermo Scientific™, Уолтем, Массачусетс, США). Результаты рассчитывали и выражали в миллиграммах цианидин-3-глюкозида на грамм сухого образца (мг C3G/г DW) по уравнению (1) следующим образом:
где A — разность поглощений, измеренных при разных значениях pH, MW — молекулярная масса цианидин-3-глюкозида (449 г/моль), DF — коэффициент разбавления, VE — объем экстракта, Ɛ — молярный коэффициент экстинкции цианидина, а M — масса образца пищевого продукта.
Конденсированные танины
Содержание конденсированных танинов (CTs) определяли по методологии Cheaib et al. [ 29 ] с некоторыми модификациями. Аликвоты по 1000 мкл экстракта образца добавляли в две разные пробирки, затем добавляли 500 мкл дистиллированной воды и 1500 мкл 12 N HCl. Затем одну из пробирок нагревали при 100 °C в течение 30 минут, в то время как вторую пробирку поддерживали при комнатной температуре. После этого в каждую пробирку добавляли по 250 мкл этанола и измеряли поглощение при 520 нм с помощью спектрофотометра Genesys 10S UV–vis (Thermo Scientific™, Уолтем, Массачусетс, США). Результаты рассчитывали и выражали в миллиграммах на грамм сухого образца (мг/г DW) по уравнению (2) следующим образом:
где Abs 1 — поглощение образца при комнатной температуре, а Abs 2 — поглощение образца, подвергнутого воздействию 100 °C.
Идентификация индивидуальных фенольных соединений
Идентификацию отдельных фенольных соединений в кожуре и семенах проводили с помощью высокоэффективного жидкостного хроматографа Waters Separations Module e2695 (Conquer Scientific, Poway, CA, США), оснащенного УФ-видимым детектором 2489 (Waters, Milford, CT, США) и колонкой C18 (2,7 мкм, 3,0 × 100 мм) для идентификации и количественного определения различных полифенолов. Прямые пробы фильтровали через стерильный нейлоновый фильтр диаметром 25 мм с размером пор 0,20 мкм и помещали во флаконы янтарного цвета объемом 2 мл для автоматического ввода проб. Образцы анализировали при длине волны 280 нм, скорости потока 0,30 мл/мин, температуре 20 °C и давлении 1500 фунтов на кв. дюйм (1500 фунтов на кв. дюйм), с общим временем анализа 45 мин на образец. В качестве фаз использовали ацетонитрил (чистый) и подкисленную воду (0,2% уксусной кислоты) в градиенте, начинающемся и заканчивающемся при соотношении ацетонитрил: подкисленная вода 0:100 и заканчивающемся градиентом 40:60. Для промывки использовали метанол. Все фазы имели класс чистоты «для ВЭЖХ» и были предварительно профильтрованы через нейлоновый мембранный фильтр с диаметром пор 47 мм и размером пор 0,20 мкм (Merck, Дармштадт, Германия). Данные обрабатывали с помощью программного обеспечения Empower 3 (Waters, Милфорд, Коннектикут, США). В качестве стандартов Merck (Дармштадт, Германия) использовались кофейная кислота (CAS № 331-39-5), катехин (CAS № 225937-10-0), хлорогеновая кислота (CAS № 327-97-9), эллаговая кислота (CAS № 476-66-4), эпикатехин (CAS № 989-51-5), феруловая кислота (CAS № 537-98-4), галловая кислота (CAS № 149-91-7), кемпферол (CAS № 520-18-3), мирицетин (CAS № 529-44-2), п -кумаровая кислота (CAS № 501-98-4), кверцетин (CAS № 117-39-5), ресвератрол (CAS № 501-36-0), рутин (CAS № 250249-75-3), сиреневая кислота (CAS № 530-57-4) и ванилиновая кислота (CAS № 121-34-6). Результаты выражались в микрограммах на миллилитр образца (мкг/мл).
2.5.2 Определение антиоксидантной активности in vitro
Антиоксидантную способность in vitro определяли с использованием методологии ингибирования радикального 2,2-дифенил-1 прикрилгидразила (DPPH) [ 30 , 31 ]. Начиная с 12 × 10⁻ 5 М разведения радикала DPPH в метаноле, начальное поглощение измеряли при 515 нм. После этого 100 мкл экстракта образца добавляли к 3900 мкл раствора DPPH. Раствор оставляли стоять в темноте на 30 мин, а затем снимали показания поглощения при 515 нм с помощью спектрофотометра Genesys 10S UV–vis (Thermo Scientific™, Waltham, MA, USA). Результаты выражали в микромолях эквивалента Trolox на грамм сухого образца (мкмоль экв. Trolox/г DW).
2.6 Статистический анализ
Был проведен многофакторный дисперсионный анализ (ANOVA), в котором в качестве независимых переменных рассматривались методы ведения сельского хозяйства (CON и ORG) и сорт винограда (SY и TE). Кроме того, был проведен апостериорный анализ Тьюки с использованием программы Statgraphics Centurion XVI (Statgraphics Technologies, Inc., Уоррентон, Вирджиния, США) для определения наличия значимых различий ( p < 0,05) между винодельческими регионами. Впоследствии был проведен главный компонентный анализ (PCA) с использованием программного обеспечения Jamovi 2.4.11 (Jamovi, Сидней, Австралия) для оценки корреляций между изучаемыми свойствами почвы, биоактивными свойствами и антиоксидантной активностью в кожице и косточках собранного винограда [ 16 , 32 ].
3. Результаты и обсуждение
3.1 Физико-химические свойства и химический состав почв
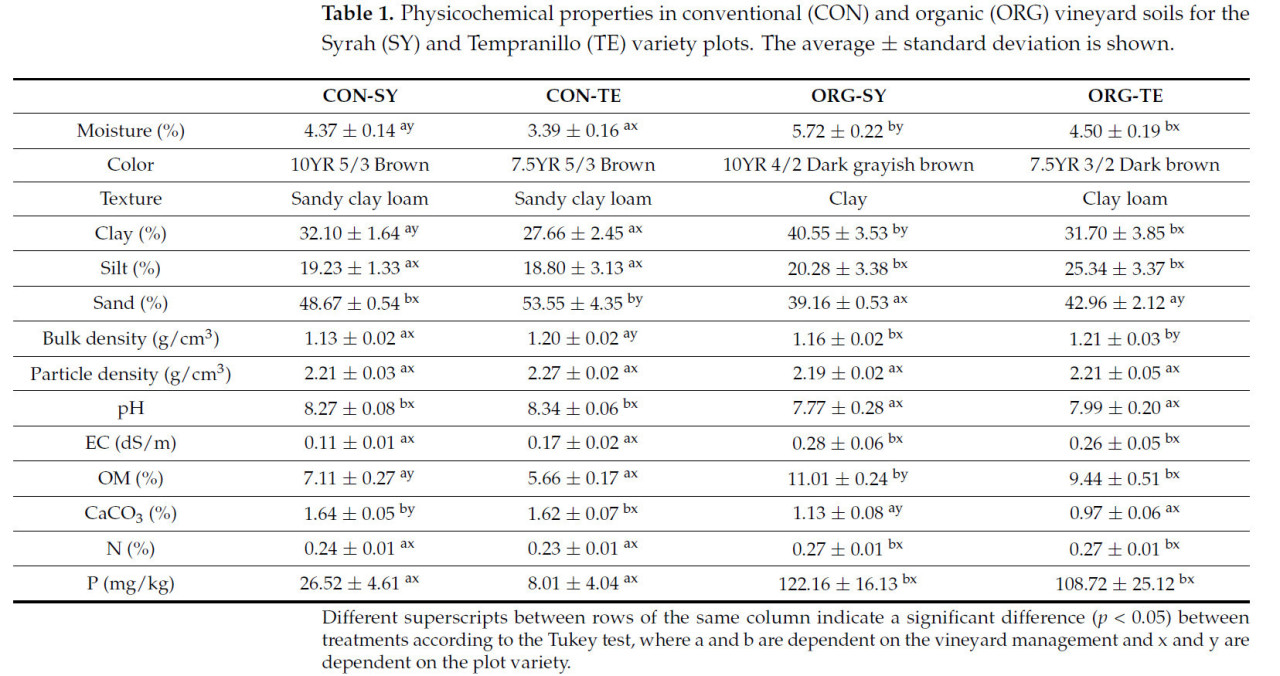
Почвы CON имели ( p < 0,05) на 24,00% меньше влаги по сравнению с ORG ( таблица 1 ). Значения, наблюдаемые на обоих виноградниках этого исследования, сопоставимы со значениями, полученными для почв виноградников в Нижней Калифорнии, на севере Мексики, где преобладают засушливые условия [ 16 ]. Аналогичным образом, полученная влажность согласуется с климатом и отрицательным дефицитом воды в изучаемом регионе (>−700 мм/год). С другой стороны, более высокое содержание влаги можно отнести к большему количеству органического вещества (OM), присутствующего в почвах ORG (10,22 ± 1,10%). Таким образом, почвы ORG показали на 37,55% больше OM ( p < 0,05) по сравнению с CON (6,38 ± 1,02%) ( таблица 1 ). Действительно, OM увеличивает уровни P и K, а также улучшает пористость и водоудерживающую способность почв виноградников [ 33 ]. Более того, участки SY показали на 16,63% больше OM, чем TE. Это увеличило бы способность удерживать питательные вещества, такие как N, P и другие катионы из-за образования глинисто-гуминового комплекса [ 34 ]. Содержание N (0,27 ± 0,00%) и P (115,44 ± 9,50 мг/кг) на участках ORG было выше ( p < 0,05) по сравнению с CON (N: 0,23 ± 0,00% и P: 17,27 ± 13,08 мг/кг). Некоторые авторы сообщали, что удобрение N может снизить обменную кислотность (pH KCl) почвы [ 35 ]. Что касается P, полученные процентные значения близки к указанным Christou et al. [ 36 ] для обычных и органических виноградников [ 37 ]. В этом смысле некоторые органические удобрения влияют на доступность фосфора, калия и азота [ 38 ].
Таблица 1. Физико-химические свойства обычных (CON) и органических (ORG) почв виноградников сортов Сира (SY) и Темпранильо (TE). Приведены средние значения ± стандартное отклонение.
Участки виноградника CON имели песчано-суглинистую текстуру (глина: 29,38 ± 2,43% и песок: 51,11 ± 3,45%). В случае виноградника ORG участок SY имел глинистую текстуру (глина: 40,55 ± 3,53% и песок: 39,16 ± 0,53%), а участок TE – суглинистую текстуру (глина: 31,70 ± 3,85 и песок: 42,96 ± 2,12). Между тем, что касается pH, почвы CON имели ( p < 0,05) более щелочной pH (8,31 ± 0,04), чем ORG (7,88 ± 0,15). В этом смысле значения pH классифицируются как среднещелочные в соответствии с национальным стандартом. Эти результаты аналогичны результатам, полученным на виноградниках Мексики [ 16 , 39 ], где некоторые авторы отмечают, что идеальный pH почвы составляет от 5,5 до 8,0; поэтому все проанализированные почвы соответствуют этому оптимальному pH. В случае электропроводности (EC) почвы виноградника ORG оказались на 48,17% более электропроводными ( p < 0,05) по сравнению с CON. EC, представленный всеми виноградниками, низкий, на что может влиять содержание удобрений, влажность и засоленность местности или естественная промывка почв и отложений водосборной площади [ 16 , 40 ].
Между тем, что касается содержания CaCO 3 , почвы CON содержали на 35,34% больше CaCO 3 ( p < 0,05) по сравнению с ORG. В этом смысле кальций влияет на биосинтез абсцизовой кислоты и закрытие устьиц, что вызывает стресс у растений [ 41 , 42 ]. Аналогичным образом, более высокие проценты CaCO 3 в почвах CON можно объяснить осаждением минерала в присутствии богатой Ca материнской породы (риолитов, богатых амфиболами, пироксенами и плагиоклазами). Это сопровождается высокой скоростью испарения в исследуемой области (CON: 1191,91 мм и ORG: 1467,01 мм).
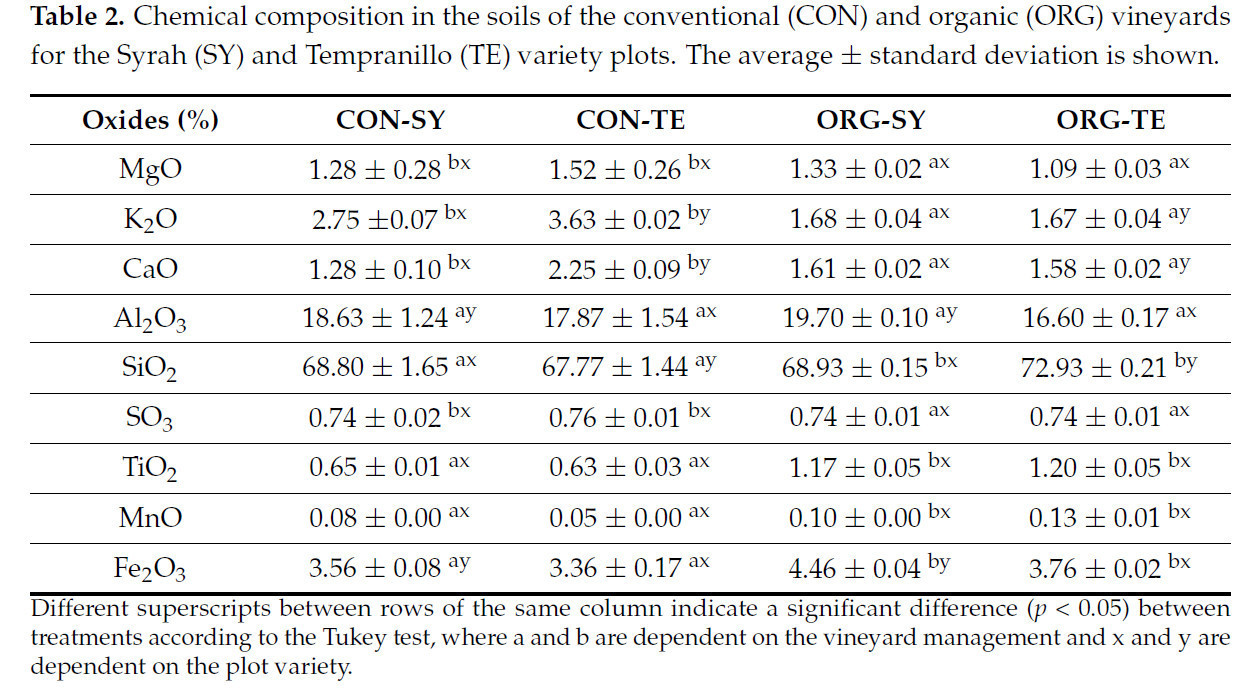
Что касается химического состава почвы, влияние материнской породы в изучаемых почвах отражается в содержании большинства оксидов. Так, на участках CON было более высокое содержание ( p < 0,05) MgO, CaO, SO 3 и K 2 O, последнее из-за присутствия кислых магматических пород с минералами, богатыми K (биотитами). С другой стороны, на участках ORG было более высокое содержание ( p < 0,05) Fe 2 O 3 , MnO, TiO 2 и SiO 2 из-за присутствия вулканических пород, богатых Fe, Mn и Ti. Аналогично этому исследованию, Гаэта и др. [ 43 ] сообщили о высоком процентном содержании SiO 2 , Al 2 O 3 , K 2 O, CaO и FeO в почвах виноградников, расположенных в Монти Альбано, Италия, где доминирующими породами в этом районе являются пирокластические породы, образованные вулканическими извержениями. Для обоих виноградников наиболее распространенными оксидами были Al2O3 и SiO2 . Более того, на участках SY было представлено на 10,08% больше Al2O3 ( p < 0,05 ) по сравнению с TE ( таблица 2 ). Некоторые авторы отмечают, что избыток ионов алюминия может снизить pH почвы до 5,5 [ 44 ]. Между тем , почвы ORG содержали на 3,73% больше SiO2 ( p < 0,05) , чем CON. В этом смысле Si улучшает структуру клеточной стенки и повышает устойчивость к засухе, морозу и вредителям [ 45 , 46 ].
Таблица 2. Химический состав почв традиционных (CON) и органических (ORG) виноградников для сортов Сира (SY) и Темпранильо (TE). Приведены средние значения ± стандартное отклонение.
3.2. Биоактивные свойства и антиоксидантная активность винограда
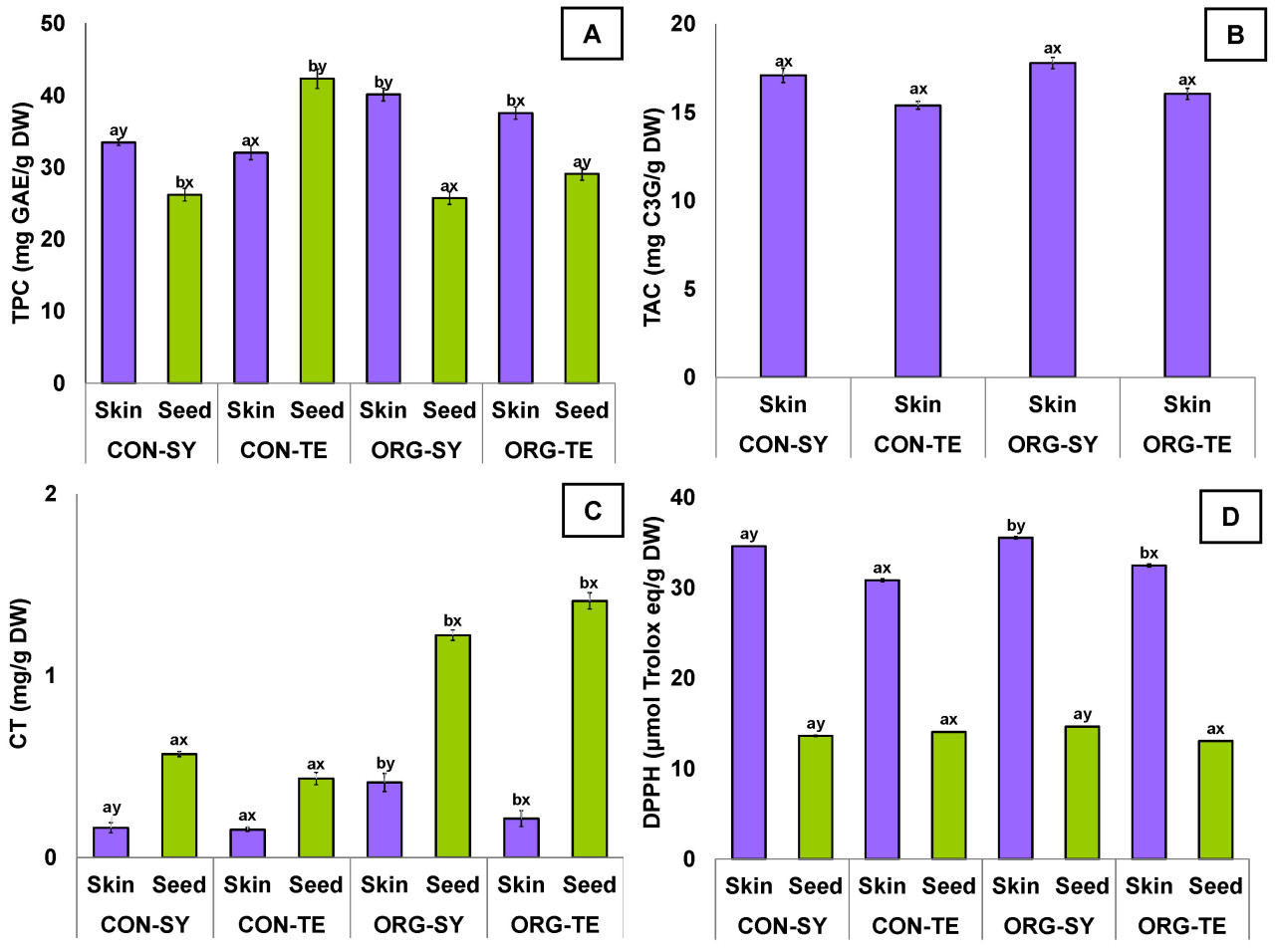
На рисунке 2 показана концентрация общих биоактивных соединений и антиоксидантная активность в кожице и косточках винограда. Что касается общего содержания фенолов (ОСФ) ( рисунок 2 А), виноград ORG (38,83 ± 1,82 мг ГАЭ/г) показал на 15,63% больше ОФС ( p < 0,05) в своей кожице, чем CON (32,76 ± 1,00 мг ГАЭ/г). Это может быть связано с тем, что растения, выращенные в органической системе без пестицидов, производят больше природных веществ, таких как ОФС, для защиты от вредителей [ 11 , 47 ]. Кроме того, виноград SY (36,79 ± 4,70 мг ГАЭ/г) показал на 5,43% больше ( p < 0,05) ОФС в своей кожице по сравнению с TE (34,79 ± 3,88 мг ГАЭ/г); Эти результаты согласуются с данными, полученными некоторыми авторами в отношении кожицы винограда сортов Каберне Совиньон, Мерло, Фетяска Нягрэ, Пино Нуар и Мускат Гамбургский [ 11 , 48 , 49 ].
Рисунок 2. Общее содержание фенолов (ОСФ) ( A ), общее содержание антоцианов (ОСА) ( B ), конденсированные танины (КТ) ( C ) и антиоксидантная активность (ДФПГ) ( D ) в кожице и косточках винограда с традиционных (КОН) и органических (ОРГ) виноградников для сортов Сира (СИ) и Темпранильо (ТЕ). Разные верхние индексы между строками одного столбца указывают на значительную разницу ( p < 0,05) между обработками согласно тесту Тьюки, где a и b зависят от метода обработки виноградника, а x и y — от сорта.
С другой стороны, виноград сорта КОН (34,26 ± 11,40 мг ГАЭ/г) показал на 20,01% больше ОПС ( p < 0,05) в своих семенах по сравнению с сортом ОРГ (27,40 ± 2,37 мг ГАЭ/г) ( рисунок 2 А). Кроме того, виноград сорта ТЕ (35,7 ± 9,36 мг ГАЭ/г) показал на 27,28% больше ОПС в своих семенах, чем сорт СИ (25,96 ± 0,33 мг ГАЭ/г); эти результаты близки к результатам, указанным Лорреном и соавторами [ 48 , 49 ] для винограда Каберне Совиньон и Мерло.
Что касается общего содержания антоцианов (ОАЦ) в кожице винограда ( Рисунок 2B ), статистически значимой разницы не наблюдалось ( p > 0,05). Что касается содержания конденсированных танинов (КТ) ( Рисунок 2C ), виноград ORG (0,31 ± 0,13 мг/г) содержал на 49,33% больше ( p < 0,05) ТС в своей кожице, чем виноград CON (0,15 ± 0,01 мг/г). Аналогично, виноград SY (0,28 ± 0,18 мг/г) содержал на 36,15% больше ( p < 0,05) ТС в своей кожице по сравнению с TE (0,18 ± 0,05 мг/г). В случае винограда из косточек, виноград ORG (1,31 ± 0,13 мг/г) показал на 61,87% больше ( p < 0,05) TC в своих семенах, чем CON (0,50 ± 0,09 мг/г), эти результаты совпадают с данными, полученными Боссо и др. [ 50 ] для винограда сорта Неббиоло (1,31 ± 0,13 мг/г).
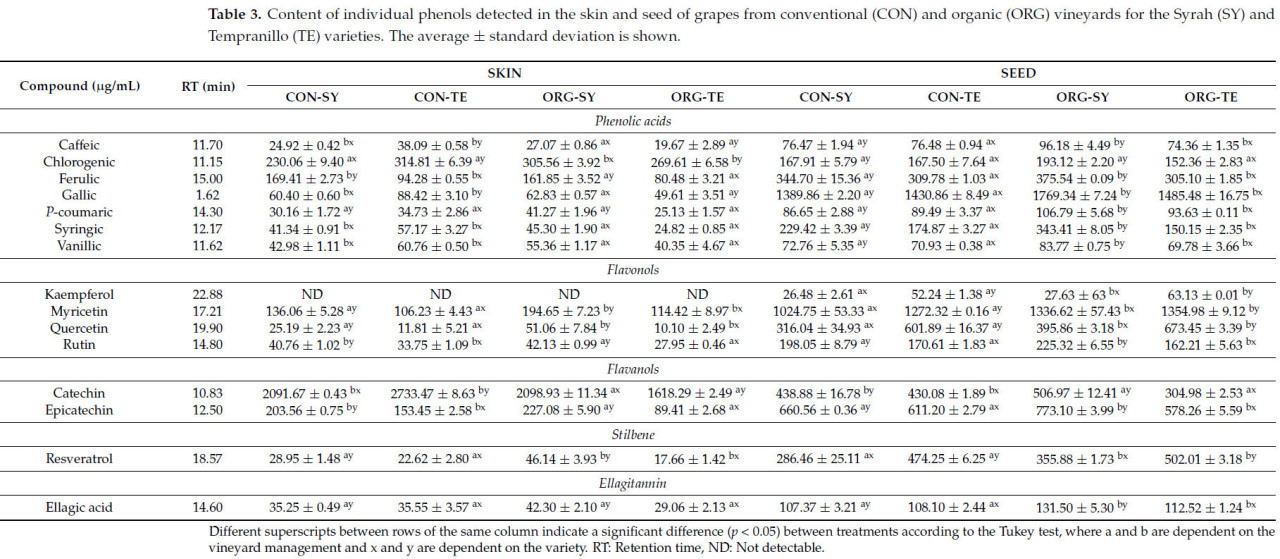
В таблице 3 показано содержание отдельных фенолов, обнаруженных методом ВЭЖХ в кожице и косточках винограда. Так, в кожице винограда сорта КОН было обнаружено более высокое содержание ( p < 0,05) кофейной кислоты (25,81%), катехина (22,96%), эпикатехина (11,34%), феруловой кислоты (8,09%), сиреневой кислоты (28,81%), ванилиновой кислоты (7,74%), галловой кислоты (24,43%) и рутина (5,95%) по сравнению с кожицей винограда сорта ОРГ. Наши результаты совпадают с данными, полученными Корралесом и соавторами [ 51 ], которые обнаружили более высокое содержание катехина и эпикатехина в кожице обычного винограда по сравнению с органическим. Кроме того, другие авторы упоминали, что более высокое содержание Ca, Mg и K2O в почве положительно влияет на биосинтез фенолов (кофейной кислоты, феруловой кислоты, сиреневой кислоты, ванильной кислоты и галловой кислоты) и флавоноидов (рутина), это согласуется с более высоким содержанием этих элементов в почвах и винограде CON ( таблица 2 и таблица 3 ) [ 52 ]. Аналогичным образом, кожица винограда ORG показала более высокий процент хлорогеновой кислоты (5,26%), мирицетина (21,60%), кверцетина (30,59%) и ресвератрола (19,17%) по сравнению с CON. Результаты совпадают с другими отчетами, которые указывают на более высокое содержание кверцетина в органической виноградной кожице, чем в обычной [ 51 , 53 ]. Кроме того, компоненты почвы (глина, pH, влажность, Al, Fe и другие) напрямую влияют на содержание флавонолов в винограде, в основном кверцетина, мирицетина и рутина [ 15 ]; зарегистрированные значения попадают в пределы их повышенного содержания в почвах ORG и винограде ( таблица 1 , таблица 2 и таблица 3 ). Что касается сортов винограда, кожица SY показала более высокие проценты ( p < 0,05) эпикатехина (43,60%), мирицетина (33,28%), рутина (25,55%), кверцетина (67,95%), ресвератрола (46,34%), эллаговой кислоты (16,68%) и p -кумаровой кислоты (16,19%), чем TE. Следовательно, содержание биологически активных соединений напрямую зависит от сорта винограда, подвоя (поглощение питательных веществ) и свойств почвы [ 53 , 54 , 55 ]. Таким образом, сорт SY имеет более высокое содержание фенольных соединений в осушенных почвах с высоким содержанием железа [ 55 ], что совпадает с нашими исследованиями ( таблица 2 ). В то же время, в кожуре сорта TE было обнаружено более высокое содержание ( p < 0,05) кофейной кислоты (9,97%), катехина (3,70%), хлорогеновой кислоты (8,34%) и галловой кислоты (10,71%) по сравнению с сортом SY.
Таблица 3. Содержание отдельных фенолов, обнаруженных в кожице и косточках винограда сортов Сира (SY) и Темпранильо (TE) с традиционных (CON) и органических (ORG) виноградников. Приведены средние значения ± стандартное отклонение.
Семена ORG показали более высокий процент ( p < 0,05) кофейной кислоты (10,31%), эллаговой кислоты (11,69%), эпикатехина (5,82%), феруловой кислоты (3,84%), галловой кислоты (13,33%), кемпферола (13,25%), рутина (4,87%), мирицетина (14,65%), p -кумаровой кислоты (12,11%), кверцетина (14,15%), ресвератрола (11,32%), сиреневой кислоты (18,08%) и ванилиновой кислоты (6,42%) по сравнению с CON ( таблица 3 ). Лоза синтезирует кверцетин, кемпферол и эллаговую кислоту для защиты от патогенов. Поэтому органическое управление, не использующее пестициды, имеет тенденцию производить больше соединений [ 56 ]. Что касается сорта винограда, семена SY показали более высокий процент ( p < 0,05) кофейной кислоты (12,63%), катехина (22,28%), эллаговой кислоты (7,64%), эпикатехина (17,03%), феруловой кислоты (14,62%), галловой кислоты (7,68%), рутина (21,38%), p -кумаровой кислоты (5,33%), сиреневой кислоты (43,26%) и ванилиновой кислоты (10,10%), чем TE. Существует конкуренция между синтезом флавоноидов в семенах и кожуре; в этом смысле, чем тяжелее семена плода, тем ниже содержание флаванолов в кожуре [ 57 ]. Это поведение можно непосредственно увидеть в более высоком содержании эпикатехина в семенах и катехина в кожуре. Наконец, семена TE показали более высокий процент ( p < 0,05) кемпферола (53,09%), мирицетина (10,12%), кверцетина (44,17%) и ресвератрола (34,20%) по сравнению с SY. Более высокое содержание отдельных соединений в кожуре и семенах TE может быть напрямую связано с более низким процентом влажности и ОВ в почве ( таблица 1 ). Таким образом, лучшее содержание ОВ и влаги в почве вызывает водный стресс у растения, что влияет на более высокий биосинтез фенольных соединений [ 58 ].
Что касается антиоксидантной активности ( рисунок 2 D), существенных различий ( p > 0,05) между семенами винограда, полученными в результате различных агротехнических мероприятий, обнаружено не было. При этом антиоксидантная активность кожицы винограда сорта ORG (34,04 ± 2,17 мкмоль эквивалента Тролокса/г) на 3,77% ( p < 0,05) выше, чем у сорта CON (32,75 ± 2,65 мкмоль эквивалента Тролокса/г). Более того, антиоксидантная активность кожицы винограда сорта SY (35,10 ± 0,67 мкмоль эквивалента Тролокса/г) на 9,71% выше, чем у сорта TE (31,69 ± 1,15 мкмоль эквивалента Тролокса/г). Более того, семена SY (14,15 ± 0,73 мкмоль эквивалента Тролокса/г) обладали на 4,09% большей ( p < 0,05) антиоксидантной активностью, чем семена TE (13,57 ± 0,71 мкмоль эквивалента Тролокса/г). Следовательно, биоактивные соединения захватывают свободные радикалы, предотвращая процессы окисления [ 59 ]. Следовательно, более высокую антиоксидантную активность сорта SY можно напрямую объяснить более высоким содержанием в нем индивидуальных фенолов ( таблица 3 ).
3.3. Анализ главных компонентов
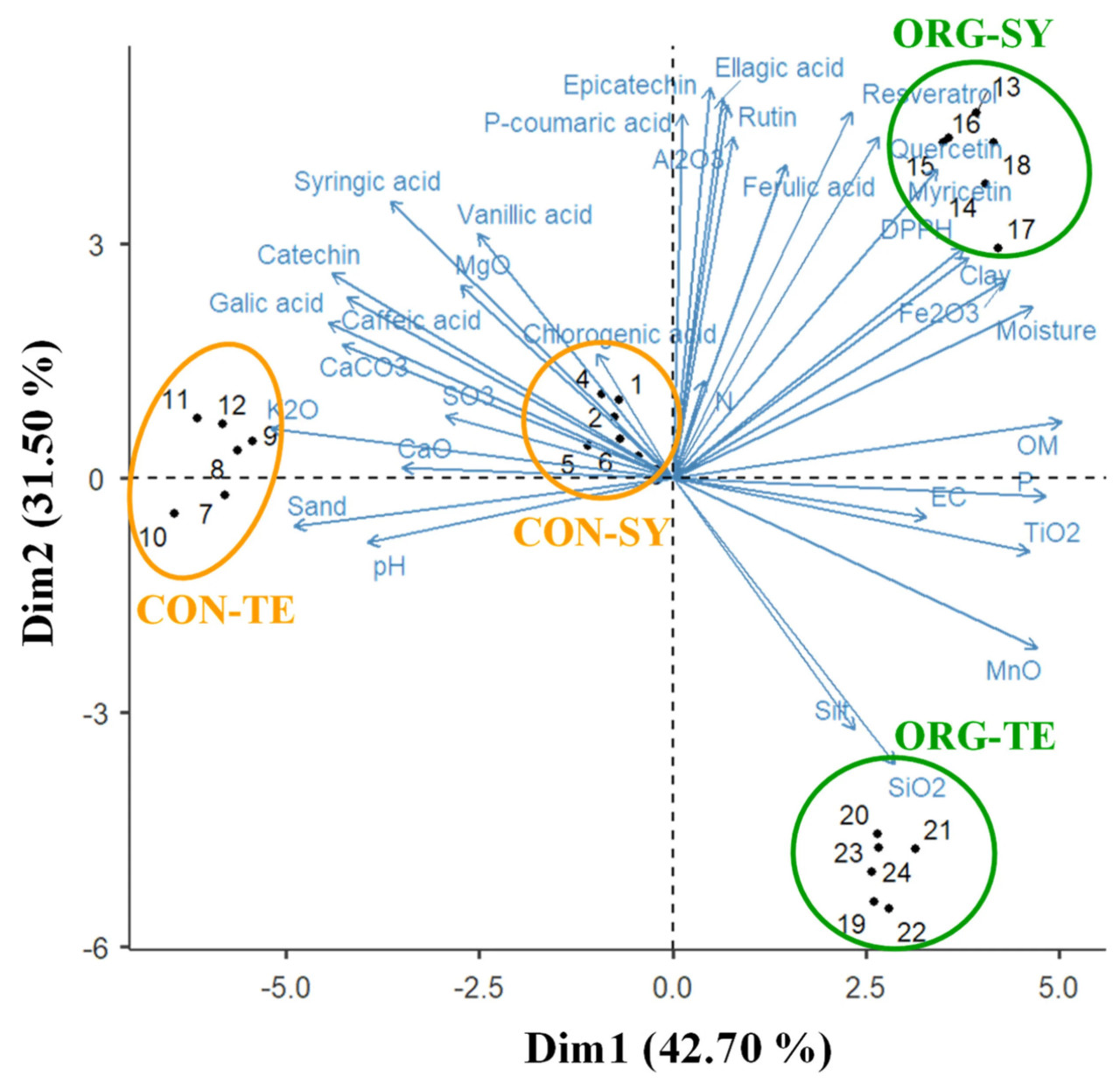
На рисунке 3 показан анализ главных компонент (PCA) для корреляции между свойствами почвы, индивидуальным фенольным профилем и антиоксидантной активностью кожицы винограда. Первые два главных компонента объясняют 74,20% общей дисперсии (42,70% и 31,50% соответственно).
Рисунок 3. Анализ главных компонентов (PCA) для характеристик почвы, биоактивных свойств и антиоксидантов кожицы винограда. Круги обозначают методы обработки винограда на традиционном (CON) и органическом (ORG) виноградниках для сортов Сира (SY) и Темпранильо (TE).
Первый компонент показал сильную положительную корреляцию (>0,60) с pH, песком, CaCO 3 , MgO, K 2 O, CaO, SO 3 в почве и содержанием катехина, галловой кислоты, ванильной кислоты, кофейной кислоты и сиреневой кислоты в кожице винограда. Аналогично была обнаружена отрицательная корреляция (>−0,60) этих соединений с влажностью, OM, EC, илом, P, SiO 2 , TiO 2 , MnO и Fe 2 O 3 в почве. pH почвы имеет решающее значение, поскольку от него зависит доступность питательных веществ для растений [ 60 ]. Акунья-Авила и др. [ 16 ] сообщили о сильной корреляции между pH почвы и содержанием Ca. Аналогично, корреляция между SiO 2 и Fe 2 O 3 предполагает присутствие глинистых минералов, которые позволяют лучше удерживать питательные вещества в почве [ 61 ]. Между тем , второй компонент показал сильную (>0,60) положительную корреляцию с влажностью, глиной, органическим веществом, Al2O3 и Fe2O3 в почве , а также содержанием эпикатехина, кверцетина, ресвератрола, рутина, пара -кумаровой кислоты, эллаговой кислоты, феруловой кислоты, мирицетина и антиоксидантной активностью в кожице винограда. Эти результаты совпадают с данными, полученными Перином и соавторами [ 15 ] , которые обнаружили сильную положительную корреляцию между процентным содержанием глины, влаги, Al и Fe в почве и содержанием кверцетина, рутина и мирицетина в кожице винограда. Некоторые авторы отмечают, что умеренная концентрация железа в почве способствует более активному биосинтезу некоторых биологически активных соединений, таких как антоцианы, флавоноиды (кверцетин и рутин) и флавоноиды (эпикатехин и мирицетин), обладающие сильным антиоксидантным действием [ 59 , 62 , 63 ]. Следовательно, антиоксидантная активность фенолов напрямую зависит от их структуры, количества гидроксильных групп и природы ароматического кольца [ 59 , 64 ]. Это может объяснить кластеризацию и положительную корреляцию между этими переменными.
Что касается распределения экспериментальных точек ( Рисунок 3 ), то органические обработки виноградников (ORG-SY и ORG-TE) предполагают более высокое содержание влаги, глины, OM, N, Fe 2 O 3 , SiO 2 , MnO, TiO 2 в почве и кверцетина, мирицетина, ресвератрола и антиоксидантной способности в кожице. Влажность связана с водным стрессом лозы, который влияет на метаболизм и усвоение N, влияя на качество производимого винограда и вина [ 58 , 65 ]. Влажность почвы имеет решающее значение в виноградарстве, поскольку нехватка воды серьезно ограничивает производство винограда для виноделия [ 65 ]. В случае обычного виноградника (CON-SY и CON-TE) распределение экспериментальных точек предполагает более высокое содержание песка, CaCO 3 , MgO, K 2 O, CaO и SO 3 ; более щелочной pH в почве; и катехин, ванилиновая кислота, сиреневая кислота, кофейная кислота и галловая кислота в кожице винограда. Пиконе и др. [ 66 ] сообщили о более низком содержании кофейной кислоты в винограде с виноградников, выращиваемых с применением органических и биодинамических методов. Кроме того, Ян и др. [ 67 ] указали, что элементный состав и текстура почвы напрямую влияют на качество винограда, используемого в виноделии.
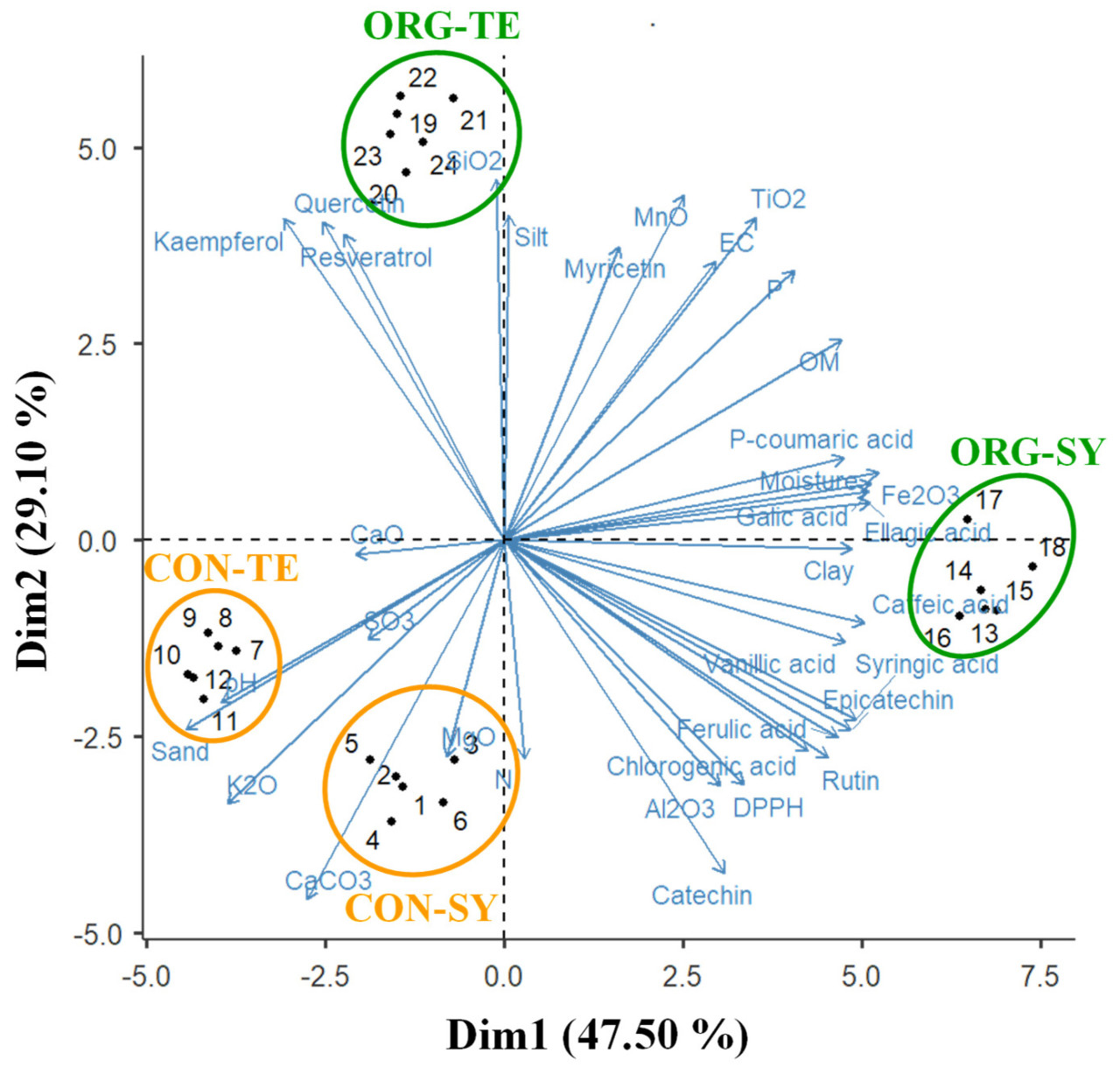
На рисунке 4 показан анализ главных компонент (PCA) для корреляции между свойствами почвы, индивидуальным фенольным профилем и антиоксидантной активностью винограда косточек. Первые два главных компонента объясняли 76,60% дисперсии (47,50% и 29,10% соответственно). В этом смысле первый компонент продемонстрировал сильную положительную корреляцию (>0,60) с влажностью, глиной, Al2O3 и Fe2O3 в почве , а также содержанием катехина , мирицетина, рутина, галловой кислоты, хлорогеновой кислоты, ванильной кислоты, кофейной кислоты, сиреневой кислоты, эпикатехина , эллаговой кислоты, феруловой кислоты и антиоксидантной активностью винограда косточек. Аналогично была обнаружена отрицательная корреляция (>−0,60) этих соединений с илом и SiO2 в почве и ресвератролом, кверцетином и кемпферолом в семенах. Таким образом, ионы железа (III) и железа (II) взаимодействуют как кофакторы в активности ферментов цитохрома P450. Они отвечают за несколько реакций в путях некоторых вторичных метаболитов (шикимовый, малоновый, мевалоновой кислоты и метилэритритолфосфатный путь) [ 68 , 69 ]. С другой стороны, исследование, проведенное на мексиканских виноградниках, выявило сильную корреляцию между антиоксидантной активностью и содержанием катехина, эпикатехина и галловой кислоты в винограде [ 16 ]. Эти же авторы упоминают об отрицательной корреляции между Al и Fe в почве с биосинтезом кверцетина и ресвератрола, что совпадает с результатами нашего исследования [ 15 ]. Между тем, второй компонент показал сильную (>0,60) положительную корреляцию с влажностью, ЕС, глиной, илом, OM, P, SiO 2 , TiO 2 , MnO и Fe 2 O 3 в почве и содержанием мирицетина, галловой кислоты, p -кумаровой кислоты и эллаговой кислоты в винограде из косточек. Более того, была обнаружена отрицательная корреляция (>−0,60) между этими соединениями и pH, песком, MgO, K 2 O и CaCO 3 в почве. Так, некоторые исследования сообщили, что некоторые элементы, такие как Sr, Pb, Si и Mn, вызывают стресс у виноградной лозы, влияя на биосинтез нескольких фенолов [ 70 , 71 ]. Кроме того, песок в почве и содержание Mg могут отрицательно влиять на содержание мирицетина в винограде. Однако фосфор связан с биосинтезом флавонолов, таких как мирицетин. Аналогично, несколько исследований показали, что некоторые тяжелые металлы, такие как Mn, вызывают стресс у растений, вызывая увеличение ферментативной активности, участвующей в биосинтезе биологически активных соединений [ 16 , 70 ].
Рисунок 4. Анализ главных компонентов (PCA) для характеристик почвы, биологически активных свойств и антиоксидантов виноградных косточек. Круги обозначают обработку винограда традиционным (CON) и органическим (ORG) способом для сортов Сира (SY) и Темпранильо (TE).
Что касается распределения экспериментальных точек ( Рисунок 4 ), большинство переменных отклика были направлены на группы органических виноградников (ORG-SY и ORG-TE). Таким образом, органические обработки виноградников (ORG-SY и ORG-TE) предполагают более высокое содержание влаги, глины, ила, EC, OM, SiO 2 , Fe 2 O 3 , MnO в почве и эпикатехина, рутина, ресвератрола, кемпферола, кверцетина, мирицетина, галловой кислоты, эллаговой кислоты, кофейной кислоты, ванильной кислоты, сиреневой кислоты, феруловой кислоты, p -кумаровой кислоты и CT в семенах. Каур и др. [ 72 ] сообщили об увеличении количества P при сочетании минералов и органических удобрений, что может объяснить более высокий процент P в виноградниках ORG. Аналогично, органическое управление увеличивает микробную активность и массу, увеличивая содержание P в почве [ 73 ]. С другой стороны, несколько исследований сообщили о более высоких концентрациях фенольных соединений в винограде, яблоках, чернике и малине, собранных в органических системах, что совпадает с данными настоящего исследования [ 17 , 74 , 75 , 76 ]. В случае обычного виноградника (CON-SY и CON-TE) распределение экспериментальных точек указывает на более высокий процент песка, MgO, CaCO 3 , K 2 O, SO 3 и CaO, а также более щелочной pH почвы. Оливер и др. [ 60 ] отметили, что почвы с более высокой кислотностью демонстрируют дефицит питательных веществ, таких как Ca, K, P и Mg; в этом смысле почвы виноградников CON — это те, которые демонстрируют более низкую кислотность.
4. Выводы
Настоящее исследование показало, что органическое сельское хозяйство и свойства почвы положительно влияют на биосинтез биологически активных соединений в кожице и косточках винограда. Таким образом, глинисто-гуминовый комплекс позволил винограднику ORG иметь более высокую влажность, глинистый, илистый, EC, OM, P, N, Fe2O3 , SiO2 , MnO и TiO2 в почве. Это позволило винограду , собранному в ORG, продемонстрировать превосходное развитие мирицетина, кверцетина , ресвератрола, хлорогеновой кислоты и антиоксидантной активности в кожице. Однако, за исключением катехина и хлорогеновой кислоты, семена ORG показали более высокую концентрацию большинства фенольных соединений. С другой стороны, виноград SY показал более высокое индивидуальное содержание фенолов. Между тем, pH почвы, глина, песок, OM, CaCO 3 и оксиды (Al 2 O 3 , K 2 O, SO 3 , MgO и CaO) положительно влияли на биосинтез отдельных фенолов и антиоксидантную способность кожицы. Между тем, влажность, глина, EC, OM, P и оксиды (SiO 2 , TiO 2 , Al 2 O 3 , Fe 2 O 3 , и MnO) в почве положительно влияли на содержание отдельных фенолов в семенах, за исключением ресвератрола, кверцетина и кемпферола. Эти результаты демонстрируют потенциал органически управляемого земледелия для производства высококачественного винограда для виноделия. Наконец, будущие исследования должны изучить влияние агротехнического управления на физико-химические, микробиологические и сенсорные свойства винограда для виноделия.
Ссылки
1. Haseeb, S.; Alexander, B.; Santi, R.L.; Liprandi, A.S.; Baranchuk, A. What’s in Wine? A Clinician’s Perspective. Trends Cardiovasc. Med. 2019, 29, 97–106. [Google Scholar] [CrossRef] [PubMed]
2. Contreras, M.d.M.; Romero-García, J.M.; López-Linares, J.C.; Romero, I.; Castro, E. Residues from Grapevine and Wine Production as Feedstock for a Biorefinery. Food Bioprod. Process. 2022, 134, 56–79. [Google Scholar] [CrossRef]
3. OIV. World Statistics. Available online: https://www.oiv.int/what-we-do/statistics (accessed on 4 August 2023).
4. Rodríguez, N. La Producción Mundial de uva Alcanzará los 281 Millones de t en la Temporada 2023/24. Available online: https://valenciafruits.com/wp-content/uploads/2024/07/3077_ValenciaFruits.pdf (accessed on 15 August 2023).
5. SIAP. Panorama Agroalimentario 2021. Available online: https://nube.siap.gob.mx/gobmx_publicaciones_siap/pag/2021/Panorama-Agroalimentario-2021 (accessed on 17 August 2023).
6. SADER. Industria de la Viña y vino, Motor de Crecimiento y Empleo Para 15 Entidades del País. Available online: https://www.gob.mx/agricultura/prensa/industria-de-la-vina-y-vino-motor-de-crecimiento-y-empleo-para-15-entidades-del-pais-agricultura?idiom=es (accessed on 2 September 2023).
7. Castro-Palafox, J.; Macías-Gallardo, F.; Ozuna, C. The Culture of Wine in Mexican Gastronomy: Historical Background, Current Context, and Perspectives for the Future. Int. J. Gastron. Food Sci. 2024, 35, 100848. [Google Scholar] [CrossRef]
8. OIV. La Producción Mundial de vino en 2023 será la Más Baja de los Últimos 60 Años. Available online: https://www.oiv.int/es/prensa/la-produccion-mundial-de-vino-en-2023-sera-la-mas-baja-de-los-ultimos-60-anos (accessed on 10 September 2023).
9. Caliskan, A.; Celebi, D.; Pirnar, I. Determinants of Organic Wine Consumption Behavior from the Perspective of the Theory of Planned Behavior. Int. J. Wine Bus. Res. 2021, 33, 360–376. [Google Scholar] [CrossRef]
10. Perrin, A.; Czyrnek-Delêtre, M.; Ben Jaballah, M.; Rouault, A.; van der Werf, H.M.G.; Ghali, M.; Sigwalt, A.; Renaud-Gentié, C. A Participatory Ecodesign Framework to Address Both Environmental and Economic Dimensions in Viticulture at Farm Scale. Agron. Sustain. Dev. 2022, 42, 10. [Google Scholar] [CrossRef]
11. Radulescu, C.; Buruleanu, L.C.; Nicolescu, C.M.; Olteanu, R.L.; Bumbac, M.; Holban, G.C.; Simal-Gandara, J. Phytochemical Profiles, Antioxidant and Antibacterial Activities of Grape (Vitis vinifera L.) Seeds and Skin from Organic and Conventional Vineyards. Plants 2020, 9, 1470. [Google Scholar] [CrossRef]
12. Varia, F.; Macaluso, D.; Agosta, I.; Spatafora, F.; Dara Guccione, G. Transitioning towards Organic Farming: Perspectives for the Future of the Italian Organic Wine Sector. Sustainability 2021, 13, 2815. [Google Scholar] [CrossRef]
13. Burg, P.; Badalíková, B.; Mašán, V.; Csáki, Š.; Burgová, J.; Turan, J.; Matwijczuk, A. Evaluation of the Effect of Deep Compost Application in the Areas around Vineyard Tree Trunks on Selected Soil Chemical Properties and the Vegetative Growth of the Vine. Processes 2023, 11, 632. [Google Scholar] [CrossRef]
14. Wilson, S.G.; Lambert, J.-J.; Dahlgren, R. Compost Application to Degraded Vineyard Soils: Effect on Soil Chemistry, Fertility, and Vine Performance. Am. J. Enol. Vitic. 2021, 72, 85–93. [Google Scholar] [CrossRef]
15. Perin, C.; Fait, A.; Palumbo, F.; Lucchin, M.; Vannozzi, A. The Effect of Soil on the Biochemical Plasticity of Berry Skin in Two Italian Grapevine (V. vinifera L.) Cultivars. Front. Plant Sci. 2020, 11, 822. [Google Scholar] [CrossRef] [PubMed]
16. Acuña-Avila, P.E.; Vásquez-Murrieta, M.S.; Franco Hernández, M.O.; Del Socorro López-Cortéz, M. Relationship between the Elemental Composition of Grapeyards and Bioactive Compounds in the Cabernet Sauvignon Grapes Vitis Vinífera Harvested in Mexico. Food Chem. 2016, 203, 79–85. [Google Scholar] [CrossRef] [PubMed]
17. Buchner, I.; Medeiros, N.; Lacerda, D.; Normann, C.; Gemelli, T.; Rigon, P.; Wannmacher, C.; Henriques, J.; Dani, C.; Funchal, C. Hepatoprotective and Antioxidant Potential of Organic and Conventional Grape Juices in Rats Fed a High-Fat Diet. Antioxidants 2014, 3, 323–338. [Google Scholar] [CrossRef]
18. Macías-Gallardo, F.; Castro-Palafox, J.; Ozuna, C. Mexican Wines: Impact of Geography, Climate, and Soil on the Quality of the Grape and Wine—A Review. ACS Food Sci. Technol. 2024, 4, 1598–1609. [Google Scholar] [CrossRef]
19. Zhao, Q.; Du, G.; Wang, S.; Zhao, P.; Cao, X.; Cheng, C.; Liu, H.; Xue, Y.; Wang, X. Investigating the Role of Tartaric Acid in Wine Astringency. Food Chem. 2023, 403, 134385. [Google Scholar] [CrossRef] [PubMed]
20. Ferrari, L. Avances En el conocimiento de la faja volcánica transmexicana durante la última década. Boletín Soc. Geológica Mex. 2000, 53, 84–92. [Google Scholar] [CrossRef]
21. INEGI. Edafología de La República Mexicana. Available online: https://www.inegi.org.mx/temas/edafologia/ (accessed on 10 May 2024).
22. SEMARNAT Norma Oficial Mexicana. NOM-021-SEMARNAT-2000 que establece las especificaciones de fertilidad, salinidad y clasificación de suelos. Estudios, muestreo y análisis. Diario Oficial de la Federación, 31 December 2002.
23. Heiri, O.; Lotter, A.F.; Lemcke, G. Loss on Ignition as a Method for Estimating Organic and Carbonate Content in Sediments: Reproducibility and Comparability of Results. J. Paleolimnol. 2001, 25, 101–110. [Google Scholar] [CrossRef]
24. Bray, R.H.; Kurtz, L.T. Determination of Total, Organic, and Available Forms of Phosphorus in Soils. Soil. Sci. 1945, 59, 39–46. [Google Scholar] [CrossRef]
25. Chordi-Barrufet, S. Contenido Fenólico y Capacidad Antioxidante de Fresa Mínimamente Procesada Sometida a Tratamientos de Conservación Por Pulsos de Luz de Alta Intensidad. Grado de Nutrición Humana y Dietética; Universidad de Lleida: Lleida, Spain, 2013. [Google Scholar]
26. Macías-Gallardo, F.; Barajas-Díaz, C.G.M.; Mireles-Arriaga, A.I.; Ozuna, C. Strawberry Variety Influences the Effectiveness of Postharvest Treatment with Gaseous Ozone: Impact on the Physicochemical, Microbiological, and Bioactive Properties of the Fruit. Processes 2023, 11, 346. [Google Scholar] [CrossRef]
27. Gülcü, M.; Uslu, N.; Özcan, M.M.; Gökmen, F.; Özcan, M.M.; Banjanin, T.; Gezgin, S.; Dursun, N.; Geçgel, Ü.; Ceylan, D.A.; et al. The Investigation of Bioactive Compounds of Wine, Grape Juice and Boiled Grape Juice Wastes. J. Food Process Preserv. 2018, 43, e13850. [Google Scholar] [CrossRef]
28. Lee, J.; Durst, R.W.; Wrolstad, R.E.; Barnes, K.W.; Eisele, T.; Giusti, M.M.; Haché, J.; Hofsommer, H.; Koswig, S.; Krueger, D.A. Determination of Total Monomeric Anthocyanin Pigment Content of Fruit Juices, Beverages, Natural Colorants, and Wines by the PH Differential Method: Collaborative Study. J. AOAC Int. 2005, 88, 1269–1278. [Google Scholar] [CrossRef]
29. Cheaib, D.; El Darra, N.; Rajha, H.N.; El-Ghazzawi, I.; Mouneimne, Y.; Jammoul, A.; Maroun, R.G.; Louka, N. Study of the Selectivity and Bioactivity of Polyphenols Using Infrared Assisted Extraction from Apricot Pomace Compared to Conventional Methods. Antioxidants 2018, 7, 174. [Google Scholar] [CrossRef] [PubMed]
30. Brand-Williams, W.; Cuvelier, M.E.; Berset, C. Use of a Free Radical Method to Evaluate Antioxidant Activity. LWT-Food Sci. Technol. 1995, 28, 25–30. [Google Scholar] [CrossRef]
31. Iacopini, P.; Baldi, M.; Storchi, P.; Sebastiani, L. Catechin, Epicatechin, Quercetin, Rutin and Resveratrol in Red Grape: Content, in Vitro Antioxidant Activity and Interactions. J. Food Compos. Anal. 2008, 21, 589–598. [Google Scholar] [CrossRef]
32. Kment, P.; Mihaljevič, M.; Ettler, V.; Šebek, O.; Strnad, L.; Rohlová, L. Differentiation of Czech Wines Using Multielement Composition—A Comparison with Vineyard Soil. Food Chem. 2005, 91, 157–165. [Google Scholar] [CrossRef]
33. Julca-Otiniano, A.; Meneses-Florián, L.; Blas-Sevillano, R.; Bello-Amez, S. La Materia Orgánica, Importancia y Experiencia De Su Uso En La Agricultura. Idesia 2006, 24, 49–61. [Google Scholar] [CrossRef]
34. Šimanský, V.; Polláková, N. Soil Organic Matter and Sorption Capacity under Different Soil Management Practices in a Productive Vineyard. Arch. Agron. Soil. Sci. 2014, 60, 1145–1154. [Google Scholar] [CrossRef]
35. Zebec, V.; Lisjak, M.; Jović, J.; Kujundžić, T.; Rastija, D.; Lončarić, Z. Vineyard Fertilization Management for Iron Deficiency and Chlorosis Prevention on Carbonate Soil. Horticulturae 2021, 7, 285. [Google Scholar] [CrossRef]
36. Christou, M.; Avramides, E.J.; Jones, D.L. Dissolved Organic Nitrogen Dynamics in a Mediterranean Vineyard Soil. Soil. Biol. Biochem. 2006, 38, 2265–2277. [Google Scholar] [CrossRef]
37. Forlan-Amaral, H.; Alves-Sena, J.O.; Freitas-SchwanEstrada, K.R.; Balota, E.L.; Souza-Andrade, D. Soil chemical and microbial properties in vineyards under organic and conventional management in southern Brazil. Soc. Bras. Ciência Solo 2011, 35, 1517–1526. [Google Scholar]
38. Karažija, T.; Čosić, T.; Lazarević, B.; Horvat, T.; Petek, M.; Palčić, I.; Jerbić, N. Effect of Organic Fertilizers on Soil Chemical Properties on Vineyard Calcareous Soil. Agric. Conspec. Sci. 2015, 80, 79–84. [Google Scholar]
39. Protano, G.; Rossi, S. Relationship between Soil Geochemistry and Grape Composition in Tuscany (Italy). J. Plant Nutr. Soil Sci. 2014, 177, 500–508. [Google Scholar] [CrossRef]
40. Rodríguez-Pérez, J.R.; Plant, R.E.; Lambert, J.J.; Smart, D.R. Using Apparent Soil Electrical Conductivity (ECa) to Characterize Vineyard Soils of High Clay Content. Precis. Agric. 2011, 12, 775–794. [Google Scholar] [CrossRef]
41. Ranty, B.; Aldon, D.; Cotelle, V.; Galaud, J.P.; Thuleau, P.; Mazars, C. Calcium Sensors as Key Hubs in Plant Responses to Biotic and Abiotic Stresses. Front. Plant Sci. 2016, 7, 186794. [Google Scholar] [CrossRef] [PubMed]
42. Yang, T.; Peng, H.; Whitaker, B.D.; Conway, W.S. Characterization of a Calcium/Calmodulin-Regulated SR/CAMTA Gene Family During Tomato Fruit Development and Ripening. BMC Plant Biol. 2012, 12, 19. [Google Scholar] [CrossRef] [PubMed]
43. Gaeta, M.; Aldega, L.; Astolfi, M.L.; Bonechi, B.; Pacheco, P.; Perinelli, C. Base Cation Mobility in Vineyard Soils of the Colli Albani Volcanic District (Central Italy). J. Soil Sci. Plant Nutr. 2022, 22, 4392–4403. [Google Scholar] [CrossRef]
44. Holzapfel, B.; Holland, J.; Treeby, M. Winegrape Nutrition and Fertiliser Application for Sustainable Production. Available online: https://www.dpi.nsw.gov.au/__data/assets/pdf_file/0007/1158127/Winegrape-nutrition-and-fertiliser-application-for-sustainable-production.pdf (accessed on 15 November 2023).
45. Rodrigues, F.A.; Resende, R.S.; Dallagnol, L.J.; Datnoff, L.E. Silicon Potentiates Host Defense Mechanisms Against Infection by Plant Pathogens. In Silicon and Plant Diseases; Springer: Cham, Switzerland, 2015; pp. 109–138. [Google Scholar] [CrossRef]
46. Schabl, P.; Gabler, C.; Kührer, E.; Wenzel, W. Effects of Silicon Amendments on Grapevine, Soil and Wine. Plant Soil. Environ. 2020, 66, 403–414. [Google Scholar] [CrossRef]
47. Bunea, C.I.; Pop, N.; Babeş, A.C.; Matea, C.; Dulf, F.V.; Bunea, A. Carotenoids, Total Polyphenols and Antioxidant Activity of Grapes (Vitis vinifera) Cultivated in Organic and Conventional Systems. Chem. Cent. J. 2012, 6, 66. [Google Scholar] [CrossRef]
48. Lorrain, B.; Chira, K.; Teissedre, P.L. Phenolic Composition of Merlot and Cabernet-Sauvignon Grapes from Bordeaux Vineyard for the 2009-Vintage: Comparison to 2006, 2007 and 2008 Vintages. Food Chem. 2011, 126, 1991–1999. [Google Scholar] [CrossRef]
49. Lorrain, B.; Ky, I.; Pasquier, G.; Jourdes, M.; Dubrana, L.G.; Gény, L.; Rey, P.; Donèche, B.; Teissedre, P.L. Effect of Esca Disease on the Phenolic and Sensory Attributes of Cabernet Sauvignon Grapes, Musts and Wines. Aust. J. Grape Wine Res. 2012, 18, 64–72. [Google Scholar] [CrossRef]
50. Bosso, A.; Guaita, M.; Petrozziello, M. Influence of Solvents on the Composition of Condensed Tannins in Grape Pomace Seed Extracts. Food Chem. 2016, 207, 162–169. [Google Scholar] [CrossRef] [PubMed]
51. Corrales, M.; Fernandez, A.; Vizoso Pinto, M.G.; Butz, P.; Franz, C.M.A.P.; Schuele, E.; Tauscher, B. Characterization of Phenolic Content, in Vitro Biological Activity, and Pesticide Loads of Extracts from White Grape Skins from Organic and Conventional Cultivars. Food Chem. Toxicol. 2010, 48, 3471–3476. [Google Scholar] [CrossRef] [PubMed]
52. Klimienė, A.; Klimas, R.; Shutava, H.; Razmuvienė, L. Dependence of the Concentration of Bioactive Compounds in Origanum Vulgare on Chemical Properties of the Soil. Plants 2021, 10, 750. [Google Scholar] [CrossRef]
53. Mulero, J.; Pardo, F.; Zafrilla, P. Antioxidant Activity and Phenolic Composition of Organic and Conventional Grapes and Wines. J. Food Compos. Anal. 2010, 23, 569–574. [Google Scholar] [CrossRef]
54. Temerdashev, Z.; Abakumov, A.; Khalafyan, A.; Bolshov, M.; Lukyanov, A.; Vasilyev, A.; Gipich, E. The Influence of the Soil Profile on the Formation of the Elemental Image of Grapes and Wine of the Cabernet Sauvignon Variety. Molecules 2024, 29, 2251. [Google Scholar] [CrossRef] [PubMed]
55. Visan, L.; Tamba-Berehoiu, R.M.; Popa, C.N.; Danaila-Guidea, S.M.; Dobrinoiu, R.V. Syrah—Grapevine and Wine—A Critical Review. Sci. Pap. Ser. Manag. Econ. Eng. Agric. Rural. Dev. 2019, 19, 609–615. [Google Scholar]
56. Asami, D.K.; Hong, Y.-J.; Barrett, D.M.; Mitchell, A.E. Comparison of the Total Phenolic and Ascorbic Acid Content of Freeze-Dried and Air-Dried Marionberry, Strawberry, and Corn Grown Using Conventional, Organic, and Sustainable Agricultural Practices. J. Agric. Food Chem. 2003, 51, 1237–1241. [Google Scholar] [CrossRef]
57. García-Estévez, I.; Andrés-García, P.; Alcalde-Eon, C.; Giacosa, S.; Rolle, L.; Rivas-Gonzalo, J.C.; Quijada-Morín, N.; Escribano-Bailón, M.T. Relationship between Agronomic Parameters, Phenolic Composition of Grape Skin, and Texture Properties of Vitis vinifera L. Cv. Tempranillo. J. Agric. Food Chem. 2015, 63, 7663–7669. [Google Scholar] [CrossRef]
58. Ramos, M.C.; Pérez-Álvarez, E.P.; Peregrina, F.; Martínez de Toda, F. Relationships between Grape Composition of Tempranillo Variety and Available Soil Water and Water Stress under Different Weather Conditions. Sci. Hortic. 2020, 262, 109063. [Google Scholar] [CrossRef]
59. Biniari, K.; Xenaki, M.; Daskalakis, I.; Rusjan, D.; Bouza, D.; Stavrakaki, M. Polyphenolic Compounds and Antioxidants of Skin and Berry Grapes of Greek Vitis vinifera Cultivars in Relation to Climate Conditions. Food Chem. 2020, 307, 125518. [Google Scholar] [CrossRef]
60. Oliver, D.P.; Bramley, R.G.V.; Riches, D.; Porter, I.; Edwards, J. Review: Soil Physical and Chemical Properties as Indicators of Soil Quality in Australian Viticulture. Aust. J. Grape Wine Res. 2013, 19, 129–139. [Google Scholar] [CrossRef]
61. Pepi, S.; Coletta, A.; Crupi, P.; Leis, M.; Russo, S.; Sansone, L.; Tassinari, R.; Chicca, M.; Vaccaro, C. Geochemical Characterization of Elements in Vitis vinifera cv. Negroamaro Grape Berries Grown under Different Soil Managements. Environ. Monit. Assess. 2016, 188, 211. [Google Scholar] [CrossRef] [PubMed]
62. Shi, P.; Li, B.; Chen, H.; Song, C.; Meng, J.; Xi, Z.; Zhang, Z.; McPhee, D.J. Iron Supply Affects Anthocyanin Content and Related Gene Expression in Berries of Vitis vinifera cv. Cabernet Sauvignon. Molecules 2017, 22, 283. [Google Scholar] [CrossRef] [PubMed]
63. Shi, P.; Song, C.; Chen, H.; Duan, B.; Zhang, Z.; Meng, J. Foliar Applications of Iron Promote Flavonoids Accumulation in Grape Berry of Vitis vinifera cv. Merlot Grown in the Iron Deficiency Soil. Food Chem. 2018, 253, 164–170. [Google Scholar] [CrossRef]
64. Balasundram, N.; Sundram, K.; Samman, S. Phenolic Compounds in Plants and Agri-Industrial by-Products: Antioxidant Activity, Occurrence, and Potential Uses. Food Chem. 2006, 99, 191–203. [Google Scholar] [CrossRef]
65. Marques, M.J.; Ruiz-Colmenero, M.; Bienes, R.; García-Díaz, A.; Sastre, B. Effects of a Permanent Soil Cover on Water Dynamics and Wine Characteristics in a Steep Vineyard in the Central Spain. Air Soil. Water Res. 2020, 13. [Google Scholar] [CrossRef]
66. Picone, G.; Trimigno, A.; Tessarin, P.; Donnini, S.; Rombolà, A.D.; Capozzi, F. 1 H NMR Foodomics Reveals That the Biodynamic and the Organic Cultivation Managements Produce Different Grape Berries (Vitis vinifera L. cv. Sangiovese). Food Chem. 2016, 213, 187–195. [Google Scholar] [CrossRef] [PubMed]
67. Yan, H.K.; Ma, S.; Lu, X.; Zhang, C.C.; Ma, L.; Li, K.; Wei, Y.C.; Gong, M.S.; Li, S. Response of Wine Grape Quality to Rainfall, Temperature, and Soil Properties in Hexi Corridor. HortScience 2022, 57, 1593–1599. [Google Scholar] [CrossRef]
68. Bramley, R.G.V.; Ouzman, J.; Boss, P.K. Variation in Vine Vigour, Grape Yield and Vineyard Soils and Topography as Indicators of Variation in the Chemical Composition of Grapes, Wine and Wine Sensory Attributes. Aust. J. Grape Wine Res. 2011, 17, 217–229. [Google Scholar] [CrossRef]
69. de la Rosa, L.A.; Moreno-Escamilla, J.O.; Rodrigo-García, J.; Alvarez-Parrilla, E. Phenolic Compounds. In Postharvest Physiology and Biochemistry of Fruits and Vegetables; Elsevier: Amsterdam, The Netherlands, 2019; pp. 253–271. [Google Scholar]
70. Manara, A. Plant Responses to Heavy Metal Toxicity. In Plants and Heavy Metals; Springer: Dordrecht, The Netherlands, 2012; pp. 27–53. [Google Scholar]
71. Yan, Z.Z.; Tam, N.F.Y. Temporal Changes of Polyphenols and Enzyme Activities in Seedlings of Kandelia Obovata under Lead and Manganese Stresses. Mar. Pollut. Bull. 2011, 63, 438–444. [Google Scholar] [CrossRef] [PubMed]
72. Kaur, K.; Kapoor, K.K.; Gupta, A.P. Impact of Organic Manures with and without Mineral Fertilizers on Soil Chemical and Biological Properties under Tropical Conditions. J. Plant Nutr. Soil Sci. 2005, 168, 117–122. [Google Scholar] [CrossRef]
73. Döring, J.; Collins, C.; Frisch, M.; Kauer, R. Organic and Biodynamic Viticulture Affect Biodiversity and Properties of Vine and Wine: A Systematic Quantitative Review. Am. J. Enol. Vitic. 2019, 70, 221–242. [Google Scholar] [CrossRef]
74. Rodrigues, A.D.; Scheffel, T.B.; Scola, G.; dos Santos, M.T.; Fank, B.; de Freitas, S.C.V.; Dani, C.; Vanderlinde, R.; Henriques, J.A.P.; Coitinho, A.S.; et al. Neuroprotective and Anticonvulsant Effects of Organic and Conventional Purple Grape Juices on Seizures in Wistar Rats Induced by Pentylenetetrazole. Neurochem. Int. 2012, 60, 799–805. [Google Scholar] [CrossRef] [PubMed]
75. Mditshwa, A.; Magwaza, L.S.; Tesfay, S.Z.; Mbili, N. Postharvest Quality and Composition of Organically and Conventionally Produced Fruits: A Review. Sci. Hortic. 2017, 216, 148–159. [Google Scholar] [CrossRef]
76. Frías-Moreno, M.N.; Parra-Quezada, R.A.; González-Aguilar, G.; Ruíz-Canizales, J.; Molina-Corral, F.J.; Sepulveda, D.R.; Salas-Salazar, N.; Olivas, G.I. Quality, Bioactive Compounds, Antioxidant Capacity, and Enzymes of Raspberries at Different Maturity Stages, Effects of Organic vs. Conventional Fertilization. Foods 2021, 10, 953. [Google Scholar] [CrossRef]
Macías-Gallardo F, Quiñones-Muñoz TA, Miranda-Avilés R, Ramírez-Santoyo LF, Zanor GA, Ozuna C. Impact of Organic Agriculture on the Quality of Grapes (Syrah and Tempranillo) Harvested in Guanajuato, Mexico: Relationship Between Soil Elemental Profile and Grape Bioactive Properties. Agriculture. 2025; 15(2):169. https://doi.org/10.3390/agriculture15020169
Перевод статьи «Impact of Organic Agriculture on the Quality of Grapes (Syrah and Tempranillo) Harvested in Guanajuato, Mexico: Relationship Between Soil Elemental Profile and Grape Bioactive Properties» авторов Macías-Gallardo F, Quiñones-Muñoz TA, Miranda-Avilés R, Ramírez-Santoyo LF, Zanor GA, Ozuna C., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
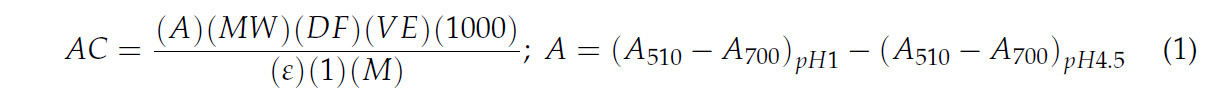
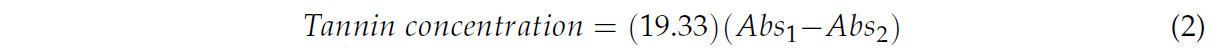






























































































Комментарии (0)