Сравнительное исследование реакции на стресс из-за засухи у растений Fragaria vesca, размноженных in vitro и in vivo
Оценка реакции растений на дефицит воды в субстрате, особенно в условиях усиления изменения климата, является критическим фактором для обеспечения стабильного сельскохозяйственного производства, экономической устойчивости и продовольственной безопасности. Основной целью данного исследования было сравнение физиологических и биохимических реакций на дефицит воды при традиционном возделывании растений Fragaria vesca, размноженных как in vitro, так и in vivo.
Аннотация
Исследование включало измерения параметров газообмена, флуоресценции хлорофилла «а», содержания фотосинтетических пигментов и пролина в листьях, индекса относительного содержания воды в листе, общего урожая плодов, массы одного плода, сырой и сухой массы корневой системы, а также концентраций K, Ca, Mg, Na, Cu, Zn, Mn и Mo. Дополнительно анализировалось соотношение одновалентных и двухвалентных катионов в листьях, корнях и коронках.
Результаты выявили значительные различия между экспериментальными вариантами в оптимальных условиях и их соответствующими реакциями на стресс засухи. Растения, полученные из in vitro культур, несмотря на изначально более низкие значения физиологических признаков, продемонстрировали более высокий потенциал урожайности (не было значительной разницы в урожае сырой массы плодов по сравнению со снижением на 78%). Однако длительный недостаток воды нанес больший ущерб их фотосинтетической системе — наблюдалось снижение физиологических признаков до 80% по сравнению с максимальным снижением на 40% у растений, полученных из сеянцев. Результаты подчеркивают, что условия окружающей среды и процесс акклиматизации растений, полученных из in vitro культур, могут значительно влиять на их адаптивный потенциал и продуктивность.
1. Введение
Как следствие изменения климата, засуха становится все более серьезной проблемой для сельского хозяйства, в частности из-за ее многогранного воздействия на окружающую среду в виде производства сельскохозяйственных культур, экономической стабильности и продовожственной безопасности [1,2]. Стресс, вызванный засухой, негативно влияет на рост и развитие растений, снижая фотосинтез, дыхание и поглощение питательных веществ, а также изменяя многочисленные метаболические процессы. Эти изменения приводят к снижению урожайности и, в тяжелых случаях, к гибели растений [3,4]. Прогнозы указывают, что изменение климата усугубит условия засухи, приводя к более частым и серьезным событиям [5]. За последние четыре десятилетия засуха затронула больше людей, чем любая другая природная опасность, причем на сельское хозяйство пришлось 83% глобального ущерба и потерь, связанных с засухой, в период с 2006 по 2016 год [6]. Из-за своего хронического характера последствия сельскохозяйственной засухи выходят за рамки непосредственных потерь, создавая длительные экономические burdens. Это подчеркивает настоятельную необходимость в эффективных стратегиях управления засухой, адаптированных к региональным условиям [7,8].
Фундаментальной особенностью, которую следует учитывать в контексте меняющегося климата, является развитие засухоустойчивых сортов сельскохозяйственных культур. Такие сорта позволяют поддерживать высокую урожайность при ограниченной доступности воды, снижая риск неурожая и повышая продовольственную безопасность. Выращивание засухоустойчивых культур также позволяет осуществлять устойчивое управление водными ресурсами. Этот подход может помочь смягчить чрезмерную эксплуатацию водных ресурсов, в частности в регионах, где вода является дефицитной, а чрезмерное использование приводит к деградации окружающей среды. Более того, выращивание засухоустойчивых растений может увеличить сельскохозяйственный доход, обеспечивая стабильную урожайность даже в условиях дефицита влаги в почве.
Род Fragaria, который включает как культивируемую землянику (Fragaria × ananassa), так и дикие виды, такие как F. vesca, F. virginiana и F. chiloensis, служит отличной моделью для исследования эффектов стресса засухи. Это объясняется его высокой чувствительностью к дефициту воды, что является результатом большой площади листьев, высокого содержания воды в плодах и поверхностной корневой системы [9,10,11]. Важным предварительным этапом в селекционных программах, направленных на повышение устойчивости растений к дефициту воды, является оценка индивидуальных уровней адаптации к ограниченной доступности воды. Генетическое разнообразие внутри видов Fragaria, в частности различия в способах размножения, может значительно влиять на их долгосрочную адаптируемость к изменяющимся климатическим условиям [12].
Размножение растений in vitro является высокоэффективным методом быстрого увеличения количества растительного материала в коммерческом производстве. Этот подход позволяет получать большое количество особей в течение относительно короткого периода, независимо от погодных условий и свободных от болезней [13,14,15,16]. Благодаря своей способности к быстрому размножению большого количества растительного материала и inherent масштабируемости, микроклональное размножение хорошо подходит для удовлетворения растущих потребностей сельскохозяйственного и садоводческого секторов путем поставки стабильного и высококачественного исходного материала. Клональное микроразмножение также играет ключевую роль в повышении устойчивости растений к экологическим стрессам, включая изменение климатических условий. Эта методика способствует развитию новых сортов растений, обладающих ценными агрономическими признаками и устойчивостью к неблагоприятным факторам окружающей среды. Обеспечивая эффективное размножение и сохранение устойчивых генотипов, таких как толерантные к засухе, оно поддерживает их внедрение в сложные климатические условия и способствует сохранению биоразнообразия экосистем [17,18].
Однако растения, размноженные с помощью in vitro культур, могут проявлять различные реакции на засуху в условиях in vivo по сравнению с растениями, размноженными традиционно. Эти различия возникают из-за уникальных условий окружающей среды, в которых развиваются in vitro культуры, а также из-за сомаклональной изменчивости и последующей адаптации к естественным условиям. Условия in vitro культур также могут стимулировать развитие защитных механизмов, таких как усиленное производство осмолитов или антиоксидантов, тем самым улучшая способность растения справляться со стрессом [19,20].
Несколько исследований, включая наши, показали, что микроразмноженные растения, такие как земляника [21] и шелковица [22], могут проявлять сходную или превосходную урожайность, более высокую выживаемость и улучшенный биохимический состав плодов в условиях in vivo по сравнению с растениями, полученными из травянистых черенков. Также предполагается, что количество subcultures в коммерческих программах микроразмножения растений рода Fragaria не должно превышать пять циклов из-за потенциального появления фенотипических признаков, таких как вариации в высоте растения, силе роста, размере и форме плода [23]. Это соображение особенно критично в коммерческом выращивании, где достижение однородности и высокой урожайности имеет первостепенное значение. Тем не менее, эти изменения могут быть не постоянными или могут проявлять полезные признаки, такие как увеличение роста на 10% [21]. Более того, недавнее исследование показало, что микроразмножение было связано с более высокими уровнями антиоксидантов в плодах по сравнению с растениями, культивируемыми в условиях in vivo [24]. Несмотря на эти потенциальные преимущества, существует заметный недостаток исследований, изучающих, влияют ли методы микроразмножения на реакции растений на дефицит воды после переноса в условия in vivo.
Целью данного исследования было сравнить физиологические реакции растений Fragaria vesca сорта Rugia, полученных из in vitro культур и из травянистых сеянцев, на дефицит воды в субстрате в условиях in vivo. Эта цель была достигнута путем проверки следующих гипотез: (1) растения, размноженные in vivo и in vitro, проявляют различия в физиологических признаках, (2) дефицит воды в субстрате значительно влияет на физиологические признаки растений Fragaria vesca, и (3) растения, размноженные in vivo и in vitro, различаются по своим физиологическим реакциям на дефицит воды в субстрате.
2. Материалы и методы
2.1. Материалы
В исследовании использовались растения Fragaria vesca сорта ‘Rugia’, полученные из семян (W. Legutko, Jutrosin, Poland). Культивируемый сорт, использованный в исследовании, пользуется значительной коммерческой популярностью в Польше. 'Rugia' - это высокоурожайный сорт, который плодоносит с июня до первых заморозков. Он демонстрирует относительно высокую морозостойкость и низкую восприимчивость к болезням [25], что делает его подходящим кандидатом для экспериментальных анализов.
Сравнивались две группы растений: те, которые были размножены in vitro и впоследствии акклиматизированы к тепличным условиям, и те, которые культивировались непосредственно в субстрате на протяжении всего вегетационного периода.
2.1.1. Растения из in vitro культур
На протяжении всего исследования pH сред доводили до 5,7 с использованием 0,1 М растворов соляной кислоты (HCl) и гидроксида натрия (NaOH). Среды дополняли 8 г·дм⁻³ агара, 30 г·дм⁻³ сахарозы и 100 мг·дм⁻³ инозита. На этапе размножения и оценки эффектов дефицита воды культуры содержали в банках объемом 300 см³, содержащих 30 см³ сред, которые стерилизовали при 121 °C в течение 20 мин. Установленные культуры инкубировали в фитотроне при температуре 25 ± 1 °C, на полках, освещаемых 16 ч в сутки белым светом интенсивностью 40 мкмоль·м⁻²·с⁻¹ ФАР.
Этап инициации: Для обеззараживания семена замачивали в воде с добавлением коммерческого моющего средства в течение 20 мин. Затем их тщательно промывали проточной водой и погружали в 70% раствор этанола на 30 с. Предварительно обеззараженные семена затем встряхивали в 10% растворе гипохлорита натрия в течение 15 мин. Наконец, семена помещали индивидуально в пробирки объемом 15 см³, содержащие 3 см³ среды MS [26].
Этап размножения: На следующей фазе исследования однопочечные побеги длиной 1 см помещали на среду MS, дополненную 3 мг·дм⁻³ цитокинина BAP (6-бензиламинопурин), с плотностью пять эксплантов на банку. Культуры, полученные этим методом, размножали несколько раз на оптимизированной среде для создания популяции для дальнейшего эксперимента.
Этап акклиматизации: После того как у растений развивались полностью функциональные корневые системы, проростки пересаживали в горшки, заполненные коммерческим садовым субстратом (Athena, Verve, Poland). Процесс акклиматизации проводили в теплице с температурой, поддерживаемой между 20 и 25 °C. Для обеспечения высокой влажности воздуха (~80%) растения изначально накрывали пластиковой пленкой. Через неделю пленку снимали на 1–2 ч ежедневно в течение семи дней. На следующей неделе вентиляцию постепенно увеличивали до 7 ч в день. На третьей неделе пленку оставляли только на ночь. К концу этого процесса растения были полностью акклиматизированы к внешним условиям окружающей среды (включая тепличные).
2.1.2. Растения из сеянцев
Растения, составляющие второй вариант эксперимента, были получены из семян, посеянных непосредственно в субстрат во второй половине апреля того же года, в котором проводился эксперимент. Как только сеянцы достигали зрелости, их пересаживали в контейнеры большего размера.
2.2. Методы
В 2020 году был проведен однолетний горшечный эксперимент с использованием полностью рандомизированной схемы с 15 повторностями (одно растение на повторность) в вегетационном зале факультета управления окружающей средой и сельского хозяйства Западно-Поморского технологического университета в Щецине, Польша (53°25′ с.ш., 14°32′ в.д.; 25 м над у.м.). Использовали пластиковые контейнеры вместимостью 10 дм³, заполненные субстратом, состоящим из смеси 1:1 (по объему) супесчаной суглинистой глинистой почвы, взятой из пахотного гумусового горизонта (0–30 см) на Сельскохозяйственной опытной станции Западно-Поморского технологического университета в Щецине, расположенной в Липнике (Польша), и песка. Чтобы позволить акклиматизацию к новым условиям, растения высаживали за год до начала измерений (в июне) по 3 растения на горшок. Сеянцы имели три полностью развитых листа.
Водный потенциал поддерживали на уровне −10 кПа в контрольных условиях (оптимальная влажность почвы) и −30 кПа в условиях дефицита воды в субстрате. Необходимость орошения определяли на основе показаний контактных почвенных тензиометров, размещенных на глубине 20 см в горшках каждого экспериментального варианта. Орошение применяли с использованием системы капельного орошения.
В течение вегетационного периода (с мая по октябрь) горшки размещали в закрытой части вегетационного зала. В остальные месяцы их содержали в неотапливаемой теплице с температурой, поддерживаемой выше 0 °C.
Удобрение проводили дважды в течение вегетационного периода: перед посадкой растений, во время заполнения горшков, и после того, как растения закончили плодоношение. Во второй год исследования удобрение проводили ранней весной, до начала вегетации, и после завершения плодоношения. Использовали многокомпонентное удобрение, специально предназначенное для земляники, которое, согласно производителю (Agrecol Sp. z o.o., Mesznary, Poland), содержит: 15,0% N (6,5% нитратного N, 8,5% аммонийного N), 6,0% P₂O₅ (растворимого в нейтральном цитрате аммония и в воде, включая 5,2% водорастворимого P₂O₅), 11,0% водорастворимого K₂O, 0,04% общего B, 0,1% общего Cu, 0,2% общего Fe, 0,17% общего Mn, 0,01% общего Mo и 0,035% общего Zn. Удобрение вносили из расчета 4 г на горшок каждый раз.
Морфологические наблюдения за растениями проводили систематически на протяжении всего вегетационного сезона, и появляющиеся усы удаляли.
2.3. Измерения
Три раза в течение вегетационного сезона растений, во вторые декады июля, августа и сентября, проводили следующие измерения и анализы:
- Содержание фотосинтетических пигментов определяли методом Арнона и др. [27] в модификации Лихтенталера и Веллберна [28] для хлорофилла «a», «b» и общего хлорофилла, и методом Хагера и Майера-Бертенрата [29] для каротиноидов.
- Индекс относительного содержания воды в листе (RWC) по методу Ямасаки и Дилленбурга [30].
- Содержание свободного пролина в растительной ткани определяли методом Бейтса и др. [31], состоящим в измерении поглощения окрашенного комплекса пролина и кислого нингидрина, экстрагированного толуолом, при длине волны λ = 520 нм. Ткань растения (0,5 г) гомогенизировали с 10 см³ 3% сульфосалициловой кислоты. Содержание пролина пересчитывали по стандартной кривой и выражали в мг·г⁻¹ сырой массы растения.
- Параметры газообмена, т.е. интенсивность чистого усвоения CO₂ (Pn), интенсивность транспирации (E), устьичную проводимость H₂O (gs) и подустьичную концентрацию CO₂ (ci), измеряли с использованием портального газоанализатора TPS-2 с PLC-4 (PP Systems, Amesbury, MA, USA); коэффициент эффективности использования воды при фотосинтезе (Water Use Efficiency; WUE) определяли на основе отношения Pn/E.
- Параметры флуоресценции хлорофилла «a» определяли с использованием спектрофлуориметра Handy PEA (Hansatech Ltd., Kings Lynn, UK) на основе стандартной процедуры аппарата (3 × 650 нм светодиода, максимальная интенсивность актиничного света 3000 мкмоль·м⁻²·с⁻¹). Измерение проводили в каждом варианте на 15 случайно выбранных, полностью выросших листьях земляники (повторностью было измерение на одном листе), в месте, предварительно затемненном в течение 20 мин, с использованием заводских зажимов (площадь облучения составляла 4 мм). Измеряли следующие параметры: начальная (нулевая) флуоресценция, индекс потерь энергии возбуждения в силовых антеннах (F0), максимальная флуоресценция, после восстановления акцепторов в ФС II и после темновой адаптации (FM), переменная флуоресценция, определяемая после темновой адаптации (параметр зависит от максимальной квантовой эффективности ФС II) (FV = FM − F0), максимальная потенциальная эффективность фотохимической реакции в ФС II, определяемая после темновой адаптации, после восстановления акцепторов в ФС II (FV/FM), время роста флуоресценции хлорофилла от начала измерения до достижения максимума (TFM) и площадь над кривой индукции флуоресценции хлорофилла «a» между точками F0 и FM, пропорциональная размеру пула восстановленных пластохинонных акцепторов электронов в ФСII (AM (Area)).
В каждый вегетационный сезон определяли общий урожай свежих плодов земляники взвешиванием, выражали в граммах на горшок, а также массу одного плода. После завершения всех измерений в течение третьего периода измерений коронки отделяли от корней и листьев. Затем корни тщательно очищали от почвы и измеряли их массу. Сухую массу корней затем определяли путем высушивания при 105 °C в течение 48 ч в лабораторной сушилке.
После каждого эксперимента определяли сырую и сухую массу корневой системы. Также измеряли содержание K, Ca, Mg, Na, Cu, Zn, Mn и Mo, а также соотношение одновалентных и двухвалентных элементов в листьях, корнях и коронках растений. Содержание кальция, магния, натрия и микроэлементов в растительных тканях определяли атомно-абсорбционной спектрометрией (AAS) с использованием спектрофотометра iCE 3000 series (ThermoScientific, Waltham, MA, USA) в мокром минерализованном материале, подготовленном со смесью азотной кислоты (HNO₃) и HCl в соотношении 1:1. Содержание фосфора определяли колориметрически с использованием спектрофотометра Marcel Mini. На основе полученных результатов дополнительно рассчитывали эквивалентное соотношение одновалентных и двухвалентных элементов, т.е. K:(Ca + Mg).
2.4. Статистический анализ
Результаты исследования были статистически проанализированы в STATISTICA версии 13.3 (StatSoft, Kraków, Poland) с использованием однофакторного дисперсионного анализа в полностью рандомизированной схеме. Значимость различий между средними значениями определяли с помощью теста Дункана с уровнем значимости α = 0,05. Одинаковые однобуквенные обозначения использовали для указания средних, не отличавшихся статистически друг от друга. Анализы проводили отдельно для каждого периода измерений.
2.5. Радарные диаграммы
Для обобщения всех собранных результатов, стандартизации изменений значений отдельных параметров и выявления общих тенденций использовали радарные диаграммы. На радарных диаграммах представлены значения выбранных анализируемых параметров. Различия между значениями для растений, выращенных в условиях оптимальной и дефицитной влажности почвы, использовали для расчета значений параметров, показанных на диаграммах.
Для параметров S — т.е. тех, для которых меньшее снижение в условиях дефицита воды по сравнению с условиями оптимальной влажности указывало на лучшую адаптацию к стрессу (E, gs, Pn, ci, WUE, F0, FM, FV, FV/FM, chla, chlb, chl total, carot, RWC, урожай сырой массы плодов, масса одного плода) — использовали следующую формулу:
где
Sdef — значение параметра в условиях дефицита влажности почвы;
Sopt — значение параметра в условиях оптимальной влажности почвы.
Для параметров D — т.е. тех, для которых меньшее увеличение в условиях дефицита воды по сравнению с условиями оптимальной влажности указывало на лучшую адаптацию к стрессу (TFM, AM) — использовали следующую формулу:
где
Ddef — значение параметра в условиях дефицита влажности почвы;
Dopt — значение параметра в условиях оптимальной влажности почвы.
Диаграммы строились на основе серии анализов, проверяющих значимость различий между средними для отдельных типов объектов, с использованием однофакторного дисперсионного анализа (ANOVA). Для средних, не отличавшихся значительно друг от друга, а также для значений, показывающих тенденции, расходящиеся с общими закономерностями — т.е. для параметров S, где значения в условиях дефицита были значительно выше, чем в оптимальных условиях, и для параметров D, где значения в условиях дефицита были значительно ниже, чем в оптимальных условиях — на радарных графиках присваивали значение 100.
Сравнения изучаемых объектов проводили путем вычисления площади многоугольника, образованного линией графика.
3. Результаты
3.1. Оценка различий в физиологических признаках, химическом составе и урожайности
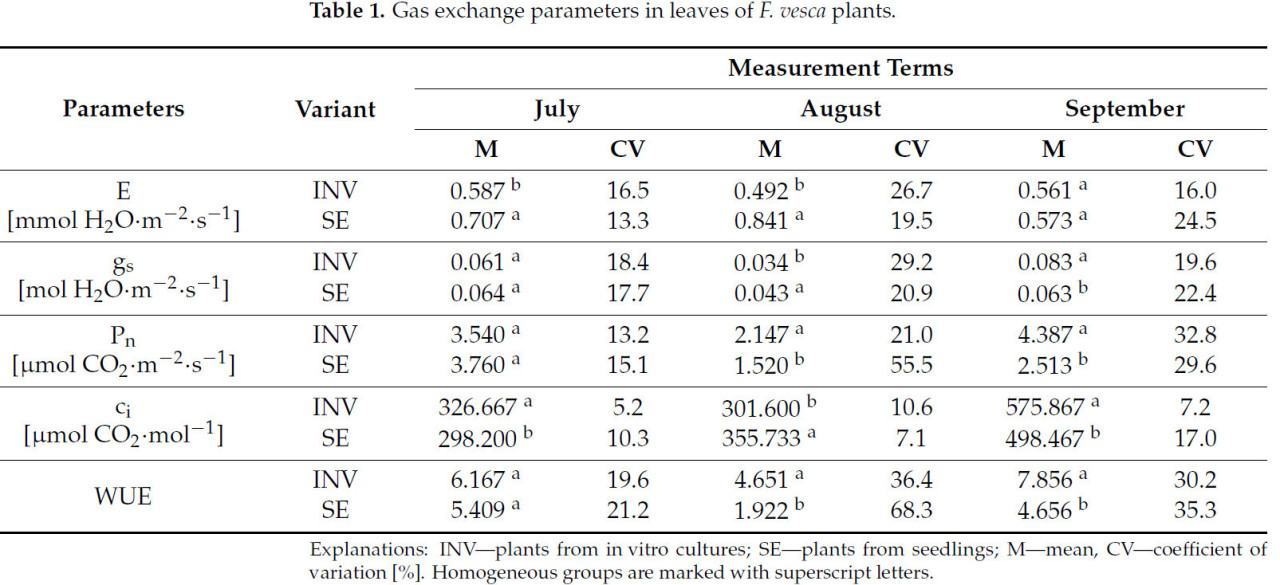
На первую дату измерения различия между растениями Fragaria vesca сорта Rugia, размноженными разными методами, наблюдались только для определенных параметров. Для параметра E более высокие значения были зарегистрированы у растений, размноженных из сеянцев (SE), по сравнению с полученными из in vitro культур (INV). И наоборот, для параметра ci растения INV демонстрировали более высокие значения, чем растения SE (Таблица 1). На вторую дату измерения растения INV демонстрировали более высокие значения для Pn и WUE, тогда как растения SE показывали более высокие значения для E, gs и ci. На третью дату измерения растения INV демонстрировали более высокие значения для всех измеренных параметров газообмена, за исключением E, для которого не наблюдалось значительных различий.
Таблица 1.Параметры газообмена в листьях растенийF. vesca.
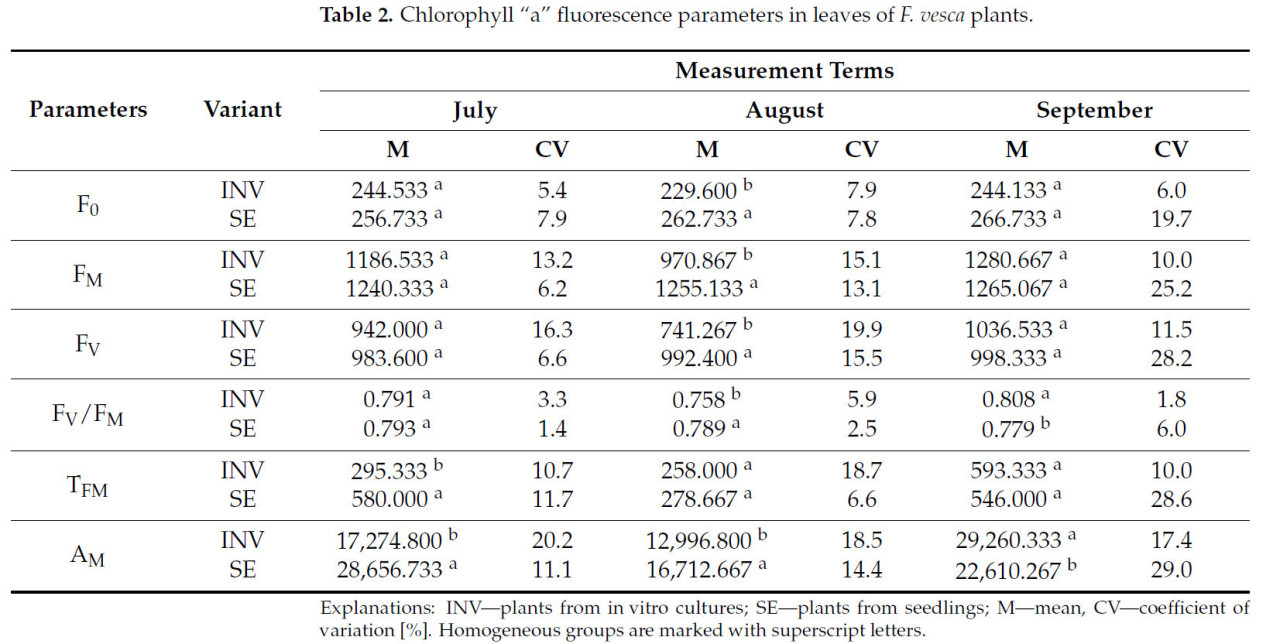
Что касается параметров флуоресценции хлорофилла, различия между растениями, размноженными разными методами, наблюдались на первую дату измерения только для TFM и AM, с более высокими значениями, зарегистрированными у растений SE (Таблица 2). Подобная тенденция наблюдалась на вторую дату измерения, где растения SE проявляли более высокие значения для параметров F0, FM, FV, FV/FM и AM. На третью дату измерения растения SE и INV различались по FV/FM и AM, причем растения INV демонстрировали более высокие значения для этих параметров.
Таблица 2.Параметры флуоресценции хлорофилла «а» в листьях растенийF. vesca.
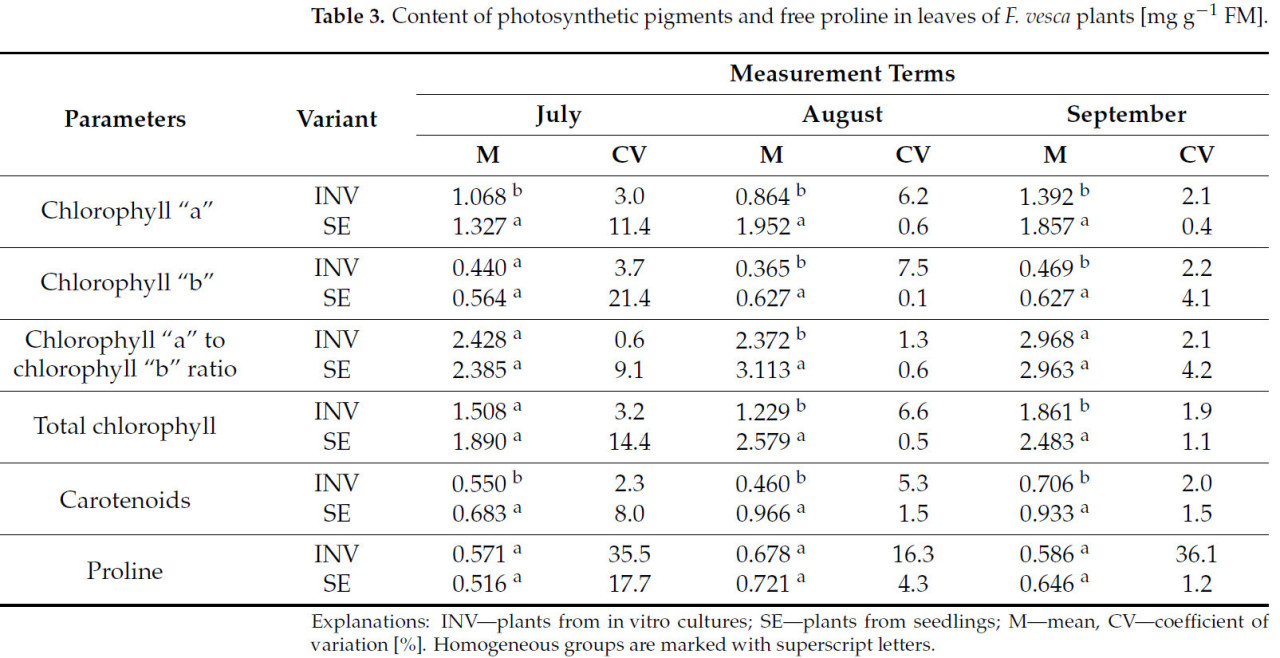
По содержанию фотосинтетических пигментов в листьях земляники различия между растениями, размноженными разными методами, наблюдались на первую дату измерения только для содержания хлорофилла «a» и каротиноидов, с более высокими уровнями, зарегистрированными у растений SE (Таблица 3). На вторую дату измерения растения SE характеризовались более высокими уровнями всех измеренных фотосинтетических пигментов, а также более высоким соотношением хлорофилла «a» к «b». Подобные тенденции наблюдались на третью дату измерения, за исключением соотношения хлорофилла «a» к «b», где не было обнаружено значительных различий. Ни на одной дате измерения не наблюдалось значительных различий в содержании свободного пролина в листьях растений Fragaria vesca сорта Rugia, размноженных разными методами.
Таблица 3.Содержание фотосинтетических пигментов и свободного пролина в листьях растенийF. vesca[мг г−1ФМ].
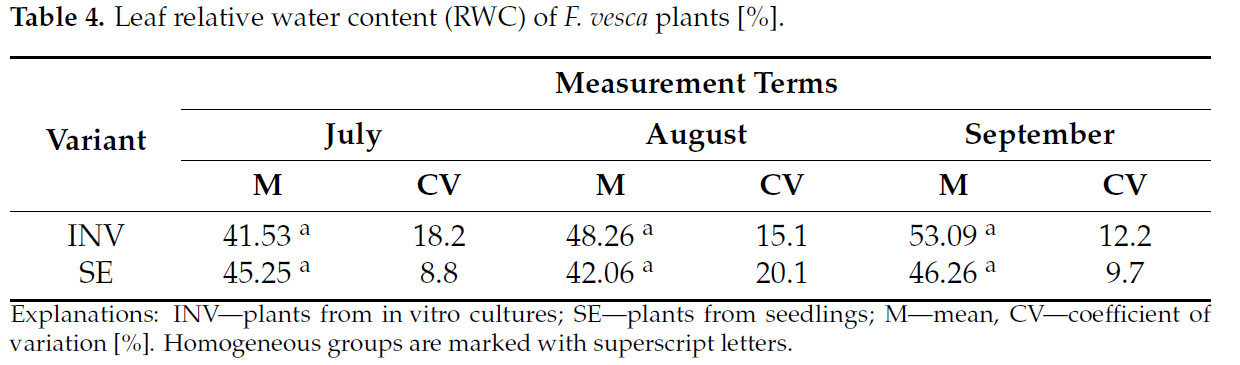
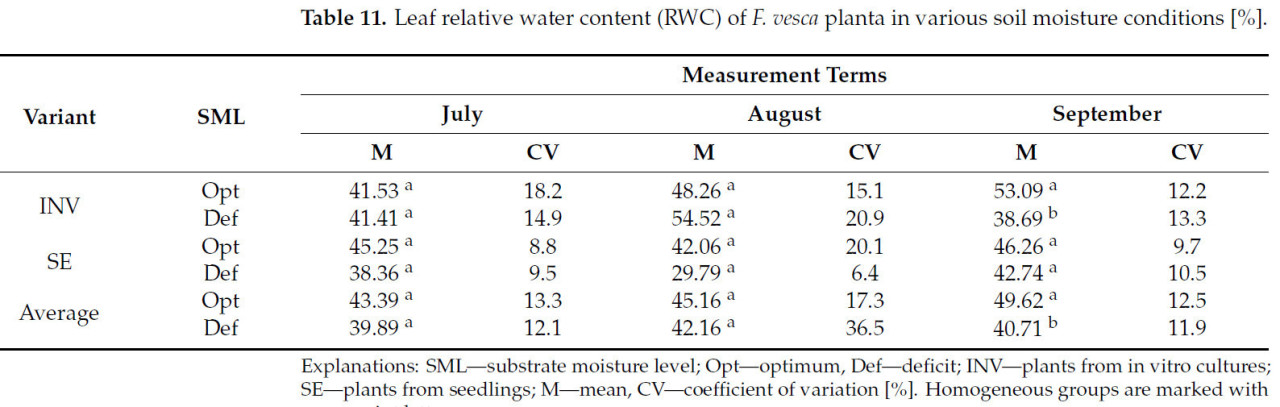
Не наблюдалось значительных различий в значениях RWC в листьях растений Fragaria vesca сорта Rugia, размноженных с использованием разных методов, ни на одной из дат измерений (Таблица 4).
Таблица 4.Относительное содержание воды в листьях (RWC) растенийF. vesca[%].
Растения INV проявляли более высокий общий урожай массы плодов по сравнению с растениями SE. Дополнительно растения INV демонстрировали более высокую среднюю массу одного плода (Таблица 5).
Таблица 5. Общий урожай плодов с одного растения и масса одного плода в течение вегетационного периода (июнь–сентябрь) у растений F. vesca [г].
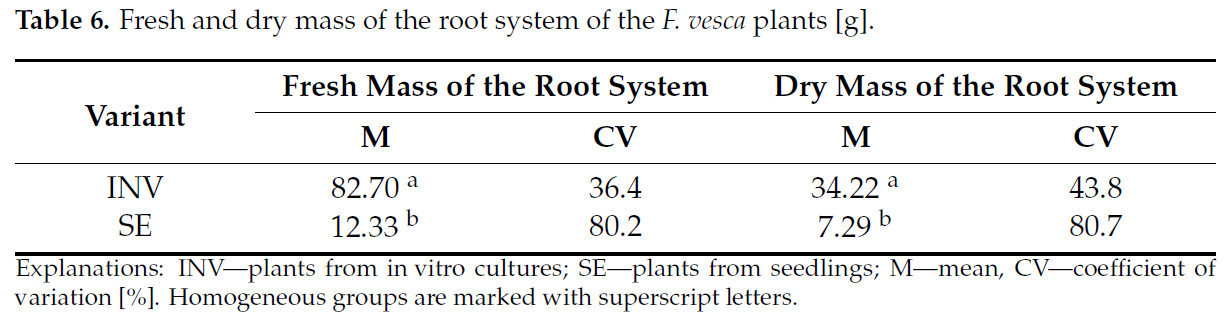
Подобно урожайности плодов, как сырая, так и сухая масса корневой системы были выше у растений INV по сравнению с растениями SE (Таблица 6).
Таблица 6. Сырая и сухая масса корневой системы растений F. vesca [г].
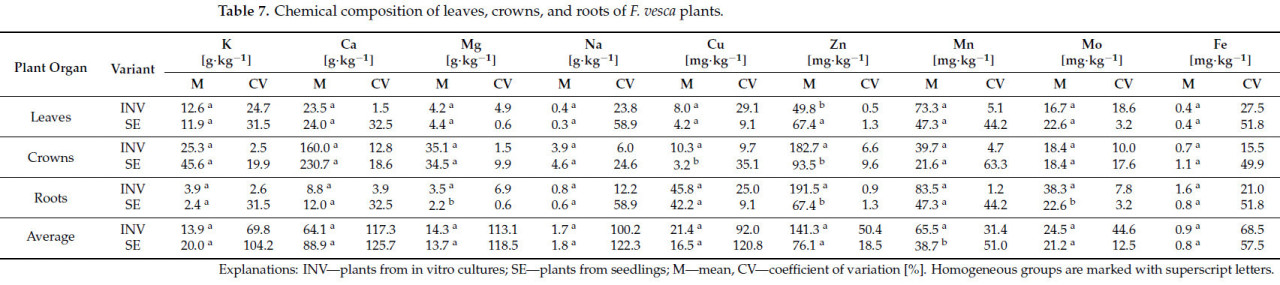
Анализ среднего содержания элементов в растениях Fragaria vesca сорта Rugia, размноженных разными методами, не выявил значительных различий в содержании K, Ca, Mg, Na, Cu, Zn, Mo и Fe (Таблица 7). Однако растения INV проявляли более высокое содержание Mn по сравнению с растениями SE. При анализе содержания элементов в отдельных органах было обнаружено, что растения SE имеют более высокое содержание Zn в своих листьях по сравнению с растениями INV. Во всех остальных случаях различий между экспериментальными вариантами не наблюдалось. Для коронок экспериментальные варианты различались только по содержанию Cu и Zn, причем растения INV содержали более высокие уровни обоих элементов. В корнях экспериментальные варианты различались по содержанию Mg, Zn и Mo. Для каждого из этих элементов растения INV демонстрировали более высокие концентрации, чем растения SE.
Таблица 7. Химический состав листьев, коронок и корней растений F. vesca.
3.2. Оценка различий в физиологических признаках, химическом составе и урожайности в различных условиях влажности почвы
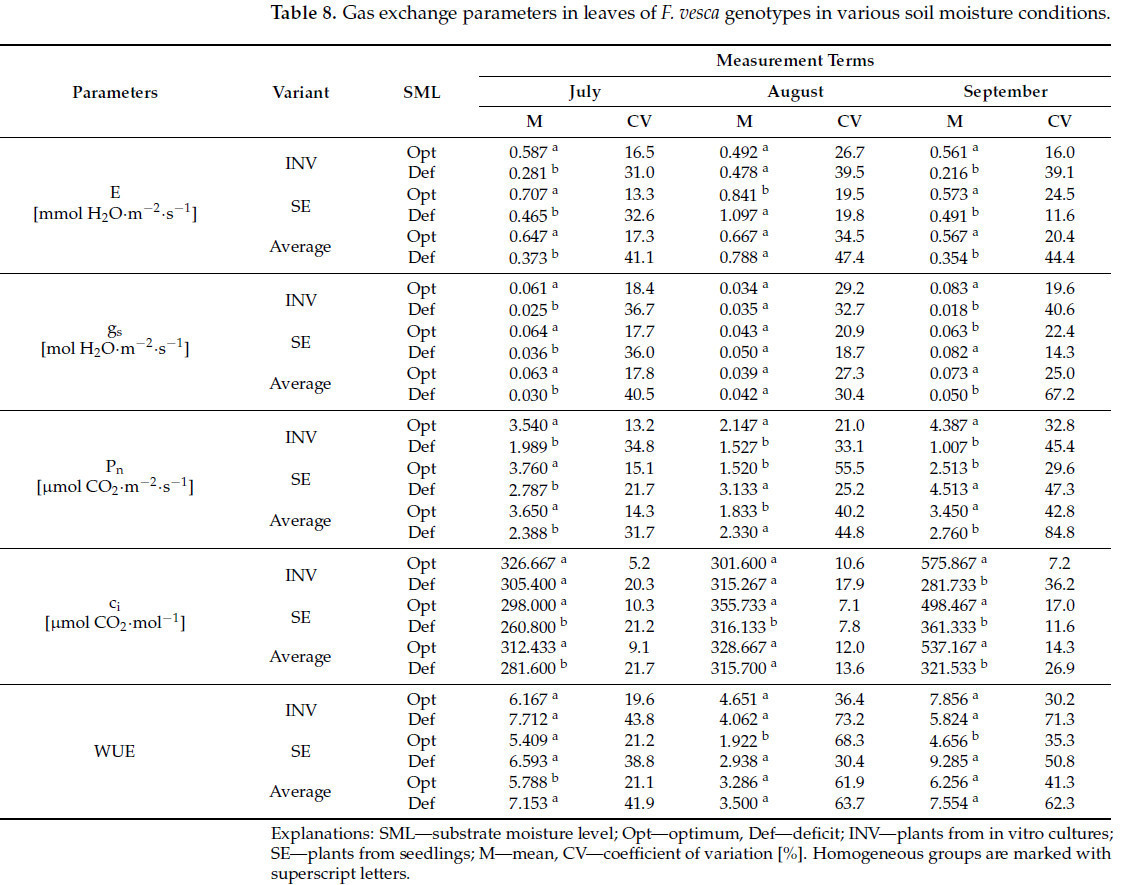
На первую и третью даты измерения, независимо от использованного метода размножения, растения Fragaria vesca, выращенные в условиях недостаточной влажности субстрата, проявляли более низкие значения параметров газообмена (E, gs, Pn, ci) (Таблица 8). На вторую дату измерения, однако, наблюдалось только более высокое значение Pn у растений, подвергнутых дефициту воды, тогда как на первую дату измерения была зарегистрирована повышенная величина отношения WUE. Растения INV реагировали на дефицит воды снижениями E и gs на первую и третью даты измерения, ci на третью дату и Pn на все три даты измерения. В contrast, растения SE проявляли снижения E на первую и третью даты измерения, gs и Pn только на первую дату и ci на все три даты. Дополнительно растения SE демонстрировали более высокие значения E на первую дату измерения и более высокие значения Pn на вторую и третью даты в условиях дефицита воды. Не наблюдалось различий в WUE для растений INV по всем датам измерения. В contrast, растения SE показали увеличение WUE на вторую и третью даты.
Таблица 8. Параметры газообмена в листьях генотипов F. vesca в различных условиях влажности почвы
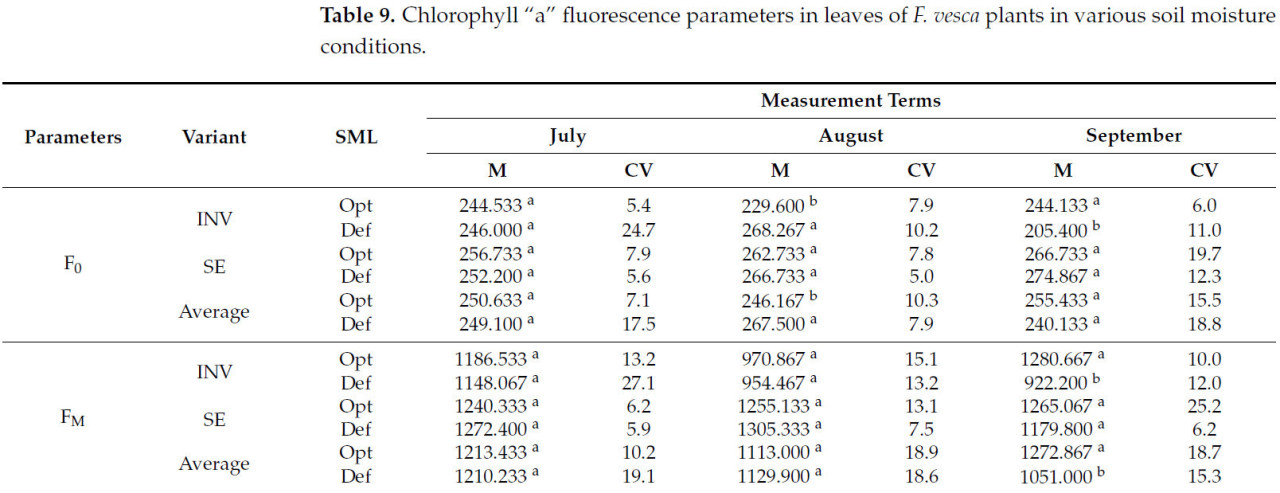
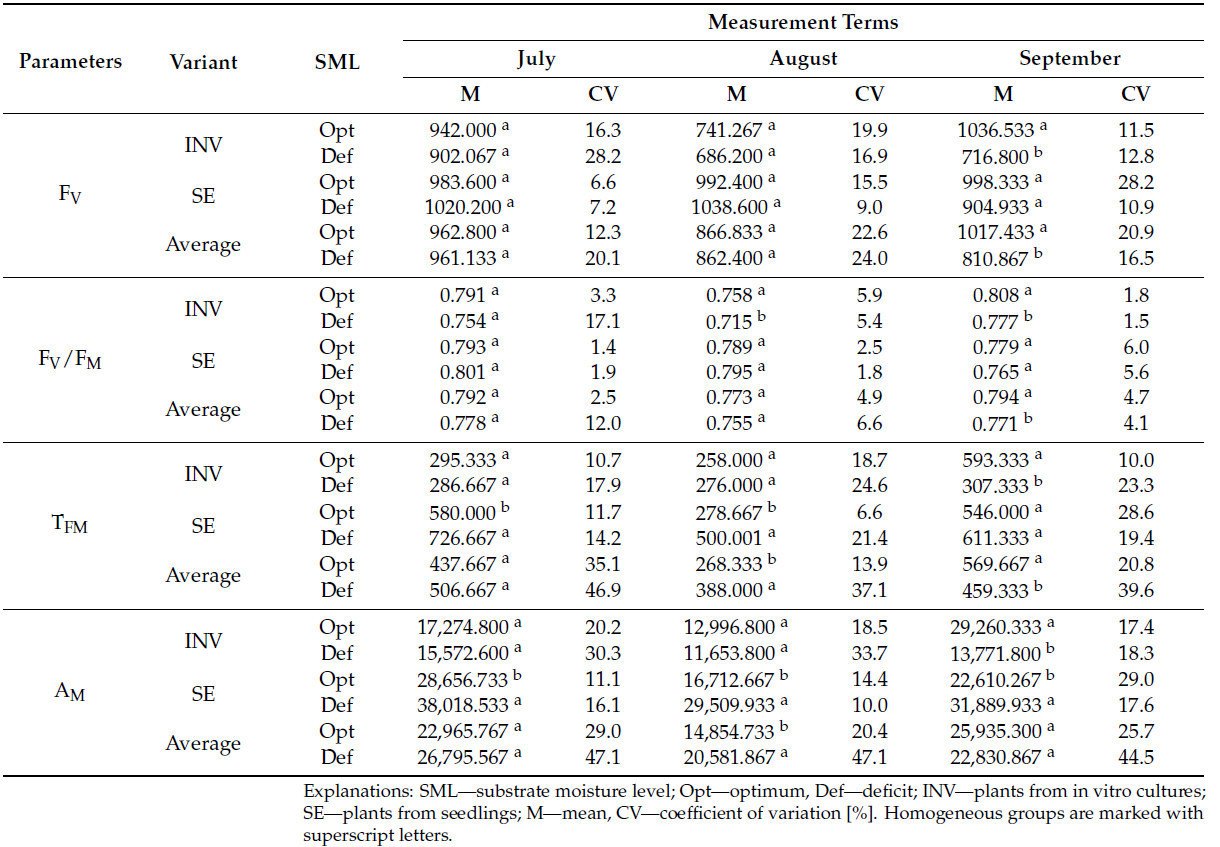
Независимо от метода размножения, увеличение значений F0 наблюдалось на вторую дату измерения у растений, выращенных в условиях стресса засухи. На третью дату измерения были зарегистрированы снижения значений FM, FV, FV/FM и TFM, в то время как увеличения AM и TFM были отмечены на вторую дату (Таблица 9). Для растений INV не наблюдалось изменений параметров флуоресценции хлорофилла «a» на первую дату измерения. На вторую дату измерения растения INV, подвергнутые стрессу засухи, проявляли более высокие значения F0 и одновременно более низкие значения FV/FM. На третью дату измерения эти растения демонстрировали более низкие значения для F0, FM, FV, FV/FM, TFM и AM. Для растений SE, выращенных в условиях дефицита воды, единственными наблюдаемыми изменениями были увеличения значений TFM на первую и вторую даты измерения и увеличения значений AM на все три даты измерения.
Таблица 9. Параметры флуоресценции хлорофилла "a" в листьях растений F. vesca в различных условиях влажности почвы.
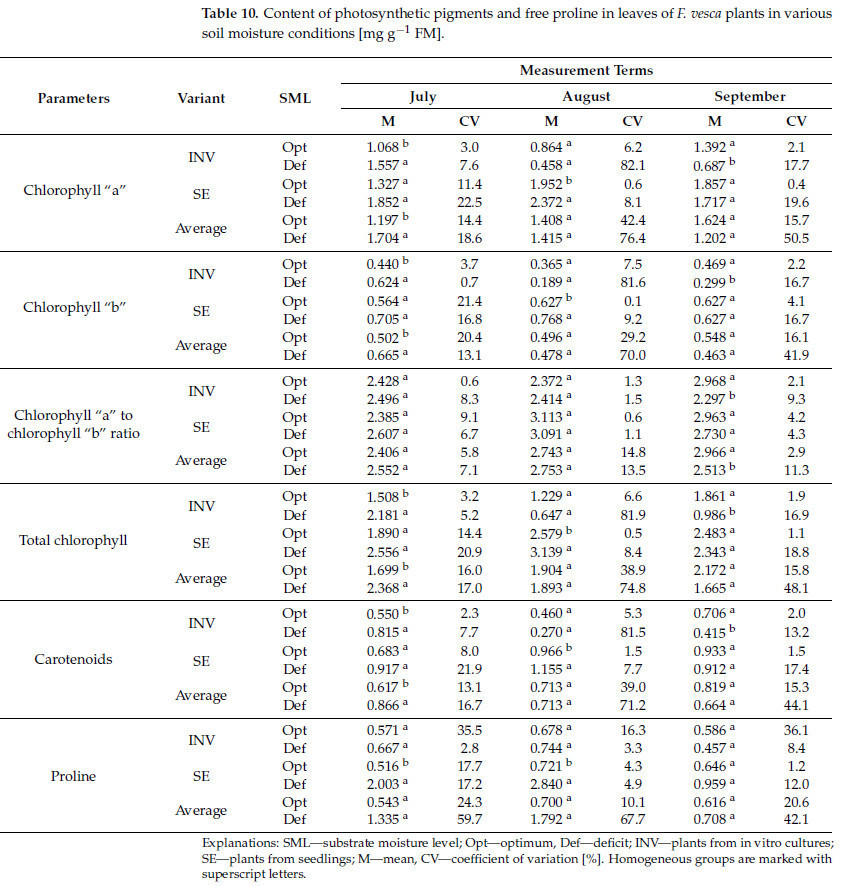
Независимо от метода размножения, растения, выращенные в условиях дефицита воды, проявляли более высокие уровни хлорофилла «a», хлорофилла «b», общего хлорофилла и каротиноидов только на первую дату измерения (Таблица 10). Однако соотношение хлорофилла «a» к «b» было ниже на третью дату измерения. У растений INV наблюдались более высокие уровни хлорофилла «a», хлорофилла «b», общего хлорофилла и каротиноидов при стрессе засухи на первую дату измерения, в то время как эти значения были ниже на третью дату измерения, наряду с уменьшенным соотношением хлорофилла «a» к «b». На вторую дату измерения не наблюдалось значительных различий у растений INV, что контрастирует с растениями SE, где изменения отмечались исключительно на эту дату. Было обнаружено, что растения SE в условиях дефицита воды проявляли более высокие уровни хлорофилла «a», хлорофилла «b», общего хлорофилла и каротиноидов на вторую дату измерения. Дополнительно только в этом случае наблюдалось повышенное содержание пролина в листьях.
Таблица 10. Содержание фотосинтетических пигментов и свободного пролина в листьях растений F. vesca в различных условиях влажности почвы [мг·г⁻¹ сырой массы].
Независимо от метода размножения или в случае растений INV, различия в значениях RWC между растениями, выращенными в различных условиях влажности субстрата, наблюдались только на третью дату измерения. На эту дату растения, подвергнутые стрессу засухи, проявляли более низкие значения RWC (Таблица 11). Во всех остальных случаях, включая все даты измерения для растений SE, не было обнаружено значительных различий между экспериментальными вариантами.
Таблица 11. Относительное содержание воды в листьях (RWC) растений F. vesca в различных условиях влажности почвы [%].
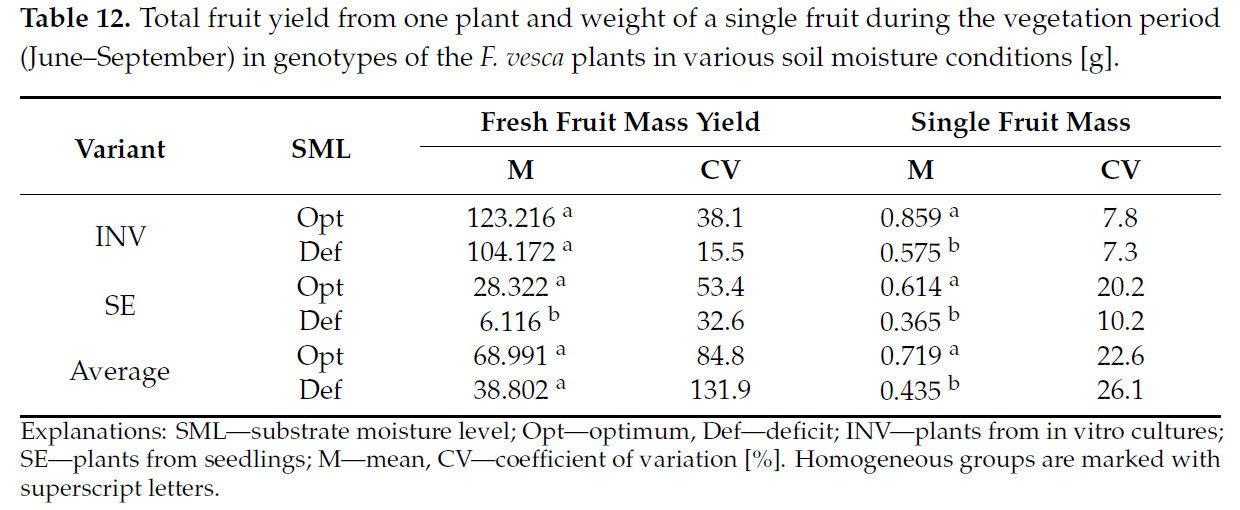
Независимо от метода размножения, растения, выращенные в различных условиях влажности субстрата, не различались по урожаю сырой массы плодов (Таблица 12). Подобное соотношение наблюдалось для растений INV. Однако в случае растений SE отмечалось снижение урожайности плодов в условиях дефицита воды. Как для растений INV и SE, так и независимо от метода размножения, было обнаружено, что растения, выращенные в условиях засухи, производили плоды с более низкой индивидуальной массой плодов по сравнению с выращенными в условиях оптимальной влажности субстрата.
Таблица 12. Общий урожай плодов с одного растения и масса одного плода в течение вегетационного периода (июнь–сентябрь) у генотипов растений F. vesca в различных условиях влажности почвы [г].
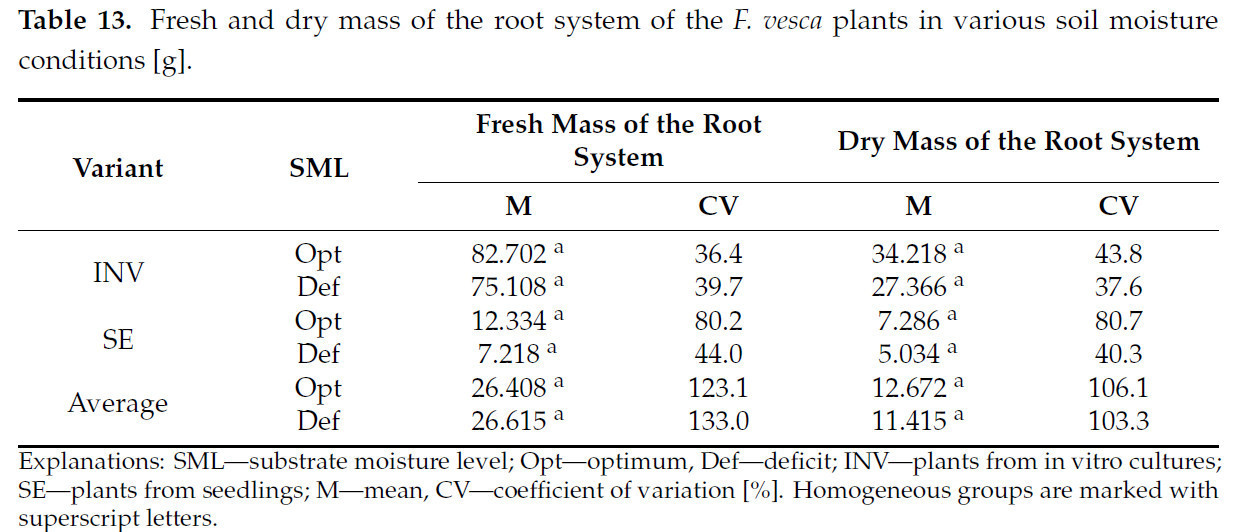
Не наблюдалось влияния различных уровней влажности субстрата ни на сырую, ни на сухую массу корневой системы у изучаемого сорта Fragaria vesca, независимо от использованного метода размножения (Таблица 13).
Таблица 13. Сырая и сухая масса корневой системы растений F. vesca в различных условиях влажности почвы [г].
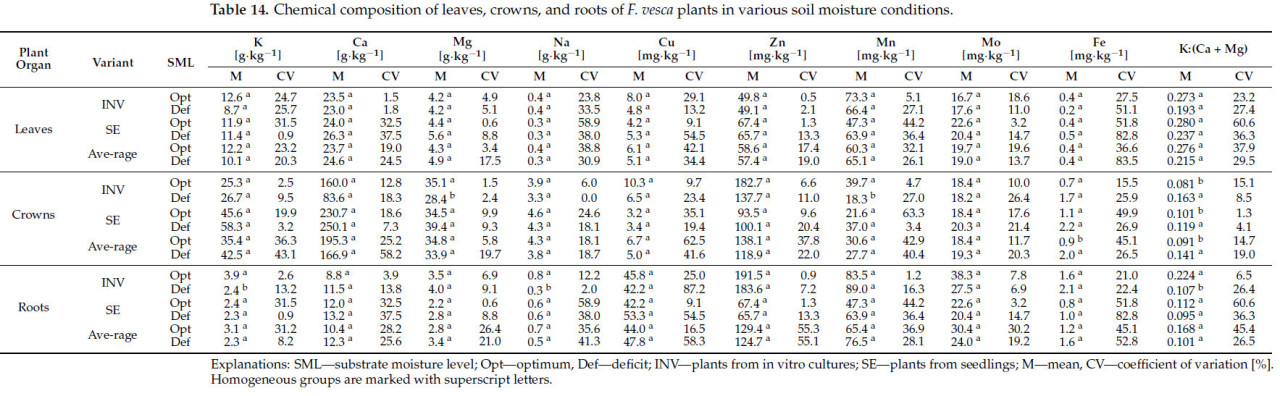
Независимо от метода размножения или варианта растения (INV или SE), было обнаружено, что растения, выращенные при стрессе засухи и выращенные в условиях оптимальной влажности субстрата, не различались по содержанию любых анализируемых элементов или по соотношению K:(Ca + Mg) в их листьях (Таблица 14).
Таблица 14. Химический состав листьев, коронок и корней растений F. vesca в различных условиях влажности почвы.
При сравнении содержания элементов в коронках растений, выращенных в различных условиях влажности субстрата, независимо от метода размножения, различия наблюдались только в содержании Fe и соотношении K:(Ca + Mg), оба из которых были выше у растений, подвергнутых стрессу засухи. Для растений INV отмечались подобные различия в соотношении K:(Ca + Mg), в то время как противоположная тенденция наблюдалась для содержания Mg и Mn, с более высокими уровнями, зарегистрированными у растений, выращенных в условиях оптимальной влажности субстрата. В коронках растений SE, выращенных в различных условиях влажности субстрата, различия наблюдались только в соотношении K:(Ca + Mg), которое было выше у растений, подвергнутых стрессу засухи.
Независимо от метода размножения или в случае растений SE, не наблюдалось различий в содержании анализируемых элементов или в соотношении K:(Ca + Mg) в корнях Fragaria vesca, выращенных в различных условиях влажности субстрата. Однако корни растений INV, выращенных в условиях оптимальной влажности субстрата, характеризовались более высоким содержанием K и Na, а также более высоким соотношением K:(Ca + Mg). Для остальных элементов различий между растениями не обнаружено.
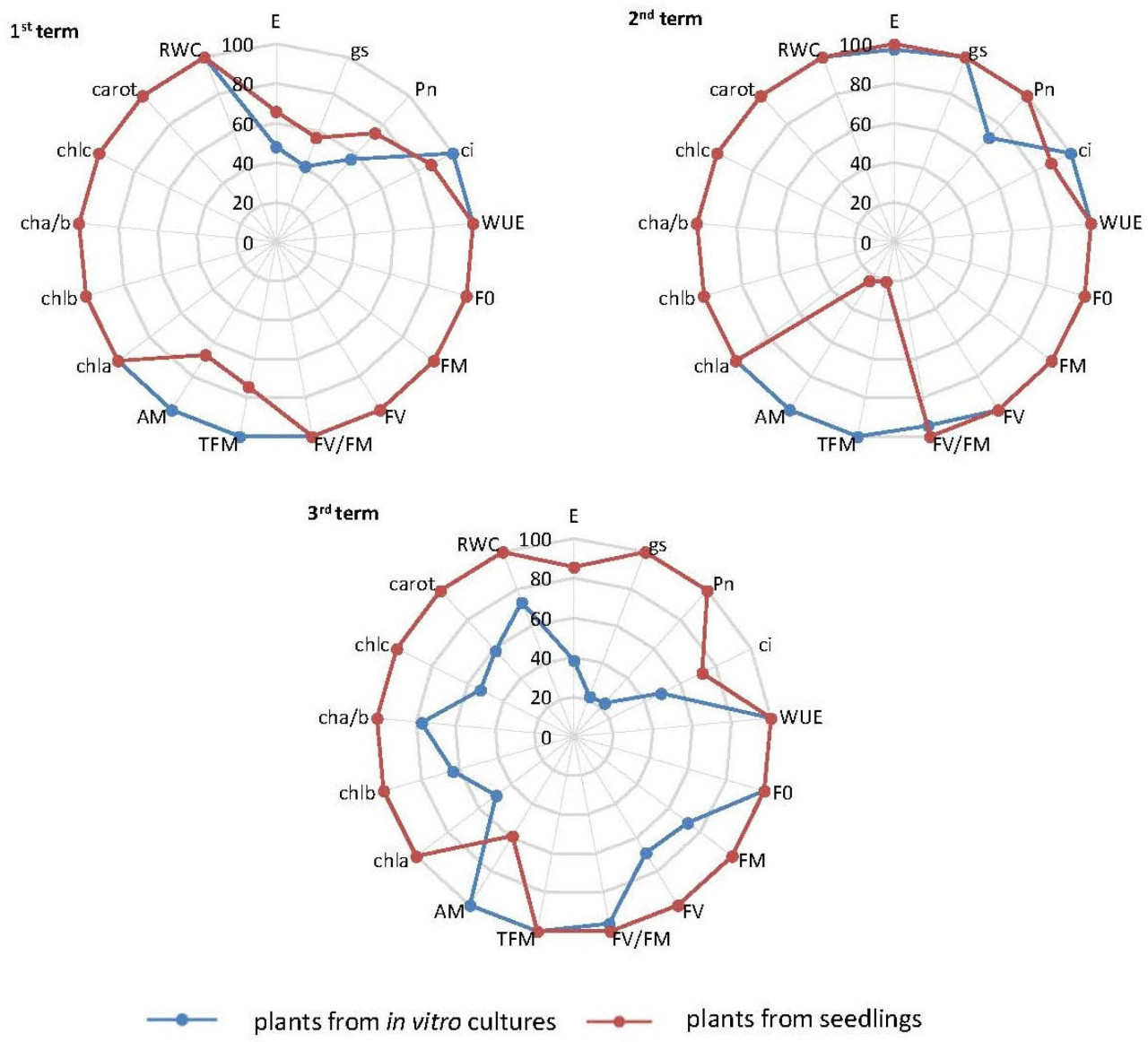
На Рисунке 1 представлен анализ изменений средних значений выбранных физиологических параметров Fragaria vesca сорта Rugia, размноженных с использованием разных методов, по датам измерений. Основываясь на площади под графиком, растения, размноженные из зеленых черенков, показали наименьшую адаптацию к дефициту воды в субстрате и самую сильную неблагоприятную реакцию на стресс засухи (представленную наименьшей площадью графика) на первую и вторую даты измерения. На третью дату измерения, однако, наименьшая адаптация и самая сильная неблагоприятная реакция наблюдались у растений, размноженных через in vitro культуры.
Рисунок 1. Изменения средних значений выбранных физиологических параметров растений F. vesca в условиях дефицита воды в субстрате по сравнению со средними значениями в условиях оптимальной влажности.
Обозначения: E — скорость транспирации H₂O, gs — устьичная проводимость H₂O, Pn — скорость чистого поглощения CO₂, ci — подустьичная концентрация CO₂, WUE — коэффициент эффективности использования воды при фотосинтезе, F₀ — начальная флуоресценция, FM — максимальная флуоресценция, FV — переменная флуоресценция, FV/FM — максимальная потенциальная эффективность фотохимической реакции в ФС II, TFM — время роста флуоресценции хлорофилла, AM — площадь над кривой индукции флуоресценции хлорофилла, chla — содержание хлорофилла a, chlb — содержание хлорофилла b, chla/b — соотношение содержания хлорофилла a к b, chlc — общее содержание хлорофилла, carot — содержание каротиноидов, RWC — индекс относительного содержания воды в листе.
4. Обсуждение
Микроразмножение растений через in vitro культуры является эффективным методом коммерческого быстрого размножения свободных от болезней, генетически однородных растений [32,33,34]. В отличие от традиционных методов, которые ограничены сезонными изменениями, микроразмножение можно проводить круглый год в контролируемых условиях, что позволяет обеспечить непрерывное производство [35]. Эта методика особенно выгодна для таких культур, как род Fragaria, где традиционные методы размножения могут приводить к распространению болезней и являются менее эффективными [33,36,37,38]. Несколько исследований [39,40,41] также предполагают, что растения, размноженные через in vitro культуры, проявляют превосходные морфогенетические признаки, включая размер коронки, количество столонов, время цветения и урожайность плодов, по сравнению с традиционно размноженными растениями.
Эти различия могут также проявляться в физиологических признаках, которые напрямую влияют на продуктивность растений в коммерческом выращивании. Специфические и контролируемые условия in vitro культур приводят к уникальным адаптациям у растений. Например, из-за высокой влажности в in vitro условиях растения обычно развивают тонкую и слабо развитую кутикулу [42], а также нежные листья [43]. Функция устьиц часто менее эффективна [44], на что влияют специфические световые условия (интенсивность и спектр) в лабораторных условиях и зависимость от сахарозы как основного источника углерода, что приводит к менее эффективному фотосинтетическому аппарату [45]. Дополнительно растения склонны развивать более слабую корневую систему из-за легкой доступности питательных веществ в среде [42], и они проявляют более низкие уровни антиоксидантных ферментов из-за сниженного воздействия экологических стрессов [46].
Акклиматизация растений из in vitro культур к условиям in vivo значительно влияет на их физиологические признаки, так как растения должны адаптироваться к среде, которая является более сложной и изменчивой по сравнению со стерильными условиями in vitro культуры [47,48]. Правильно проведенная акклиматизация также улучшает способность растения переносить экологические стрессы [48,49,50]. В настоящем исследовании было показано, что в условиях оптимальной влажности субстрата растения, полученные из in vitro культур, проявляли, в зависимости от даты измерения, более низкие параметры газообмена (в частности интенсивность транспирации), более низкие параметры флуоресценции хлорофилла и сниженные уровни фотосинтетических пигментов. Однако эти растения одновременно достигали значительно более высокой урожайности сырой массы плодов, массы одного плода и сырой и сухой массы корней.
Более низкая интенсивность транспирации, наблюдаемая у растений, полученных из in vitro культур, может быть результатом их адаптации к условиям высокой влажности, типичным для in vitro сред, где существует сниженная потребность в сохранении воды [51,52]. Растения, перенесенные в условия ex vitro, изначально не хорошо адаптированы к эффективной регуляции воды через поверхность листьев, в частности на ранних стадиях, что подтверждается данным исследованием. Более низкие значения транспирации наблюдались только в течение первых двух дат измерений. К третьей дате измерения различия уже не были значительными, что предполагает продолжающиеся адаптивные процессы. Сниженные значения флуоресценции хлорофилла «a», наблюдаемые у растений, полученных из in vitro культур, указывают на менее эффективное функционирование фотосинтетического аппарата [53,54]. Дополнительно более низкие уровни фотосинтетических пигментов могут дальнейшим образом способствовать снижению фотосинтетической эффективности [55]. Другие исследования также указывали, что сниженные параметры флуоресценции хлорофилла предполагают менее эффективный фотосинтетический аппарат, в частности когда функциональность ФСII (FV/FM) падает ниже ~0,7 [56]. Сходные результаты были получены для Coccinia indica, где микроразмноженные растения проявляли более низкие скорости транспорта по сравнению с размноженными in vivo растениями. Это различие объяснялось развитием нефункциональных устьиц, плохо развитых корневых систем и неадекватным формированием эпидермиса в условиях in vitro [57]. Эти находки дальнейшим образом поддерживаются сообщениями Вахадати и др. [58].
Несмотря на эти более низкие значения физиологических параметров, растения, полученные из in vitro культур, производили более высокий урожай сырой массы плодов, включая более крупные单个 массы плодов, а также большую сырую и сухую массу корней. Растения, полученные из in vitro культур, несмотря на более низкие скорости транспирации и фотосинтеза, могут использовать водные и энергетические ресурсы более эффективно, способствуя росту на ранних стадиях развития. Постепенное увеличение физиологической активности после акклиматизации позволяет этим растениям оптимизировать свой метаболизм и достигать высокой урожайности. Это дальнейшим образом поддерживается другими исследованиями, указывающими, что микроразмноженная земляника достигает на 24% более высокой урожайности в полевых условиях по сравнению с размноженной традиционными методами [59]. Более того, микроразмножение также значительно увеличило урожай сахарного тростника, результат, объясненный улучшенными агрономическими признаками, такими как большая высота растения и большее количество жизнеспособных почек, которые способствуют улучшенной продуктивности [60]. Это увеличение урожайности может значительно повысить продуктивность и прибыльность производителей, в частности в условиях недостаточной влажности почвы. Дополнительно растения, полученные in vitro, являются генетически однородными и свободными от вирусов, обеспечивая стабильный потенциал роста и продуктивность при сохранении высокого качества [61]. В contrast, генетическое разнообразие среди in vivo растений может приводить к тому, что только часть популяции достигает оптимальной урожайности.
Хотя настоящее исследование не продемонстрировало значительной взаимосвязи между уровнями влажности почвы и биомассой корней (наблюдалась более низкая масса корней у растений при стрессе засухи, но эти различия не были статистически значительными), возможность такой взаимосвязи не следует упускать из виду. Стресс засухи приводит к снижению плотности корней и глубины корневой системы, реакция, обычно наблюдаемая у различных видов растений. Это снижение архитектуры корней является типичной адаптацией к ограниченной доступности воды [62]. Дефицит воды может уменьшать водный потенциал в корневой зоне, приводя к снижению тургора клеток и ингибированию деления клеток [63]. Дополнительно водный стресс снижает фотосинтетическую активность в листьях, что ограничивает доступность ассимилятов (сахаров и других углеводов), транспортируемых к корням [64]. Дополнительно увеличенное производство активных форм кислорода (АФК) в условиях стресса может приводить к апоптозу и некрозу в клетках корней, тем самым уменьшая накопление биомассы [65].
Химический состав листьев, коронок и корней растений может претерпевать существенные изменения в ответ на стресс засухи [66]. Стресс засухи влияет на поглощение и накопление различных минералов внутри растений. Например, у китайской пихты (Cunninghamia lanceolata) было обнаружено, что сильный стресс засухи увеличивает поглощение P и K, в то время как уменьшает поглощение Mg и Mn в тонких корнях. Дополнительно поглощение Fe увеличивалось в тонких и средних корнях, но уменьшалось в более крупных корнях [67]. Небольшие различия в химическом составе растительного материала между двумя экспериментальными вариантами предполагают, что растения, полученные in vitro, адаптируют свои корневые системы через соответствующие механизмы роста и внутреннего транспорта в течение эксперимента.
Хотя оба экспериментальных варианта реагировали на дефицит воды снижением физиологических параметров, более сильный эффект наблюдался на первые две даты измерения для растений, размноженных in vivo, тогда как на третью дату измерения растения, размноженные in vitro, проявляли более выраженную реакцию. Примечательно, что на последнюю дату измерения эти различия были наиболее очевидны, в основном из-за значительных снижений параметров газообмена и содержания фотосинтетических пигментов. Значения RWC также снижались только на третью дату измерения, в основном у растений INV. RWC является мерой водного статуса в растении, отражающей метаболическую активность в тканях [68]. Более низкие значения RWC в основном указывают на сниженную фотосинтетическую активность [69]. In vitro культуры развиваются в условиях высокой влажности [70], что может способствовать более эффективному управлению водой при переносе в условия in vivo. В течение ранних стадий вегетации эти растения проявляли более низкие скорости транспирации, полезный признак в условиях засухи. Однако длительный водный стресс вызывал большее повреждение фотосинтетического аппарата у растений, полученных из in vitro культур.
Стресс засухи также влияет на цепь транспорта электронов. Это запускает производство АФК, которые напрямую способствуют деградации фотосинтетических пигментов и повреждению структур тилакоидов [71]. Хлорофилл является неотъемлемым компонентом процесса фотосинтеза. Его деградация в условиях стресса может приводить к снижению фотосинтетической эффективности и препятствовать росту растений [72]. Исследования показали, что поддержание содержания хлорофилла при стрессе коррелирует со сниженными потерями урожайности у таких культур, как пшеница [73]. Деградация хлорофилла может происходить через окисление молекул пигмента сильными окислителями, такими как синглетный кислород или гидроксильные радикалы [74]. Другой путь деградации хлорофилла АФК involves перекисное окисление липидов в мембранах тилакоидов. Супероксид-анион радикалы могут окислять пул пластохинона, приводя к производству перекиси водорода, которая действует как сигнальная молекула и способствует перекисному окислению липидов [75]. Окислительные модификации, вызванные АФК, также могут влиять на белки D1, неотъемлемый компонент реакционного центра ФСII, где связан хлорофилл. Повреждение этих белков приводит к дисфункции фотосинтетических комплексов и вторичной деградации хлорофилла [76]. Дополнительно окислительный стресс может индуцировать экспрессию ферментов, катализирующих деградацию хлорофилла, таких как хлорофиллаза [77].
Исследование подтвердило физиологические различия между растениями Fragaria vesca сорта Rugia, полученными из in vitro культур и размноженными из сеянцев. Несмотря на изначально более низкие значения физиологических параметров, растения, полученные in vitro, демонстрировали более высокую урожайность сырой массы плодов, более крупную массу одного плода и более развитую корневую систему. Эти находки предполагают их способность эффективно управлять водными и энергетическими ресурсами, несмотря на начальные физиологические ограничения. Стоит отметить, что потенциальные генетические последствия сомаклональной изменчивости, приводящей к появлению полезных признаков у размноженных растений, включают ее использование для генерации новых сортов растений с желательными характеристиками, такими как устойчивость к болезням, улучшенная урожайность и толерантность к стрессам [78]. Это особенно ценно для культур, чувствительных к засухе, таких как род Fragaria. Тем не менее, возникновение сомаклональной изменчивости часто случайно, что может приводить к непредсказуемым эффектам внутри растительного материала. В то время как полезные изменения могут быть использованы в селекционных программах, непредсказуемость этого процесса представляет значительную проблему для коммерческого выращивания, где генетическая и фенотипическая однородность является критичной.
Водный стресс негативно влиял на оба экспериментальных варианта, но различия в реакции были динамичными. Однако длительный дефицит воды более серьезно нарушал фотосинтетический аппарат растений, полученных из in vitro культур. Тем не менее, их более высокая урожайность и лучше развитые корневые системы подтверждают потенциал этих растений для адаптации и высокой продуктивности в in vivo выращивании при условии, что условия окружающей среды и процесс акклиматизации properly управляются.
Эти находки подчеркивают необходимость оптимизации практик выращивания для растений, полученных in vitro, в частности в системах, склонных к дефициту воды, и для развития сортов с улучшенной засухоустойчивостью. Более того, эти находки могут иметь широкое практическое применение в сельском хозяйстве, садоводстве и охране окружающей среды, в частности в контексте изменения климата и проблем, вызванных нехваткой воды. Характеристики растений, полученных из in vitro культур, могут быть высоко полезны в условиях полевого выращивания, где эффективное управление водными и энергетическими ресурсами является ключевым для продуктивности и выживания растений. Способность этих растений эффективно использовать ограниченные ресурсы подчеркивает их потенциал для использования в системах выращивания, работающих в сложных условиях окружающей среды.
Будущие исследования должны сосредоточиться на молекулярных и биохимических механизмах, лежащих в основе реакций растений на длительный водный стресс при различных методах размножения, в частности роли антиоксидантных ферментов. Важно интегрировать молекулярные маркеры для идентификации засухоустойчивых генотипов. Дополнительно усилия должны быть направлены на оптимизацию процесса акклиматизации для смягчения эффектов начальных физиологических ограничений и для оценки физиологической производительности в системах многолетних культур. С точки зрения коммерческого производства земляники садовой и земляники лесной, проведение полевых исследований при различных уровнях влажности почвы было бы высоко значимым. Эти исследования должны включать оценку физиологических и морфологических параметров в течение последовательных лет роста, принимая во внимание различные методы размножения растений.
Это исследование, однако, связано с несколькими ограничениями. Во-первых, поскольку эксперименты проводились в контролируемых горшечных условиях, результаты могут не fully переводиться на полевые условия, где многочисленные дополнительные факторы влияют на физиологические реакции. Тем не менее, нашей целью было изолировать и изучить единственный фактор, минимизируя влияние других как можно больше. Во-вторых, отсутствие данных относительно массы/площади поверхности надземных частей растений значительно ограничивает объем анализа. Такие данные, combined с информацией об интенсивности фотосинтеза, могли бы предоставить ключевые представления о функциональности фотосинтетического аппарата. Эти аспекты будут рассмотрены в будущих исследованиях. Наконец, определенные измерения могут казаться немного несогласованными (например, относительно низкие значения RWC) из-за extended продолжительности исследования и влияния неконтролируемых факторов, таких как ветер, вредители и влажность, которые не учитывались в наших анализах.
5. Выводы
Это исследование позволило провести сравнительный анализ физиологических реакций растений Fragaria vesca сорта Rugia, полученных из in vitro культур и сеянцев, на дефицит воды в субстрате в условиях in vivo. Ключевые выводы следующие:
· Растения, размноженные с использованием различных методов, проявляют отчетливые физиологические признаки. Растения, полученные из in vitro культур, несмотря на более низкие общие физиологические параметры (такие как газообмен и флуоресценция хлорофилла), демонстрируют более высокую урожайность и большую массу корней.
· Дефицит воды в субстрате значительно влияет на физиологические признаки растений F. vesca. Условия засухи приводят к снижениям параметров газообмена, содержания ассимиляционных пигментов и массы плодов.
· Метод размножения влияет на чувствительность растений к засухе. Растения, полученные из in vitro культур, проявляли большую чувствительность к дефициту воды к концу вегетационного сезона. Однако на ранней стадии роста растения, размноженные из травянистых черенков, показывали более высокую чувствительность к засухе.
References
1. Nagpal, N.; Heilemann, J.; Klauer, B.; Gawel, E. Hydro-economic assessment of biophysical drought impacts on agriculture. In Proceedings of the EGU General Assembly 2024, EGU24-17486, Vienna, Austria, 14–19 April 2024. [Google Scholar] [CrossRef]
2. Rinaldo, T.; Ridolfi, E.; Moccia, B.; Marconi, F.; D’Odorico, P.; Russo, F.; Napolitano, F. The impact of drought on the water-food nexus at the global scale. In Proceedings of the EGU General Assembly 2024, EGU24-13506, Vienna, Austria, 14–19 April 2024. [Google Scholar] [CrossRef]
3. Fatima, S.; Aslam, R.; Shahzadi, K.; Awan, H.; Nadeem, M.; Shabir, M.; Shafiq, Y.; Hamid, M. Effect of drought stress on growth and development of pea (Pisum sativum L.). Asian J. Res. Crop Sci. 2024, 9, 76–80. [Google Scholar] [CrossRef]
4. Agunbiade, V.; Babalola, O. Drought stress amelioration attributes of plant-associated microbiome on agricultural plants. Bioinform. Biol. Insights 2024, 18, 11779322241233442. [Google Scholar] [CrossRef] [PubMed]
5. Rodziewicz, D.; Dice, J. Drought risk to the agriculture sector. Econ. Rev. 2020, 105, 01612387. [Google Scholar] [CrossRef]
6. Rojas, O. Next generation agricultural stress index system (ASIS) for agricultural drought monitoring. Remote Sens. 2021, 13, 959. [Google Scholar] [CrossRef]
7. Song, Y.; Joo, J.; Kim, H.; Park, M. Development and applicability evaluation of damage scale analysis techniques for agricultural drought. Water 2024, 16, 1342. [Google Scholar] [CrossRef]
8. Xiao, F.; Liu, Q.; Qin, Y.; Huang, D.; Liao, Y. Agricultural drought research knowledge graph reasoning by using VOSviewer. Heliyon 2024, 10, e27696. [Google Scholar] [CrossRef]
9. Klamkowski, K.; Treder, W.; Wójcik, K. Effects of long-term water stress on leaf gas exchange, growth and yield of three strawberry cultivars. J. Agric. Sci. Technol. 2015, 17, 167–178. [Google Scholar]
10. Caulet, R.P.; Gradinariu, G.; Iurea, D.; Morariu, A. Influence of furostanol glycosides treatments on strawberry (Fragaria × ananassa Duch.) growth and photosynthetic characteristics under drought conditions. Sci. Hort. 2014, 169, 179–188. [Google Scholar] [CrossRef]
11. Mikiciuk, G.; Mikiciuk, M.; Hawrot-Paw, M. Influence of superabsorbent polymers on the chemical composition of strawberry (Fragaria × ananassa Duch.) and biological activity in the soil. Folia Hortic. 2015, 27, 63–69. [Google Scholar] [CrossRef][Green Version]
12. Sammarco, I.; Münzbergová, Z.; Latzel, V. Response of Fragaria vesca to projected change in temperature, water availability and concentration of CO2 in the atmosphere. Sci. Rep. 2023, 13, 10678. [Google Scholar] [CrossRef]
13. Garg, M.; Datta, S.; Ahmad, S. Plant tissue culture: A potential tool for the production of secondary metabolites. In In Vitro Propagation and Secondary Metabolite Production from Medicinal Plants: Current Trends (Part 2); Bentham Science Publishers: Oak Park, IL, USA, 2024; pp. 15–63. [Google Scholar] [CrossRef]
14. Lone, R.; Mochi, S.; Hajam, Y.; Khurshid, I.; Kamili, A. In vitro propagation and phytochemical screening of some important medicinal plants of Northern India—A review. In In Vitro Propagation and Secondary Metabolite Production from Medicinal Plants: Current Trends (Part 2); Bentham Science Publishers: Oak Park, IL, USA, 2024; pp. 92–118. [Google Scholar] [CrossRef]
15. Yunita, R. In vitro culture’s function in plant breeding. Adv. Res. Biol. Sci. 2024, 4, 85–94. [Google Scholar] [CrossRef]
16. Hamdeni, I.; Louhaichi, M.; Slim, S.; Boulila, A. Incorporation of organic growth additives to enhance in vitro tissue culture for producing genetically stable plants. Plants 2022, 11, 3087. [Google Scholar] [CrossRef] [PubMed]
17. Kodad, S.; Melhaoui, R.; Addi, M.; Hano, C.; Sahib, N.; Elamrani, A.; Abid, M.; Mihamou, A. Micropropagation of zygotic embryos from genetically diverse almond seedling orchards in eastern Morocco. E3S Web Conf. 2021, 298, 03008. [Google Scholar] [CrossRef]
18. Saha, S.; Chowdhury, T.; Ghosh, P. Micropropagation for Stress Tolerance in Crop Plants: An Overview. In Response of Field Crops to Abiotic Stress, 1st ed.; Choudhury, S., Moulick, D., Eds.; CRC Press: Boca Raton, FL, USA, 2022; pp. 241–249. [Google Scholar]
19. Spinoso-Castillo, J.; Mancilla-Álvarez, E.; Bello-Bello, J. In vitro response of sugarcane (Saccharum spp. Hybrid) plantlets to flooding stress. J. Biotechnol. 2024, 393, 74–80. [Google Scholar] [CrossRef] [PubMed]
20. Tajaragh, R.; Rasouli, F.; Giglou, M.; Zahediego, S.; Hassanpouraghdama, M.; Azamiego, M.; Adamkowa, A.; Mlček, J. Morphological and physiological responses of in vitro-grown Cucurbita sp. landrace seedlings under osmotic stress by mannitol and PEG. Horticulturae 2022, 8, 1117. [Google Scholar] [CrossRef]
21. Capocasa, F.; Balducci, F.; Marcellini, M.; Bernardini, D.; Navacchi, O.; Mezzetti, B. Comparing nursery behavior, field plant yield and fruit quality of in vitro and in vivo propagated strawberry mother plants. Plant Cell Tissue Organ Cult. 2019, 136, 65–74. [Google Scholar] [CrossRef]
22. Chitra, D.V.; Chinthapalli, B.; Padmaja, G. A comparative study on field performance of micropropagated plants and stem cutting derived plants of S-36 cultivar of Mulberry (Morus indica L.). Res. Biotechnol. 2016, 7, 21–27. [Google Scholar] [CrossRef]
23. Fonseca, A.P.; da Silva, E.C.; da Pereira, M.B.; Oliveira, R.P.; Dornelles, A.L.C. Phenotypic stability of strawberry genotypes subjected to variable number of in vitro subcultures. Ciênc. Rural. 2013, 43, 1345–1350. [Google Scholar] [CrossRef]
24. Irshad, M.; Rukh, S.; Nabi, G.; Israr, M.; Ali, S.; Munsif, F.; Suhail, M.; Mohammad, S.; Rizwan, H.M. Fruits of micropropagated strawberry (Fragaria ananassa) plants exhibited higher antioxidant metabolites as compared to in vivo grown plants. Pak. J. Bot. 2023, 55, 727–737. [Google Scholar] [CrossRef]
25. Żurawicz, E. Truskawka i Poziomka (Strawberry and Wild Strawberry); Państwowe Wydawnictwo Rolnicze i Leśne: Warsaw, Poland, 2005. [Google Scholar]
26. Murashige, T.; Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiol. Plant. 1962, 15, 473–497. [Google Scholar] [CrossRef]
27. Arnon, D.I.; Allen, M.B.; Whatley, F.R. Photosynthesis by isolated chloroplasts. IV. General concept and comparison of three photochemical reactions. Biochim. Biophys. Acta 1956, 20, 449–461. [Google Scholar] [CrossRef] [PubMed]
28. Lichtenthaler, H.; Wellburn, A. Determinations of total carotenoids and chlorophyll a and b of leaf extracts in different solvents. Biochem. Soc. Trans. 1966, 11, 591–592. [Google Scholar] [CrossRef]
29. Hager, A.; Mayer-Berthenrath, T. Die Isolierung und quantative Bestimung der Carotenoide und Chlorophyll von Blatern, Algen und isolierten Chloroplasten mit Hilfe Dunnschichtchromatographischer Methoden. Planta 1966, 69, 198–217. [Google Scholar] [CrossRef] [PubMed]
30. Yamasaki, S.; Rebello Dillenburg, I. Measurements of leaf relative water content in Araucaria angustifolia. Rev. Bras. Fisiol. Veg. 1999, 11, 69–75. [Google Scholar]
31. Bates, L.; Waldren, R.; Teare, I. Rapid determination of free proline for water-stress studies. Plant Soil 1966, 39, 205–207. [Google Scholar] [CrossRef]
32. Gantait, S.; Mandal, N.; Nandy, S. Advances in micropropagation of selected aromatic plants: A review on vanilla and strawberry. Am. J. Biochem. Mol. Biol. 2011, 1, 1–19. [Google Scholar] [CrossRef]
33. Rokosa, M.; Mikiciuk, M. In vitro regeneration of Fragraria plants. Acta Sci. Pol. Hortorum Cultus 2017, 16, 145–158. [Google Scholar] [CrossRef]
34. Valliath, A.; Mondal, R. Micropropagation of strawberry crop (Fragaria ananassa): A review. Bhartiya Krishi Anusandhan Patrika 2023, 38, 41–44. [Google Scholar] [CrossRef]
35. Chaudhari, V. Tissue culture: Aeon of micropropagation in vegetable crops. Int. J. Environ. Clim. Chang. 2023, 13, 1989–1999. [Google Scholar] [CrossRef]
36. Ashrafuzzaman, M.; Faisal, S.; Yadav, D.; Khanam, D.; Raihan, F. Micropropagation of strawberry (Fragaria ananassa) through runner culture. Bangladesh J. Agric. Res. 2013, 38, 467–472. [Google Scholar] [CrossRef]
37. Hasan, M.; Nigar, S.; Rabbi, M.; Mizan, S.; Rahman, M. Micropropagation of strawberry (Fragaria × ananassa Duch.). Int. J. Sustain. Crop Prod. 2010, 5, 36–41. [Google Scholar]
38. Bhatt, I.; Dhar, U. Micropropagation of Indian wild strawberry. Plant Cell Tissue Organ Cult. 2000, 60, 83–88. [Google Scholar] [CrossRef]
39. Karhu, S.; Hakala, K. Micropropagated strawberry in the field. Acta Hortic. 2002, 567, 321–324. [Google Scholar] [CrossRef]
40. Diengngan, S.; Mahadevamma, M.; Murthy, B. Efficacy of in vitro propagation and crown sizes on the performance of strawberry (Fragaria × ananassa Duch.) cv. Festival under field conditions. J. Agric. Sci. Technol. 2016, 18, 255–264. [Google Scholar]
41. Marn, M.; Berljak, J.; Koron, D. Influence of in vitro propagation on the economically important traits of strawberry cv. Marmolada. Acta Biol. Slov. 2003, 46, 41–45. [Google Scholar] [CrossRef]
42. Mahendra, R.; Chauhan, N.; Sharma, J.; Rana, K.; Bakshi, M. Ex-vitro establishment of tissue cultured plants in fruit crops—A review. Int. J. Curr. Microbiol. Appl. Sci. 2020, 9, 3321–3329. [Google Scholar] [CrossRef]
43. Suárez, E.; Alfayate, C.; Pérez-Francés, J.; Rodríguez-Pérez, J. Structural and ultrastructural differences between field, micropropagated and acclimated leaves and stems of two Leucospermum cultivars (Proteaceae). Plant Cell Tissue Organ Cult. 2019, 136, 15–27. [Google Scholar] [CrossRef]
44. Joshi, P.; Joshi, N.; Purohit, S. Stomatal characteristics during micropropagation of Wrightia tomentosa. Acta Hortic. 2010, 865, 187–191. [Google Scholar] [CrossRef]
45. Zhou, Y.; Guo, D.; Zhu, Z.; Qian, Q. Effects of in vitro rooting environments and irradiance on growth and photosynthesis of strawberry plantlets during acclimatization. Plant Cell Tissue Organ Cult. 2005, 81, 105–108. [Google Scholar] [CrossRef]
46. Baťková, P.; Pospíšilová, J.; Synková, H. Production of reactive oxygen species and development of antioxidative systems during in vitro growth and ex vitro transfer. Biol. Plant. 2008, 52, 413–422. [Google Scholar] [CrossRef]
47. Pospíšilová, J.; Synková, H.; Haisel, D.; Semorádová, Š. Acclimation of plantlets to ex vitro conditions: Effects of air humidity, irradiance, CO2 concentration and abscisic acid—A review. Acta Hortic. 2007, 748, 29–38. [Google Scholar] [CrossRef]
48. Sharma, N.; Kumar, N.; James, J.; Kalia, S.; Joshi, S. Strategies for successful acclimatization and hardening of in vitro regenerated plants: Challenges and innovations in micropropagation techniques. Plant Sci. Today 2023, 10 (Suppl. S2), 90–97. [Google Scholar] [CrossRef]
49. Seymour, Z.; Mercedes, J.; Fang, J. Effect of heat acclimation on thermotolerance of in vitro strawberry plantlets. Folia Hortic. 2024, 36, 135–147. [Google Scholar] [CrossRef]
50. Mohammed, M.; Munir, M.; Ghazzawy, H. Design and evaluation of a smart ex vitro acclimatization system for tissue culture plantlets. Agronomy 2022, 13, 78. [Google Scholar] [CrossRef]
51. Ghashghaie, J.; Brenckmann, F.; Saugier, B. Water relations and growth of rose plants cultured in vitro under various relative humidities. Plant Cell Tissue Organ Cult. 1992, 30, 51–57. [Google Scholar] [CrossRef]
52. Rezaei Nejad, A.; van Meeteren, U. Dynamics of adaptation of stomatal behavior to moderate or high relative air humidity in Tradescantia virginiana. J. Exp. Bot. 2008, 59, 289–301. [Google Scholar] [CrossRef]
53. Noga, A.; Warchoł, M.; Czyczyło-Mysza, I.; Marcińska, I.; Dziurka, K.; Warzecha, T.; Skrzypek, E. Chlorophyll a fluorescence parameters in the evaluation of oat DH lines yield components. Cereal Res. Commun. 2017, 45, 665–674. [Google Scholar] [CrossRef]
54. Orekhov, D.I.; Yakovleva, O.; Goryachev, S.; Protopopov, F.; Alekseev, A. The use of parameters of chlorophyll a fluorescence induction to evaluate the state of plants under anthropogenic load. Biophysics 2015, 60, 263–268. [Google Scholar] [CrossRef]
55. Kitajima, K.; Hogan, K. Increases of chlorophyll a/b ratios during acclimation of tropical woody seedlings to nitrogen limitation and high light. Plant Cell Environ. 2003, 26, 857–865. [Google Scholar] [CrossRef]
56. Zait, Y.; Shemer, O.E.; Cochavi, A. Dynamic responses of chlorophyll fluorescence parameters to drought across diverse plant families. Physiol. Plant. 2024, 176, e14527. [Google Scholar] [CrossRef]
57. Shekhawat, M.S.; Manokari, M. Micromorphological and anatomical evaluation of in vitro and field transferred plants of Coccinia indica. Agric. Res. 2018, 7, 135–144. [Google Scholar] [CrossRef]
58. Vahdati, K.; Asayesh, Z.M.; Aliniaeifard, S.; Leslie, C. Improvement of ex vitro desiccation through elevation of CO2 concentration in the atmosphere of culture vessels during in vitro growth. HortScience 2017, 52, 1006–1012. [Google Scholar] [CrossRef]
59. Zobayer, N.; Prodham, S.H.; Sikdar, S.U.; Azim, F.; Ashrafuzzaman, M. Study of shoot multiplication of strawberry (Fragaria ananassa). Int. J. Agric. Res. Innov. Technol. 2011, 1, 69–72. [Google Scholar] [CrossRef]
60. Sood, N.; Gupta, P.K.; Srivastava, R.K.; Gosal, S.S. Comparative studies on field performance of micropropagated and conventionally propagated sugarcane plants. Plant Tissue Cult. Biotechnol. 2006, 16, 25–29. [Google Scholar] [CrossRef]
61. Gupta, N.; Jain, V.; Joseph, M.; Devi, S. A review on micropropagation culture method. Asian J. Pharm. Res. Dev. 2020, 8, 86–93. [Google Scholar] [CrossRef]
62. Irshad, A.; Ahmad, H.; Muhammad, I.; Khan, S.U.; Raza, S. The role of water stress and soil texture on plant roots anatomy, architecture, and senescence. Front. Plant Sci. 2024, 15, 1490001. [Google Scholar] [CrossRef]
63. Kim, Y.X.; Stumpf, B.; Sung, J.; Lee, S.J. The Relationship between Turgor Pressure Change and Cell Hydraulics of Midrib Parenchyma Cells in the Leaves of Zea mays. Cells 2018, 7, 180. [Google Scholar] [CrossRef]
64. Jain, M.; Kataria, S.; Hirve, M.; Prajapati, R. Water deficit stress effects and responses in maize. In Plant Abiotic Stress Tolerance; Hasanuzzaman, M., Hakeem, K., Nahar, K., Alharby, H., Eds.; Springer: Cham, Switzerland, 2019; pp. 129–151. [Google Scholar]
65. Demidchik, V.; Tyutereva, E.V.; Voitsekhovskaja, O.V. The role of ion disequilibrium in induction of root cell death and autophagy by environmental stresses. Funct. Plant Biol. 2017, 45, 28–46. [Google Scholar] [CrossRef]
66. Alekseenko, V.A.; Shvydkaya, N.V.; Alekseenko, A.V.; Machevariani, M.M.; Bech, J.; Pashkevich, M.A.; Puzanov, A.V.; Nastavkin, A.V.; Roca, N. Element Accumulation Patterns of Native Plant Species under the Natural Geochemical Stress. Plants 2021, 10, 33. [Google Scholar] [CrossRef]
67. Li, S.; Yang, L.; Huang, X.; Zou, Z.; Zhang, M.; Guo, W.; Addo-Danso, S.D.; Zhou, L. Mineral Nutrient Uptake, Accumulation, and Distribution in Cunninghamia lanceolata in Response to Drought Stress. Plants 2023, 12, 2140. [Google Scholar] [CrossRef]
68. Sinclar, T.R.; Ludlow, M.M. Influence of soil water supply on the plant water balance of four tropical legumes. Funct. Plant Biol. 1986, 13, 329–341. [Google Scholar] [CrossRef]
69. Tezara, W.; Mitchell, V.; Driscoll, S.P.; Lawlor, D.W. Effects of water deficit and its interaction with CO2 supply on the biochemistry and physiology of photosynthesis in sunflower. J. Exp. Bot. 2002, 53, 1781–1791. [Google Scholar] [CrossRef] [PubMed]
70. Pinar, H.; Kılınç, N.; Uzun, A. Effect of different temperature and moisture on development of in vitro derived banana plantlets. Curr. Trends Nat. Sci. 2020, 9, 216–221. [Google Scholar] [CrossRef]
71. Farooqi, Z.; Ayub, M.; Rehman, M.U.; Sohail, M.; Usman, M.; Khalid, H.; Naz, K. Regulation of drought stress in plants. In Plant Life Under Changing Environment: Responses and Management; Academic Press: Cambridge, MA, USA, 2020; pp. 77–104. [Google Scholar] [CrossRef]
72. Li, X.; Zhang, W.; Niu, D.; Liu, X. Effects of abiotic stress on chlorophyll metabolism. Plant Sci. 2024, 342, 112030. [Google Scholar] [CrossRef]
73. Fu, J.; Krishna Jagadish, S.V.; Bowden, R.L. Effects of post-flowering heat stress on chlorophyll content and yield components of a spring wheat diversity panel. Crop Sci. 2022, 62, 1926–1936. [Google Scholar] [CrossRef]
74. Merzlyak, M.N.; Kovrizhnikh, V.A.; Timofeev, K.N. Superoxide mediated chlorophyll allomerization in a dimethyl sulphoxide-water mixture. Free Radic. Res. Commun. 1991, 15, 197–201. [Google Scholar] [CrossRef]
75. Borisova-Mubarakshina, M.M.; Naydov, I.A.; Ivanov, B.N. Oxidation of the plastoquinone pool in chloroplast thylakoid membranes by superoxide anion radicals. FEBS Lett. 2018, 592, 3221–3228. [Google Scholar] [CrossRef]
76. Lupínková, L.; Komenda, J. Oxidative Modifications of the Photosystem II D1 Protein by Reactive Oxygen Species: From Isolated Protein to Cyanobacterial Cells. Photochem. Photobiol. 2004, 79, 152–162. [Google Scholar] [CrossRef]
77. Knapp, M.; Jo, M.; Henthorn, C.L.; Brimberry, M.; Gnann, A.D.; Dowling, D.P.; Bridwell-Rabb, J. Chlorophyllase from Arabidopsis thaliana Reveals an Emerging Model for Controlling Chlorophyll Hydrolysis. ACS Bio Med Chem Au 2024, 4, 353–370. [Google Scholar] [CrossRef]
78. Ferreira, M.D.S.; Rocha, A.D.J.; Nascimento, F.D.S.; Oliveira, W.D.D.S.; Soares, J.M.D.S.; Rebouças, T.A.; Morais Lino, L.S.; Haddad, F.; Ferreira, C.F.; Santos-Serejo, J.A.D.; et al. The Role of Somaclonal Variation in Plant Genetic Improvement: A Systematic Review. Agronomy 2023, 13, 730. [Google Scholar] [CrossRef]
Rokosa M, Mikiciuk M, Kulpa D, Ptak P. A Comparative Study on Drought Stress Response In Vitro and In Vivo Propagated Fragaria vesca Plants. Agriculture. 2025; 15(2):145. https://doi.org/10.3390/agriculture15020145
Перевод статьи «A Comparative Study on Drought Stress Response In Vitro and In Vivo PropagatedFragaria vescaPlants» авторов Rokosa M, Mikiciuk M, Kulpa D, Ptak P., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
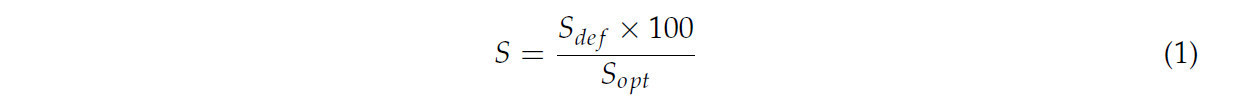
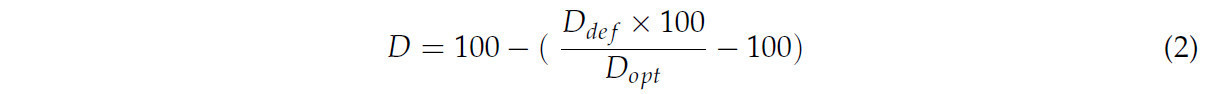































































































Комментарии (0)