Синтетический гидрогель ослабляет эффект Serratia plymuthica на Brassica napus L. в условиях засухи
Прогрессирующее изменение климата увеличивает частоту засух, что серьезно влияет на рост и урожайность сельскохозяйственных культур. Необходимы новые экологически безопасные альтернативы химическим средствам защиты и удобрениям для снижения загрязнения и улучшения здоровья растений. В данном исследовании оценивались эффекты ризобактерий, стимулирующих рост растений (PGPR), и гидрогеля (полиакрилата калия) на рапс (Brassica napus L.) в условиях засухи.
Аннотация
По результатам экспериментов in vitro и в горшках, Serratia plymuthica была выбрана из шести кандидатов PGPR на основе ее способности увеличивать биомассу растений, длину побега и количество междоузлий. Тесты на жизнеспособность семян, накопление активных форм кислорода и активность СОД показали отсутствие негативного влияния гидрогеля на семена рапса. Более того, гидрогель не проявлял токсичности по отношению к тестируемым бактериальным штаммам.
Полевые испытания в период засухи показали, что инокуляция S. plymuthica значительно увеличила количество стручков (на 16,48%) и урожайность (на 19,93%) по сравнению с контрольной группой. Растения, выращенные из инокулированных семян, также были выше (на 3,28%) и имели больше боковых побегов (на 39,99%). Также анализировались всхожесть семян, количество междоузлий, масса тысячи семян и влажность семян.
Гидрогель, внесенный в почву, замедлял появление всходов и ослаблял стимулирующий рост эффект S. plymuthica, что приводило к снижению урожайности. По сравнению с растениями, инокулированными только S. plymuthica, у растений, обработанных только гидрогелем, и у растений, обработанных и гидрогелем, и бактерией, наблюдалось снижение урожайности на 23,61% и 27,79% соответственно.
Наши результаты указывают на то, что S. plymuthica обладает высоким потенциалом для использования в коммерческом выращивании рапса, особенно в качестве компонента, добавляемого в покрытие семян.
1. Введение
В последнем отчете МГЭИК (Межправительственной группы экспертов по изменению климата) подчеркивается, что изменение климата, как ожидается, значительно увеличит частоту, продолжительность и интенсивность засух во многих регионах. В нем подчеркивается, что повышение температуры, изменение характера осадков и увеличение скорости испарения способствуют более суровым засушливым условиям [ 1 ]. Засуха влияет на различные важные процессы в растениях, включая дыхание [ 2 ], фотосинтез [ 3 ], устьичную проводимость и движение [ 4 ], и нарушает эффективность использования воды растениями [ 5 ] и усвоение питательных веществ [ 6 , 7 ]. Таким образом, засуха влияет на рост и развитие растений, существенно влияя на производительность растений и, следовательно, приводя к потере урожая [ 3 ]. Оценочная потеря урожая колеблется от 30 до 90% в зависимости от вида сельскохозяйственных культур и интенсивности засухи [ 8 ]. Кроме того, с прогнозируемым ростом населения мира засуха представляет собой значительную угрозу продовольственной безопасности, влияя как на количество, так и на качество продуктов питания [ 9 ].
Рапс ( Brassica napus L. var. napus ) является второй по распространенности масличной культурой в мире, ее производство в 2020/2021 г. достигло 73,6% Мт [ 10 ]. Рост производства канолы связан с ее благоприятным составом жирных кислот, хорошо сбалансированным содержанием аминокислот и многочисленными применениями в промышленности, например, в производстве биотоплива, красок, полиуретанов, клеев и покрытий [ 11 ]. Рапс чувствителен к нехватке воды на всех стадиях вегетативного роста, развития семян и созревания [ 12 ], причем прорастание и раннее развитие сеянцев являются наиболее чувствительными стадиями, что приводит к снижению биомассы и выживаемости [ 13 ]. Дефицит воды во время цветения и созревания семян может привести к изменению состава содержимого семян, т. е. увеличению содержания белка с одновременным снижением фенолов и жирных кислот, а также общему уменьшению количества стручков [ 12 ].
Одним из предлагаемых решений для улучшения здоровья растений и урожайности в сельском хозяйстве является предпосевная обработка семян [ 14 , 15 ] и/или использование микроорганизмов, стимулирующих рост растений (PGPM) [ 16 , 17 , 18 ]. Биоинокулянты, состоящие из живых или спящих организмов, положительно влияют на рост и развитие растений за счет улучшения параметров прорастания [ 19 , 20 ], увеличения удлинения побега и корня [ 21 , 22 , 23 ], увеличения производства биомассы и урожайности [ 24 , 25 ], ускорения цветения [ 26 , 27 ] и повышения эффективности фотосинтеза [ 4 , 28 ]. Кроме того, PGPM может смягчать стрессовые эффекты и повышать стрессоустойчивость растений к биотическим [ 29 , 30 ] и абиотическим стрессам, включая загрязнение тяжелыми металлами [ 31 , 32 ], засоление [ 20 , 33 ] и засуху [ 4 , 25 , 34 ]. Инокуляция пшеницы ( Triticum aestivum L.) с помощью Burkholderia phytofirmans PsJN смягчила эффект стресса засухи, повысила эффективность фотосинтеза и увеличила урожайность на 18–21%. Более того, эта процедура улучшила эффективность использования воды и ионный баланс и увеличила содержание азота, фосфора, калия и белка в зерне [ 4 ]. В эксперименте в теплице инокуляция семян кукурузы ( Zea mays L.) и ризосферы кукурузы с помощью Azospirillum sp. В результате наблюдалось увеличение содержания свободных аминокислот (54% и 45% соответственно) и растворимого сахара (63% и 31% соответственно) в условиях засухи по сравнению с контрольными растениями (неинокулированными) [ 34 ]. Это подчеркивает значительное влияние метода инокуляции на результат. В полевых условиях семена B. napus L., инокулированные Trichoderma viride VII, показали увеличение урожайности на 16,7% во время засухи по сравнению с неинокулированными растениями. Кроме того, T. viride VII положительно повлиял на высоту и ветвление растений, количество стручков и вес тысячи семян (TSW) [ 25]. Недавний метаанализ PGPR (ризобактерий, стимулирующих рост растений) показал, что инокуляция ризобактерий хорошо поливаемых растений увеличивает биомассу корней и побегов на 35% и 28% соответственно, при среднем увеличении урожайности на 19%. Интересно, что эти цифры выше для растений в условиях засухи: биомасса корней и побегов увеличивается на 43% и 45% соответственно, а урожайность увеличивается на 40% [ 35 ]. Аналогичное наблюдение было отмечено Чжао и соавторами [ 36 ], где авторы показали, что PGPR более эффективно увеличивает биомассу растений, улучшает скорость фотосинтеза и более эффективно смягчает окислительный стресс у растений, подверженных дефициту воды, чем у контрольных растений [ 36 ].
Другой предлагаемый подход к смягчению последствий засухи на пахотных землях заключается в добавлении в почву гидрогеля: гидрофильных гелей, которые могут поглощать воду через водородные связи с гидрофильными функциональными группами геля (-OH, -COOH и -NH 2 ). Полимеры, которые могут служить основой гидрогеля, включают коллаген, желатин, альгинат и агарозу [ 37 ]. Гидрогели обладают уникальной способностью удерживать большие объемы воды в полимерной сети и, кроме того, их пористая структура замедляет испарение [ 4 ]. Сельскохозяйственные гидрогели могут увеличивать водоудерживающую способность почвы [ 37 , 38 ] и, таким образом, способствовать экономии воды, улучшать влажность почвы, предотвращать вымывание питательных веществ из удобрений и уменьшать эрозию почвы [ 37 ]. Чжу и др. [ 39 ] продемонстрировали, что нанесение гидрогеля, полученного из тофу и соевого молока, на почву увеличило урожайность листовых овощей более чем на 60% и 35% у чой сум ( Brassica rapa var. parachinensis (LH Bailey) Hanelt) и пак-чой ( Brassica rapa subsp. chinensis (L.) Hanelt) соответственно по сравнению с контрольными растениями, выращенными без гидрогеля. Кроме того, эти растения показали большую площадь листьев и улучшенную эффективность использования воды в полевых условиях. Интересно, что эффекты добавления гидрогеля в значительной степени зависят от типа почвы, на которой они используются. Маковска и др. [ 40 ] показали, что нанесение гидрогеля на чернозем и песчаный грунт увеличило содержание воды в клубнике ( Fragaria × xananassa Duchesne) в полевых условиях, при этом значения для чернозема были в два раза выше, чем для песчаного грунта. Более того, применение гидрогеля в концентрации 3 г/дм³ улучшило устьичную проводимость и эффективность фотосинтеза. Для сравнения, применение гидрогеля в более высокой концентрации (6 г/дм³ ) по-видимому, ослабляло его положительное влияние на исследуемые параметры. Тем не менее, результаты всё ещё были выше, чем у контрольных растений, не обработанных гидрогелем.
Хотя в последнее время наблюдается резкий рост числа исследований по использованию PGPR и гидрогеля для повышения урожайности сельскохозяйственных культур в различных условиях, существует явный пробел в данных о том, как PGPR и гидрогель действуют в полевых условиях. Целью данного исследования было найти наилучшую комбинацию PGPM–гидрогеля, которая защитила бы B. napus от засухи и улучшила бы урожайность рапса в полевом эксперименте. Мы предположили, что одновременное применение гидрогеля и ризобактерий при выращивании рапса будет синергетически влиять на стимуляцию роста и повышение урожайности. Сначала мы оценили ростостимулирующую и смягчающую засуховой стресс способность шести штаммов бактерий в эксперименте в горшке и выбрали S. plymuthica для дальнейшего тестирования в полевом эксперименте. Мы также проверили действие гидрогеля на бактерии и потенциальное токсическое действие на семена рапса.
2. Материалы и методы
2.1 Биологический материал
Семена рапса весеннего ( Brassica napus L.), сорт Lumen, были приобретены у Rapool (Вонгровец, Польша). Если не указано иное, поверхность семян была стерилизована в соответствии с методом, представленным Mierek-Adamska et al. [ 41 ] в смеси 96% этанола и 30% H 2 O 2 (1:1, об. : об. ) в течение 5 минут, а затем промыта не менее 10 раз стерильной водой. Поверхностно-стерилизованные семена были помещены на стерильные чашки Петри, содержащие диски из фильтровальной бумаги, смоченные 3 мл стерильной воды. Чашки были перенесены в вегетационную камеру при температуре 25 °C на 12/12-часовой световой день в течение трех дней.
Бактерии, использованные в данном исследовании, получены из коллекции кафедры генетики Университета Николая Коперника (NCU) в Торуни: Bacillus sp., Bacillus megaterium , Bacillus polymyxa и Paenibacillus peoriae , а также из коллекции кафедры микробиологии (NCU, Торунь): Serratia plymuthica и Serratia liquefaciens . Штаммы бактерий хранились при температуре −80 °C в глицериновом растворе (80%).
2.2 Оценка роста бактерий в присутствии гидрогеля
Бактериальные штаммы из глицериновых стоков высевали на плотную среду R2A. Чашки Петри с инокулированными бактериями инкубировали при 25 °C в течение 2–5 дней в зависимости от скорости роста бактериального штамма. Затем жидкие культуры получали путем инокуляции 20 мл жидкой среды R2A, которые поддерживали в течение 2–5 дней при 25 °C на лабораторном шейкере с термостатом. Затем измеряли оптическую плотность бактериальных культур и разбавляли до оптической плотности OD600 = 0,2. Для проверки влияния гидрогеля на бактерии к 5 мл среды R2A добавляли 10 мг гидрогеля (полиакрилат калия (AgroManager, Осельско, Польша)) и 100 мкл суспензии одного бактериального штамма. Пробирки инкубировали при 25 °C с использованием качающейся платформы в течение 5 дней. Контролем служили жидкие бактериальные культуры без гидрогеля. Жидкие культуры отдельных штаммов бактерий центрифугировали в течение 10 минут при 12 000 об/мин на миницентрифуге (BioRad, Hercules, CA, США). Надосадочную жидкость аккуратно удаляли, а бактериальный осадок взвешивали на лабораторных весах для оценки свежей биомассы, затем лиофилизировали с помощью системы CentriVap Cold Trap (Labconco, Kansas City, MO, США) и взвешивали для определения сухой биомассы. Для каждого штамма бактерий проводили три повтора.
2.3. Эксперимент с горшком
Семена рапса помещали в горшки (по 5 семян в горшок) с 1 г гидрогеля на 1 л почвы (500 мл песка, смешанного с 500 мл садовой земли). Стерильные семена инокулировали (замачивали в бактериальной суспензии в dH2O при 5,0 × 107 КОЕ /см3 ) перед посевом или нет (контроль; замачивали в стерильной dH2O ) в соответствии с протоколом, описанным ранее [ 33 ]. Растения поливали ad libitum в течение пяти недель. Затем полив прекращали, чтобы вызвать физиологический стресс засухи. Этот стресс продолжался до появления симптомов засухи (высыхание листьев и отсутствие тургора), которые были видны после двух недель лишения воды. В это время собирали надземную часть растений и измеряли высоту растений, количество междоузлий и их сухую биомассу. Эксперимент проводили в 3 биологических повторностях.
2.4. Локализация ROS
Перекись водорода локализовалась согласно Дауди и соавторам [ 42 ]. Инфильтрацию сеянцев проводили в темноте при встряхивании в течение 3 ч в 0,1% растворе 3,3′-диаминобензидина (ДАБ) в 10 мМ фосфатном буфере, содержащем 0,05% ТВИН-20. После инфильтрации образцы дважды промывали дистиллированной водой и обесцвечивали в смеси этанола, глицерина и уксусной кислоты в соотношении 3:1:1 (об . / об. / об. ). Для локализации радикала O 2 - использовали метод окрашивания нитросиним тетразолий хлоридом (НБТ) [ 30 ]. Инфильтрацию сеянцев канолы проводили в темноте в течение 2 ч с 0,1% нитросиним тетразолий хлоридом (НБТ) и 10 мМ азидом натрия в 50 мМ фосфатном буфере (рН 7,5). После инфильтрации образцы дважды промывали дистиллированной водой и обесцвечивали в смеси этанола, глицерина и уксусной кислоты в соотношении 3:1:1 ( об. / об. / об. ). Отрицательные контроли инкубировали с растворами, не содержащими DAB или NBT. Эксперимент проводили трижды.
Числовые данные для полуколичественного анализа были получены с использованием программного обеспечения ICY ( https://icy.bioimageanalysis.org , дата обращения: 15 ноября 2024 г.) и выражены в виде суммы общей интенсивности пикселей красного (DAB) или синего цвета (NBT), деленной на сумму интенсивностей красных, синих и зеленых пикселей.
2.5. Активность СОД
Активность супероксиддисмутазы (СОД) измеряли спектрофотометрическим методом [ 31 ]. Для выделения общих белков 50 мг растительной ткани (3-дневные проростки) измельчали в жидком азоте и суспендировали в 1 мл холодного буфера для выделения белка (100 мМ трицина, 3 мМ MgSO 3 , 3 мМ EGTA, 1 мМ DTT, pH 7,5 доводили с помощью 1 М Трис). Затем инкубировали на льду в течение 15 мин и центрифугировали при 13 000 × g в течение 20 мин при 4 °C. Концентрацию белка в полученном экстракте измеряли с помощью набора для анализа белка Pierce™ Coomassie (Bradford) и многодетекторного микропланшетного ридера (модель Synergy HT; BioTek, Winooski, VT, США).
Для измерений активности супероксиддисмутазы (СОД) рабочий раствор состоял из смеси 0,1 М фосфатного буфера pH 7,5, 2,4 мкМ рибофлавина, 840 мкМ НБТ, 150 мМ метионина и 12 мМ Na2ЭДТА в соотношении 8:1:1:1:1 ( v / v / v / v / v ). Были подготовлены два микротитрационных планшета с 5 мкл белкового экстракта, добавленными в трех повторах для технического и двух биологических репликатов. Затем в каждую лунку добавляли 150 мкл рабочего раствора. Один планшет держали в темноте в качестве бланка, в то время как другой подвергали воздействию теплого белого светодиодного света при 400 мкЭ в течение 15 мин. Поглощение при 560 нм измеряли с помощью многодетекторного микропланшетного ридера (модель Synergy HT; BioTek, Winooski, VT, США).
2.6. Тест на тетразолий (ТЗ)
Семена инкубировали в 1%-ном растворе хлорида 2,3,5-трифенилтетразолия (ТТХ) в буфере PBS (pH 7,4) в течение 24 часов при температуре 30 °C в темноте. После инкубации образцы трижды промывали дистиллированной водой и обесцвечивали в смеси молочной кислоты, фенола, глицерина и воды в соотношении 1:1:2:1 (об. / об. /об. / об . ) . Для визуализации зародышей семенную оболочку удаляли. Отрицательным контролем служили семена, прокипяченные в течение 1 часа при 95 °C.
Числовые данные для полуколичественного анализа были получены с использованием программного обеспечения ICY и выражены как общая интенсивность красных пикселей, деленная на сумму интенсивностей красного, синего и зеленого.
2.7. Полевой эксперимент
Полевой эксперимент был проведен, как описано в нашем предыдущем исследовании [ 25 ], в Хшанстово (53°09′52″ с. ш. 17°35′02″ в. д.) на участке с коричневой почвой средней глинистости и pH 6,4. Эксперимент был заложен 7 апреля 2022 года, а урожай был собран 12 августа 2022 года. Содержание биодоступных минералов было проанализировано на химико-сельскохозяйственной районной станции в Быдгоще, Польша, и составило: K — 183 мг/кг −1 , Mg — 47 мг/кг −1 и P — 95 мг/кг −1 . Нестерильные семена рапса опрыскивали стерильной H2O ( контроль) или бактериальной суспензией в dH2O при концентрации 5,0 × 107 КОЕ /см3 ( S. plymuthica ); семена постоянно перемешивали для равномерного распределения инокулята, затем высушивали перед посевом. Размер опытного поля составлял 16,5 м2 . Перед посевом гидрогель вносили в почву (на глубину 4 см) сеялкой, согласно инструкции производителя. Гидрогель вносили полосами шириной 0,5 м, в которые механически (на глубину 2 см; плотность 100 растений на м2) сеялкой высевали инокулированные и неинокулированные семена . Опытные участки были рандомизированными, и эксперимент проводили одновременно в трех повторностях на разных делянках рядом друг с другом. Удобрение проводилось, как описано в предыдущей статье [ 25 ], с половинной дозой перед посевом, а другая половина использовалась впоследствии в качестве подкормки, с общими дозами чистых ингредиентов 30 кг/га NH4NO3; 48 кг / га P2O5 ; 34 кг/га (NH4 ) 2SO4 ; и 80 кг / га K2O . Для защиты растений от стручкового вредителя использовались инсектициды Decis Mega 50EW (Bayer; Леверкузен, Германия) и Boravi 50 WG (Gowan; Юма , Аризона , США). После уборки урожая на 10 случайно выбранных растениях с каждого из трех участков оценивались следующие параметры рапса: высота, количество ветвей и стручков. Кроме того, определялась урожайность семян при 9% влажности семян и измерялся вес тысячи семян (TSW). Всхожесть всходов оценивалась по шкале BBCH.
Метеостанция, установленная на полевом участке, регистрировала количество осадков и температуру. Суточное количество осадков измерялось с помощью дождемера Хеллмана (ёмкостью 200 см² ; Herter, Польша), установленного на высоте 1 м над поверхностью земли. Среднесуточная температура рассчитывалась на основе показаний в 8:00, 14:00 и 20:00 по формуле:
Средняя суточная температура, TD = ( T min + T max + T 1 + T 2 )/4
где T min — самая низкая зарегистрированная температура, T max — самая высокая зарегистрированная температура, T 1 — температура, измеренная в 8:00, а T 2 — температура, измеренная в 20:00.
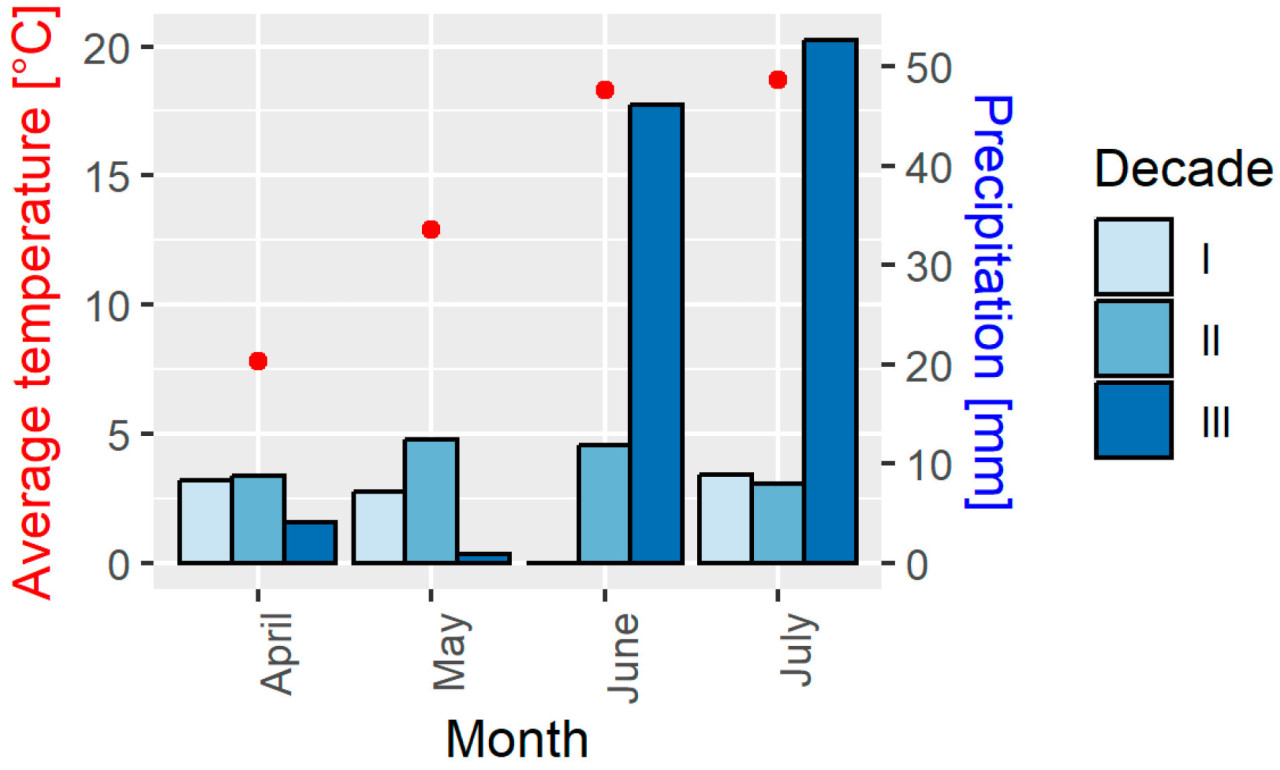
В течение вегетационного периода наблюдались неблагоприятные климатические условия: заморозки на почве в апреле (до −4,5 °C) и мае (до −6,2 °C), а также высокие температуры воздуха (в июне до 34,6 °C и в июле до 35,7 °C). Количество осадков и средняя температура за вегетационный период представлены на рисунке 1 .
Рисунок 1. Количество осадков и средние температуры в период вегетации рапса. Декада обозначает 10 последовательных дней в течение месяца.
2.8 Статистический анализ
Данные были проанализированы с помощью однофакторного дисперсионного анализа (ANOVA) с апостериорным тестом Тьюки в R [ 43 ] с использованием следующих пакетов: «ggplot2», «dplyr», «tidyr», «FSA», «multcomp», «multcompView» и «plyr».
3. Результаты
3.1. Рост бактерий в присутствии гидрогеля
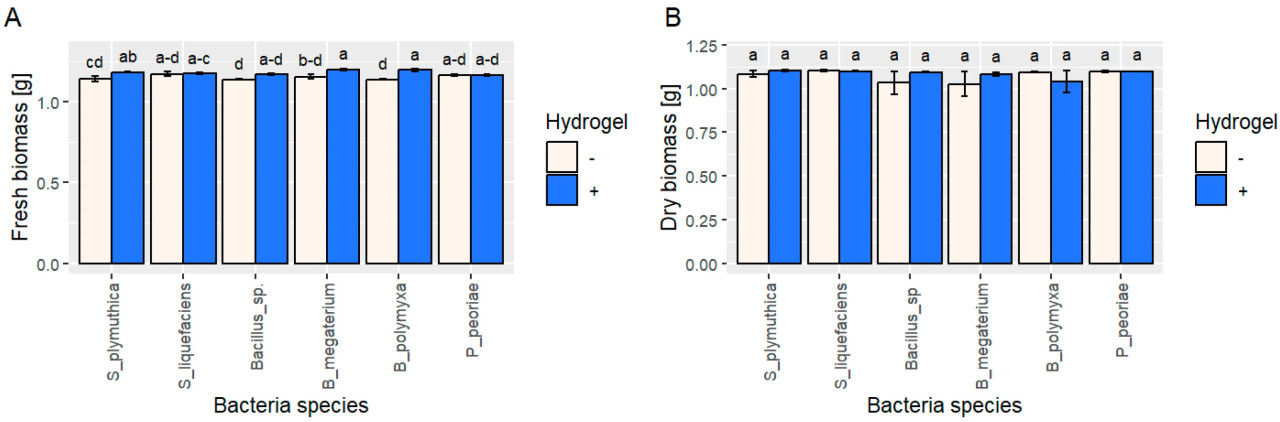
Свежая биомасса S. plymuthica была более чем на 3,7% выше в присутствии гидрогеля, чем в контрольных условиях (без гидрогеля). Однако мы не наблюдали подобного значительного улучшения сухой биомассы ( рисунок 2 ). Рост B. megaterium и B. polymyxa продемонстрировал схожую с S. plymuthica тенденцию , со значительным увеличением свежей биомассы на 3,83% и 5,02% соответственно в присутствии гидрогеля. Рост S. liquefaciens , P. perioae и Bacillus sp. не показал существенных изменений в этих условиях.
Рисунок 2. ( A ) Свежая и ( B ) сухая биомасса штаммов бактерий ( B. megaterium , B. polymyxa , Bacillus sp., P. peoriae , S. liquefaciens и S. plymuthica ), выращенных в жидкой среде R2A с гидрогелем (синие столбцы) или без него (контроль, белые столбцы). Столбцы представляют средние значения со стандартной ошибкой. Статистический анализ проводился с использованием однофакторного дисперсионного анализа (ANOVA) с последующим апостериорным тестом Тьюки. Разные буквы обозначают статистически значимые различия ( p > 0,05).
3.2 Влияние PGPR и гидрогелей на рост рапса
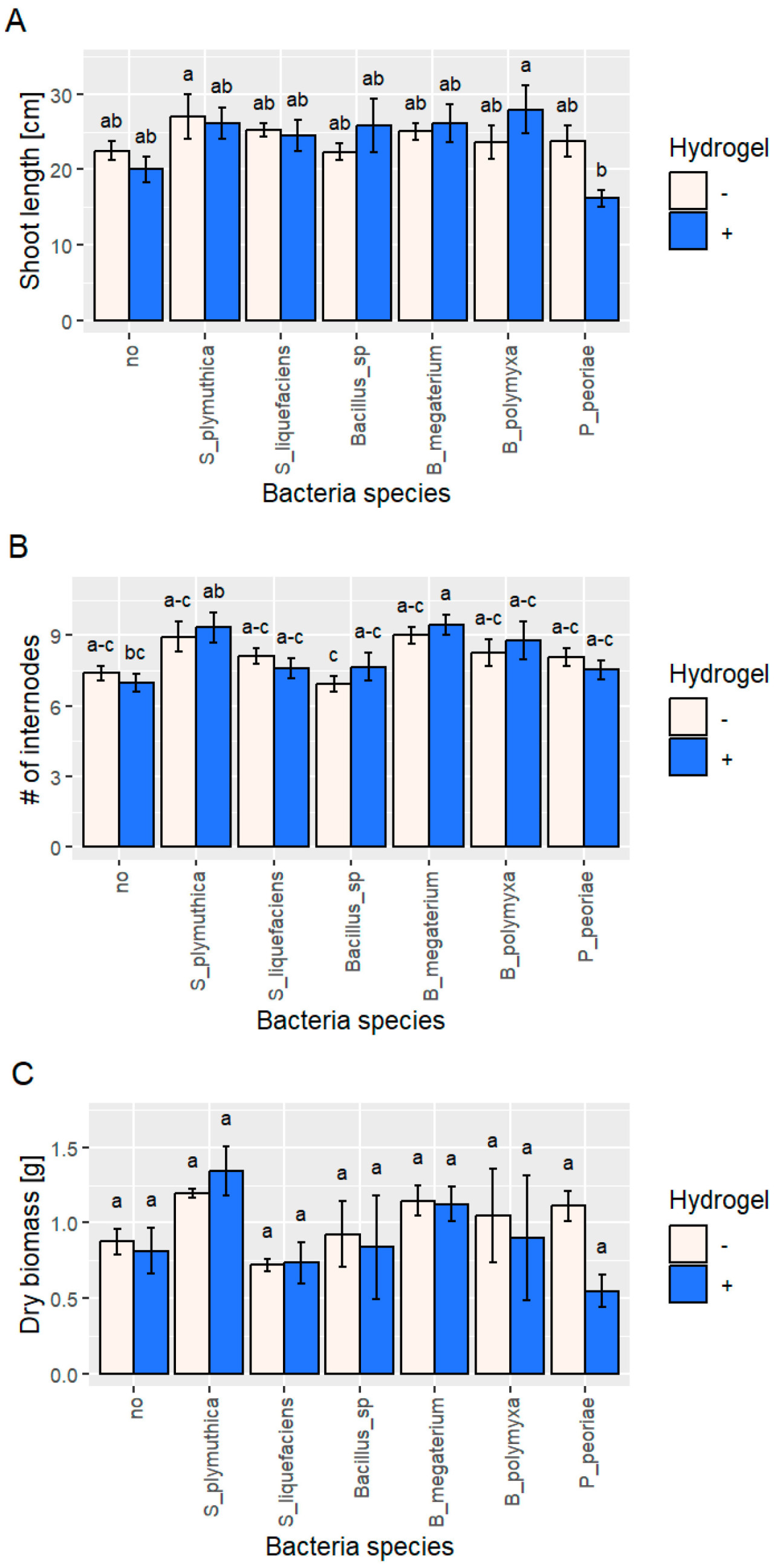
Применение гидрогеля, по-видимому, ослабило ростостимулирующую активность некоторых штаммов ( S. plymuthica , S. liquefaciens и P. peoriae ) и усилило этот эффект в случае бактерий, принадлежащих к роду Bacillus ( Bacillus sp., B. megaterium и B. polymyxa ) ( рисунок 3 ). Самые высокие результаты по длине побегов были отмечены у B. polymyxa с добавлением гидрогеля и S. plymuthica без гидрогеля, с увеличением на 24% и 20% соответственно по сравнению с контролем и примерно на 34–39% по сравнению с неинокулированными растениями, выращенными в присутствии гидрогеля. Самые низкие баллы были отмечены для P. peoriae с гидрогелем, где общая высота была ниже более чем на 38% по сравнению с контролем и на 23% по сравнению с гидрогелем (неинокулированные растения). Кроме того, внесение гидрогеля в почву горшков с неинокулированными растениями уменьшило высоту растений более чем на 12% по сравнению с контрольными растениями. Наибольшее количество междоузлий было отмечено у растений, инокулированных S. plymuthica и B. megaterium , как с добавлением гидрогеля, так и без него, с 2–3 междоузлиями больше по сравнению с контрольными растениями ( Рисунок 3 ). Сухая биомасса была самой высокой у растений, инокулированных S. plymuthica, независимо от добавления гидрогеля, с увеличением в диапазоне 36–54% по сравнению с контрольными растениями (неинокулированные, без гидрогеля) и 46–65% по сравнению с неинокулированными растениями, выращенными в присутствии гидрогеля ( Рисунок 3 ).
Рисунок 3. Биометрические параметры B. napus , культивируемого в отсутствие бактериальных штаммов в условиях эксперимента в горшках с гидрогелем (синие столбцы) или без него (контроль, белые столбцы). ( A ) длина побега рапса; ( B ) количество междоузлий рапса; и ( C ) сухая биомасса рапса. Столбцы представляют собой средние значения (n = 15 для длины побега и количества междоузлий и n = 3 для сухой биомассы) со стандартной ошибкой. Статистический анализ был выполнен с использованием однофакторного дисперсионного анализа (ANOVA) с последующим апостериорным тестом Тьюки. Разные буквы обозначают статистически значимые различия ( p > 0,05).
3.3. Антиоксидантный баланс
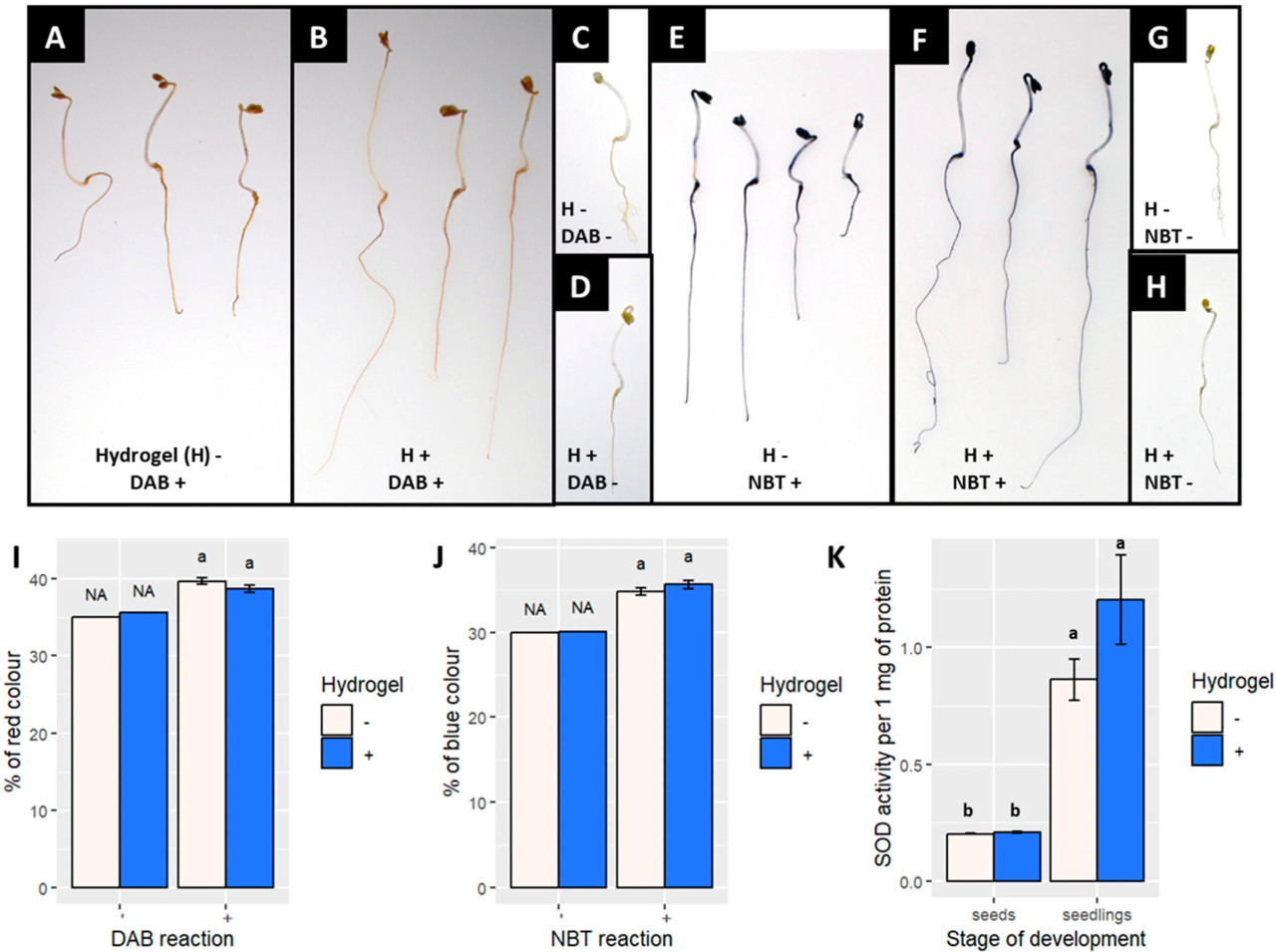
Проростки рапса , выращенные в присутствии гидрогеля, не демонстрировали повышенного накопления активных форм кислорода: H₂O₂ ( рис . 4 A–D,I) или O₂− ( рис . 4 E–H,J). Аналогичным образом, семена и проростки с гидрогелем и без него не показали различий в активности супероксиддисмутазы (СОД) ( рис. 4 K). Эти результаты свидетельствуют о том, что гидрогель не вызывает стресса у проростков рапса.
Рисунок 4. Образование и поглощение активных форм кислорода в сеянцах рапса в контрольных условиях (H − ) и при обработке гидрогелем (H+). ( A – D ) Окрашивание DAB, где коричневый цвет указывает на накопление H 2 O 2. ( E – H ) Окрашивание NBT, где темно-синий цвет указывает на накопление O 2 − . ( A , E ) контрольные растения; ( B , F ) растения, растущие в гидрогеле; и ( C , D , G , H ) отрицательные контроли для процедур окрашивания. Столбчатые диаграммы ( I , J ) результаты полуколичественного измерения накопления H 2 O 2 и O 2 − . ( K ) активность СОД в семенах и сеянцах. Столбцы представляют средние значения (n = 15 для длины побега и количества междоузлий и n = 3 для сухой биомассы) со стандартной ошибкой. Статистический анализ был выполнен с использованием однофакторного дисперсионного анализа (ANOVA) с последующим апостериорным тестом Тьюки. Разные буквы указывают на статистически значимые различия ( p > 0,05).
3.4 Жизнеспособность семян
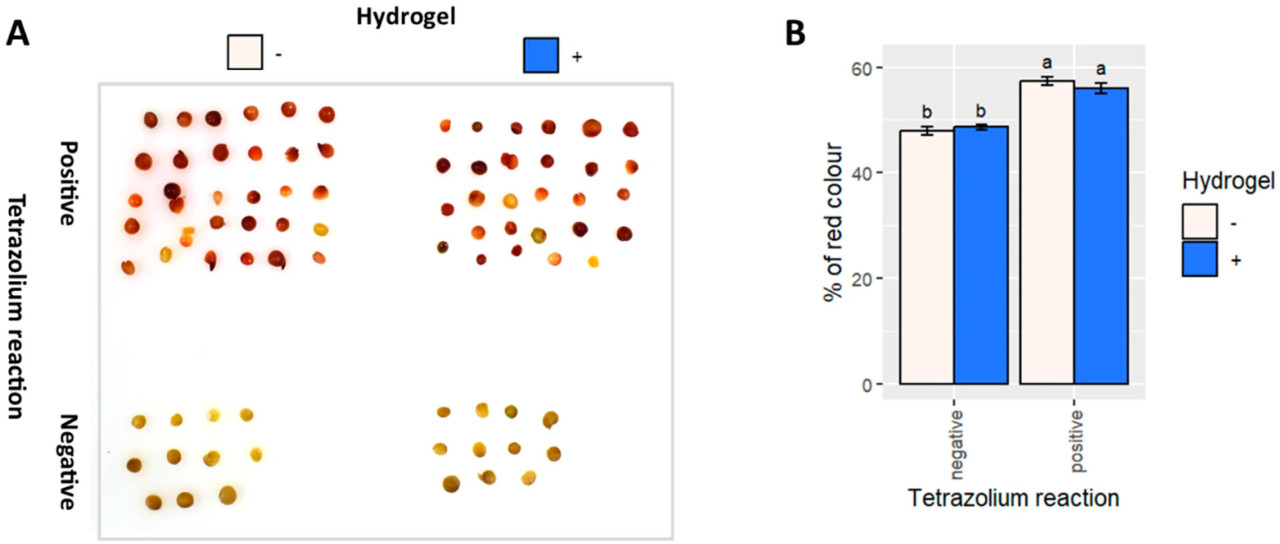
Окрашивание тетразолием (TZ) не выявило снижения жизнеспособности семян рапса, проросших в контрольных условиях или в присутствии гидрогеля ( рисунок 5 ), что аналогично анализам, касающимся антиоксидантного баланса.
Рисунок 5. Тест с тетразолием (TZ) позволяет оценить всхожесть рапса в контрольных условиях и при обработке гидрогелем. Отрицательный контроль состоял из семян, инкубированных в течение 1 часа при температуре 95 °C. ( A ) Фотографии окрашенных семян. ( B ) Полуколичественная оценка реакции TZ, рассчитанная как процент красных пикселей. Статистический анализ проводился с использованием однофакторного дисперсионного анализа (ANOVA) с последующим апостериорным тестом Тьюки. Разные буквы обозначают статистически значимые различия ( p > 0,05).
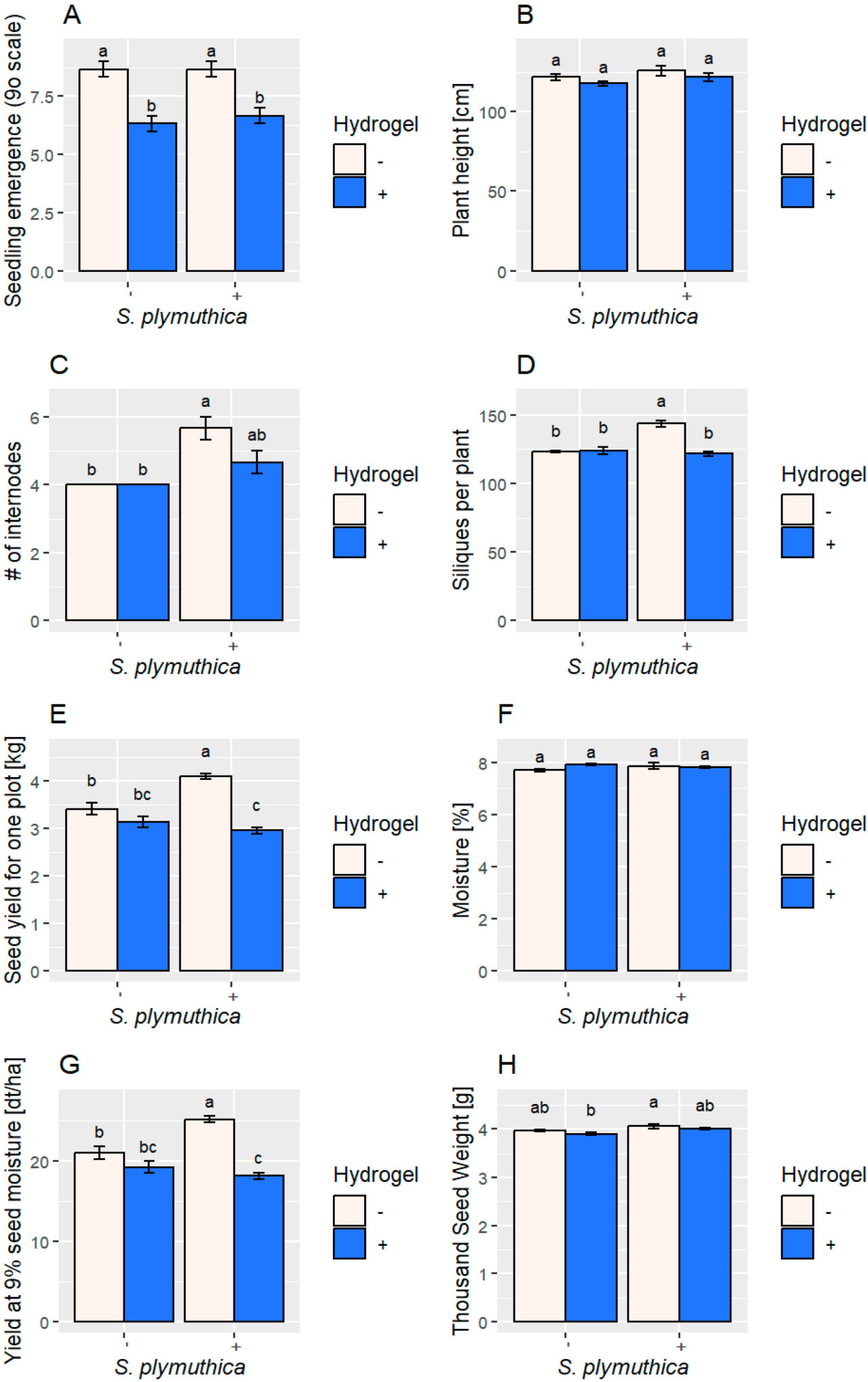
3.5. Рост рапса в присутствии гидрогеля и S. plymuthica в полевом эксперименте
Гидрогель отрицательно повлиял на всхожесть всходов рапса ( Рисунок 6 ). Более того, растения, выращенные в присутствии гидрогеля, но не инокулированные S. plymuthica , были в среднем на 4–8 см меньше, чем контрольные растения и инокулированные растения. Урожайность и TSW были самыми низкими у растений, выращенных с гидрогелем. Рапс, инокулированный S. plymuthica, показал значительное увеличение количества стручков (16,48%), урожайности (19,93%) и TSW (2%) по сравнению с контрольными растениями. Нанесение гидрогеля на растения, инокулированные S. plymuthica, ослабило ростостимулирующий эффект бактерий, что привело к снижению урожайности ( Рисунок 6 ).
Рисунок 6. Биометрическая оценка растений B. napus L., выращенных из семян, инокулированных S. plymuthica , почвы, смешанной с гидрогелем, и почвы, смешанной как с гидрогелем, так и с семенами, инокулированными S. plymuthica, в полевых условиях. ( A ) всхожесть сеянцев; ( B ) высота растения; ( C ) количество междоузлий; ( D ) стручков на растение; ( E ) урожайность семян с одной делянки; ( F ) влажность семян; ( G ) урожайность при 9% влажности; и ( H ) вес тысячи семян. Статистический анализ проводился с использованием однофакторного дисперсионного анализа (ANOVA) с последующим апостериорным тестом Тьюки. Разные буквы указывают на статистически значимые различия ( p > 0,05).
4. Обсуждение
Мы выдвинули гипотезу, что объединение двух агротехнических обработок, т. е. одновременного использования гидрогелей и инокуляции PGPM, может синергетически усилить рост и развитие рапса в полевых условиях. Применение биоинокулянтов в полевых условиях дает неоднозначные эффекты, в основном из-за различных уровней выживаемости микробов, внесенных в почву. Факторы, влияющие на успешное укоренение внесенного штамма PGPM, включают условия окружающей среды (т. е. температуру, количество осадков и тип почвы) [ 17 , 44 ] и способность конкурировать с местным почвенным микробиомом [ 17 , 45 ]. Поэтому существует острая необходимость в оценке дополнительных штаммов PGPM в лабораторных условиях (т. е. эксперименты в горшках в условиях теплицы) и полевых экспериментах. Чтобы проверить нашу гипотезу, мы оценили рост бактериальных изолятов в среде, обогащенной гидрогелем, чтобы подтвердить, что он не токсичен для бактерий. Наши результаты показали, что, хотя добавление гидрогеля в питательную среду улучшило свежую биомассу тестируемых бактерий, оно не оказало существенного влияния на сухую биомассу. Это расхождение может указывать на то, что частицы гидрогеля прилипли к бактериальным клеткам, изменив измерения биомассы, поскольку сухой вес бактерий, выращенных с гидрогелем, был аналогичен таковому в контрольной группе. Был проведен тест на жизнеспособность семян (TTC) для оценки потенциально вредной или токсической активности гидрогеля по отношению к семенам. Анализ накопления TTC и ROS не выявил неблагоприятного воздействия гидрогеля на семена рапса. Более того, активность SOD осталась неизменной в семенах и проростках, что указывает на отсутствие стрессовой реакции у растений. Эти результаты свидетельствуют о том, что гидрогель безопасен для покрытия семян и внесения в почву и нетоксичен для ризобактерий. Мэтис и соавторы [ 46 ] показали, что полиакриловая кислота (PAA) и PAA с добавлением лигноцеллюлозных волокон положительно повлияли на проникновение тестируемых ризобактерий в корневую систему пшеницы. Более того, авторы показали, что применение тестируемых гидрогелей увеличило количество таксонов, связанных с растворением фосфора в полевом эксперименте. Интересно, что микробиом ризосферы пшеницы имел иной состав по сравнению с основной почвой и ризосферой контрольных растений (т. е. не обработанных гидрогелем).
Горшечный эксперимент продемонстрировал, что все протестированные бактерии усилили рост канолы в условиях моделированной засухи, что позволило нам выбрать S. plymuthica в качестве наиболее перспективного кандидата для дальнейших полевых исследований. Наши предыдущие исследования (горшечный эксперимент) показали, что выбранный штамм S. plymuthica проявляет протеолитическую, целлюлозолитическую и лигнолитическую активность и может способствовать росту канолы в компостной почве и сельскохозяйственной почве, загрязненной пластиком [ 47 , 48 ]. Эти бактерии могут образовывать биопленку на поверхности пластиковых полимеров [ 49 ], что указывает на сильную ризокомпетентность. Proença и др. [ 50 ] показали, что S. plymuthica может солюбилизировать фосфаты и цинк; продуцировать сидерофоры, индол-3-уксусную кислоту (ИУК) и АЦК-деаминазу; и проявлять хитинолитическую и нематоцидную активность. Более того, обработка канолы PGPM может снизить возникновение патогенных микробов. Abuamsha и др. [ 51 ] сообщили, что покрытие семян канолы S. plymuthica снижает уровень заражения Leptosphaeria maculans . S. plymuthica также проявляет антагонистическую активность по отношению к другим грибковым патогенам, включая Verticillium bilit , Rhizoctonia solani и Sclerotinia sclerotiorum [ 52 ]. Применение S. plymuthica положительно повлияло на рост канолы в условиях засухи, увеличив высоту растений, количество стручков, ветвление и TSW. Применение только S. plymuthica привело к наиболее благоприятным результатам для роста и урожайности канолы, что согласуется с предыдущими исследованиями эффектов Serratia spp. на рост различных растений, включая пшеницу ( Triticum aestivum L.) [ 53 ], кукурузу [ 54 , 55 ], перец чили ( Capsicum annum L.) [ 56 ], черный перец ( Piper nigrum L.) [ 57 ], рис ( Oryza sativa L.) [ 58 , 59 ] и киноа ( Chenopodium quinoa Willd.) [ 60 ]. Наблюдаемое усиленное образование стручков и TSW позволяют предположить, что S. plymuthica могла увеличить поглощение питательных веществ и/или их доступность за счет растворения Zn и P, а также хелатирования Fe через экссудацию сидерофоров. Увеличенная высота и ветвление в инокулированном рапсе, вероятно, связаны со способностью S. plymuthica производить ИУК [ 50 ].Сообщалось, что S. plymuthica улучшает параметры роста растений у декоративных растений в условиях водного стресса, усиливая цветение и сухую биомассу побегов у петунии ( Petunia × hybrida (Sweet) D. Don ex WH Baxter), бальзамина ( Impatiens walleriana Hook.f.) и анютиных глазок ( Viola × wittrockiana Gams ex Nauenb. & Buttler) [ 52 ]. Аналогичные результаты были получены для пшеницы, выращиваемой в условиях сильного дефицита воды, где Serratia sp. 1–9 значительно увеличила биомассу пшеницы и площадь корней [ 61 ]. Интересным моментом является то, что все еще необходимо оценить взаимодействие конкретных видов бактерий с конкретными культурами. Pan et al. [ 62 ] показали, что Serratia proteamaculans и Serratia liquefaciens не оказали заметного влияния на рост и образование клубеньков выращенной в полевых условиях сои ( Glycine max L. Merr), тогда как S. liquefaciens значительно улучшили биомассу редиса ( Raphanus sativus L.) в условиях стресса, вызванного тяжелыми металлами [ 63 ].
Использование гидрогеля дало менее желаемые результаты, чем ожидалось. Растения канолы показали задержку всходов, уменьшенную высоту и немного более низкое значение TSW. Эти результаты указывают на то, что гидрогели могли создать чрезмерно влажные условия в корневой зоне, уменьшив доступность кислорода и затруднив развитие корней, что повлияло на всходы [ 64 ]. Хотя обычно сообщается, что гидрогели увеличивают пористость почвы и доступность кислорода [ 65 ], наши результаты подчеркивают острую необходимость в дальнейших исследованиях использования сельскохозяйственных гидрогелей в полевых условиях. Одновременное использование гидрогеля и S. plymuthica дало результаты, схожие с полученными для варианта с одним только гидрогелем, что указывает на то, что комбинация почвенных добавок (например, сельскохозяйственных гидрогелей) может препятствовать или уменьшать стимулирующее рост действие ризобактерий. Специфические свойства используемого гидрогеля могли препятствовать ожидаемой синергии между гидрогелем и PGPM. Его высокая водоудерживающая способность могла снизить доступность кислорода, ограничив микробную колонизацию и активность в ризосфере. Кроме того, коммерчески доступные синтетические гидрогели часто содержат акриламид, акриловую кислоту или акрилат калия, которые обладают отрицательным зарядом [ 66 ], а включение NaOH или KOH в качестве инициаторов гелеобразования и растворителей может привести к накоплению ионов Na и K в ризосфере, что приводит к засолению [ 67 , 68 ]. Некоторые отчеты предполагают, что избыток Na может ухудшить поглощение Ca и привести к корневой гнили и снижению накопления биомассы [ 66 , 69 ]. Более того, высокие концентрации растворенных веществ в гидрогеле могут привести к осмотическому стрессу и ухудшить поглощение воды корневой системой [ 66 ]. Хотя одновременное применение гидрогеля и S. plymuthica улучшило ветвление рапса, урожайность и всхожесть всходов были ниже по сравнению с контрольными растениями, что может указывать на то, что гидрогель несколько ухудшил способность бактерий колонизировать ризосферу или ограничил доступ кислорода к корням, фактически сведя на нет способность бактерий стимулировать рост растений [ 64 ]. Хотя некоторые исследования показывают различную эффективность гидрогелей в зависимости от факторов окружающей среды и видов растений, все еще необходимы комплексные исследования взаимодействия гидрогеля с почвой и растением в полевых условиях. Гидрогели не только увеличивают водоудерживающую способность почвы, но и ограничивают вымывание питательных веществ из почвы [ 65 , 70 ]. Как упоминалось ранее, тип почвы сильно влияет на эффективность применяемого гидрогеля. Вомак и др. [ 71] показали увеличение пористости почвы на 4, 10 и 19% в глинистых, песчаных и супесчаных почвах соответственно. Более того, авторы сообщили, что гидрогели естественного происхождения оказали более благоприятное влияние на структуру почвы, чем коммерческие синтетические [ 71 ]. Шен и др. [ 72 ] оценили выживаемость Serratia plymuthica A21-4 в экспериментах в горшках и полевых условиях. Добавление 2% гидрогеля в почву в эксперименте в горшке увеличило бактериальную колонизацию как почвы, так и ризосферы перца ( Capsicum L.). В ризосфере 40-дневных растений перца в почве, обработанной гидрогелем, было продемонстрировано в 100 раз больше бактерий по сравнению с контрольной группой. Растения перца, обработанные гидрогелем в эксперименте в горшке, также показали более высокую всхожесть семян и лучший рост, а также снижение фитофтороза .
Хотя известно, что гидрогели увеличивают пористость почвы и удержание воды, эти же свойства могут создавать избыточную влажность в некоторых почвах, что приводит к снижению доступности кислорода и задержке развития корней [ 64 ]. Этот парадокс подчёркивает необходимость дальнейшего изучения применения гидрогелей в различных условиях окружающей среды и почвы, особенно в полевых условиях, а также в контексте микробиома ризосферы.
Использование PGPR, таких как S. plymuthica , может представлять собой экономически эффективную альтернативу обычным удобрениям, поскольку цены на удобрения постоянно растут [ 73 , 74 ]. Потенциал повышения урожайности и снижения зависимости от химических удобрений может принести фермерам значительные экономические выгоды, особенно в регионах, испытывающих нехватку воды. Более того, сокращение использования синтетических химикатов, а также экологические и нормативные преимущества делают PGPR устойчивым долгосрочным решением. Однако стоимость производства и применения гидрогеля остается проблемой, поскольку его преимущества могут варьироваться в зависимости от типа почвы и условий окружающей среды [ 68 , 71 ], что требует тщательного анализа затрат и выгод перед широким внедрением.
5. Выводы
Наше исследование демонстрирует способность S. plymuthica улучшать урожайность рапса в условиях засухи, что подчеркивает его потенциал для использования в коммерческом сельском хозяйстве. Более того, успешное использование PGPR для повышения урожайности при одновременном снижении удобрений, как того требует Европейский союз, подтверждает его пригодность для устойчивых методов ведения сельского хозяйства. Гидрогель был признан неэффективным для улучшения роста рапса в полевых условиях и мешал появлению всходов, что указывает на необходимость дальнейшей оценки коммерчески доступных синтетических гидрогелей. Более того, гидрогель ослабил стимулирующий рост эффект, наблюдаемый для S. plymuthica, что означает, что для достижения синергетического эффекта в повышении урожайности существует острая необходимость в дальнейших исследованиях для понимания взаимодействий растение-микроб-гидрогель в различных полевых условиях. Интересным исследовательским моментом было бы наблюдение за долгосрочным влиянием применения гидрогеля на здоровье почвы и микробиом.
Ссылки
1. Lee, H.; Romero, J. Climate Change 2023: Synthesis Report. Contribution of Working Groups I, II and III to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change; IPCC: Geneva, Switzerland, 2023. [Google Scholar]
2. Metcalfe, D.B.; Meir, P.; Aragão, L.E.O.C.; Lobo-do-Vale, R.; Galbraith, D.; Fisher, R.A.; Chaves, M.M.; Maroco, J.P.; da Costa, A.C.L.; de Almeida, S.S.; et al. Shifts in plant respiration and carbon use efficiency at a large-scale drought experiment in the eastern Amazon. New Phytol. 2010, 187, 608–621. [Google Scholar] [CrossRef] [PubMed]
3. Shah, N.H.; Paulsen, G.M. Interaction of drought and high temperature on photosynthesis and grain-filling of wheat. Plant Soil 2003, 257, 219–226. [Google Scholar] [CrossRef]
4. Naveed, M.; Hussain, M.B.; Zahir, Z.A.; Mitter, B.; Sessitsch, A. Drought stress amelioration in wheat through inoculation with Burkholderia phytofirmans strain PsJN. Plant Growth Regul. 2014, 73, 121–131. [Google Scholar] [CrossRef]
5. Ghannoum, O.; Von Caemmerer, S.; Conroy, J.P. The effect of drought on plant water use efficiency of nine NAD–ME and nine NADP–ME Australian C4 grasses. Funct. Plant Biol. 2002, 29, 1337–1348. [Google Scholar] [CrossRef]
6. Bista, D.R.; Heckathorn, S.A.; Jayawardena, D.M.; Mishra, S.; Boldt, J.K. Effects of drought on nutrient uptake and the levels of nutrient-uptake proteins in roots of drought-sensitive and -tolerant grasses. Plants 2018, 7, 28. [Google Scholar] [CrossRef]
7. Haile, G.G.; Tang, Q.; Li, W.; Liu, X.; Zhang, X. Drought: Progress in broadening its understanding. Wiley Interdiscip. Rev. Water 2020, 7, e1407. [Google Scholar] [CrossRef]
8. Dietz, K.J.; Zörb, C.; Geilfus, C.M. Drought and crop yield. Plant Biol. 2021, 23, 881–893. [Google Scholar] [CrossRef]
9. Moreno-Jiménez, E.; Plaza, C.; Saiz, H.; Manzano, R.; Flagmeier, M.; Maestre, F.T. Aridity and reduced soil micronutrient availability in global drylands. Nat. Sustain. 2019, 2, 371–377. [Google Scholar] [CrossRef]
10. Borges, C.E.; Von dos Santos Veloso, R.; da Conceição, C.A.; Mendes, D.S.; Ramirez-Cabral, N.Y.; Shabani, F.; Shafapourtehrany, M.; Nery, M.C.; da Silva, R.S. Forecasting Brassica napus production under climate change with a mechanistic species distribution model. Sci. Rep. 2023, 13, 12656. [Google Scholar] [CrossRef]
11. Zdziennicka, A.; Szymczyk, K.; Jańczuk, B.; Longwic, R.; Sander, P. Surface, volumetric, and wetting properties of oleic, linoleic, and linolenic acids with regards to application of canola oil in diesel engines. Appl. Sci. 2019, 9, 3445. [Google Scholar] [CrossRef]
12. Zhu, M.; Monroe, J.G.; Suhail, Y.; Villiers, F.; Mullen, J.; Pater, D.; Hauser, F.; Jeon, B.W.; Bader, J.S.; Kwak, J.M.; et al. Molecular and systems approaches towards drought-tolerant canola crops. New Phytol. 2016, 210, 1169–1189. [Google Scholar] [CrossRef] [PubMed]
13. Chunjie, Y.; Xuekun, Z.; Chongshun, Z. Effects of drought simulated by PEG-6000 on germination and seedling growth of rapeseed (Brassica napus L.). Chin. J. Oil Crop Sci. 2007, 29, 425–430. [Google Scholar]
14. Michalak, M.; Antoszewski, M.; Kamiński, D.; Mierek-Adamski, A.; Dąbrowska, B.G. Priming of Brassica napus L. seeds with aqueous extract from mistletoe (Viscum album L.) boosts the content of photosynthetic pigments. Ecol. Quest. 2024, 35, 1–15. [Google Scholar]
15. Paparella, S.; Araújo, S.S.; Rossi, G.; Wijayasinghe, M.; Carbonera, D.; Balestrazzi, A. Seed priming: State of the art and new perspectives. Plant Cell Rep. 2015, 34, 1281–1293. [Google Scholar] [CrossRef]
16. El-Saadony, M.T.; Saad, A.M.; Soliman, S.M.; Salem, H.M.; Ahmed, A.I.; Mahmood, M.; El-Tahan, A.M.; Ebrahim, A.A.M.; Abd El-Mageed, T.A.; Negm, S.H.; et al. Plant growth-promoting microorganisms as biocontrol agents of plant diseases: Mechanisms, challenges and future perspectives. Front. Plant Sci. 2022, 13, 923880. [Google Scholar] [CrossRef]
17. Antoszewski, M.; Mierek-Adamska, A.; Dąbrowska, G.B. The importance of microorganisms for sustainable agriculture—A review. Metabolites 2022, 12, 1100. [Google Scholar] [CrossRef]
18. Dąbrowska, G.B.; Zdziechowska, E. The role of rhizobacteria in the stimulation of the growth and development processes and protection of plants against environmental factors. Prog. Plant Prot. 2015, 55, 498–506. [Google Scholar]
19. Saravanakumar, K.; Fan, L.; Fu, K.; Yu, C.; Wang, M.; Xia, H.; Sun, J.; Li, Y.; Chen, J. Cellulase from Trichoderma harzianum interacts with roots and triggers induced systemic resistance to foliar disease in maize. Sci. Rep. 2016, 6, 35543. [Google Scholar] [CrossRef]
20. Patel, P.; Gajjar, H.; Joshi, B.; Krishnamurthy, R.; Amaresan, N. Inoculation of salt-tolerant Acinetobacter sp. (RSC9) improves the sugarcane (Saccharum sp. Hybrids) growth under salinity stress condition. Sugar Tech 2022, 24, 494–501. [Google Scholar] [CrossRef]
21. Radhakrishnan, R.; Khan, A.L.; Kang, S.M.; Lee, I.J. A comparative study of phosphate solubilization and the host plant growth promotion ability of Fusarium verticillioides RK01 and Humicola sp. KNU01 under salt stress. Ann. Microbiol. 2015, 65, 585–593. [Google Scholar] [CrossRef]
22. Zahir, Z.A.; Ghani, U.; Naveed, M.; Nadeem, S.M.; Asghar, H.N. Comparative effectiveness of Pseudomonas and Serratia sp. containing ACC-deaminase for improving growth and yield of wheat (Triticum aestivum L.) under salt-stressed conditions. Arch. Microbiol. 2009, 191, 415–424. [Google Scholar] [CrossRef] [PubMed]
23. Dąbrowska, G.B.; Garstecka, Z.; Trejgell, A.; Dąbrowski, H.P.; Konieczna, W.; Szyp-Borowska, I. The impact of forest fungi on promoting growth and development of Brassica napus L. Agronomy 2021, 11, 2475. [Google Scholar] [CrossRef]
24. Sharma, M.; Mishra, V.; Rau, N.; Sharma, R.S. Increased iron-stress resilience of maize through inoculation of siderophore-producing Arthrobacter globiformis from mine. J. Basic Microbiol. 2016, 56, 719–735. [Google Scholar] [CrossRef] [PubMed]
25. Garstecka, Z.; Antoszewski, M.; Mierek-Adamska, A.; Krauklis, D.; Niedojadło, K.; Kaliska, B.; Hrynkiewicz, K.; Dąbrowska, G.B. Trichoderma viride colonizes the roots of Brassica napus L., alters the expression of stress-responsive genes, and increases the yield of canola under field conditions during drought. Int. J. Mol. Sci. 2023, 24, 15349. [Google Scholar] [CrossRef] [PubMed]
26. Flores, A.C.; Luna, A.A.E.; Portugal, V.O. Yield and quality enhancement of marigold flowers by inoculation with Bacillus subtilis and Glomus fasciculatum. J. Sustain. Agric. 2007, 31, 21–31. [Google Scholar] [CrossRef]
27. Janowska, B.; Andrzejak, R.; Kosiada, T. The influence of fungi of the Trichoderma genus on the flowering of Freesia refracta Klatt “Argentea” in winter. Hortic. Sci. 2020, 47, 203–210. [Google Scholar] [CrossRef]
28. Khan, A.L.; Hamayun, M.; Kim, Y.H.; Kang, S.M.; Lee, J.H.; Lee, I.J. Gibberellins producing endophytic Aspergillus fumigatus sp. LH02 influenced endogenous phytohormonal levels, isoflavonoids production and plant growth in salinity stress. Process Biochem. 2011, 46, 440–447. [Google Scholar] [CrossRef]
29. Parmasi, Z.; Tahmasebi, Z.; Zare, M.J.; Nourollahi, K.; Kanouni, H. Biocontrol of Ascochyta blight by Azospirillum sp. depending on the degree of resistance of chickpea genotypes. J. Phytopathol. 2019, 167, 601–607. [Google Scholar] [CrossRef]
30. Turkan, S.; Mierek-Adamska, A.; Kulasek, M.; Konieczna, W.B.; Dabrowska, G.B. New seed coating containing Trichoderma viride with anti-pathogenic properties. PeerJ 2023, 11, e15392. [Google Scholar] [CrossRef]
31. Rojas-Tapias, D.F.; Bonilla, R.; Dussán, J. Effect of inoculation and co-inoculation of Acinetobacter sp. RG30 and Pseudomonas putida GN04 on growth, fitness, and copper accumulation of maize (Zea mays). Water Air Soil Pollut. 2014, 225, 2232. [Google Scholar] [CrossRef]
32. Dąbrowska, G.; Hrynkiewicz, K.; Trejgell, A.; Baum, C. The effect of plant growth-promoting rhizobacteria on the phytoextraction of Cd and Zn by Brassica napus L. Int. J. Phytoremediat. 2017, 19, 597–604. [Google Scholar] [CrossRef] [PubMed]
33. Szymańska, S.; Dąbrowska, G.B.; Tyburski, J.; Niedojadło, K.; Piernik, A.; Hrynkiewicz, K. Boosting the Brassica napus L. tolerance to salinity by the halotolerant strain Pseudomonas stutzeri ISE12. Environ. Exp. Bot. 2019, 163, 55–68. [Google Scholar] [CrossRef]
34. Bano, Q.; Ilyas, N.; Bano, A.; Zafar, N.; Akram, A.; Fayaz, A.; Hassan, U.L. Effect of Azospirillum inoculation on maize (Zea mays L.) under drought stress. Pak. J. Bot. 2013, 45, 13–20. [Google Scholar]
35. Rubin, R.L.; van Groenigen, K.J.; Hungate, B.A. Plant growth promoting rhizobacteria are more effective under drought: A meta-analysis. Plant Soil 2017, 416, 309–323. [Google Scholar] [CrossRef]
36. Zhao, X.; Yuan, X.; Xing, Y.; Dao, J.; Zhao, D.; Li, Y.; Li, W.; Wang, Z. A meta-analysis on morphological, physiological and biochemical responses of plants with PGPR inoculation under drought stress. Plant Cell Environ. 2023, 46, 199–214. [Google Scholar] [CrossRef]
37. Skrzypczak, D.; Mikula, K.; Kossińska, N.; Widera, B.; Warchoł, J.; Moustakas, K.; Chojnacka, K.; Witek-Krowiak, A. Biodegradable hydrogel materials for water storage in agriculture-review of recent research. Desalination Water Treat. 2020, 194, 324–332. [Google Scholar] [CrossRef]
38. Liu, Y.; Wang, J.; Chen, H.; Cheng, D. Environmentally friendly hydrogel: A review of classification, preparation and application in agriculture. Sci. Total Environ. 2022, 846, 157303. [Google Scholar] [CrossRef]
39. Zhu, J.; Suhaimi, F.; Lim, J.Y.; Gao, Z.; Swarup, S.; Loh, C.S.; Li, J.; Ong, C.N.; Tan, W.K. A field study on using soybean waste-derived superabsorbent hydrogel to enhance growth of vegetables. Sci. Total Environ. 2022, 851, 158141. [Google Scholar] [CrossRef]
40. Makowska, M.; Borowski, E.; Ziemba, A. The gas exchange and yielding of strawberry plants cultivated in black soil and sandy soil with the addition of hydrogel. Acta Sci. Pol. Hortorum Cultus 2005, 4, 153–161. [Google Scholar]
41. Mierek-Adamska, A.; Kotowicz, K.; Goc, A.; Boniecka, J.; Berdychowska, J.; Dąbrowska, G.B. Potential involvement of rapeseed (Brassica napus L.) metallothioneins in the hydrogen peroxide-induced regulation of seed vigour. J. Agron. Crop Sci. 2019, 205, 598–607. [Google Scholar] [CrossRef]
42. Daudi, A.; O’Brien, J. Detection of hydrogen peroxide by DAB staining in Arabidopsis leaves. Bio-Protocol 2012, 2, e263. [Google Scholar] [CrossRef] [PubMed]
43. R Core Team. R: A Language and Environment for Statistical Computing; PBC: Boston, MA, USA, 2024. [Google Scholar]
44. Pandey, A.; Yarzábal, L.A. Bioprospecting cold-adapted plant growth promoting microorganisms from mountain environments. Appl. Microbiol. Biotechnol. 2018, 103, 643–657. [Google Scholar] [CrossRef] [PubMed]
45. Van Elsas, J.D.; Chiurazzi, M.; Mallon, C.A.; Elhottova, D.; Krištůfek, V.; Salles, J.F. Microbial diversity determines the invasion of soil by a bacterial pathogen. Proc. Natl. Acad. Sci. USA 2012, 109, 1159–1164. [Google Scholar] [CrossRef] [PubMed]
46. Mathes, F.; Murugaraj, P.; Bougoure, J.; Pham, V.T.H.; Truong, V.K.; Seufert, M.; Wissemeier, A.H.; Mainwaring, D.E.; Murphy, D.V. Engineering rhizobacterial community resilience with mannose nanofibril hydrogels towards maintaining grain production under drying climate stress. Soil Biol. Biochem. 2020, 142, 107715. [Google Scholar] [CrossRef]
47. Janczak, K.; Hrynkiewicz, K.; Znajewska, Z.; Dąbrowska, G. Use of rhizosphere microorganisms in the biodegradation of PLA and PET polymers in compost soil. Int. Biodeterior. Biodegrad. 2018, 130, 65–75. [Google Scholar] [CrossRef]
48. Janczak, K.; Dąbrowska, G.B.; Raszkowska-Kaczor, A.; Kaczor, D.; Hrynkiewicz, K.; Richert, A. Biodegradation of the plastics PLA and PET in cultivated soil with the participation of microorganisms and plants. Int. Biodeterior. Biodegrad. 2020, 155, 105087. [Google Scholar] [CrossRef]
49. Dąbrowska, G.B.; Tylman-Mojżeszek, W.; Mierek-Adamska, A.; Richert, A.; Hrynkiewicz, K. Potential of Serratia plymuthica IV-11-34 strain for biodegradation of polylactide and poly(ethylene terephthalate). Int. J. Biol. Macromol. 2021, 193, 145–153. [Google Scholar] [CrossRef]
50. Proença, D.N.; Schwab, S.; Vidal, M.S.; Baldani, J.I.; Xavier, G.R.; Morais, P.V. The nematicide Serratia plymuthica M24T3 colonizes Arabidopsis thaliana, stimulates plant growth, and presents plant beneficial potential. Braz. J. Microbiol. 2019, 50, 777–789. [Google Scholar] [CrossRef]
51. Abuamsha, R.; Salman, M.; Ehlers, R.-U. Effect of seed priming with Serratia plymuthica and Pseudomonas chlororaphis to control Leptosphaeria maculans in different oilseed rape cultivars. Eur. J. Plant Pathol. 2011, 130, 287–295. [Google Scholar] [CrossRef]
52. Adam, E.; Müller, H.; Erlacher, A.; Berg, G. Complete genome sequences of the Serratia plymuthica strains 3Rp8 and 3Re4-18, two rhizosphere bacteria with antagonistic activity towards fungal phytopathogens and plant growth promoting abilities. Stand. Genom. Sci. 2016, 11, 61. [Google Scholar] [CrossRef]
53. Singh, R.P.; Jha, P.N. The multifarious PGPR Serratia marcescens CDP-13 augments induced systemic resistance and enhanced salinity tolerance of wheat (Triticum aestivum L.). PLoS ONE 2016, 11, e0155026. [Google Scholar] [CrossRef] [PubMed]
54. Koo, S.Y.; Cho, K.S. Isolation and characterization of a plant growth-promoting rhizobacterium, Serratia sp. SY5. J. Microbiol. Biotechnol. 2009, 19, 1431–1438. [Google Scholar] [PubMed]
55. El-Esawi, M.A.; Alaraidh, I.A.; Alsahli, A.A.; Alzahrani, S.M.; Ali, H.M.; Alayafi, A.A.; Ahmad, M. Serratia liquefaciens KM4 improves salt stress tolerance in maize by regulating redox potential, ion homeostasis, leaf gas exchange and stress-related gene expression. Int. J. Mol. Sci. 2018, 19, 3310. [Google Scholar] [CrossRef]
56. Patel, S.K.; Singh, S.; Benjamin, J.C.; Singh, V.R.; Bisht, D.; Lal, R.K. Plant growth-promoting activities of Serratia marcescens and Pseudomonas fluorescens on Capsicum annuum L. plants. Ecol. Front. 2024, 44, 654–663. [Google Scholar] [CrossRef]
57. Dastager, S.G.; Deepa, C.K.; Pandey, A. Potential plant growth-promoting activity of Serratia nematodiphila NII-0928 on black pepper (Piper nigrum L.). World J. Microbiol. Biotechnol. 2011, 27, 259–265. [Google Scholar] [CrossRef]
58. Kotoky, R.; Nath, S.; Kumar Maheshwari, D.; Pandey, P. Cadmium resistant plant growth promoting rhizobacteria Serratia marcescens S2I7 associated with the growth promotion of rice plant. Environ. Sustain. 2019, 2, 135–144. [Google Scholar] [CrossRef]
59. Niu, H.; Sun, Y.; Zhang, Z.; Zhao, D.; Wang, N.; Wang, L.; Guo, H. The endophytic bacterial entomopathogen Serratia marcescens promotes plant growth and improves resistance against Nilaparvata lugens in rice. Microbiol. Res. 2022, 256, 126956. [Google Scholar] [CrossRef]
60. Mahdi, I.; Hafidi, M.; Allaoui, A.; Biskri, L. Halotolerant endophytic bacterium Serratia rubidaea ED1 enhances phosphate solubilization and promotes seed germination. Agriculture 2021, 11, 224. [Google Scholar] [CrossRef]
61. Wang, S.; Ouyang, L.; Ju, X.; Zhang, L.; Zhang, Q.; Li, Y. Survey of plant drought-resistance promoting bacteria from Populus euphratica tree living in arid area. Indian J. Microbiol. 2014, 54, 419–426. [Google Scholar] [CrossRef]
62. Pan, B.; Vessey, J.K.; Smith, D.L. Response of field-grown soybean to co-inoculation with the plant growth promoting rhizobacteria Serratia proteamaculans or Serratia liquefaciens, and Bradyrhizobium japonicum pre-incubated with genistein. Eur. J. Agron. 2002, 17, 143–153. [Google Scholar] [CrossRef]
63. Han, H.; Sheng, X.; Hu, J.; He, L.; Wang, Q. Metal-immobilizing Serratia liquefaciens CL-1 and Bacillus thuringiensis X30 increase biomass and reduce heavy metal accumulation of radish under field conditions. Ecotoxicol. Environ. Saf. 2018, 161, 526–533. [Google Scholar] [CrossRef] [PubMed]
64. Tariq, Z.; Iqbal, D.N.; Rizwan, M.; Ahmad, M.; Faheem, M.; Ahmed, M. Significance of biopolymer-based hydrogels and their applications in agriculture: A review in perspective of synthesis and their degree of swelling for water holding. RSC Adv. 2023, 13, 24731–24754. [Google Scholar] [CrossRef] [PubMed]
65. Guilherme, M.R.; Aouada, F.A.; Fajardo, A.R.; Martins, A.F.; Paulino, A.T.; Davi, M.F.T.; Rubira, A.F.; Muniz, E.C. Superabsorbent hydrogels based on polysaccharides for application in agriculture as soil conditioner and nutrient carrier: A review. Eur. Polym. J. 2015, 72, 365–385. [Google Scholar] [CrossRef]
66. Sahmat, S.S.; Rafii, M.Y.; Oladosu, Y.; Jusoh, M.; Hakiman, M.; Mohidin, H. A systematic review of the potential of a dynamic hydrogel as a substrate for sustainable agriculture. Horticulturae 2022, 8, 1026. [Google Scholar] [CrossRef]
67. Chen, X.; Huang, L.; Mao, X.; Liao, Z.; He, Z. A comparative study of the cellular microscopic characteristics and mechanisms of maize seedling damage from superabsorbent polymers. Pedosphere 2017, 27, 274–282. [Google Scholar] [CrossRef]
68. Dhanalakshmi, A.; Vijayakumari, K.K.; Marimuthu, S.; Surendran, U. Evaluation of different soil textures in combination with growing media on growth, yield, and water productivity of blackgram. Commun. Soil Sci. Plant Anal. 2020, 51, 2670–2682. [Google Scholar]
69. Al Rohily, K.; El-Hamshary, H.; Ghoneim, A.; Modaihsh, A. Controlled release of phosphorus from superabsorbent phosphate-bound alginate-graft-polyacrylamide: Resistance to soil cations and release mechanism. ACS Omega 2021, 5, 32919–32929. [Google Scholar] [CrossRef]
70. Wu, Y.; Li, S.; Chen, G. Hydrogels as water and nutrient reservoirs in agricultural soil: A comprehensive review of classification, performance, and economic advantages. Environ. Dev. Sustain. 2023, 26, 24653–24685. [Google Scholar] [CrossRef]
71. Womack, N.C.; Piccoli, I.; Camarotto, C.; Squartini, A.; Guerrini, G.; Gross, S.; Maggini, M.; Cabrera, M.L.; Morari, F. Hydrogel application for improving soil pore network in agroecosystems. Preliminary results on three different soils. CATENA 2022, 208, 105759. [Google Scholar] [CrossRef]
72. Shen, S.S.; Kim, W.-I.; Park, C.S. Effect of hydrogel on survival of Serratia plymuthica A21-4 in soils and plant disease suppression. Plant Pathol. J. 2006, 22, 364–368. [Google Scholar] [CrossRef]
73. Erdogan, S.; Kartal, M.T.; Pata, U.K. Does climate change cause an upsurge in food prices? Foods 2024, 13, 154. [Google Scholar] [CrossRef]
74. Schaub, S.; Benni, N.E. How do price (risk) changes influence farmers’ preferences to reduce fertilizer application? Agric. Econ. 2024, 55, 365–383. [Google Scholar] [CrossRef]
Dąbrowska GB, Krauklis D, Kulasek M, Nocny M, Antoszewski M, Mierek-Adamska A, Kaliska B. Synthetic Hydrogel Dilutes Serratia plymuthica Growth— Promoting Effect on Brassica napus L. Under Drought Conditions. Agriculture. 2025; 15(2):142. https://doi.org/10.3390/agriculture15020142
Перевод статьи «Synthetic Hydrogel DilutesSerratia plymuthicaGrowth— Promoting Effect onBrassica napusL. Under Drought Conditions» авторов Dąbrowska GB, Krauklis D, Kulasek M, Nocny M, Antoszewski M, Mierek-Adamska A, Kaliska B., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык






























































































Комментарии (0)