Физиолого-биохимические показатели как индикаторы устойчивости к кадмию у сортов Brassica napus L.
Кадмий (Cd) — неэссенциальный тяжелым металл и повсеместный загрязнитель сельскохозяйственных почв. Несмотря на многочисленные исследования, посвященные накоплению и толерантности к Cd у растений, отсутствует систематический анализ того, как различные физиолого-биохимические показатели реагируют на токсичность Cd, в частности, их индикативная роль в механизмах устойчивости растений.
Аннотация
В условиях теплицы был проведен вегетационный эксперимент для оценки различий в накоплении и толерантности к Cd у трех сортов рапса (Brassica napus L.) ('Hanyou 2', 'Hanyou 3' и 'Hanyou 16') при обработках CK (0,18 мг/кг в почве), T1 (2,18 мг/кг), T2 (4,18 мг/кг) и T3 (8,18 мг/кг). Все три сорта продемонстрировали высокие индексы толерантности (TI) и сильную устойчивость к Cd при воздействии концентрации Cd в почве 2,18 мг/кг (T1). Были выявлены значимые положительные корреляции между TI и содержанием хлорофилла a (Chla), хлорофилла b (Chlb), каротиноидов (Car), чистой скоростью фотосинтеза (Pn), скоростью транспирации (Tr), а также активностью антиоксидантных ферментов и неферментных антиоксидантов, таких как супероксиддисмутаза (SOD), аскорбатпероксидаза (APX), глутатион (GSH) и аскорбиновая кислота (ASA). В то же время наблюдалась отрицательная корреляция с межклеточной концентрацией CO₂ (Ci) и содержанием малонового диальдегида (MDA). Эти результаты подчеркивают значительную индикативную роль данных физиолого-биохимических показателей в выяснении механизмов толерантности к Cd у B. napus, и они могут быть использованы в селекционных программах для создания сортов с высокой устойчивостью к Cd, но низким уровнем его поглощения. Однако следует отметить, что данное исследование было проведено только в условиях вегетационного опыта. Полевые эксперименты могут быть более информативными в будущем.
1. Введение
Кадмий (Cd) — тяжёлый металл, обладающий высокой биотоксичностью, и даже при низких концентрациях экзогенный Cd, попавший в почву, легко усваивается растениями [ 1 ]. В настоящее время в разных регионах Китая наблюдается разная степень загрязнения тяжёлыми металлами. Среди них загрязнение почвы Cd является наиболее серьёзным. Cd — один из основных загрязнителей тяжёлыми металлами [ 2 ]. Деятельность человека является значительным источником загрязнения Cd, причём такие районы, как регионы добычи металлов и промышленные зоны, особенно сильно загрязнены кадмием [ 3 ]. В этих регионах Cd может попадать в сельскохозяйственные почвы через атмосферные осадки, реки, грунтовые воды и другими путями [ 4 ] и передаваться человеку через пищевую цепь, что приводит к ряду связанных с этим заболеваний. Это представляет серьёзную угрозу как для экосистемы, так и для здоровья населения [ 5 ]. Растения, растущие на почвах, загрязнённых Cd, также могут испытывать нарушения роста и развития, что влияет на их урожайность [ 6 , 7 ].
Во время цикла роста растений стресс, вызванный кадмием, может негативно влиять на различные фундаментальные функции растений на физиологическом и биохимическом уровнях [ 8 ]. С одной стороны, стресс, вызванный кадмием, может снижать фотосинтез растений, ингибируя синтез хлорофилла, повреждая фотосинтетические органы и вызывая выработку пигментов фотоингибирования. С другой стороны, стресс, вызванный кадмием, может приводить к дисбалансу активных форм кислорода (АФК), что может напрямую или косвенно вызывать повреждение растения, способствовать перекисному окислению липидов, повреждать клеточные мембраны и влиять на различные метаболические процессы в растении [ 9 , 10 ]. Чтобы защитить себя от АФК, растения используют антиоксидантную систему для борьбы с окислительным стрессом, вызванным кадмием. Антиоксидантная система включает в себя ферменты, такие как супероксиддисмутаза (СОД), каталаза (КАТ) и аскорбатпероксидаза (APX), а также неферментные антиоксиданты, такие как глутатион (GSH) и аскорбиновая кислота (ASA) [ 11 ]. Эти компоненты работают вместе, чтобы уменьшить избыток ROS в растении, тем самым минимизируя окислительное повреждение. Ci и др. [ 12 ] сообщили, что толерантные сорта пшеницы накапливали меньше Cd, а активность как SOD, так и CAT была выше в толерантной к Cd пшенице по сравнению с чувствительной к Cd пшеницей. Это указывает на важность этих ферментов для толерантности к Cd [ 13 ]. Для безопасного использования загрязненных Cd почв, использование растений-гипераккумуляторов Cd для рекультивации почвы и посадка безопасных для Cd культур в загрязненные Cd почвы являются двумя экологически чистыми методами с хорошим экономическим потенциалом [ 14 ]. Поэтому растения, используемые в загрязненных Cd почвах, должны иметь сильную толерантность к Cd [ 15 , 16 ]. Исследования показали, что рапс обладает относительно сильной толерантностью к кадмию, и его накопление кадмия выше, чем у других видов, что делает его идеальным растением для рекультивации загрязненных Cd почв [ 17 ].
Brassica napus L. семейства Brassicaceae — важная масличная культура, выращиваемая во всем мире. Она служит основным источником пищевого растительного масла, овощей, корма для животных, зеленого удобрения и биодизеля и широко культивируется в Китае. Ее также можно использовать в качестве зеленого удобрения или даже как декоративную культуру [ 18 ]. Устойчивость B. napus к кадмию зависит от ризосферной почвы и сорта B. napus [ 19 ]. Скрининг сортов B. napus на повышенную устойчивость к кадмию имеет решающее значение для улучшения роста на почвах, загрязненных кадмием. Ван и др. [ 20 ] выделили два высокоурожайных сорта B. napus ('72A' и '47') с низким накоплением кадмия. При выращивании на почвах, содержащих 1,57 мг кг⁻ 1 Cd, эти сорта накапливали менее 0,30 мг кг⁻ 1 Cd в своих семенах, что значительно ниже стандарта безопасности пищевых продуктов 0,50 мг кг⁻ 1. В то же время они также выделили три сорта B. napus ('Nanchongjie', 'Pengzhoubai' и 'J-25') с высоким содержанием биомассы и Cd. В целом, сорта B. napus с сильной толерантностью к Cd и высоким накоплением Cd могут быть использованы для рекультивации почв, загрязненных Cd, в то время как сорта с сильной толерантностью к Cd, но низким накоплением Cd подходят для выращивания сельскохозяйственных культур на загрязненных Cd почвах [ 21 ]. Однако исследований о связи между физиологическими характеристиками толерантности B. napus и Cd недостаточно , особенно среди его различных сортов [ 22 , 23 ]. Мы предположили, что устойчивость B. napus к кадмию будет обратно пропорционально коррелировать с концентрацией кадмия в листьях. Более того, мы предположили, что вызванное кадмием снижение роста будет происходить при снижении уровня активных форм кислорода (ROS) и снижении уровня СОД, КАТ и APX. Целью нашей работы было количественно оценить поглощение кадмия и активность ферментов B. napus в почве, содержащей кадмий в концентрации от 0,18 до 8,18 мг / кг .
2. Материалы и методы
2.1 Экспериментальные материалы и дизайн
Почва (желто-коричневая) была отобрана из пахотного слоя (0–20 см) опытного поля Технологического университета Шэньси. pH составил 6,5, общее содержание азота составило 1,71 г кг⁻¹ , содержание органического вещества составило 26,8 г кг⁻¹ , содержание доступного калия составило 17,3 мг кг⁻¹ , содержание доступного фосфора составило 16,8 мг кг⁻¹ , а содержание Cd составило 0,18 мг кг⁻¹ [ 24 ] . В соответствии с Национальным стандартом Китайской Народной Республики, в частности Стандартом качества окружающей среды почвы для контроля риска загрязнения почвы сельскохозяйственных угодий (испытание), почва была классифицирована как чистая [ 25 ]. Горшечный эксперимент был двухфакторным экспериментом (фактор a: обработка почвы с 4 градациями; фактор b: генотип с 3 градациями), с конечными концентрациями Cd в почве, составляющими 0,18 мг кг −1 (CK), 2,18 мг кг −1 (T1), 4,18 мг кг −1 (T2) и 8,18 мг кг −1 (T3). Реагент CdCl2 · 2,5 H2O высшей степени чистоты был добавлен к образцам почвы для получения целевых концентраций Cd, и конечные значения были подтверждены с помощью измерений [ 24 ]. Согласно общей ситуации с загрязнением Cd на полях Китая, почва в CK довольно чистая с низким уровнем загрязнения в T1, T2 и T3 сильно загрязнены. Градиент концентрации Cd в почвах может лучше отражать толерантность растений [ 24 ]. После двухмесячного периода уравновешивания семена разных сортов рапса высевали в 2 кг почвы на горшок при соответствующих обработках.
Сорта B. napus «Hanyou 2», «Hanyou 3» и «Hanyou 16» были предоставлены Ханьчжунским институтом сельскохозяйственных наук. Семена стерилизовали 5% раствором NaClO и замачивали в сверхчистой воде в течение 1 дня, затем высевали в лоток с субстратной почвой в условиях теплицы (25 °C, 15 000 люкс, 10/14 D/L) для ожидания прорастания. Рассаду пересаживали в почву, содержащую Cd, когда она прорастала с длиной корешка около 30 мм (одна неделя). В каждом горшке было высажено пять сеянцев. Горшки были расположены в случайном порядке блоками. Было три повторности каждого варианта обработки. Горшки поливали водопроводной водой для поддержания влагоудерживающей способности (WHC) на уровне 75% от влагоемкости поля. Средний цикл трёх сортов B. napus составлял 150 дней, а сбор растений производился на стадии проростков (65 дней, близкой к стадии активной вегетации без цветения) после пересадки. Образцы для измерения физико-биохимических показателей собирались в то же время. Для проведения исследований не было определённой фенологической фазы или периода сбора листьев.
2.2. Измерение образцов
2.2.1 Определение содержания Cd в биомассе
Образцы растений разделяли на корни и листья, тщательно промывали ультрачистой водой, высушивали в сушильном шкафу при температуре 105 °C в течение 5 минут, а затем при температуре 75 °C до достижения постоянного веса. Регистрировали сухой вес листьев и корней растений [ 24 ].
На основе биомассы был рассчитан индекс толерантности (ИТ) по уравнению (1) [ 19 ]:
Концентрацию Cd в растениях определяли в растворе для разложения с помощью атомно-абсорбционного спектрофотометра (Hitachi 180-80, Токио, Япония). Перед определением высушенные образцы растений измельчали в мелкий порошок. Разложение проводили смесью концентрированной азотной и хлорной кислот в соотношении 9:3. Контроль качества и оценку проводили с использованием стандартного образца GBW07405 (GSS-5) [ 24 ].
2.2.2 Определение содержания хлорофилла
Содержание хлорофилла определяли методом экстракции смесью этанола и ацетона [ 26 ]. Свежие, полностью развернувшиеся листья взвешивали и погружали в раствор ацетона и безводного этанола (1:1, об. / об. , Шанхай, Китай) в темноте на 24 часа. Поглощение измеряли при OD470, OD645 и OD663. Содержание хлорофилла а (Ch1a), хлорофилла b (Ch1b) и каротиноидов (Car) рассчитывали по методу Дая и др. [ 27 ].
2.2.3 Измерение параметров фотосинтеза
Измерения проводились с 9:00 до 11:00 утра при температуре около 20–25 °C, интенсивности освещения от 1200 до 2000 люкс и относительной влажности от 60 до 80%. Чистая скорость фотосинтеза (Pn), скорость транспирации (Tr) и межклеточная концентрация CO2 ( Ci) листьев B. napus измерялись с помощью портативного фотосинтезатора CI-340 (CID, Камас, штат Вашингтон, США) в соответствии с протоколами измерений [ 28 ].
2.2.4 Определение активности антиоксидантных ферментов
Для определения СОД, АПК и МДА был приготовлен ферментный раствор. Свежие листья B. napus (1 г) взвешивали и добавляли 5 мл предварительно охлажденного 50 мМ фосфатного буфера (pH = 7,8, Ханчжоу, Китай). Смесь измельчали на ледяной бане и доводили объем раствора до 10 мл. После центрифугирования при 12 000 g и температуре 4 °C в течение 20 минут надосадочную жидкость декантировали и сохраняли для анализа [ 24 ].
Определение активности СОД: 100 мкл раствора фермента смешивали с 2 мл 39 мМ метионина (Met, Шанхай, Китай), 2 мл 0,225 ммоль/л нитро-синего тетразолия (NBT, Нинбо, Китай), 1 мл 0,6 ммоль/л ЭДТА-Na2 (Гуанчжоу, Китай) и 1 мл 0,012 мМ рибофлавина (Ханьдань, Китай). Смесь хорошо встряхивали и помещали в искусственный инкубатор при 30 °C под флуоресцентной лампой 4000 люкс на 20 мин и останавливали в темноте; затем реакцию останавливали в темноте. Поглощение измеряли при OD560 с помощью УФ-спектрофотометра. Контролем, используемым для калибровки, была освещенная пробирка без раствора фермента, а обнуление проводили с использованием образца без освещения и без раствора фермента [ 29 ].
Определение активности APX: 100 мкл раствора фермента и 5 мкл раствора 9 мМ H2O2 ( Баодин, Китай) последовательно добавляли к 3 мл 50 мМ PBS (pH = 7,0, Ханчжоу, Китай) , содержащего 0,1 мМ EDTA-Na2 и 0,3 мМ ASA . Реакционный раствор смешивали до однородности и измеряли изменение поглощения с течением времени при OD290 с помощью УФ-спектрофотометра (Shimadzu, Киото, Япония). Активность APX образцов затем рассчитывали по формуле, описанной Чжаном и соавторами [ 30 ].
Определение содержания МДА: 2 мл раствора фермента смешивали с 2 мл 0,5% раствора тиобарбитуровой кислоты (растворенной в 10% трихлоруксусной кислоте (Цзыбо, Китай), Ухань, Китай). Реакционную смесь нагревали при 95 °C в течение 30 мин, быстро охлаждали и центрифугировали при 10 000× g в течение 10 мин. Поглощение измеряли при OD532, OD600 и OD450. Контроль готовили, заменяя раствор фермента 2 мл воды и добавляя раствор тиобарбитуровой кислоты. Содержание МДА рассчитывали по формуле, предоставленной Диндсой и Матове [ 31 ].
2.2.5 Определение неферментативных компонентов
Для определения восстановленного содержания GSH 0,2 г листьев B. napus измельчали с 10 мл предварительно охлажденного 5% раствора HPO₂ (Шанхай, Китай). Смесь центрифугировали при 4 °C в течение 10 мин. Полученный супернатант использовали в качестве раствора образца. Поглощение при OD412 измеряли методом DTNB (5,5′-дитиобис (2-нитробензойная кислота), Чжэньцзян, Китай) [ 28 ].
Для определения содержания АСК 0,2 мл исходного раствора смешивали с 1,4 мл 75 мМ раствора NaH₂PO₄ (pH = 7,4, Янчжоу, Китай). Затем к смеси добавляли 0,4 мл 10% HPO₂, 0,4 мл 44% H₂PO₄ (Куньмин, Китай), 0,4 мл 4% 2,2-дипиридина (Ухань, Китай) и 0,2 мл 3% FeCl₂ (Ланфан, Китай) и инкубировали при температуре 37 °C в течение 1 часа. После этого измеряли поглощение при OD525 и рассчитывали содержание АСК с помощью уравнения стандартной кривой [ 32 ].
2.3 Обработка данных и статистический анализ
Среднее значение, стандартное отклонение (SD) и цифры были рассчитаны или сгенерированы с использованием Microsoft Excel 2021 и Origin 2021. Статистическое программное обеспечение SPSS 27 использовалось для анализа значимости различий данных среди различных сортов и обработок методом LSD на уровнях p < 0,05, p < 0,01 или p < 0,001.
3. Результаты
3.1. Различия в накоплении и устойчивости к Cd трех сортов B. napus
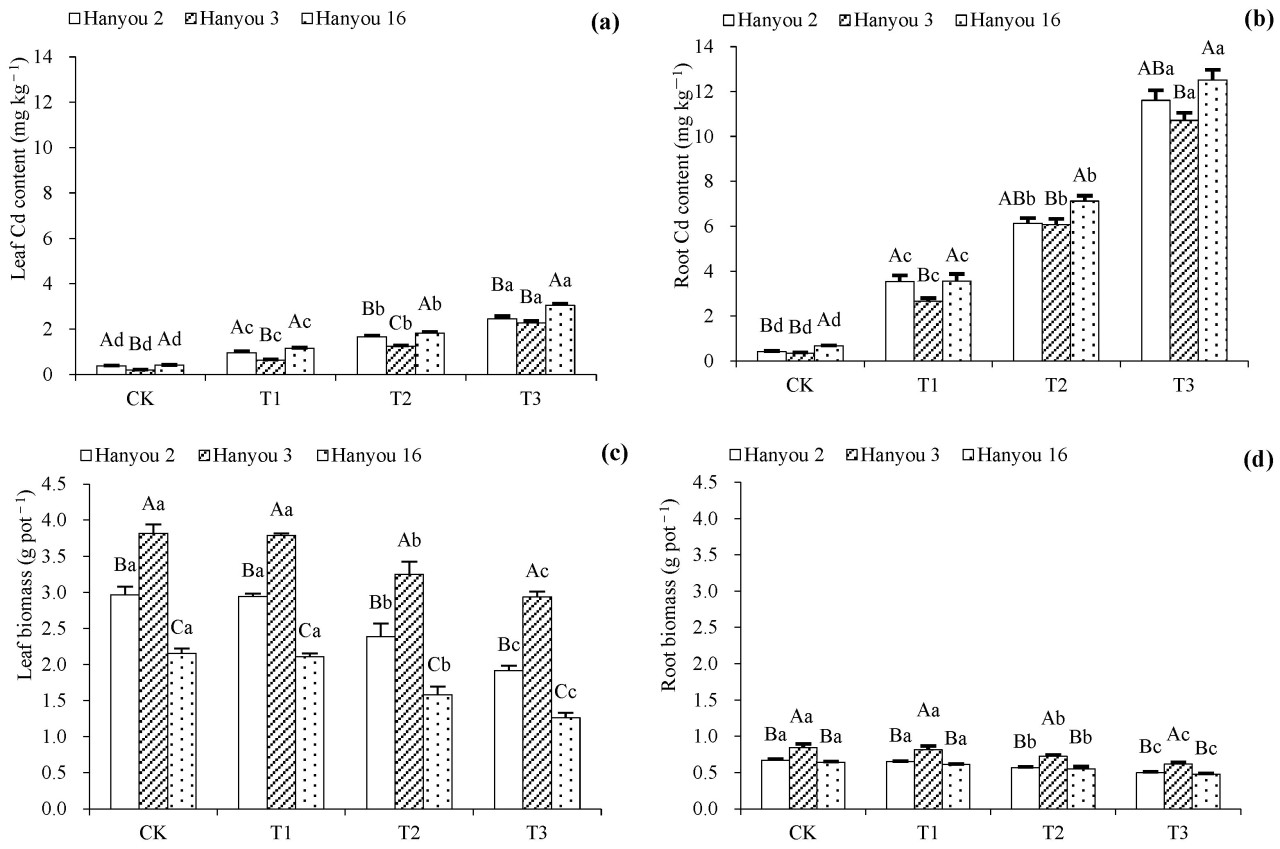
Как показано на рисунке 1 , от CK до T1-T3 концентрация Cd в листьях (a) и корнях (b) трех сортов B. napus значительно увеличилась ( p < 0,05), что указывает на значительную роль градиента концентрации Cd в почвах. При обработках T1–T3 уровни этого тяжелого металла в листьях трех сортов были значительно ниже, чем в корнях, но не было больших различий между листьями и корнями при обработке CK. Среди разных сортов концентрации Cd в листьях и корнях сортов Hayou 16 и Hanyou 2 были сопоставимы, но значительно выше, чем наблюдаемые у Hanyou 3 ( p < 0,05).
Рисунок 1. Содержание Cd в листьях ( a ), содержание Cd в корнях ( b ), биомасса листьев ( c ) и биомасса корней ( d ) трёх сортов B. napus . Различия в обозначениях заглавными буквами в столбцах между разными сортами указывают на существенные различия, а различия в обозначениях строчными буквами в разных вариантах обработки одного и того же сорта указывают на существенные различия при p < 0,05.
Биомасса листьев и корней трех изучаемых сортов B. napus в целом снижалась с увеличением концентрации Cd (от CK и T1 до T2 и T3) в почвах ( p < 0,05), как показано на рисунке 1 c, d. Биомасса листьев и корней в вариантах T2 и T3 была значительно ниже по сравнению с вариантом CK, тогда как в варианте T1 значительного снижения не наблюдалось ( p < 0,05). Были обнаружены значительные различия в биомассе листьев между сортами ( p < 0,05). Биомасса корней у сорта Hanyou 3 была значительно выше, чем у Hanyou 2 и Hanyou 16 ( p < 0,05). У сорта Hanyou 2 биомасса была выше, чем у Hanyou 16, а у Hanyou 3 в целом была самая высокая биомасса.
В таблице 1 представлены значения ИП трёх сортов B. napus . Как правило, ИП в вариантах T1 были самыми высокими и постепенно снижались от T2 к T3 ( p < 0,05). Различия в ИП между тремя сортами в варианте T1 были незначительными. Однако ИП сорта Hanyou 3 были, очевидно, самыми высокими в вариантах T2 и T3 (при этом Hanyou 2 находился посередине), что указывает на более высокую устойчивость сорта Hanyou 3 к кадмию.
Таблица 1. Индексы толерантности (ИТ) трех сортов B. napus .
3.2. Различия в содержании хлорофилла у трёх сортов B. napus
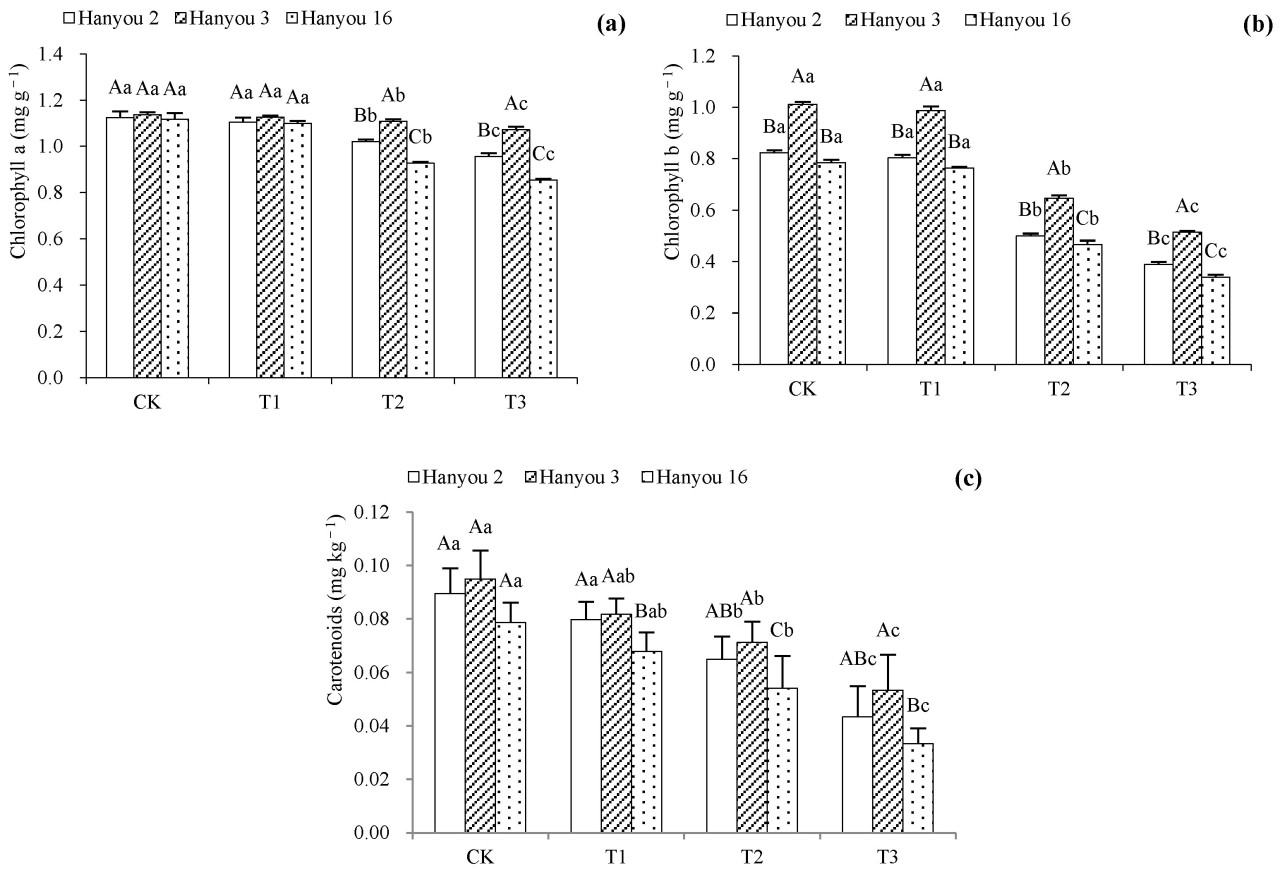
Содержание хлорофилла a (Chla), хлорофилла b (Chlb) и каротиноидов (Car) в трёх сортах B. napus постепенно снижалось с увеличением концентрации Cd (T1–T3) ( рисунок 2 ). Однако, по сравнению с CK, содержание Chla, Chlb и Car в варианте T1 снизилось незначительно ( p < 0,05). Среди сортов сорт Hanyou 3 стабильно содержал наибольшее количество Chla, Chlb и Car, за ним следовали Hanyou 2 и Hanyou 16.
Рисунок 2. Хлорофилл a ( a ), хлорофилл b ( b ) и каротиноиды ( c ) трёх сортов B. napus . Различия в названиях столбцов разных сортов указывают на существенные различия, а различия в названиях строчных букв в разных вариантах обработки одного и того же сорта указывают на существенные различия при p < 0,05.
3.3. Различия в параметрах фотосинтеза между тремя сортами B. napus
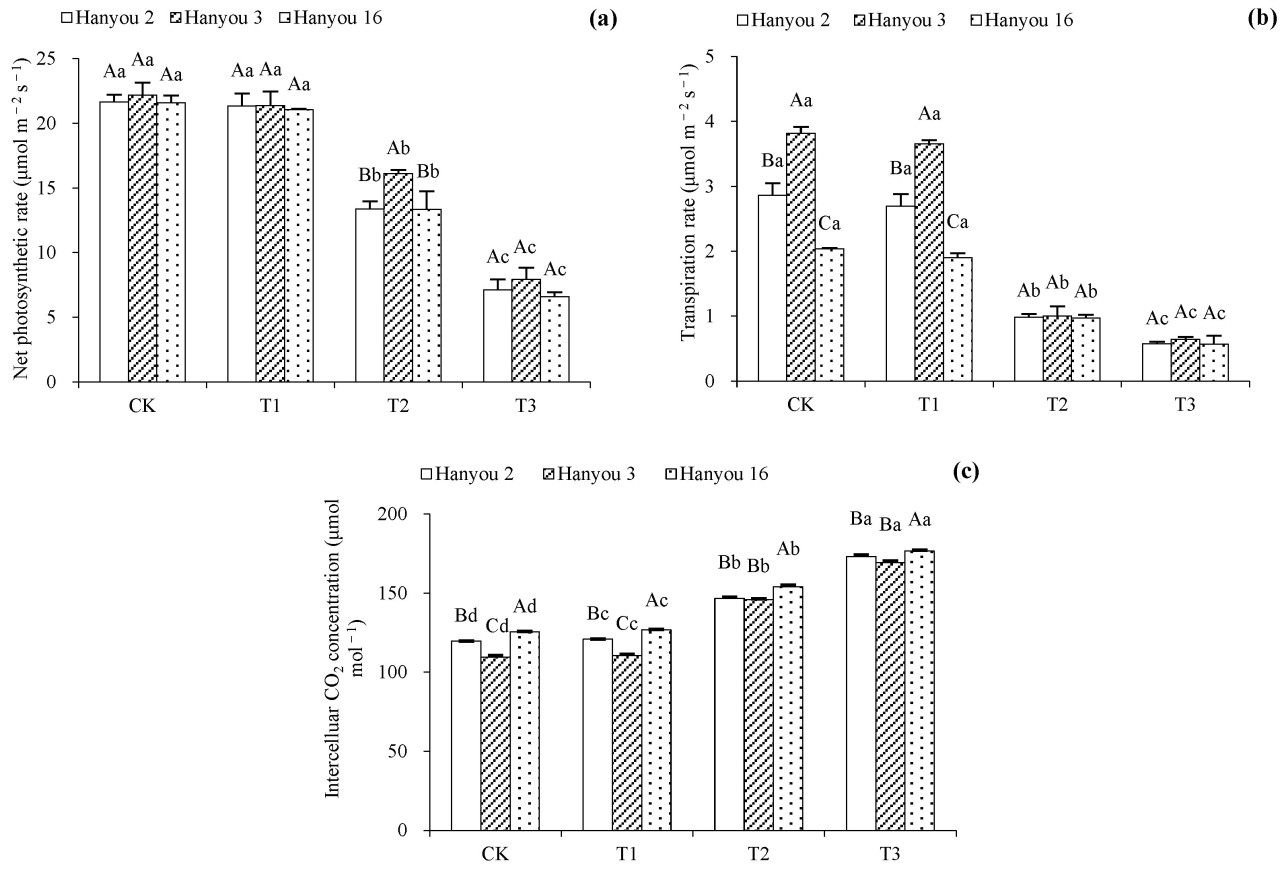
На рисунке 3а показано, что чистая скорость фотосинтеза (Pn) имела тенденцию к снижению с увеличением концентрации Cd. По сравнению с обработкой CK, значения Pn для трёх сортов не были существенно снижены в T1, но значительное снижение было зафиксировано в вариантах T2 и T3 ( p < 0,05). У сорта Hanyou 3 значения Pn были значительно выше, чем у Hanyou 2 и Hanyou 16 при обработке T2, но значимой разницы при обработке T3 не наблюдалось ( p < 0,05). Наибольшая Pn наблюдалась у сорта Hanyou 3, в то время как значения Hanyou 2 и Hanyou 16 были схожими.
Рисунок 3. Чистая скорость фотосинтеза ( a ), скорость транспирации ( b ) и межклеточная концентрация CO2 ( c ) трёх сортов B. napus . Различия в обозначениях заглавными буквами в столбцах между разными сортами указывают на существенные различия, а различия в обозначениях строчными буквами в разных вариантах одного сорта указывают на существенные различия при p < 0,05.
Скорость транспирации (Tr) имела аналогичную тенденцию к Pn ( рисунок 3b ). В варианте T1 не наблюдалось существенного снижения Tr по сравнению с вариантом CK, но выраженное снижение наблюдалось в вариантах T2 и T3 у всех трёх сортов ( p < 0,05). Tr сорта Hanyou 3 был самым высоким при вариантах CK и T1, тогда как существенных различий между тремя сортами при вариантах T2 и T3 не обнаружено ( p < 0,05).
Концентрация межклеточного CO2 ( Ci) продемонстрировала обратную тенденцию по сравнению с концентрацией Pn и Tr ( рисунок 3c ). Ci всех трёх сортов значительно увеличился при повышении концентрации Cd в почвах (T1–T3) ( p < 0,05). Среди сортов самые низкие значения Ci были у сорта Hanyou 3, тогда как более высокие, но схожие значения были получены для сортов Hanyou 2 и Hanyou 16 ( p < 0,05).
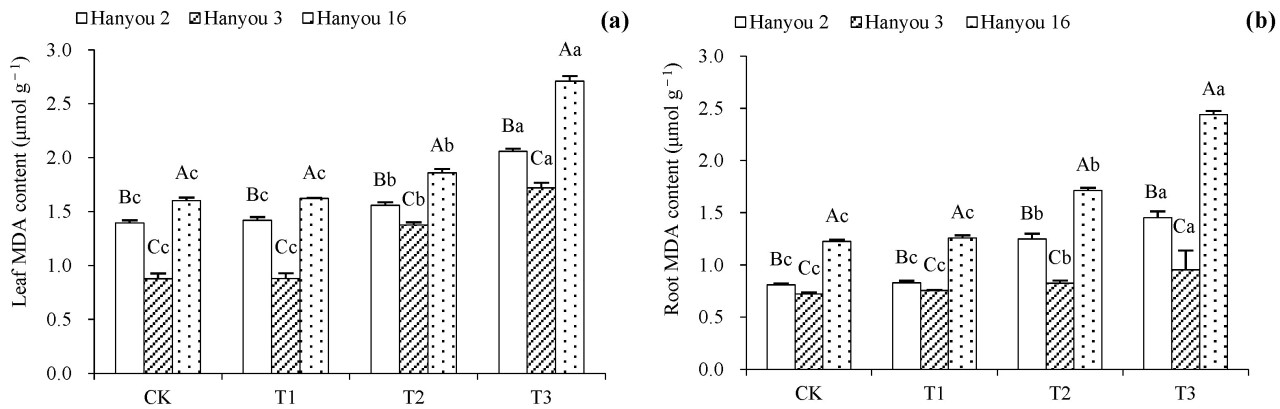
3.4. Различия в содержании МДА у трёх сортов B. napus
На рисунке 4 показано, что содержание МДА в листьях и корнях трёх сортов увеличивалось с ростом концентрации кадмия в почве. По сравнению с вариантом CK, содержание МДА в варианте T1 существенно не изменилось, тогда как в вариантах T2 и T3 наблюдалось значительное увеличение ( p < 0,05). Содержание МДА в сорте Hanyou 16 было самым высоким среди всех вариантов, а Hanyou 3 и Hanyou 2 заняли второе и третье места соответственно ( p < 0,05).
Рисунок 4. Содержание МДА в листьях ( а ) и содержание МДА в корнях ( б ) трех сортов B. napus (разные заглавные буквы в столбце между разными сортами указывают на существенные различия, а разные строчные буквы в разных обработках одного и того же сорта указывают на существенные различия при p < 0,05).
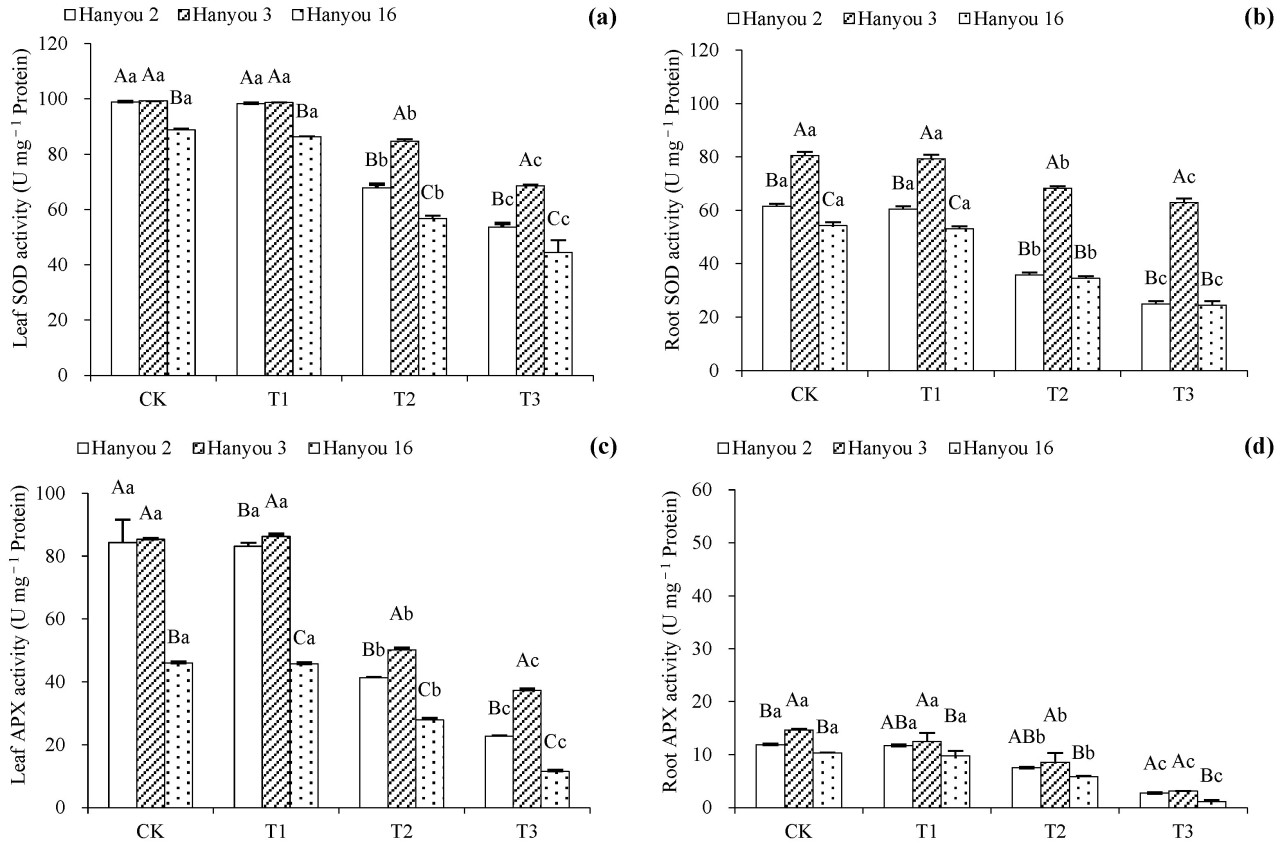
3.5. Различия в активности антиоксидантных ферментов у разных сортов B. napus
Активность СОД и АПКС в листьях и корнях трёх сортов следовала схожим тенденциям во всех вариантах обработки (CK, T1-T3; рисунок 5 ). По сравнению с обработкой CK, активность СОД и АПКС в листьях и корнях не была значительно снижена при обработке T1, но значительно снижена при обработке T2 и T3 ( p < 0,05). Среди сортов наибольшую активность СОД и АПКС как в листьях, так и в корнях продемонстрировал сорт Hanyou 3, за которым следовали Hanyou 2 и Hanyou 16 соответственно ( p < 0,05).
Рисунок 5. Активность СОД в листьях ( a ), активность СОД в корнях ( b ), активность APX в листьях ( c ) и активность APX в корнях ( d ) трёх сортов B. napus . Различия в обозначениях заглавными буквами в столбцах разных сортов указывают на существенные различия, а различия в обозначениях строчными буквами в разных вариантах обработки одного и того же сорта указывают на существенные различия при p < 0,05.
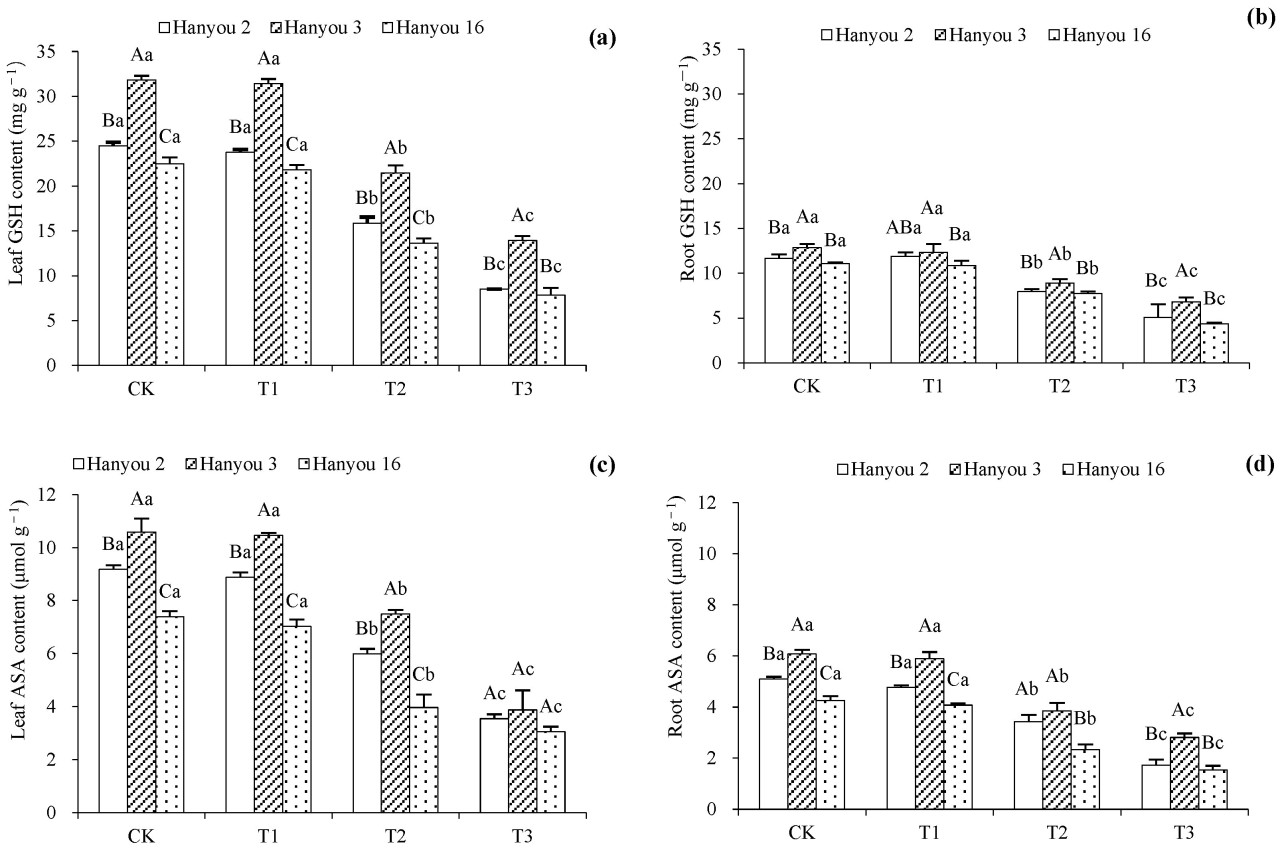
3.6. Неферментативные антиоксиданты в трёх сортах B. napus
Содержание GSH и ASA в листьях и корнях трёх сортов ( Рисунок 6 ) показало схожие тенденции с активностью SOD и APX ( Рисунок 5 ). Существенных различий в содержании GSH и ASA между обработками CK и T1 не выявлено; однако эти маркеры были значительно снижены в T2 и T3 по сравнению с обработкой CK ( p < 0,05). Самые высокие уровни GSH и ASA были у сорта Hanyou 3, за ним следовали Hanyou 2 и Hanyou 16 ( p < 0,05).
Рисунок 6. Содержание GSH в листьях ( a ), содержание GSH в корнях ( b ), содержание ацетилсалициловой кислоты в листьях ( c ) и содержание ацетилсалициловой кислоты в корнях ( d ) трёх сортов B. napus . Различия в обозначениях заглавными буквами в столбцах разных сортов указывают на существенные различия, а различия в обозначениях строчными буквами в разных вариантах обработки одного и того же сорта указывают на существенные различия при p < 0,05.
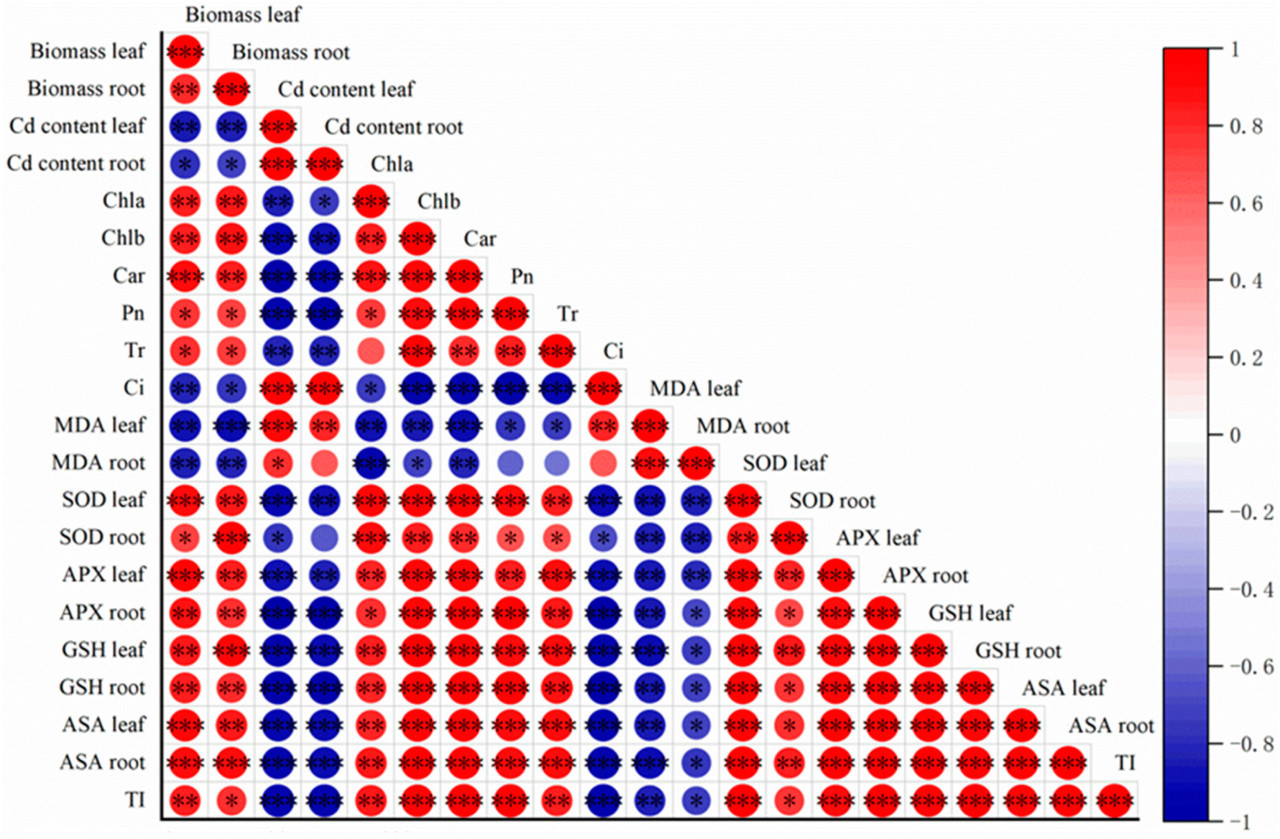
3.7. Корреляционный анализ Пирсона концентрации Cd и биомассы с физиологическими показателями трёх сортов B. napus
На рисунке 7 представлен корреляционный анализ Пирсона между индексом толерантности (TI), концентрацией кадмия, биомассой и физиологическими показателями трёх сортов во всех вариантах обработки. TI всех трёх сортов демонстрировал значимые положительные корреляции с показателями Chla, Chlb, Car, Tr, SOD, APX, GSH и ASA. Напротив, значимые отрицательные корреляции наблюдались с показателями Ci и MDA при p < 0,05, p < 0,01 или p < 0,001. Кроме того, TI значимым образом положительно коррелировал с биомассой листьев и корней ( p < 0,05 или p < 0,01 соответственно).
Содержание Cd в листьях и корнях показало значимую отрицательную корреляцию с их биомассой, Chla, Chlb, Car, Tr, SOD, APX, GSH, ASA и TI. Напротив, между Ci и MDA наблюдались значимые положительные корреляции ( p < 0,05, p < 0,01 или p < 0,001). Зависимость биомассы листьев и корней от содержания Cd и этих физиологических показателей следовала той же закономерности, что и для TI ( рисунок 7 ).
4. Обсуждение
Биомасса трех сортов в обработке T1 не была значительно снижена по сравнению с обработкой CK, и все они показали высокие индексы толерантности к кадмию, что указывает на то, что они были сортами, толерантными к кадмию в таких условиях [ 33 ]. Однако концентрация кадмия в листьях превысила предел загрязняющих веществ в пище (0,1 мг кг −1 , сырая масса) [ 34 ]. Поэтому их нельзя классифицировать как сорта с низким накоплением кадмия, когда концентрация кадмия в почве ниже 2 мг кг −1 (T1) [ 33 ]. В то время как Hanyou 3 показал самую высокую биомассу, все три сорта следовали аналогичной тенденции во всех обработках (T1–T3), то есть биомасса растений оставалась стабильной при T1, но значительно снизилась в условиях T2 и T3 по сравнению с обработкой CK ( рисунок 1 ), что указывает на толерантность к низким концентрациям кадмия (T1) [ 33 ]. Обработка TI более непосредственно отражала уровень толерантности, поскольку она показала положительную корреляцию с биомассой ( Рисунок 7 ).
Содержание хлорофилла, фотосинтез, дыхание и транспирация значительно подвержены влиянию стресса, вызванного кадмием. Фотосинтетические пигменты играют решающую роль в поглощении и передаче световой энергии во время фотосинтеза растений, а их уровни указывают на внешние стрессы [ 35 ]. При стрессе, вызванном кадмием, содержание хлорофилла a (Chla), хлорофилла b (Chlb) и каротиноидов (Car) в листьях Brassica и земляники значительно снижается, что приводит к заметному снижению чистой скорости фотосинтеза (Pn) и скорости транспирации (Tr), в то время как внутренняя концентрация CO2 ( Ci) увеличивается [ 23 , 36 ]. В этом исследовании по сравнению с CK, Pn, Tr, Chla, Chlb и Car трех сортов B. napus существенно не снизились в условиях T1, но значительно снизились в условиях T2 и T3. Напротив, Ci существенно не увеличился в условиях T1, но существенно увеличился в условиях T2 и T3 ( Рисунок 2 и Рисунок 3 ). Эти результаты согласуются с реакциями Robinia pseudoacacia и клещевины, которые показали сильную толерантность к Cd [ 37 , 38 ]. Cd влияет на фотосинтез, нарушая перенос электронов и повреждая целостность хлоропластов [ 39 ]. По мере увеличения концентрации Cd в растениях, содержание хлорофилла значительно снижается [ 40 ]. Помимо изменения структуры хлоропластов, стресс, вызванный Cd, снижает содержание хлорофилла, ингибируя экспрессию ключевых ферментов, участвующих в его синтезе. Тяжелые металлы, включая Cd, усиливают деградацию каротиноидов, увеличивая экспрессию деградирующих ферментов [ 41 ], а Cd также замещает Mg2⁺ в хлорофилле и Ca2⁺ в кластере Ca/Mn комплекса ФСII [ 42 ]. Ли и др. [ 43 ] предположили, что Ci является ключевым индикатором для различения устьичных и неустьичных ограничений. Когда Pn и Ci снижались одновременно, фотосинтез в первую очередь ограничивался устьицами. И наоборот, если Pn снижался, а Ci значительно увеличивался, ограничение фотосинтеза было неустьичным. В этом исследовании обработка Cd в различных концентрациях снижала Pn и увеличивала Ci у трех сортов B. napus . Это указывало на то, что ограничение фотосинтеза при стрессе Cd было вызвано неустьичными факторами, в первую очередь за счет повреждения фотосинтетического аппарата и ингибирования активности ферментов во время темновой реакции, тем самым снижая эффективность фотосинтеза.
Помимо влияния на фотосинтез, стресс, вызванный кадмием, значительно увеличивает содержание МДА в B. napus . В условиях T1, по сравнению с CK, содержание МДА этого сорта не показало значительного увеличения ( Рисунок 4 ), что указывает на определенный уровень толерантности к кадмию. Стресс, вызванный кадмием, может повреждать мембраны растительных клеток, увеличивая проницаемость клеточной мембраны, экстравазацию внутриклеточных растворимых веществ, разрушение внутриклеточных ферментов и метаболическое действие в исходной области. Содержание МДА отражает силу перекисного окисления липидов [ 44 ]. Повреждение клеточной мембраны может привести к нарушению баланса между мембраносвязанными ферментами и внутриклеточной мембраной, что позволяет большому количеству веществ экстравазироваться, а токсичным веществам свободно проникать в клетку, что приводит к ряду нарушений физиологических и биохимических процессов клетки [ 45 ]. Однако растения могут повысить свою толерантность к кадмию посредством стратегий избегания и детоксикации [ 46 ]. SOD, APX, GSH и ASA могут удалять активные формы кислорода из растений и уменьшать повреждение Cd путем регулирования антиоксидантной системы, что в некоторой степени указывает на толерантность к Cd [ 47 ]. В исследовании Чжана и соавторов [ 48 ] у устойчивого к Cd сорта клещевины Zibo No. 8 была более высокая активность GSH и SOD, чем у Zibo No. 5. В этом эксперименте активность антиоксидантных ферментов и неферментов сорта Hanyou 3, который проявил высокую толерантность к Cd в T1, была выше, чем у двух других сортов B. napus . Этот антиоксидантный ферментативный и неферментативный индексы Hanyou 3 при обработке T1 существенно не изменились по сравнению с CK, существенно положительно коррелировали с индексом толерантности к Cd и имели схожую толерантность к Cd. Это может быть реакцией растения, чтобы защитить себя от повреждения активными формами кислорода (АФК), запуская ряд сложных механизмов антиоксидантной ферментативной защиты, чтобы избежать или уменьшить окислительное повреждение, вызванное кадмием. Система ферментативной защиты включает антиоксидантные ферменты, такие как СОД и APX. СОД является важным защитным ферментом в ферментативной системе защиты от АФК в растениях, в то время как APX играет ключевую роль в поддержании сбалансированного окислительно-восстановительного состояния, повышая стабильность цикла GSH-ASA и поддерживая высокие уровни GSH и ASA для противодействия потенциальным проблемам, вызванным окислительным повреждением [ 49 ]. Эти физико-биохимические индексы играют показательную роль в реакции сортов B. napus на стресс Cd.
5. Выводы
Были обнаружены значительные различия в устойчивости к кадмию между сортами Hanyou 2, 3 и 16, которые показали высокие индексы устойчивости (TIs) и сильную устойчивость к кадмию при концентрации кадмия 2,18 мг кг −1 (T1) в почве. Среди них сорт Hanyou 3 продемонстрировал самый высокий индекс устойчивости (TI) и наименьшее снижение биомассы при стрессе, вызванном кадмием, что указывает на его превосходную адаптивность к загрязненной кадмием среде. Физиологические реакции сортов были тесно связаны с их устойчивостью к кадмию. Была обнаружена значительная положительная корреляция между TI и различными физиологическими показателями, включая содержание хлорофилла, чистую скорость фотосинтеза, скорость транспирации и активность антиоксидантных ферментов, что подчеркивает важность этих параметров в обеспечении устойчивости к кадмию. В частности, сорт Hanyou 3 показал более высокую активность SOD, APX, GSH и ASA, что указывает на мощную систему антиоксидантной защиты, которая способствует его повышенной устойчивости к кадмию. Исследование подчёркивает необходимость дальнейших генетических исследований для выявления специфических генов или генных сетей, ответственных за устойчивость к кадмию, особенно тех, которые влияют на активность антиоксидантных ферментов и синтез хлорофилла. Кроме того, эксперимент проводился только в вегетационных условиях. Учитывая, что взаимодействие растений с элементами может значительно отличаться от условий в полевых условиях, особенно в отношении накопления и концентрации кадмия в листьях, для дальнейшего подтверждения может потребоваться проведение полевого эксперимента.
Ссылки
1. Filippone, E.; Tranchida-Lombardo, V.; Vitiello, A.; Ruiu, F.; Di Salvatore, M.; Galise, T.R.; Laccetti, L.; Amoresano, A.; D’Ambrosio, G.; Frusciante, L.; et al. Evaluation of Cadmium Effects on Six Solanum melongena L. Cultivars from the Mediterranean Basin. Agriculture 2022, 12, 1059. [Google Scholar] [CrossRef]
2. Wu, Y.; Li, X.; Yu, L.; Wang, T.; Wang, J.; Liu, T. Review of Soil Heavy Metal Pollution in China: Spatial Distribution, Primary Sources, and Remediation Alternatives. Resour. Conserv. Recycl. 2022, 181, 106261. [Google Scholar] [CrossRef]
3. Shi, J.; Zhao, D.; Ren, F.; Huang, L. Spatiotemporal Variation of Soil Heavy Metals in China: The Pollution Status and Risk Assessment. Sci. Total Environ. 2023, 871, 161768. [Google Scholar] [CrossRef] [PubMed]
4. Yang, J.; Han, Z.Y.; Yan, Y.X.; Guo, G.H.; Wang, L.; Shi, H.D.; Liao, X.Y. Neglected Pathways of Heavy Metal Input into Agricultural Soil: Water–Land Migration of Heavy Metals Due to Flooding Events. Water Res. 2024, 267, 122469. [Google Scholar] [CrossRef] [PubMed]
5. Peng, J.Y.; Zhang, S.; Han, Y.Y.; Bate, B.; Ke, H.; Chen, Y.M. Soil Heavy Metal Pollution of Industrial Legacies in China and Health Risk Assessment. Sci. Total Environ. 2022, 816, 151632. [Google Scholar] [CrossRef] [PubMed]
6. Guo, Z.X.; Lv, J.L.; Zhang, H.M.; Hu, C.Y.; Qin, Y.; Dong, H.; Zhang, T.; Dong, X.X.; Du, N.S.; Piao, F.Z. Red and Blue Light Function Antagonistically to Regulate Cadmium Tolerance by Modulating the Photosynthesis, Antioxidant Defense System and Cd Uptake in Cucumber (Cucumis sativus L.). J. Hazard. Mater. 2022, 429, 128412. [Google Scholar] [CrossRef] [PubMed]
7. Ahmad, S.; Sehrish, A.K.; Alomrani, S.O.; Zhang, L.; Waseem, M.; Noureen, S.; Ullah, I.; Tabassam, R.; Abbas, G.; Ali, S. Combined Application of Biochar and Metal-Tolerant Bacteria Alleviates Cadmium Toxicity by Modulating the Antioxidant Defense Mechanism and Physicochemical Attributes in Rice (Oryza sativa L.) Grown in Cadmium-Contaminated Soil. Plant Stress 2024, 11, 100348. [Google Scholar] [CrossRef]
8. Wu, Z.M.; Tang, Q.M.; Wang, Y.F.; Qiu, C.S.; Long, S.H.; Zhao, X.L. Ramie (Boehmeria nivea) as Phytoremediation Crop for Heavy Metal-Contaminated Paddy Soil in Southern China: Variety Comparison, Cd Accumulation, and Assessment of Fiber Recycling. J. Nat. Fibers 2022, 19, 11078–11091. [Google Scholar] [CrossRef]
9. Lyčka, M.; Barták, M.; Helia, O.; Kopriva, S.; Moravcová, D.; Hájek, J.; Fojt, L.; Čmelík, R.; Fajkus, J.; Fojtová, M. Sulfate Supplementation Affects Nutrient and Photosynthetic Status of Arabidopsis thaliana and Nicotiana tabacum Differently under Prolonged Exposure to Cadmium. J. Hazard. Mater. 2023, 445, 130527. [Google Scholar] [CrossRef] [PubMed]
10. Shomali, A.; Das, S.; Sarraf, M.; Johnson, R.; Janeeshma, E.; Kumar, V.; Aliniaeifard, S.; Puthur, J.T.; Hasanuzzaman, M. Modulation of Plant Photosynthetic Processes during Metal and Metalloid Stress, and Strategies for Manipulating Photosynthesis-Related Traits. Plant Physiol. Biochem. 2024, 206, 108211. [Google Scholar] [CrossRef]
11. Fan, P.H.; Wu, L.W.; Wang, Q.; Wang, Y.; Luo, H.M.; Song, J.Y.; Yang, M.H.; Yao, H.; Chen, S.L. Physiological and Molecular Mechanisms of Medicinal Plants in Response to Cadmium Stress: Current Status and Future Perspective. J. Hazard. Mater. 2023, 450, 131008. [Google Scholar] [CrossRef] [PubMed]
12. Ci, D.W.; Jiang, D.; Dai, T.B.; Jing, Q.; Cao, W.X. Effects of Cadmium on Plant Growth and Physiological Traits in Contrast Wheat Recombinant Inbred Lines Differing in Cadmium Tolerance. Chemosphere 2009, 77, 1620–1625. [Google Scholar] [CrossRef]
13. Wu, X.W.; Tian, H.; Li, L.; Guan, C.Y.; Zhang, Z.H. Higher Cd-Accumulating Oilseed Rape Has Stronger Cd Tolerance Due to Stronger Cd Fixation in Pectin and Hemicellulose and Higher Cd Chelation. Environ. Pollut. 2021, 285, 117218. [Google Scholar] [CrossRef]
14. Sarker, A.; Masud, M.A.A.; Deepo, D.M.; Das, K.; Nandi, R.; Ansary, M.W.R.; Islam, A.R.M.T.; Islam, T. Biological and Green Remediation of Heavy Metal Contaminated Water and Soils: A State-of-the-Art Review. Chemosphere 2023, 332, 138861. [Google Scholar] [CrossRef]
15. Jinadasa, N.; Collins, D.; Holford, P.; Milham, P.J.; Conroy, J.P. Reactions to Cadmium Stress in a Cadmium-Tolerant Variety of Cabbage (Brassica oleracea L.): Is Cadmium Tolerance Necessarily Desirable in Food Crops? Environ. Sci. Pollut. Res. 2016, 23, 5296–5306. [Google Scholar] [CrossRef] [PubMed]
16. Ghuge, S.A.; Nikalje, G.C.; Kadam, U.S.; Suprasanna, P.; Hong, J.C. Comprehensive Mechanisms of Heavy Metal Toxicity in Plants, Detoxification, and Remediation. J. Hazard. Mater. 2023, 450, 131039. [Google Scholar] [CrossRef] [PubMed]
17. Rosca, M.; Cozma, P.; Minut, M.; Hlihor, R.-M.; Bețianu, C.; Diaconu, M.; Gavrilescu, M. New Evidence of Model Crop Brassica Napus L. in Soil Clean-Up: Comparison of Tolerance and Accumulation of Lead and Cadmium. Plants 2021, 10, 2051. [Google Scholar] [CrossRef] [PubMed]
18. Fu, D.H.; Jiang, L.Y.; Mason, A.S.; Xiao, M.L.; Zhu, L.R.; Li, L.Z.; Zhou, Q.H.; Shen, C.J.; Huang, C.H. Research Progress and Strategies for Multifunctional Rapeseed: A Case Study of China. J. Integr. Agric. 2016, 15, 1673–1684. [Google Scholar] [CrossRef]
19. Pan, W.; Lu, Q.; Xu, Q.R.; Zhang, R.R.; Li, H.Y.; Yang, Y.H.; Liu, H.J.; Du, S.T. Abscisic Acid-Generating Bacteria Can Reduce Cd Concentration in Pakchoi Grown in Cd-Contaminated Soil. Ecotoxicol. Environ. Saf. 2019, 177, 100–107. [Google Scholar] [CrossRef] [PubMed]
20. Wang, X.; Bai, J.Y.; Wang, J.; Le, S.; Wang, M.L.; Zhao, Y. Variations in Cadmium Accumulation and Distribution among Different Oilseed Rape Cultivars in Chengdu Plain in China. Environ. Sci. Pollut. Res. 2019, 26, 3415–3427. [Google Scholar] [CrossRef] [PubMed]
21. Zhang, Q.Y.; Wang, L.; Zhu, J.; Liu, Q.Q.; Zhao, F.H.; Liao, X.Y. Screening of Low-Cd-Accumulating and Cd-Remediating Oilseed Rape Varieties Using a Newly Indicator System for Risk Management of Cd-Contaminated Agricultural Land. Chemosphere 2024, 358, 142148. [Google Scholar] [CrossRef]
22. Zhang, F.G.; Xiao, X.; Wu, X.M. Physiological and Molecular Mechanism of Cadmium (Cd) Tolerance at Initial Growth Stage in Rapeseed (Brassica napus L.). Ecotoxicol. Environ. Saf. 2020, 197, 110613. [Google Scholar] [CrossRef] [PubMed]
23. Dhaliwal, S.S.; Sharma, V.; Kaur, J.; Shukla, A.K.; Singh, J.; Singh, P. Cadmium Phytoremediation Potential of Brassica Genotypes Grown in Cd Spiked Loamy Sand Soils: Accumulation and Tolerance. Chemosphere 2022, 302, 134842. [Google Scholar] [CrossRef] [PubMed]
24. Dai, H.P.; Wei, S.H.; Twardowska, I.; Hou, N.; Zhang, Q. Cosmopolitan Cadmium Hyperaccumulator Solanum nigrum: Exploring Cadmium Uptake, Transport and Physiological Mechanisms of Accumulation in Different Ecotypes as a Way of Enhancing Its Hyperaccumulative Capacity. J. Environ. Manag. 2022, 320, 115878. [Google Scholar] [CrossRef] [PubMed]
25. GB15618-2018; NSPRC-SEQS. National Standard of the People’s Republic of China: Soil Environmental Quality Standard for Soil Pollution Risk Control of Agricultural Land (Trial). Environmental Protection Agency Beijing: Beijing, China, 2018.
26. Kapoor, D.; Singh, M.P.; Kaur, S.; Bhardwaj, R.; Zheng, B.; Sharma, A. Modulation of the Functional Components of Growth, Photosynthesis, and Anti-Oxidant Stress Markers in Cadmium Exposed Brassica juncea L. Plants 2019, 8, 260. [Google Scholar] [CrossRef]
27. Dai, H.P.; Shan, C.J.; Zhao, H.; Li, J.C.; Jia, G.-L.; Jiang, H.; Wu, S.Q.; Wang, Q. The Difference in Antioxidant Capacity of Four Alfalfa Cultivars in Response to Zn. Ecotoxicol. Environ. Saf. 2015, 114, 312–317. [Google Scholar] [CrossRef] [PubMed]
28. Dai, H.P.; Wei, S.H.; Skuza, L.; Jia, G.L. Selenium Spiked in Soil Promoted Zinc Accumulation of Chinese Cabbage and Improved Its Antioxidant System and Lipid Peroxidation. Ecotoxicol. Environ. Saf. 2019, 180, 179–184. [Google Scholar] [CrossRef]
29. Chen, D.M.; Chen, D.Q.; Xue, R.R.; Long, J.; Lin, X.H.; Lin, Y.B.; Jia, L.H.; Zeng, R.S.; Song, Y.Y. Effects of Boron, Silicon and Their Interactions on Cadmium Accumulation and Toxicity in Rice Plants. J. Hazard. Mater. 2019, 367, 447–455. [Google Scholar] [CrossRef]
30. Zhang, W.E.; Pan, X.J.; Zhao, Q.; Zhao, T. Plant Growth, Antioxidative Enzyme, and Cadmium Tolerance Responses to Cadmium Stress in Canna orchioides. Hortic. Plant J. 2021, 7, 256–266. [Google Scholar] [CrossRef]
31. Dhindsa, R.S.; Matowe, W. Drought Tolerance in Two Mosses: Correlated with Enzymatic Defence Against Lipid Peroxidation. J. Exp. Bot. 1981, 32, 79–91. [Google Scholar] [CrossRef]
32. Jung, H.; Lee, B.-R.; Chae, M.-J.; Lee, E.-J.; Lee, T.-G.; Jung, G.-B.; Kim, M.-S.; Lee, J. Ascorbate-Mediated Modulation of Cadmium Stress Responses: Reactive Oxygen Species and Redox Status in Brassica napus. Front. Plant Sci. 2020, 11, 586547. [Google Scholar] [CrossRef] [PubMed]
33. Liu, W.T.; Liang, L.C.; Zhang, X.; Zhou, Q.X. Cultivar Variations in Cadmium and Lead Accumulation and Distribution among 30 Wheat (Triticum aestivum L.) Cultivars. Environ. Sci. Pollut. Res. 2015, 22, 8432–8441. [Google Scholar] [CrossRef]
34. GB 2762-2012; National Food Safety Standards—Limit of Pollutants in Food. Ministry of Health: Beijing, China, 2012.
35. Zhang, H.H.; Xu, Z.S.; Huo, Y.Z.; Guo, K.W.; Wang, Y.; He, G.Q.; Sun, H.W.; Li, M.B.; Li, X.; Xu, N.; et al. Overexpression of Trx CDSP32 Gene Promotes Chlorophyll Synthesis and Photosynthetic Electron Transfer and Alleviates Cadmium-Induced Photoinhibition of PSII and PSI in Tobacco Leaves. J. Hazard. Mater. 2020, 398, 122899. [Google Scholar] [CrossRef]
36. Saqib, M.; Shahzad, U.; Zulfiqar, F.; Tiwari, R.K.; Lal, M.K.; Naz, S.; Jahan, M.S.; Awan, Z.A.; El-Sheikh, M.A.; Altaf, M.A. Exogenous Melatonin Alleviates Cadmium-Induced Inhibition of Growth and Photosynthesis through Upregulating Antioxidant Defense System in Strawberry. S. Afr. J. Bot. 2023, 157, 10–18. [Google Scholar] [CrossRef]
37. Liu, C.F.; Guo, J.L.; Cui, Y.L.; Lü, T.F.; Zhang, X.H.; Shi, G.R. Effects of Cadmium and Salicylic Acid on Growth, Spectral Reflectance and Photosynthesis of Castor Bean Seedlings. Plant Soil 2011, 344, 131–141. [Google Scholar] [CrossRef]
38. Dezhban, A.; Shirvany, A.; Attarod, P.; Delshad, M.; Matinizadeh, M.; Khoshnevis, M. Cadmium and Lead Effects on Chlorophyll Fluorescence, Chlorophyll Pigments and Proline of Robinia pseudoacacia. J. For. Res. 2015, 26, 323–329. [Google Scholar] [CrossRef]
39. Chu, J.J.; Zhu, F.; Chen, X.Y.; Liang, H.Z.; Wang, R.J.; Wang, X.X.; Huang, X.H. Effects of Cadmium on Photosynthesis of Schima Superba Young Plant Detected by Chlorophyll Fluorescence. Environ. Sci. Pollut. Res. 2018, 25, 10679–10687. [Google Scholar] [CrossRef] [PubMed]
40. Huang, W.M.; Jin, Q.; Yin, L.Y.; Li, W. Responses of CO2-Concentrating Mechanisms and Photosynthetic Characteristics in Aquatic Plant Ottelia Alismoides Following Cadmium Stress under Low CO2. Ecotoxicol. Environ. Saf. 2020, 202, 110955. [Google Scholar] [CrossRef]
41. Chen, X.J.; Tao, H.F.; Wu, Y.Z.; Xu, X.M. Effects of Cadmium on Metabolism of Photosynthetic Pigment and Photosynthetic System in Lactuca sativa L. Revealed by Physiological and Proteomics Analysis. Sci. Hortic. 2022, 305, 111371. [Google Scholar] [CrossRef]
42. Rasafi, T.E.; Oukarroum, A.; Haddioui, A.; Song, H.; Kwon, E.E.; Bolan, N.; Tack, F.M.; Sebastian, A.; Prasad, M.N.V.; Rinklebe, J. Cadmium Stress in Plants: A Critical Review of the Effects, Mechanisms, and Tolerance Strategies. Crit. Rev. Environ. Sci. Technol. 2022, 52, 675–726. [Google Scholar] [CrossRef]
43. Li, S.L.; Yang, W.H.; Yang, T.T.; Chen, Y.; Ni, W.Z. Effects of Cadmium Stress on Leaf Chlorophyll Fluorescence and Photosynthesis of Elsholtzia argyi—A Cadmium Accumulating Plant. Int. J. Phytoremediat. 2015, 17, 85–92. [Google Scholar] [CrossRef] [PubMed]
44. Zhao, H.Y.; Guan, J.L.; Liang, Q.; Zhang, X.Y.; Hu, H.L.; Zhang, J. Effects of Cadmium Stress on Growth and Physiological Characteristics of Sassafras Seedlings. Sci. Rep. 2021, 11, 9913. [Google Scholar] [CrossRef]
45. Saeed, W.; Mubeen, S.; Pan, J.; Rehman, M.; Fang, W.Q.; Luo, D.J.; Liu, P.W.; Li, Y.; Chen, P. Integrated Physiological and Metabolomic Responses Reveal Mechanisms of Cd Tolerance and Detoxification in Kenaf (Hibiscus cannabinus L.) under Cd Stress. Front. Plant Sci. 2024, 15, 1332426. [Google Scholar] [CrossRef] [PubMed]
46. Su, H.X.; Zou, T.; Lin, R.Y.; Zheng, J.X.; Jian, S.G.; Zhang, M. Characterization of a Phytochelatin Synthase Gene from Ipomoea Pes-Caprae Involved in Cadmium Tolerance and Accumulation in Yeast and Plants. Plant Physiol. Biochem. 2020, 155, 743–755. [Google Scholar] [CrossRef]
47. Wen, K.; Li, X.G.; Huang, R.; Nian, H. Application of Exogenous Glutathione Decreases Chromium Translocation and Alleviates Its Toxicity in Soybean (Glycine max L.). Ecotoxicol. Environ. Saf. 2022, 234, 113405. [Google Scholar] [CrossRef] [PubMed]
48. Zhang, H.Z.; Guo, Q.J.; Yang, J.X.; Chen, T.B.; Zhu, G.X.; Peters, M.; Wei, R.F.; Tian, L.Y.; Wang, C.Y.; Tan, D.Y.; et al. Cadmium Accumulation and Tolerance of Two Castor Cultivars in Relation to Antioxidant Systems. J. Environ. Sci. 2014, 26, 2048–2055. [Google Scholar] [CrossRef]
49. Gill, S.S.; Tuteja, N. Reactive Oxygen Species and Antioxidant Machinery in Abiotic Stress Tolerance in Crop Plants. Plant Physiol. Biochem. 2010, 48, 909–930. [Google Scholar] [CrossRef] [PubMed]
Qiu Y, Wei S, Zhan J, Robinson BH, Skuza L, Xue J, Dai H, Zhan L, Tang Z. Physio-Biochemical Indexes as Indicators of Cadmium Tolerance in Brassica napus L. Cultivars. Agriculture. 2025; 15(2):132. https://doi.org/10.3390/agriculture15020132
Перевод статьи «Physio-Biochemical Indexes as Indicators of Cadmium Tolerance inBrassica napusL. Cultivars» авторов Qiu Y, Wei S, Zhan J, Robinson BH, Skuza L, Xue J, Dai H, Zhan L, Tang Z., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
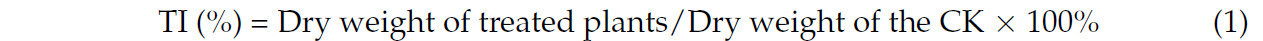

































































































Комментарии (0)