Стратегии выбора потенциально эффективных видов биофумигантов для достижения оптимальных результатов биофумигации
Почвенные патогены представляют угрозу для устойчивого сельского хозяйства, традиционно контролируемую химическими фумигантами, использование которых в настоящее время ограничено из-за экологических проблем и рисков для здоровья. В данном исследовании оценивается потенциал биофумигации видов семейства Капустные (Brassicaceae), а именно Brassica carinata A. Braun., Brassica juncea (L.) Czern., Raphanus sativus L. и Sinapis alba L., культивируемых в центральной Испании. Полевые испытания в течение двух вегетационных циклов оценивали продуктивность биомассы, концентрацию глюкозинолатов (GSL), перехват фотосинтетически активной радиации (ФАР) и эффективность её использования (ЭИР).
Аннотация
Продуктивность биомассы варьировала в зависимости от вида и даты отбора проб: S. alba и R. sativus превосходили другие виды в более коротких циклах, в то время как B. juncea и B. carinata продемонстрировали более эффективный профиль GSL в отношении контроля почвенных болезней, особенно по алифатическим глюкозинолатам, таким как синигрин. Результаты выделяют B. juncea и B. carinata как мощные биофумиганты благодаря их высокому уровню GSL, тогда как S. alba и R. sativus более пригодны для раннего производства биомассы. В исследовании также изучается индекс содержания хлорофилла (SPAD) как потенциальный полевой индикатор концентрации GSL, что предлагает практический подход для оптимизации сроков проведения биофумигации.
Полученные данные обосновывают выбор конкретных видов семейства Капустные, адаптированных к климатическим условиям и продолжительности вегетационных циклов, для эффективной биофумигации в рамках устойчивых сельскохозяйственных практик.
1. Введение
Заболевания, передающиеся через почву, представляют значительную угрозу для устойчивого сельскохозяйственного производства, в первую очередь влияя на урожайность и качество сельскохозяйственных культур из-за инфекций, вызываемых грибками, бактериями и нематодами. Традиционные меры борьбы часто основаны на химических фумигантах. Однако негативное воздействие на окружающую среду, опасность для здоровья, общественные опасения и разработка новых экологических стратегий, таких как «Стратегия от фермы до стола», существенно ограничили использование этих синтетических химических соединений. Эта растущая обеспокоенность стимулировала поиск устойчивых альтернатив, которые могут снизить количество и токсичность синтетических химикатов, применяемых на сельскохозяйственных полях, причем биофумигация становится особенно многообещающей стратегией [ 1 , 2 , 3 ].
Хотя некоторые покровные культуры обладают потенциалом подавлять почвенных вредителей и болезни с помощью нескольких механизмов, включая то, что они являются неплохим хозяином, что снижает численность вредителей и болезней из-за голодания, или задерживают культуры, на которых водятся вредители, но предотвращают их размножение [ 4 ], одним из наиболее эффективных механизмов является биофумигация.
Термин «биофумигация» был первоначально предложен Киркегардом и соавторами [ 5 ]. Хотя изначально биофумигация определялась как выращивание определённых растений, которые естественным образом производят биоактивные соединения с биоцидными свойствами, с последующим внесением растительных остатков в почву путём измельчения и быстрого перемешивания [ 3 , 6 , 7 ], в настоящее время она охватывает различные методы применения. К ним относятся посев покровных культур, заделка целых растений и использование изолированных растительных продуктов, таких как обезжиренная мука из семян промышленного производства или концентрированные аппликации растительных эфирных масел или дистиллированных эссенций [ 2 , 8 , 9 ].
Хотя различные виды и растительные остатки были исследованы на предмет биофумигации (например, Allium spp., Lavandula spp., Sorghum spp., Tagetes lucida Cav., Azadirachta indica A.Juss) [ 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 ], исследования показали, что растения семейства Brassicaceae являются одними из наиболее эффективных. Эти растения быстро растут и производят большое количество биомассы [ 17 , 18 ], а некоторые виды синтезируют высокие уровни глюкозинолатов (ГСЛ) в своих тканях.
Из-за высоких концентраций GSL виды таких родов, как Brassica , Raphanus , Sinapis и Eruca , наиболее часто используются для биофумигации [ 16 , 19 , 20 , 21 ]. Глюкозинолаты — это вторичные метаболиты, обнаруженные в некоторых растениях (например, семейства Brassicaceae ,Capparidaceae , Tropaeolaceae , Moringaceae и Amaryllidaceae ) [ 7 , 22 ]. Они состоят из N-гидроксисульфатов β-тиоглюкозида (общая функциональная группа) с боковой группой (R — вариабельная боковая цепь агликона, полученная из одной из восьми природных аминокислот) и связанной с серой β-d-глюкопиранозной группой [ 23 ]. Группа R сохраняется в полученных изотиоцианатах (ИТЦ), влияя на их биоцидную активность [ 24 , 25 ].
Разложение тканей капусты и ферментативный гидролиз ГСЛ мирозиназой приводят к образованию токсичных ИТК, а также других соединений, таких как тиоцианат, нитрилы, органические цианиды, метилсульфид, диметилсульфид и метантиол, образующихся в результате различных химических реакций. Хотя эти дополнительные соединения обычно менее токсичны, чем изотиоцианаты, они часто присутствуют в больших количествах и также могут способствовать биофумигации [ 26 , 27 , 28 ]. Среди этих соединений ИТК, в частности, высокоэффективны для борьбы с болезнями благодаря своему широкому спектру антимикробных свойств [ 20 , 26 , 28 , 29 ].
Как правило, самые высокие концентрации ГСЛ обнаруживаются в семенах, а затем в надземных и подземных тканях [ 19 , 30 , 31 ]. Концентрация глюкозинолатов в семенах обычно в 8–10 раз выше, чем в других частях растения [ 8 ], хотя она варьируется в зависимости от стадии роста, окружающей среды и взаимодействия видов [ 30 , 31 ].
Для эффективной дезинфекции почвы методом биофумигации необходимы высокие концентрации ИТК. Например, стерилизация почвы рассчитывается при эффективных значениях от 517 до 1294 мкмоль/г почвы метилизотиоцианата [ 32 ]. Однако более низкие концентрации ИТК в почве (<1 мкмоль/г почвы бензила, 150 мкмоль/г почвы аллила или 182 мкмоль/г почвы метилизотиоцианата) достаточны для борьбы с большинством вредителей и почвенных болезней, таких как Folsomia fimetaria , Verticillium dahliae или личинки Otiorhynchus sulcatus (F.) [ 33 , 34 , 35 ]. Важно отметить, что, хотя биофумигация направлена на борьбу с болезнями, она достигается за счёт использования целевых доз глюкозинолатов, которые высвобождают ИТК без необходимости полной стерилизации почвы. Это соответствует цели сохранения биоразнообразия почвы и экосистемных услуг, которые она обеспечивает, в соответствии с политикой ЕС, способствующей устойчивому развитию сельского хозяйства. Таким образом, хотя концентрация ГСЛ в растениях имеет решающее значение для успеха биофумигации, ключевым фактором является контролируемое высвобождение ИТК в почву, что позволяет эффективно подавлять болезни, сохраняя при этом экологический баланс [ 36 ].
Биофумигация имеет ряд потенциальных преимуществ: она не только представляет собой натуральную альтернативу синтетическим фумигантам с пониженным риском для окружающей среды и здоровья человека, но и предлагает широкий спектр биоактивных химических веществ, к которым почвенные заболевания могут быть не адаптированы. Биофумигация обогащает почву органическими веществами, улучшая ее структуру и здоровье за счет предотвращения эрозии, повышая доступность питательных веществ, снижая вымывание азота, стимулируя полезные или подавляющие патогены микробные сообщества и подавляя рост сорняков, что потенциально снижает затраты производителей [ 2 , 16 , 24 ].
Несколько исследований показали, что эффективность биофумигации связана с концентрацией GSL в тканях, а также, особенно, со способностью каждого вида накапливать биомассу [ 37 , 38 ]. В свою очередь, способность видов накапливать биомассу зависит от их способности перехватывать и использовать фотосинтетически активную радиацию (ФАР), а также от их RUE [ 18 ].
Несколько исследований показали, что накопление биомассы R. sativus и S. alba больше, чем у других покровных культур [ 17 , 18 ]. Эти виды могут достигать 115,8 г/м² и 138,2 г/м² сухого вещества биомассы, соответственно, в летне-осенние циклы в условиях дефицита воды в Центральной Богемии [ 18 ] и 480 г/м² и 452 г/м² сухого вещества биомассы, соответственно, в летне-осенние циклы в условиях Северной Европы (Нидерланды и Германия) [ 18 ]. Эти результаты демонстрируют высокую приспособляемость и потенциал роста этих видов.
В целом, такое поведение обусловлено высоким улавливанием PAR этих видов (от 520 до 559 МДж/м 2 в условиях Северной Европы), а не высоким RUE [ 17 , 18 , 39 ].
Хотя Арно и др. [ 15 ] показали, что RUE крестоцветных ( R. sativus , 0,8 г/МДж или S. alba , 0,85 г/МДж) были ниже, чем у других покровных культур, таких как Avena strigosa Schreb. (1,18 г/МДж), при оптимальных условиях (внесение азота и плотность посадки) B. napus может демонстрировать высокий RUE (1,33 г/МДж) [ 39 ].
Целью данного исследования является оценка потенциала видов биофумигантов для использования в экстенсивных садовых культурах в центральной Испании. В частности, исследование направлено на выявление видов, которые не только обладают высоким содержанием биоактивных ГСЛ, но и демонстрируют эффективную адаптацию к климатическим условиям и циклам возделывания региона. Оценивая эти виды с точки зрения производства биомассы, концентрации ГСЛ и сезонных колебаний, данное исследование стремится оптимизировать методы биофумигации, которые могут быть интегрированы в местные системы севооборота и управления культурами.
2. Материалы и методы
2.1 Местоположение и почвенно-климатические условия
Испытание проводилось на экспериментальных полях Мадридского политехнического университета (ETSIAAB) в течение сельскохозяйственных циклов 2022–2023 и 2023–2024 годов, далее именуемых первым и вторым циклами соответственно. Почва на экспериментальном участке имеет супесчаный гранулометрический состав с щелочным pH 7,8 и низким содержанием органических веществ (1,2%). Соотношение углерода к азоту (C/N) составляет 8, а электропроводность (EC), измеренная в вытяжке 1:5, составляет 0,16 дСм/м. На основании анализов, проведенных на четырех образцах почвы, по одному на опытный блок, отобранных из горизонтов 0–30 см и 30–60 см, были обнаружены высокие уровни кальция (Ca ≥ 2500 мг/кг), магния (Mg ≥ 250 мг/кг), калия (K ≥ 300 мг/кг) и фосфора (P ≥ 60 мг/кг).
Согласно классификации Кёппена, климат региона умеренный с сухим или жарким летом (Csa), со среднегодовым количеством осадков 379 мм и среднегодовой температурой 14,6 °C (Кастилия-Ла-Манча, т.е. Толедо, Сьюдад-Реаль, Альбасете). Согласно классификации ЮНЕСКО-ФАО, климат на месте проведения испытаний (Мадрид) описывается как «умеренный климат с мягкой зимой, засушливый, смягченный термосредиземноморский», со среднегодовым количеством осадков 421 мм и среднегодовой температурой 15,1 °C.
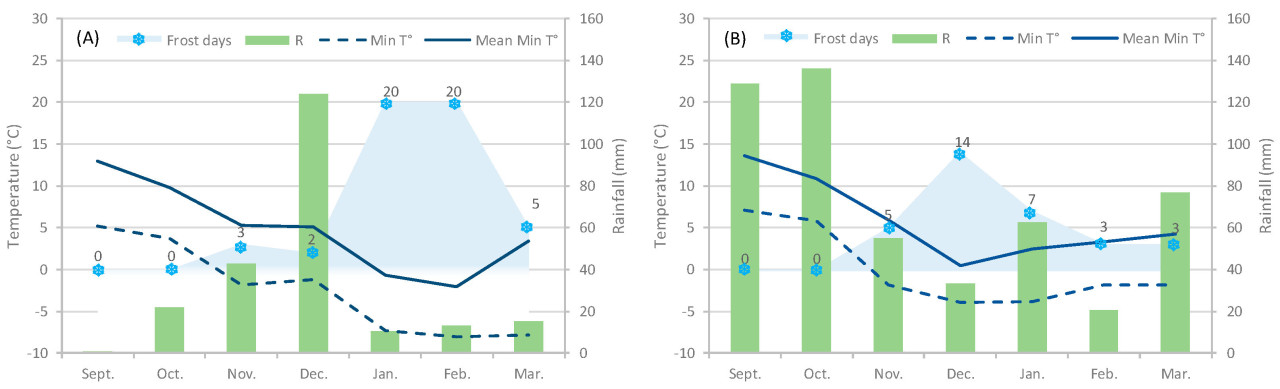
Погодные условия в 2022 и 2023 годах с точки зрения температурного режима и режима осадков существенно различались: в 2022 году была очень сухая осень и холодная зима с продолжительным морозным периодом, тогда как 2023 год характеризовался обильными осадками осенью и мягкой зимой ( рисунок 1 ).
Рисунок 1. Метеорологические данные за вегетационные периоды 2022–2023 гг. ( A ) и 2023–2024 гг. ( B ). Морозные дни: дни в месяце, когда минимальная температура была ниже 0 °C; R: количество осадков; Min T°: минимальная температура; Mean Min T°: средняя минимальная температура.
2.2 Экспериментальный дизайн
Эксперимент был разработан по рандомизированной схеме с четырьмя повторностями, при этом основным фактором был вид биофумиганта. Были включены четыре вида: Brassica carinata A.Braun (сорт Eleven), Brassica juncea L. (сорт Scala), Raphanus sativus L. (сорт Córdoba) и Sinapis alba L. (сорт Venice). Каждая элементарная делянка имела длину 10 м и ширину 3,6 м, общая площадь – 36 м² .
Посев состоялся 22 сентября 2022 года и 29 сентября 2023 года с использованием экспериментальной сеялки шириной 1,2 м. Нормы высева составили 12,5 кг/га для B. carinata и B. juncea и 25 кг/га для R. sativus и S. alba . Для стимулирования прорастания в 2022 году было применено два экстренных полива по 15 мм каждый в конце сентября и начале октября. В 2023 году количество осадков за тот же период было достаточным для обеспечения хорошей всхожести, со скоростью всхожести 75–80% для всех видов, кроме B. juncea , у которой скорость составила 32%. Учитывая этот низкий показатель, были проведены испытания на всхожесть и жизнеспособность (тетразолиевый тест), подтвердившие, что низкая всхожесть была обусловлена не качеством семян, а внутренними характеристиками вида. Минеральное удобрение в обоих циклах выращивания заключалось в внесении перед посевом 400 кг/га комплексного удобрения NPK (S) 15-15-15 (13).
2.3 Аналитические определения
На каждом элементарном участке оценивались различные параметры на протяжении всего цикла роста видов биофумиганта, уделяя особое внимание образованию и распределению биомассы, а также физиологическому развитию растений. Были определены следующие параметры:
Производство биомассы: общая биомасса была количественно определена, разделяя надземную часть и корни, на разных этапах цикла. Для этого площадь 0,5 м2 ( 1 м × 0,5 м) с каждой элементарной делянки была вручную собрана в следующие даты: 23 января и 27 марта 2023 года (через 123 и 186 дней после посева (das) соответственно) и 11 декабря 2023 года и 29 января 2024 года (через 73 и 122 das соответственно). После извлечения растений корни были отделены от надземной части для всех растений, и свежая биомасса была измерена как для корней, так и для надземной части. Затем была отобрана подвыборка из трех репрезентативных растений, и содержание сухого вещества в корневой и надземной биомассе было определено отдельно после сушки в сушильном шкафу с принудительной циркуляцией воздуха при температуре 65 °C до достижения постоянного веса. Применяя содержание сухого вещества в корневых и надземных тканях к их соответствующей свежей биомассе, были получены сухая биомасса корней (RDB) и сухая надземная биомасса (ADB), сумма этих значений представляла собой общую сухую биомассу (TDB).
Экстракция, очистка, десульфатация и анализ глюкозинолатов были проведены Институтом устойчивого сельского хозяйства (IAS-CSIC) в соответствии со стандартом ISO (1992) с некоторыми изменениями. 50 мг измельченного порошка помещали в две пробирки объемом 10 мл, в которые добавляли 1,5 мл 70% метанола и 100 мкл глюкотропеолина (5 мМ и 20 мМ соответственно) в качестве внутренних стандартов (категория 89216; PhytoLab GmbH & Co. KG, Вестенбергсгройт, Германия). Пробирки выдерживали на водяной бане при 80 °C для экстракции ГСЛ. Через 20 минут при комнатной температуре пробирки центрифугировали при 3600 об/мин в течение 20 минут, а супернатанты сохраняли для анализа.
Для очистки GSL были подготовлены 96-луночные фильтр-планшеты с ионообменной смолой A25 DEAE Sephadex с использованием многофункционального колоночного загрузчика Millipore. В каждую лунку добавляли по 150 мкл 60% метанола. Через час жидкость удаляли вакуумным насосом. В каждую лунку переносили по 300 мкл супернатанта образца, и жидкость снова удаляли вакуумным насосом. После этого лунки дважды промывали 150 мкл 60% метанола и дважды водой.
Для ферментативной десульфатации ГСЛ в каждую лунку добавляли по 10 мкл воды и 10 мкл раствора сульфатазы, после чего планшеты оставляли на ночь при комнатной температуре. Десульфоглюкозинолаты элюировали, дважды промывая 100 мкл 60% метанола и дважды водой. Полученные образцы, содержащие десульфоглюкозинолаты, хранили при температуре -20 °C до анализа методом ВЭЖХ.
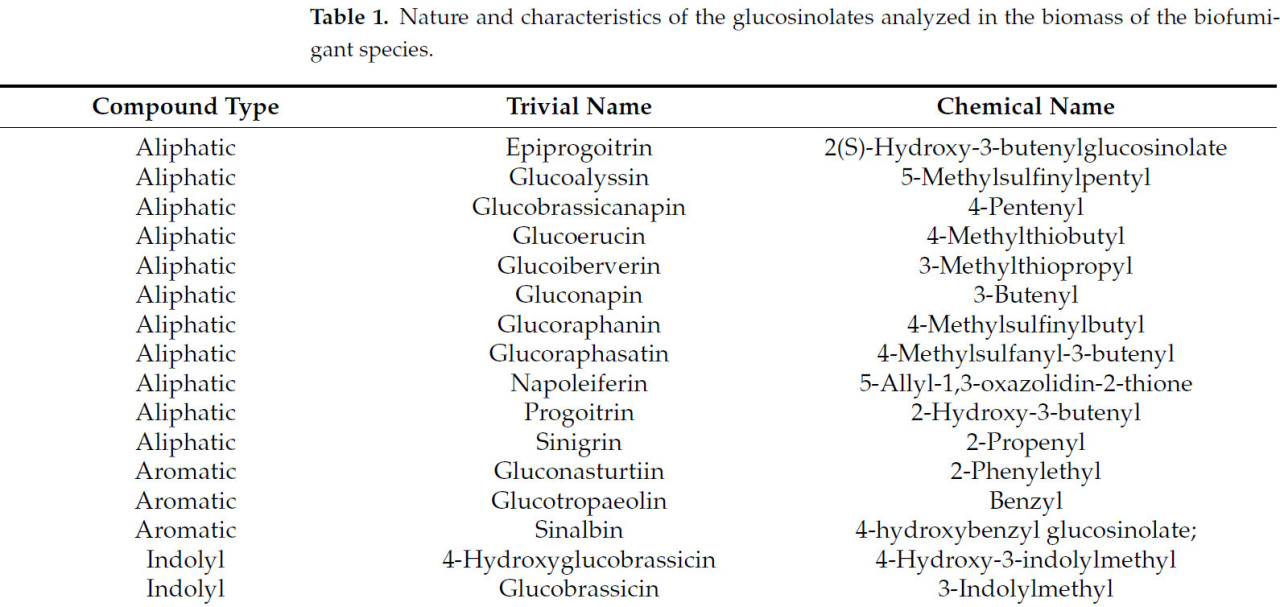
Система ВЭЖХ включала бинарный насос Waters 1525, УФ/видимый детектор Waters 2489, настроенный на 229 нм, и автосэмплер Waters 2707 (Waters Corporation, Милфорд, Массачусетс, США). Использовалась колонка Kinetex C18 размером 250 × 4,6 мм, внутренним диаметром 100 Å и размером частиц 5 мкм (Phenomenex, Торранс, Калифорния, США). Анализ ВЭЖХ проводился с использованием воды (растворитель A) и 20% ацетонитрила (растворитель B) в качестве элюентов со следующим градиентом: 2 мин растворитель B при 0%, 23 мин увеличение растворителя B до 100%, 5 мин снижение растворителя B до 0% и 5 мин поддержание растворителя B при 0% при скорости потока 1 мл/мин и температуре печи 40 °C. Качество воды поддерживалось на уровне 18,2 МОм с помощью прибора Milli-Q Direct Water (Merck Millipore, Дармштадт, Германия) на всех этапах анализа. Количественное определение десульфоглюкозинолатов проводилось с использованием коэффициентов чувствительности, ранее указанных в стандарте ISO 9167 [ 40 ] и в работе Yi et al. (2016) [ 41 ] для GSL, не включённых в стандарт ISO. Проанализированные GSL представлены в таблице 1 .
Таблица1. Природа и характеристики глюкозинолатов, проанализированных в биомассе видов биофумигантов.
Доля фотосинтетически активной радиации (ФАР), перехваченной пологом (fIPAR), рассчитывалась как отношение перехваченной ФАР (падающая ФАР — прошедшая ФАР) к падающей ФАР, измеренной в солнечный полдень в каждую дату отбора проб, всегда при ясном небе. На основе значений fIPAR расчет ФАР, перехваченной культурой от посева до каждой даты отбора проб биомассы, был разделен на столько подпериодов, сколько было измерений fIPAR. Значение перехваченной ФАР для каждого подпериода рассчитывалось путем умножения падающей ФАР для этого подпериода (ежедневные данные о падающей ФАР были получены с метеорологической станции, расположенной вблизи места проведения испытаний) на среднее арифметическое значений fIPAR, определенных в начале и в конце этого подпериода.
В свою очередь, RUE рассчитывался как среднее значение RUE за период между датой посева и каждой из двух дат отбора проб биомассы для вида биофумиганта. Этот показатель определялся как отношение TDB (в г сухого вещества/м² ) к количеству ФАР, перехваченной пологом (в МДж/м² ) за тот же период. Таким образом, RUE (в г сухого вещества/МДж) выражает эффективность преобразования растениями поглощенной радиации в биомассу.
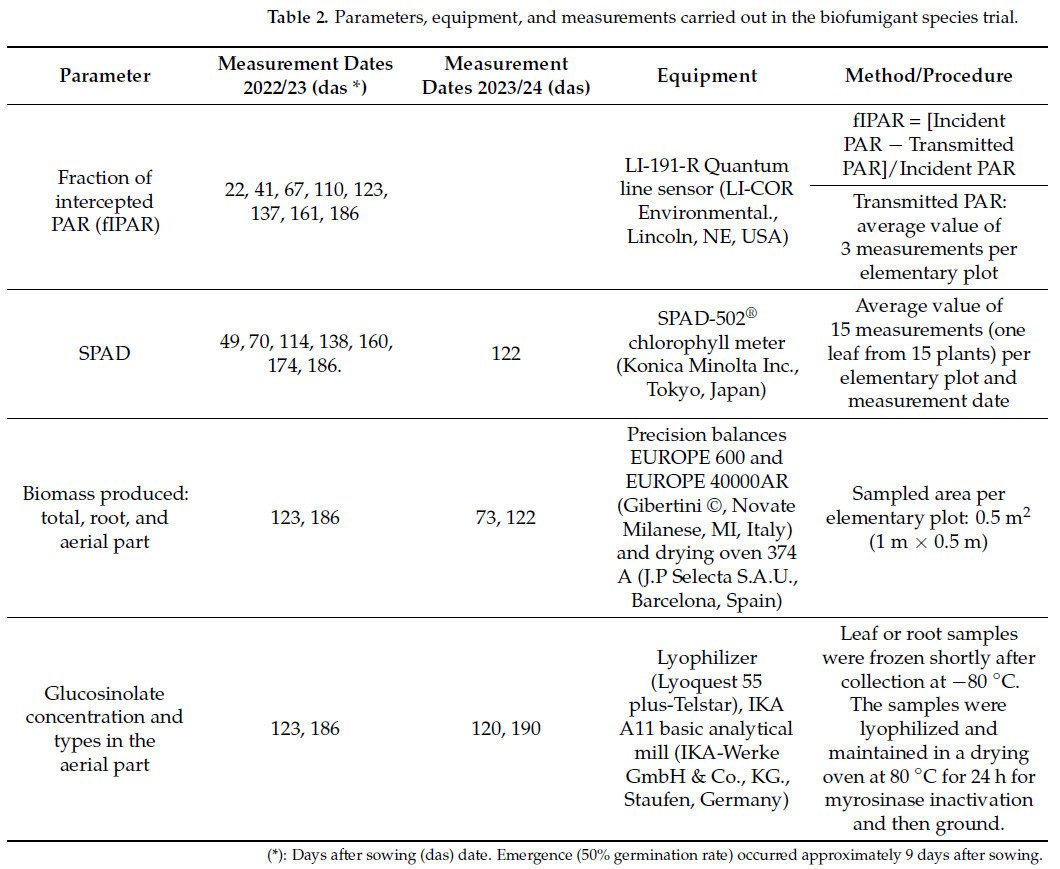
Содержание хлорофилла в листьях видов-биофумигантов измерялось с помощью измерителя SPAD на различных этапах роста для оценки состояния питания растений. В каждый день отбора проб проводилось 15 измерений на каждой элементарной делянке (по одному листу на растение из 15) ( таблица 2 ).
Таблица 2. Параметры, оборудование и измерения, проведенные в ходе испытания видов биофумиганта.
2.4 Статистический анализ
Дисперсионный анализ биомассы, fIPAR, RUE, SPAD и концентрации GSL проводился с использованием теста наименьшей значимой разницы Фишера (LSD) с достоверностью 95,0%. Тестирование проводилось с использованием статистического пакета STATGRAPHICS Centurion XVIII (StatPoint, Inc., Херндон, Вирджиния, США). Для оценки корреляции между различными оцениваемыми параметрами простой регрессионный анализ был скорректирован с использованием нелинейной обратной X-модели, поскольку она показала наибольшее значение r² .
3. Результаты
3.1. Агрономические показатели и производство биомассы
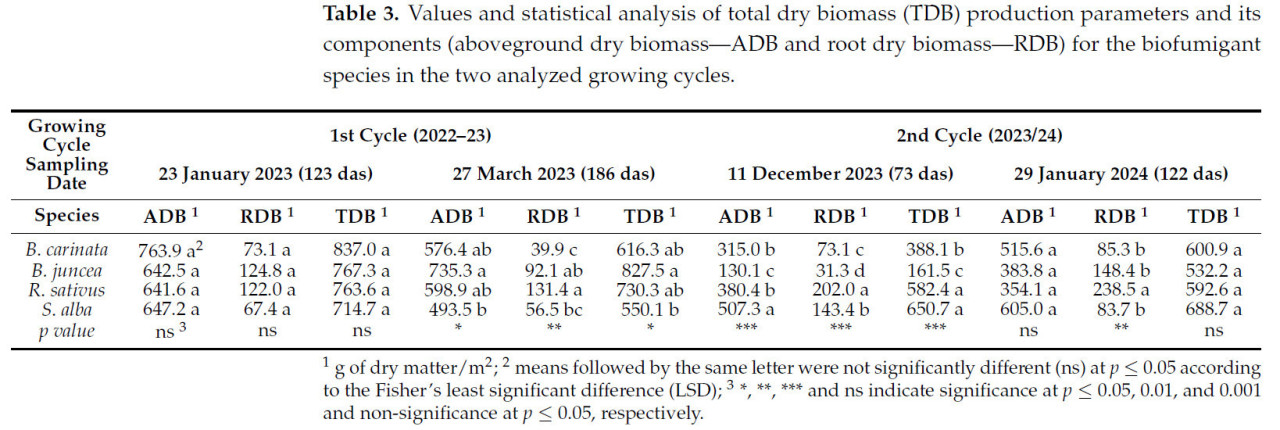
Полевые испытания проводились в течение двух последовательных циклов роста, и в обоих циклах были выявлены значительные различия в биомассе, продуцируемой анализируемыми видами биофумиганта. Эти различия и вариации в отборе проб зависели от цикла роста и времени отбора проб ( таблица 3 ).
Таблица 3. Значения и статистический анализ параметров продукции общей сухой биомассы (ОСБ) и ее компонентов (надземной сухой биомассы — АСБ и корневой сухой биомассы — КССБ) для видов биофумигантов в двух проанализированных циклах выращивания.
В ходе отбора проб, проведенного 23 января 2023 года (123 дня), четыре исследованных вида биофумиганта достигли уровней производства сухой биомассы, которые существенно не различались ни по общей биомассе, ни по двум ее компонентам (корневой и надземной). Значения варьировались от 837,0 г сухого вещества/м² для B. carinata до 714,7 г сухого вещества/м² для S. alba ( таблица 3 ). Более того, для всех видов было очевидно, что надземная биомасса внесла более значительный вклад в общую сухую биомассу, составив от 84% до 91% от общего объема, в зависимости от вида.
Примерно через два месяца после первого отбора проб, и после периода сильных заморозков, сравнительный анализ между видами показал изменения в их способности производить и накапливать биомассу по сравнению с тем, что наблюдалось при отборе проб 23 января. В этом втором отборе проб как ADB, так и TDB, продуцируемые B. juncea, были значительно выше, чем продуцируемые S . alba , а B . carinata и R. sativus заняли промежуточное положение. Это стало результатом минимальных колебаний в уровнях накопления биомассы, показанных B. juncea и R. sativus по сравнению с предыдущим отбором проб, в отличие от значительного снижения, наблюдаемого B . carinata и S. alba ( таблица 3 ).
Следовательно, хотя ни один из четырёх видов, по-видимому, не приспособлен к производству и накоплению биомассы в периоды низких температур (заморозков), очевидно, что B. carinata и S. alba чрезвычайно чувствительны к таким условиям ( таблица 3 ). Этот факт имеет решающее значение при определении наиболее подходящих сроков их внесения в почву в регионах с заморозками.
Результаты, полученные при осеннем посеве 2022 года, выявили необходимость корректировки графика отбора проб для определения биомассы при осеннем посеве 2023 года ( таблица 3 ). Первый отбор проб биомассы был перенесен на 73 дня (11 декабря 2023 года), а второй отбор проб остался на аналогичную дату первого цикла (около 120 дней). Эта корректировка была основана на чувствительности видов к морозу и направлена на оценку их способности производить биомассу в более коротких циклах, завершающихся до наступления периода заморозков. Решение было также поддержано заметно более высокими начальными темпами роста R. sativus и S. alba , что подтверждается их более высокими уровнями перехвата ФАР.
В отборе проб, проведенном 11 декабря 2023 года (73 дас), по показателю TDB четыре вида были сгруппированы в три уровня со статистически значимыми различиями: первую группу составили S. alba и R. sativus , которые превзошли B. carinata по TDB, а последний, в свою очередь, продуцировал и накапливал больше биомассы, чем B. juncea. Эти результаты подтверждают более высокую способность S. alba и R. sativus продуцировать биомассу в коротких циклах (около 70 дас) по сравнению с потенциалом, проявляемым B. carinata и, особенно, B. juncea на этой стадии.
Что касается анализа двух компонентов, определяющих TDB (ADB и RDB), то ключевое отличие состоит в том, что S. alba накапливает больше биомассы в ADB, чем R. sativus , тогда как в RDB ситуация обратная.
К концу января 2024 года, через 48 дней после предыдущего отбора проб (122 дас), четыре вида биофумиганта достигли очень близких значений TDB, что соответствует результатам, полученным при эквивалентном отборе проб из опыта осеннего посева 2022 года. Это связано с тем, что R. sativus и S. alba сохранили схожие уровни продуктивности с предыдущим отбором проб, практически не показав роста в этот период. Напротив, B. carinata и, особенно, B. juncea показали значительный рост TDB в это время, достигнув уровней, сопоставимых с двумя другими видами ( таблица 3 ). Что касается анализа двух компонентов (ADB и RDB), наиболее примечательным наблюдением является большее накопление корневой биомассы (RDB) у R. sativus по сравнению с другими тремя видами.
После проведения гомологических выборок в обоих циклах пробного выращивания (приблизительно 120 дас) для определения биомассы четырех видов биофумигантов был проведен статистический анализ с использованием результатов обоих циклов выращивания, подтвердивший выводы, полученные в ходе отдельных анализов в каждом цикле пробного выращивания ( таблица 4 ).
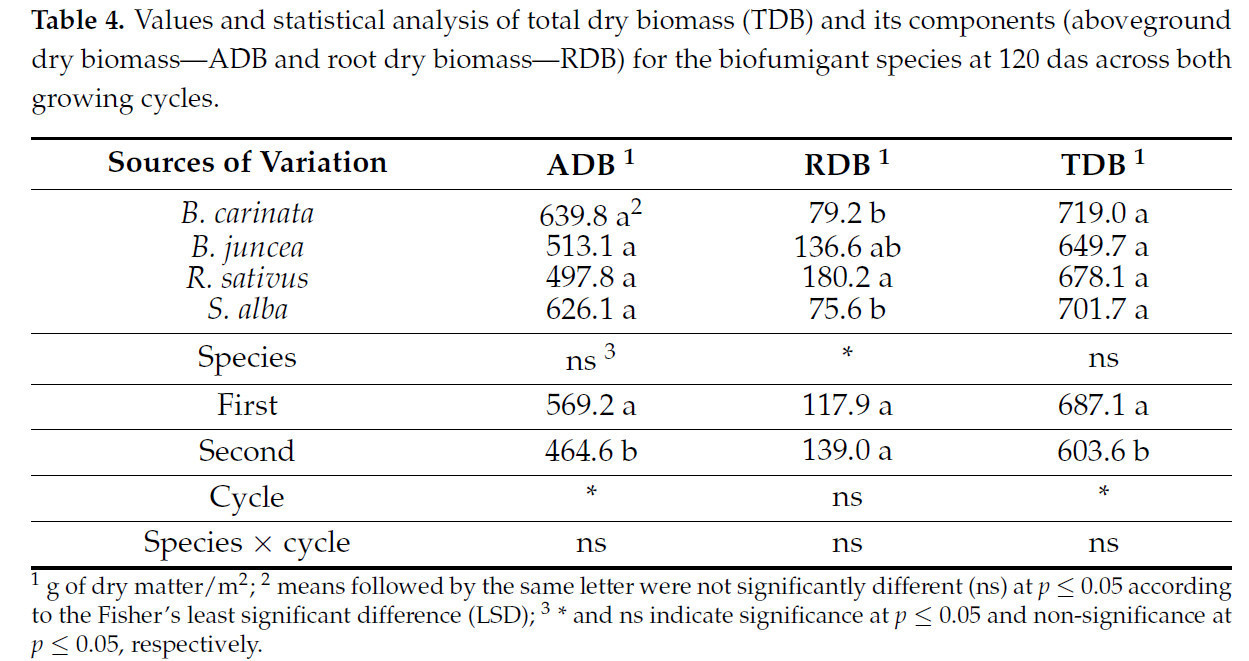
Таблица 4. Значения и статистический анализ общей сухой биомассы (TDB) и ее компонентов (надземная сухая биомасса — ADB и корневая сухая биомасса — RDB) для видов биофумиганта при 120 дас в обоих циклах выращивания.
Хотя между двумя циклами роста наблюдались различия в образовании биомассы, особенно в отношении TDB, общие закономерности распределения биомассы оставались неизменными. B. carinata и S. alba показали больший вклад ADB в TDB, в то время как R. sativus выделялся своим накоплением корневой биомассы RDB. Более того, различия в эффективности производства между циклами подкрепляют идею о том, что климатические условия и продолжительность цикла существенно влияют на конечную эффективность видов биофумигантов. Тем не менее, единообразное поведение видов с точки зрения распределения биомассы предполагает, что стратегии управления, такие как сроки внесения в почву, должны быть скорректированы в соответствии с этими закономерностями. Результаты подтверждают, что все виды способны достигать схожих уровней накопления биомассы, но со значительными различиями в том, как они распределяют ресурсы между надземной частью и корнями, что является ключевым фактором, который следует учитывать при реализации стратегий биофумигации.
3.2. Перехват излучения и эффективность его использования
3.2.1. Доля фотосинтетически активной радиации, перехваченной пологом леса (fIPAR)
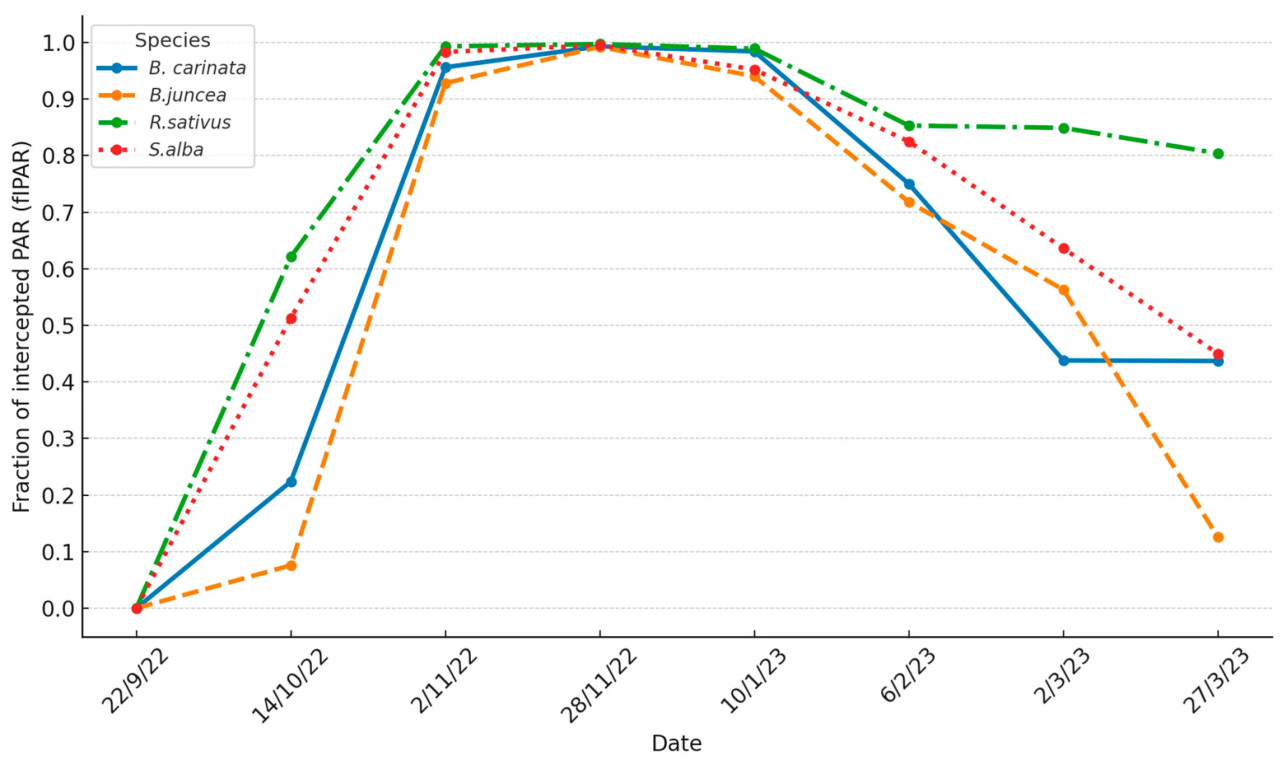
Динамика fIPAR под воздействием различных видов биофумигантов в течение агрономического цикла 2022–2023 гг. претерпела значительные изменения ( рисунок 2 ).
Рисунок 2. Изменение доли фотосинтетически активной радиации, перехваченной пологом (fIPAR) видов биофумигантов в течение цикла 2022–2023 гг.
Основные различия в динамике fIPAR между видами биофумиганта наблюдались на начальном и конечном этапах цикла 2022–2023 гг. На начальном этапе (22 дня) значения fIPAR у R. sativus и S. alba были выше, чем у B. carinata , что обусловлено более интенсивным ранним прорастанием и ростом. В свою очередь, у B. carinata значения fIPAR были выше, чем у B. juncea .
По мере развития цикла эти первоначальные различия между видами постепенно уменьшались. К началу ноября 2022 года (41 дас) только B. juncea показала более низкие уровни перехвата PAR по сравнению с другими видами, у которых значения fIPAR уже превысили 0,95. К концу ноября 2022 года (67 дас) ( рис. 2 ) значения fIPAR приблизились к 1 (между 0,99 и 1) у всех четырёх видов.
Морозный период начался в конце ноября 2022 года ( рисунок 3 ) с трех дней с легкими заморозками (минимальная температура ≥ −1,7 °C). В декабре 2022 года и первой половине января 2023 года заморозков практически не было, и все четыре вида продолжали демонстрировать очень высокие уровни fIPAR. Однако в последнюю декаду января 2023 года, большую часть февраля и первую неделю марта 2023 года урожай подвергся длительному морозному периоду (45 морозных дней, из которых 25 дней с минимальными температурами ниже −2 °C, а в некоторые дни достигали −8 °C).
Рисунок 3. Изображение испытания видов биофумиганта от 22 ноября 2022 г. (67 дней).
В результате к концу января 2023 года вид начал испытывать снижение почвенного покрытия или затенения полога, что отразилось в их значениях fIPAR. Это снижение было более выражено у B. carinata , B. juncea и S. alba по сравнению с R. sativus . Процесс ухудшился в последующие месяцы, так что к началу марта значения fIPAR упали примерно до 0,5–0,6 для первых трех видов, в то время как R. sativus сохранил fIPAR около 0,85. Этот вид был способен «обновлять и поддерживать» свой полог за счет непрерывного отрастания побегов, подпитываемого резервами, накопленными в корнях.
3.2.2. Количество PAR, перехваченное в течение цикла, и эффективность использования излучения
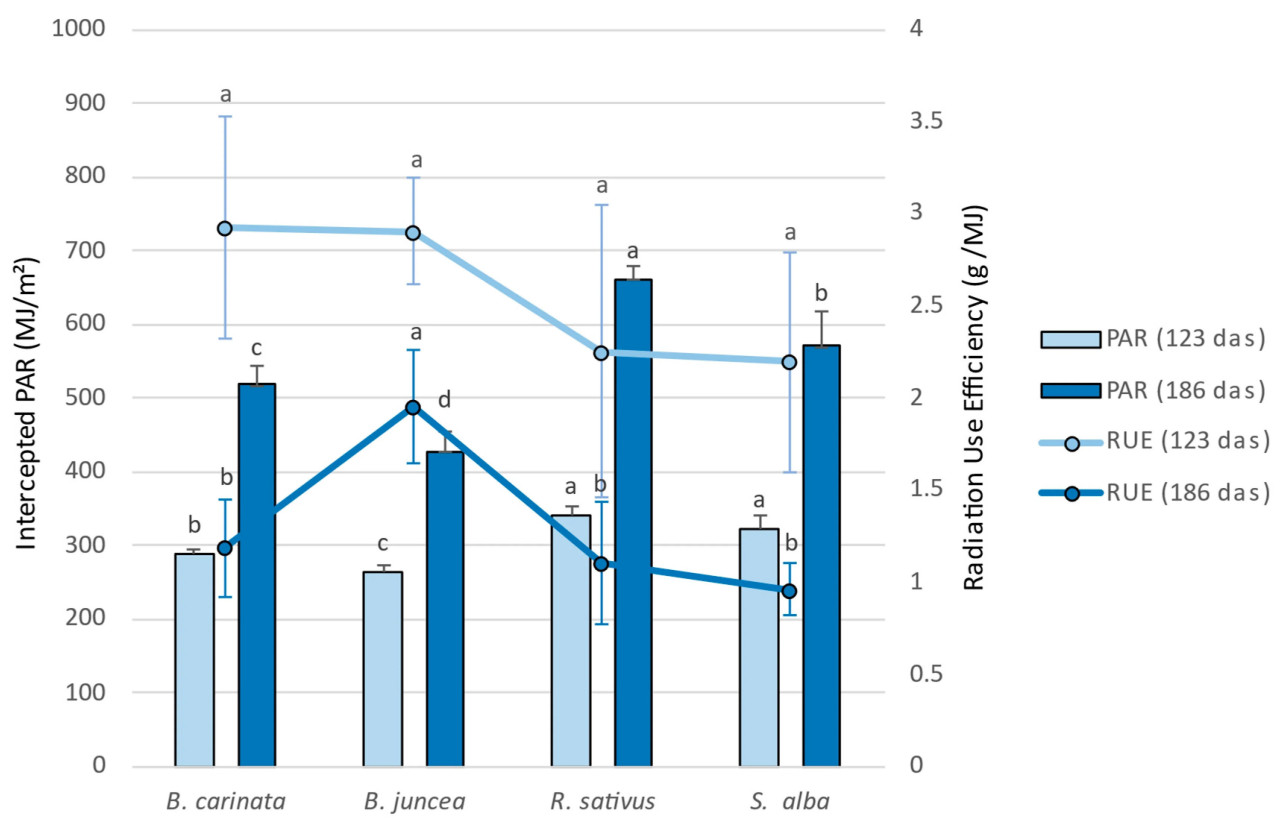
Интегрированный эффект эволюции fIPAR отразился в общих значениях PAR, перехваченных каждым из видов биофумиганта с момента посева до каждой из двух дат отбора проб биомассы (123 и 186 дас) ( Рисунок 4 ).
Рисунок 4. Перехваченная фотосинтетически активная радиация (ФАР) (МДж/м² ) и эффективность использования радиации (ЭИ) (г/МДж) листовым покровом биофумиганта в два дня (123 и 186 дней). Средние значения, отмеченные одной и той же буквой, достоверно не различались (ns) при p ≤ 0,05 согласно критерию наименьшей значимой разницы Фишера (LSD).
На двух проанализированных датах были обнаружены статистически значимые различия в общих значениях перехваченного PAR между видами, со схожей общей картиной в обоих случаях. RUE, коэффициент, который показывает, как перехваченный или поглощенный PAR используется культурой для производства биомассы, как известно, варьируется в зависимости от множества факторов, включая экологические стрессы, фенологические стадии, генотипы [ 42 ], доступность воды и азота [ 43 ], виды, управление культурой, погодные условия [ 44 ] и плотность растений [ 39 ], а также взаимодействие между этими факторами [ 42 ]. R. sativus и S . alba перехватили большее количество PAR из-за более быстрого начального роста и развития по сравнению с B. carinata , которая, в свою очередь, превзошла B. juncea по перехваченному PAR. Это в первую очередь является результатом более плохого и более нерегулярного прорастания и более медленного начального роста в B. juncea . Единственное заметное различие в сравнительном анализе между видами в обе даты состоит в том, что при отборе проб в конце марта (186 дас) R. sativus перехватил больше ФАР, чем S. alba , поскольку R. sativus смог сохранить больший зеленый лиственный покров в период заморозков.
Что касается значений RUE при 123 дас, статистически значимых различий (уровень значимости 5%) среди различных видов биофумигантов не наблюдалось, хотя и R. sativus и S. alba показали немного более низкие средние значения по сравнению с двумя другими видами. Таким образом, кажется, что существует явный компенсаторный эффект между двумя факторами, которые определяют производство биомассы (RUE и перехваченный PAR), что объясняет отсутствие статистически значимых различий в накопленном производстве биомассы к этой дате среди четырех протестированных видов. В соответствии с предыдущими исследованиями, виды Brassica имеют тенденцию быстро покрывать почву, что приводит к высокому захвату радиации (517 МДж/м2 ) , хотя эффективность использования ими радиации остается низкой (0,80 г/МДж) по сравнению с другими покровными культурами [ 18 ].
Принимая во внимание цикл в 186 дас, B. juncea достигает гораздо более высоких значений RUE по сравнению с другими тремя видами ( Рисунок 4 ), с весьма значительными различиями между двумя группами. Примечательно, что все четыре вида показывают снижение RUE из-за большего старения листового покрова, частично вызванного растянутым циклом до конца зимы и частично из-за периода заморозков, который они испытывали в течение большей части зимы. В любом случае, B. juncea показал наименьшее снижение RUE. Еще раз, интегрированный анализ обоих параметров (перехваченный PAR и RUE) прекрасно объясняет различия, наблюдаемые в продукции биомассы среди различных видов биофумигантов в выборке конца зимы (186 дас). B. juncea является видом с самым высоким производством биомассы (со статистически значимыми различиями по сравнению с S. alba ), поскольку его более низкая способность перехватывать PAR — из-за снижения роста в условиях низких температур — компенсируется более высокими значениями RUE. В случае R. sativus более низкий уровень продукции биомассы объясняется низким значением RUE, а не количеством перехваченной PAR. Для оставшихся двух видов ( B. carinata и S. alba ) более низкое накопление биомассы обусловлено как снижением перехваченной PAR, так и RUE, что указывает на то, что эти два вида наиболее подвержены влиянию низких температур на производство и накопление биомассы.
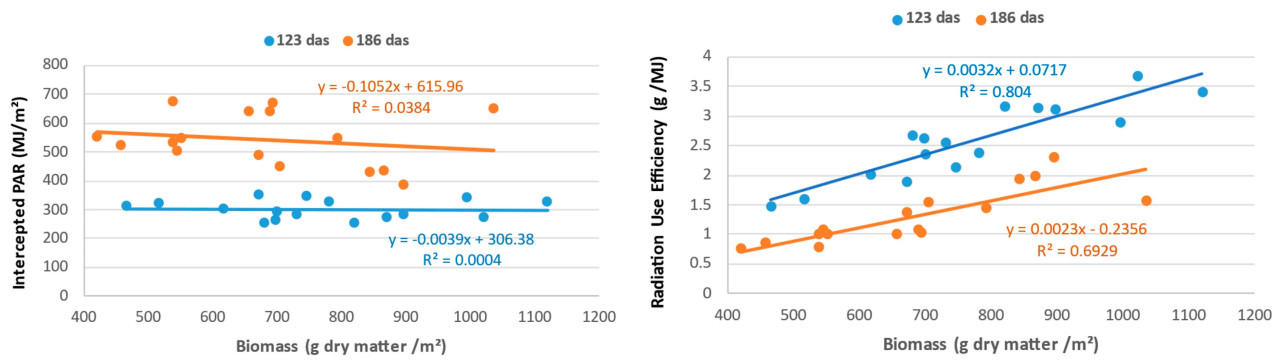
Кроме того, при анализе корреляций между накопленной биомассой и двумя факторами, которые ее определяют (перехваченный PAR и RUE), в обеих выборках (123 и 186 das) очевидно, что связь между биомассой и RUE намного сильнее, чем между биомассой и перехваченным PAR ( Рисунок 5 ).
Рисунок 5. Анализ взаимосвязей между накопленной биомассой на 123 и 186 день после посева (das) и ее определяющими компонентами: перехваченной фотосинтетически активной радиацией (ФАР) ( слева ) и эффективностью использования радиации (RUE) ( справа ).
3.3 Индекс содержания хлорофилла
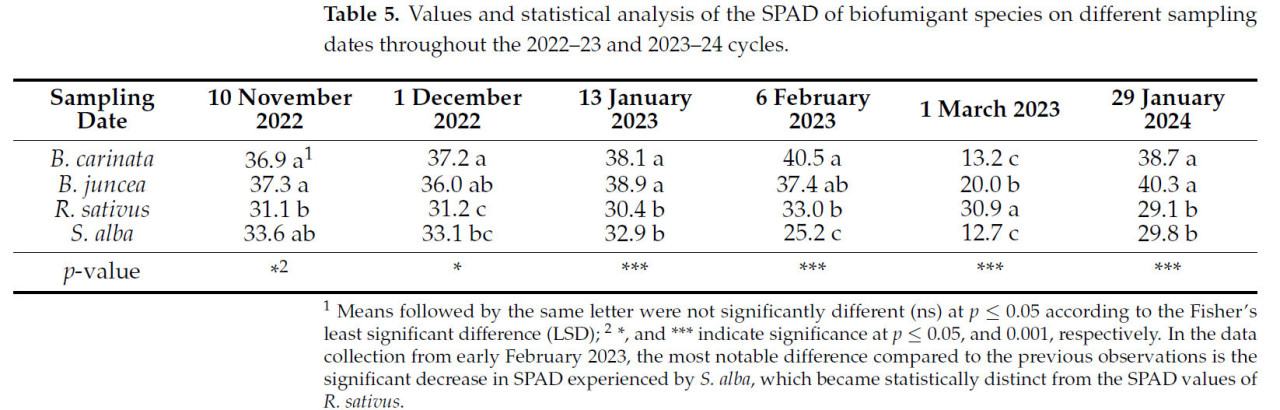
В первые три даты измерения SPAD, соответствующие периоду цикла, в течение которого заморозки практически не наблюдались (до 13 января 2023 г.), статистический анализ результатов показывает, что четыре вида биофумиганта были сгруппированы в две отдельные категории со значительными различиями между ними. Первая группа состояла из B. carinata и B. juncea со значениями SPAD в диапазоне приблизительно от 36,9 до 38,9, тогда как вторая группа включала R. sativus и S. alba со значениями SPAD в диапазоне приблизительно от 30,4 до 33,6 ( таблица 5 ).
Таблица 5. Значения и статистический анализ SPAD видов биофумигантов в различные даты отбора проб в циклах 2022–23 и 2023–24 годов.
Наконец, в начале марта 2023 года, после длительного периода низких температур, различия в значениях SPAD между видами биофумигантов стали значительно более выраженными. Это было связано с резким снижением значений SPAD, наблюдавшимся у B. carinata , B. juncea и S. alba , чего не наблюдалось у R. sativus , у которого значения SPAD либо сохранились, либо лишь незначительно снизились по сравнению с предыдущими измерениями. В результате, к тому времени четыре вида биофумигантов были сгруппированы в три отдельных уровня с весьма значительными различиями между ними.
В зимний период второго посевного цикла (2023–2024 гг.) измерение SPAD проводилось 29 января 2024 г. (122 дня). Результаты, полученные в этот день, подтверждают аналогичную тенденцию, наблюдавшуюся в предыдущем цикле (2022–2023 гг.), как по абсолютным значениям SPAD, так и по существенным различиям между видами биофумиганта.
В этом цикле B. juncea продемонстрировала самые высокие значения SPAD, со средним значением 40,3 ± 2,6. Эти значения согласуются с результатами предыдущего цикла, где B. juncea также продемонстрировала высокие значения, что свидетельствует о высокой способности поддерживать повышенный уровень хлорофилла в листьях. У B. carinata также зафиксированы высокие значения SPAD со средним значением 38,7 ± 1,1, что свидетельствует о наличии устойчивой тенденции для этого вида в отношении параметра SPAD.
Напротив, R. sativus и S. alba продемонстрировали значительно более низкие значения SPAD, при этом средние значения SPAD постоянно были ниже 30. Эта разница между группами согласуется с наблюдениями предыдущего цикла, где оба вида также продемонстрировали более низкие значения SPAD по сравнению с B. carinata и B. juncea .
Эти результаты подтверждают гипотезу о том, что SPAD сильно зависит от видов биофумигантов, подчеркивая важность дальнейшего изучения взаимосвязи между этим параметром и другими ключевыми факторами, такими как концентрация GSL, которые могут способствовать биофумигантному потенциалу видов.
3.4. Профили глюкозинолатов и изотиоцианатный потенциал
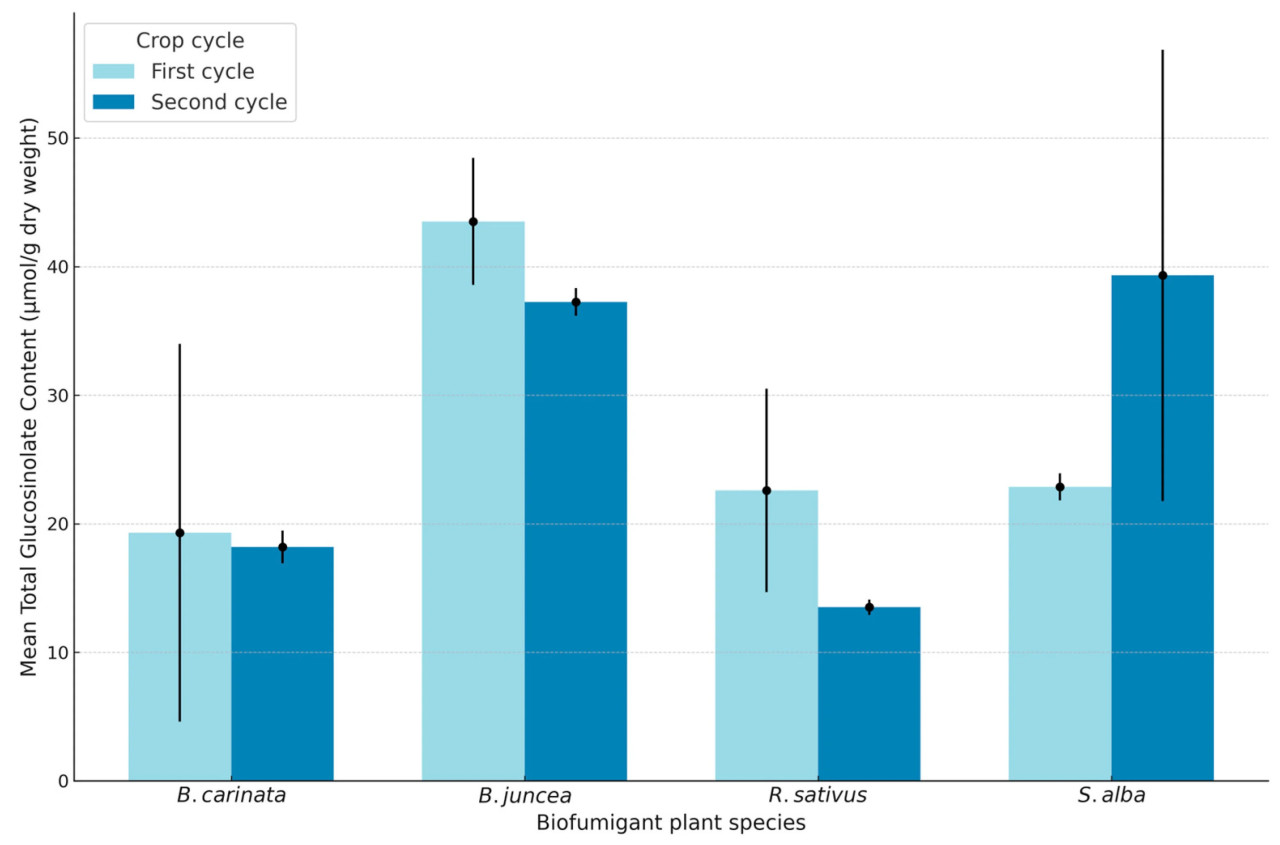
Профили GSL в видах Brassica , проанализированные в январе и марте 2023 и 2024 гг., показали заметную дифференциацию между алифатическими, ароматическими и индольными типами со значительными колебаниями концентрации среди видов ( Рисунок 6 ). В частности, B. juncea демонстрировал самую высокую общую концентрацию GSL в обоих циклах и по месяцам, при этом значения в январе были заметно выше, чем в марте. S. alba также демонстрировал высокие уровни GSL, особенно в мартовском образце второго цикла, где он достиг своей пиковой концентрации. Напротив, B. carinata и R. sativus продемонстрировали сравнительно более низкие концентрации GSL, при этом B. carinata демонстрировал существенное снижение с января по март, особенно во втором цикле, что указывает на сезонное или экологическое влияние на биосинтез GSL.
Рисунок 6. Общая концентрация глюкозинолатов в видах растений-биофумигантов во время первого и второго циклов (отбор проб в январе и марте).
Рисунок 6 иллюстрирует эти тенденции, где B. juncea и S. alba стабильно доминируют в уровнях GSL, что потенциально подчеркивает их повышенную метаболическую способность к синтезу GSL в различных условиях. Различия между циклами, представленные различными оттенками синего, подчеркивают потенциальное ежегодное воздействие на окружающую среду или адаптацию, поскольку второй цикл показал немного сниженные концентрации B. juncea в марте, в то время как S. alba достигла своего максимума в этот период. Эти колебания указывают на видоспецифические реакции на переменные среды, возможно, из-за различий в генетической регуляции путей GSL. Визуальное разделение значений по месяцам и циклам дополнительно подчеркивает важность сроков и экологического контекста в концентрации и составе GSL среди видов Brassica ( Рисунок 6 и Рисунок 7 ).
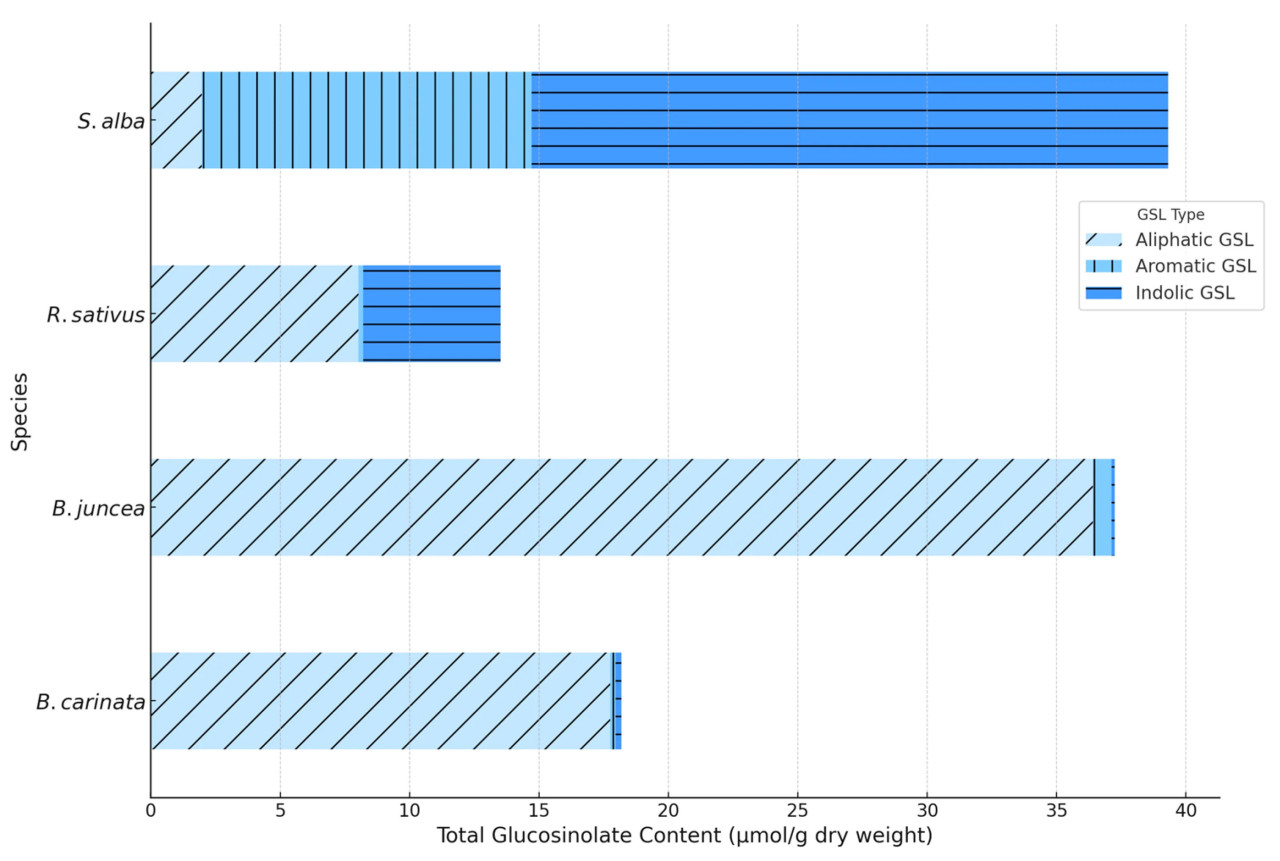
Рисунок 7. Сравнение концентрации алифатических, ароматических и индольных глюкозинолатов в видах растений-биофумигантов: 2023–2024 гг.
На рисунке 7 показано, что алифатические ГСЛ демонстрировали самые высокие концентрации у большинства видов в обоих циклах роста, при этом синигрин выделялся как ключевое соединение у B. juncea и B. carinata , известное своей способностью высвобождать ИТК с фунгицидным действием. Среди них синигрин был одним из наиболее распространенных алифатических соединений. Среди других известных алифатических ГСЛ были глюкорафанин и глюкоэруцин, которые продуцируют ИТК, такие как сульфорафан и эруцин, соответственно, соединения с хорошо известным влиянием на защитные функции растений.
Кроме того, глюконапин и глюкотропеолин вносили вклад в алифатический профиль в более низких концентрациях, а продукты гидролиза, такие как бензилизотиоцианат [ 33 ]. В период с января по март алифатические ГСЛ снижались в среднем на 15–20% у этих видов, особенно у B. juncea , что может указывать на раннюю защитную адаптацию.
Напротив, ароматические GSL, в первую очередь синальбин в S. alba , были более стабильны в течение двух анализируемых циклов роста, показывая менее зависимый от сезонности профиль.
Что касается ароматических ГСЛ, то здесь примечательны синальбин и глюконастуртиин, а основными продуктами их синтеза являются нитрилы и фенетилизотиоцианаты. У R. sativus индольные ГСЛ были значительно сконцентрированы в январе, демонстрируя снижение до 25% к марту ( рисунок 7 ). Между вегетационными циклами наблюдалась тенденция к стабильности ароматических ГСЛ и небольшое снижение алифатических ГСЛ в 2024 году, особенно в марте, что свидетельствует о межгодовой адаптации защитной реакции этих видов к факторам окружающей среды.
3.5 Корреляционный анализ измеряемых переменных
Как отмечалось в предыдущем разделе, концентрации и профили ГСЛ демонстрируют чёткие различия между исследуемыми видами, что указывает на их вероятное различное биофумигантное действие. Эти различия значительно превышают наблюдаемые в объёмах биомассы, производимой видами за 120-дневные циклы, что позволяет предположить, что различия в общем количестве ГСЛ, внесённых в почву к концу цикла, будут в значительной степени зависеть от их концентрации ГСЛ. Точное определение этих концентраций и профилей требует трудоёмких процедур отбора, обработки и консервации проб, а также дорогостоящих аналитических исследований. Поэтому представляет большой интерес анализ потенциальных взаимосвязей между показателями сельскохозяйственных культур (видами биофумигантов), которые можно быстро и легко измерить с помощью проксимальных и/или дистанционных датчиков, а концентрация ГСЛ является инструментом, помогающим в принятии решений относительно оптимальной точки цикла для внесения биомассы видов биофумигантов в почву. Одним из таких быстрых и легко измеряемых показателей является SPAD.
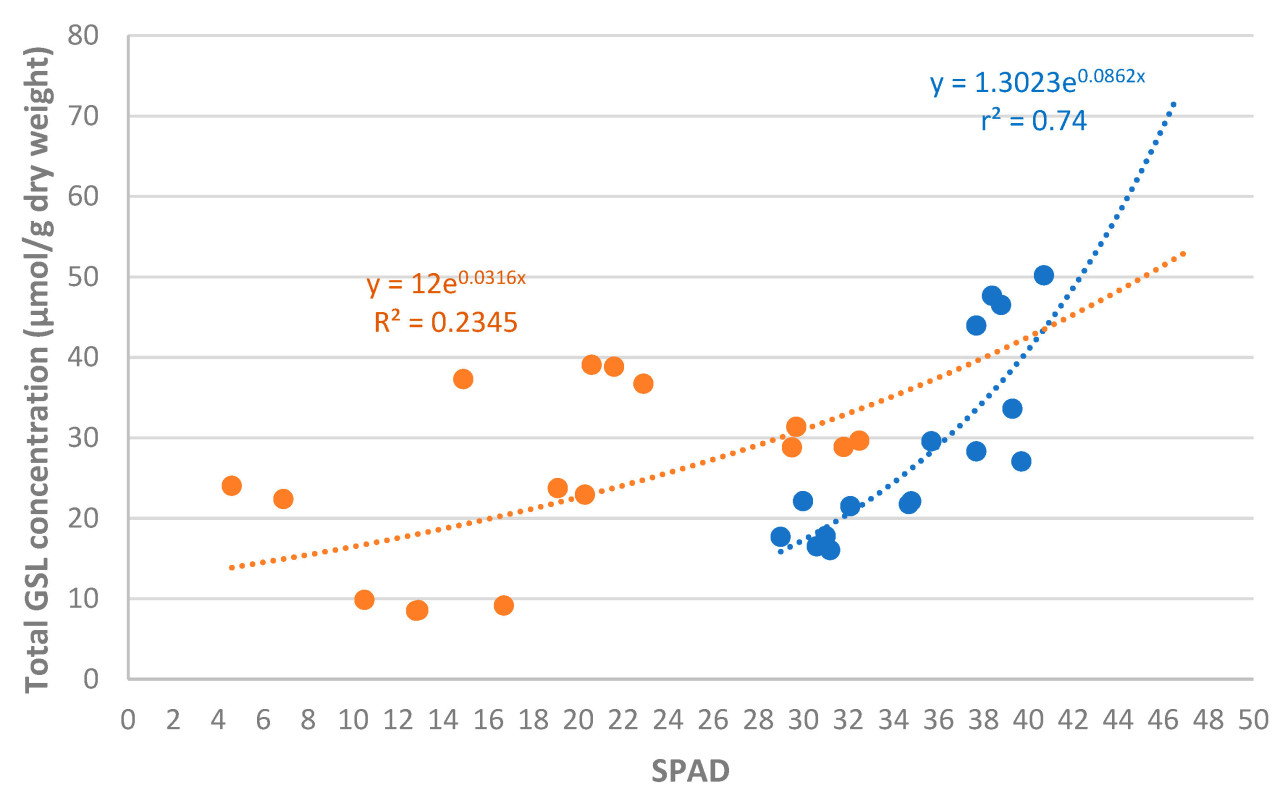
На рисунке 8 графически показана зависимость между общей концентрацией GSL в биомассе видов биофумиганта и SPAD в образцах, отобранных в январе и марте 2023 года. В образцах, отобранных в январе 2023 года, эта зависимость является последовательной (r 2 = 0,74), демонстрируя экспоненциальную зависимость: чем выше SPAD, тем выше концентрация GSL.
Рисунок 8. Индивидуальный анализ связи между общей концентрацией глюкозинолатов в биомассе видов-биофумигантов и значениями SPAD в пробах января (синий) и марта (красный) 2023 года.
Однако в выборке, собранной в марте 2023 года, эта связь оказалась гораздо менее устойчивой (r² = 0,23). Весьма вероятно, что заморозки, случившиеся между двумя выборками и сильно повлиявшие на спад вида, стали наиболее определяющим фактором в потере этой связи.
Как уже упоминалось, значения SPAD, а также концентрация и профили GSL, по-видимому, сильно зависят от видов или связаны с ними. Однако на оба параметра влияют многие другие факторы окружающей среды и агрономического управления. В связи с этим при анализе результатов за несколько лет необходимо выражать результаты в относительных единицах по сравнению с эталоном, чтобы исключить влияние дополнительных источников вариации, которые могут исказить анализ этой взаимосвязи. В данном случае в качестве эталонного вида был выбран B. juncea , поскольку он показал самую высокую концентрацию GSL и, наряду с B. carinata , также входил в число видов с самыми высокими значениями SPAD.
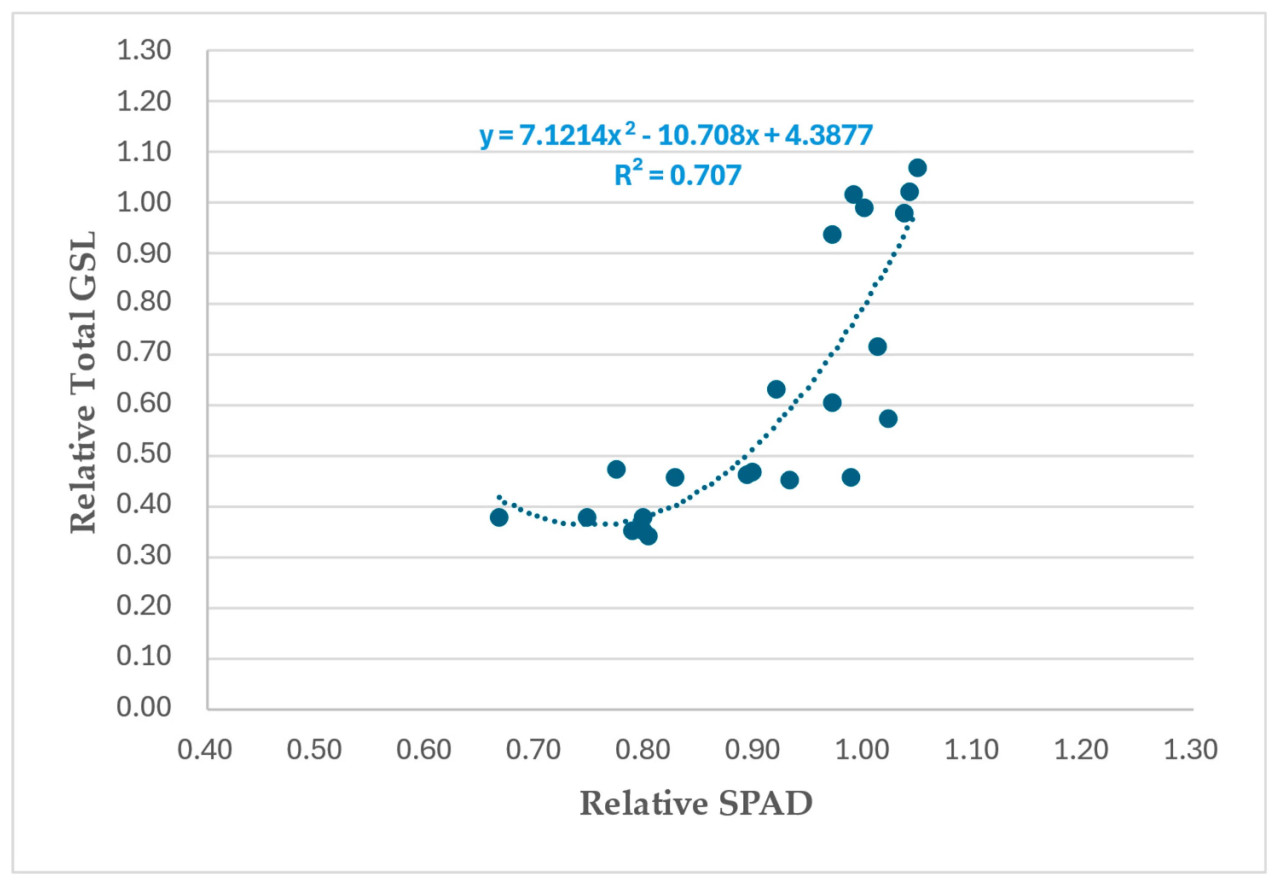
Глобальный анализ этой зависимости, соответствующий выборкам в январе 2023 и 2024 годов ( Рисунок 9 ), показывает очень схожую согласованность (r2 = 0,71), полученную в индивидуальном анализе в январе 2023 года ( Рисунок 8 ). Это открывает интересные возможности для дальнейшего изучения этой зависимости и её использования в качестве практического инструмента при реализации стратегий биофумигации.
Рисунок 9. Глобальный анализ взаимосвязи между относительной общей концентрацией глюкозинолатов в биомассе видов-биофумигантов и относительными значениями SPAD в образцах, отобранных в январе 2023 и 2024 гг. (120 дас).
4. Обсуждение
Наблюдаемая в нашем исследовании продукция биомассы S. alba и R.
sativus была существенно
выше значений, полученных Брантом и др.
(2011) [ 17 ],
которые зафиксировали значения от 115,8
до 138,2 г/м² для этих
видов в летне-осенний период в условиях дефицита воды. Однако наши значения
продукции биомассы были аналогичны значениям, полученным Элхакимом и др. (2021)
[ 18 ]
для этих видов в летне-осенний период в условиях Северной Европы.
Различия можно объяснить меньшим дефицитом воды и более благоприятными условиями для эффективности использования радиации (ЭИИ). Тем не менее, три исследования подчеркивают быстрые темпы роста S. alba и R. sativus на начальных этапах их вегетационного цикла, что подтверждает их пригодность для биофумигации.
Захват излучения (PAR), наблюдаемый в этом исследовании для R. sativus и S. alba в течение 120-дневного цикла (320–340 МДж/м² ) ( Рисунок 4 ), был выше значений Elhakeem et al. (2021) [ 18 ] (233 МДж/м² ) , несмотря на более раннюю дату их посева. Это можно объяснить разницей в продолжительности цикла (84 дня против 120 дней) и климатическими условиями. Аналогичным образом, значения RUE были сопоставимы, при этом в нашем исследовании сообщалось о 2,2 г/МДж (общая биомасса) против их скорректированного значения 1,87 г/МДж.
Значения RUE, наблюдаемые для B. carinata , B. juncea и B. napus, были заметно выше, чем значения, полученные Куаем и соавторами (2016) [ 39 ] для B. napus . Это различие можно объяснить более высокой плотностью посева, использованной в нашем исследовании, и более короткой продолжительностью цикла. Эти результаты свидетельствуют о том, что более плотные схемы посева и сезонность значительно повышают эффективность производства биомассы у видов, используемых в качестве биофумигантов.
Наши результаты подтверждают предыдущие выводы, показывающие, что RUE является более определяющим фактором для производства биомассы, чем улавливание PAR, особенно в различных условиях окружающей среды и подходах к агротехнике [ 42 ]. В конечном счёте, RUE лучше объясняет способность четырёх протестированных видов биофумигантов к производству биомассы, чем улавливание PAR.
Хотя существенные различия между видами биофумигантов стали очевидны во вторую дату отбора проб первого цикла, особенно в надземной биомассе, второй цикл показывает постоянство видов с более высокими начальными темпами роста, таких как S. alba и R. sativus . Надземная биомасса B. carinata , измеренная в середине фазы цветения, согласно [ 38 ], варьировалась от 435 до 2417 г/м 2 , при этом S. alba и B. juncea составляли 140–387 г/м 2 и 205–1792 г/м 2 соответственно, что подтверждает значительный потенциал урожайности биомассы этих видов. Эти два вида снова превзошли B. juncea и B. carinata по накоплению биомассы во время ранних отборов проб. Эта согласованность в обоих циклах подтверждает, что S. alba и R. sativus более эффективно производят биомассу на ранних стадиях выращивания, что делает их более подходящими для коротких циклов, например, заканчивающихся перед заморозками. Несмотря на различия в производстве биомассы, концентрация GSL в тканях растений в значительной степени генетически детерминирована, но также зависит от таких факторов, как органы растения, стадия развития и условия окружающей среды [ 19 , 31 , 38 , 45 , 46 ]. С другой стороны, B. juncea и B. carinata , хотя изначально и демонстрировали более медленный рост, сумели догнать другие виды на поздних стадиях цикла выращивания, что указывает на компенсаторную способность в более продолжительных условиях.
Таким образом, результаты обоих циклов подчеркивают важность адаптации выбора видов биофумигантов к продолжительности цикла выращивания и конкретным климатическим условиям, уделяя особое внимание чувствительности некоторых видов к низким температурам. Этот процесс выбора должен также учитывать характеристики биофумиганта, выходящие за рамки концентрации GSL, такие как выход биомассы, адаптируемость к конкретным условиям окружающей среды и способность видов выделять биологически активные соединения, такие как ИТК, как продемонстрировано в исследованиях ду Сантоса и соавторов (2021) [ 3 ].
Хотя данное исследование сосредоточено на специфических условиях центральной Испании, потенциальная применимость результатов к производственным системам Северной Европы заслуживает рассмотрения. Северная Европа характеризуется иными климатическими условиями, такими как более низкие температуры, обильное количество осадков и короткий вегетационный период, что может существенно влиять на рост, образование биомассы и профили глюкозинолатов (ГСЛ) видов, используемых в качестве биофумигантов. Например, чувствительность к заморозкам, наблюдаемая у B. carinata и S. alba в данном исследовании, позволяет предположить, что этим видам может потребоваться тщательный выбор времени посева и заделки, чтобы избежать повреждений от заморозков. Напротив, активный ранний рост и образование биомассы у R. sativus и S. alba могут сделать их подходящими кандидатами для более коротких циклов в регионах с коротким вегетационным периодом.
Результаты данного исследования подчеркивают потенциальную эффективность видов Brassica в качестве биофумигантов, особенно тех, которые содержат высокие уровни алифатических GSL, таких как синигрин в B. juncea и B. carinata . По данным Сарвара и др. (1998) [ 47 ], алифатические GSL особенно эффективны благодаря своей способности выделять летучие ИТК, которые обладают широким спектром токсичности против патогенных грибов и нематод [ 38 ]. Наши результаты показывают, что концентрации алифатических GSL были самыми высокими у этих видов во время январского анализа, что предполагает адаптивную стратегию для максимального высвобождения биологически активных соединений на ранних стадиях роста. Фактически, алифатические GSL, такие как синигрин (0,1–26,5 и 10,0–20,0 мкмоль/г в B. juncea и B. carinata соответственно), основным продуктом которого является аллилизотиоцианат, известный своими биоактивными свойствами [ 21 ], как показали другие авторы [ 38 , 48 ], доминируют в надземной биомассе этих видов, способствуя их более высокой эффективности биофумигации [ 37 , 38 ]. Кроме того, высокие уровни алифатических GSL в B. juncea и B. carinata указывают на то, что их биофумигационный потенциал может быть также эффективен в условиях Северной Европы, при условии, что эти виды будут управляться для оптимизации роста до наступления неблагоприятных погодных условий. Необходимы будущие исследования по оценке этих видов в различных условиях окружающей среды для подтверждения их производительности и эффективности биофумигации в различных европейских производственных системах.
Аналогичным образом, ароматические GSL, такие как синальбин в S. alba , показали меньшую изменчивость между датами отбора проб, что согласуется с выводами Torrijos et al. (2023) [ 48 ] и нашими наблюдениями за стабильностью синальбина с января по март. Это говорит о том, что ароматические GSL играют более постоянную защитную роль, особенно против менее летучих угроз, таких как насекомые [ 49 ]. В отличие от алифатических GSL, синальбин в первую очередь производит нитрилы вместо ITC [ 26 , 47 ], что указывает на дополнительную функцию с меньшим количеством прямых фунгицидных эффектов. Постоянные уровни синальбина в S. alba подчеркивают его роль в защите от патогенов или стрессоров окружающей среды, где постоянное присутствие является преимуществом. Однако, несмотря на их высокую токсичность в контролируемых лабораторных условиях [ 25 , 33 ], ароматические GSL менее эффективны для биофумигации почвы из-за их меньшей летучести и более сильной сорбции на органическом веществе, что ограничивает их использование в полевых условиях [ 24 , 50 ].
Индольные GSL, такие как глюкобрассицин, хотя и не высвобождают ITC, предлагают косвенные преимущества, вызывая защитные реакции в растениях-хозяевах, включая активацию ауксинов и связанных с ними сигнальных соединений [ 35 , 38 ]. У R. sativus промежуточные уровни индольных GSL, наблюдаемые в январе, могут отражать раннюю стадию адаптации к абиотическому стрессу. Эти соединения, включая глюкобрассицин и 4-гидроксиглюкобрассицин, высвобождают продукты гидролиза, такие как индолы [ 26 ], которые выполняют критические защитные функции против травоядных животных и как сигнальные молекулы в ответ на повреждение тканей, а не оказывают прямое фунгицидное действие. Это может указывать на стратегическую защитную адаптацию, при которой индольные соединения более многочисленны на ранних стадиях роста, когда абиотические стрессы более выражены, и уменьшаются на поздних стадиях цикла роста.
Среди исследованных видов наиболее устойчивый алифатический профиль GSL продемонстрировала B. juncea , за ней следует B. carinata , что подтверждает её потенциал для стратегий биофумигации, направленных на более сильное фунгицидное действие. Напротив, R. sativus демонстрирует более смешанный профиль, сочетающий алифатические и индольные GSL. Такое разнообразие может быть полезным в условиях с более широким спектром патогенов и подчёркивает её полезность в ротационной биофумигации с различными профилями GSL.
Эти результаты подчеркивают важность учета как сезонных, так и межгодовых изменений в профилях GSL при разработке стратегий биофумигации на основе Brassica . Адаптация этих стратегий к конкретным экологическим условиям и сезонной динамике будет иметь решающее значение для оптимизации их эффективности.
5. Выводы
Эта всесторонняя оценка видов Brassicaceae для биофумигации выявляет значительные видоспецифические вариации, которые имеют решающее значение для оптимизации стратегий биофумигации. Результаты подчеркивают потенциал использования значений SPAD в качестве косвенной оценки, по крайней мере в относительном выражении, общей концентрации GSL в биомассе этих четырех видов биофумигантов, служа инструментом, помогающим в практической реализации биофумигации. Необходимость использования эталонного вида может представлять собой «незначительное» практическое неудобство, но это целесообразно при работе с индикаторами сельскохозяйственных культур, абсолютные значения которых зависят от многих неконтролируемых переменных. Кроме того, эти результаты также открывают дверь для изучения других индикаторов сельскохозяйственных культур различных типов: индикаторов, связанных с хлорофиллом, таких как индекс нормализованной разницы красной кромки (NDRE); индикаторов вегетативного развития, таких как индекс нормализованной разницы вегетации (NDVI) и индекс нормализованной разницы зеленой растительности (GNDVI); и комбинированные индексы, такие как индекс трансформированного поглощения хлорофилла в отражательной способности/оптимизированный индекс вегетации с поправкой на почву (TCARI/OSAVI), определяемые с помощью дистанционных датчиков (мультиспектральных камер, установленных на дронах, спутниковых снимков). Эти показатели обладают большим потенциалом для применения в более крупных масштабах (на больших участках) по сравнению с измерениями SPAD, получаемыми с помощью портативных рефлектометров.
Ссылки
1. Billen, G.; Aguilera, E.; Einarsson, R.; Garnier, J.; Gingrich, S.; Grizzetti, B.; Lassaletta, L.; Le Noë, J.; Sanz-Cobena, A. Beyond the Farm to Fork Strategy: Methodology for Designing a European Agro-Ecological Future. Sci. Total Environ. 2024, 908, 168160. [Google Scholar] [CrossRef] [PubMed]
2. Brennan, R.J.B.; Glaze-Corcoran, S.; Wick, R.; Hashemi, M. Biofumigation: An Alternative Strategy for the Control of Plant Parasitic Nematodes. J. Integr. Agric. 2020, 19, 1680–1690. [Google Scholar] [CrossRef]
3. dos Santos, C.A.; de Souza, A.C.; Ferreira, M.G. Biofumigation with Species of the Brassicaceae Family: A Review. Cienc. Rural. 2021, 51, 1–17. [Google Scholar] [CrossRef]
4. Chekanai, V.; Neilson, R.; Clark, M.; Edwards, S.G.; Roberts, D.; Back, M. Management of and Future Perspectives on Plant Parasitic Nematodes Associated with Narcissus Grown in the UK. J. Hortic. Sci. Biotechnol. 2024, 100, 1–10. [Google Scholar] [CrossRef]
5. Kirkegaard, J.A.; Gardner, P.A.; Desmarchelier, J.M.; Angus, J.F. Biofumigation—Using Brassica Species to Control Pests and Diseases in Horticulture and Agriculture. In Proceedings of the 9th Australian Research Assembly on Brassicas, Wagga Wagga, Australia, 5–7 October 1993; Wratten, N., Mailer, R.J., Eds.; Agricultural Research Institute: Wagga Wagga, Australia, 1993; pp. 77–82. [Google Scholar]
6. Dutta, T.K.; Khan, M.R.; Phani, V. Plant-Parasitic Nematode Management via Biofumigation Using Brassica and Non-Brassica Plants: Current Status and Future Prospects. Curr. Plant Biol. 2019, 17, 17–32. [Google Scholar] [CrossRef]
7. Karavina, C.; Mandumbu, R. Biofumigation for Crop Protection: Potential for Adoption in Zimbabwe. J. Anim. Plant Sci. 2012, 14, 1996–2005. [Google Scholar]
8. Lazzeri, L.; Malaguti, L.; Cinti, S.; Ugolini, L.; De Nicola, G.R.; Bagatta, M.; Casadei, N.; D’Avino, L.; Matteo, R.; Patalano, G. The Brassicaceae Biofumigation System for Plant Cultivation and Defence. An Italian Twenty-Year Experience of Study and Application. Acta Hortic. 2013, 1005, 375–382. [Google Scholar] [CrossRef]
9. Ntalli, N.; Caboni, P. A Review of Isothiocyanates Biofumigation Activity on Plant Parasitic Nematodes. Phytochem. Rev. 2017, 16, 827–834. [Google Scholar] [CrossRef]
10. Wei, F.; Passey, T.; Xu, X. Effects of Individual and Combined Use of Bio-Fumigation-Derived Products on the Viability of Verticillium Dahliae Microsclerotia in Soil. Crop Prot. 2016, 79, 170–176. [Google Scholar] [CrossRef]
11. Goswami, B.; Pariyar, B. Biofumigation-a Sustainable Alternative to Chemical Control of Soil Borne Pathogens: A Review. Int. J. Adv. Multidiscip. Res. Stud. 2024, 4, 134–138. [Google Scholar]
12. Gamliel, A.; van Bruggen, A.H.C. Maintaining Soil Health for Crop Production in Organic Greenhouses. Sci. Hortic. 2016, 208, 120–130. [Google Scholar] [CrossRef]
13. Céspedes, C.L.; Avila, J.G.; Martínez, A.; Serrato, B.; Calderón-Mugica, J.C.; Salgado-Garciglia, R. Antifungal and Antibacterial Activities of Mexican Tarragon (Tagetes lucida). J. Agric. Food Chem. 2006, 54, 3521–3527. [Google Scholar] [CrossRef] [PubMed]
14. Barros, A.F.; Campos, V.P.; da Silva, J.C.P.; Pedroso, M.P.; Medeiros, F.H.V.; Pozza, E.A.; Reale, A.L. Nematicidal Activity of Volatile Organic Compounds Emitted by Brassica Juncea, Azadirachta Indica, Canavalia Ensiformis, Mucuna Pruriens and Cajanus Cajan against Meloidogyne Incognita. Appl. Soil Ecol. 2014, 80, 34–43. [Google Scholar] [CrossRef]
15. Arnault, I.; Fleurance, C.; Vey, F.; Fretay, G.D.; Auger, J. Use of Alliaceae Residues to Control Soil-Borne Pathogens. Ind. Crops Prod. 2013, 49, 265–272. [Google Scholar] [CrossRef]
16. Wieczorek, R.; Zydlik, Z.; Zydlik, P. Biofumigation Treatment Using Tagetes Patula, Sinapis Alba and Raphanus Sativus Changes the Biological Properties of Replanted Soil in a Fruit Tree Nursery. Agriculture 2024, 14, 1023. [Google Scholar] [CrossRef]
17. Brant, V.; Pivec, J.; Fuksa, P.; Neckář, K.; Kocourková, D.; Venclová, V. Biomass and Energy Production of Catch Crops in Areas with Deficiency of Precipitation during Summer Period in Central Bohemia. Biomass Bioenergy 2011, 35, 1286–1294. [Google Scholar] [CrossRef]
18. Elhakeem, A.; van der Werf, W.; Bastiaans, L. Radiation Interception and Radiation Use Efficiency in Mixtures of Winter Cover Crops. Field Crops Res. 2021, 264, 108034. [Google Scholar] [CrossRef]
19. Morris, E.K.; Fletcher, R.; Veresoglou, S.D. Effective Methods of Biofumigation: A Meta-Analysis. Plant Soil 2020, 446, 379–392. [Google Scholar] [CrossRef]
20. Matthiessen, J.; Kirkegaard, J. Biofumigation and Enhanced Biodegradation: Opportunity and Challenge in Soilborne Pest and Disease Management. CRC Crit. Rev. Plant Sci. 2006, 25, 235–265. [Google Scholar] [CrossRef]
21. Hanschen, F.S.; Winkelmann, T. Biofumigation for Fighting Replant Disease-a Review. Agronomy 2020, 10, 425. [Google Scholar] [CrossRef]
22. Kirkegaard, J. Biofumigation for Plant Disease Control—From the Fundamentals to the Farming System. In Disease Control in Crops: Biological and Environmentally Friendly Approaches; Walters, D., Ed.; Wiley-Blackwell: Oxford, UK, 2009; pp. 172–195. [Google Scholar]
23. Fahey, J.W.; Zalcmann, A.T.; Talalay, P. The Chemical Diversity and Distribution of Glucosinolates and Isothiocyanates among Plants. Phytochemistry 2001, 56, 5–51. [Google Scholar] [CrossRef] [PubMed]
24. Clarkson, J.; Michel, V.; Neilson, R. Biofumigation for the Control of Soil-Borne Diseases. Soil Borne Disease Focus Group 2015. Available online: https://ec.europa.eu/eip/agriculture/sites/default/files/9_eip_sbd_mp_biofumigation_final_0.pdf (accessed on 1 November 2024).
25. Chekanai, V.; Neilson, R.; Roberts, D.; Edwards, S.; Back, M. In Vitro Nematicidal Efficacy of Brassica-Derived Isothiocyanates against the Root Lesion Nematode, Pratylenchus Penetrans. Nematology 2024, 26, 899–908. [Google Scholar] [CrossRef]
26. Agerbirk, N.; Olsen, C.E. Glucosinolate Structures in Evolution. Phytochemistry 2012, 77, 16–45. [Google Scholar] [CrossRef] [PubMed]
27. Rosa, E.A.S.; Heaney, R.K.; Fenwick, G.R.; Portas, C.A.M. Glucosinolate in Crop Plants. In Horticultural Reviews; Janick, J., Ed.; Wiley: Hoboken, NJ, USA, 1997; Volume 19, pp. 99–215. [Google Scholar]
28. Gimsing, A.L.; Kirkegaard, J.A. Glucosinolates and Biofumigation: Fate of Glucosinolates and Their Hydrolysis Products in Soil. Phytochem. Rev. 2009, 8, 299–310. [Google Scholar] [CrossRef]
29. Björkman, M.; Klingen, I.; Birch, A.N.E.; Bones, A.M.; Bruce, T.J.A.; Johansen, T.J.; Meadow, R.; Mølmann, J.; Seljåsen, R.; Smart, L.E.; et al. Phytochemicals of Brassicaceae in Plant Protection and Human Health—Influences of Climate, Environment and Agronomic Practice. Phytochemistry 2011, 72, 538–556. [Google Scholar] [CrossRef] [PubMed]
30. Bellostas, N.; Sørensen, J.C.; Sørensen, H. Profiling Glucosinolates in Vegetative and Reproductive Tissues of Four Brassica Species of the U-Triangle for Their Biofumigation Potential. J. Sci. Food Agric. 2007, 87, 1586–1594. [Google Scholar] [CrossRef]
31. Fourie, H.; Ahuja, P.; Lammers, J.; Daneel, M. Brassicacea-Based Management Strategies as an Alternative to Combat Nematode Pests: A Synopsis. Crop Prot. 2016, 80, 21–41. [Google Scholar] [CrossRef]
32. Brown, P.D.; Morra, M.J.; McCaffrey, J.P.; Auld, D.L.; Williams, L., III. Allelochemicals Produced during Glucosinolate Degradation in Soil. J. Chem. Ecol. 1991, 17, 2021–2034. [Google Scholar] [CrossRef] [PubMed]
33. Neubauer, C.; Heitmann, B.; Müller, C. Biofumigation Potential of Brassicaceae Cultivars to Verticillium Dahliae. Eur. J. Plant Pathol. 2014, 140, 341–352. [Google Scholar] [CrossRef]
34. Borek, V.; Elberson, L.R.; McCaffrey, J.P.; Morra, M.J. Toxicity of Isothiocyanates Produced by Glucosinolates in Brassicaceae Species to Black Vine Weevil Eggs. J. Agric. Food Chem. 1998, 46, 5318–5323. [Google Scholar] [CrossRef]
35. Jensen, J.; Styrishave, B.; Gimsing, A.L.; Hansen, H.C.B. The Toxic Effects of Benzyl Glucosinolate and Its Hydrolysis Product, the Biofumigant Benzyl Isothiocyanate, to Folsomia Fimetaria. Environ. Toxicol. Chem. 2010, 29, 359–364. [Google Scholar] [CrossRef]
36. Morra, M.J.; Kirkegaard, J.A. Isothiocyanate Release from Soil-Incorporated Brassica Tissues. Soil Biol. Biochem. 2002, 34, 1683–1690. [Google Scholar] [CrossRef]
37. Bellostas, N.; Sørensen, J.C.; Sørensen, H. Qualitative and Quantitative Evaluation of Glucosinolates in Cruciferous Plants during Their Life Cycles. Agroindustria 2004, 3, 5–10. [Google Scholar]
38. Kirkegaard, J.A.; Sarwar, M. Biofumigation Potential of Brassicas I. Variation in Glucosinolate Profiles of Diverse Field-Grown Brassicas. Plant Soil 1998, 201, 71–89. [Google Scholar] [CrossRef]
39. Kuai, J.; Sun, Y.; Zhou, M.; Zhang, P.; Zuo, Q.; Wu, J.; Zhou, G. The Effect of Nitrogen Application and Planting Density on the Radiation Use Efficiency and the Stem Lignin Metabolism in Rapeseed (Brassica napus L.). Field Crops Res. 2016, 199, 89–98. [Google Scholar] [CrossRef]
40. ISO 9167-1; Rapeseed—Determination of Glucosinolates Content—Part 1: Method Using High-Performance Liquid Chromatography. ISO: Geneva, Switzerland, 1992.
41. Yi, G.E.; Robin, A.H.K.; Yang, K.; Park, J.I.; Hwang, B.H.; Nou, I.S. Exogenous Methyl Jasmonate and Salicylic Acid Induce Subspecies-Specific Patterns of Glucosinolate Accumulation and Gene Expression in Brassica oleracea L. Molecules 2016, 21, 1617. [Google Scholar] [CrossRef] [PubMed]
42. Lake, L.; Sadras, V.O. Associations between Yield, Intercepted Radiation and Radiation Use Efficiency in Chickpea. In Proceedings of the 18th Australian Society of Agronomy Conference, Ballarat, Australia, 24–28 September 2017; Armstrong, R.D., Hafner, L., Eds.; Australian Society of Agronomy: Ballarat, Australia, 2017; pp. 24–28. [Google Scholar]
43. Wang, S.; Wang, E.; Wang, F.; Tang, L. Phenological Development and Grain Yield of Canola as Affected by Sowing Date and Climate Variation in the Yangtze River Basin of China. Crop Pasture Sci. 2012, 63, 478–488. [Google Scholar] [CrossRef]
44. Manevski, K.; Lærke, P.E.; Jiao, X.; Santhome, S.; Jørgensen, U. Biomass Productivity and Radiation Utilisation of Innovative Cropping Systems for Biorefinery. Agric. Meteorol. 2017, 233, 250–264. [Google Scholar] [CrossRef]
45. Larkin, R.P.; Griffin, T.S. Control of Soilborne Potato Diseases Using Brassica Green Manures. Crop Prot. 2007, 26, 1067–1077. [Google Scholar] [CrossRef]
46. Winde, I.; Wittstock, U. Insect Herbivore Counteradaptations to the Plant Glucosinolate-Myrosinase System. Phytochemistry 2011, 72, 1566–1575. [Google Scholar] [CrossRef]
47. Sarwar, M.; Kirkegaard, J.A. Biofumigation Potential of Brassicas II. Effect of Environment and Ontogeny on Glucosinolate Production and Implications for Screening. Plant Soil 1998, 201, 91–101. [Google Scholar] [CrossRef]
48. Torrijos, R.; Righetti, L.; Cirlini, M.; Calani, L.; Mañes, J.; Meca, G.; Dall’Asta, C. Phytochemical Profiling of Volatile and Bioactive Compounds in Yellow Mustard (Sinapis alba) and Oriental Mustard (Brassica juncea) Seed Flour and Bran. LWT 2023, 173, 114221. [Google Scholar] [CrossRef]
49. Ashiq, S.; Edwards, S.; Watson, A.; Blundell, E.; Back, M. Antifungal Effect of Brassica Tissues on the Mycotoxigenic Cereal Pathogen Fusarium Graminearum. Antibiotics 2022, 11, 1249. [Google Scholar] [CrossRef] [PubMed]
50. Ríos, P.; Obregón, S.; González, M.; de Haro, A.; Sánchez, M.E. Screening Brassicaceous Plants as Biofumigants for Management of Phytophthora Cinnamomi Oak Disease. For. Pathol. 2016, 46, 652–659. [Google Scholar] [CrossRef]
Арройо Дж. М., Солер Дж., Линарес Р., Палмеро Д. Стратегии выбора потенциально эффективных видов биофумигантов для достижения оптимальных результатов биофумигации. Сельское хозяйство. 2025; 15(2):147. https://doi.org/10.3390/agriculture15020147
Перевод статьи «Стратегии выбора потенциально эффективных видов биофумигантов для достижения оптимальных результатов биофумигации» авторов Арройо Дж. М., Солер Дж., Линарес Р., Палмеро Д, оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык

































































































Комментарии (0)