Оценка содержания биоактивных веществ в мелассе при ультразвуковой экстракции в разных условиях
Меласса сахарного тростника, являющаяся широко производимым побочным продуктом с высоким содержанием биологически активных соединений, обладает значительным потенциалом для переработки с целью получения ценных веществ.
Аннотация
Для экстракции биоактивных соединений из патоки сахарного тростника была исследована ультразвуковая экстракция с использованием различных гидроэтанольных растворителей (0, 2.5, 5, 7.5 и 10% этанола) при разных значениях pH (4.11, 5.11, 6.11 и 7.11). В полученных экстрактах патоки было определено содержание общих фенолов, мономерных антоцианов, общих флавоноидов, общих танинов и антиоксидантная способность (DPPH-тест), а также проведен анализ основных компонентов патоки методом ГХ-МС.
На основании ГХ-МС анализа патоки было установлено, что сахара и азотсодержащие соединения являются наиболее распространенными классами соединений. Гидроэтанольный растворитель с содержанием этанола 2.5% при pH 6.11 показал наиболее высокую эффективность экстракции в отношении общих фенолов (22074.98 мкг ГЭ/мл) и общих флавоноидов (245.42 мкг КЭ/мл). Кроме того, экстракция растворителем с 2.5% этанола при pH 5.11 позволила получить наибольшее количество общих танинов (1177.85 мкг ТЭ/мл). Поведение мономерных антоцианов при ультразвуковой экстракции гидроэтанольным растворителем было несколько иным: наибольшее их количество было экстрагировано 2.5% растворителем при pH 4.11 (11.1 мкг ЦГЭ/мл) и pH 7.11 (10.68 мкг ЦГЭ/мл). Результаты DPPH-теста показали, что экстракты, полученные с использованием 2.5% гидроэтанольного растворителя при pH 4.11 (68.35%) и pH 5.11 (68.10%), обладали наибольшей способностью к нейтрализации DPPH-свободных радикалов.
В заключение, ультразвуковая экстракция с применением 2.5% гидроэтанольного растворителя в диапазоне pH 4.11-6.11 оказалась наиболее подходящей для извлечения биологически активных соединений из патоки сахарного тростника.
1. Введение
Растущий интерес потребителей к продуктам, способствующим укреплению здоровья, усилил сильную тенденцию к утилизации биологически активных соединений из природных источников [1]. Считается, что добавление соответствующих соединений может улучшить качество и пищевую ценность переработанных пищевых продуктов, ингибируя разрушительные окислительные реакции во время хранения [2]. Биологически активные соединения — это природные или синтетические соединения, которые также способны вызывать широкий спектр биологических реакций и могут быть извлечены из различных биологических матриц животного, растительного и морского происхождения, а также из их побочных продуктов [3]. Таким образом, сахарный тростник, а также его продукты (соки) и побочные продукты (жмых, меласса), образующиеся при переработке, представляют собой признанный источник биологически активных соединений природного происхождения и продуктов реакции Майяра [4].
Меласса сахарного тростника, как побочный продукт сахарной промышленности, помимо содержания сахарозы, минералов, низкого количества жира и сырого протеина, богата биологически активными соединениями (фенольными кислотами, флавоноидами и танинами), которые обладают сильным антиоксидантным действием и высокой биологической активностью [5,6]. Тем не менее, в мелассе могут присутствовать различные типы и количества биологически активных соединений из-за условий экстракции, применяемых при переработке сахарного тростника [7,8]. Это в основном относится к меланоидинам, биологически активным соединениям, присутствующим в мелассе, которые могут проявлять различную биологическую активность, включая антиоксидантные, противоаллергенные, антимикробные и цитотоксические свойства, учитывая их роль в качестве восстановителей, хелаторов металлов и поглотителей радикалов [9]. Кроме того, фенольные кислоты, такие как феруловая кислота, п-кумаровая кислота, п-гидроксибензальдегид [10], хлорогеновая и сиринговая кислота [8], а также флавоноиды, а именно диосмин и свиртизин [8], являются одними из основных идентифицированных фенольных соединений с антиоксидантным действием в мелассе. Соответственно, меласса сахарного тростника и ее экстракт могут служить новым источником для получения и использования биологически активных соединений, представляя собой природную альтернативу, богатую антиоксидантными и антибактериальными соединениями, пригодными для замены химических консервантов в пищевой промышленности [11].
Однако отрасль сталкивается с проблемами преобразования соответствующих значительных остатков и побочных продуктов в экономически выгодные пищевые ингредиенты, а зеленые технологии экстракции с использованием экологически чистых растворителей представляют собой перспективный подход. Среди них ультразвуковая экстракция (UAE) признана зеленой технологией экстракции, которая обеспечивает высокую эффективность извлечения биологически активных соединений при умеренных температурах благодаря образованию кавитационных пузырьков, генерируемых акустическими волнами. Последующий разрыв кавитационных пузырьков при контакте с поверхностью материала может увеличить процесс массопереноса целевого соединения в растворитель и эффективно предотвратить деградацию активных соединений при высоких температурах [12,13]. Более того, использование UAE приводит к улучшению выхода экстракции общего содержания полифенолов, общего содержания мономерных антоцианов и общей антиоксидантной способности [14].
Научные источники определили использование подходящего растворителя как один из важнейших аспектов извлечения фенольных и других биологически активных соединений из мелассы сахарной свеклы [12]. Соответственно, использование экологически чистого растворителя, такого как этанол, который является пригодным для повторного использования, нетоксичным, применимым в пищевой промышленности и, как было установлено, сохраняет биологически активные соединения во время хранения [15,16], является еще одним способом повысить экстрагируемость биологически активных соединений и решить проблему устойчивости пищевых продуктов. Шагом вперед в применении экологически чистых растворителей, безусловно, является использование гидроэтанольного растворителя, который в качестве основного преимущества обеспечивает наиболее полное извлечение как индивидуальных, так и смесей гидрофильных и липофильных биологически активных соединений [16]. Однако этот подход остается недостаточно изученным в отношении мелассы, особенно с учетом гидроэтанольных растворителей с низкой долей этанола (до 10%).
Меласса сахарной свеклы, подвергнутая UAE с использованием кислого этанола в качестве растворителя, дала перспективные результаты в отношении общего содержания фенолов (173 мкг ГЭ/г), общего содержания антоцианов (318 мкг/г), а также общей антиоксидантной способности (43%) [12]. Обзор литературы показывает, что использование воды для приготовления водного экстракта мелассы сахарного тростника [17] и этанола для приготовления спиртового экстракта [8], содержащего биологически активные соединения, обладающие биологической активностью, расширяется, но использование гидроэтанольного растворителя для этих целей является редким. Соответственно, сочетание зеленых технологий экстракции, таких как UAE, с гидроэтанольным растворителем с низкой долей этанола в качестве среды для экстракции при получении биологически активных соединений из мелассы сахарного тростника может внести улучшения в отношении их сохранения, уменьшить нагрузку на окружающую среду за счет снижения потребления этанола, что соответствует Целям устойчивого развития (ЦУР), и снизить высокую стоимость восстановления этанола после экстракции. Одновременно большое количество фенольных соединений может быть извлечено за более короткое время и с низким энергопотреблением.
Учитывая представленный пробел в исследованиях, настоящее исследование было направлено на изучение синергетического эффекта UAE и гидроэтанольного растворителя (доля от 2,5 до 10%) в качестве среды экстракции на содержание различных биологически активных соединений (фенолы, флавоноиды, танины, антоцианы) и их антиоксидантную активность (DPPH) в экстракте мелассы сахарного тростника. Одновременно оценивалось влияние различных значений pH на эффективность экстракции отдельных типов биологически активных соединений, а также была охарактеризована меласса сахарного тростника с точки зрения профилей сахаров, органических кислот и азотистых соединений. Цель исследования состояла в том, чтобы способствовать применению экстракта мелассы сахарного тростника, богатого биологически активными соединениями, в разработке новых полезных для здоровья пищевых продуктов.
2. Материалы и методы
2.1. Материалы
Образцы мелассы сахарного тростника (80° Брикса) были получены с заводов по переработке сахарного тростника (Ахваз, Иран) с приблизительным содержанием сахарозы и золы 60 и 11% соответственно и были вручную гомогенизированы перед использованием.
Химические реактивы аналитической чистоты, такие как реактив Фолина–Чокальтеу (2 Н), карбонат натрия, нитрит натрия, гексагидрат хлорида алюминия, гидроксид натрия, хлорид калия, метабисульфит калия, соляная кислота, тригидрат ацетата натрия, хлорид железа (III) и ферроцианид калия, а также стандарты галловой кислоты, кверцетина, цианидин-3-глюкозида, катехина и 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновой кислоты (Trolox), были приобретены у компании Merck (Рахвей, Нью-Джерси, США). Для приготовления гидроэтанольных растворителей использовался этанол пищевого качества.
2.2. Методы
2.2.1. ГХ-МС анализ мелассы сахарного тростника
Анализ соединений (первичных метаболитов) в лиофилизированной (0,05 мбар, в течение ночи) и силилированной мелассе сахарного тростника проводился с использованием методики ГХ-МС в соответствии с методом Ali et al. [18].
ГХ анализ образцов выполняли с использованием системы Agilent 7890A Network GC (Agilent Technologies, Санта-Клара, Калифорния, США) с пламенно-ионизационным детектором (310 °C) и инжектором в режиме split (объем 1,0 мкл, температура 250 °C). Разделение проводили на колонке Agilent HP 5MS (Agilent Technologies, Санта-Клара, Калифорния, США) (длина 30 м × внутренний диаметр 0,25 мм, толщина пленки 0,25 мкм) в следующих условиях: газ-носитель гелий со скоростью потока 1,1 мл мин−1 и давление в колонке, установленное на 8,13 PSI. Температура термостата колонок первоначально поддерживалась на уровне 50 °C в течение 2 мин после инжекции, а затем повышалась до 310 °C со скоростью 8 °C мин−1 и оставалась постоянной при 310 °C в течение 12 мин. Соединения идентифицировали с использованием библиотеки Wiley и литературы (NIST Chemistry WebBook, NIST Standard Reference Database Number 69, Национальный институт стандартизации и технологий, Гейтерсберг, Мэриленд, США) путем сопоставления их индексов удерживания и паттернов масс-спектров с доступными референсными спектрами.
2.2.2. Приготовление образцов
Определенное количество мелассы сахарного тростника (2 г) разбавляли 60 мл гидроэтанольных растворителей, содержащих различную долю этанола (0, 2,5, 5, 7,5 и 10% этанола), с последующей корректировкой до 4 уровней pH (4,11, 5,11 (исходный pH мелассы сахарного тростника), 6,11 и 7,11). Для корректировки pH растворов мелассы использовали карбонат натрия (20% об./об.) и лимонную кислоту (20% об./об.). Приготовленные образцы подвергали UAE в ультразвуковой ванне в следующих условиях: 45 °C в течение 30 мин при частоте 35 кГц и мощности 450 Вт (Bandelin Sonorex, Берлин, Германия) [11]. Экстракты мелассы, освобожденные от этанола с помощью роторного вакуумного испарителя при 55 °C и 100 мбар (Rotavapor® R-100, BUCHI, Берлин, Германия), использовали для последующего анализа.
2.2.3. Определение общего содержания фенолов
Для определения общего содержания фенолов (TPC) применяли метод Фолина–Чокальтеу [19] (50 мкл экстракта) с детектированием поглощения при 765 нм (Jenway 6405 UV/Vis, Стаффордшир, Великобритания). TPC выражали в эквиваленте галловой кислоты (мкг ГЭ/мл экстракта).
2.2.4. Определение общего содержания флавоноидов
Для оценки общего содержания флавоноидов (TFC) применяли алюмохлоридный колориметрический метод, описанный Chang et al. [20], с детектированием поглощения при 510 нм (Jenway 6405 UV/Vis, Стаффордшир, Великобритания) (50 мкл экстракта), выражая результат в эквиваленте кверцетина (мкг КЭ/мл экстракта).
2.2.5. Определение общего содержания танинов
Общее содержание танинов в образцах (50 мкл экстракта) измеряли при 395 нм (Jenway 6405 UV/Vis, Стаффордшир, Великобритания) и выражали в эквиваленте катехина (мкг КЭ/мл экстракта) [21].
2.2.6. Определение содержания мономерных антоцианов
Для оценки содержания мономерных антоцианов (300 мкл экстракта) использовали дифференциальный метод pH, следуя процедуре Lao and Giusti [20], путем измерения оптической плотности при 520 и 700 нм (Jenway 6405 UV/Vis, Стаффордшир, Великобритания). Расчеты проводили в соответствии с Lao and Giusti [22], а содержание антоцианов выражали в эквиваленте цианидин-3-глюкозида (мкг Ц3Г/мл экстракта).
2.2.7. Определение общей антиоксидантной способности с использованием свободных радикалов DPPH
Значение поглощения экстрактов мелассы измеряли при 517 нм (Jenway 6405 UV/Vis, Стаффордшир, Великобритания) после одного часа выстаивания реакционной смеси, содержащей образец (150 мкл экстракта) и 0,1 мМ метанольный раствор DPPH (3 мл). В качестве стандарта использовали Trolox, а ингибирующую способность экстрактов выражали в % ингибирования DPPH [17]. Дополнительно был рассчитан IC50 (мг/мл) — концентрация тестируемого раствора, необходимая для ингибирования 50% доступных свободных радикалов DPPH, следуя функции, связывающей проценты ингибирования DPPH, достигнутые образцами при различных концентрациях [17].
2.3. Статистический анализ
Эксперименты проводили с использованием метода полностью рандомизированного дизайна с двумя переменными, pH (на 4 уровнях) и этанол (на 5 уровнях), в 3 повторностях. Для сравнения различных средних значений на уровне значимости 5% (p < 0,05) использовали тест Дункана. Анализ данных проводили с использованием статистического программного обеспечения SAS (версия 9.1) (Institute Inc., Кэри, Северная Каролина, США), в то время как Excel (2013) использовали для графического представления результатов. Дополнительно анализ главных компонент (PCA) был выполнен с использованием программного обеспечения Statistica (Tibco Inc., Пало-Альто, Калифорния, США, 2020, версия 14.0.0.15).
3. Результаты и обсуждение
3.1. Соединения мелассы сахарного тростника, идентифицированные с помощью ГХ-МС анализа
Всего 17 соединений были идентифицированы в исследуемой мелассе сахарного тростника с помощью GS-MC анализа, и они представлены в таблице 1. Обнаруженные классы соединений включали спирты, неорганические и органические кислоты, азотистые соединения, а также сахара.
Таблица 1. Идентифицированные соединения и их содержание наряду с соответствующими временами удерживания (Rt), полученными с помощью ГХ-МС анализа мелассы сахарного тростника.
Как и ожидалось, соединения, принадлежащие к классу сахаров, были наиболее распространенными, с восемью идентифицированными соединениями, из которых сахароза составляет 59,74%, за ней следуют талоза (9,94%) и маннопираноза (9,19%) (Таблица 1). По сравнению с предыдущим исследованием мелассы сахарного тростника из Египта [18], были получены более высокие количества для маннопиранозы 6-дезокси, фруктозы и галактофуранозы, а также для сахарозы и редких сахаров, таких как аллюлоза и талоза.
Присутствие аллюлозы (D-аллюлозы), как сахара с многочисленными положительными физиологическими эффектами, такими как регуляция метаболизма липидов, нейропротекция, а также противодействие ожирению [23] в более высоких количествах, является крайне желательным, особенно с учетом того, что она общепризнана как безопасная (GRAS, GRN No. 1057), что согласуется с критериями «чистой этикетки» пищевых продуктов. Аналогично, талоза может служить прекурсором для синтеза антибиотиков, в то время как ее метилированные формы могут служить ингибиторами воспалительных процессов [24].
Тем не менее, для исследуемой мелассы было отмечено отсутствие D-тагатозы и D-аллозы, хотя соответствующие сахара ранее были обнаружены в мелассе сахарного тростника в количестве ~7 и ~5% соответственно [18]. Наблюдаемые расхождения в полученных результатах и литературных данных можно объяснить применяемыми агротехническими мерами во время роста сахарного тростника, а также условиями во время его переработки. Что касается органических кислот, яблочная кислота, которая естественным образом присутствует в сахарном тростнике, была наиболее распространенной в исследуемой мелассе, что согласуется с результатами Ali et al. [18]. Кроме того, было подтверждено присутствие молочной кислоты как соединения, образующегося во время переработки сахарного тростника (Таблица 1). Дополнительно были обнаружены N,O-гидроксиламин, а также незначительные количества (<0,8%) пипеколиновой кислоты, этиленгликоля и фосфата (Таблица 1), что соответствует результатам Ali et al. [18].
3.2. Общее содержание фенолов в экстрактах мелассы сахарного тростника
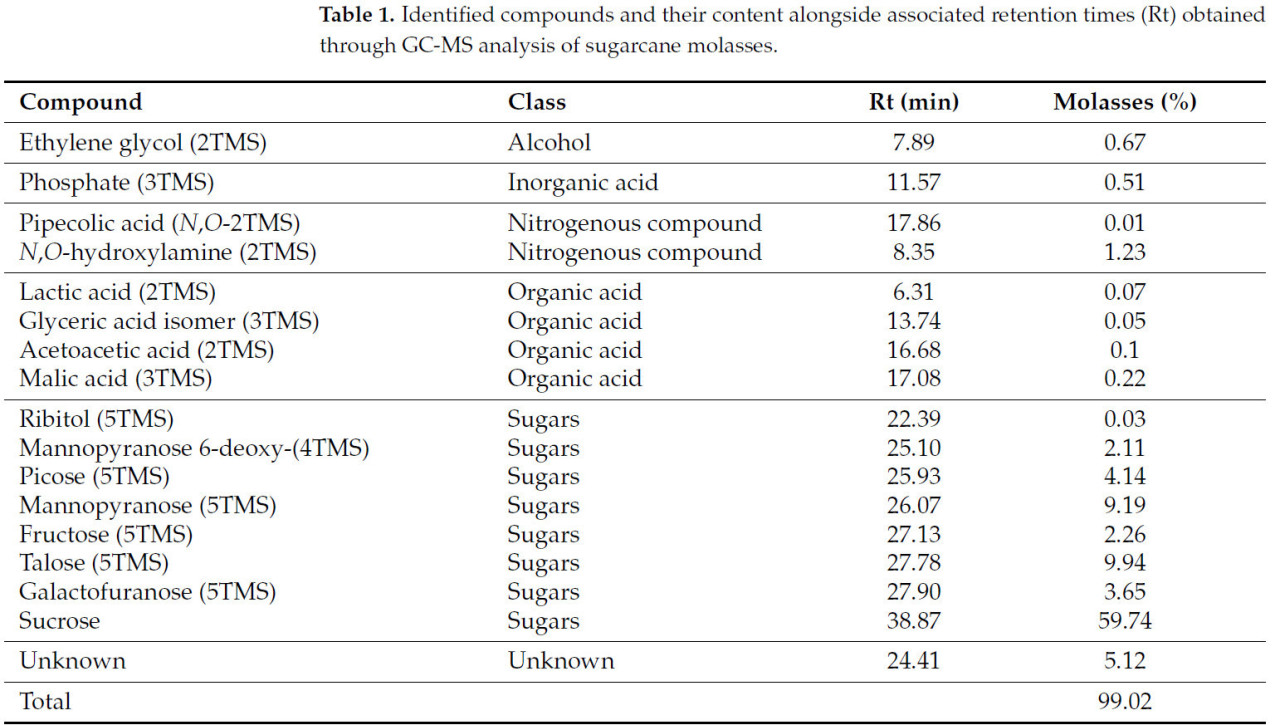
Влияние используемого гидроэтанольного растворителя и применяемого pH во время UAE на биологически активные фенольные соединения из мелассы сахарного тростника показано на рисунке 1a. Результаты указывают, что комбинация применяемого pH и этанола в растворителе оказывала значительное влияние на содержание извлеченных фенольных соединений (p ˂ 0,05). TPC варьировался от 14 925 до 22 075 мкг ГЭ/мл в зависимости от экспериментальных условий (Рисунок 1a).
Рисунок 1. Влияние ультразвуковой гидроэтанольной (EtOH-доля этанола 0, 5, 7,5 и 10%) экстракции и pH (4,11, 5,11, 6,11, 7,11) на мелассу сахарного тростника: (a) общее содержание фенолов; (b) общее содержание флавоноидов. Столбцы с разными буквами указывают на статистически значимую разницу при p < 0,05.
Максимальная способность к экстракции фенольных соединений была получена при использовании гидроэтанольного растворителя, содержащего 2,5% этанола, при pH 6,11 (22 074,98 мкг ГЭ/мл) и 7,11 (20 675,03 мкг ГЭ/мл) (Рисунок 1a). Высокое содержание TPC в экстрактах мелассы сахарного тростника при упомянутых условиях экстракции может быть следствием лучшей пригодности смесей растворителей (этанол и вода) по сравнению с индивидуальными растворителями и лучшего соответствия полярности фенольных соединений мелассы сахарного тростника и гидроэтанольной смеси растворителей, что является ключевым для процесса экстракции. Полученный TPC был выше, чем TPC этанольного экстракта мелассы сахарного тростника с долей этанола 75% (17 400 мкг ГЭ/г) [8], а также экстракта с 50% (об./об.) этанолом (2795,60 мкг ГЭ/г) [25] и водных экстрактов мелассы сахарного тростника [19,20]. Более того, полученные результаты TPC были выше по сравнению с UAE экстрактами мелассы сахарной свеклы, полученными в оптимизированных условиях с 57–63% этанолом [12]. Более высокая доля этанола в гидроэтанольном растворителе в сочетании с UAE при том же pH (6,11 и 7,11) была менее эффективна для экстракции фенольных соединений из мелассы сахарного тростника, что контрастирует с мелассой сахарной свеклы, где увеличение TPC было достигнуто с увеличением концентраций этанола при фиксированной концентрации HCl (1,55–1,72 моль·л−1) [12]. Дополнительно, кислые условия (более высокие концентрации HCl) и более низкое содержание этанола (~60%) дали наибольший TPC экстракта мелассы сахарной свеклы, в то время как сильно кислые условия в данном исследовании (pH 4,11 и 5,11) вызвали снижение TPC экстрактов, за исключением тех, которые содержали 10% этанола (Рисунок 1). Предполагается, что возможное разрушение фенольных соединений, чувствительных к изменениям pH [26], может происходить, снижая эффективность их экстракции.
Соответственно, для соответствующего гидроэтанольного растворителя, содержащего 2,5% этанола, потребление этанола может быть уменьшено, что способствует снижению нагрузки на окружающую среду и снижению высокой стоимости восстановления этанола, используемого во время экстракции, в то время как большое количество фенольных соединений может быть извлечено за более короткое время и с использованием малого количества энергии с помощью UAE. Из-за предполагаемого полезного для здоровья эффекта, связанного со снижением окислительного стресса и связанных с ним состояний, привлекательность фенольных соединений для использования в пищевой промышленности помимо их консервирующей роли возрастает.
3.3. Общее содержание флавоноидов в экстрактах мелассы сахарного тростника
Значительное влияние (p < 0,05) используемой доли гидроэтанольного растворителя и pH во время UAE на экстрагируемость флавоноидов из мелассы сахарного тростника также было подтверждено (Рисунок 1b). TFC варьировался от 193 до 246 мкг/мл в зависимости от применяемых условий.
Комбинация гидроэтанольного растворителя с 2,5% этанола и UAE при pH 6,11 (245,42 мкг КЭ/мл) и 7,11 (236,33 мкг КЭ/мл) проявила наибольшее сродство к экстракции флавоноидных соединений (Рисунок 1b). Соответственно, широкое использование органических растворителей, смешанных с различными пропорциями воды, успешно применялось для экстракции флавоноидов из растительных источников с помощью UAE [27]. Интересно, что более низкие проценты этанола (2,5%) показали наибольший эффект на экстракцию важных биологически активных флавоноидных соединений. Вероятно, это связано с типом флавоноидов, присутствующих в мелассе, и также является следствием присутствия сахарного остатка, обнаруженного в мелассе, который обычно увеличивает растворимость свободных флавоноидов в воде. Дополнительно, присутствие флавоноидных гликозидов, которые обычно растворимы в высокополярных растворителях, таких как вода, метанол и этанол, усилило экстракцию флавоноидов [28]. Учитывая, что флавоноидные соединения, присутствующие в сахарном тростнике, в основном находятся в форме C-гликозидов [18], менее полярные части компонентов флавоноидных гликозидов растворимы в этаноле, а те, которые имеют более высокую полярность, растворимы в воде; таким образом, доля 2,5% этанола в растворителе была правильной пропорцией для достижения наибольшего TFC [29]. Полученные результаты были выше по сравнению с TFC 50% (об./об.) этанольных экстрактов мелассы сахарного тростника (101,8 мкг КЭ/г) [25], но значительно ниже по сравнению с результатами UAE мелассы сахарного тростника с 70% этанолом (79 500 мкг ЭР/г) [5], а также метанольных экстрактов (2970 мкг КЭ/г) [18]. Наблюдаемые расхождения в отчетных результатах являются следствием множества факторов (происхождение сырья, вариации производственного процесса), а также отсутствия стандартизированных методических протоколов для такого рода аналитического определения [3,17].
Хотя большие выходы флавоноидов обычно регистрируются при экстракции в кислой среде, потому что большинство флавоноидов обладают фенольными гидроксильными группами, количество и положение которых определяют их кислотность [28], в настоящем исследовании большее содержание флавоноидов было получено в слабокислых и нейтральных условиях (pH 6,11 и 7,11). Аналогично, Ghosh, Chakraborty, and Raychaudhuri [30] заявили, что с повышением значений pH с 3,5 до 6,5 TFC увеличивался и в ферментированных пальмовых соках. Предполагается, что более высокая эффективность экстракции флавоноидов при упомянутом pH может быть следствием параметров экстракции (мощность, температура, продолжительность экстракции) и их независимых или интерактивных эффектов с другими составляющими мелассы, такими как сахара, т.е. различные релевантные сахарные остатки [31].
Это демонстрирует, что гидроэтанольный растворитель с малой долей этанола может служить растворителем с лучшей экстрагирующей способностью для флавоноидов в сочетании с UAE, чем классическая этанольная экстракция, которая требует большего расхода этанола, без значительных изменений исходного значения pH мелассы сахарного тростника.
3.4. Общее содержание танинов в экстрактах мелассы сахарного тростника
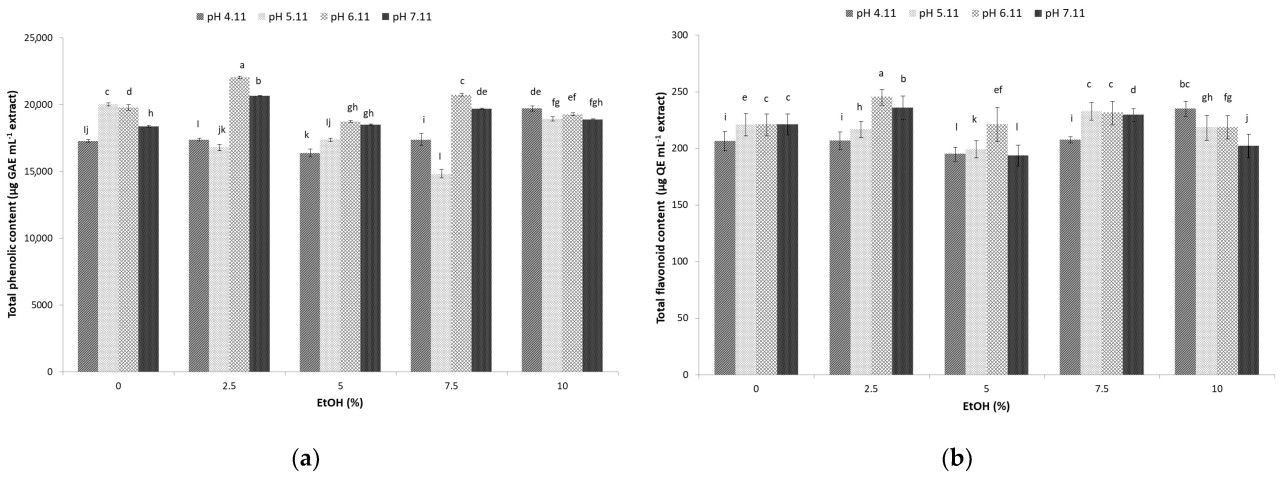
Танины являются полимерными соединениями с высокой пищевой ценностью, которые могут быть извлечены из мелассы сахарного тростника с использованием UAE и гидроэтанольных растворителей. Результаты, представленные на рисунке 2a, показывают, что комбинация pH и процентного содержания этанола в UAE оказывает значительное влияние на скорость экстракции танинов (диапазон 260–1178 мкг КЭ/мл, p < 0,05). Результаты указывают, что использование UAE с гидроэтанольным растворителем, содержащим 2,5% этанола при pH 5,11 (1177,85 мкг КЭ/мл) и 7,5% этанола при pH 6,11 (1009,45 мкг КЭ/мл), имело наибольшую способность к экстракции танинов из мелассы сахарного тростника (Рисунок 2a). Хотя данных о содержании танинов в мелассе сахарного тростника немного, сообщалось, что функциональные напитки, приготовленные из мелассы сахарного тростника, содержат 93,6 мкг КЭ/мл танинов [32], что меньше, чем количество, указанное здесь. Более того, примерно в два раза более высокое общее содержание танинов было обнаружено в этанольном экстракте мякоти сахарной свеклы (2200 мкг ГЭ/г сухой массы) без указания доли этанола [33].
Рисунок 2. Влияние ультразвуковой гидроэтанольной (EtOH-доля этанола 0, 5, 7,5 и 10%) экстракции и pH (4,11, 5,11, 6,11, 7,11) на мелассу сахарного тростника: (a) общее содержание танинов; (b) содержание мономерных антоцианов. Столбцы с разными буквами указывают на статистически значимую разницу при p < 0,05.
Вода представляет собой предпочтительный растворитель для экстракции танинов в промышленных масштабах, в то время как добавление этанола способствует эффективности экстракции, как и ультразвук [34]. Более того, кислая среда оказывается благоприятной с точки зрения экстракции танинов, вероятно, как следствие усиленного высвобождения танинов из мелассы сахарного тростника, как предполагалось ранее для виноградного сусла [35]. Вклад UAE как метода экстракции в экстрагируемость танинов, как ожидается, также будет значительным на основе предыдущих результатов [36]. К сожалению, недостаточно данных, имеющих отношение для сравнения, доступно в отношении продуктов и побочных продуктов сахарной промышленности.
3.5. Содержание мономерных антоцианов в экстрактах мелассы сахарного тростника
Антоцианы являются полимерными соединениями с молекулами сахара в их структуре и обладают пищевой ценностью. Применение UAE с гидроэтанольным растворителем оказало положительное влияние на экстракцию антоцианов из мелассы сахарного тростника, с содержанием в диапазоне 2,67–11,1 мкг Ц3Г/мл (p < 0,05). Предполагается, что массоперенос интенсифицируется, обеспечивая более легкий доступ растворителя к молекулам антоцианов, под действием ультразвуковых волн и создаваемого кавитационного эффекта [37].
Более того, результаты, представленные на рисунке 2b, показывают, что комбинация pH и процентного содержания этанола для UAE оказывает значительное влияние на экстракцию антоцианов. Использование 2,5% этанола при pH 4,11 (11,1 мкг Ц3Г/мл) и 7,11 (10,68 мкг Ц3Г/мл) было наиболее эффективным в отношении экстракции антоцианов. Более высокие проценты этанола не показали положительного влияния на эффективность экстракции этих важных биологически активных соединений (Рисунок 2b). Аналогично, Liu et al. [38] сообщили о снижении выхода антоцианов, экстрагированных из плодов Malus 'Royalty' с использованием UAE, когда содержание этанола увеличивалось до 100%.
Это можно объяснить тем, что антоцианы классифицируются в группу водорастворимых фенольных пигментов [22,39], что позволяет их лучше экстрагировать в гидроэтанольных растворителях с более высоким содержанием воды. Это также было замечено ранее во время UAE мелассы сахарной свеклы, где растворитель с наименьшей долей этанола (60%) давал наибольшее содержание антоцианов при сходной температуре обработки (41 °C) [12].
Другими факторами, влияющими на стабильность антоцианов и, следовательно, на их содержание, безусловно, являются pH и время ультразвуковой обработки. В соответствии с результатами, полученными здесь, кислая среда была наиболее благоприятной для экстракции антоцианов из мелассы сахарной свеклы с помощью UAE [12]. Продолжительная ультразвуковая обработка (70 мин) также оказала положительное влияние на антоцианы в отношении мелассы сахарной свеклы [12]. Однако полученные здесь результаты значительно ниже по сравнению с данными о содержании антоцианов в UAE экстракте мелассы сахарной свеклы, которое составляло 318,3 мкг/г [12], а также разбавленной мелассы сахарной свеклы, на уровне 14,7 мкг/г [40]. Концентрация химических соединений в сахарном тростнике зависит от различных факторов, включая географическое положение, которые влияют на содержание флавоноидов и антоцианов в сахарном тростнике и, следовательно, в мелассе [41]. Дополнительно, отмеченные расхождения можно объяснить изменчивостью содержания антоцианов между различными сортами сахарного тростника [39], аналогично растворителю, но также потенциальным гидролизом антоцианов, вызванным применением ультразвука [42].
3.6. Общая антиоксидантная способность экстрактов мелассы сахарного тростника, определенная с использованием свободных радикалов DPPH
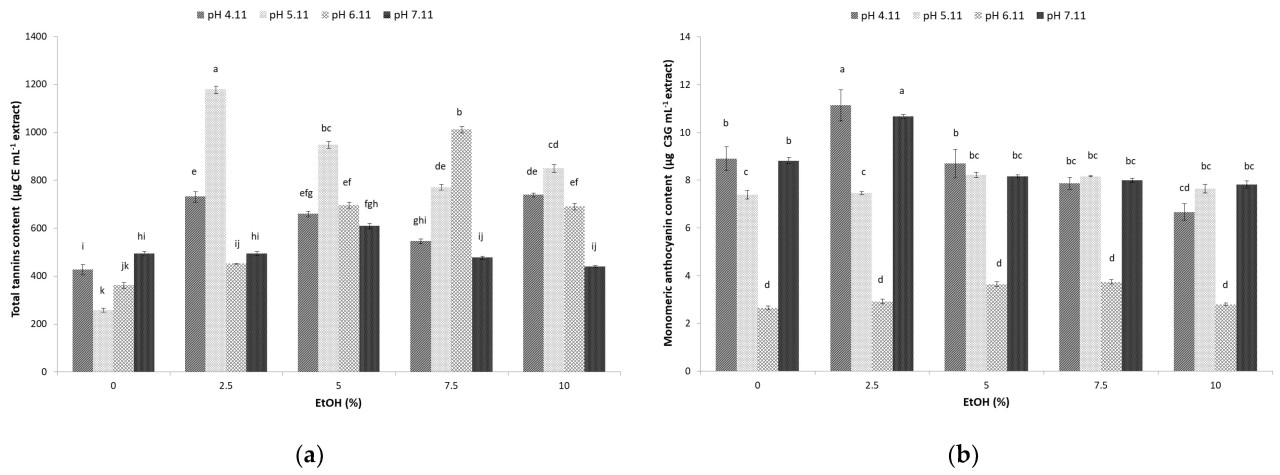
Биологически активные соединения, включая фенолы, флавоноиды, танины и антоцианы, присутствующие в мелассе сахарного тростника, активно удаляют свободные радикалы (свободные радикалы DPPH) и обладают высокой пищевой ценностью [18]. Экстракция этих биологически активных соединений из мелассы сахарного тростника путем сочетания гидроэтанольного растворителя и UAE при различных значениях pH была выполнена, и результаты антиоксидантной способности, выраженные в % ингибирования по отношению к свободным радикалам DPPH, представлены на рисунке 3. Антиоксидантная способность экстрактов мелассы сахарного тростника колебалась от 56,05 до 68,35% (p < 0,05) в зависимости от применяемых условий, что подразумевает значительное влияние pH и доли этанола.
Рисунок 3. Влияние ультразвуковой гидроэтанольной (EtOH-доля этанола 0, 5, 7,5 и 10%) экстракции и pH (4,11, 5,11, 6,11, 7,11) на общую антиоксидантную способность мелассы сахарного тростника. Столбцы с разными буквами указывают на статистически значимую разницу при p < 0,05.
Использование гидроэтанольного растворителя с 2,5% этанола при pH 4,11 (IC50 2,53 мг/мл (68,35%)) и 5,11 (IC50 2,53 мг/мл (68,1%)) во время UAE показало наивысшую эффективность в экстракции биологически активных соединений со способностью к ингибированию свободных радикалов DPPH (Рисунок 3). Более высокие проценты этанола не показали положительного влияния на антиоксидантную способность экстрактов мелассы сахарного тростника, что согласуется с предыдущими выводами относительно гидроэтанольных экстрактов растительных материалов (ароматические растения, листья оливы и апельсина) [15,16]. Это наблюдение можно объяснить тем, что биологически активные соединения мелассы сахарного тростника, проявляющие антиоксидантную активность, имеют более полярную природу, что позволяет их лучше экстрагировать в гидроэтанольных смесях, содержащих более низкую долю этанола, чем в абсолютном этаноле [16]. Действительно, фенольные кислоты мелассы сахарного тростника (феруловая кислота, п-кумаровая кислота, п-гидроксибензальдегид, хлорогеновая и сиринговая кислота), содержащие карбоксильную группу, и флавоноиды (гликозиды), считающиеся ковалентными полярными молекулами, проявляют большее предпочтение к растворителям с более низкой долей этанола [43].
Хотя предыдущие исследования проводили измерения антиоксидантной активности в мелассе сахарного тростника с использованием DPPH, сравнение результатов затруднено из-за возможности выражать результаты несколькими способами. В исследованиях Valli et al. [44] и Molina-Cortés et al. [17] по мелассе сахарного тростника результаты были выражены как IC50, относящийся к концентрации образца, необходимой для достижения 50% ингибирования радикалов DPPH. IC50 2,53 мг/мл, полученный здесь, был выше по сравнению с 1,47 мг/мл, о которых сообщили Valli et al. [44], но он также был намного ниже, учитывая результаты, полученные Molina-Cortés et al. [17] для C мелассы (6,77 мг/мл), что подразумевает как более низкую, так и более высокую антиоксидантную активность гидроэтанольного экстракта мелассы сахарного тростника, полученного в настоящем исследовании, соответственно.
Сахарный тростник и меласса являются богатыми источниками биологически активных соединений, таких как фенолы, терпеноиды, фитостеролы и различные фенольные кислоты (п-кумаровая, галловая, хлорогеновая и феруловая кислота) [4]. Было обнаружено, что эти соединения обладают биологической активностью и положительной корреляцией с ингибированием свободных радикалов в лабораторных условиях [45]. DPPH реагирует с фенольными соединениями посредством двух механизмов: быстрого последовательного потери протона-переноса электрона (SPLET) в ионизирующих растворителях (таких как этанол) и более медленного переноса атома водорода (HAT) в неионизирующих растворителях или в присутствии кислоты [46]. Более того, предполагается, что перераспределение –OH радикалов на кольцах фенольных молекул может происходить при различных значениях pH во время моделированного пищеварения [47] и, следовательно, изменять стабильность биологически активных соединений и их антиоксидантную активность. В этом отношении роль pH в организме человека многогранна; это движущая сила различных жизненно важных реакций (внутриклеточный синтез аденозинтрифосфата (АТФ) и перенос кислорода в мышечных тканях), в то время как в кишечном тракте он создает оптимальную среду для действия пищеварительных и метаболических ферментов и бактерицидных эффектов кислот [48]. Учитывая, что наивысшая антиоксидантная способность, полученная здесь, достигается при pH 4,11 и 5,11, можно сказать, что фенольные соединения в мелассе сахарного тростника будут вести себя как очень хорошие антиоксиданты в кислых условиях (в желудочном просвете), в то время как они не будут столь эффективны при pH 7–8, что характерно для кишечного тракта, крови, внеклеточной жидкости и внутри клеток [49]. Дополнительно, возможные практические применения извлеченных фенольных соединений мелассы сахарного тростника могут включать безалкогольные напитки, съедобные пленки и активные упаковочные материалы, тем самым улучшая стабильность чувствительных к окислению пищевых продуктов.
3.7. Анализ главных компонент
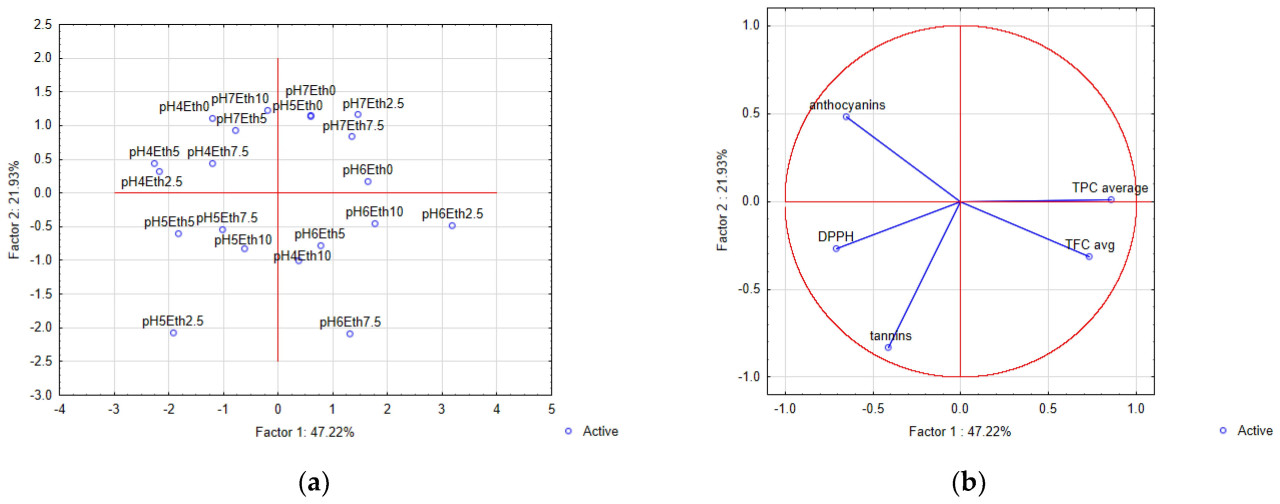
Анализ главных компонент (PCA) использовался как ценный инструмент для группировки сходных ответов, а также для дифференциации противоположных. Изменчивость применяемого pH и доли этанола во время UAE объяснялась двумя основными компонентами на целых 69,15% (Рисунок 4).
Рисунок 4. Анализ главных компонент (PCA), показывающий (a) график нагрузок и (b) график оценок, описывающий взаимосвязь между определенными биологически активными соединениями и различными условиями ультразвуковой гидроэтанольной экстракции (доля этанола и pH). Eth, этанол.
Главный компонент 1 (PC1) объяснял 47,22% общей дисперсии, в то время как главный компонент 2 (PC2) объяснял 21,93% дисперсии (Рисунок 4). Было показано, что гидроэтанольные экстракты мелассы сахарного тростника с долями этанола 2,5, 5, 7,5 и 10% при pH 5,11 (отрицательный левый квадрант, Рисунок 4a) оказывали отрицательное влияние на расчеты PC1 и PC2, но соответствующие условия экстракции обеспечивали большую антиоксидантную активность по DPPH и содержание танинов. Экстракты, полученные при pH 6,11 и долях этанола 2,5, 5, 7,5 и 10%, проявляли положительный эффект на PC1, но отрицательный на PC2 (Рисунок 4a) и были связаны с содержанием TFC (Рисунок 4b). Более того, наименьшая доля этанола в гидроэтанольном растворителе, используемом для UAE мелассы сахарного тростника при pH 5,11, 6,11 и 7,11 (положительный правый квадрант, Рисунок 4a), положительно влияла на расчеты координат PC1 и PC2 и была связана с большим TPC (Рисунок 4b). В оставшемся квадранте pH 4,11 и pH 7,11 вместе с долями этанола 0–10% положительно влияли на расчеты PC2 и отрицательно на PC1 (Рисунок 4a) и были связаны с содержанием антоцианов (Рисунок 4b). Дополнительно, значения DPPH находятся в том же квадранте, что и общие танины (Рисунок 4b), что указывает на то, что соответствующие условия благоприятны для экстракции этих биологически активных соединений, что может быть связано с их гидроксильными группами, в соответствии с предыдущими исследованиями [16,34]. В то же время для наиболее эффективной экстракции общих фенолов, флавоноидов и антоцианов следует применять различные условия (Рисунок 4b). Соответственно, при использовании PCA для образцов экстракта мелассы сахарного тростника были определены наиболее подходящие условия экстракции в отношении pH, а также долей этанола в растворителе, которые обеспечивают большее содержание биологически активных соединений и антиоксидантную активность.
4. Выводы
Экстракт мелассы сахарного тростника содержит биологически активные соединения, такие как фенолы, флавоноиды, танины и антоцианы, которые обладают высокой пищевой ценностью и антиоксидантной способностью с потенциалом использования в пищевой промышленности. Экстракцию этих соединений можно улучшить с помощью ультразвуковой гидроэтанольной экстракции. Результаты указывают, что использование 2,5% этанола при pH 6,11 с ультразвуковой обработкой было наиболее эффективным для экстракции фенольных и флавоноидных соединений по сравнению с более высокими процентами этанола. Максимальная экстракция танинов была достигнута при использовании 2,5% этанола и pH 5,11. Антоцианы как полимерные соединения положительно реагировали на ультразвуковую гидроэтанольную экстракцию и показали наибольшее экстрагируемое количество в 2,5% этаноле при pH 4,11. Соответственно, выраженная антиоксидантная способность гидроэтанольного экстракта мелассы сахарного тростника, включающего набор биологически активных соединений (фенолы, флавоноиды, танины и антоцианы), была наибольшей, когда использовался 2,5% гидроэтанольный растворитель при pH 4,11.
Это исследование свидетельствует, что UAE может быть перспективной селективной технологией экстракции для эффективного извлечения биологически активных соединений из мелассы сахарного тростника с использованием гидроэтанольного растворителя с минимальной долей этанола в кислых условиях, получая экстракты, богатые биологически активными соединениями. Соответствующие экстракты могут быть дальнейшем применены в качестве компонентов безалкогольных и молочных напитков, характеризующихся немного кислым вкусом, или в качестве компонентов с консервирующей ролью в съедобных и активных упаковочных материалах для различных пищевых продуктов. Этот подход может предложить новую перспективу для утилизации мелассы сахарного тростника при масштабировании процесса экстракции, и оценка биодоступности биологически активных соединений мелассы сахарного тростника после пищеварения может направлять дальнейшие исследования.
Ссылки
1. García-Pérez, P.; Losada-Barreiro, S.; Gallego, P.P.; Bravo-Díaz, C. Adsorption of gallic acid, propyl gallate and polyphenols from Bryophyllum extracts on activated carbon. Sci. Rep. 2019, 9, 14830. [Google Scholar] [CrossRef] [PubMed]
2. Wojdyło, A.; Oszmiański, J.; Czemerys, R. Antioxidant activity and phenolic compounds in 32 selected herbs. Food Chem. 2007, 105, 940–949. [Google Scholar] [CrossRef]
3. Djordjević, M.; Djordjević, M.; Starowicz, M.; Krupa-Kozak, U. Plant-Based Antioxidants in Gluten-Free Bread Production: Sources, Technological and Sensory Aspects, Enhancing Strategies and Constraints. Antioxidants 2024, 13, 142. [Google Scholar] [CrossRef] [PubMed]
4. Molina-Cortés, A.; Quimbaya, M.; Toro-Gomez, A.; Tobar-Tosse, F. Bioactive compounds as an alternative for the sugarcane industry: Towards an integrative approach. Heliyon 2023, 9, e13276. [Google Scholar] [CrossRef]
5. Cheng, Y.; Yu, Y.; Wang, C.; Zhu, Z.M. Inhibitory effect of sugarcane (Saccharum officinarum L.) molasses extract on the formation of heterocyclic amines in deep-fried chicken wings. Food Control 2021, 119, 107490. [Google Scholar] [CrossRef]
6. Iwuozor, K.O.; Emenike, E.C.; Ighalo, J.O.; Eshiemogie, S.; Omuku, P.E.; Adeniyi, A.G. Valorization of Sugar Industry’s By-products: A Perspective. Sugar Tech 2022, 24, 1052–1078. [Google Scholar] [CrossRef]
7. Ali, S.E.; Yuan, Q.; Wang, S.; Farag, M.A. More than sweet: A phytochemical and pharmacological review of sugarcane (Saccharum officinarum L.). Food Biosci. 2021, 44, 101431. [Google Scholar] [CrossRef]
8. Deseo, M.A.; Elkins, A.; Rochfort, S.; Kitchen, B. Antioxidant activity and polyphenol composition of sugarcane molasses extract. Food Chem. 2020, 314, 126180. [Google Scholar] [CrossRef]
9. Chandra, R.; Naresh Bharagava, R.; Rai, V. Melanoidins as major colourant in sugarcane molasses based distillery effluent and its degradation. Bioresour. Technol. 2008, 99, 4648–4660. [Google Scholar] [CrossRef]
10. Asikin, Y.; Takahashi, M.; Mishima, T.; Mizu, M.; Takara, K.; Wada, K. Antioxidant activity of sugarcane molasses against 2,2′-azobis(2-amidinopropane) dihydrochloride-induced peroxyl radicals. Food Chem. 2013, 141, 466–472. [Google Scholar] [CrossRef]
11. Shafiqa-Atikah, M.; Nor-Khaizura, M.; Mahyudin, N.; Abas, F.; Nur-Syifa, J.; Ummul-Izzatul, Y. Evaluation of phenolic constituent, antioxidant and antibacterial activities of sugarcane molasses towards foodborne pathogens. Food Res. 2020, 4, 40–47. [Google Scholar] [CrossRef]
12. Chen, M.; Zhao, Y.; Yu, S. Optimisation of ultrasonic-assisted extraction of phenolic compounds, antioxidants, and anthocyanins from sugar beet molasses. Food Chem. 2015, 172, 543–550. [Google Scholar] [CrossRef] [PubMed]
13. Gharib-Bibalan, S. High Value-added Products Recovery from Sugar Processing By-products and Residuals by Green Technologies: Opportunities, Challenges, and Prospects. Food Eng. Rev. 2018, 10, 95–111. [Google Scholar] [CrossRef]
14. Demesa, A.G.; Saavala, S.; Pöysä, M.; Koiranen, T. Overview and Toxicity Assessment of Ultrasound-Assisted Extraction of Natural Ingredients from Plants. Foods 2024, 13, 3066. [Google Scholar] [CrossRef]
15. Galanakis, C.M.; Tornberg, E.; Gekas, V. Recovery and preservation of phenols from olive waste in ethanolic extracts. J. Chem. Technol. Biotechnol. 2010, 85, 1148–1155. [Google Scholar] [CrossRef]
16. Tsakona, S.; Galanakis, C.M.; Gekas, V. Hydro-Ethanolic Mixtures for the Recovery of Phenols from Mediterranean Plant Materials. Food Bioprocess Technol. 2012, 5, 1384–1393. [Google Scholar] [CrossRef]
17. Molina-Cortés, A.; Sánchez-Motta, T.; Tobar-Tosse, F.; Quimbaya, M. Spectrophotometric Estimation of Total Phenolic Content and Antioxidant Capacity of Molasses and Vinasses Generated from the Sugarcane Industry. Waste Biomass Valorization 2020, 11, 3453–3463. [Google Scholar] [CrossRef]
18. Ali, S.E.; El Gedaily, R.A.; Mocan, A.; Farag, M.A.; El-Seedi, H.R. Profiling Metabolites and Biological Activities of Sugarcane (Saccharum officinarum Linn.) Juice and its Product Molasses via a Multiplex Metabolomics Approach. Molecules 2019, 24, 934. [Google Scholar] [CrossRef]
19. Singleton, V.L.; Orthofer, R.; Lamuela-Raventós, R.M. [14] Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent. Method. Enzymol. 1999, 299, 152–178. [Google Scholar] [CrossRef]
20. Chang, C.C.; Yang, M.-H.; Wen, H.-M.; Chern, J.-C. Estimation of total flavonoid content in propolis by two complementary colometric methods. J. Food Drug Anal. 2002, 10, 178–182. [Google Scholar] [CrossRef]
21. Krishnaiah, D.; Devi, T.; Bono, A.; Sarbatly, R. Studies on phytochemical constituents of six Malaysian medicinal plants. J. Med. Plant Res. 2009, 3, 67–72. [Google Scholar]
22. Lao, F.; Giusti, M.M. Quantification of Purple Corn (Zea mays L.) Anthocyanins Using Spectrophotometric and HPLC Approaches: Method Comparison and Correlation. Food Anal. Methods 2016, 9, 1367–1380. [Google Scholar] [CrossRef]
23. Xia, Y.; Cheng, Q.; Mu, W.; Hu, X.; Sun, Z.; Qiu, Y.; Liu, X.; Wang, Z. Research Advances of d-allulose: An Overview of Physiological Functions, Enzymatic Biotransformation Technologies, and Production Processes. Foods 2021, 10, 2186. [Google Scholar] [CrossRef] [PubMed]
24. Öberg, C.T.; Blanchard, H.; Leffler, H.; Nilsson, U.J. Protein subtype-targeting through ligand epimerization: Talose-selectivity of galectin-4 and galectin-8. Bioorg. Med. Chem. Lett. 2008, 18, 3691–3694. [Google Scholar] [CrossRef]
25. Sampaio, M.R.F.; Machado, M.C.; Lisboa, M.T.; Vieira, M.A.; Zimmer, T.B.R.; Otero, D.M.; Zambiazi, R.C. Physicochemical Characterization and Antioxidant Activity of Refined and Unrefined Sugarcane Products from Southern Brazil. Sugar Tech 2023, 25, 295–307. [Google Scholar] [CrossRef]
26. Settharaksa, S.; Jongjareonrak, A.; Hmadhlu, P.; Chansuwan, W.; Siripongvutikorn, S. Flavonoid, phenolic contents and antioxidant properties of Thai hot curry paste extract and its ingredients as affected of pH, solvent types and high temperature. Int. Food Res. J. 2012, 19, 1581–1587. [Google Scholar]
27. Chaves, J.O.; de Souza, M.C.; da Silva, L.C.; Lachos-Perez, D.; Torres-Mayanga, P.C.; Machado, A.P.F.; Forster-Carneiro, T.; Vázquez-Espinosa, M.; González-de-Peredo, A.V.; Barbero, G.F.; et al. Extraction of Flavonoids From Natural Sources Using Modern Techniques. Front. Chem. 2020, 8, 507887. [Google Scholar] [CrossRef]
28. Miao, L.; Zhang, H.; Yang, L.; Chen, L.; Xie, Y.; Xiao, J. Chapter 4.8—Flavonoids. In Antioxidants Effects in Health the Bright and the Dark Side, 1st ed.; Nabavi, S.M., Sanches Silva, A., Eds.; Elsevier: Amsterdam, The Netherlands, 2022; pp. 353–374. [Google Scholar] [CrossRef]
29. Huang, D.; Zhou, X.; Si, J.; Gong, X.; Wang, S. Studies on cellulase-ultrasonic assisted extraction technology for flavonoids from Illicium verum residues. Chem. Cent. J. 2016, 10, 56. [Google Scholar] [CrossRef]
30. Ghosh, S.; Chakraborty, R.; Raychaudhuri, U. Determination of pH-dependent antioxidant activity of palm (Borassus flabellifer) polyphenol compounds by photoluminol and DPPH methods: A comparison of redox reaction sensitivity. 3 Biotech 2015, 5, 633–640. [Google Scholar] [CrossRef]
31. Hollman, P.C.; Bijsman, M.N.; van Gameren, Y.; Cnossen, E.P.; de Vries, J.H.; Katan, M.B. The sugar moiety is a major determinant of the absorption of dietary flavonoid glycosides in man. Free Radic. Res. 1999, 31, 569–573. [Google Scholar] [CrossRef]
32. Gadhoumi, H.; Gullo, M.; De Vero, L.; Martinez-Rojas, E.; Saidani Tounsi, M.; Hayouni, E.A. Design of a New Fermented Beverage from Medicinal Plants and Organic Sugarcane Molasses via Lactic Fermentation. Appl. Sci. 2021, 11, 6089. [Google Scholar] [CrossRef]
33. Arjeh, E.; Khodaei, S.M.; Barzegar, M.; Pirsa, S.; Sani, I.K.; Rahati, S.; Mohammadi, F. Phenolic compounds of sugar beet (Beta vulgaris L.): Separation method, chemical characterization, and biological properties. Food Sci. Nutr. 2022, 10, 4238–4246. [Google Scholar] [CrossRef] [PubMed]
34. Fraga-Corral, M.; García-Oliveira, P.; Pereira, A.G.; Lourenço-Lopes, C.; Jimenez-Lopez, C.; Prieto, M.A.; Simal-Gandara, J. Technological Application of Tannin-Based Extracts. Molecules 2020, 25, 614. [Google Scholar] [CrossRef] [PubMed]
35. Forino, M.; Picariello, L.; Rinaldi, A.; Moio, L.; Gambuti, A. How must pH affects the level of red wine phenols. LWT-Food Sci. Technol. 2020, 129, 109546. [Google Scholar] [CrossRef]
36. de Hoyos-Martínez, P.L.; Merle, J.; Labidi, J.; Charrier-El Bouhtoury, F. Tannins extraction: A key point for their valorization and cleaner production. J. Clean. Prod. 2019, 206, 1138–1155. [Google Scholar] [CrossRef]
37. Dumitrash, P.G.; Bologa, M.K.; Shemyakova, T.D. Ultrasound-assisted extraction of biologically active substances from tomato seeds. Surf. Eng. Appl. Electrochem. 2016, 52, 270–275. [Google Scholar] [CrossRef]
38. Liu, Y.; Zhao, Y.; Zhuo, Y.; Li, Y.; Meng, J.; Wang, Y.; Li, H. Ultrasound-Assisted Extraction of Anthocyanins from Malus ‘Royalty’ Fruits: Optimization, Separation, and Antitumor Activity. Molecules 2022, 27, 4299. [Google Scholar] [CrossRef]
39. Farmani, B.; Djordjević, M.; Bodbodak, S.; Alirezalu, K.; Ghanbarpour, A. Powdered Activated Carbon Treatment of Sugar Beet Molasses for Liquid Invert Sugar Production: Effects of Storage Time and Temperatures. Sugar Tech 2022, 24, 522–531. [Google Scholar] [CrossRef]
40. Zhao, Z.; Yan, H.; Zheng, R.; Khan, M.S.; Fu, X.; Tao, Z.; Zhang, Z. Anthocyanins characterization and antioxidant activities of sugarcane (Saccharum officinarum L.) rind extracts. Ind. Crops Prod. 2018, 113, 38–45. [Google Scholar] [CrossRef]
41. Wani, A.K.; Rahayu, F.; Fauziah, L.; Suhara, C. Advances in safe processing of sugarcane and bagasse for the generation of biofuels and bioactive compounds. J. Agric. Food Res. 2023, 12, 100549. [Google Scholar] [CrossRef]
42. Chua, L.S.; Wahab, N.S.A.; Soo, J. Water soluble phenolics, flavonoids and anthocyanins extracted from jaboticaba berries using maceration with ultrasonic pretreatment. Food Chem. Adv. 2023, 3, 100387. [Google Scholar] [CrossRef]
43. Khiari, Z.; Makris, D.P.; Kefalas, P. An Investigation on the Recovery of Antioxidant Phenolics from Onion Solid Wastes Employing Water/Ethanol-Based Solvent Systems. Food Bioprocess Technol. 2009, 2, 337–343. [Google Scholar] [CrossRef]
44. Valli, V.; Gómez-Caravaca, A.; Di Nunzio, M.; Danesi, F.; Caboni, M.; Bordoni, A. Sugar Cane and Sugar Beet Molasses, Antioxidant-rich Alternatives to Refined Sugar. J. Agric. Food Chem. 2012, 60, 12508–12515. [Google Scholar] [CrossRef] [PubMed]
45. Feng, S.; Luo, Z.; Zhong, Z.; Jiang, L.; Tang, K. Extraction optimization by response surface methodology: Purification and characterization of phytosterol from sugarcane (Saccharum officinarum L.) rind. J. Sep. Sci. 2014, 37, 1308–1314. [Google Scholar] [CrossRef]
46. Xie, J.; Schaich, K.M. Re-evaluation of the 2,2-Diphenyl-1-picrylhydrazyl Free Radical (DPPH) Assay for Antioxidant Activity. J. Agric. Food Chem. 2014, 62, 4251–4260. [Google Scholar] [CrossRef]
47. Friedman, M.; Jürgens, H.S. Effect of pH on the Stability of Plant Phenolic Compounds. J. Agric. Food Chem. 2000, 48, 2101–2110. [Google Scholar] [CrossRef]
48. Yamamura, R.; Inoue, Y.K.; Nishino, K.; Yamasaki, S. Intestinal and fecal pH in human health. Front. Microbiomes 2023, 2. [Google Scholar] [CrossRef]
49. Amorati, R.; Pedulli, G.F.; Cabrini, L.; Zambonin, L.; Landi, L. Solvent and pH Effects on the Antioxidant Activity of Caffeic and Other Phenolic Acids. J. Agric. Food Chem. 2006, 54, 2932–2937. [Google Scholar] [CrossRef]
Farmani B, Djordjević M, Mohammadkhani S, Djordjević M. Assessing Sugarcane Molasses’ Bioactive Compound Content upon Ultrasound-Assisted Hydroethanolic Extraction at Various pH Values. Agriculture. 2025; 15(2):158. https://doi.org/10.3390/agriculture15020158
Перевод статьи «Assessing Sugarcane Molasses’ Bioactive Compound Content upon Ultrasound-Assisted Hydroethanolic Extraction at Various pH Values» авторов Farmani B, Djordjević M, Mohammadkhani S, Djordjević M., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык






























































































Комментарии (0)