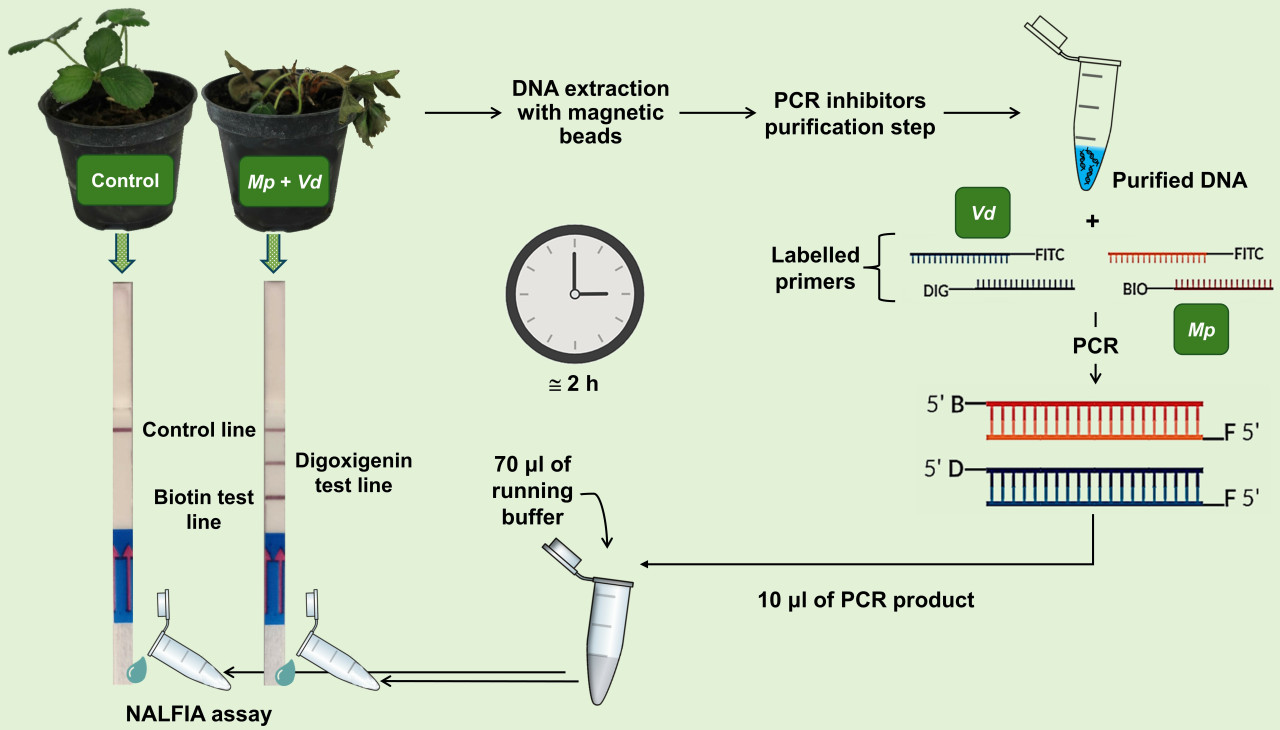
Разработка нового теста для быстрого выявления двух опасных возбудителей гнили земляники
Гнили корневой шейки и корней земляники вызываются почвенными патогенами, включая Macrophomina phaseolina (Mp) и Verticillium dahliae (Vd). Симптомы, вызываемые этими патогенами, очень схожи и их трудно различить, а традиционные методы обнаружения, основанные на культивировании, трудоемки, требуют много времени и дают медленные результаты. В данной работе мы разработали дуплексный ПЦР-анализ в комбинации с NALFIA, используя две пары видоспецифичных праймеров, меченных на 5'-конце различными молекулами, для одновременной идентификации Mp и Vd.
Аннотация
Для проведения NALFIA использовали иммунохроматографическую тест-полоску для детекции двух аналитов. Метод был разработан с помощью одинарного и дуплексного ПЦР (Mp, Vd, Mp + Vd) на примере все более сложных биологических систем: (i) ДНК из чистых культур патогенов; (ii) ДНК из искусственно инокулированных срезов стеблей дыни; и (iii) ДНК из искусственно инокулированных растений земляники сорта Аромас. Протокол дуплексного ПЦР оказался эффективным для обнаружения двух патогенов в тканях дыни и дал хорошие результаты с тканями корневой шейки земляники только после очистки образцов ДНК для удаления ингибиторов ПЦР. Полученные ампликоны использовались как для электрофореза в агарозном геле (AGE), так и для анализа методом NALFIA, который продемонстрировал более высокую чувствительность (10 пг) для одновременного обнаружения двух патогенов.
1. Введение
Земляника (Fragaria × ananassa Duch.) принадлежит к семейству Rosaceae и является одним из самых популярных фруктов в мире. Землянику выращивают в коммерческих целях в 76 странах мира [1], и, согласно отчетам ФАО, мировое производство земляники в 2022 году превысило 9,56 млн тонн на сумму более 25,5 млрд долларов [2].
Полезные для здоровья свойства, связанные с потреблением земляники, обусловлены ее богатством витаминами, минералами, клетчаткой и соединениями с антиоксидантными и противовоспалительными свойствами [3].
Выращивание земляники подвержено воздействию почвенных патогенов, которые сохраняются в почвенной матрице и в растительных остатках на поверхности почвы. Эти патогены распространены по всему миру, и без надлежащего управления болезнями они ежегодно наносят значительные потери отрасли земляники [4,5].
Исторически для предпосадочной фумигации почвы с целью борьбы с почвенными патогенами использовали метилбромид [6]. Однако из-за его негативного воздействия на окружающую среду он был выведен из употребления во всем мире в соответствии с Монреальским протоколом 1986 года для сохранения озонового слоя, который защищает Землю от ультрафиолетового излучения (УФ) [7,8]. В результате почвенные патогены стали важнейшей проблемой во многих странах-производителях земляники [9,10,11].
Двумя наиболее важными патогенами, снижающими урожайность в этой категории, являются грибы Macrophomina phaseolina (Tassi) Goid и Verticillium dahliae Kleb., оба вызывающие заболевания гнилей корневой шейки и корней [12,13].
M. phaseolina — это почвенный и семенной неспециализированный некротрофный грибной патоген с широким распространением, способный заражать более 500 видов растений из более чем 100 семейств [14]. Его важность особенно возрастает в контексте изменения климата, особенно в условиях повышенного теплового стресса и засухи [15,16], что делает регион Средиземноморья благоприятной средой для его распространения [17]. Длительный срок жизни его микросклероциев, который составляет от 2 до 15 лет, способствует его способности выживать в суровых условиях окружающей среды [18].
V. dahliae известен во всем мире своей агрессивностью и способностью вызывать сосудистые заболевания растений. Он поражает более 400 видов двудольных растений, включая экономически важные сельскохозяйственные культуры [19,20,21]. Гриб образует микросклероции, которые могут сохраняться в почве до 10 лет, что позволяет ему выживать в неблагоприятных условиях [22].
Заболевания земляники, повреждающие ткани корней и корневой шейки, часто могут оставаться незамеченными в почве, что задерживает обнаружение до появления серьезных симптомов в надземных частях растения, таких как отставание в росте, увядание, хлороз и, в конечном итоге, гибель растения. Это особенно важно, потому что симптомы, вызываемые двумя патогенами, схожи, что осложняет традиционные методы обнаружения [23]. Раннее обнаружение патогенов в семенах, маточных растениях и посадочном материале имеет ключевое значение для применения надлежащих мер контроля в нужное время [24,25]. Именно поэтому при управлении посевами земляники особое внимание следует уделять ранней диагностике патогенов в посадочном материале [26].
Традиционные методы обнаружения патогенов часто включают морфологическую идентификацию на основе культивирования. Однако этот подход трудоемок и требует много времени, что делает его непригодным для ранней диагностики. Визуальное распознавание симптомов с использованием традиционных шкал оценки болезней всегда было важно для диагностики; однако этот метод является чрезмерно субъективным и может представлять сложности, когда заболевание вызвано почвенными патогенами, вызывающими сходные симптомы. Для улучшения принятия решений в области борьбы с болезнями метод обнаружения должен быть как можно более быстрым, чувствительным и точным. Методы на основе нуклеиновых кислот и серологические методы обладают этими характеристиками и предоставляют важные инструменты в диагностике болезней растений, в дополнение к традиционным методам [27,28].
Полимеразная цепная реакция (ПЦР) в настоящее время является наиболее важным и распространенным методом на основе нуклеиновых кислот для обнаружения фитопатогенов. В диагностике на основе ПЦР праймеры разрабатываются для спаривания с уникальными последовательностями ДНК целевых организмов. Это позволяет обнаруживать единичную мишень в сложных смесях ДНК без необходимости выделения патогенов. Эффективное выделение ДНК имеет ключевое значение для успешной ПЦР, чему могут препятствовать ингибиторы в анализе образца. Ингибиторы ПЦР представляли собой важнейшее препятствие для разработки и применения диагностических методов на основе ПЦР в пораженных тканях многих растений, включая землянику [24,25,29].
Мультиплексная ПЦР (М-ПЦР) представляет собой вариант ПЦР, основанный на использовании более одной пары праймеров, позволяющий одновременно обнаруживать различные генетические последовательности путем проведения единичной реакции [27]. Основное преимущество М-ПЦР заключается в значительной экономии времени и усилий за счет одновременной амплификации нескольких локусов; однако эта методика представляет сложности в оптимизации процесса амплификации. Наличие нескольких пар праймеров может привести к таким проблемам, как низкая чувствительность и специфичность, предпочтительная амплификация определенных локусов или образование димеров праймеров [30,31].
Несколько исследований были сосредоточены на одновременном обнаружении патогенов земляники с использованием протоколов М-ПЦР; некоторые примеры — обнаружение трех видов Pythium [32], Phytophthora nicotianae и P. cactorum [33], Fusarium oxysporum f. sp. fragariae, P. nicotianae и Colletotrichum gloeosporioides [34], а также Fusarium oxysporum f. sp. fragariae и C. gloeosporioides [35].
Иммунохроматографический анализ (ИХА) — это устоявшаяся технология, применяемая для широкого спектра диагностических применений в местах оказания медицинской помощи (POC) или полевых условий [36]. Это тест, основанный на принципах хроматографии, используемый в основном для качественного анализа различных типов аналитов. Его цель — обнаружение наличия целевого вещества в жидком образце. Этот тип технологии привлекает все больший интерес из-за короткого времени анализа, низкой стоимости и того факта, что его могут легко использовать даже неспециалисты [37,38].
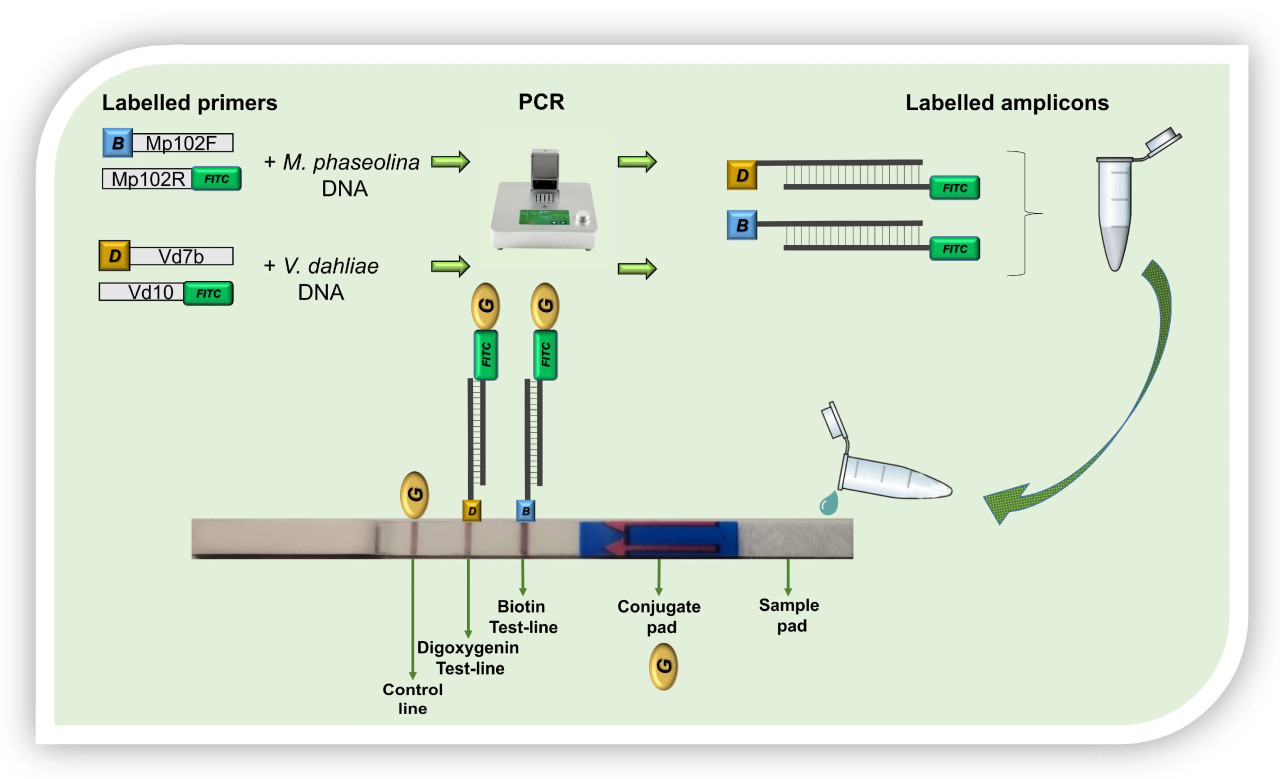
Иммунохроматографический анализ на основе нуклеиновых кислот (NALFIA) представляет собой вариант ИХА, используемый для проверки наличия или отсутствия ДНК патогенов в биологических образцах. В NALFIA нуклеиновые кислоты улавливаются на тест-полосках в формате, зависящем от антител: биосенсор использует улавливающую линию антител и меченый ампликон. В этом случае усиленная двуцепочечная нуклеиновая последовательность, специфичная для целевого организма, может быть обнаружена с использованием праймеров с двумя различными метками (например, биотином и флуоресцеинизотиоцианатом). Аналит распознается путем связывания с антителом, специфичным к метке (анти-флуоресцеиновым антителом), предварительно нанесенным на нитроцеллюлозную мембрану, а золотые наночастицы, меченные авидином, используются в качестве репортера, что позволяет визуализировать результат [39,40]. Амплификация целевой последовательности происходит с использованием праймеров с двумя различными метками на 5'-конце, например, биотином и FITC. Если реакция происходит, все ампликоны будут мечены биотином и FITC. Затем реакционную смесь ПЦР смешивают с буфером и наносят на стартовую подушку иммунохроматографического устройства (LFD), генерируя окрашенную полосу на тестовой линии, видимую невооруженным глазом [41,42].
Анализ NALFIA можно интегрировать с методами обнаружения M-ПЦР [43]. Этот тип анализа предполагает использование более одной пары праймеров: прямые праймеры мечены различными молекулами, а обратные праймеры мечены одной и той же молекулой. Реакционные мембраны содержат более одной тестовой линии для распознавания и связывания метки прямых праймеров и предоставляют мульти-аналитный тест [41]. Праймеры можно метить в 5'-положении различными молекулами, чтобы добиться разделения соответствующих продуктов амплификации на реакционной мембране LFD. Наиболее часто используемыми метками являются Биотин, Флуоресцеинизотиоцианат (FITC), Карбоксифлуоресцеин (FAM), Динитрофенол (DNP) и Техасский красный [44].
Целью данной работы была разработка молекулярного диагностического анализа, дуплексной ПЦР-NALFIA, с использованием видоспецифичных праймеров, меченных на 5'-конце различными молекулами, для одновременной идентификации M. phaseolina (Mp) и V. dahliae (Vd), возбудителей гнилей корней и корневой шейки земляники. Метод обнаружения был разработан с помощью одинарной (Mp и Vd) и дуплексной ПЦР (Mp + Vd) на примере все более сложных биологических систем: (i) ДНК из чистых культур патогенов; (ii) ДНК из искусственно инокулированных срезов стеблей дыни; и (iii) ДНК из искусственно инокулированных растений земляники. Ампликоны, полученные по выбранной программе ПЦР, использовались как для электрофореза в агарозном геле (AGE), так и для анализа методом NALFIA с использованием коммерческого иммунохроматографического устройства (LFD) для обнаружения двух аналитов и сравнения полученных результатов.
2. Материалы и методы
2.1. Грибные изоляты и условия культивирования
При разработке дуплексного анализа ПЦР-NALFIA, помимо некоторых изолятов M. phaseolina и V. dahliae, использовались другие виды грибов в качестве внешних групп: Diplodia seriata и Neofusicoccum parvum (семейство Botryosphaeriaceae); Verticillium tricorpus и Verticillium nubilum (Таблица 1). Грибные культуры выращивали на различных средах для достижения оптимального роста. Все грибы инкубировали при 25 °C с циклом 12/12 НУФ/свет, если не указано иное.
Таблица 1. Грибные изоляты, использованные в данном исследовании.
Изоляты M. phaseolina, D. seriata и N. parvum культивировали на картофельно-декстрозном агаре (КДА, Biolife Italiana S.r.l., Милан, Италия).
Все виды Verticillium выращивали на агаре с декстрозой, дрожжевым экстрактом и аспарагином [DYEAsp агар, г л⁻¹: декстроза 10, дрожжевой экстракт 1, L-аспарагин 0,5, K₂HPO₄·3H₂O 0,5, MgSO₄·7H₂O 0,25, FeCl₃ (10% раствор) 0,5 мл, агар 20], за исключением V. nubilum, который выращивали на КДА.
Мицелий грибов для выделения ДНК выращивали в 25 мл дрожжево-солодового бульона в пробирках Falcon на 50 мл (YMB — 0,3% дрожжевого экстракта, 0,3% солодового экстракта, 0,5% пептона, 1% глюкозы). Каждую пробирку инокулировали пятью блоками мицелия размером 5 × 5 мм с культур на КДА или агаре DYEAsp. Пробирки помещали в программируемый ротатор Multi RS-60 (Biosan, Рига, Латвия) (орбитальный 60 об/мин/20 с; возвратно-поступательный 90°/30 с; вибрационный 3°/5 с) и инкубировали при комнатной температуре (22 ± 2 °C) в течение 5–7 дней. Мицелий собирали фильтрацией через стерильную ткань Miracloth (Calbiochem, Сан-Диего, Калифорния, США), тщательно промывали стерильной дистиллированной водой и отжимали досуха между стерильными бумажными полотенцами. Собранный мицелий использовали немедленно для выделения ДНК или хранили при −20 °C до использования.
2.2. Искусственная инокуляция срезов стеблей дыни
С целью создания биологической модельной системы для проверки эффективности дуплексных анализов ПЦР-NALFIA были проведены одинарные (Mp, Vd) или двойные (Mp + Vd) искусственные инокуляции M. phaseolina (Mp) и V. dahliae (Vd) на срезах стеблей дыни (Cucumis melo гибрид F1 ‘Eldorado’) с использованием метода, описанного Twizeyimana и др. [46], с некоторыми модификациями. Растения дыни выращивали в климатической камере с 12-часовым фотопериодом при 22 ± 1 °C и относительной влажности 65%. Для экспериментов по искусственной инокуляции был выбран репрезентативный изолят каждого вида (M. phaseolina 10726 и V. dahliae 10361).
Стебли дыни длиной 4 см срезали с растений. Открытый конец наконечника для пипетки объемом 100 мкл вдавливали в край активно растущих агаровых культур M. phaseolina или V. dahliae и вырезали и удаляли диск грибного мицелия и агара. Наконечник пипетки, содержащий колонизированный агаровый диск, помещали над срезанной стороной и вдавливали, чтобы погрузить стебель в среду и закрепить наконечник на стебле. Заостренные концы наконечников пипеток запаивали нагреванием. Инокулированные стебли помещали на стерильное предметное стекло микроскопа внутри чашки Петри, содержащей увлажненный стерильной водой фильтр Whatman, для поддержания высокого уровня влажности. Чашки Петри затем запечатывали парафильмом и инкубировали при 25 ± 1 °C (Рисунок 1).
Рисунок 1. Искусственная инокуляция среза стебля дыни Verticillium dahliae (слева) и Macrophomina phaseolina (справа).
Через пять дней после инокуляции наконечники удаляли, а стебли поверхностно стерилизовали в течение 2 минут в водном растворе, содержащем гипохлорит натрия (NaOCl; 1% доступного хлора), дважды промывали стерильной дистиллированной водой и высушивали на воздухе в ламинарном шкафу. Стебли дыни разрезали на две половины, сделав продольный разрез. Каждую половину затем разрезали на 3 части (центральная, сторона Vd и сторона Mp).
Кусочки из каждого положения каждого стебля помещали в пробирку Eppendorf на 1,5 мл и хранили при −20 °C для последующего выделения ДНК и амплификации или высевали на агаровую среду DYEAsp, дополненную сульфатом стрептомицина (0,3 г л⁻¹, Sigma-Aldrich, Сент-Луис, Миссури, США), чтобы повторно выделить инокулированные грибы, отследить их колонизацию стебля и сравнить микробиологические результаты с результатами ПЦР-амплификации (Рисунок S1). Контролем для экспериментов по инокуляции служили стебли дыни, инокулированные дисками агара, свободными от мицелия.
Этот эксперимент позволил нам проверить одновременное присутствие M. phaseolina и V. dahliae в инокулированных частях стебля дыни. Точное отслеживание их присутствия в тканях с помощью микробиологических анализов позволило с большей точностью выбрать другую половину образцов для молекулярных анализов.
2.3. Искусственная инокуляция растений земляники
Метод обнаружения оценивали с помощью одинарной и дуплексной ПЦР (Mp, Vd, Mp + Vd) на примере все более сложной биологической системы, состоящей из растений земляники (Fragaria × ananassa Duch.) сорта Aromas, выращенных в горшках и содержавшихся в климатической камере с 12-часовым фотопериодом при 25 ± 1 °C с относительной влажностью 65%.
Искусственные инокуляции проводили с использованием метода зубочисток, предложенного Pickel и др. [47], с некоторыми модификациями. Использовали кончики деревянных зубочисток, и 8–12 кончиков помещали на 7–14-дневные культуры двух патогенов на несколько дней, пока они не покрывались мицелием и микросклероциями (Рисунок 2a–d).
Рисунок 2. Метод искусственной инокуляции корневой шейки земляники кончиками зараженных деревянных зубочисток. Колонии Verticillium dahliae (a) и Macrophomina phaseolina (c), использованные для инокуляции кончиков зубочисток. Стереомикроскопические изображения (шкала = 750 мкм) кончика зубочистки, колонизированного Verticillium dahliae (b) и Macrophomina phaseolina (d), на которых видны грибные гифы и образование микросклероциев. (e) Корневая шейка земляники, подвергнутая двойной обработке инокуляцией кончиками зубочисток, колонизированными Verticillium dahliae и Macrophomina phaseolina. (f) Растение земляники, инокулированное Verticillium dahliae и Macrophomina phaseolina, с явными симптомами увядания. (g) Контрольное растение земляники, инокулированное неколонизированными кончиками зубочисток.
Использовали те же репрезентативные изоляты каждого вида, выбранные выше. Одинарные инокуляции проводили путем создания двух диаметрально противоположных ран на корневой шейке, в то время как для двойных инокуляций создавали четыре раны, инокулируя патогены диаметрально противоположным образом (Рисунок 2e). Для каждой обработки инокулировали двенадцать растений земляники: одинарная инокуляция (Mp, Vd), двойная инокуляция (Mp + Vd) и контроль.
В конце экспериментов, когда симптомы заболевания становились очевидными у инокулированных растений (Рисунок 2f), а неинокулированные растения не проявляли никаких симптомов (Рисунок 2g), растения земляники извлекали из горшков и сначала промывали водопроводной водой, чтобы удалить всю приставшую почву. Корневые шейки и черешки срезали с растений и поверхностно стерилизовали в течение 2,5 минут в водном растворе, содержащем гипохлорит натрия (NaOCl; 1% доступного хлора), дважды промывали стерильной дистиллированной водой и высушивали на воздухе в ламинарном шкафу. Стерилизованные ткани делили пополам: одну половину помещали на агаровые среды, как описано ранее (см. Раздел 2.2), а другую половину нарезали на мелкие кусочки и хранили при −20 °C для выделения ДНК (Рисунок S2).
На основе культурных и морфологических характеристик колоний, происходящих из тканей земляники, были идентифицированы различные роды грибов. Грибные структуры наблюдали с помощью стереомикроскопа Leica MZ FLIII или составного микроскопа Leitz Dialux 22. Эксперимент проводили для проверки присутствия двух инокулированных патогенов, а также количества и разнообразия микофлоры, присутствующей в тканях земляники. Эта информация позволяет нам оценить качественный состав выделенной ДНК.
2.4. Выделение ДНК из грибного мицелия и инокулированных срезов стеблей дыни
Общую геномную ДНК выделяли из грибного мицелия; 0,2–0,5 г мицелия помещали в стерильные пробирки для экстракции объемом 2 мл, предварительно заполненные 0,36 г промытых кислотой стеклянных шариков из диоксида кремния (Sigma-Aldrich, США). Пробирки заполняли 500 мкл раствора для подготовки образцов (Genesig® Easy DNA/RNA Extraction Kit, Primerdesign, Великобритания). Мицелий гомогенизировали с использованием метода встряхивания с шариками на гомогенизаторе BeadBug™ (Benchmarck Scientific Inc., Сейревилл, Нью-Джерси, США). Выполняли три цикла по 30 с и 4000 об/мин каждый; каждый цикл чередовался с паузой в 30 с, в течение которой образцы помещали на лед для поддержания низкой температуры гомогената.
Впоследствии гомогенат подвергали выделению ДНК в соответствии с протоколом набора Genesig® Easy DNA/RNA Extraction Kit. Очищенную ДНК затем ресуспендировали в 50 мкл воды, свободной от нуклеаз (ThermoFisher Scientific™, Вильнюс, Литва).
ДНК также выделяли из инокулированных и неинокулированных стеблей дыни, используя ту же процедуру, описанную выше, с некоторыми модификациями. Перед помещением образцов в пробирки для экстракции объемом 2 мл их помещали в пробирки Eppendorf объемом 2 мл, заполненные 500 мкл раствора для подготовки образцов, и подвергали предварительной обработке с помощью гомогенизатора тканей G50 с пестиком (Coyote Bioscience, Пекин, Китай) для гомогенизации тканей. Разрушенные ткани в растворе для подготовки образцов затем переносили в пробирки для экстракции объемом 2 мл, предварительно заполненные 0,36 г промытых кислотой стеклянных шариков диоксида кремния диаметром 0,5 мм, следуя тому же протоколу, что и для выделения ДНК из мицелия.
При необходимости ДНК концентрировали с использованием набора DNA Clean & Concentrator™ (Zymo Research, Тастин, Калифорния, США) в соответствии с инструкциями производителя.
2.5. Выделение ДНК из инокулированных корневых шеек земляники
Выделение ДНК из корневых шеек растений земляники проводили, как описано ранее (см. Раздел 2.4). Из-за твердости тканей корневой шейки процесс гомогенизации состоял из пяти-шести циклов по 120 с каждый при 4000 об/мин с использованием гомогенизатора BeadBug™ (Benchmarck Scientific Inc., Сейревилл, Нью-Джерси, США) с стеклянными шариками диоксида кремния и раствором для подготовки образцов. Для получения ДНК, пригодной для ПЦР-амплификации, выделенные образцы очищали с помощью набора OneStep™ PCR Inhibitor Removal Kit (Zymo Research, Тастин, Калифорния, США) и, при необходимости, концентрировали с использованием набора DNA Clean & Concentrator™ (Zymo Research, Тастин, Калифорния, США) в соответствии с инструкциями производителя (Рисунок S3).
2.6. Амплификация ДНК и секвенирование
Концентрацию каждого образца ДНК измеряли с помощью флуориметра Qubit™ 4 (ThermoFisher Scientific™, Вильнюс, Литва), в то время как ее целостность визуально оценивали с помощью AGE в 1% (м/об) агарозном геле, выполняемом в буфере 0,5× TBE (45 мМ основания Тризма, 44 мМ борной кислоты, 1 мМ ЭДТА, pH 8,4) с последующим окрашиванием GelRed™ (Biotium Inc., Фримонт, Калифорния, США) в соответствии с инструкциями производителя.
Матрицы включали следующее: (i) ДНК из мицелия двух патогенов и нетаргетных изолятов, перечисленных в Таблице 1 (доведенная до 1 нг мкл⁻¹); (ii) ДНК из инокулированных стеблей дыни; и (iii) ДНК из инокулированных корневых шеек земляники, обе доведенные до 10 нг мкл⁻¹.
Для определения способности к амплификации выделенных ДНК внутренний транскрибируемый спейсер (ITS) области рДНК амплифицировали с помощью ПЦР с использованием универсальных пар праймеров ITS1/ITS4 и ITS5/ITS4 [48] в соответствии с процедурой, описанной Pecchia и др. [49].
Видоспецифичные праймеры на основе межгенного спейсера (IGS) рДНК M. phaseolina (Mp102F/Mp102R, длина ампликона 102 п.н.) и V. dahliae (Vd7b/Vd10, длина ампликона 139 п.н.) были использованы для разработки дуплексного анализа ПЦР-NALFIA [42,50]. Обратные праймеры Mp102R и Vd10 были мечены флуоресцеинизотиоцианатом (FITC), который взаимодействует с золотыми наночастицами, меченными антителами, специфичными к FITC, что позволяет провести колориметрическую реакцию. Прямые праймеры Mp102F и Vd7b были мечены на 5'-конце биотином (Bio) и дигоксигенином (Dig) соответственно. Каждый праймер был протестирован против других на потенциальное образование димеров с помощью программы Primer Dimer (http://www.primer-dimer.com/, доступ 5 февраля 2024 г.). Те же немеченые праймеры использовались для экспериментов по секвенированию.
ПЦР с использованием видоспецифичных праймеров проводили в реакционном объеме 25 мкл, содержащем 5 мкл 5× бесцветного буфера для реакции GoTaq® Flexi, 1,5 мМ MgCl₂, 0,2 мМ смеси dNTP, 0,2 мкМ каждого праймера для M. phaseolina, 0,1 мкМ каждого праймера для V. dahliae, 1,25 ед. Taq полимеразы GoTaq® MDx, без глицерина, 0,25 М бетаина и 1 мкл матричной ДНК, с доведением объемов до 25 мкл водой, свободной от нуклеаз. Условия одинарной и дуплексной ПЦР включали начальный этап денатурации 94 °C в течение 2 мин, затем 25 циклов амплификации, состоящих из этапа денатурации 30 с при 94 °C, этапа отжига 30 с при 57 °C и этапа элонгации 30 с при 72 °C. После 25 циклов выполняли конечную элонгацию в течение 4 мин при 72 °C. Отрицательный контроль (без ДНК) и положительный контроль (ДНК из чистой культуры каждого патогена) включались для каждого набора реакций.
Оптимизация описанного выше протокола дуплексной ПЦР-NALFIA включала изучение некоторых параметров (концентрация праймеров, количество циклов ПЦР, тип Taq полимеразы, использование и концентрация бетаина).
Чувствительность дуплексного ПЦР-анализа проверяли с использованием в качестве матриц ДНК, выделенной из мицелия M. phaseolina (10726) и V. dahliae (10361), последовательно разведенной от 1 нг до 1 пг мкл⁻¹.
Продукты амплификации анализировали с помощью AGE (1,5% м/об) в буфере 0,5× TBE и детектировали по флуоресценции в УФ-свете после окрашивания GelRed™ (Biotium, Inc., Фримонт, Калифорния, США) в соответствии с инструкциями производителя. Лестница ДНК 100 п.н. (Promega, Мэдисон, Висконсин, США) использовалась в качестве маркера молекулярного размера.
Ампликоны затем очищали с использованием набора QIAquick PCR purification Kit (Qiagen Italia, Милан, Италия) и отправляли в BMR Genomics (Падуя, Италия) для секвенирования в обоих направлениях с тем же набором праймеров, который использовался для амплификации.
2.7. Анализ NALFIA
После ПЦР-реакций полученные дважды меченые ампликоны делили на две аликвоты: одну для анализа AGE, как описано ранее, а другую для анализа NALFIA.
Анализ NALFIA проводили с использованием коммерческого иммунохроматографического устройства (LFD) для обнаружения двух аналитов, меченных биотином и дигоксигенином, соответственно (Milenia® HybriDetect, MGHD2, Milenia Biotec, Гиссен, Германия). LFD использовали для проверки наличия или совместного присутствия ампликонов M. phaseolina и V. dahliae. Каждый анализ NALFIA включал отрицательный контроль (без ДНК).
Для подготовки анализа NALFIA 10 мкл продуктов ПЦР смешивали с 70 мкл буфера для анализа в пробирке Eppendorf объемом 0,2 мл. Затем сторону стартовой подушки LFD погружали в пробирку Eppendorf, содержащую смесь. Через несколько секунд конъюгированные золотые наночастицы (связанные с поликлональными козьими антителами против FITC) мигрировали по аналитической мембране. Обычно для появления четких сигналов требуется от 2 до 5 минут. Не уловленные золотые наночастицы стекают к контрольной линии и фиксируются там специфическими антителами (поликлональные анти-козьи антитела), что приводит к окрашиванию контрольной линии. По мере увеличения времени инкубации появляется интенсивно окрашенная контрольная полоса (Рисунок 3).
Рисунок 3. Иммунохроматографическое устройство для обнаружения двух аналитов, использованное в данном исследовании. B = биотин; D = Дигоксигенин; FITC = флуоресцеинизотиоцианат; G = конъюгированные золотые наночастицы.
Полученные с помощью анализа NALFIA результаты затем сравнивали с результатами, полученными с помощью AGE.
3. Результаты
3.1. Анализ ПЦР-NALFIA с использованием ДНК, выделенной из мицелия
С использованием выбранной программы ПЦР протестировали правильность функционирования видоспецифичных праймеров с помощью одинарных ПЦР, используя в качестве матрицы ДНК, выделенную из мицелия изолятов, указанных в Таблице 1 (Рисунок 4). ПЦР-амплификация дала единичную полосу размером приблизительно 100 п.н. для изолятов M. phaseolina и 140 п.н. для изолятов V. dahliae. Амплификации не наблюдалось, когда матрицей была ДНК, выделенная из мицелия изолятов внешней группы, или в отрицательных контролях (без ДНК). Результаты, полученные с помощью анализа AGE (Рисунок 4a,b) и анализа NALFIA (Рисунок 4c,d), согласуются друг с другом.
Рисунок 4. Специфичность ПЦР с использованием пары праймеров MP102F/MP102R, меченных биотином и FITC, для обнаружения Macrophomina phaseolina и пары праймеров Vd7b/Vd10, меченных дигоксигенином и FITC, для обнаружения Verticillium dahliae. (a,b) = электрофорез в агарозном геле; (c,d) = анализ NALFIA. (a,c). 1–3 = Macrophomina phaseolina (10726, PVS-Mp1, DAFE SP19-24); 4 = Diplodia seriata DAFE SP19-25; 5 = Neofusicoccum parvum DAFE SP19-26; 6 = отрицательный контроль (без ДНК); M = лестница ДНК 100 п.н. (b,d) 1–3 = Verticillium dahliae (10361, 10357, 10355); Verticillium nubilum 10464; Verticillium tricorpus PD593; 6 = отрицательный контроль (без ДНК); M = лестница ДНК 100 п.н. Анализ NALFIA проводили с теми же ампликонами, которые использовались в электрофорезе в агарозном геле. Белые стрелки указывают на полосу 500 п.н. маркера.
Затем каждую пару видоспецифичных праймеров использовали в экспериментах ПЦР с ДНК другого целевого вида, чтобы проверить наличие неспецифических взаимодействий. После наблюдения AGE продукта амплификации обнаружено не было, что указывает на то, что видоспецифичные праймеры взаимодействуют только с ДНК целевого вида (Рисунок S4). Это привело к выводу, что неспецифические ампликоны не должны получаться ни в одной дуплексной ПЦР.
Секвенирование специфических фрагментов, очищенных от ПЦР-реакций, подтвердило ожидаемые последовательности.
Дуплексную ПЦР проводили, вставляя пары праймеров MP102F/MP102R и
Vd7b/Vd10 в одну и ту же ПЦР-смесь, используя в качестве матрицы ДНК,
выделенную из мицелия M. phaseolina и V. dahliae
(по 1 нг каждой). Продукты ПЦР
использовали для проведения анализов AGE и NALFIA. Дуплексная ПЦР привела к
одновременной амплификации ампликонов разных размеров: приблизительно 100 п.н.
для M. phaseolina и 140 п.н. для V. dahliae (Рисунок 5). Также в этом случае
результаты, полученные с помощью анализа AGE (Рисунок 5, левая панель) и
анализа NALFIA (Рисунок 5, правая панель), согласуются друг с другом.
Амплификации не наблюдалось в отрицательных контролях (без ДНК). Образования димеров
праймеров не наблюдалось ни в анализе AGE, ни в анализе NALFIA, хотя праймеры
MP102R и Vd7b получили наименьший балл по образованию димеров (−7,85 ккал/моль)
после компьютерного анализа PrimerDimer. Результаты указывают на то, что две
пары праймеров могут хорошо работать вместе в одной ПЦР-смеси с установленными
в протоколе программой ПЦР и концентрациями праймеров.
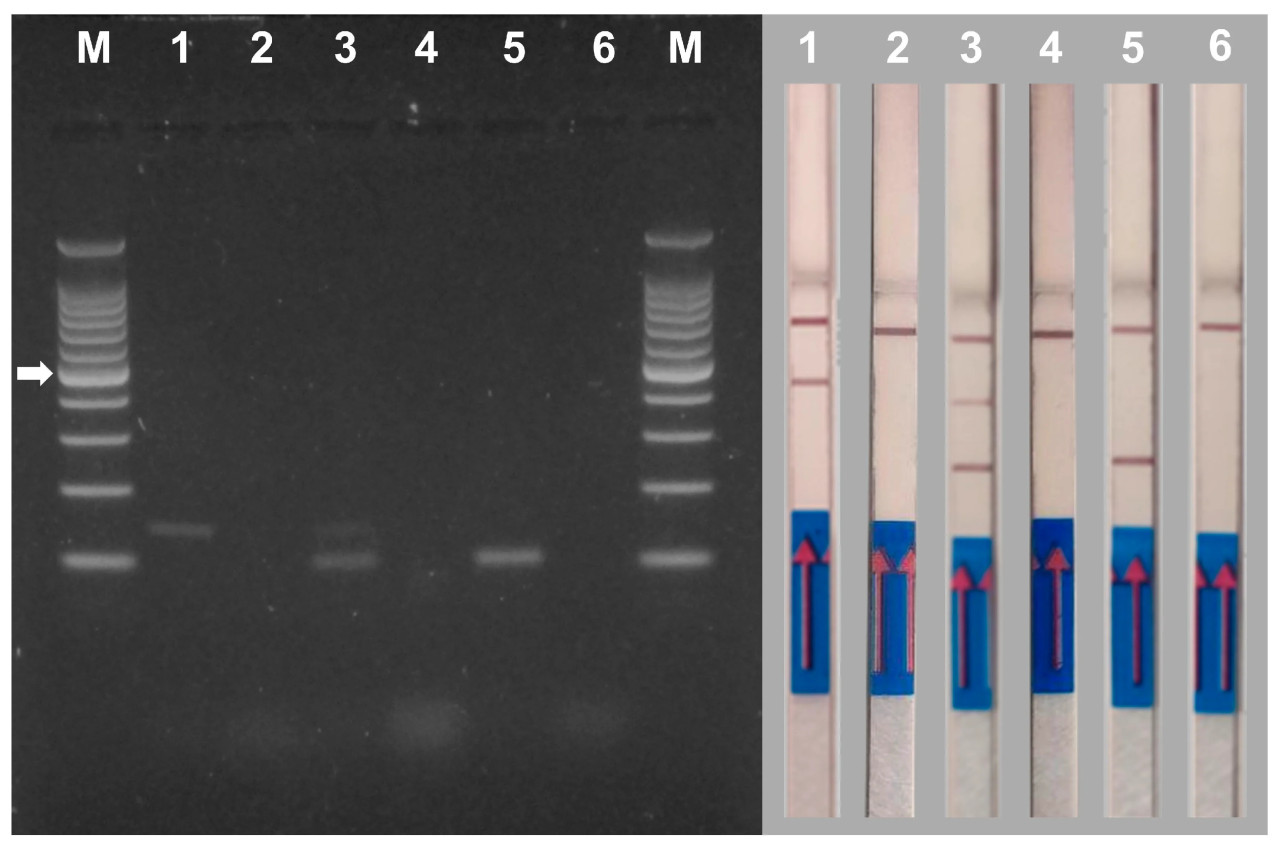
Рисунок 5. Электрофорез в геле (левая панель) и анализ NALFIA (правая панель) одинарной и дуплексной ПЦР с использованием ДНК, выделенной из мицелия Verticillium dahliae и Macrophomina phaseolina. Пара праймеров Vd7b/Vd10, меченная дигоксигенином и FITC, использовалась для обнаружения Verticillium dahliae (дорожка 1), а пара праймеров MP102F/MP102R, меченная биотином и FITC, использовалась для обнаружения Macrophomina phaseolina (дорожка 5). Обе пары праймеров использовались для дуплексной ПЦР (дорожка 3). Отрицательный контроль (без ДНК) выполняли для каждой ПЦР-реакции (дорожки 2, 4 и 6). M = лестница ДНК 100 п.н. Белая стрелка указывает на полосу 500 п.н. маркера. Анализ NALFIA проводили с теми же ампликонами, которые использовались в электрофорезе в агарозном геле. Vd = Verticillium dahliae; Mp = Macrophomina phaseolina; C = контроль дуплексной ПЦР.
Дуплексную ПЦР также проводили, используя в качестве матрицы ДНК (1 нг), выделенную из мицелия изолятов внешней группы (Diplodia seriata, Neofusicoccum parvum, Verticillium nubilum и Verticillium tricorpus). Продукты ПЦР использовали для проведения анализов AGE и NALFIA. После обоих анализов продукт амплификации не был обнаружен, что указывает на то, что видоспецифичные праймеры взаимодействуют только с ДНК целевого вида даже в дуплексном ПЦР-анализе (Рисунок S5).
Дуплексные ПЦР-реакции, проведенные с использованием 10-кратных последовательных разведений матричных ДНК (ДНК из мицелия изолята M. phaseolina 10726 и изолята V. dahliae 10361), от 1,0 нг до 1,0 пг, анализировали с помощью анализов AGE и NALFIA. Для AGE использовали по 10 мкл продуктов ПЦР каждой реакции. Ампликоны V. dahliae были видны на геле только при 1 нг матричной ДНК, в то время как ампликоны M. phaseolina были видны вплоть до 100 пг матричной ДНК. Для анализа NALFIA также использовали по 10 мкл продуктов ПЦР каждой реакции; в этом случае ампликоны обоих патогенов обнаруживались вплоть до 10 пг матричной ДНК, что указывает на повышенную чувствительность этого анализа (Рисунок 6).
Рисунок 6. Чувствительность дуплексной ПЦР с использованием пары праймеров MP102F/MP102R, меченных биотином и FITC, для обнаружения Macrophomina phaseolina и пары праймеров Vd7b/Vd10, меченных дигоксигенином и FITC, для обнаружения Verticillium dahliae. Анализ проводили с использованием 10-кратных последовательных разведений матричных ДНК в диапазоне от 1,0 нг до 1,0 пг. Электрофорез в геле (левая панель) и анализ NALFIA (правая панель). 1 = 1 нг матричных ДНК; 2 = 100 пг матричных ДНК; 3 = 10 пг матричных ДНК; 4 = 1 пг матричных ДНК; 5 = отрицательный контроль (без ДНК); M = лестница ДНК 100 п.н. Белая стрелка указывает на полосу 500 п.н. маркера.
3.2. Искусственная инокуляция срезов стеблей дыни
M. phaseolina и V. dahliae стабильно выделяли из половинок инокулированных срезов стеблей дыни, высеянных на чашки с агаром Dextrose Yeast Extract Asparagine, дополненным сульфатом стрептомицина (DYEAsp+S). Полученные результаты обобщены в Таблице 2. Стебли дыни являются хорошим субстратом для роста обоих патогенов; однако они не всегда выделялись вместе из центральной части стебля во всех проанализированных случаях. Напротив, частота выделения из дистальных частей стеблей была очень высокой для обоих грибов (92%).
Таблица 2. Частота выделения Macrophomina phaseolina (Mp) и Verticillium dahliae (Vd) из различных частей инокулированных срезов стеблей дыни (n = 12). Срезанные стебли инокулировали Mp с правой стороны и Vd с левой стороны. Части высевали на чашки с агаром Dextrose Yeast Extract Asparagine, дополненным сульфатом стрептомицина (DYEAsp+S). Central = центральная часть инокулированного стебля; Vd side = сторона инокуляции Verticillium dahliae; Mp side = сторона инокуляции Macrophomina phaseolina.
В качестве контроля использовали стебли, не инокулированные двумя грибами. Из контрольных образцов роста V. dahliae или M. phaseolina не наблюдалось, но наблюдалось несколько сапротрофных грибов (например, Penicillium sp., Aspergillus sp., Alternaria sp., Trichoderma sp.). На основе этих результатов для выделения ДНК были выбраны различные инокулированные и неинокулированные части стеблей.
3.3. Дуплексный анализ ПЦР-NALFIA с использованием ДНК, выделенной из срезов стеблей дыни
Одинарную и дуплексную ПЦР проводили на образцах, инокулированных M. phaseolina и V. dahliae, в которых оба патогена были обнаружены с помощью микробиологических анализов. В каждый набор ПЦР-реакций включали отрицательные контроли (без ДНК) (Рисунок 7).
Рисунок 7. Электрофорез в геле (левая панель) и анализ NALFIA (правая панель) одинарной и дуплексной ПЦР с использованием ДНК, выделенной из тканей стеблей дыни, инокулированных Verticillium dahliae и Macrophomina phaseolina. Пара праймеров Vd7b/Vd10, меченная дигоксигенином и FITC, использовалась для обнаружения Verticillium dahliae (1), а пара праймеров MP102F/MP102R, меченная биотином и FITC, использовалась для обнаружения Macrophomina phaseolina (5). Обе пары праймеров использовались для дуплексной ПЦР (3). Отрицательный контроль (без ДНК) выполняли для каждой ПЦР-реакции (2, 4 и 6). M = лестница ДНК 100 п.н. Белая стрелка указывает на полосу 500 п.н. маркера. Анализ NALFIA проводили с теми же ампликонами, которые использовались в электрофорезе в агарозном геле.
В образцах анализа AGE образцы 1 и 5 дали ожидаемые единичные ампликоны V. dahliae (139 п.н.) и M. phaseolina (102 п.н.) соответственно. Образец 3 дал ожидаемые две полосы обоих патогенов. Контроль каждой реакции (образцы 2, 4 и 6 без ДНК) не показал полос. (Рисунок 7, левая панель).
Те же ПЦР-реакции, которые использовались для анализа AGE, использовали для проведения анализа NALFIA, чтобы сравнить их эффективность (Рисунок 7, правая панель). Образцы 1 и 5 дали положительный результат на наличие V. dahliae и M. phaseolina соответственно. Образец 5 дал положительный результат на наличие обоих патогенов. Контрольные образцы 2, 4 и 6, как и ожидалось, не показали наличия положительных сигналов на тестовых линиях. Анализ нескольких образцов ДНК (n = 12) дал аналогичные результаты.
3.4. Искусственная инокуляция растений земляники
Все инокулированные растения показали серьезные повреждения, вызванные инокуляцией M. phaseolina и/или V. dahliae (одинарная или двойная инокуляция). Растения земляники показали явные симптомы увядания, хлороза и/или некроза старых нижних листьев, а черешки полностью полегли. Симптомы постепенно появлялись в течение примерно двух месяцев (12–58 дней после инокуляции), и по мере появления более тяжелых симптомов растения отбирали. Ни одно из контрольных растений не проявляло таких симптомов заболевания, и инокулированные изоляты не были повторно выделены из этих растений.
Культивируемые грибы были выделены из высеянных инокулированных и неинокулированных тканей земляники. На основе культурных и морфологических характеристик колоний были идентифицированы различные роды грибов (Рисунок 8). Из 24 растений, инокулированных M. phaseolina, он был выделен из 12 растений, в то время как V. dahliae никогда не выделяли из 24 инокулированных растений. В общей сложности доминирующим отделом был Ascomycota, за исключением рода Ceratobasidium, который принадлежит к отделу Basidiomycota. Кроме того, мы не смогли идентифицировать несколько таксонов на уровне рода (Другие).
Рисунок 8. Частота выделения (%) культивируемых родов грибов, выделенных из корневых шеек и черешков растений земляники.
3.5. Дуплексный анализ ПЦР-NALFIA с использованием ДНК, выделенной из корневых шеек земляники
Наличие ингибиторов ПЦР в тканях растений земляники является одной из основных проблем, с которыми мы столкнулись при разработке дуплексного анализа ПЦР-NALFIA.
ДНК, выделенную из корневых шеек земляники с использованием коммерческого набора на основе использования магнитных частиц, тестировали в экспериментах ПЦР как с универсальными парами праймеров ITS (ITS1/ITS4 и ITS5/ITS4), так и с видоспецифичными парами праймеров (MP102F/MP102R и Vd7b/Vd10) без получения какого-либо результата.
Когда выделенные образцы ДНК очищали путем специфического устранения потенциальных загрязнений, которые могли ингибировать последующую ПЦР, были получены положительные результаты. При необходимости образцы концентрировали для получения количества ДНК примерно равного 10 нг мкл⁻¹.
В случае образцов ДНК, выделенных из корневых шеек земляники, инокулированных отдельно двумя патогенами, в анализе AGE видимых полос не наблюдалось. Видимых полос не наблюдалось даже при использовании образцов ДНК, выделенных из контрольных растений, инокулированных кончиками зубочисток, не колонизированных M. phaseolina или V. dahliae. Единственными видимыми полосами являются полосы положительных контролей эксперимента, состоящих из ДНК, выделенной из мицелия грибов (Рисунок 9a,b, левая панель). Однако в анализе NALFIA с использованием тех же образцов, проанализированных с помощью анализа AGE, тест-полоски показали, что образцы земляники положительны на наличие M. phaseolina или V. dahliae, что демонстрирует повышенную чувствительность этого анализа. Положительные контроли показали очень четкую полосу на полосках, в то время как образцы от контрольных растений, как и ожидалось, не показали полосы на полосках (Рисунок 9a,b, правая панель).
Рисунок 9. Электрофорез в геле (левая панель) и анализ NALFIA (правая панель) ПЦР с использованием ДНК, выделенной из тканей корневой шейки земляники, инокулированных Verticillium dahliae (a) и Macrophomina phaseolina (b). Пара праймеров Vd7b/Vd10, меченная дигоксигенином и FITC, использовалась для обнаружения Verticillium dahliae, а пара праймеров MP102F/MP102R, меченная биотином и FITC, использовалась для обнаружения Macrophomina phaseolina. 1 = образцы корневых шеек земляники, инокулированных Verticillium dahliae (a) и Macrophomina phaseolina (b). 2 = ДНК, выделенная из мицелия Verticillium dahliae (a) и Macrophomina phaseolina (b). 3 = образцы неинокулированной корневой шейки земляники. M = лестница ДНК 100 п.н. Белая стрелка указывает на полосу 500 п.н. маркера. Анализ NALFIA проводили с теми же ампликонами, которые использовались в электрофорезе в агарозном геле.
Образцы ДНК от растений земляники, инокулированных M. phaseolina и V. dahliae, подвергали дуплексной ПЦР с использованием видоспецифичных праймеров. В анализе AGE образец 1 не показал никаких видимых полос, в то время как образец 2 показал слабые полосы для обоих патогенов. Положительный контроль эксперимента показал две очень интенсивные полосы, и видимых полос не наблюдалось даже при использовании ДНК, выделенной из контрольного растения (Рисунок 10, левая панель). В этом случае анализ NALFIA оказался более чувствительным, чем анализ AGE, идентифицировав оба патогена в образцах ДНК земляники, инокулированной обоими грибами, а также в положительном контроле. Образец от контрольного растения, как и ожидалось, не показал полосы на полоске (Рисунок 10, правая панель). Анализ нескольких образцов ДНК (n = 12) дал аналогичные результаты.
Рисунок 10. Электрофорез в геле (левая панель) и анализ NALFIA (правая панель) дуплексной ПЦР с использованием ДНК, выделенной из тканей корневой шейки земляники, инокулированных Verticillium dahliae и Macrophomina phaseolina. Пара праймеров Vd7b/Vd10, меченная дигоксигенином и FITC, использовалась для обнаружения Verticillium dahliae, а пара праймеров MP102F/MP102R, меченная биотином и FITC, использовалась для обнаружения Macrophomina phaseolina. Обе пары праймеров использовались для дуплексной ПЦР. 1 и 2 = образцы корневых шеек земляники, инокулированных обоими патогенами. 3 = ДНК, выделенная из мицелия Verticillium dahliae и Macrophomina phaseolina. 4 = образец неинокулированной корневой шейки земляники. M = лестница ДНК 100 п.н. Белая стрелка указывает на полосу 500 п.н. маркера. Анализ NALFIA проводили с теми же ампликонами, которые использовались в электрофорезе в агарозном геле. Vd = Verticillium dahliae; Mp = Macrophomina phaseolina; C = контроль неинокулированного образца.
4. Обсуждение
В данном исследовании мы успешно разработали новый дуплексный анализ ПЦР-NALFIA, который может одновременно обнаруживать M. phaseolina и V. dahliae, возбудителей гнилей корневой шейки и корней земляники, непосредственно из пораженных корневых шеек земляники.
ПЦР-протокол, описанный в данном исследовании, представляет собой первую попытку установить дуплексный метод обнаружения как M. phaseolina, так и V. dahliae. С разработанным ПЦР-протоколом длина каждого ампликона соответствовала ожидаемой длине ампликона, полученной в других исследованиях с использованием тех же видоспецифичных праймеров [42,50].
Критический аспект применения мультиплексной ПЦР — это соотношение праймеров и матрицы. Чрезмерно высокие соотношения могут привести к образованию димеров праймеров [31]. Поэтому концентрации видоспецифичных праймеров для этого протокола были максимально снижены: 0,2 мкМ для MP102F/MP102R и 0,1 мкМ для Vd7b/Vd10. Дополнительно, недавно было показано, что одним из факторов, влияющих на эффективность анализа NALFIA, является наличие непрореагировавших ПЦР-праймеров [51]. Эти концентрации были достаточны для амплификации 1 нг ДНК из чистых культур патогенов и 10 нг ДНК, выделенной из искусственно инокулированных корневых шеек дыни и земляники.
Выбор праймеров играет ключевую роль в оптимизации протоколов мультиплексной ПЦР. Длина праймеров должна составлять 18–24 п.н. или более, с содержанием GC 35–60% и температурой отжига (Ta) 55–58 °C [30]. Эти условия почти оптимальны в нашем случае: праймер MP102R имеет длину 16 п.н., а праймер MP102F имеет содержание GC 67%, а праймеры для V. dahliae попадают в описанные выше параметры.
Выбранный для этого протокола цикл ПЦР состоял из 25 циклов, что является более короткой программой, чем обычно. Это решение было обусловлено необходимостью адаптировать диагностическую систему для анализа NALFIA. Действительно, уменьшая количество циклов ПЦР, значительно снижается возможность образования ложноположительных результатов, отображаемых на иммунохроматографическом устройстве (LFD) [39].
Разработанный протокол дуплексной ПЦР был сначала протестирован на ДНК, выделенной из мицелия двух патогенов, а затем на все более сложных биологических системах: срезах стеблей дыни и горшечных растениях земляники.
Искусственная инокуляция срезов стеблей дыни позволила проследить присутствие двух патогенов в растительных тканях, чтобы точнее выбрать образцы для молекулярных анализов. Оба патогена быстро колонизируют ткани дыни, поскольку дыня является одним из нескольких хозяев как M. phaseolina, так и V. dahliae, которые связаны с корневой гнилью дыни [17,52]. Отсутствие истинной системы защиты растений и других источников питательных веществ позволило патогенам расти внутри стеблей дыни, которые оказались хорошей модельной системой для мониторинга роста патогенов внутри растительной ткани. Протокол дуплексной ПЦР был эффективен в обнаружении двух патогенов в тканях дыни.
При использовании искусственно инокулированных растений земляники, выращенных в горшках, разработанный протокол дуплексной ПЦР дал хорошие результаты только тогда, когда образцы ДНК были очищены путем удаления ингибиторов ПЦР.
Хорошо известно, что обнаружение патогенов в тканях земляники постоянно осложняется наличием ингибиторов ПЦР, таких как полисахариды и полифенолы. Эти ингибиторы могут мешать работе Taq-полимеразы, хелатируя ионы магния (Mg²⁺), осаждая фермент или ингибируя его активность путем образования вторичных структур или связывания с целевой ДНК [53]. Дополнительно, ингибиторы ПЦР снижают чувствительность реакции, и когда начальные последовательности целевой ДНК присутствуют в низком количестве копий, они мешают первым критическим циклам амплификации и могут вызывать ложноотрицательные результаты [24].
Со временем было предложено несколько решений проблемы присутствия ингибиторов ПЦР в образцах ДНК, выделенных из тканей растений земляники, как с использованием коммерческих наборов, так и с помощью специфических протоколов выделения ДНК [24,29,53,54].
Другой способ преодолеть присутствие ингибиторов ПЦР — разбавить экстракты ДНК для снижения их концентрации. Хотя этот метод может уменьшить присутствие ингибиторов, он также влияет на эффективность и чувствительность анализа, снижая количество копий ДНК, способных к амплификации [55].
В данном исследовании проблема присутствия ингибиторов ПЦР в образцах ДНК, выделенных из корневых шеек земляники, была решена с использованием набора для удаления ингибиторов ПЦР, специально разработанного для устранения полифенольных соединений, гуминовых/фульвокислот, танинов и меланина. После процесса очистки присутствие M. phaseolina и V. dahliae было успешно обнаружено в образцах ДНК земляники, как по отдельности, так и одновременно. Протокол дуплексной ПЦР оказался эффективным в обнаружении двух патогенов внутри корневых шеек земляники, при этом большая чувствительность была наглядно показана при использовании анализа NALFIA по сравнению с анализом AGE. Аналогичные результаты были получены при разработке анализа ПЦР-NALFIA для обнаружения M. phaseolina [42].
Аналогично, некоторые авторы, во время разработки диагностического анализа для Xanthomonas fragariae в тканях корневой шейки земляники, четко выделили отсутствие амплификации целевой ДНК при выполнении стандартной ПЦР на геномной ДНК, выделенной из смеси бактерий и экстрактов тканей корневой шейки земляники. Они опробовали ряд распространенных наборов/методов выделения ДНК без положительных результатов и предположили, что присутствующие в экстрактах тканей корневой шейки ингибиторы ПЦР не были удовлетворительно устранены или снижены, чтобы позволить произойти стандартной ПЦР [56]. Таким образом, наши результаты помогают подтвердить, что качество ДНК, выделенной из растительного материала земляники (особенно корневых шеек), может представлять собой узкое место в диагностике заболеваний.
Мы использовали метод инокуляции зубочистками для создания зараженного материала для оценки дуплексного анализа ПЦР-NALFIA в тканях земляники. Этот метод оказался очень эффективным как для M. phaseolina [47,57], так и для V. dahliae [58,59], которые инокулировались по отдельности. В данном исследовании оба патогена совместно инокулировали в растения земляники, что все равно дало хорошие результаты. Аналогичные результаты были получены Degani и др., которые предложили метод совместной инокуляции, опосредованный зубочистками, для M. phaseolina и Magnaporthiopsis maydis в проростках хлопчатника [60].
Выделение нескольких культивируемых грибов из корневых шеек земляники подчеркнуло, что образцы выделенной ДНК, использованные для проверки эффективности разработанного протокола дуплексной ПЦР, содержали смесь ДНК: от растения, от инокулированных патогенных грибов и от естественно присутствующих неинокулированных грибов. Это доказательство сделало метод идентификации дуплексной ПЦР более надежным, даже если присутствие двух патогенов было очень низким. Фактически, используя в качестве положительного контроля 1 нг ДНК, выделенной из чистых культур M. phaseolina и V. dahliae, можно было наблюдать довольно интенсивные полосы как в анализе AGE, так и в анализе NALFIA. Выделение, амплификация и идентификация микробной ДНК в различных образцах окружающей среды довольно сложны, особенно когда патогены присутствуют в небольшом количестве [61].
Порог чувствительности дуплексной ПЦР-реакции оценивали, тестируя последовательные разведения ДНК, выделенной из мицелия M. phaseolina и V. dahliae, в качестве матриц. Предел обнаружения анализа NALFIA для обоих патогенов составил 10 пг, тогда как для AGE он составил 1 нг для V. dahliae и 100 пг для M. phaseolina.
Анализ NALFIA всегда давал положительные результаты, но полосы были менее интенсивными, когда использовались сложные образцы ДНК (10 нг), выделенные из инфицированных тканей. Это предполагает, что присутствие двух патогенов в этих образцах, безусловно, в количествах менее 1 нг. В предыдущем исследовании с использованием M. phaseolina слабые полосы соответствовали приблизительно 0,017–1,7 пг целевой ДНК [42].
Чувствительность дуплексного анализа ПЦР-NALFIA, разработанного в данном исследовании, немного ниже, чем обнаруженная в анализах одинарной ПЦР. С другой стороны, известно, что мультиплексные ПЦР используют несколько пар праймеров, которые конкурируют за доступные реагенты в реакции, и это снижает общую чувствительность. Дополнительно, оптимизация дуплексной ПЦР-реакции для предотвращения неспецифических продуктов ПЦР и ложноположительных результатов в анализе NALFIA могла немного снизить чувствительность, достижимую в реакциях одинарной ПЦР [34].
Несмотря на это, чувствительность разработанного дуплексного анализа ПЦР-NALFIA остается высокой, также благодаря мультикопийной природе используемой целевой ДНК. Действительно, высокое число копий межгенного спейсера (IGS) ядерной рибосомальной ДНК (рДНК) увеличивает чувствительность методов на основе ПЦР, и эта область использовалась для разработки специфических диагностических анализов для многих фитопатогенных грибов [42]. Для V. dahliae, который использовал пару праймеров Vd7b/Vd10, предел обнаружения составил 1 пг мкл⁻¹ при Scorpion-PCR и 1 фг мкл⁻¹ при вложенной Scorpion-PCR [50].
Дуплексный анализ ПЦР-NALFIA, разработанный в данном исследовании, также может быть применен к другим биологическим матрицам, таким как почва, семена или вода. Анализ является качественным и может стать полуколичественным, поскольку это колориметрическое обнаружение. Количественные результаты теста основаны на считывании цвета полос с помощью портативного считывателя полосок и могут быть интегрированы с электронными устройствами, такими как смартфоны [37].
Потребность в быстрых и высокочувствительных методах обнаружения патогенов становится все более важной, особенно поскольку питомники и производители земляники полагаются на диагностику для обеспечения свободного от патогенов посадочного материала и для различения почвенных заболеваний со схожими симптомами.
Дуплексный анализ ПЦР-NALFIA, описанный здесь, оказался специфичным, чувствительным, быстрым и достаточно практичным и может быть очень мощным и простым инструментом для точной диагностики M. phaseolina и V. dahliae, двух из наиболее важных грибных патогенов культурной земляники в мире.
5. Выводы
При выращивании земляники болезни, вызываемые почвенными патогенами, приводят к значительным потерям производства. Поэтому крайне важно иметь диагностические методы с высокой специфичностью и чувствительностью для правильной идентификации различных патогенов и для применения адекватных стратегий защиты. Двумя наиболее важными патогенами, снижающими урожайность в посевах земляники, являются грибы Macrophomina phaseolina и Verticillium dahliae, оба вызывающие заболевания гнилей корневой шейки и корней.
Управление заболеванием, вызванным двумя патогенами земляники, включает культурные (например, соляризацию почвы, анаэробную обеззараживание почвы, внесение мелиорантов в почву и обработку паром), устойчивость хозяина, химические и биологические стратегии. Однако их реакция на эти стратегии иногда различается значительно. Например, соляризация почвы и анаэробное обеззараживание почвы показали положительные результаты в нескольких исследованиях против V. dahliae, но в случае с M. phaseolina они не обеспечили полного контроля в полевых условиях [62,63].
Генетическая устойчивость к V. dahliae и M. phaseolina считается одним из многих компонентов интегрированной системы управления болезнями. Многие исследования были сосредоточены на устойчивости сортов земляники к этим грибным патогенам. Некоторые коммерческие сорта показали частичную устойчивость к V. dahliae, тогда как для M. phaseolina был обнаружен широкий спектр ответных реакций, указывающий на то, что устойчивость хозяина может быть использована для частичного контроля этого патогена. Дополнительно, было выделено, что каждый сорт земляники показывает различные уровни устойчивости/восприимчивости к двум патогенам [11,64]. Следовательно, знание того, какой патоген присутствует, позволяет использовать более утонченный подход, используя как генетическую устойчивость, так и агротехнические приемы.
Традиционные диагностические методы часто трудоемки, требуют много времени и менее точны, чем современные молекулярные методы, которые предлагают более быстрые, надежные и высокочувствительные результаты для идентификации целевых микроорганизмов. Хотя некоторые молекулярные методы требуют специализированного оборудования, предлагаемый дуплексный анализ ПЦР-NALFIA характеризуется своей простотой и доступностью. Протокол для одновременного обнаружения M. phaseolina и V. dahliae, начиная с выделения образца ДНК из корневой шейки земляники, требует примерно 2 часов лабораторной работы для получения конечного результата. Этот метод не требует квалифицированного персонала и дорогостоящего оборудования, и результаты могут быть легко интерпретированы. Эта доступность в сочетании с простотой и скоростью метода делает его значительным улучшением по сравнению с традиционными подходами или более специализированными молекулярными методами.
Дополнительные материалы
Следующие вспомогательные материалы можно загрузить по адресу: https://www.mdpi.com/article/10.3390/agriculture15020160/s1, Рисунок S1: Схематическое представление метода повторного выделения Macrophomina phaseolina и Verticillium dahliae и отбора растительного материала для выделения ДНК из инокулированных срезов стеблей дыни; Рисунок S2: Схематическое представление метода повторного выделения Macrophomina phaseolina и Verticillium dahliae и отбора растительного материала для выделения ДНК из инокулированных корневых шеек земляники; Рисунок S3: Схематическое представление метода выделения ДНК из инокулированных корневых шеек земляники; Рисунок S4: Электрофорез в геле одинарной ПЦР с использованием ДНК, выделенной из мицелия Verticillium dahliae и Macrophomina phaseolina. Каждая видоспецифичная пара праймеров использовалась с ДНК другого целевого вида, чтобы проверить наличие любых неспецифических взаимодействий; Рисунок S5: Специфичность дуплексной ПЦР с использованием пары праймеров MP102F/MP102R, меченных биотином и FITC, для обнаружения Macrophomina phaseolina и пары праймеров Vd7b/Vd10, меченных дигоксигенином и FITC, для обнаружения Verticillium dahliae. Дуплексную ПЦР проводили с использованием ДНК (1 нг), выделенной из мицелия изолятов внешней группы (Verticillium tricorpus, Verticillium nubilum, Diplodia seriata и Neofusicoccum parvum).
Ссылки
1. Simpson, D. The economic importance of strawberry crops. In The Genomes of Rosaceous Berries and Their Wild Relatives; Hytönen, T., Graham, J., Harrison, R., Eds.; Springer: Cham, Switzerland, 2018; pp. 1–7. [Google Scholar]
2. FAO. Agricultural Data/Agricultural Production/Crops Primary [WWW Document]. FAOSTAT 2024. Available online: https://www.fao.org/faostat/en/#data/QCL (accessed on 22 June 2024).
3. Hernàndez-Martínez, N.R.; Blanchard, C.; Wells, D.; Salazar-Gutiérrez, M.R. Current state and future perspectives of commercial strawberry production: A review. Sci. Hortic. 2023, 312, 111893. [Google Scholar] [CrossRef]
4. Steele, M.E.; Hewavitharana, S.S.; Henry, P.; Goldman, P.; Holmes, G.J. Survey of late-season soilborne pathogens infecting strawberry in Watsonville-Salinas, California. Plant Health Prog. 2023, 24, 104–109. [Google Scholar] [CrossRef]
5. Katan, J. Diseases caused by soilborne pathogens: Biology, management and challenges. J. Plant Pathol. 2017, 99, 305–315. [Google Scholar]
6. Panth, M.; Hassler, S.C.; Baysal-Gurel, F. Methods for management of soilborne diseases in crop production. Agriculture 2020, 10, 16. [Google Scholar] [CrossRef]
7. de los Santos, B.; Medina, J.J.; Miranda, L.; Gómez, J.A.; Talavera, M. Soil disinfestation efficacy against soil fungal pathogens in strawberry crops in Spain: An overview. Agronomy 2021, 11, 526. [Google Scholar] [CrossRef]
8. Pastrana, A.M.; Borrero, C.; Pérez, A.G.; Avilés, M. Soilborne pathogens affect strawberry fruit flavor and quality. Plant Sci. 2023, 326, 111533. [Google Scholar] [CrossRef]
9. Chamorro, M.; Seijo, T.E.; Noling, J.C.; de los Santos, B.; Peres, N.A. Efficacy of fumigant treatments and inoculum placement on control of Macrophomina phaseolina in strawberry beds. Crop Prot. 2016, 90, 163–169. [Google Scholar] [CrossRef]
10. López-Aranda, J.M.; Domínguez, P.; Miranda, L.; de los Santos, B.; Talavera, M.; Daugovish, O.; Soria, C.; Chamorro, M.; Medina, J.J. Fumigant use for strawberry production in Europe: The current landscape and solutions. Int. J. Fruit Sci. 2016, 16, 1–15. [Google Scholar] [CrossRef]
11. Holmes, G.J.; Mansouripour, S.Y.; Hewavitharana, S.S. Strawberries at the crossroads: Management of soil-borne diseases in California without methyl bromide. Phytopathology 2020, 110, 956–968. [Google Scholar] [CrossRef]
12. Steele, M.E.; Mendez, M.; Hewavitharana, S.S.; Holmes, G.J. Survey of soilborne pathogens infecting strawberry in Santa Maria, California. Int. J. Fruit Sci. 2023, 23, 256–266. [Google Scholar] [CrossRef]
13. Koster, J.T.; Ding, S.; Holmes, G.J.; Robinson, E.A.; Hewavitharana, S.S. Effect of sequential crop termination and bed fumigation on Verticillium dahliae soil and plant density in strawberry. Int. J. Fruit Sci. 2024, 24, 1–17. [Google Scholar] [CrossRef]
14. Marquez, N.; Giachero, M.L.; Declerck, S.; Ducasse, D.A. Macrophomina phaseolina: General characteristics of pathogenicity and methods of control. Front. Plant Sci. 2021, 12, 634397. [Google Scholar] [CrossRef] [PubMed]
15. Pandey, A.K.; Basandrai, A.K. Will Macrophomina phaseolina spread in legumes due to climate change? A critical review of current knowledge. J. Plant Dis. Prot. 2021, 128, 9–18. [Google Scholar] [CrossRef]
16. Mathur, M.; Mathur, P. Global distribution modelling of Macrophomina phaseolina (Tassi) Goid: A comparative assessment using ensemble machine learning tools. Australas. Plant Pathol. 2023, 52, 353–371. [Google Scholar] [CrossRef]
17. Cohen, R.; Elkabetz, M.; Paris, H.S.; Gur, A.; Dai, N.; Rabinovitz, O.; Freeman, S. Occurrence of Macrophomina phaseolina in Israel: Challenges for disease management and crop germplasm enhancement. Plant Dis. 2022, 106, 15–25. [Google Scholar] [CrossRef]
18. Khan, A.N.; Shair, F.; Malik, K.; Hayat, Z.; Khan, M.A.; Hafeez, F.Y.; Hassan, M.N. Molecular identification and genetic characterization of Macrophomina phaseolina strains causing pathogenicity on sunflower and chickpea. Front. Microbiol. 2017, 8, 1309. [Google Scholar] [CrossRef]
19. Klosterman, S.J.; Atallah, Z.K.; Vallad, G.E.; Subbarao, K.V. Diversity, pathogenicity, and management of Verticillium species. Annu. Rev. Phytopathol. 2009, 47, 39–62. [Google Scholar] [CrossRef]
20. Song, R.; Li, J.; Xie, C.; Jian, W.; Yang, X. An overview of the molecular genetics of plant resistance to the Verticillium wilt pathogen Verticillium dahliae. Int. J. Mol. Sci. 2020, 21, 1120. [Google Scholar] [CrossRef]
21. Kowalska, B. Management of the soil-borne fungal pathogen—Verticillium dahliae Kleb. causing vascular wilt diseases. J. Plant Pathol. 2021, 103, 1185–1194. [Google Scholar] [CrossRef]
22. Wilhelm, S. Longevity of the Verticillium wilt fungus in the laboratory and the field. Phytopathology 1958, 45, 180–181. [Google Scholar]
23. Koike, S.T.; Gordon, T.R. Management of Fusarium wilt of strawberry. Crop Prot. 2015, 73, 67–72. [Google Scholar] [CrossRef]
24. Mirmajlessi, S.M.; Destefanis, M.; Gottsberger, R.A.; Mänd, M.; Loit, E. PCR-based specific techniques used for detecting the most important pathogens on strawberry: A systematic review. Syst. Rev. 2015, 4, 9. [Google Scholar] [CrossRef] [PubMed]
25. Baldi, P.; La Porta, N. Molecular approaches for low-cost point-of-care pathogen detection in agriculture and forestry. Front. Plant Sci. 2020, 11, 570862. [Google Scholar] [CrossRef] [PubMed]
26. Pastrana, A.M.; Basallote-Ureba, M.J.; Aguado, A.; Capote, N. Potential inoculum sources and incidence of strawberry soilborne pathogens in Spain. Plant Dis. 2017, 101, 751–760. [Google Scholar] [CrossRef]
27. Martinelli, F.; Scalenghe, R.; Davino, S.; Panno, S.; Scuderi, G.; Ruisi, P.; Villa, P.; Stroppiana, D.; Boschetti, M.; Goulart, L.R.; et al. Advanced methods of plant disease detection. A review. Agron. Sustain. Dev. 2015, 35, 1–25. [Google Scholar] [CrossRef]
28. Venbrux, M.; Crauwels, S.; Rediers, H. Current and emerging trends in techniques for plant pathogen detection. Front. Plant Sci. 2023, 14, 1120968. [Google Scholar] [CrossRef]
29. Bhat, R.G.; Browne, G.T. Specific detection of Phytophthora cactorum in diseased strawberry plants using nested polymerase chain reaction. Plant Pathol. 2010, 59, 121–129. [Google Scholar] [CrossRef]
30. Henegariu, O.; Heerema, N.A.; Dlouhy, S.R.; Vance, G.H.; Vogt, P.H. Multiplex PCR: Critical parameters and step-by-step protocol. BioTechniques 1997, 23, 504–511. [Google Scholar] [CrossRef]
31. Markoulatos, P.; Siafakas, N.; Moncany, M. Multiplex polymerase chain reaction: A practical approach. J. Clin. Lab. Anal. 2002, 16, 47–51. [Google Scholar] [CrossRef]
32. Ishiguro, Y.; Asano, T.; Otsubo, K.; Suga, H.; Kageyama, K. Simultaneous detection by multiplex PCR of the high-temperature-growing Pythium species: P. aphanidermatum, P. helicoides and P. myriotylum. J. Gen. Plant Pathol. 2013, 79, 350–358. [Google Scholar] [CrossRef]
33. Li, M.; Asano, T.; Suga, H.; Kageyama, K. A multiplex PCR for the detection of Phytophthora nicotianae and P. cactorum, and a survey of their occurrence in strawberry production areas of Japan. Plant Dis. 2011, 95, 1270–1278. [Google Scholar] [CrossRef] [PubMed]
34. Hou, S.; Liu, J.; Xu, T.; Li, X.; Li, X.; Li, S.; Wang, H. Simultaneous detection of three crown rot pathogens in field-grown strawberry plants using a multiplex PCR assay. Crop Prot. 2022, 156, 105957. [Google Scholar] [CrossRef]
35. Nakano, M.; Inaba, M.; Suehiro, J. Selective visual detection of multiplex PCR amplicon using magnetic microbeads. Biosens. Bioelectron. X 2024, 18, 100461. [Google Scholar] [CrossRef]
36. O’Farrel, B. Lateral flow immunoassay systems: Evolution from the current state of the art to the next generation of highly sensitive, quantitative rapid assays. In The Immunoassay Handbook Theory and Applications of Ligand Binding, ELISA and Related Techniques, 4th ed.; Wild, D.G., Ed.; Elsevier Ltd: London, UK, 2013; pp. 89–107. [Google Scholar]
37. Bahadır, E.B.; Sezgintürk, M.K. Lateral flow assays: Principles, designs and labels. TrAC Trends Anal. Chem. 2016, 82, 286–306. [Google Scholar] [CrossRef]
38. Andryukov, B.G. Six decades of lateral flow immunoassay: From determining metabolic markers to diagnosing COVID-19. AIMS Microbiol. 2020, 6, 280–304. [Google Scholar] [CrossRef]
39. Blažková, M.; Koets, M.; Rauch, P.; van Amerongen, A. Development of a nucleic acid lateral flow immunoassay for simultaneous detection of Listeria spp. and Listeria monocytogenes in food. Eur. Food Res. Technol. 2009, 229, 867–874. [Google Scholar] [CrossRef]
40. Blažková, M.; Koets, M.; Wichers, J.H.; Van Amerongen, A.; Fukal, L.; Rauch, P. Nucleic acid lateral flow immunoassay for the detection of pathogenic bacteria from food. Czech J. Food Sci. 2009, 27, S350–S353. [Google Scholar] [CrossRef]
41. Posthuma-Trumpie, G.A.; Korf, J.; van Amerongen, A. Lateral flow (immuno)assay: Its strengths, weaknesses, opportunities and threats. A literature survey. Anal. Bioanal. Chem. 2009, 393, 569–582. [Google Scholar] [CrossRef]
42. Pecchia, S.; Da Lio, D. Development of a rapid PCR Nucleic Acid Lateral Flow Immunoassay (PCR-NALFIA) based on rDNA IGS sequence analysis for the detection of Macrophomina phaseolina in soil. J. Microbiol. Methods 2018, 158, 118–128. [Google Scholar] [CrossRef]
43. Anfossi, L.; Di Nardo, F.; Cavalera, S.; Giovannoli, C.; Baggiani, C. Multiplex lateral flow immunoassay: An overview of strategies towards high-throughput point-of-need testing. Biosensors 2019, 9, 2. [Google Scholar] [CrossRef]
44. Roth, J.M.; De Bes, L.; Sawa, P.; Omweri, G.; Osoti, V.; Oberheitmann, B.; Schallig, H.D.F.H.; Mens, P.F. Plasmodium detection and differentiation by direct-on-blood PCR nucleic acid lateral flow immunoassay: Development, validation, and evaluation. J. Mol. Diagn. 2018, 20, 78–86. [Google Scholar] [CrossRef] [PubMed]
45. Inderbitzin, P.; Bostock, R.M.; Davis, R.M.; Usami, T.; Platt, H.W.; Subbarao, K.V. Phylogenetics and taxonomy of the fungal vascular wilt pathogen Verticillium, with the descriptions of five new species. PLoS ONE 2011, 6, e28341. [Google Scholar] [CrossRef] [PubMed]
46. Twizeyimana, M.; Hill, C.B.; Pawlowski, M.; Paul, C.; Hartman, G.L. A cut-stem inoculation technique to evaluate soybean for resistance to Macrophomina phaseolina. Plant Dis. 2012, 96, 1210–1215. [Google Scholar] [CrossRef] [PubMed]
47. Pickel, B.; Dai, N.; Maymon, M.; Elazar, M.; Tanami, Z.; Frenkel, O.; Toamy, M.A.; Mor, N.; Freeman, S. Development of a reliable screening technique for determining tolerance to Macrophomina phaseolina in strawberry. Eur. J. Plant Pathol. 2020, 157, 707–718. [Google Scholar] [CrossRef]
48. White, T.J.; Bruns, T.; Lee, S.; Tailor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In PCR Protocols. A Guide to Methods and Applications; Innis, M.A., Gelfand, D.H., Sninsky, J.J., White, T.J., Eds.; Academic Press, Inc.: New York, NY, USA, 1990; pp. 315–322. [Google Scholar]
49. Pecchia, S.; Caggiano, B.; Da Lio, D.; Resta, E. Morphological and molecular identification of Dactylonectria macrodidyma as causal agent of a severe Prunus lusitanica dieback in Italy. Horticulturae 2023, 9, 145. [Google Scholar] [CrossRef]
50. Schena, L.; Nigro, F.; Ippolito, A. Real-time PCR detection and quantification of soilborne fungal pathogens: The case of Rosellinia necatrix, Phytophthora nicotianae, P. citrophthora, and Verticillium dahliae. Phytopathol. Mediterr. 2004, 43, 273–280. [Google Scholar]
51. Agarwal, P.; Toley, B.J. Unreacted labeled PCR primers inhibit the signal in a Nucleic Acid Lateral Flow Assay as elucidated by a transport reaction model. ACS Meas. Sci. Au 2022, 2, 317–324. [Google Scholar] [CrossRef]
52. Aegerter, B.J.; Gordon, T.R.; Davis, R.M. Occurrence and pathogenicity of fungi associated with melon root rot and vine decline in California. Plant Dis. 2000, 84, 224–230. [Google Scholar] [CrossRef]
53. Wei, T.; Lu, G.; Clover, G. Novel approaches to mitigate primer interaction and eliminate inhibitors in multiplex PCR, demonstrated using an assay for detection of three strawberry viruses. J. Virol. Methods 2008, 151, 132–139. [Google Scholar] [CrossRef]
54. Bartsch, C.; Szabo, K.; Dinh-Thanh, M.; Schrader, C.; Trojnar, E.; Johne, R. Comparison and optimization of detection methods for noroviruses in frozen strawberries containing different amounts of RT-PCR inhibitors. Food Microbiol. 2016, 60, 124–130. [Google Scholar] [CrossRef]
55. Munawar, M.A.; Martin, F.; Toljamo, A.; Kokko, H.; Oksanen, E. RPA-PCR couple: An approach to expedite plant diagnostics and overcome PCR inhibitors. BioTechniques 2020, 69, 270–280. [Google Scholar] [CrossRef] [PubMed]
56. Turechek, W.W.; Hartung, J.S.; McCallister, J. Development and optimization of a real-time detection assay for Xanthomonas fragariae in strawberry crown tissue with receiver operating characteristic curve analysis. Phytopathology 2008, 98, 359–368. [Google Scholar] [CrossRef] [PubMed][Green Version]
57. Fang, X.L.; Phillips, D.; Li, H.; Sivasithamparam, K.; Barbetti, M.J. Comparisons of virulence of pathogens associated with crown and root diseases of strawberry in Western Australia with special reference to the effect of temperature. Sci. Hortic. 2011, 131, 39–48. [Google Scholar] [CrossRef]
58. Slattery, R.J. Inoculum potential of verticillium—Infested potato cultivars. Am. Potato J. 1981, 58, 135–142. [Google Scholar] [CrossRef]
59. Retief, E.; Lamprecht, S.; McLeod, A. Characterization and pathogenicity of Verticillium dahliae isolates associated with Verticillium wilt of tomato in the Limpopo Province of South Africa. J. Plant Pathol. 2023, 105, 1465–1481. [Google Scholar] [CrossRef]
60. Degani, O.; Becher, P.; Gordani, A. Pathogenic interactions between Macrophomina phaseolina and Magnaporthiopsis maydis in mutually infected cotton sprouts. Agriculture 2022, 12, 255. [Google Scholar] [CrossRef]
61. Nnachi, R.C.; Sui, N.; Ke, B.; Luo, Z.; Bhalla, N.; He, D.; Yang, Z. Biosensors for rapid detection of bacterial pathogens in water, food and environment. Environ. Int. 2022, 166, 107357. [Google Scholar] [CrossRef]
62. Kanaan, H.; Medina, S.; Krassnovsky, A.; Raviv, M. Survival of Macrophomina phaseolina s.l. and Verticillium dahliae during solarization as affected by composts of various maturities. Crop Prot. 2015, 76, 108–113. [Google Scholar] [CrossRef]
63. Shennan, C.; Muramoto, J.; Baird, G.; Zavatta, M.; Toyama, L.; Mazzola, M.; Koike, S.T. Anaerobic soil disinfestation (ASD): A strategy for control of soil borne diseases in strawberry production. Acta Hortic. 2016, 1137, 113–120. [Google Scholar] [CrossRef]
64. Knapp, S.J.; Cole, G.S.; Pincot, D.D.; Lopez, C.M.; Gonzalez-Benitez, O.A.; Famula, R.A. ‘UC Eclipse’, a summer plant-adapted photoperiod-insensitive strawberry cultivar. HortScience 2023, 58, 1568–1572. [Google Scholar] [CrossRef]
Papini V, Meloni A, Pecchia S. Development of a Duplex PCR-NALFIA Assay for the Simultaneous Detection of Macrophomina phaseolina and Verticillium dahliae Causal Agents of Crown and Root Rot of Strawberry. Agriculture. 2025; 15(2):160. https://doi.org/10.3390/agriculture15020160
Перевод статьи «Development of a Duplex PCR-NALFIA Assay for the Simultaneous Detection ofMacrophomina phaseolinaandVerticillium dahliaeCausal Agents of Crown and Root Rot of Strawberry» авторов Papini V, Meloni A, Pecchia S., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык








































































































Комментарии (0)