Внекорневая подкормка и перемещение радиоактивно меченной суспензии оксида цинка в сравнении с раствором сульфата цинка растениями сои
В настоящем исследовании использовался радиоактивный изотоп 65Zn в качестве трассера для изучения фолиарного поглощения и характера распределения концентрированной суспензии ZnO и раствора ZnSO4, нанесенных распылением на листья растений сои. Обработку мечеными составами проводили распылением на листья на фенологических стадиях V4 и V8. Радиоактивность 65Zn в листьях, корнях, стеблях и стручках определяли с помощью γ-спектрометрии.
Аннотация
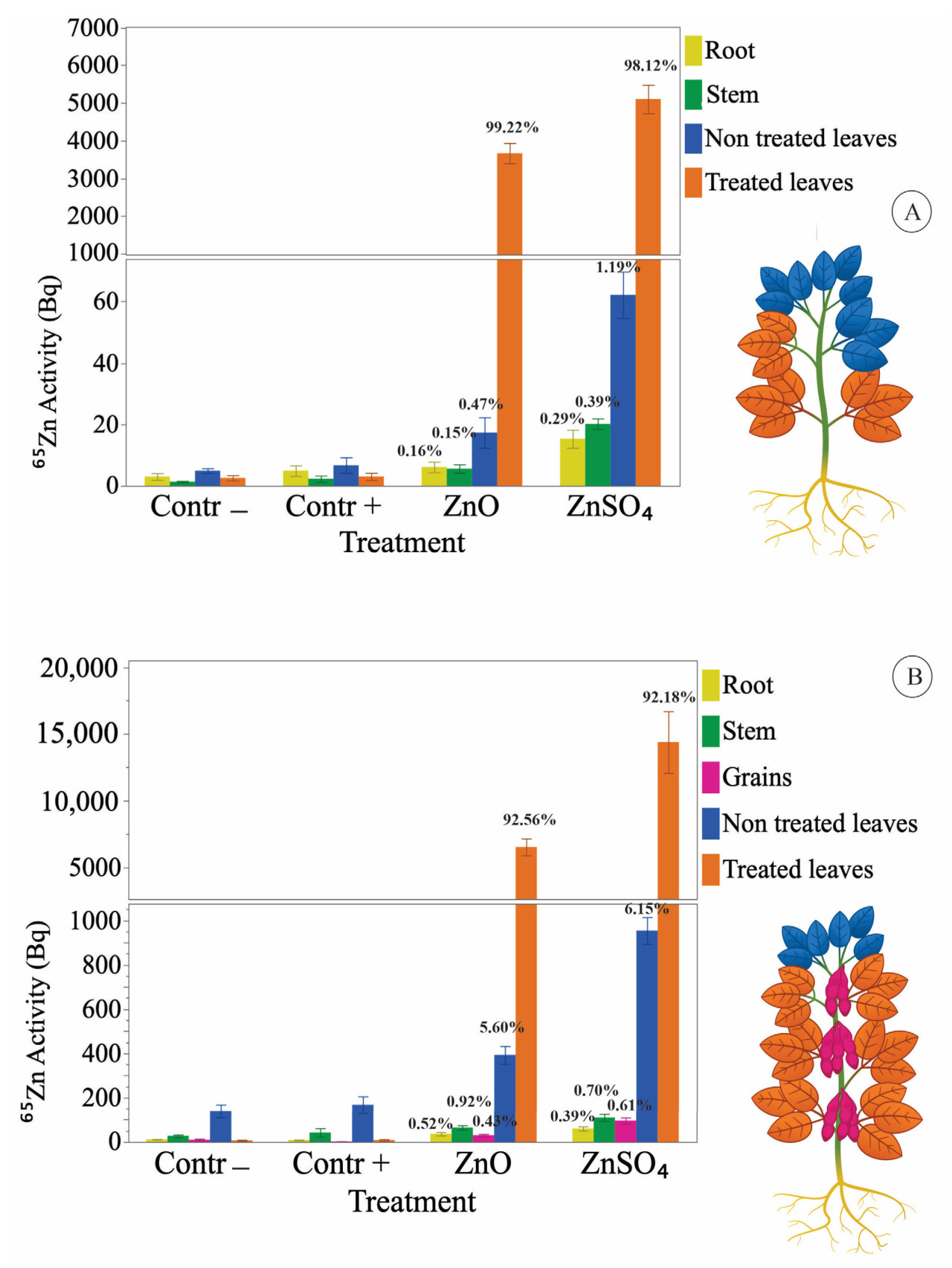
После первой фолиарной обработки (стадия V4) распределение меченого Zn в растениях, обработанных ZnO и ZnSO4, составило соответственно: 99,22% и 98,12% в обработанных листьях; 0,15% и 0,39% в стеблях; 0,16% и 0,29% в корнях; и 0,47% и 1,19% во вновь развернувшихся необработанных листьях.
После двух обработок (стадии V4 и V8) распределение меченого Zn в растениях, обработанных ZnO и ZnSO4, составило соответственно: 92,56% и 92,18% в обработанных листьях; 0,92% и 0,70% в стеблях; 0,52% и 0,39% в корнях; 5,60% и 6,15% во вновь развернувшихся необработанных листьях; и 0,43% и 0,61% в зернах.
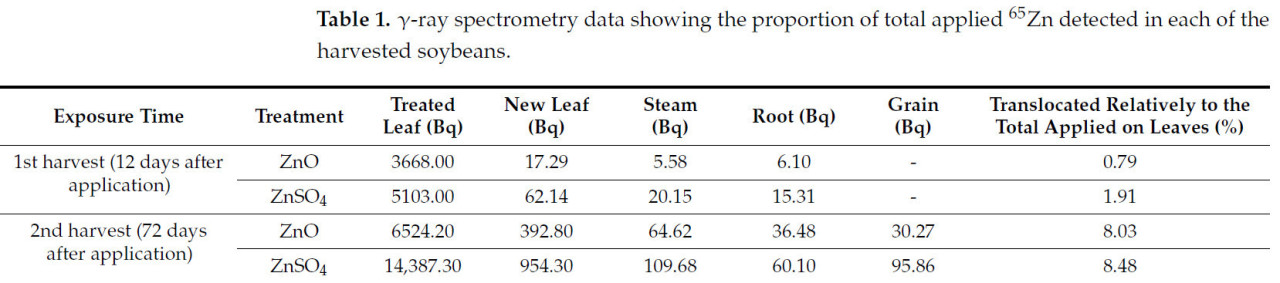
Общая фракция, транслоцированная из ткани нанесения, составила 0,79% для ZnO и 1,91% для ZnSO4 через 12 дней и 8,03% для ZnO и 8,48% для ZnSO4 через 72 дня.
Анатомический анализ показал, что растения, выращенные в питательном растворе с 10% ионной силы Zn, имели на 63% меньше устьиц, а ксилемные сосуды были на 63% меньше по сравнению с растениями, выращенными в растворе со 100% ионной силой Zn.
Можно сделать вывод, что в течение короткого периода (12 дней) поглощение и транслокация ZnSO4 были выше и быстрее, чем у ZnO, а в течение длительного периода (72 дня) их эффективность была схожей.
1. Введение
Внекорневое внесение питательных веществ — это устоявшаяся практика, направленная на дополнение почвенного снабжения питательными веществами. Ее можно применять при нескольких условиях, таких как (i) хронически низкий уровень питательных веществ в почве, например, наблюдаемый для микроэлементов-металлов перехода в естественных щелочных условиях или в поверхностном слое известкованных почв в системе нулевой обработки [1]; (ii) временный дефицит в почве, например, наблюдаемый для Mn в условиях затопленных оксисолей из-за конкуренции с избытком Fe²⁺ [2]; (iii) для агрономического биофортификации зерна и плодов [3]; и (iv) для доставки питательных веществ в определенные моменты высокого спроса, гарантируя, что они не будут лимитировать потенциал урожайности растения [4].
Zn напрямую связан с синтезом гормонов роста и, таким образом, непосредственно связан с площадью листа и количеством листовых органов, как показано [5]. Zn преимущественно транспортируется в виде комплексированных ионов Zn²⁺ через флоэму из обработанного листа в другие части растения [6]; избыток Zn также ответственен за открытие устьиц и определяет скорость притока K⁺ в эти клетки, а его избыток может вызвать уменьшение количества замыкающих клеток и размера устьиц [7]. Подсчитано, что около 9% протеома эукариот содержит цинк (Zn) [8]. Этот микроэлемент участвует в делении и удлинении клеток, которые являются критическими процессами в росте и развитии растений. Он играет роль в регуляции ауксинов — растительных гормонов, способствующих удлинению клеток, и действует в поддержании активности клеток камбия, ответственных за образование вторичной ксилемы и флоэмы [1,9,10].
При возделывании сои ткани растений считаются дефицитными по цинку (Zn), когда концентрации падают ниже 20 мг/кг, как отмечено [11]. Кроме того, критический порог для концентрации Zn в почве обычно ниже 1 мг/дм³. В зернах сои концентрации Zn колеблются в пределах 30–50 мг/кг, причем пик накопления происходит между репродуктивными стадиями R5 и R6 [12].
Вынос цинка соей сильно зависит от урожайности, но составляет около 80–100 г/га Zn за цикл роста, из которых 30–50 г/кг экспортируется через убираемые зерна. Цинк классифицируется как микроэлемент с низкой подвижностью внутри растения. После поглощения корнями и транспорта в различные ткани Zn прочно связывается с белками и ферментами [12]. Это сильное связывание затрудняет его перераспределение к новым, активно растущим частям растения. Поэтому симптомы наблюдаются на более молодых листьях.
На рынке удобрений доступно несколько источников цинка; их можно условно разделить на две большие группы: растворы и суспензии. В качестве представителя растворов можно выделить соли, такие как ZnSO₄, хелаты, такие как Zn-ЭДТА, и комплексы, сочетающие Zn²⁺ с аминокислотами или сульфированными лигноцеллюлозными продуктами. Суспензии обычно получают путем измельчения и суспендирования ZnO или ZnCO₃ до микрометрового или субмикронного размера. Альтернативно, наночастицы также могут быть использованы для формирования коллоидных дисперсий. Некоторые из ключевых различий между растворами и суспензиями касаются концентрации растворенного Zn; в отличие от растворов, в суспензиях растворена лишь небольшая доля Zn. Эта доля может быть рассчитана на основе ПР (произведения растворимости) твердого вещества и также зависит от pH. Обычно концентрация, доступная для немедленного поглощения, составляет менее 1% от общего Zn. Концентрация Zn в растворе, среди многих других параметров, влияет на скорость поглощения Zn листьями растений. Этот факт вызывает опасения относительно степени, в которой растения могут поглощать Zn из суспензий.
Таким образом, понимание процессов поглощения и транспорта имеет первостепенное значение для разработки продуктов и адекватного применения конечными пользователями. Радиоизотопы могут быть использованы для изучения поглощения и перемещения определенных элементов в растениях. Например, Zn можно отслеживать путем мониторинга ⁶⁵Zn — радиоактивного изотопа с периодом полураспада 244 дня, который испускает гамма-излучение с энергией 1,11 МэВ.
Используя авторадиографию и γ-спектрометрию, был проанализирован поведение ⁶⁵Zn, нанесенного на листья пшеницы в различных формах (ZnCl₂, ZnЭДТА, наночастицы ZnO и микрочастицы ZnO), при активности каждого обработки 131 МБк. Капля объемом 5 мкл наносилась на самый молодой полностью развернувшийся лист, и образцы отбирались через 1 и 5 дней. Листья, обработанные ⁶⁵ZnCl₂, показали самое высокое поглощение, но имели самый низкий транспорт от обработанного листа через 15 дней. ⁶⁵ZnЭДТА показал промежуточное поглощение и транспорт, в то время как большая часть ⁶⁵Zn от всех обработок оставалась сконцентрированной в обработанном листе [13].
В исследовании, посвященном оценке реакции различных сортов ржи, мягкой и твердой пшеницы на условия с ограниченной доступностью цинка, использовался изотоп ⁶⁵Zn для сравнения способностей поглощения цинка корнями в условиях дефицита цинка. Растения выращивались при 0,1 мкМ (растения с дефицитом Zn) и 10 мкМ (растения с достаточным Zn). Для эксперимента по поглощению, спустя 9, 11 и 13 дней, растения подвергались воздействию питательного раствора, содержащего 8 мкМ ⁶⁵ZnSO₄ + 18,2 мкМ ⁶⁵Zn-HEDTA, меченного 37 кБк ⁶⁵Zn, в течение 8 часов. При адекватном снабжении Zn не было заметных различий в поглощении или транспорте ⁶⁵Zn от корней к побегам среди сортов. Однако в условиях дефицита Zn наблюдались значительные различия. Рожь показала самое высокое поглощение Zn, а твердая пшеница — самое низкое. Среди сортов мягкой пшеницы скорости поглощения ⁶⁵Zn были сходными и не коррелировали с их эффективностью использования Zn, которая относится к их способности поддерживать рост и урожайность при дефиците Zn. В условиях недостатка Zn рожь имела самую быструю транслокацию ⁶⁵Zn от корней к побегам, тогда как сорта мягкой и твердой пшеницы демонстрировали сопоставимые скорости перемещения ⁶⁵Zn от корней к побегам [14].
Аналогично, в другом исследовании, направленном на оценку путей транспорта цинка, нанесенного на листья пшеницы, в экспериментах, предназначенных для отслеживания перемещения ⁶⁵Zn, растения выращивались в питательном растворе без цинка. Исходный раствор 0,71 мМ ⁶⁵Zn с удельной активностью 50 МБк/ммоль использовали для приготовления тестируемого раствора 5 мМ ⁶⁵Zn. Нанесение ⁶⁵Zn проводилось тремя способами: погружением срезанного кончика листа в меченый раствор, нанесением капли раствора, содержащего ⁶⁵Zn, на верхнюю поверхность листа, или добавлением ⁶⁵Zn на одну сторону горшков с разделенными корнями. Нанесение ⁶⁵Zn на поверхность листа показало, что добавление поверхностно-активного вещества (ПАВ) улучшает поглощение Zn примерно на 15%. Следовательно, в последующих экспериментах с поверхностным нанесением использовали раствор, смешанный с ПАВ. Большая часть поверхностно-нанесенного ⁶⁵Zn, около 85%, перемещалась к кончику обработанного листа, в то время как оставшаяся часть распределялась между стеблем, листьями, корнями и, в меньшей степени, старыми листьями [15].
Также, другое исследование изучало эффекты внекорневых обработок ZnSO₄ и наночастиц оксида цинка (ZnO НЧ) на растения фасоли, в частности, оценивая поглощение Zn. Обработки включали применение либо водного раствора ZnSO₄, либо суспензии ZnO НЧ, оба в концентрации 150 мг·л⁻¹. Результаты показали, что обработки ZnO НЧ заметно увеличивали концентрации Zn²⁺ в листочках, корнях, стеблях и стручках [16].
Влияние наноколлоида ZnO, наночастиц ZnO и микрометрических частиц ZnO на рост кукурузы было оценено [17]. Концентрация 2 ppm каждого типа частиц ZnO вносилась через поливную воду. Результаты показывают, что все три формы ZnO увеличивали сухую массу побега и индекс листовой поверхности. Наиболее значительные улучшения наблюдались при обработке наночастицами ZnO, которые увеличивали сухую массу побега и индекс листовой поверхности в среднем на 63,8% и 69,7% соответственно. Эти результаты свидетельствуют, что наночастицы цинка имеют потенциал для улучшения роста и урожайности кукурузы, особенно на почвах с низкой доступностью минералов.
Эти исследования помогают нам понять, как Zn может перемещаться в растении через поглощение листьями, а уровни радиации позволили оценить, какая часть Zn в результате обработок распределяется в тканях. Однако мы обнаружили пробел в знаниях относительно способности сои поглощать и транспортировать Zn при внекорневом опрыскивании. Учитывая прибавку урожая, о которой сообщают фермеры, мы предполагаем, что поглощение Zn из ZnO может происходить через листья, но это несколько противоречит низкой концентрации растворенного Zn в суспензии. Следовательно, настоящее исследование ставило две цели: во-первых, определить долю, транспортированную из листьев, опрысканных Zn, в другие необработанные ткани растения. Во-вторых, оценить, как дефицит Zn влияет на анатомию растения.
2. Материалы и методы
2.1. Экспериментальный план и внекорневое внесение
Эксперимент проводился в теплице, расположенной в Центре ядерной энергии в сельском хозяйстве, Пирасикаба-СП, Бразилия (22.70748 °ю.ш., 47.64531 °з.д.), с июля по октябрь 2022 года. Для дополнения естественного светового облучения мы использовали 800 мкмоль фотонов/м² от светодиодных ламп.
Семена сои сорта NS6700 IPRO проращивали в бумажных полотенцах, увлажненных раствором CaSO₄ 2 г·л⁻¹, в течение 7 дней для избежания заражения болезнями, а затем пересаживали в горшки объемом 3 л, содержащие питательный раствор. Раствор, чей химический состав приведен ниже, заменяли каждые 5 дней. Уровень воды в горшках пополняли каждые 2 дня. Состав раствора при 100% ионной силе был адаптацией [18], следующим: 1 М KNO₃; 1 М Ca(NO₃)₂·4H₂O; 1 М NH₄H₂PO₄; 1 М MgSO₄·7H₂O; 25 мМ KCl, 13 мкм H₃BO₃; 1 мкм MnSO₄·7H₂O; 1 мкм ZnSO₄·7H₂O; 0,25 мкм CuSO₄·5H₂O; 0,34 мкм (NH₄)₆Mo₇O₂₄; и 50 мкм NaFeЭДТА. Горшки постоянно аэрировались.
Растения, которые получали внекорневые обработки — раствор ZnSO₄·7H₂O или суспензию ZnO, — выращивались в растворе, содержащем 10% ионной силы, указанной выше. Дополнительно мы выращивали два контроля: (i) полный питательный раствор, в котором растения получали водное опрыскивание вместо обработок Zn, и (ii) питательный раствор с 10% рекомендации по Zn, в котором растения также получали водное опрыскивание вместо обработок Zn. Эксперимент проводился с пятью биологическими повторностями в полностью рандомизированном блочном дизайне (CRB), всего 40 горшков, половина из которых была убрана на стадиях V6–V8 (12 дней после 1-го внесения обработки), а другая половина — на стадии R5.3–R5.5 (60 дней после 2-го внесения обработки).
Внекорневые обработки формулированной суспензией ZnO и раствором ZnSO₄, обе меченные, проводились в два момента. Поверхности горшков были должным образом покрыты, чтобы избежать любого загрязнения меченым Zn. Половина растений получила однократное опрыскивание на стадии V4, а другая половина растений получила два опрыскивания на стадиях V4 и V6–V8; каждое растение получило 1,3 мл обработки, что привело к концентрации 0,65 мг Zn на растение. Обработки вносились на 3 старейших тройчатых листа, и мониторинг доли внесенного цинка, который был транспортирован в другие части растения, проводился на стадиях V6–V8 и R5.3–R5.5.
Первый сбор урожая проводился через 12 дней после первого внекорневого внесения, стадии V6–V8, и сборы делились на (i) обработанные листья, которые получали внекорневую обработку, и (ii) необработанные листья, которые не получали обработку, а также корни и стебли. После сбора образцы сушили в течение 72 ч при 65 °C и размалывали. На этом этапе половина эксперимента была завершена, осталось только 20 горшков, которые получили 2-е внекорневое внесение.
Второе внесение проводилось на новых листьях на стадии V6–V8, а отбор проб проводился на стадиях R5.3–R5.5.
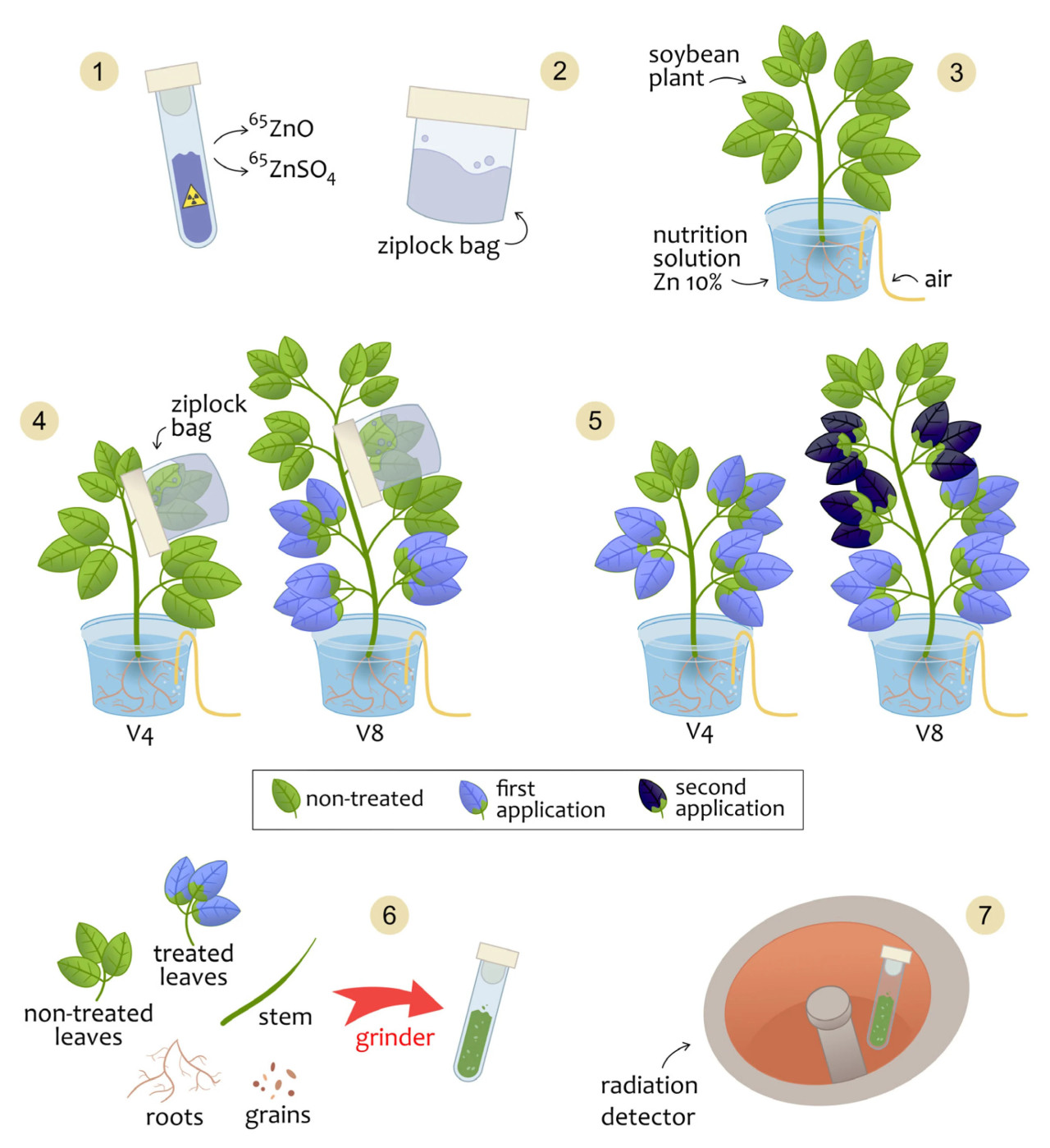
Для ясности экспериментальная процедура обобщена и проиллюстрирована на Рисунке 1.
Рисунок 1. Процесс внесения ⁶⁵Zn. На этом рисунке представлен весь процесс распыления ⁶⁵Zn на разных стадиях V и то, как собирали растения.
Размолотый растительный материал взвешивали и переносили в пластиковые флаконы. Определение ⁶⁵Zn проводили с помощью γ-спектрометрии с колодцевым детектором HPGe, Ortec (Уокингем, Великобритания) модель GWL22015. Все активности были скорректированы на распад, приняв 26 августа 2022 года в качестве контрольной даты.
2.2. Приготовление меченых источников
Меченые цинковые материалы были получены путем активации ZnO, поставляемого компанией Yara (Паулиния, Бразилия). Yara International ASA — ведущая глобальная сельскохозяйственная компания со штаб-квартирой в Осло, Норвегия. Тот же ZnO, который используется при производстве коммерческого продукта Zintrac, используется в этом контексте, и ZnSO₄·7H₂O при тепловом нейтронном потоке 8 × 10¹² см⁻²·с⁻¹ в течение 4 часов в исследовательском ядерном реакторе IEA-R1 Института ядерных и энергетических исследований (IPEN), поставлялся компанией Merck (Дармштадт, Германия). Были облучены две полиэтиленовые капсулы с 16 мг ZnO и две капсулы с 57 мг ZnSO₄, что дало индивидуальную активность 162 кБк и 164 кБк ⁶⁵Zn соответственно.
Порошок ⁶⁵ZnO смешивали с двумя жидкими фирменными поверхностно-активными веществами, поставляемыми компанией Yara. ⁶⁵ZnSO₄ растворяли в воде. Концентрация Zn в обеих обработках составляла 0,5 мг/мл.
2.3. Анализ плотности устьиц, трихом и анатомии стебля
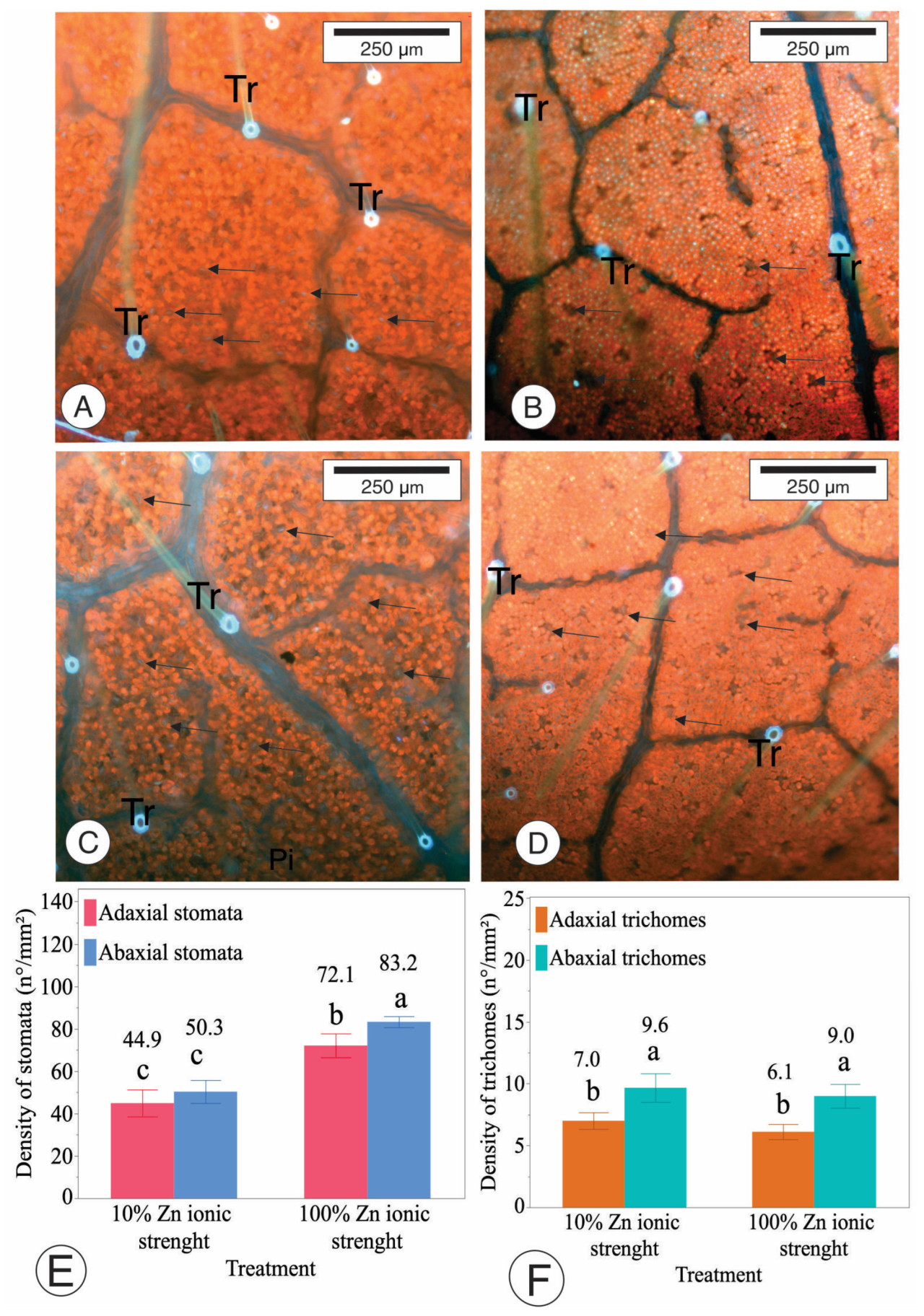
Для этого эксперимента растения выращивали, как описано выше. Двадцать горшков распределили в полностью рандомизированном блоке (CRD) с 10 повторностями и 2 обработками, в которых 10 горшков содержали сою, выращенную в питательном растворе с ионной силой Zn 100% (контроль), что составляет 100% рекомендации по Zn, а другие 10 горшков выращивали сою в растворе с ионной силой Zn 10% (обработка), что составляет 10% рекомендации по Zn. На фенологической стадии V4 собирали третьи зрелые тройчатые листья и анализировали под ультрафиолетовым световым микроскопом, как описано [19]. Плотность трихом и устьиц на абаксиальной и адаксиальной поверхностях подсчитывали с помощью программного обеспечения ImageJ 1.54g.
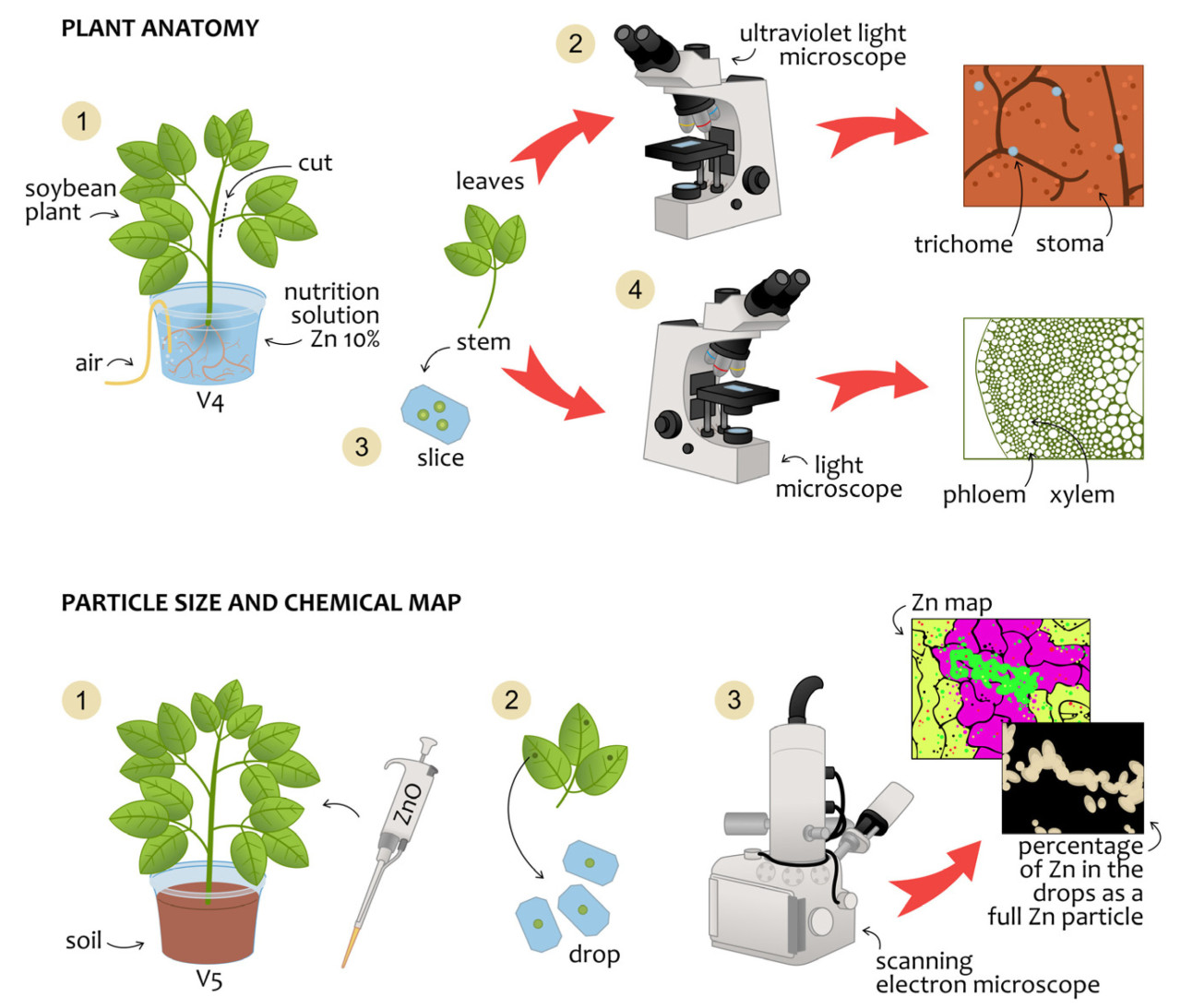
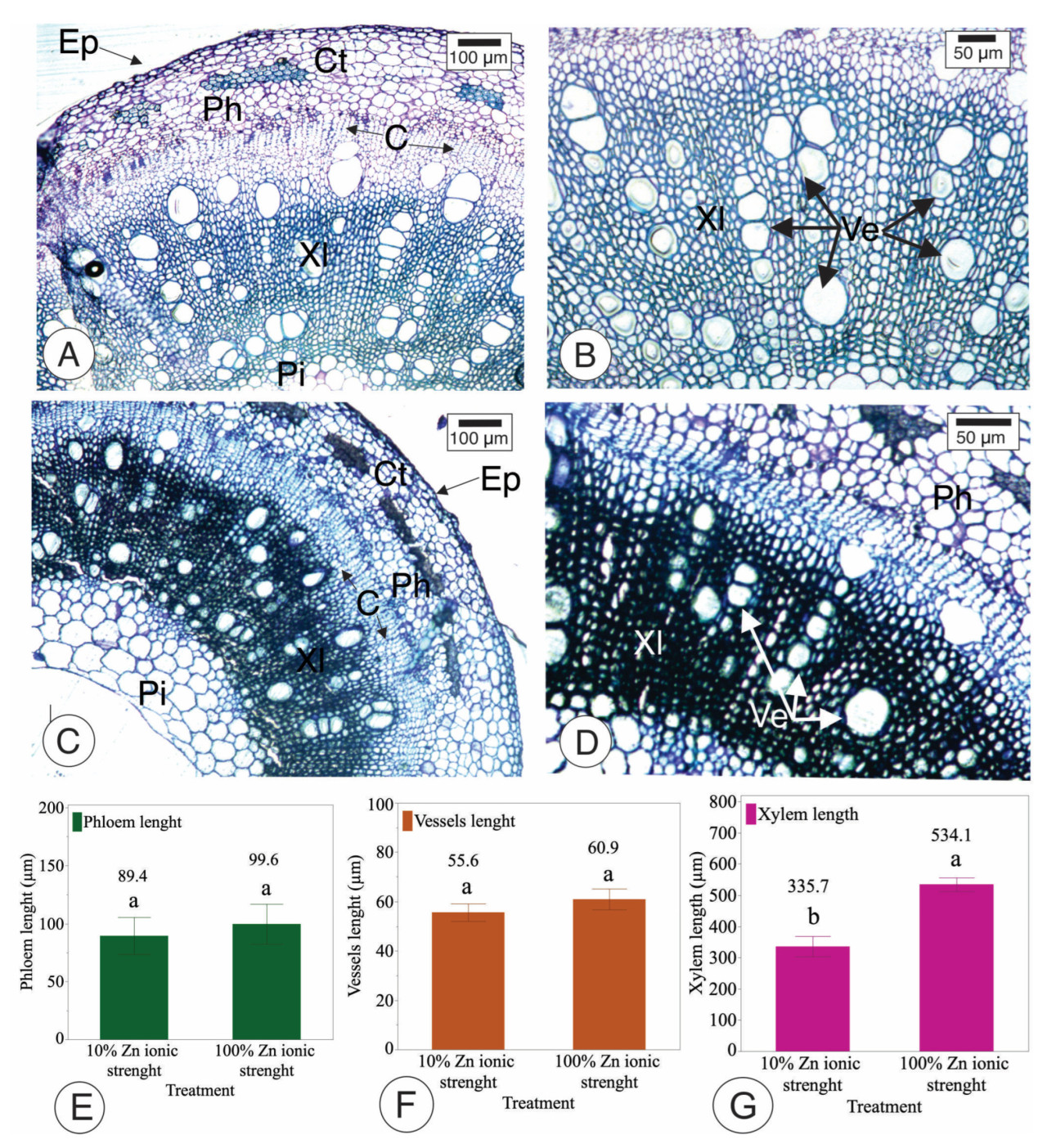
Сегменты стебля (5 см от корневой шейки) от тех же растений в упомянутом выше эксперименте собирали и обрабатывали для анатомического анализа, как описано [20]. Например, образец фиксировали в растворе Карновского и помещали в вакуумный насос для удаления воздуха, содержащегося в межклеточных пространствах; затем образцы обезвоживали в этаноле и заливали в гликоль метакрилат Technovit histories. Затем образцы нарезали на микротоме срезом толщиной 7 мкм для анализа под световым микроскопом. Срезы окрашивали толуидиновым синим и анализировали под световым микроскопом, как показано на Рисунке 2.
Рисунок 2. Этапы анатомического анализа и распределения частиц на поверхности листа. Анатомия растения представляет этапы анализа количества трихом и устьиц на абаксиальной и адаксиальной сторонах, а также размеров сосудов, ксилемы и флоэмы. Размер частиц и химическая карта представляют этапы измерения частиц ZnO и концентрации Zn в каплях.
2.4. Мониторинг размера частиц и химическое картирование
Для мониторинга формы и распределения частиц ZnO, осажденных на поверхности листа, готовили суспензию Zintrac-Yara™, чтобы получить суспензию, содержащую 245 мг/л. Двенадцать растений сои выращивали в теплице, которые получали однократную обработку: три капли по 1 мкл, нанесенные микропипеткой на адаксиальную поверхность листьев сои на фенологической стадии V5. Растения выращивали в условиях теплицы на супесчаной суглинистой почве, содержащей 0,4 мг Zn/кг почвы, экстрагированного с помощью ДТПА [21]. Амплитуда температуры и относительной влажности воздуха во время эксперимента составила максимум 37,5 °C и минимум 14,4 °C, а также максимум 89,2% и минимум 29% соответственно.
Четыре области листьев, содержащих высохшие капли удобрения, отбирали от разных растений, каждая представляла собой биологическую реплику; их собирали через 0,04 дня (1 ч), 1 день, 14 дней и 21 день. Никакой предварительной обработки (фиксации или обезвоживания) не проводили, чтобы избежать смыва Zn-удобрения с поверхности листа сои. Эти образцы листьев растений с высохшими каплями Zn помещали на алюминиевый держатель образцов, покрытый двусторонней углеродной лентой. На следующем этапе образцы сначала покрывали слоем углерода в вакууме с помощью испарителя Balzers MED 010 (Technotrade International, Манчестер, Нью-Гэмпшир, США), а затем переносили в эксикатор для процесса обезвоживания. Затем их анализировали с помощью сканирующего электронного микроскопа JEOL IT 300 при напряжении 20 кВ. Кроме того, анализы SEM EDX выполнялись с детектором рентгеновского излучения Oxford с использованием программного обеспечения AzTech 3.0. Химические изображения EDX трех точек на каплю при увеличении 300× использовали как метод для выявления концентрации Zn в области капли, а изображения SEM использовали для определения размеров частиц ZnO, оставшихся на поверхности; для этого последнего шага оценивали не менее 500 частиц на образец. На Рисунке 2 обобщена и проиллюстрирована процедура.
2.5. Статистический анализ
Статистические анализы выполнялись с помощью программного обеспечения JMP SAS 16.1. Проводили дисперсионный анализ (ANOVA), и при p < 0,10 применяли тест средних LSD 10%. Выбор порогового значения p-value p < 0,1 был установлен до анализа на основе практических целей исследования и агрономического контекста, что гарантировало, что решение не было продиктовано полученными результатами, и позволяло соблюсти баланс между научной строгостью и практической применимостью. Хотя p < 0,05 является общепринятым стандартом, p < 0,1 был принят для уверенности, что значимые для агрономического управления эффекты не будут упущены из-за более ограничительного подхода.
3. Результаты
3.1. Меченые источники
Рисунок 3A показывает активность ⁶⁵Zn в частях растений на фенологических стадиях V6–V8, которые получили внекорневое опрыскивание на стадии V4. Он показывает, что через 12 дней 92,56% и 92,18% Zn, внесенного в виде ZnO и ZnSO₄ соответственно, оставались в листьях, получивших обработку. Также демонстрируется, что Zn как из ZnSO₄, так и из ZnO транспортировался в необработанные листья, которые развернулись после опрыскивания; аналогично, количество ⁶⁵Zn выше контроля было обнаружено в корнях и стеблях. Мы также заметили, что количество ⁶⁵Zn было выше в необработанных тканях растений, опрысканных ZnSO₄, чем в растениях, опрысканных ZnO.
Рисунок 3. (A) Активность ⁶⁵Zn в частях растений от сбора после первого сбора (обработка на V4 и сбор V6–V8). (B) Активность ⁶⁵Zn в частях растений от второго сбора (обработка на V6–V8 и сбор R5.3–R5.4). Contr− — растения, выращенные в растворе с 10% рекомендации по Zn и без листового внесения, и Contr+ — растения, выращенные в растворе с 100% рекомендации по Zn и без листового внесения. Столбцы указывают стандартную ошибку среднего. Коэффициент вариации представлен как CV%. Zn, нанесенный на листья растений, транспортировался в другие части растений. Значения в % представляют активность Zn в каждой части растения относительно общей активности во всех частях растения.
Рисунок 3B показывает активность ⁶⁵Zn для частей растений на стадии R5.3–R5.5; эти растения обрабатывались дважды на стадиях V4 и V6–V8. В течение 60 дней между второй обработкой и отбором тканей растения развили новые листья и зерна. Активность ⁶⁵Zn в необработанных листьях, зернах, корнях и стеблях показывает, что Zn из обоих источников поглощался и транспортировался внутри растения.
Таблица 1 показывает, что транспорт обоих источников составляет менее 2% от общего Zn, осажденного на листьях опрыскиванием в течение 12 дней. Более 92% Zn осталось в обработанных листьях. К сожалению, экспериментальный подход, примененный в настоящем исследовании, не позволил нам определить долю Zn, которая была поглощена, и сколько осталось прикрепленным к внешней части листа. Выбор экспериментального подхода был сделан для минимизации количества радиоактивных отходов, генерируемых экспериментом. Стоит отметить, что при первом сборе, через 12 дней после внесения, транспорт ZnO составлял лишь 41% от такового для ZnSO₄, а через 72 дня транспорт ZnO составлял 94% от такового для ZnSO₄.
Таблица 1. Данные γ-спектрометрии, показывающие долю общего внесенного ⁶⁵Zn, обнаруженную в каждой из собранных проб сои.
3.2. Влияние Zn на анатомию растения
Лист амфистоматический, с абаксиальной стороной, которая имеет большую плотность трихом и устьиц, чем адаксиальная сторона, на 32,2% и 13,6% соответственно, в растворе с 100% ионной силой Zn (Рисунок 4). Кроме того, абаксиальная сторона растений, выращенных в растворе с 10% ионной силой Zn, показала на 27% больше трихом и на 10,7% больше устьиц, чем адаксиальная сторона. Здесь мы представляем влияние Zn на формирование этих листовых структур. Поперечные срезы стебля указывают, что стебли сои с дефицитом Zn демонстрировали сниженную активность камбия и уменьшенную толщину вторичной ксилемы (Рисунок 5). Интересно, что различий во флоэме не наблюдалось. Также не было обнаружено статистических различий в диаметре элементов сосудов (Ve — стрелки показаны на Рисунке 5).
Рисунок 4. Анализ адаксиальной (A,C) и абаксиальной (B,D) поверхностей листа сои под УФ-светом и анализ с помощью эпифлуоресцентной микроскопии с Imagens. Можно наблюдать аутофлуоресценцию в замыкающих клетках — устьица (стрелки) и основание трихом (Tr). (E,F) Плотность устьиц и трихом на листьях сои. Средние значения, обозначенные одинаковыми буквами, статистически не отличаются друг от друга по тесту LSD (p < 0,10), и столбцы указывают стандартную ошибку среднего.
Рисунок 5. Поперечный срез стебля сои (A–D) контрольных (A,B) и опытных (C,D) растений и биометрические данные флоэмы, диаметра элементов сосудов и ксилемы (E–G). Стебли сои с рекомендованной дозой Zn имеют больше клеток вторичной ксилемы по сравнению с 10% Zn. Размер ксилемы и флоэмы в стеблях сои. Можно наблюдать аутофлуоресценцию в эпидермисе (Ep — стрелки), коре (Ct), флоэме (Ph), камбии (C — стрелки), элементах сосудов (Ve — стрелки), сердцевине (Pi) и ксилеме (Xl). Средние значения, обозначенные одинаковыми буквами, статистически не отличаются друг от друга по тесту LSD (p < 0,10), и столбцы указывают стандартную ошибку среднего.
Кроме того, растения, выращенные в условиях дефицита Zn, имели на 43% меньше абаксиальных устьиц и на 42,14% меньше адаксиальных устьиц, чем растения, выращенные со 100% рекомендуемых уровней Zn. Хотя исследования показали, что трихомы играют важную роль в поглощении питательных веществ, разницы в плотности трихом не наблюдалось, когда растения выращивались при низких уровнях Zn. В этом исследовании растения, подвергнутые дефициту Zn, имели сосуды ксилемы на 37% меньше и на 63% меньше устьиц, чем растения с достаточным Zn.
3.3. Форма, размер и концентрация ZnO на поверхности листа в зависимости от времени
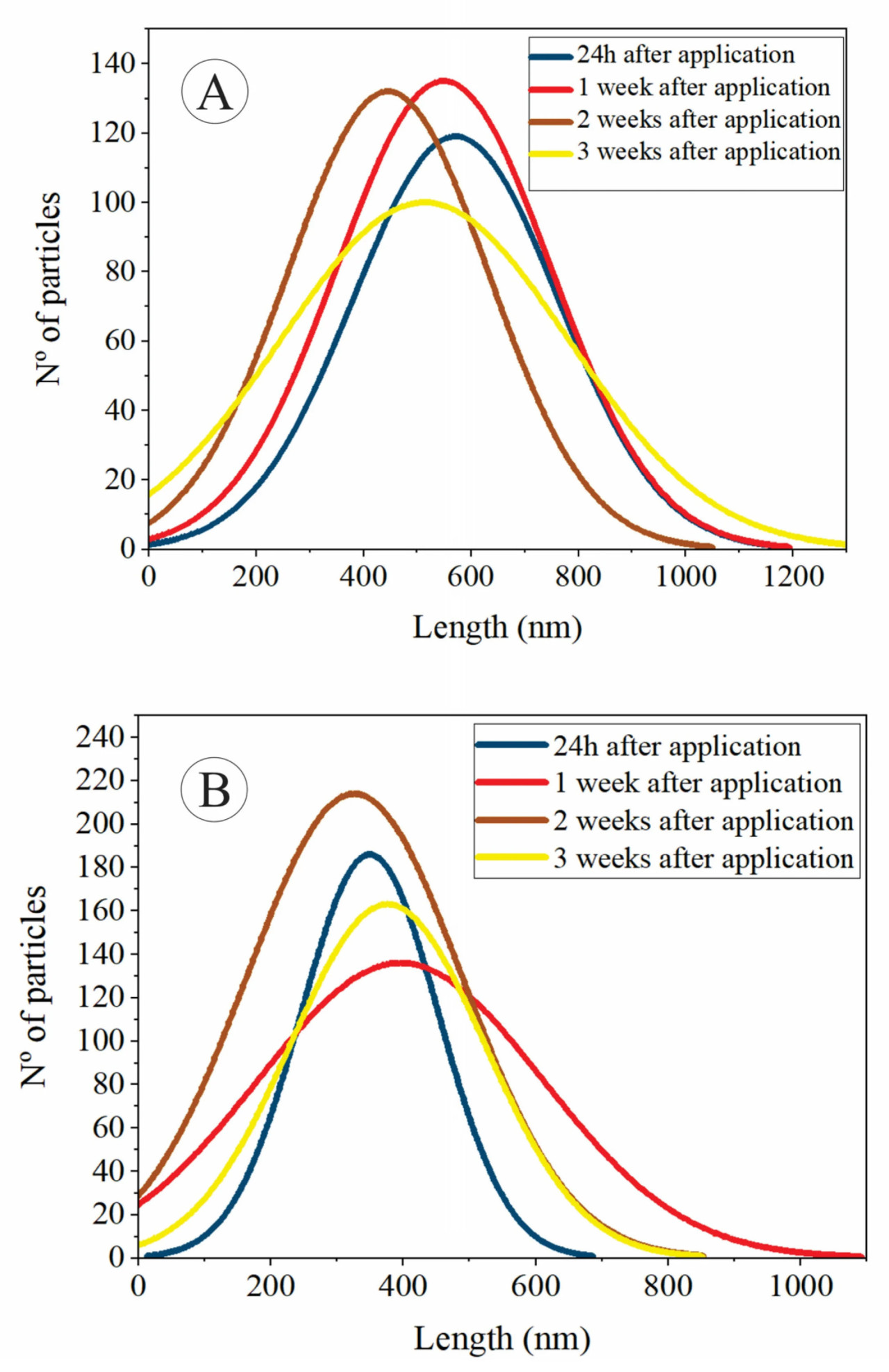
Рисунок 6 представляет распределение размеров частиц ZnO на поверхности листьев в зависимости от времени; Рисунок 6A показывает длину по большой оси, а Рисунок 6B показывает длину по малой оси частиц. Частицы, осажденные на поверхности листьев, имеют нормальное распределение; по мере течения времени мы наблюдаем, что стандартная ошибка изменяется, что показывает, что распределение размеров частиц меняется. Это подтверждает гипотезу о том, что частицы растворяются на поверхности листа, и ионный Zn поглощается. Тот факт, что средний размер частиц уменьшается, а затем увеличивается, может указывать на то, что частицы могут агломерироваться, как только они повторно суспендируются при образовании росы или водяных пленок на поверхности листа.
Рисунок 6. Гистограмма длины малой оси (A). Гистограмма длины большой оси наночастиц Zn. (B).
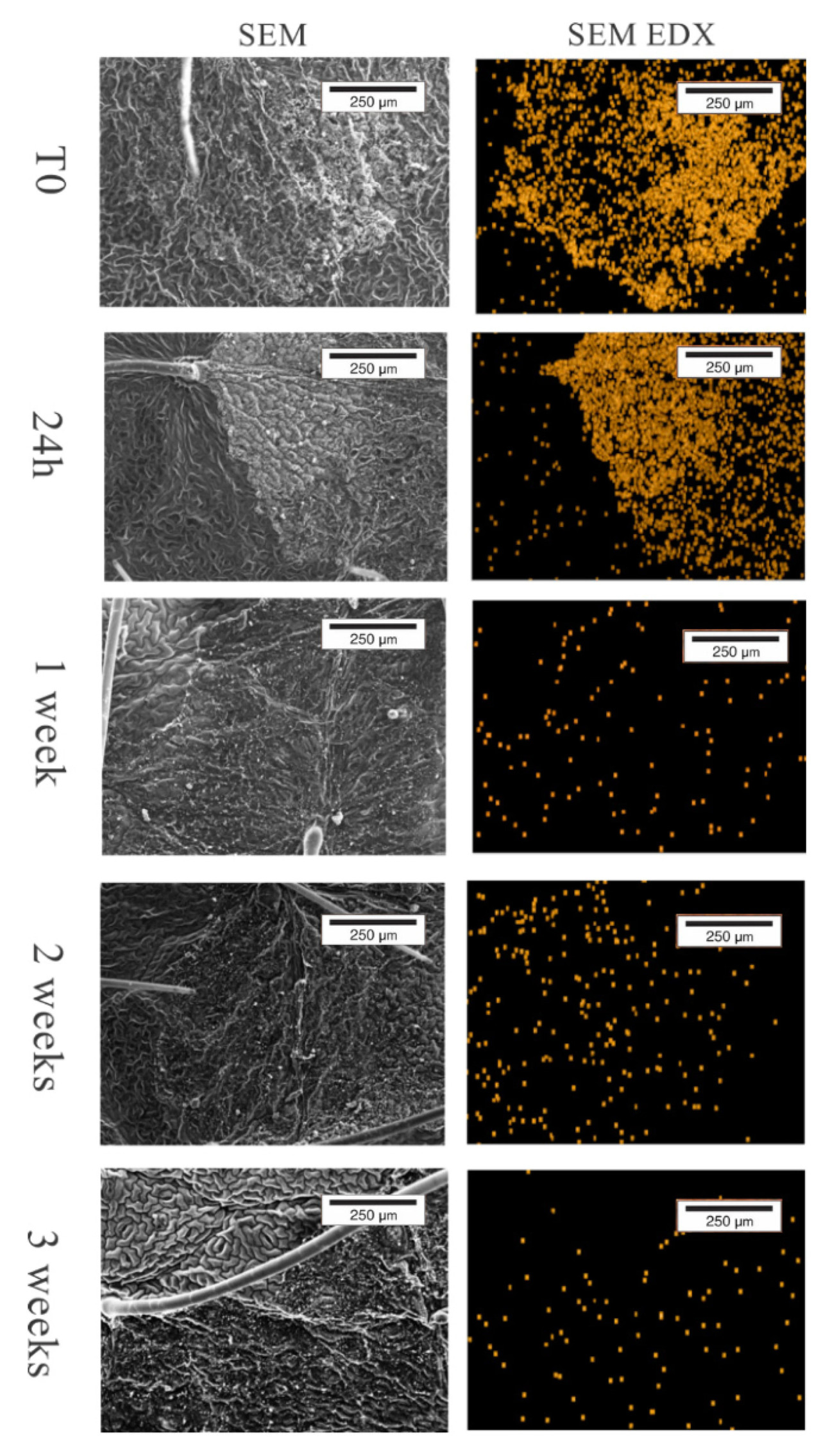
Рисунок 7 представляет пространственное распределение Zn в капле ZnO. Видно, что Zn исчезает с поверхности, поскольку листья не мыли; вывод состоит в том, что Zn поглощается. Путем интегрирования скорости счета рентгеновской флуоресценции Zn можно определить концентрацию Zn на поверхности листа.
Рисунок 7. Сканирующая электронная микроскопия адаксиальной поверхности листа сои, показывающая морфологию поверхности листа и пространственное распределение Zn на поверхности листа в зависимости от времени.
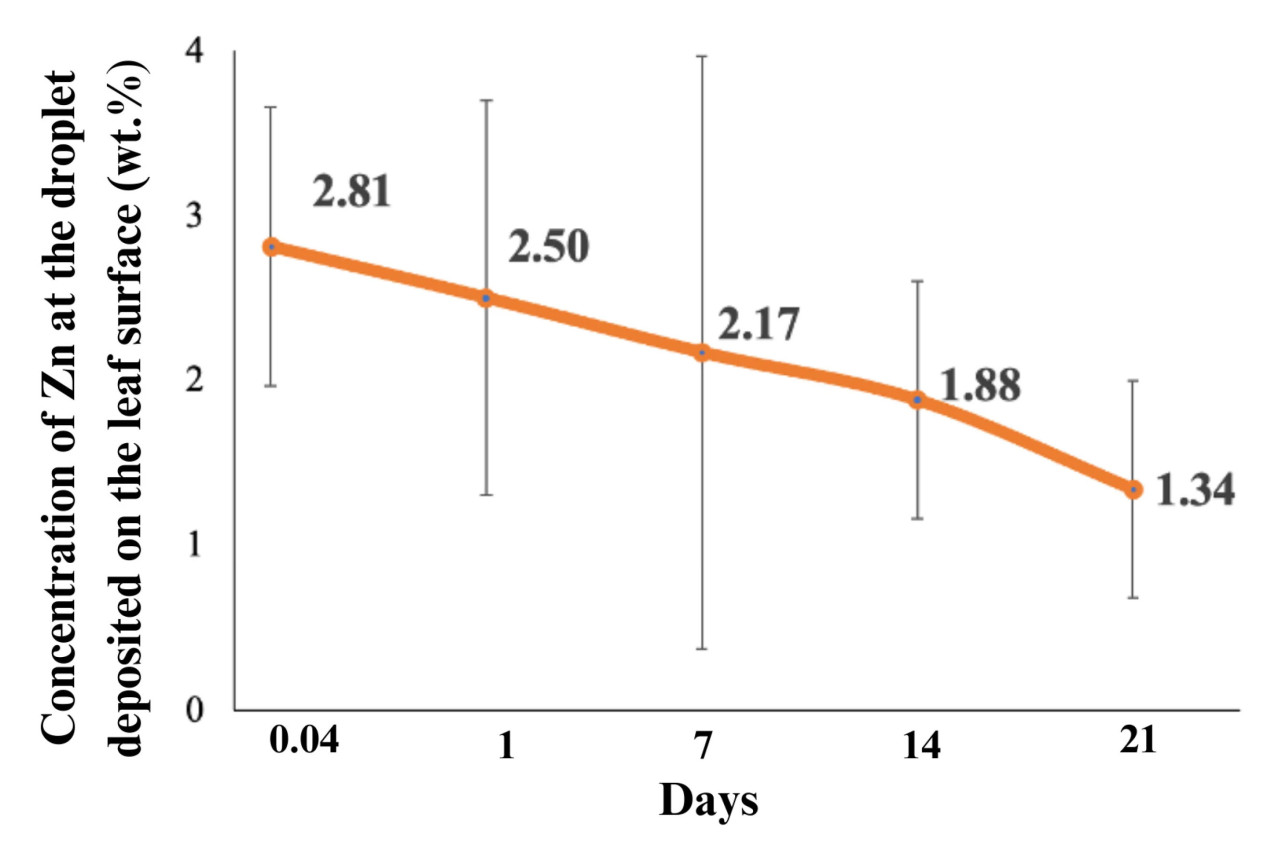
Рисунок 8 показывает концентрацию Zn в каплях на поверхности листьев в зависимости от времени. Глубина, исследуемая электронным зондом, составляла приблизительно 4 мкм, что гарантирует, что это количественное определение Zn представляет Zn, находящийся на поверхности листа, включая слой кутикулы толщиной около 1 ± 10 мкм. Концентрация Zn на проанализированных участках уменьшается в зависимости от времени; требуется 20 дней, чтобы концентрация снизилась до 50% от исходной.
Рисунок 8. Концентрация Zn в капле ZnO, нанесенной на поверхность листа, в зависимости от дней. Столбцы представляют стандартное отклонение.
4. Обсуждение
Как и настоящее исследование, предыдущие работы изучали внекорневое поглощение и транспорт ZnSO₄ и ZnO соей через неделю после опрыскивания и обнаружили, что за короткий промежуток времени поглощение Zn из ZnSO₄ происходит быстрее, чем из ZnO [22]. Аналогично, у листьев пшеницы внекорневое внесение Zn как из ZnSO₄, так и из ZnЭДТА перемещалось менее чем на 25 мм от места нанесения в течение 24 часов. Большая часть движения происходила между 3 и 12 часами после нанесения, с меньшим движением, наблюдаемым между 12 и 24 часами [23]. Однако настоящее исследование показывает, что в долгосрочной перспективе, т.е. в течение нескольких недель, внекорнево внесенные питательные вещества могут транспортироваться на гораздо более длинные расстояния.
У твердой и мягкой пшеницы листья, обработанные ⁶⁵ZnSO₄, показали более высокий транспорт у растений, выращенных в питательном растворе с дефицитом Zn. Приблизительно 40% от общего поглощенного ⁶⁵Zn было транспортировано из обработанного листа в корни и другие части побега в течение 8 дней. Напротив, у растений с достаточным Zn доля транспортированного ⁶⁵Zn составляла около 26% от общего поглощенного. После 6 дней роста в питательных растворах с обеспечением Zn кончики самых старых листьев погружали в раствор ⁶⁵Zn на 10 с. Раствор для нанесения содержал 0,1 мМ ⁶⁵ZnSO₄ (111 кБк ⁶⁵Zn). Растения собирали через 4 и 8 дней после нанесения. Обработанные кончики листьев срезали и промывали в течение примерно 10 минут в растворе 10 мМ ZnSO₄ для удаления любого ⁶⁵Zn, адсорбированного на поверхности листа и в апопластных пространствах листа [24].
Другое исследование со стабильным изотопом ⁶⁸Zn проводилось, чтобы показать, что зрелые листья фисташки и грецкого ореха поглотили 12% и 8% соответственно от общего внесенного цинка. Из этого удержанного цинка приблизительно 6,5% у фисташки и 3,5% у грецкого ореха поглощалось в листья и впоследствии транспортировалось за пределы обработанной области. Эти результаты свидетельствуют, что способность листьев поглощать и перераспределять Zn варьируется между видами сельскохозяйственных культур. Поглощение цинка измеряли с интервалами от 10 минут до 24 часов после нанесения [25].
Через 72 дня и принимая во внимание, что обработки не смывались дождем, можно считать, что поглощение составило 100% или близко к этому для обоих источников. В этом гипотетическом сценарии доля транспортированного цинка относительно поглощенного составила бы 7,8% для ZnSO₄ и 7,4% для ZnO; значения схожи, поскольку транспорт и ремобилизация связаны с химической формой Zn внутри растения, которая предположительно одинакова для обоих источников Zn. Однако мы должны учитывать, что скорость транспорта, безусловно, зависит от скорости поглощения, которая, в свою очередь, зависит от источника питательного вещества, концентрации распыла, адъювантов, относительной влажности воздуха, а также точек делюгесценции и эффлоресценции препаратов, которые также могут быть изменены адъювантами. Следовательно, использование независимых исследований, опубликованных в литературе, для проведения количественного сравнения скоростей транспорта от одного вида к другому может быть сложным, потому что экспериментальный дизайн не является единообразным. Некоторые статьи рассматривали эффекты дефицита питательных веществ на поглощение и метаболизм растений, подчеркивая, что в условиях дефицита растения могут проявлять адаптивные механизмы, которые приводят к снижению поглощения питательных веществ. Это происходит как реакция растения на сохранение энергии и ее распределение на жизненно важные процессы во время нехватки питательных веществ.
Аналогично, дефицит Zn привел к значительному снижению поглощения Zn из ZnSO₄ листьями подсолнечника, в диапазоне от 50% до 66%, по сравнению с растениями, обеспеченными цинком [26]. То же исследование показало, что основными факторами, способствующими снижению поглощения Zn в условиях дефицита цинка, были уменьшение плотности листовых трихом и потенциальные изменения в составе и структуре адаксиальной поверхности листа по сравнению с теми, которые мы могли изучить в этом эксперименте. Когда растения выращивались при 10% снижении Zn, количество трихом и устьиц уменьшалось, что объясняет, почему поглощение меченых источников было низким. Таким образом, в настоящем исследовании относительно низкий транспорт Zn, показанный в Таблице 1, также мог способствовать низкому содержанию Zn в питательном растворе, который содержал только 10% обычной ионной силы Zn.
У Bromeliaceae только отрицательный контроль (без Zn и без Se) давал более низкую плотность устьиц [27]. Эксперимент проводился in vitro в течение 75 дней при концентрациях Zn (0, 30 и 300 мкМ) в сочетании с двумя концентрациями Se (0 и 4 мкМ). За 21 день до сбора растения обрабатывали питательным раствором Хогланда [28]. Эти результаты наблюдались в исследовании на культуре сафлора, который выращивали в питательном растворе, содержащем 0, 10 и 20 мг·дм⁻³ Zn (ZnSO₄) в течение трех недель. Растения, получавшие 20 мг·дм⁻³ Zn, демонстрировали большее количество сосудов ксилемы с большими диаметрами по сравнению с теми, которые обрабатывались более низкими концентрациями Zn [29].
Состав кутикулы в базальных клетках нежелезистых трихом у подсолнечника отличается от такового у обычных эпидермальных клеток листа, что может облегчать поглощение Zn [30]. Как базальные клетки, так и трихомы имеют богатые пектином, гидрофильные клеточные стенки, которые могут улучшать поглощение питательных веществ [31]. Различия в устьичном поглощении питательных веществ могут зависеть от внешних факторов, влияющих на смачиваемость замыкающих клеток, потенциально активируя устьица для транспорта растворенных веществ [32]. Например, частицы фосфита цинка могут агломерироваться в устьицах и высвобождать ионы во влажных условиях, тем самым увеличивая поглощение Zn через этот путь [33], что также отмечалось у риса, обработанного наночастицами ZnO [34]. Кислотные обработки Zn уменьшают фиксацию катионов на листовых кутикулах, способствуя проникновению Zn [6]. Более того, Zn в основном обнаруживался в стенках клеток ксилемы и паренхимы обработанных растений, но не в контролях, что потенциально объясняет различия в размере ксилемы между контролем и обработкой 10% Zn [35].
5. Выводы
Настоящее исследование приходит к выводу, что оба источника, ZnO и ZnSO₄, могут снабжать растения сои цинком при внекорневом внесении. Меченый Zn, нанесенный на листья, был обнаружен в корнях, стеблях, новых листьях и даже в зернах.
Хотя не удалось определить скорости поглощения, скорость транспорта Zn из ZnSO₄ была выше, чем из ZnO при первом сборе, через 12 дней после опрыскивания. Основываясь на ранее опубликованных результатах и параллельном продолжающемся исследовании нашей группы, мы полагаем, что это объясняется более высокой скоростью поглощения Zn из ZnSO₄ по сравнению с ZnO. Однако после более длительного периода, а именно через 72 дня после первого опрыскивания, скорости транспорта как ZnO, так и ZnSO₄ были схожими. Это происходит потому, что в течение такого длительного периода время не является лимитирующим фактором для поглощения ZnO. Мы также можем заключить, что ZnO действует как источник Zn с медленным высвобождением; для поглощения 50% Zn листьями сои требуется около 20 дней.
Доля Zn, транспортированного в части растения, которые не получали опрыскивание, составляла менее 2% от общего Zn, внесенного на растения через 12 дней. Это подчеркивает важность дробного внесения, поскольку большая часть Zn останется в обработанных органах. Через 72 дня доля транспортированного Zn составила 8,03% для ZnO и 8,48% для ZnSO₄ относительно общего Zn, осажденного на листьях растений.
Дефицит цинка существенно влияет на количество устьиц и размер ксилемы, что свидетельствует о роли Zn в модуляции развития или расширении ксилемы, но не оказывает значительного влияния на трихомы.
Кроме того, результаты химического картирования демонстрируют, что когда капли ZnO наносились на листья, наблюдалось заметное уменьшение размера капель. Этот результат подтверждает, что листья могут поглощать удобрение ZnO, вызывая уменьшение размера капель по мере поглощения питательных веществ растением.
Ссылки
1. Zekri, M.; Koo, R.C. Application of micronutrients to citrus trees through microirrigation systems. J. Plant Nutr. 1992, 15, 251. [Google Scholar] [CrossRef]
2. Cornell, R.M.; Schwertmann, U. The Iron Oxides: Structure, Properties, Reactions, Occurrences, and Uses; Wiley-VCH: Hoboken, NJ, USA, 2003; p. 664. [Google Scholar]
3. Cakmak, I. Enrichment of cereal grains with zinc: Agronomic or genetic biofortification? Plant Soil 2008, 302, 1–17. [Google Scholar] [CrossRef]
4. Qin, D.; Tominaga, R.; Saneoka, H. Uptake and Use Efficiency of Major Plant Nutrients for Climate-Resilient Agriculture. Clim. -Resilient Agric. Agro-Biotechnol. Adv. Crop Prod. 2023, 2, 35–50. [Google Scholar] [CrossRef]
5. Sharma, P.N.; Tripathi, A.; Bisht, S.S. Bisht, Zinc Requirement for Stomatal Opening in Cauliflower. Plant Physiol. 1995, 107, 751–756. [Google Scholar] [CrossRef]
6. Fernández, V.; Brown, P.H. From plant surface to plant metabolism: The uncertain fate of foliar-applied nutrients. Front. Plant Sci. 2013, 4, 289. [Google Scholar] [CrossRef]
7. Tsonev, T.; Cebola Lidon, F.J. Zinc in plants-an overview. Emir. J. Food Agric. EJFA 2012, 24, 322–333. [Google Scholar]
8. Stanton, C.; Sanders, D.; Krämer, U.; Podar, D. Zinc in plants: Integrating homeostasis and biofortification. Mol. Plant 2022, 15, 65–85. [Google Scholar] [CrossRef]
9. Mao, J.L.; Miao, Z.Q.; Wang, Z.; Yu, L.H.; Cai, X.T.; Xiang, C.B. Arabidopsis ERF1 mediates cross-talk between ethylene and auxin biosynthesis during primary root elongation by regulating ASA1 expression. PLoS Genet. 2016, 12, e1005760. [Google Scholar] [CrossRef]
10. Qin, H.; Zhang, Z.; Wang, J.; Chen, X.; Wei, P.; Huang, R. The activation of OsEIL1 on YUC8 transcription and auxin biosynthesis is required for ethylene-inhibited root elongation in rice early seedling development. PLoS Genet. 2017, 13, e1006955. [Google Scholar] [CrossRef]
11. Malavolta, E. Manual de Nutrição Mineral de Plantas; de Queiroz, L., Ed.; University of São Paulo: São Paulo, SP, Brazil, 2006. [Google Scholar]
12. Marschner, H. Marschner’s Mineral Nutrition of Higher Plants; Academic Press: Cambridge, MA, USA, 2012. [Google Scholar] [CrossRef]
13. Read, T.L.; Doolette, C.L.; Howell, N.R.; Kopittke, P.M.; Cresswell, T.; Lombi, E. Zinc accumulates in the nodes of wheat following the foliar application of 65Zn oxide nano-and microparticles. Environ. Sci. Technol. 2021, 55, 13523–13531. [Google Scholar] [CrossRef]
14. Erenoglu, B.; Cakmak, I.; Römheld, V.; Derici, R.; Rengel, Z. Uptake of zinc by rye, bread wheat, and durum wheat cultivars differing in zinc efficiency. Plant Soil 1999, 209, 245–252. [Google Scholar] [CrossRef]
15. Haslett, B.S.; Reid, R.J.; Rengel, Z. Zinc mobility in wheat: Uptake and distribution of zinc applied to leaves or roots. Ann. Bot. 2001, 87, 379–386. [Google Scholar] [CrossRef]
16. Bautista-Diaz, J.; Cruz-Alvarez, O.; Hernández-Rodríguez, O.A.; Sánchez-Chávez, E.; Jacobo-Cuellar, J.L.; Preciado-Rangel, P.; Avila-Quezada, G.D.; Ojeda-Barrios, D.L. Zinc sulphate or zinc nanoparticle applications to leaves of green beans. Folia Hortic. 2021, 33, 365–375. [Google Scholar] [CrossRef]
17. Taheri, M.; Qarache, H.A.; Qarache, A.A.; Yoosefi, M. The Effects of Zinc-Oxide Nanoparticles on Growth Parameters of Corn (SC704). STEM Fellowsh. J. 2015, 1, 17–20. [Google Scholar] [CrossRef]
18. Marshner, H.; Cakmak, I. High light intensity enhances chlorosis and necrosis in leaves of zinc, potassium, and magnesium deficient bean (Phaseolus vulgaris) plants. J. Plant Physiol. 1989, 134, 308–315. [Google Scholar] [CrossRef]
19. Montanha, G.S.; Marques, J.P.R.; Santos, E.; Jones, M.W.M.; de Carvalho, H.W.P. Physiological responses of plants to in vivo X-ray damage from X-ray fluorescence measurements: Insights from anatomical, elemental, histochemical, and ultrastructural analyses. Metallomics 2023, 15, mfad034. [Google Scholar] [CrossRef]
20. Rodrigues Marques, J.P.; Kasue Misaki Soares, M. Handbook of Techniques in Plant Histopathology; Springer International Publishing: Cham, Switzerland, 2022. [Google Scholar] [CrossRef]
21. Lindsay, W.L.; Norvell, W.A. Development of a DTPA soil test for zinc, iron, manganese, and copper. Soil Sci. Soc. Am. J. 1978, 42, 421–427. [Google Scholar] [CrossRef]
22. Gomes, M.H.; Machado, B.A.; Rodrigues, E.S.; Montanha, G.S.; Rossi, M.L.; Otto, R.P.; Carvalho, H.W. In vivo evaluation of Zn foliar uptake and transport in soybean using X-ray absorption and fluorescence spectroscopy. J. Agric. Food Chem. 2019, 67, 12172–12181. [Google Scholar] [CrossRef]
23. Doolette, C.L.; Read, T.L.; Li, C.; Scheckel, K.G.; Donner, E.; Kopittke, P.M.; Lombi, E. Foliar application of zinc sulfate and zinc EDTA to wheat leaves: Differences in mobility, distribution, and speciation. J. Exp. Bot. 2018, 69, 4469–4481. [Google Scholar] [CrossRef]
24. Erenoglu, B.; Nikolic, M.; Römheld, V.; Cakmak, I. Uptake and transport of foliar-applied zinc (65-Zn) in bread and durum wheat cultivars differing in zinc efficiency. Plant Soil 2002, 241, 251–257. [Google Scholar] [CrossRef]
25. Zhang, Q.; Brown, P.H. The mechanism of foliar zinc absorption in pistachio and walnut. J. Am. Soc. Hortic. Sci. 1999, 124, 312–317. [Google Scholar] [CrossRef]
26. Li, C.; Wang, P.; van der Ent, A.; Cheng, M.; Jiang, H.; Read, T.L.; Lombi, E.; Tang, C.; de Jonge, M.D.; Menzies, N.W.; et al. Absorption of foliar-applied Zn in sunflower (Helianthus annuus): Importance of the cuticle, stomata and trichomes. Ann. Bot. 2019, 123, 57–68. [Google Scholar] [CrossRef] [PubMed]
27. Martins, J.P.R.; Souza, A.F.C.; Rodrigues, L.C.A.; Braga, P.C.S.; Gontijo, A.B.P.L.; Falqueto, A.R. Zinc and selenium as modulating factors of the anatomy and physiology of Billbergia zebrina (Bromeliaceae) during in vitro culture. Photosynthetica 2020, 58, 1068–1077. [Google Scholar] [CrossRef]
28. Shi, G.R.; Cai, Q.S. Photosynthetic and anatomic responses of peanut leaves to zinc stress. Biol. Plant. 2009, 53, 391–394. [Google Scholar] [CrossRef]
29. Gadallah, M.A.A.; Ramadan, T. Effects of zinc and salinity on growth and anatomical structure of Carthamus tinctorius L. Biol. Plant. 1997, 39, 411–418. [Google Scholar] [CrossRef]
30. Li, C.; Wang, P.; Lombi, E.; Wu, J.; Blamey, F.P.C.; Fernández, V.; Howard, D.L.; Menzies, N.W.; Kopittke, P.M. Absorption of foliar applied Zn is decreased in Zn deficient sunflower (Helianthus annuus) due to changes in leaf properties. Plant Soil 2018, 433, 309–322. [Google Scholar] [CrossRef]
31. Otto, R.; Marques, J.P.R.; Pereira de Carvalho, H.W. Strategies for probing absorption and translocation of foliar-applied nutrients. J. Exp. Bot. 2021, 72, 4600–4603. [Google Scholar] [CrossRef]
32. Fernández, V.; Gil-Pelegrín, E.; Eichert, T. Foliar water and solute absorption: An update. Plant J. 2021, 105, 870–883. [Google Scholar] [CrossRef]
33. Gomes, M.H.F.; de Almeida Machado, B.; Marques, J.P.R.; Otto, R.; Eichert, T.; de Carvalho, H.W.P. Foliar Application of Zn Phosphite and Zn EDTA in Soybean (Glycine max (L.) Merrill): In Vivo Investigations of Transport, Chemical Speciation, and Leaf Surface Changes. J. Soil Sci. Plant Nutr. 2020, 20, 2731–2739. [Google Scholar] [CrossRef]
34. Bala, R.; Kalia, A.; Dhaliwal, S.S. Evaluation of Efficacy of ZnO Nanoparticles as Remedial Zinc Nanofertilizer for Rice. J. Soil Sci. Plant Nutr. 2019, 19, 379–389. [Google Scholar] [CrossRef]
35. Todeschini, V.; Lingua, G.; D’agostino, G.; Carniato, F.; Roccotiello, E.; Berta, G. Effects of high zinc concentration on poplar leaves: A morphological and biochemical study. Environ. Exp. Bot. 2011, 71, 50–56. [Google Scholar] [CrossRef]
Beltrame A, Rodrigues Marques JP, Ayres Rodrigues M, de Almeida E, Arruda Bacchi M, De Nadai Fernandes EA, Otto R, Pereira de Carvalho HW. Foliar Application and Translocation of Radiolabeled Zinc Oxide Suspension vs. Zinc Sulfate Solution by Soybean Plants. Agriculture. 2025; 15(2):197. https://doi.org/10.3390/agriculture15020197
Фото: freepik
Перевод статьи «Foliar Application and Translocation of Radiolabeled Zinc Oxide Suspension vs. Zinc Sulfate Solution by Soybean Plants» авторов Beltrame A, Rodrigues Marques JP, Ayres Rodrigues M, de Almeida E, Arruda Bacchi M, De Nadai Fernandes EA, Otto R, Pereira de Carvalho HW., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык






























































































Комментарии (0)