Урожай выше, вирус слабее: индийские ученые разработали уникальную подкормку для папайи
Папайя (Carica papaya L.) — высокопитательная плодовая культура, выращиваемая в промышленных масштабах в тропических и субтропических регионах мира. Будучи культурой с поверхностной корневой системой, она требует частого внесения питательных веществ. Папайя отличается высокой рентабельностью благодаря своей продуктивности и положительно реагирует на подкормки. Вирус кольцевой пятнистости папайи (PRSV) является основной угрозой для производства папайи, вызывая значительные потери урожая и снижая качество плодов.
Аннотация
Для борьбы с PRSV и повышения продуктивности был разработан специальный питательный комплекс, сочетающий органические и минеральные источники питательных веществ с агентами биоконтроля для улучшения здоровья и жизнеспособности растений. С января 2021 по декабрь 2023 года в Тамилнадском аграрном университете (Коимбатур, Тамилнад, Индия) были проведены эксперименты для стандартизации сроков применения и оценки эффективности данного питательного состава в повышении урожайности и борьбе с заболеваемостью PRSV.
Результаты показали, что листовое внесение питательной формуляции с месячными интервалами с 3-го по 7-й месяц после посадки (MAP) на фоне регулярного внесения рекомендуемой дозы удобрений (RDF) с двухмесячными интервалами, начиная с 3-го MAP, достоверно увеличило урожайность (на 37.79% у сорта TNAU Papaya CO 8 и на 30.57% у сорта Red Lady) и снизило заболеваемость PRSV (на 22.49% у TNAU Papaya CO 8 и на 16.53% у Red Lady).
Метаболомическое исследование показало, что листовая обработка питательной формуляцией повысила уровень активаторов и предшественников защитных ферментов, а именно: пероксидазы (PO), полифенолоксидазы (PPO), фенилаланин-аммиак-лиазы (PAL), каталазы (CAT) и нитратредуктазы (NRase) у обработанных растений по сравнению с необработанным контролем. Таким образом, обработанные растения проявили толерантность к заболеванию PRSV благодаря поддержанию жизненной силы и индуцированного системного сопротивления, обеспеченного действием защитных ферментов.
1. Введение
С годами обеспечение питательной безопасности стало актуальной проблемой в связи с ростом мирового населения. Хотя продовольственная безопасность была успешно обеспечена, акцент сместился на поддержание здорового образа жизни за счет ежедневного потребления фруктов и овощей. Папайя (Carica papaya L.) — это богатая питательными веществами плодовая культура, широко культивируемая в тропических и субтропических регионах мира. Этот монотипический вид рода Carica является единственным экономически важным представителем семейства Caricaceae, происходящего из тропической Америки. Общее мировое производство папайи в 2022 году составило 13,82 миллиона метрических тонн [1], а основными странами-производителями являются Индия, Доминиканская Республика, Бразилия, Мексика и Индонезия. Эта культура была завезена в Индию в XVI веке. Индия лидирует по производству папайи : 52,40 лакха метрических тонн плодов производятся с 1,48 лакха гектаров при продуктивности 35,35 метрических тонн с гектара [2]. Папайя, также известная как «чудо-фрукт тропиков», является богатым источником витамина А (2020 МЕ/100 г), витамина С, фолата, рибофлавина, кальция и клетчатки. Спелые плоды используются в качестве десерта и перерабатываются в различные продукты с добавленной стоимостью, включая цукаты, нектар, вино, тути-фрути и сироп. Латекс, полученный из незрелых плодов, содержит протеолитический фермент «папаин», который в основном используется для размягчения мяса, производства жевательной резинки, обезжиривания натурального шелка, а также в фармацевтической, пивоваренной, молочной, фотографической, текстильной, оптической, дубильной и кожевенной промышленности.
Возделывание папайи является высокорентабельным благодаря ее высокой продуктивности. Эта культура характеризуется непрерывным ростом; после начала цветения вегетативная и репродуктивная фазы происходят одновременно. Плоды можно собирать непрерывно с 8,5–9 месяцев после посадки. Папайя имеет высокую потребность в питательных веществах и положительно реагирует на их внесение. Корни папайи проникают в почву только на глубину до 45 см, и из-за поверхностной корневой системы растение не может поддерживать себя за счет поглощения питательных веществ из более глубоких слоев почвы. Следовательно, для получения высокого урожая с хорошим качеством плодов необходимо адекватное и частое внесение питательных веществ через регулярные промежутки времени на различных стадиях роста и развития культуры. Рекомендуемая доза удобрений (RDF) в качестве почвенного внесения составляет 50 г каждого из N, P₂O₅ и K₂O на растение с двухмесячными интервалами, начиная с 3-го месяца после посадки (MAP), а листовое внесение 0,5% сульфата цинка и 0,1% борной кислоты на 3-й, 5-й и 7-й MAP рекомендуется для культивирования папайи в Тамилнаде [3]. Дополнительно было отмечено, что листовое внесение 0,5% нитрата кальция и 0,5% сульфата калия вместе с микроэлементами и RDF также улучшает рост, урожайность и качество плодов папайи [4,5].
Папайя является полигамным видом, а культивируемые сорта проявляют двудомные и гинадвдомные формы пола. TNAU papaya CO 8 (двудомный) и Red Lady (гинадвдомный) — два важных коммерческих сорта папайи, широко возделываемые в различных регионах выращивания папайи в Индии благодаря их более высокому потенциальному урожаю. Выращивание папайи серьезно страдает от различных биотических и абиотических стрессов, и вирус кольцевой пятнистости папайи (PRSV) остается преобладающим. PRSV относится к семейству Potyviridae и передается тлями непостоянно. В передаче PRSV сообщалось о различных видах тлей, а именно: Aphis craccivora, Myzus persicae, Aphis gossypii, Aphis citricola и Rhopalosiphum maidis [6]. PRSV имеет два штамма, а именно: PRSV-P (штамм папайи), который заражает растения семейств Caricaceae и Cucurbitaceae, и PRSV-W (штамм арбуза), который поражает только тыквенные [7]. Зараженные PRSV растения проявляют различные симптомы, такие как мозаичная пятнистость и хлороз листьев, пропитанные водой маслянистые пятна или полосы на черешке и стволе дерева, деформация молодых листьев, а сильное заражение приводит к симптомам, напоминающим шнурки, и приводит к задержке роста растений. Плоды показывают маслянистые кольцевые пятна, а сильное заражение приводит к деформации плодов. Заражение может привести к потере урожая до 80–90% в зависимости от стадии культуры и серьезности вирусной инфекции [7]. Было отмечено, что гинадвдомные сорта папайи сравнительно более восприимчивы к PRSV, чем двудомные сорта [8].
В различных странах-производителях папайи для борьбы с заражением PRSV используются несколько научных подходов. К ним относятся селекционные подходы, такие как разработка сортов с механизмами толерантности или устойчивости с помощью различных методов селекции, иммунизация растений-хозяев и трансгенные подходы (ГМ-культуры). Также применяются агрономические подходы, такие как борьба с переносчиками, контроль альтернативных хозяев и применение микроэлементов. В настоящее время в Индии для возделывания нет коммерческих сортов папайи, устойчивых к PRSV. Однако несколько исследований предполагают , что применение микроэлементов может помочь бороться с вирусными инфекциями растений, косвенно улучшая иммунитет растений. Это достигается за счет повышенной экспрессии генов, связанных с патогенезом (PR), и усиления активности антиоксидантных ферментов [9]. Например, наночастицы Fe₃O₄ показали противовирусные свойства против вируса мозаики репы у Nicotiana benthamiana [10]. Дополнительно , почвенное и листовое применение ZnSO₄ обеспечило толерантность к вирусу мозаики кассавы (CMD) у кассавы [11]. Сообщалось также, что применение агентов биоконтроля, таких как Bacillus sp., индуцирует системную устойчивость против вируса мозаики у табака [12]. Следовательно, адекватное и правильное внесение питательных веществ вместе с борьбой с переносчиками поможет повысить жизнеспособность растения папайи, получить оптимальный урожай с плодами хорошего качества и бороться с PRSV без потери урожая. Таким образом, была выдвинута гипотеза, что комбинация органических и неорганических питательных веществ и агентов биоконтроля может улучшить жизнеспособность растений папайи для борьбы с PRSV, что приведет к более высокому урожаю и улучшенному качеству плодов. Учитывая эту предысторию, настоящее исследование было разработано для создания питательного состава, стандартизации времени применения, а также для проверки его эффективности в отношении роста, урожайности, качества, лежкости и толерантности к PRSV у папайи.
2. Материалы и методы
2.1. Приготовление питательного состава
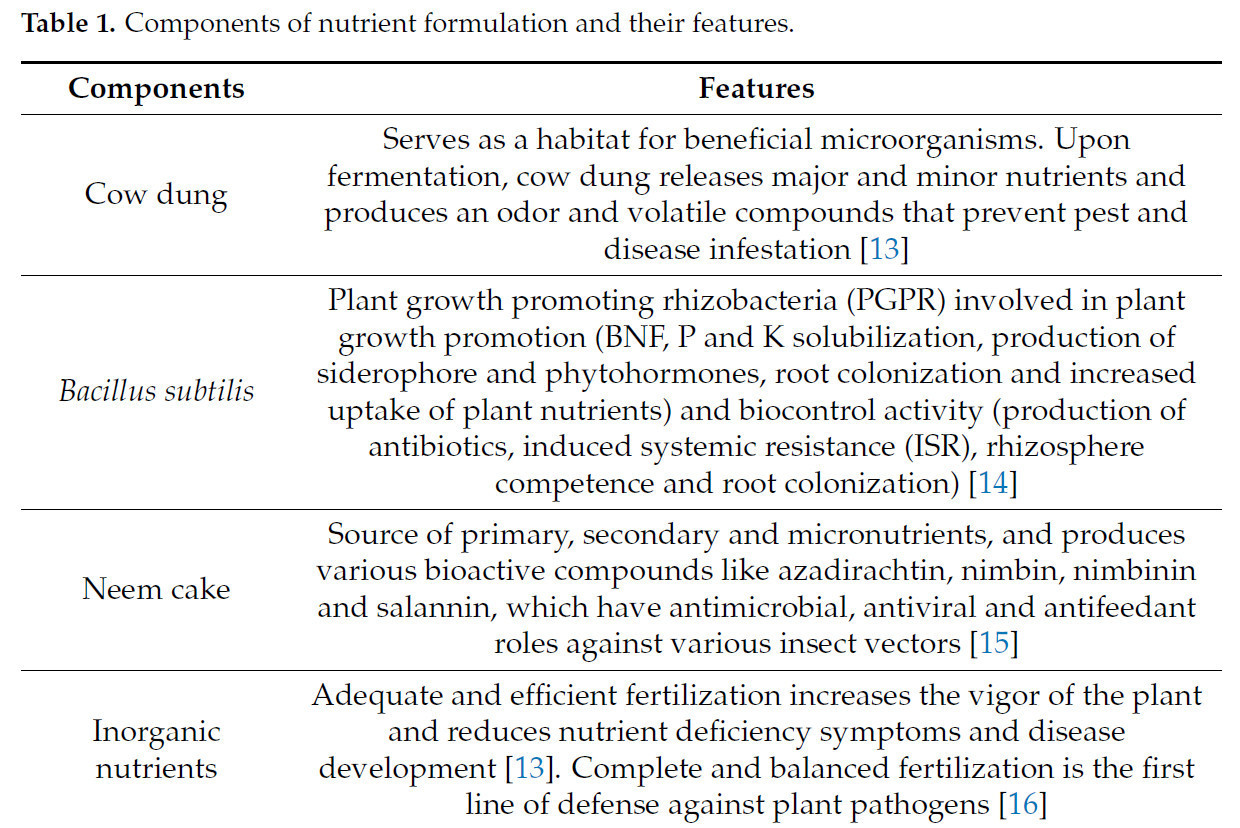
Используемые компоненты для приготовления питательного состава для папайи: свежий коровий навоз, Bacillus subtilis, нимовый жмых, сульфат калия, сульфат цинка, борная кислота, сульфат железа и нитрат кальция; их особые характеристики упомянуты в Таблице 1.
Таблица 1. Компоненты питательного состава и их характеристики.
Питательный состав был приготовлен путем добавления 40 кг свежего коровьего навоза в 100 л воды, перемешивания и фильтрации. К фильтрату добавили один килограмм Bacillus subtilis и один килограмм нимового жмыха. Затем раствор залили в герметичный контейнер и оставили для брожения (10 дней) с периодическим перемешиванием через день. Через 10 дней фильтрат собрали и обогатили 2,0 кг питательной смеси, состоящей из 0,5% сульфата калия, 0,25% нитрата кальция, 0,125% сульфата цинка, 0,25% сульфата железа и 0,15% борной кислоты. Затем конечный объем довели до 200 л и использовали для опрыскивания одного акра посевов папайи в тот же день.
2.2. Стандартизация времени листового опрыскивания питательным составом для роста, урожайности, качества и борьбы с PRSV у папайи
Настоящее исследование состояло из двух полевых экспериментов, проведенных в период 2021–2023 гг. Экспериментальные поля располагались в Колледжском саду, Садоводческом колледже и НИИ, Тамилнадский сельскохозяйственный университет, Коимбатур, на высоте 426,72 м над уровнем моря и между 11° с.ш. и 77° в.д., со средним количеством осадков 625 мм и тропическим климатом. Первый эксперимент был проведен в период с января 2021 г. по июнь 2022 г. для стандартизации времени применения и оценки влияния питательного состава на рост, урожайность, качество и заболеваемость PRSV папайи. Экспериментальный участок состоял из суглинистой почвы (pH 7,74 и EC 0,67 дСм·м⁻¹) с содержанием доступного азота, фосфора и калия 217 кг·га⁻¹, 11 кг·га⁻¹ и 685 кг·га⁻¹ соответственно. Эксперимент включал четыре обработки, а именно: T1: RDF + Листовое опрыскивание питательным составом с двухмесячными интервалами (3-й, 5-й и 7-й MAP), T2: RDF + Листовое опрыскивание питательным составом с месячными интервалами (3-й, 4-й, 5-й, 6-й и 7-й MAP), T3: RDF + Листовое опрыскивание ZnSO₄ (0,5%) + Борная кислота (0,1%) + Ca(NO₃)₂ (0,5%) + K₂SO₄ (0,25%) с двухмесячными интервалами (3-й, 5-й и 7-й MAP) и T4: Контроль (только RDF) с пятью повторениями в рандомизированном полном блочном дизайне (RCBD). В качестве посадочного материала служила рассада TNAU Papaya CO 8, выращенная в питомнике с теневой сеткой. В возрасте сорока пяти дней здоровую и свободную от болезней рассаду пересадили с расстоянием 1,8 м × 1,8 м. Все междурядные операции, такие как орошение, прополка, управление питательными веществами и защита растений, проводились в соответствии с рекомендациями Руководства по производству культур, TNAU, 2020 [3].
2.3. Эффективность питательного состава на рост, урожайность, качество и толерантность к PRSV у коммерческих сортов папайи
Второй полевой эксперимент для проверки эффективности питательного состава на двух коммерческих сортах папайи также проводился в том же месте, но на другом поле с июля 2022 г. по декабрь 2023 г. Текстура почвы экспериментального поля — супесчаный суглинок с pH почвы и EC 8,21 и 0,14 дСм·м⁻¹ соответственно. Содержание доступного азота, фосфора и калия составляло 182 кг·га⁻¹, 33,2 кг·га⁻¹ и 735 кг·га⁻¹ соответственно. Эксперимент был заложен в разделенных делянках, состоящих из двух основных делянок, т.е. M1 — TNAU Papaya CO 8, M2 — Red Lady и двух подделянок, т.е. S1 — Листовое опрыскивание питательным составом с месячными интервалами (3-й, 4-й, 5-й, 6-й и 7-й MAP), S2 — Контроль (без опрыскивания), с 13 повторениями для проверки эффективности питательного состава на рост, урожайность, качество и толерантность к PRSV у коммерческих сортов папайи. Здоровую и свободную от болезней рассаду TNAU papaya CO 8 и Red Lady в возрасте сорока пяти дней пересадили с расстоянием 1,8 м × 1,8 м. Все другие междурядные операции проводились, как подробно описано в предыдущем эксперименте.
2.4. Наблюдения
В обоих экспериментах регистрировали наблюдения за параметрами роста растений (высота растения, обхват стебля и площадь листа), дни до первого цветения и первого сбора урожая, урожайность и компоненты урожая (количество плодов, вес плода, урожай плодов с растения, твердость плода, толщина мякоти), лежкость и качественные показатели (общее количество растворимых сухих веществ, титруемая кислотность, общие сахара, аскорбиновая кислота, β-каротин и ликопин), выход папаина (выход сырого латекса, выход сухого латекса) и активность фермента папаина, а также заболеваемость PRSV.
2.4.1. Показатели роста
Высоту растения измеряли от уровня земли до верхушечной почки во время первого сбора урожая и выражали в сантиметрах. Обхват стебля измеряли на стволе во время первого сбора урожая на высоте 15 см над уровнем земли и выражали в сантиметрах. Площадь листа рассчитывали с использованием метода прогнозирования, описанного Карикари (1973) [17], и выражали в см². Дни, прошедшие с даты посадки до появления первого цветка, считали днями до первого цветения и выражали в днях. Дни с даты посадки до сбора первого плода на стадии изменения окраски считали днями до первого сбора урожая и выражали в днях.
2.4.2. Компоненты урожая
Общее количество плодов на растении подсчитывали при начале первого сбора урожая и выражали в штуках. Средний вес пяти плодов одинакового размера измеряли как вес плода и выражали в килограммах. Урожайность оценивали путем умножения количества плодов на средний вес, выражали в килограммах. Твердость плодов измеряли с помощью цифрового пенетрометра для фруктов (модель: GY-4, Sundoo Industries Co., Ltd., Вэньчжоу, Китай) с цилиндрическим щупом диаметром 7,9 мм. Показания снимали в проксимальной, дистальной и средней частях, а средние значения выражали в кг·см⁻². После разрезания плодов на две продольные половинки толщину мякоти измеряли в самой широкой точке и выражали в сантиметрах. Собранные плоды хранили при комнатной температуре и визуально наблюдали до стадии потребления, которую регистрировали как количество дней лежкости.
2.4.3. Показатели качества
Содержание общих растворимых сухих веществ в мякоти определяли с помощью ручного рефрактометра «ERMA» (ERMA®, Токио, Япония), и показания записывали в °B. Общие сахара оценивали, применяя процедуру, изложенную Сомодьи [18], и выражали в %. Кислотность и аскорбиновую кислоту оценивали в соответствии с методами, предложенными Ранганной (1977) [19], и выражали в процентах в пересчете на лимонную кислоту и мг на 100 г мякоти соответственно. Содержание β-каротина и ликопина в плоде оценивали методом, предложенным Нагатой и Ямаситой (1992) [20], и выражали в мг на 100 г.
2.4.4. Показатели папаина
Папаин экстрагировали из плодов каждой обработки с интервалами в 3–4 дня с 85 по 90 день после завязывания плодов. Собранный латекс взвешивали на электронных весах для измерения выхода сырого латекса, выраженного в г. Затем его сушили на солнце в течение 7–8 часов. Высушенный сырой папаин взвешивали на электронных весах и выражали в г. Активность папаина анализировали с использованием метода, описанного Муром (1984) [21]. В этом методе в качестве субстрата использовали казеин, и определяли количество тирозина, высвобожденного из основного раствора казеина, которое сообщалось в единицах тирозина на г папаина.
2.4.5. Заболеваемость PRSV (%)
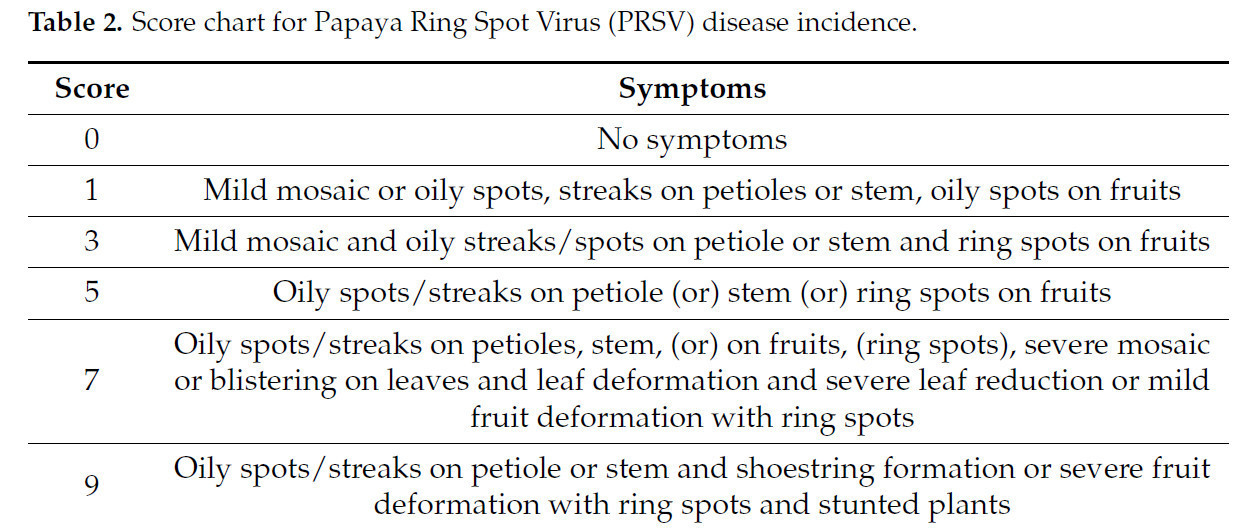
Заболеваемость вирусом кольцевой пятнистости папайи (PRSV) регистрировали с использованием оценочной шкалы от 0 до 9 (Таблица 2), предоставленной Дханамом (2006) [22], и оценивали заболеваемость.
Таблица 2. Оценочная шкала для заболеваемости вирусом кольцевой пятнистости папайи (PRSV).
2.5. Оценка содержания питательных веществ в черешке листа и активности ферментов
Недавно созревший шестой черешок листа от верхушки (индексная ткань) при первом цветении и при первом сборе урожая собирали со всех обработок эксперимента 2.3 и готовили для анализа питательных веществ в черешке листа в соответствии с процедурой, приведенной Бхаргавой и Чадхой (1993) [23]. Образцы черешков листьев переваривали с использованием диацидного и триацидного экстрактов, а затем макро-, вторичные и микроэлементы определяли с помощью микроволновой плазменной атомно-эмиссионной спектроскопии (MPAES) и атомно-абсорбционной спектроскопии (AAS). Листья также собирали с растений, опрысканных питательным составом, и контрольных растений, и подвергали биохимическому анализу (хлорофилл листьев и общие фенолы) и анализу ферментов (пероксидаза (PO), полифенолоксидаза (PPO), каталаза (CAT), нитратредуктаза (NRase), фенилаланин-аммиак-лиаза (PAL)). Свежие образцы листьев весом 250 мг растирали в 10 мл 80% ацетона с помощью пестика и ступки. Образцы гомогенизировали при 5000 об/мин в течение 5 минут, а объем доводили до 25 мл 80% ацетона. Измеряли поглощение раствора на двух разных длинах волн: λ = 663, 645, и значение хлорофилла выражали в мг·г⁻¹ [24]. Общее содержание фенолов в листьях определяли методом, данным Маликом и Сингхом (1980) [25], и выражали в мг·г⁻¹ растительной ткани. Активность пероксидазы измеряли с использованием метода, данного Маликом и Сингхом (1980) [25]. Активность фермента выражали как изменение оптической плотности реакционной смеси в минуту на г ткани. Полифенолоксидазу оценивали с использованием фосфатного буфера и катехина, а активность выражали как изменение оптической плотности в минуту на г растительного образца [26]. Активность каталазы определяли с использованием фосфатного буфера, метода с перекисью водорода [27] и выражали в активности каталазы в минуту на г свежего веса образца. Активность нитратредуктазы оценивали методом, данным Яворски (1971) [28], а активность NRase выражали в мкг NO₂·г⁻¹·ч⁻¹. Фенилаланин-аммиак-лиазу оценивали с использованием HCl-буфера, содержащего меркаптоэтанол, TCA, а активность PAL выражали как мкг·мин⁻¹·г⁻¹ [29].
2.6. Оценка метаболитов листа
Образцы листьев от индексного листа собирали на следующий день после опрыскивания в течение 7-го MAP у растений, опрысканных питательным составом, и у контроля. Экстракцию метаболитов и дериватизацию образцов проводили, как описано Лизеком и др. (2006) [30], а метаболиты определяли с помощью ГХ-МС. Всего 1 мкл дериватизированного экстракта вводили в капиллярную колонку DB-5MS (30,0 м × 0,25 мм × 0,25 мкм) (Shimadzu, Киото, Япония). Температура инжектора была установлена на 225 °C. После задержки растворителя в шесть минут начальная температура термостата ГХ была установлена на 70 °C; после инжекции в течение 1 мин температуру термостата ГХ повышали до 300 °C со скоростью 5 °C·мин⁻¹ и выдерживали при 300 °C в течение 5 минут. Температура инжекции была установлена на 300 °C, а температура источника ионов соответствовала. Гелий был газом-носителем с постоянной скоростью потока 1 мл·мин⁻¹. Измерение проводили с ионизацией электронным ударом (70 эВ) (Shimadzu, Киото, Япония) в режиме полного сканирования (m/z от 50 до 650). Метаболиты идентифицировали на основе индекса времени удерживания, специфичных масс, сравнивая их с эталонными спектрами в библиотеках масс-спектров (NIST 2017).
3. Статистический анализ
В первом эксперименте стандартизация времени листового опрыскивания питательным составом для роста, урожайности, качества и борьбы с PRSV у папайи была заложена в рандомизированном полном блочном дизайне (RCBD) с четырьмя обработками и пятью повторениями. Во втором эксперименте эффективность питательного состава на рост, урожайность, качество и толерантность к PRSV у коммерческой папайи была заложена в дизайне разделенных делянок с двумя основными делянками и двумя подделянками. Данные по обработкам и повторениям собирали из обоих экспериментов, и статистический анализ выполняли, применяя статистические процедуры в соответствии с методами, данными Пансе и Сухатме (1967) [31]. Собранные данные анализировали с помощью двухфакторного дисперсионного анализа, а значимость средних значений обработок определяли с использованием критической разности (CD) при p = 0,05. Статистический анализ проводили в программном обеспечении R studio и R Core team версии r 4.3.1 [32] с использованием пакета agricolae [33]. Данные по заболеваемости PRSV (%) подвергали арксинус-преобразованию, а графики и регрессионный анализ (связь между урожайностью, заболеваемостью PRSV и выходом сырого латекса) проводили с использованием MS Excel.
4. Результаты
4.1. Влияние питательного состава на рост, урожайность, качество и активность папаина у папайи
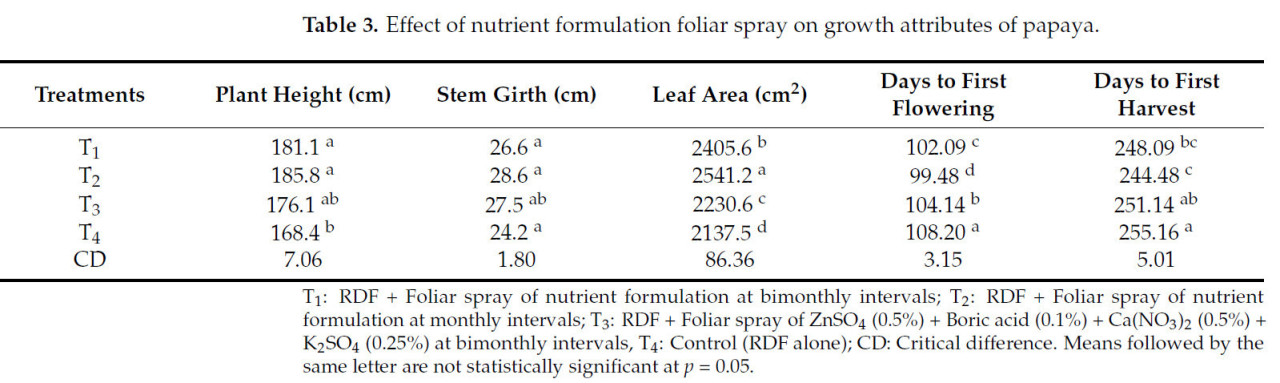
Результаты эксперимента показали, что листовое внесение питательного состава с месячными интервалами с 3-го по 7-й MAP (T2) значительно улучшило показатели роста папайи (Таблица 3), а именно: высоту растения (185,8 см), обхват стебля (28,6 см) и площадь листа (2541,2 см²). Дополнительно к этому, в той же обработке наблюдались раннее цветение (99 дней) и ранний сбор урожая (244 дня), тогда как контроль (T4) показал меньше показателей роста и позднее цветение (108 дней) и поздний сбор урожая (255 дней). Обработка с двухмесячным внесением питательного состава (T1) также показала результаты наравне с обработкой T2 по высоте растения (181,1 см) и обхвату стебля (26,6 см).
Таблица 3. Влияние листового опрыскивания питательным составом на показатели роста папайи.
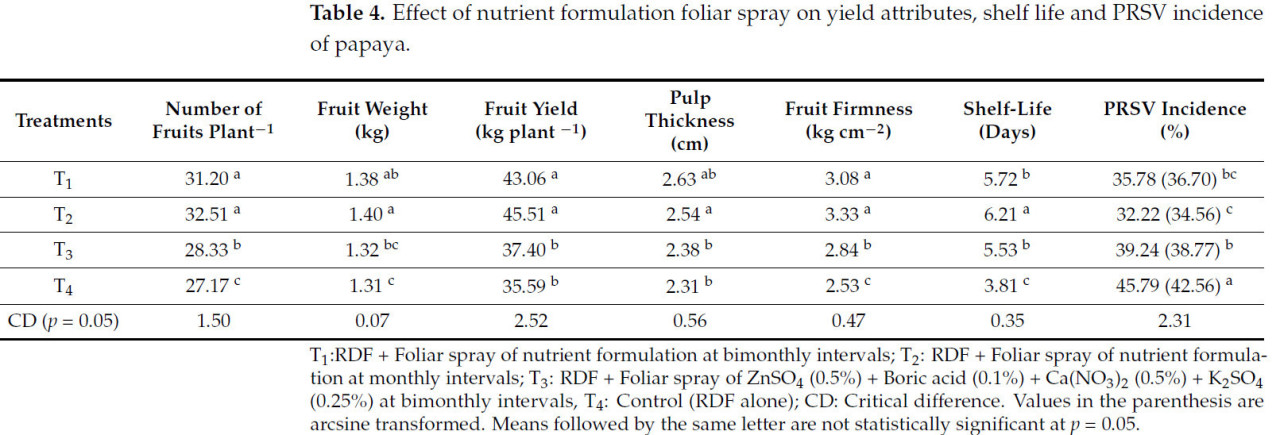
Показатели урожайности, а именно: количество плодов на растение (32,51), вес плода (1,40 кг), урожай плодов (45,51 кг с растения), твердость плода (3,33 кг·см⁻²) и лежкость (6,21 дня) были значительно улучшены при обработке с ежемесячным внесением питательного состава у папайи (T2) (Таблица 4). Однако обработка с двухмесячным внесением питательного состава (T1) также показала результаты наравне с обработкой T2 по количеству плодов (31,20), урожайности плодов (43,06 кг с растения) и твердости плода (3,08 кг·см⁻²). Контрольные растения показали сравнительно меньшую урожайность, а именно: на 21,80% меньше по сравнению с наиболее эффективной обработкой (T2). Лежкость плодов с растений, обработанных листовым внесением питательного состава с месячными интервалами (T2), была выше (6,21 дня), а наименьшее значение было зафиксировано в контроле (3,81 дня). Опрыскивание питательным составом с месячными интервалами (T2) привело к снижению заболеваемости PRSV на 29,64% по сравнению с контролем (T4) (Таблица 4).
Таблица 4. Влияние листового опрыскивания питательным составом на компоненты урожая, лежкость и заболеваемость PRSV папайи.
Та же обработка, получавшая листовое внесение питательного состава с месячными интервалами (T2), значительно улучшила качественные показатели у папайи, зафиксировав максимальные значения TSS (12,58 °Brix), аскорбиновой кислоты (48,05 мг·100 г⁻¹), β-каротина (2,83 мг·100 г⁻¹) и ликопина (2,13 мг·100 г⁻¹) при минимальной титруемой кислотности (0,112%). Однако максимальное общее содержание сахаров 12,34% было зафиксировано при обработке с листовым внесением питательного состава с двухмесячными интервалами (T1). Контрольные растения показали наименьшие значения для всех проанализированных параметров качества. Аналогично, опрыскивание питательным составом значительно улучшило выход папаина (сырого и сухого латекса) и протеолитическую активность фермента по сравнению с контролем (T4) (Таблица 5).
Таблица 5. Влияние листового опрыскивания питательным составом на качественные показатели и активность папаина у папайи.
4.2. Эффективность питательного состава
4.2.1. Влияние питательного состава на рост, урожайность, качество и толерантность к PRSV у коммерческих сортов папайи
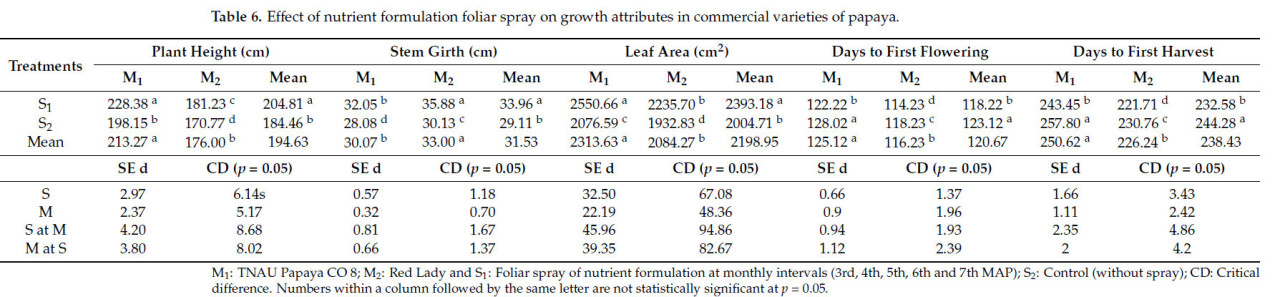
Крупномасштабные полевые испытания с TNAU Papaya CO 8 и Red Lady показали, что листовое опрыскивание питательным составом значительно улучшило показатели роста, урожайности и качества обоих сортов папайи. Напротив , заболеваемость PRSV была меньше у растений, подвергнутых листовой обработке. TNAU Papaya CO 8 с опрыскиванием питательным составом (M1S1) показал максимальную высоту растения (228,38 см), площадь листа (2550,66 см²), за которым следовал Red Lady с опрыскиванием питательным составом (M2S1); контрольная обработка у Red Lady (M2S2) показала минимальную высоту растения и площадь листа (Таблица 6). Red Lady с опрыскиванием питательным составом (M2S1) показал максимальный обхват стебля (35,8 см при первом сборе урожая) с ранним цветением (114 дней) и ранним сбором урожая (221 день), тогда как контрольная обработка у TNAU papaya CO 8 (M1S2) показала позднее цветение (128 дней) и поздний сбор урожая (257 дней) (Таблица 6).
Таблица 6. Влияние листового опрыскивания питательным составом на показатели роста у коммерческих сортов папайи.
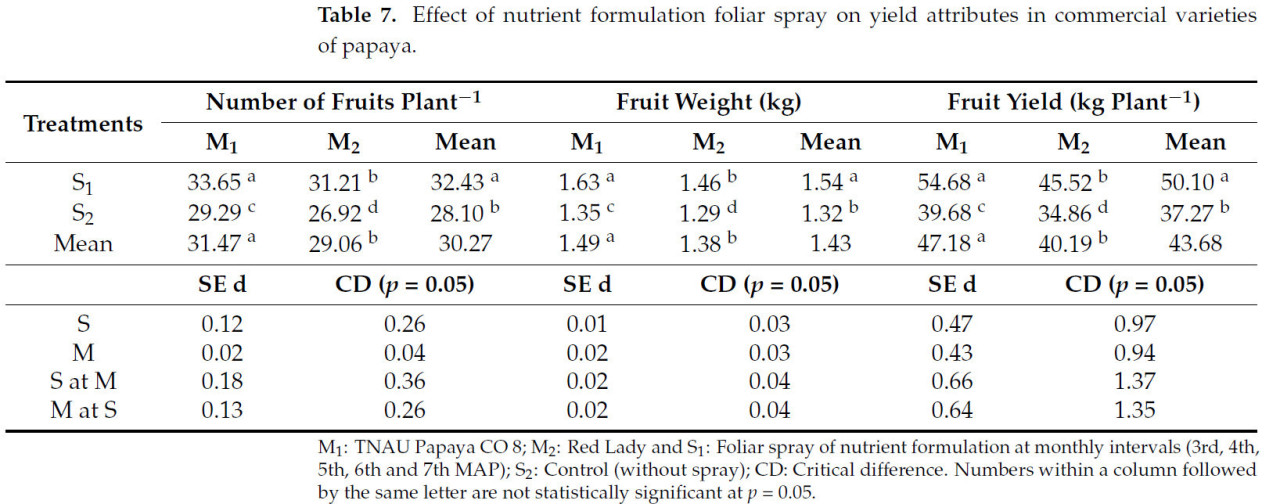
Максимальное количество плодов на растение (33,65), вес плода (1,63 кг) и урожай плодов (54,68 кг с растения) были зафиксированы у TNAU Papaya CO 8 с опрыскиванием питательным составом (M1S1). Однако сорт Red Lady, не получавший опрыскивания питательным составом (M2S2), показал меньшее количество плодов (26,92) с минимальным весом плода (1,29 кг) и урожайностью плодов (34,86 кг с растения) (Таблица 7).
Таблица 7. Влияние листового опрыскивания питательным составом на компоненты урожая у коммерческих сортов папайи.
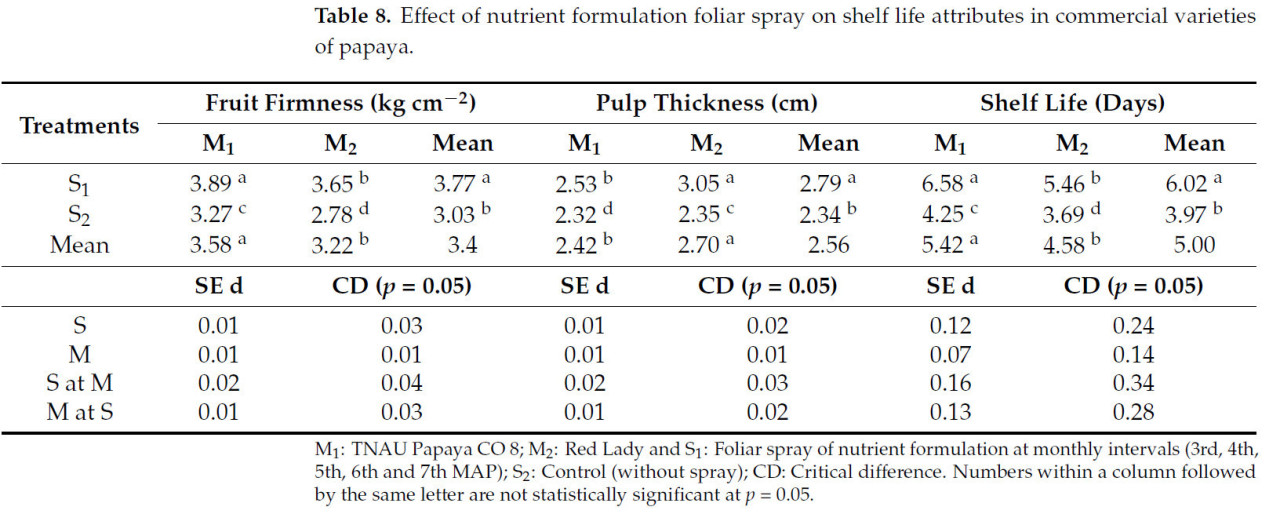
Между обработками были значительные различия по различным показателям, связанным с лежкостью (Таблица 8). Максимальная твердость плода (3,89 кг·см⁻²) и лежкость (6,58 дней) были зафиксированы у TNAU Papaya CO 8 с опрыскиванием питательным составом (M1S1), тогда как обработка M2S2, т.е. Red Lady, не получавшая опрыскивания питательным составом, показала меньшую лежкость (3,69 дня) с минимальной твердостью плода (2,78 кг·см⁻²).
Таблица 8. Влияние листового опрыскивания питательным составом на показатели лежкости у коммерческих сортов папайи.
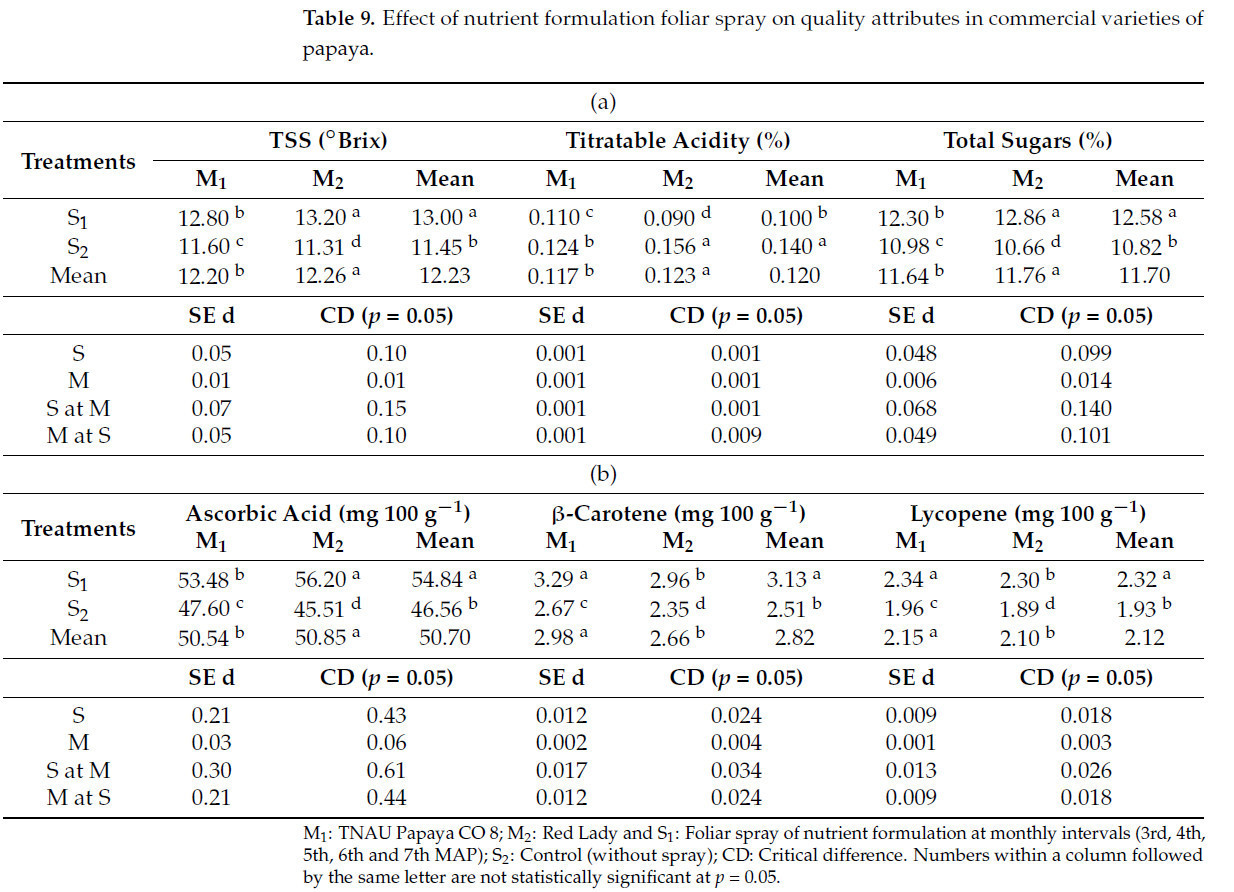
Сорт папайи Red Lady, получавший листовое внесение питательного состава с месячными интервалами (M2S1), показал более высокие TSS (13,20 °Brix), общие сахара (12,86%), аскорбиновую кислоту (56,20 мг·100 г⁻¹) с меньшей титруемой кислотностью (0,90%). Однако максимальные β-каротин (2,83 мг·100 г⁻¹) и ликопин (2,13 мг·100 г⁻¹) были зафиксированы у TNAU papaya CO 8 с листовым внесением питательного состава с месячными интервалами (M1S1). Контрольные растения обоих сортов показали наименьшие значения для всех проанализированных параметров качества (Таблица 9a,b).
Таблица 9. Влияние листового опрыскивания питательным составом на качественные показатели у коммерческих сортов папайи.
4.2.2. Влияние питательного состава на биохимические показатели, содержание питательных веществ в черешке и активность ферментов у коммерческих сортов папайи
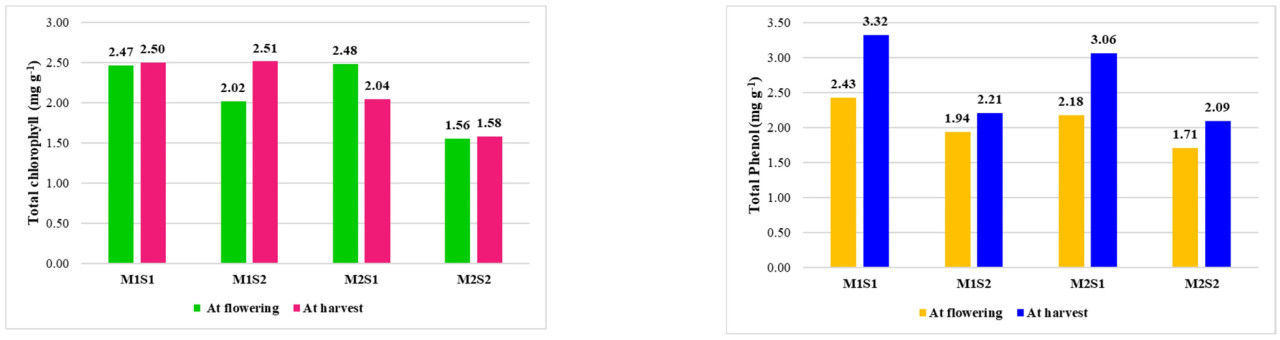
Листовое опрыскивание питательным составом значительно увеличило общий хлорофилл, общие фенолы и содержание питательных веществ в черешке листа у обоих сортов по сравнению с их соответствующим контролем. Общее содержание хлорофилла было максимальным как при первом цветении, так и при первом сборе урожая у сорта Red Lady, получавшего листовое опрыскивание питательным составом (M2S1), а именно: 2,479 мг·г⁻¹ и 2,513 мг·г⁻¹ соответственно, что наравне с TNAU papaya CO 8, получавшим листовое опрыскивание питательным составом (M1S1), а минимальное общее содержание хлорофилла 1,557 мг·г⁻¹ и 1,578 мг·г⁻¹ соответственно при первом цветении и при первом сборе урожая наблюдалось у M2S2 (Red Lady без опрыскивания питательным составом). По общему содержанию фенолов TNAU papaya CO 8, получавший листовое опрыскивание питательным составом с месячными интервалами (M1S1), показал максимум 2,431 мг·г⁻¹ и 3,321 мг·г⁻¹ при первом цветении и при первом сборе урожая соответственно, а минимальное общее содержание фенолов было зафиксировано у Red Lady, не получавшего листового опрыскивания питательным составом (M2S2) (Рисунок 1).
Рисунок 1. Влияние листового опрыскивания питательным составом на общее содержание хлорофилла и общих фенолов у коммерческих сортов папайи. M1 — TNAU Papaya CO 8; M2 — Red Lady; S1 — Листовое опрыскивание питательным составом с месячными интервалами; S2 — Контроль (без опрыскивания).
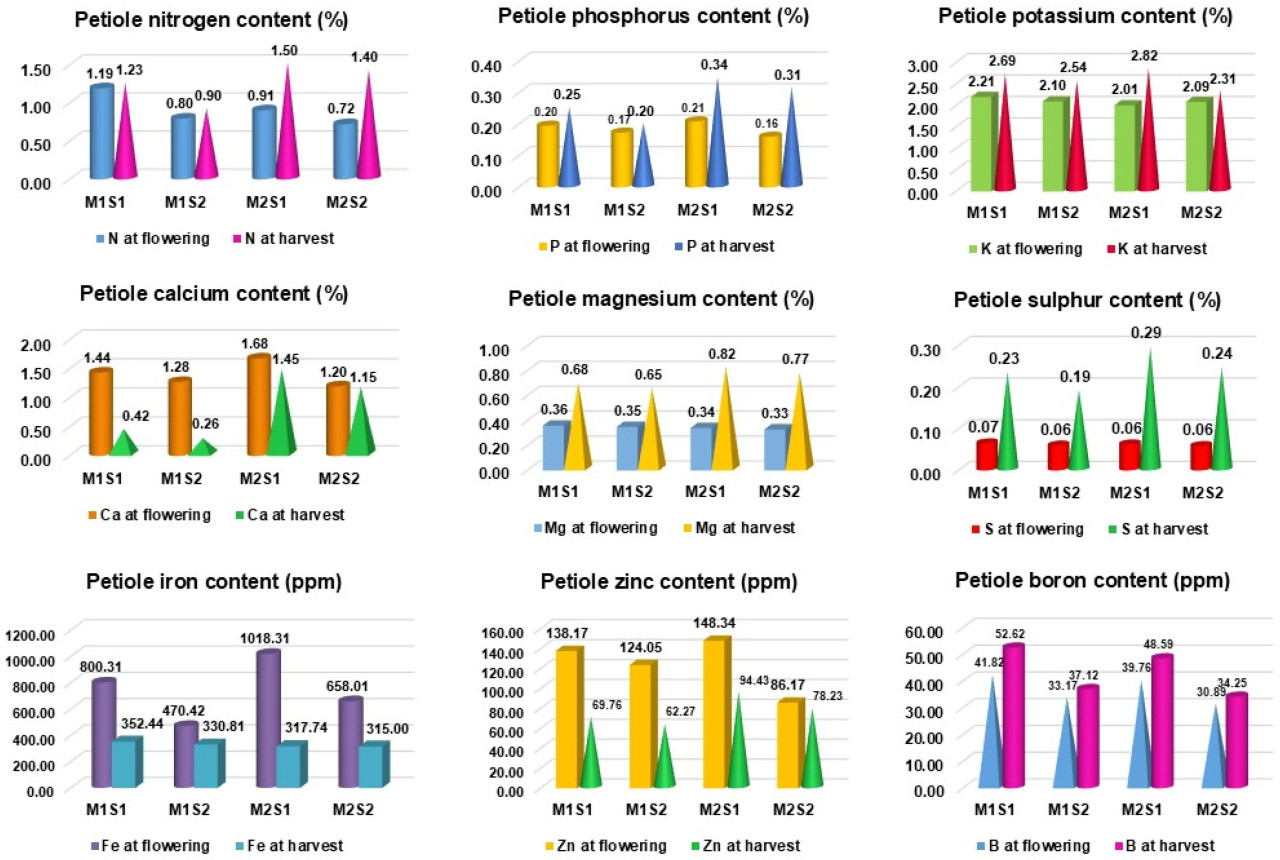
Максимальное содержание макроэлементов наблюдалось у TNAU papaya CO 8, получавшего листовое опрыскивание питательным составом (M1S1) при цветении, а именно: N (1,19%), P (0,21%) и K (2,21%), тогда как Red Lady, получавший листовое опрыскивание питательным составом (M2S1), показал самые высокие значения N (1,50%), P (0,34%) и K (2,82%) при сборе урожая (Рисунок 2). У обоих сортов содержание вторичных и микроэлементов было максимальным в обработках с листовым опрыскиванием по сравнению с контролем.
Рисунок 2. Влияние листового опрыскивания питательным составом на содержание питательных веществ в черешке листа у коммерческих сортов папайи. M1 — TNAU Papaya CO 8; M2 — Red Lady; S1 — Листовое опрыскивание питательным составом с месячными интервалами; S2 — Контроль (без опрыскивания).
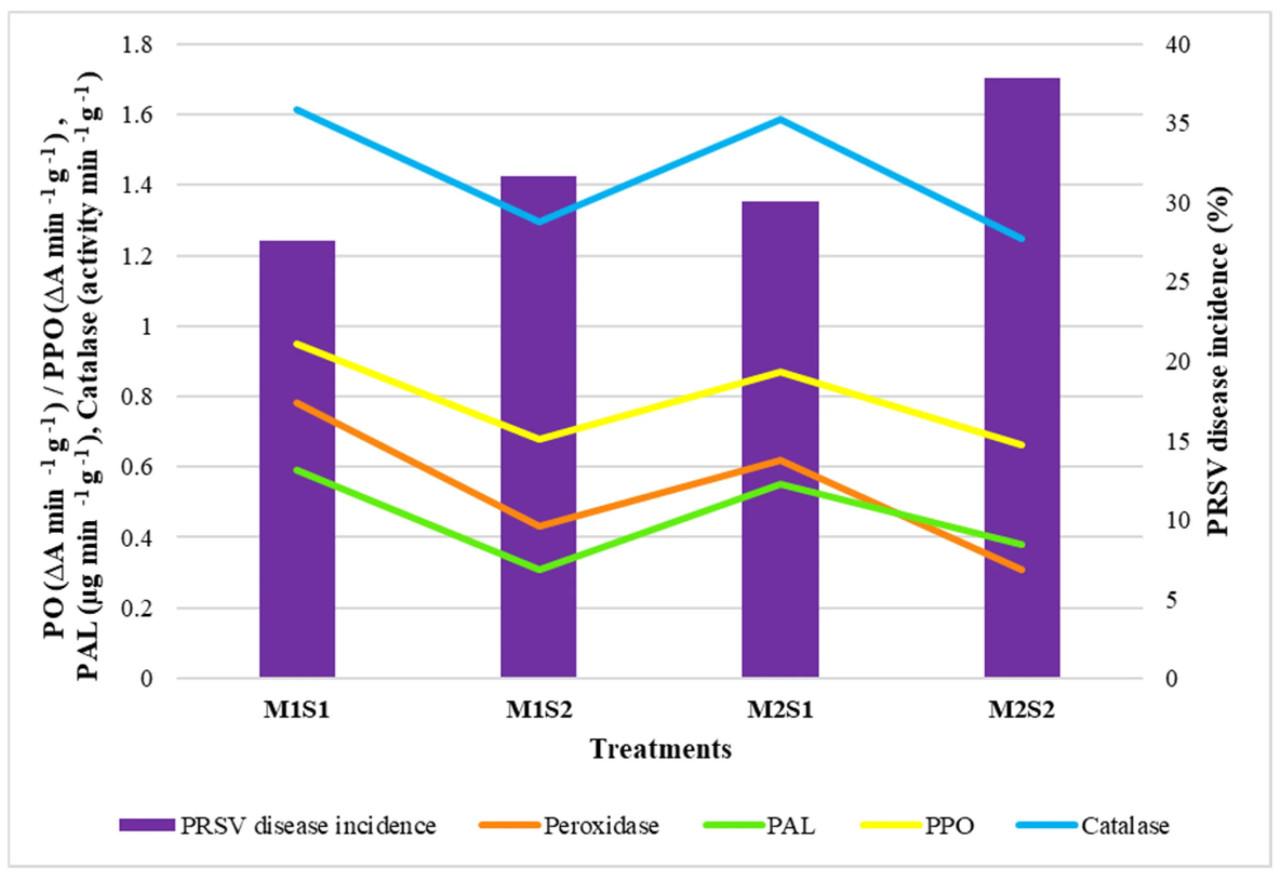
Листовое внесение питательного состава сравнительно усилило активность защитных ферментов. Обработка M1S1 (TNAU papaya CO 8 с листовым опрыскиванием питательным составом) показала максимальную активность пероксидазы (0,470 и 0,780 ∆A·мин⁻¹·г⁻¹), активность полифенолоксидазы (0,810 и 0,950 ∆A·мин⁻¹·г⁻¹), активность каталазы (1,597 и 1,614 активность·мин⁻¹·г⁻¹), активность нитратредуктазы (5,92 и 6,64 мкг NO₂·г⁻¹·ч⁻¹) и активность PAL (0,530 и 0,590 активность·мин⁻¹·г⁻¹) при первом цветении и первом сборе урожая соответственно, за которым следовала M2S1 (Red Lady с листовым опрыскиванием питательным составом), а минимальная активность ферментов наблюдалась у Red Lady без листового опрыскивания питательным составом (M2S2) (Рисунок 3).
Рисунок 3. Влияние питательного состава на активность ферментов листьев папайи. M1 — TNAU Papaya CO 8; M2 — Red Lady; S1 — Листовое опрыскивание питательным составом с месячными интервалами; S2 — Контроль (без опрыскивания).
4.2.3. Влияние опрыскивания питательным составом на показатели папаина
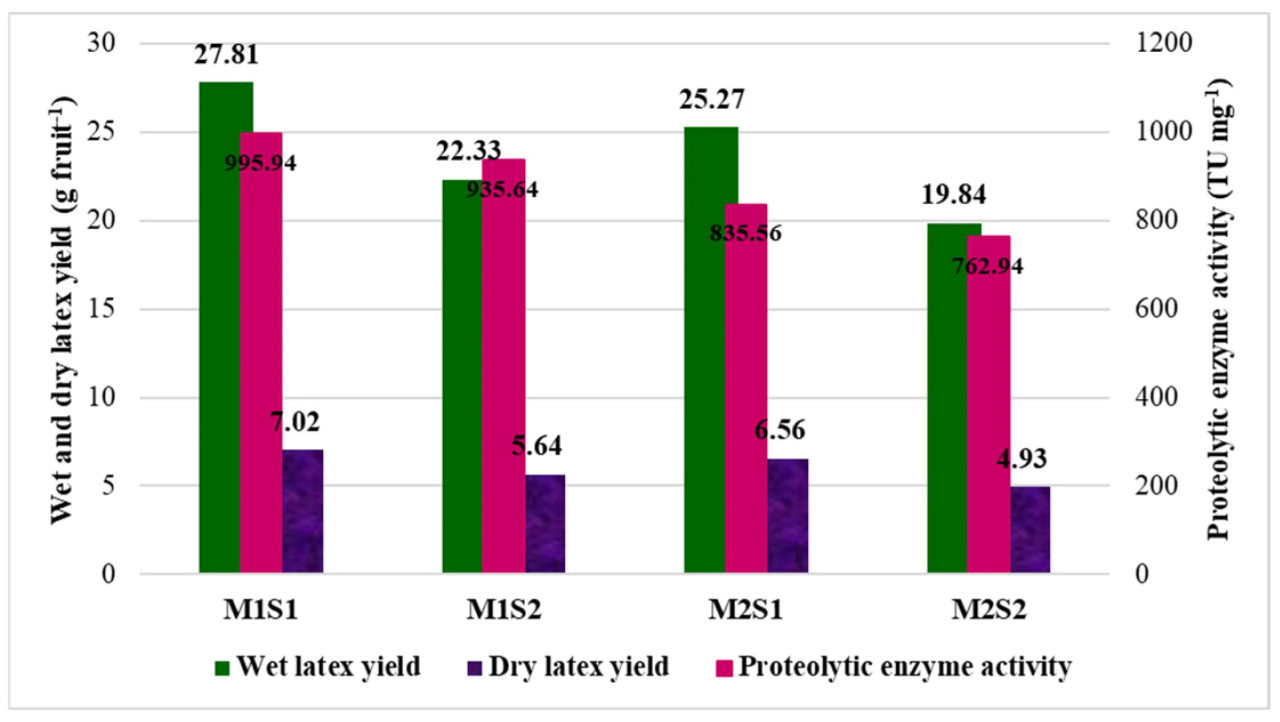
Листовое внесение питательного состава в высокой степени повлияло на выход папаина и протеолитическую активность фермента у обоих сортов. Обработка M1S1 (TNAU papaya CO 8 с листовым опрыскиванием питательным составом) показала высокий выход сырого латекса (27,81 г·плод⁻¹; 936,02 г·дерево⁻¹) и сухого латекса (7,02 г·плод⁻¹; 236,36 г·дерево⁻¹) с высокой протеолитической активностью фермента (995,94 ТЕ·мг⁻¹), за которым следовала M2S1 (Red Lady с листовым опрыскиванием питательным составом), тогда как обработка M2S2 (Red Lady без листового опрыскивания) имела минимальный выход папаина и активность папаина (Рисунок 4).
Рисунок 4. Влияние питательного состава на выход папаина и протеолитическую активность фермента у папайи. M1 — TNAU Papaya CO 8; M2 — Red Lady; S1 — Листовое опрыскивание питательным составом с месячными интервалами; S2 — Контроль (без опрыскивания).
4.2.4. Связь между урожайностью, заболеваемостью PRSV и выходом сырого латекса
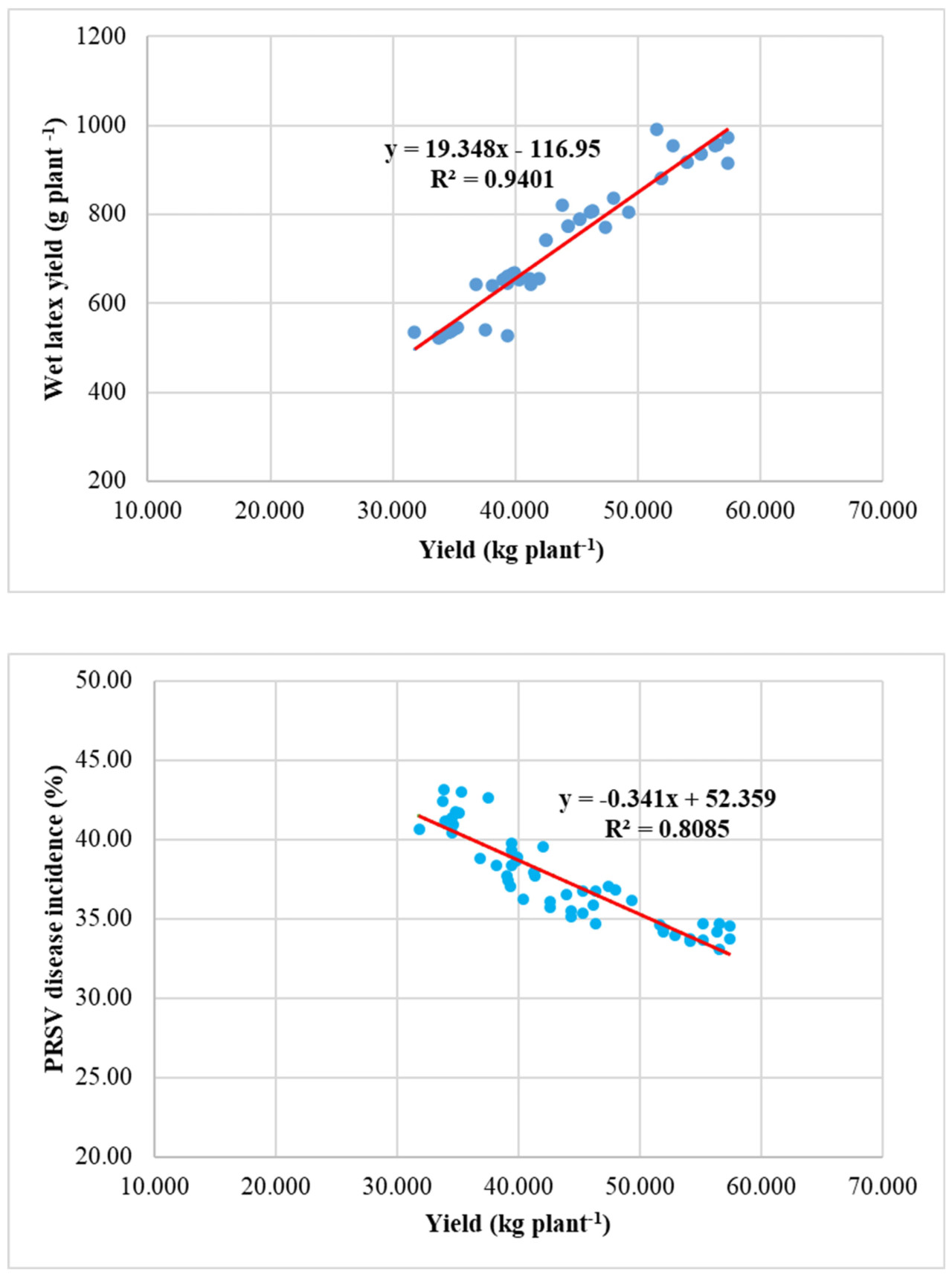
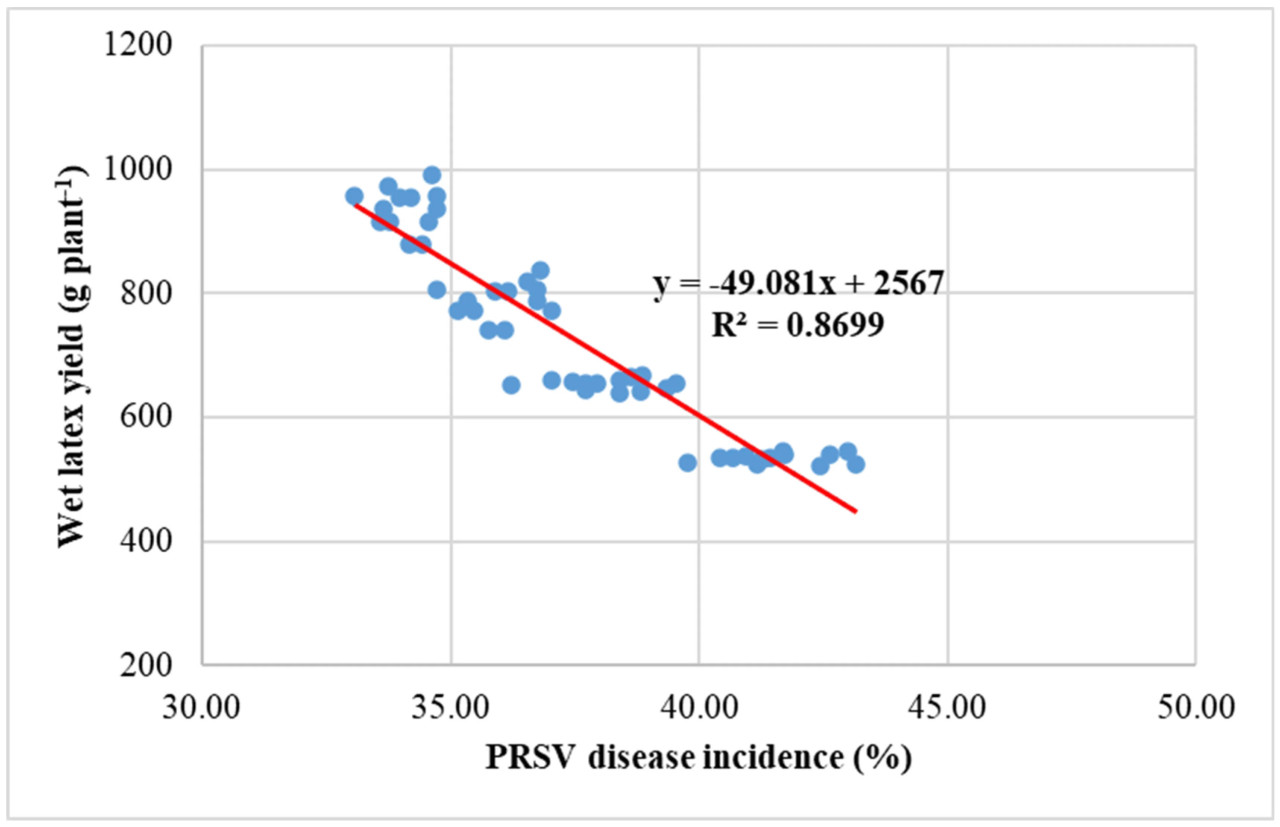
Результат показал значительную положительную линейную связь между урожайностью и выходом сырого латекса (R² = 0,940). Однако была значительная отрицательная линейная связь между урожайностью и заболеваемостью PRSV (R² = 0,808), а также между выходом сырого латекса и заболеваемостью PRSV (R² = 0,869) (Рисунок 5).
Рисунок 5. Связь между урожайностью папайи, выходом сырого латекса и заболеваемостью PRSV.
4.2.5. Влияние питательного состава на метаболиты листа
Был проанализирован хроматограмм газовой хроматографии образцов листьев папайи, опрысканных питательным составом, вместе с контролем. Основными химическими компонентами, идентифицированными из хроматограммы образцов листьев папайи, опрысканных питательным составом, были: яблочная кислота, кетоглутаровая кислота, сахароза, α-глюкопираноза, кумаровая кислота, пальмитиновая кислота, кофейная кислота, аскорбиновая кислота и винная кислота.
5. Обсуждение
5.1. Влияние питательного состава на параметры роста
Листовое внесение питательного состава с месячными интервалами оказало положительное влияние на параметры роста, а именно: высоту растения, обхват стебля и площадь листа у TNAU papaya CO 8 и Red Lady по сравнению с контролем. Это в основном объясняется модуляцией метаболической активности папайи питательными веществами и гормонами в питательном составе. Коровий навоз богат азотом (0,1%) и гормонами, а именно: индолилуксусной кислотой и гиббереллинами [34], и при применении в качестве листового опрыскивания положительно влияет на высоту растений у кассавы [35]. Калий заметно влияет на обхват стебля, поддерживая осморегуляцию и удлинение клеток [36], что в совокупности стимулировало выработку регуляторов роста растений и улучшало рост растений. Более высокое расширение поверхности листа можно объяснить влиянием основных питательных веществ, таких как кальций, сера, цинк и бор. Эти питательные вещества могли стимулировать деление клеток, приводя к увеличению площади листа за счет усиленного синтеза ауксина [4,37,38,39].
Листовое внесение питательного состава показало раннее цветение и ранний сбор урожая по сравнению с контролем, и это может быть объяснено благотворным влиянием бора и цинка, которые способствовали увеличению выработки метаболитов. Бор и цинк способствуют образованию хлорофилла и увеличению площади листа, что в конечном итоге приводит к улучшенной ассимиляции и ускоренному синтезу метаболитов у растений. Дополнительно , бор играет важную роль в репродуктивном росте, особенно в формировании и развитии цветочных почек, а также в росте пыльников и пыльцы. Раннее цветение может быть связано с положительным влиянием микроэлементов в питательном составе, о чем также сообщали более ранние исследователи [40,41].
5.2. Влияние питательного состава на содержание питательных веществ в черешке листа
Опрыскивание питательным составом значительно улучшило содержание питательных веществ в черешке у TNAU Papaya CO 8 и Red Lady. Это может быть связано с тем, что коровий навоз и нимовый жмых содержат макро- и микроэлементы, легкодоступные в питательном составе, а листовое опрыскивание макро- и микроэлементами положительно повлияло на содержание питательных веществ в черешке. Как неподвижный элемент флоэмы, бор нелегко транспортируется по всему растению, что делает листовое опрыскивание эффективным методом поддержания оптимального уровня бора, необходимого для роста и развития. Это увеличение концентрации бора в листьях после применения удобрения, содержащего бор, также было задокументировано у папайи [4,42].
5.3. Влияние питательного состава на биохимические параметры
Повышение уровня хлорофилла у растений, обработанных питательным составом, может быть связано с повышенными концентрациями азота и магния в листьях (Рисунок 1). Эти элементы являются важнейшими , поскольку они способствуют формированию тетрапиррольного кольца и служат центральным атомом в молекулах хлорофилла [43,44].
Микроэлементы, включая Zn, Fe, Mn и Cu, ключевые для продукции цитозольной супероксиддисмутазы, каталазы, митохондриальной супероксиддисмутазы и цитохромоксидазы соответственно, и удаления АФК в растительных тканях, и отрицательно коррелируют с распространением болезней [45,46]. Активность пероксидазы была на 80% выше у растений, опрысканных питательным составом, чем у контрольных растений, независимо от сортов. Это может быть связано с усилением регуляции генов POX бактериями Bacillus, присутствующими в питательном составе [47,48]. Растения, опрысканные питательным составом, показали в 1,3 раза более высокую активность каталазы, чем контрольные растения. Это может быть связано с добавлением железа через листовое опрыскивание, поскольку каталаза является тетрамерным металлоферментом, состоящим из четырех идентичных, тетраэдрически расположенных субъединиц, каждая с гемовой группой в своем активном центре [49,50].
Дополнительно , из-за повышенной активности полифенолоксидазы (PPO) и фенилаланин-аммиак-лиазы (PAL) у растений папайи, опрысканных питательным составом, снижается серьезность заболевания. PPO детоксифицирует клеточную перекись водорода, образующуюся в ответ на атаку патогена. Он также окисляет фенольные соединения в противомикробные хиноны, ограничивая распространение вируса путем инактивации вирусной РНК [51]. Индуцированная системная устойчивость (ISR), вызываемая Bacillus, может усиливать синтез антиоксидантных ферментов, включая PAL [52].
Зависящая от нитратредуктазы (NR) продукция оксида азота (NO) была необходима для регуляции пути AOX, который играет важную роль в NO-опосредованном защитном ответе, способствуя ядерной транслокации NPR1 (Non-expression of pathogenesis-related) для индукции экспрессии гена PR (pathogenesis-related protein) [53]. Аналогичные результаты повышенной защиты за счет усиления антиоксидантных ферментов были зарегистрированы у папайи [50,54].
5.4. Влияние питательного состава на урожайность и компоненты урожая
Количество плодов на растение, вес плода и урожай с растения показали благоприятные результаты благодаря листовому внесению питательного состава с улучшенными колонками плодов и биометрией плодов. Применение нимового жмыха и коровьего навоза питает растения, обеспечивая макро- и микроэлементы, которые помогают увеличить урожайность [55]. Цинк поддерживает стабильность мембран, а бор улучшает подвижность кальция в плодах. Это положительно способствует увеличению продукции фотосинтатов и облегчает стабильную поставку углеводов для эффективного поглощения кальция, что в конечном итоге увеличивает количество плодов [56]. Максимальное количество листьев, площадь листа и содержание хлорофилла положительно коррелировали с улучшением фотосинтеза и продукции фотосинтатов, что увеличило количество плодов на растение, что привело к более высокой урожайности с растения [38,44].
Увеличение веса плода может быть связано с улучшенной активностью ферментов, транспортирующих и накапливающих больше питательных веществ и фотосинтатов, взаимодействием кальция с другими питательными веществами, а также увеличением срединной пластинки и клеточной стенки. Бор также увеличивает вес плода за счет накопления сухого вещества [57]. Цинк способствует синтезу эндогенных ауксинов и других веществ, стимулирующих рост [58], и контролирует проницаемость клеточной стенки, тем самым способствуя мобилизации воды в плодах.
5.5. Влияние питательного состава на качественные показатели плодов
Растения, получавшие опрыскивание питательным составом, значительно улучшили общие растворимые сухие вещества (TSS) и общие сахара. Бор способствует расщеплению сложных полисахаридов на более простые сахара путем гидролиза и помогает увеличить TSS. Калий играет роль в транспорте сахаров, приводя к увеличению уровня сахаров за счет эффективного перемещения фотосинтатов из листьев в плоды. Увеличение общих растворимых сухих веществ и уровня сахаров может быть объяснено преобразованием углеводов в простые сахара по мере созревания плодов с последующим использованием сахаров в процессе дыхания. Аналогичные результаты также наблюдались у папайи [59] и гуавы [60]. Калий и сера, вероятно, помогли растениям увеличить накопление аскорбиновой кислоты в плодах, ингибируя ферментную систему, ответственную за окисление аскорбиновой кислоты. Бор и цинк привели к повышению уровня аскорбиновой кислоты в папайе, возможно, из-за преобразования сахаров в аскорбиновую кислоту [61]. Снижение титруемой кислотности может быть связано с благоприятным влиянием цинка и бора на преобразование кислот в сахара и их производные через гликолиз или дыхание [62]. Содержание ликопина и β-каротина являются определяющими факторами цвета мякоти и кожуры у папайи. Улучшение ликопина и β-каротина может быть связано с комбинированным действием цинка и бора, которые способствуют накоплению и активации важных ферментов, участвующих в производстве пигментов. Аналогичные результаты наблюдались Зеленой [63] у томатов. Толщина мякоти значительно увеличилась благодаря микроэлементам, присутствующим в питательном составе. Согласно Ортису и др. (2011) [64], кальций действует как межмолекулярное связующее вещество, которое защищает пектин-белковые комплексы срединной пластинки и накопление кальция в пектиновых полисахаридах.
5.6. Влияние питательного состава на лежкость и активность папаина
Твердость плодов была повышена у плодов, опрысканных питательным составом, у обоих сортов, и это может быть связано с влиянием кальция на утолщение клеточной стенки. Он связывает эти пектиновые цепи вместе, образуя связи между ними и укрепляя клеточную стенку, чтобы противостоять ферментативному разрушению на стадии созревания [65]. В настоящем исследовании наблюдалось увеличение лежкости у опрысканных плодов, что может быть связано с прямым или косвенным влиянием кальция на атрибуты созревания плодов (дыхание и производство этилена) [66] и увеличением концентрации бора в срединной пластинке клеточной стенки плода. Бор обеспечивает физическую прочность клеточной стенки, а также улучшает цвет и внешний вид плодов [40]. Опрыскивание питательным составом, которое содержало кальций и серу, значительно улучшило выход сырого и сухого латекса и протеолитическую активность фермента. Это может быть связано с повышенной целостностью сосудов на поверхности плода. Листовое опрыскивание биорегулятором увеличило выход латекса и активность папаина у TNAU Papaya CO 8 [67,68].
5.7. Влияние питательного состава на заболеваемость PRSV
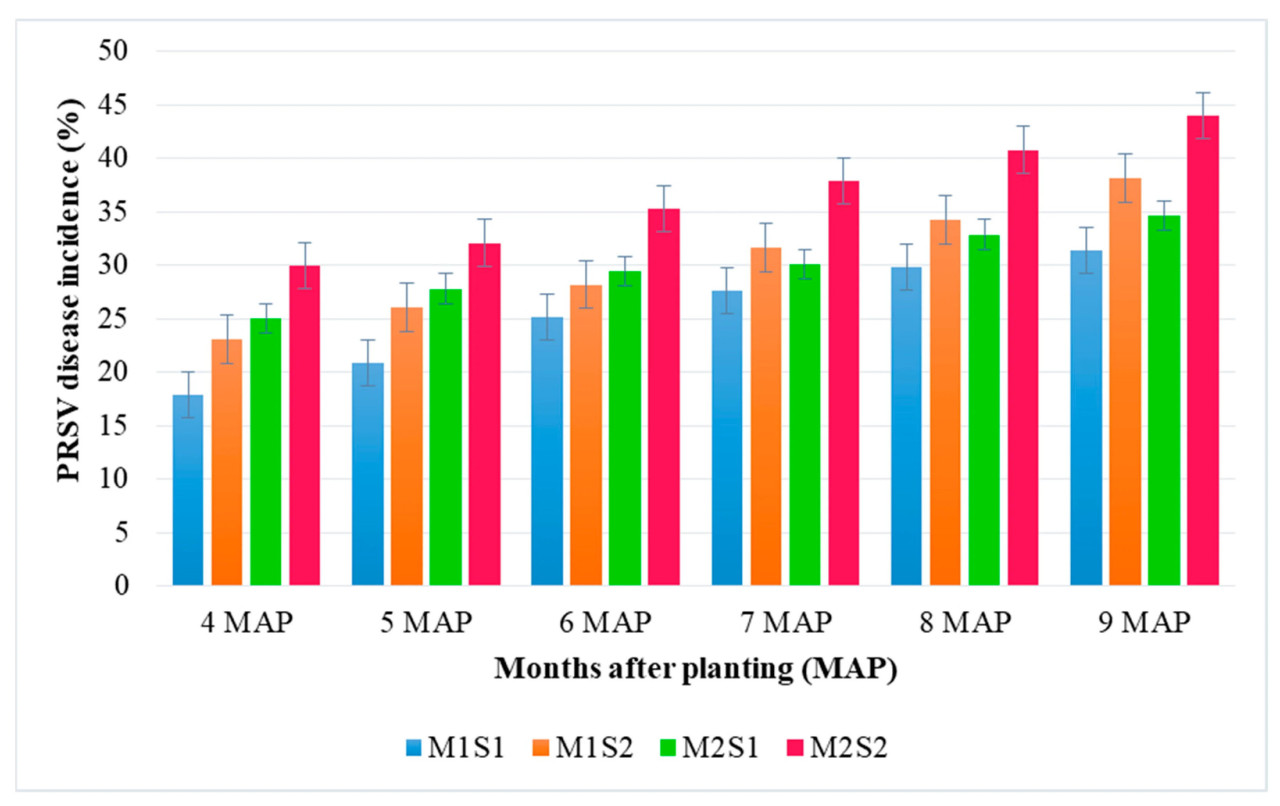
Листовое внесение питательного состава с месячными интервалами с 3-го по 7-й MAP (S1) показало меньшую заболеваемость PRSV у TNAU Papaya CO 8 и Red Lady по сравнению с контролем (S2) (Рисунок 6).
Рисунок 6. Влияние питательного состава на заболеваемость PRSV (%). M1 — TNAU Papaya CO 8; M2 — Red Lady; S1 — Листовое опрыскивание питательным составом с месячными интервалами; S2 — Контроль (без опрыскивания).
Снижение заболеваемости среди обработок может быть связано с усилением синтеза защитных ферментов, таких как пероксидаза, каталаза, NR и PPO [54], и репеллентной активностью летучих соединений, образующихся во время брожения коровьего навоза [34]. Bacillus subtilis улучшал рост растений, производя вещества, стимулирующие рост, и предотвращая развитие болезней [69]. Антифидантная активность против тлей-переносчиков достигается за счет азадирахтина, нимбина и нимбинина, присутствующих в нимовом жмыхе [70]. Совместное применение органических источников питательных веществ, неорганических микроэлементов и агентов биоконтроля улучшает здоровье и жизнеспособность растений; тем самым потеря урожая и выраженность симптомов вирусного заболевания значительно снижались [37,71,72].
5.8. Влияние питательного состава на метаболиты листа
Основными химическими компонентами, идентифицированными из хроматограммы образцов листьев папайи, опрысканных питательным составом, были: яблочная кислота, кетоглутаровая кислота, сахароза, α-глюкопираноза, кумаровая кислота, пальмитиновая кислота, кофейная кислота, аскорбиновая кислота и винная кислота. Яблочная кислота способствует росту растений, увеличивая содержание хлорофилла и защищая фотосинтетические структуры, тем самым значительно увеличивая биомассу растений [73,74]. В результате большего фотосинтеза уровень сахарозы и α-глюкопиранозы (циклической формы глюкозы) увеличился и действовал как сигнальные молекулы против фитопатогенов [75]. При биотическом стрессе мАФК (митохондриальные АФК) влияют на поведение всей клетки, вызывая различные реакции, которые могут привести к запрограммированной гибели клеток (PCD) [76]. Таким образом, дыхание листьев является одним из важнейших метаболических процессов в иммунном ответе [77]. Кетоглутаровая кислота является одним из ключевых промежуточных органических кислот цикла трикарбоновых кислот (TCA), а также важна для метаболизма различных вторичных метаболитов, таких как глюкозинолат, флавоноид и алкалоиды, обладающих различными биологическими функциями, включая защиту от патогенов [78]. Она также служит источником двух аминокислот, а именно: глутамата и глутамина, тем самым стимулируя синтез белка и ингибируя деградацию белка [79].
Аскорбиновая кислота защищает клетки от активных форм кислорода, и уровень аскорбиновой кислоты положительно коррелировал со степенью вирусной устойчивости [80]. Наряду с основной функцией прямой детоксикации АФК, аскорбиновая кислота также связана с другими процессами метаболической регуляции, включая виолаксантин деэпоксидазу в фотосинтезе, расширение клеточной стенки и деление клеток [81]. Следовательно, она предотвращает PCD более эффективно и немедленно, чем устранители АФК [82]. Винная кислота описывается как «специализированный первичный метаболит», происходящий из метаболизма углеводов и катаболизма аскорбиновой кислоты, и предполагается, что она обладает антиоксидантными свойствами [83]. Увеличение активности фермента PAL способствует превращению фенилаланина в коричную кислоту. При гидроксилировании коричная кислота образует кумаровую кислоту, за которой следует окисление ее боковой цепи, что в конечном итоге приводит к производству салициловой кислоты [84]. Салициловая кислота обладает способностью препятствовать всем трем основным фазам вирусной инфекции, включая репликацию, передачу между клетками и движение на большие расстояния [85]. Связанные с клеточной стенкой кумаровые кислоты также служат хранилищем фенилпропаноидных единиц для биосинтеза лигнина, отмечая начальные стадии лигнификации [86]. Биосинтез монолигнолов включает превращение кумаровой кислоты в кофейную кислоту, обе из которых выше у обработанных растений по сравнению с контролем [87]. Таким образом, синтезированный лигнин действует как физический барьер для тлей, влияя на проникновение их стилета, тем самым снижая вирусную инфекцию [88].
6. Выводы
Из этого исследования был сделан вывод, что листовое внесение питательного состава с месячными интервалами (3-й, 4-й, 5-й, 6-й и 7-й месяц после посадки) вместе с регулярным внесением рекомендуемой дозы удобрений с двухмесячными интервалами, начиная с 3-го месяца после посадки, полезно для улучшения роста, урожайности, качества, лежкости папайи и борьбы с вирусом кольцевой пятнистости папайи (PRSV). Комбинация органических и неорганических источников питательных веществ с агентами биоконтроля улучшает питательный статус растения и защитные ферменты, тем самым борясь с болезнью PRSV и приводя к повышению урожайности с производством качественных плодов.
Ссылки
1. Statista. Available online: https://www.statista.com/statistics/578039/world-papaya-production/#:~:text=This%20statistic%20depicts%20the%20production,million%20metric%20tons%20in%202021 (accessed on 4 October 2024).
2. Agricultural Statistics at a Glance 2022–23. Available online: https://desagri.gov.in/wp-content/uploads/2023/05/Agricultural-Statistics-at-a-Glance-2022.pdf (accessed on 20 October 2024).
3. Crop Production Guide Horticulture Crops; Directorate of Horticulture and Plantation Crops and Tamil Nadu Agricultural University: Chennai and Coimbatore, India, 2020; pp. 1–405.
4. Monika, G.; Soorianathasundaram, K.; Auxcilia, J.; Chitdeshwari, T.; Kavitha, C.; Muthulakshmi, P. Effect of foliar nutrition of calcium and sulphur on growth and yield of papaya (Carica papaya L.). Int. J. Chem. Stud. 2018, 6, 765–769. [Google Scholar]
5. Monika, G.; Soorianathasundaram, K.; Auxcilia, J.; Chitdeshwari, T.; Kavitha, C. Effect of foliar nutrition of calcium and sulphur on pulp quality attributes and shelf-life of papaya (Carica papaya L.). Int. J. Chem. Stud. 2018, 6, 2728–2730. [Google Scholar]
6. Kalleshwaraswamy, C.; Kumar, N.K. Transmission efficiency of Papaya ringspot virus by three aphid species. Phytopathology 2008, 98, 541–546. [Google Scholar] [CrossRef] [PubMed]
7. Purcifull, D.E.; Edwardson, J.R.; Hiebert, E.; Gonsalves, D. Papaya ringspot virus. CMI/AAB Descr. Plant Viruses 1984, 292. [Google Scholar]
8. Thirugnanavel, A.; Balamohan, T.; Manoranjitham, S.; Karunakaran, G. Screening of Papaya (Carica papaya L.) Cultivars for Resistance to PRSV Under Polyhouse Conditions. Madras Agric. J. 2013, 100, 287–290. [Google Scholar]
9. Warghane, A.; Saini, R.; Shri, M.; Andankar, I.; Ghosh, D.K.; Chopade, B.A. Application of nanoparticles for management of plant viral pathogen: Current status and future prospects. Virology 2024, 592, 109998. [Google Scholar] [CrossRef]
10. Hao, Y.; Yuan, W.; Ma, C.; White, J.C.; Zhang, Z.; Adeel, M.; Zhou, T.; Rui, Y.; Xing, B. Engineered nanomaterials suppress Turnip mosaic virus infection in tobacco (Nicotiana benthamiana). Environ. Sci. Nano 2018, 5, 1685–1693. [Google Scholar] [CrossRef]
11. John, K.S.; Anju, P.S.; Suja, G.; Mathew, J.; Shivay, Y.S. Zinc nutrition in tropical tuber crops: A review. Indian J. Agron. 2019, 64, 1–10. [Google Scholar] [CrossRef]
12. Hashem, A.; Tabassum, B.; AbdAllah, E.F. Bacillus subtilis: A plant-growth promoting rhizobacterium that also impacts biotic stress. Saudi J. Biol. Sci. 2019, 26, 1291–1297. [Google Scholar] [CrossRef] [PubMed]
13. Gupta, N.; Debnath, S.; Sharma, S.; Sharma, P.; Purohit, J. Role of nutrients in controlling the plant diseases in sustainable agriculture. Agric. Important Microbes Sustain. Agric. 2017, 2, 217–262. [Google Scholar]
14. Saeed, Q.; Xiukang, W.; Haider, F.U.; Kučerik, J.; Mumtaz, M.Z.; Holatko, J.; Naseem, M.; Kintl, A.; Ejaz, M.; Naveed, M. Rhizosphere bacteria in plant growth promotion, biocontrol, and bioremediation of contaminated sites: A comprehensive review of effects and mechanisms. Int. J. Mol. Sci. 2021, 22, 10529. [Google Scholar] [CrossRef]
15. Bhamare, U.U.; Mali, Y.S.; Shaikh, A.Z. Neem: As a natural medicine. Res. J. Pharmacogn. Phytochem. 2020, 12, 245–255. [Google Scholar]
16. Elmer, W.; Datnoff, L. Mineral nutrition and suppression of plant disease. In Encyclopedia of Agriculture and Food Systems; LSU: Baton Rouge, LA, USA, 2014; pp. 231–244. [Google Scholar] [CrossRef]
17. Karikari, S. Estimation of leaf area in papaya (Carica papaya) from leaf measurements. Trop. Agric. 1973, 50, 346. [Google Scholar]
18. Somogyi, M. Notes on sugar determination. J. Biol. Chem. 1952, 195, 19–23. [Google Scholar] [CrossRef]
19. Ranganna, S. Manual of Analysis Fruits and Vegetables; Tata McGraw-Hill: New Delhi, India, 1977; p. 634. [Google Scholar]
20. Nagata, M.; Yamashita, I. Simple method for simultaneous determination of chlorophyll and carotenoids in tomato fruit. J. Japan. Soc. Food Sci. Technol. 1992, 39, 925–928. [Google Scholar] [CrossRef]
21. Moore, D.J. The production and processing of papain. Bull. Trop. Dev. Res. Instt. 1984. [Google Scholar]
22. Dhanam, S. Studies on Papaya Ring Spot Disease. Master’s Thesis, Tamil Nadu Agricultural University, Coimbatore, India, 2006. [Google Scholar]
23. Bhargava, B.; Chadha, K. Leaf nutrient guide for fruit crops. In Advances in Horticulture; Chadha, K., Pareek, O., Eds.; Malhothra Publishing House: New Delhi, India, 1993; Volume 2, pp. 973–1029. [Google Scholar]
24. Arnon, D.I. Copper enzymes in isolated chloroplasts. Polyphenoloxidase in Beta vulgaris. Plant Physiol. 1949, 24, 1–15. [Google Scholar] [CrossRef]
25. Malik, C.P.; Singh, M. Plant Enzymology and Histo-Enzymology; Kalyani Publishers: New Delhi, India, 1980. [Google Scholar]
26. Esterbauer, H.; Schwarzl, E.; Hayn, M. A rapid assay for catechol oxidase and laccase using 2-nitro-5-thiobenzoic acid. Anal. Biochem. 1977, 77, 486–494. [Google Scholar] [CrossRef] [PubMed]
27. Aebi, H. [13] Catalase in vitro. In Methods in Enzymology; Elsevier: Amsterdam, The Netherlands, 1984; Volume 105, pp. 121–126. [Google Scholar]
28. Jaworski, E.G. Nitrate reductase assay in intact plant tissues. Biochem. Biophys. Res. Commun. 1971, 43, 1274–1279. [Google Scholar] [CrossRef] [PubMed]
29. Brueske, C.H. Phenylalanine ammonia lyase activity in tomato roots infected and resistant to the root-knot nematode, Meloidogyne incognita. Physiol. Plant Pathol. 1980, 16, 409–414. [Google Scholar] [CrossRef]
30. Lisec, J.; Schauer, N.; Kopka, J.; Willmitzer, L.; Fernie, A.R. Gas chromatography mass spectrometry–based metabolite profiling in plants. Nat. Protoc. 2006, 1, 387–396. [Google Scholar] [CrossRef]
31. Panse, V.G.; Sukhatme, P.V. Statistical Methods for Agricultural Workers, 2nd ed.; Indian Council of Agricultural Research: New Delhi, India, 1967. [Google Scholar]
32. Team, R.C. R: A Language and Environment for Statistical Computing; R Foundation for Statistical Computing: Vienna, Austria, 2020; Available online: https://www.r-project.org/ (accessed on 20 October 2024).
33. De Mendiburu, F. Agricolae: Statistical Procedures for Agricultural Research. 2020. Available online: https://CRAN.R-project.org/package=agricolae, (accessed on 20 October 2024).
34. Srivastava, R.; Aragno, M.; Sharma, A. Cow dung extract: A medium for the growth of pseudomonads enhancing their efficiency as biofertilizer and biocontrol agent in rice. Indian J. Microbiol. 2010, 50, 349–354. [Google Scholar] [CrossRef] [PubMed]
35. Manivannan, K. Studies on the Efficacy of Foliar Spray of Nutrient Formulation on Growth, Yield, Quality and CMD Incidence in Cassava; Tamil Nadu Agricultural University: Coimbatore, India, 2013. [Google Scholar]
36. Kumar, P.; Kumar, T.; Singh, S.; Tuteja, N.; Prasad, R.; Singh, J. Potassium: A key modulator for cell homeostasis. J. Biotechnol. 2020, 324, 198–210. [Google Scholar] [CrossRef]
37. Kumar, K.N.; Kavitha, C.; Muthuvel, I.; Kalarani, M.; Elaiyabharathi, T. Foliar Application of Nutrient Formulation to Enhance Growth and PRSV Tolerance in Commercial Varieties of Papaya. Int. J. Plant Soil Sci. 2023, 35, 946–953. [Google Scholar] [CrossRef]
38. Manjunatha, S.; Swamy, G.; Prakash, N.; Jagadeesha, R.; Chavan, M.; Shankarappa, K. Effect of Micronutrients and Silicon on Growth and Yield of Papaya cv. Red lady. J. Agric. Res. Technol. 2014, 39, 15–20. [Google Scholar]
39. Subedi, A.; Shrestha, A.; Tripathi, K.; Shrestha, B. Effect of Foliar Spray of Boron and Zinc on Growth and Yield of Papaya (Carica papaya L.) cv. Red Lady in Chitwan, Nepal. Field Crop 2019, 2, 1–6. [Google Scholar]
40. Singh, D.; Ghosh, S.; Paul, P.; Suresh, C. Effect of different micronutrients on growth, yield and quality of papaya (Carica papaya L.) cv. Ranchi. Acta Hortic. 2010, 851, 351–356. [Google Scholar] [CrossRef]
41. Bhalerao, P.; Patel, B. Effect of foliar application of Ca, Zn, Fe and B on growth, yield and quality of papaya var. Taiwan Red Lady. Indian J. Hortic. 2015, 72, 325–328. [Google Scholar] [CrossRef]
42. Bhalerao, P.; Patel, B. Effect of foliar application of Ca, Zn, Fe and B on physiological attributes, nutrient status, yield and economics of papaya (Carica papaya L.) cv. Taiwan Red lady. Madras Agric. J. 2012, 99, 298–300. [Google Scholar]
43. Pareek, S.; Sagar, N.A.; Sharma, S.; Kumar, V.; Agarwal, T.; González-Aguilar, G.A.; Yahia, E.M. Chlorophylls: Chemistry and biological functions. In Fruit and Vegetable Phytochemicals: Chemistry and Human Health, 2nd ed.; Yahia, E.M., Ed.; Wiley-Blackwell: Hoboken, NJ, USA, 2017; Volume 1, pp. 269–284. [Google Scholar]
44. Reddy, P.V.K.; Gowda, V.N. Influence of greenhouse cultivation on fruit quality of ‘Red Lady’papaya. In Proceedings of the International Symposium on Tropical and Subtropical Fruits, Chiang Mai, Thailand, 12 March 2014; pp. 109–114. [Google Scholar]
45. Gupta, R.; Verma, N.; Tewari, R.K. Micronutrient deficiency-induced oxidative stress in plants. Plant Cell Rep. 2024, 43, 213. [Google Scholar] [CrossRef]
46. Everse, J. Heme Proteins. In Heme Proteins, 2nd ed.; Elsevier: Amsterdam, The Netherlands, 2013; pp. 532–538. [Google Scholar] [CrossRef]
47. Yue, Z.; Chen, Y.; Chen, C.; Ma, K.; Tian, E.; Wang, Y.; Liu, H.; Sun, Z. Endophytic Bacillus altitudinis WR10 alleviates Cu toxicity in wheat by augmenting reactive oxygen species scavenging and phenylpropanoid biosynthesis. J. Hazard. Mater. 2021, 405, 124272. [Google Scholar] [CrossRef] [PubMed]
48. Thakker, J.N.; Patel, S.; Dhandhukia, P.C. Induction of defense-related enzymes in banana plants: Effect of live and dead pathogenic strain of Fusarium oxysporum f. sp. cubense. Int. Sch. Res. Not. 2013, 2013, 601303. [Google Scholar] [CrossRef] [PubMed]
49. Scibior, D.; Czeczot, H. Katalaza–budowa, właściwości, funkcje [Catalase: Structure, properties, functions]. Postep. Hig Med. Dosw. 2006, 60, 170–180. [Google Scholar]
50. Fan, H.; Yan, X.; Fu, M.; Liu, D.; Awan, A.W.; Chen, P.; Rasheed, S.M.; Gao, L.; Zhang, R. Interactive effect of biological agents chitosan, Lentinan and Ningnanmycin on papaya ringspot virus resistance in papaya (Carica papaya L.). Molecules 2022, 27, 7474. [Google Scholar] [CrossRef] [PubMed]
51. Lian, L.; Xie, L.; Zheng, L.; Lin, Q. Induction of systemic resistance in tobacco against Tobacco mosaic virus by Bacillus spp. Biocontrol Sci. Technol. 2011, 21, 281–292. [Google Scholar] [CrossRef]
52. Miljaković, D.; Marinković, J.; Balešević-Tubić, S. The significance of Bacillus spp. in disease suppression and growth promotion of field and vegetable crops. Microorganisms 2020, 8, 1037. [Google Scholar] [PubMed]
53. Jian, W.; Zhang, D.-W.; Zhu, F.; Wang, S.-X.; Zhu, T.; Pu, X.-J.; Zheng, T.; Feng, H.; Lin, H.-H. Nitrate reductase-dependent nitric oxide production is required for regulation alternative oxidase pathway involved in the resistance to Cucumber mosaic virus infection in Arabidopsis. Plant Growth Regul. 2015, 77, 99–107. [Google Scholar] [CrossRef]
54. Ranasinghe, C.; De Costa, D. Field Performance of Mixtures of Pseudomonas and Bacillus spp. in Managing Papaya Ringspot Virus Disease and their Effect on Plant Defense Enzyme Activity. Trop. Agric. Res. 2020, 31, 75–85. [Google Scholar]
55. Sagar, S.; Singh, A.; Bala, J.; Chauhan, R.; Kumar, R.; Bhatia, R.K.; Walia, A. Insights into Cow Dung-Based Bioformulations for Sustainable Plant Health and Disease Management in Organic and Natural Farming System: A Review. J. Soil Sci. Plant Nutr. 2023, 24, 30–53. [Google Scholar] [CrossRef]
56. Raja, M.E. Importance of micronutrients in the changing horticultural scenario in India. J. Hortic. Sci. 2009, 4, 1–27. [Google Scholar] [CrossRef]
57. Thakur, S.; Sinha, A.; Ghosh Bag, A. Boron-a critical element for fruit nutrition. Commun. Soil Sci. Plant Anal. 2023, 54, 2899–2914. [Google Scholar] [CrossRef]
58. Babu, R.; Tripathi, V. Impact of foliar application of NAA, Zinc and Boron on growth, yield and quality parameters of Guava (Psidium guajava L.). Progress. Agric. 2022, 22, 190–194. [Google Scholar] [CrossRef]
59. Moganapathi, B.; Kavitha, C.; Pugalendhi, L.; Kalarani, M.K. Effect of Nutrient Formulation on Shelf Life and Quality Attributes of Papaya (Carica papaya L.). Biol. Forum—Int. J. 2022, 14, 348–352. [Google Scholar]
60. Ishwariya, R.; Sivakumar, V.; Shanmugasundaram, K.; Vanitha, K.; Seenivasan, N.; Muthuvel, I. Nutri-hormonal Manipulation for Yield and Quality Improvement in Guava (Psidium guajava L.). Int. J. Environ. Clim. Change 2023, 13, 3494–3502. [Google Scholar] [CrossRef]
61. Kavitha, M.; Kumar, N.; Jeyakumar, P. Role of zinc and boron on fruit yield and associated characters in papaya cv. Co. 5. South Indian Hortic. 2000, 48, 6–10. [Google Scholar]
62. Ball, J.A. Evaluation of Two Lipid-Based Edible Coatings for Their Ability to Preserve Post Harvest Quality of Green Bell peppers. Ph.D. Thesis, Faculty of the Virginia Polytecnic Institute and state University, Blacksburg, VA, USA, 1997. [Google Scholar]
63. Zelená, E.; Holasová, M.; Zelený, F.; Fiedlerová, V.; Novotná, P.; Landfeld, A.; Houška, M. Effect of sulphur fertilisation on lycopene content and colour of tomato fruits. Czech J. Food Sci. 2009, 27, S80–S84. [Google Scholar] [CrossRef]
64. Ortiz, A.; Graell, J.; Lara, I. Preharvest calcium applications inhibit some cell wall-modifying enzyme activities and delay cell wall disassembly at commercial harvest of ‘Fuji Kiku-8′ apples. Postharvest Biol. Technol. 2011, 62, 161–167. [Google Scholar] [CrossRef]
65. Huang, W.; Shi, Y.; Yan, H.; Wang, H.; Wu, D.; Grierson, D.; Chen, K. The calcium-mediated homogalacturonan pectin complexation in cell walls contributes the firmness increase in loquat fruit during postharvest storage. J. Adv. Res. 2023, 49, 47–62. [Google Scholar] [CrossRef]
66. Irfan, P.; Vanjakshi, V.; Prakash, M.K.; Ravi, R.; Kudachikar, V. Calcium chloride extends the keeping quality of fig fruit (Ficus carica L.) during storage and shelf-life. Postharvest Biol. Technol. 2013, 82, 70–75. [Google Scholar] [CrossRef]
67. Schröder, E.; Phillips, C.; Garman, E.; Harlos, K.; Crawford, C. X-ray crystallographic structure of a papain-leupeptin complex. FEBS Lett. 1993, 315, 38–42. [Google Scholar] [CrossRef] [PubMed]
68. Akino, A.; Soorianathasundaram, K.; Paramaguru, P.; Jeyakumar, P.; Muthulakshmi, P. Influence of bioregulators on latex yield and proteolytic activity of papain extracted from field-grown TNAU papaya CO. 8 under the natural incidence of papaya ring spot virus. Madras Agric. J. 2021, 108, 266–274. [Google Scholar]
69. Wang, X.; Zhao, D.; Shen, L.; Jing, C.; Zhang, C. Application and mechanisms of Bacillus subtilis in biological control of plant disease. In Role of Rhizospheric Microbes in Soil; Meena, V.S., Ed.; Stress management and agricultural sustainability; Springer: Singapore, 2018; Volume 1, pp. 225–250. [Google Scholar]
70. Lowery, D.T.; Isman, M.B. Antifeedant activity of extracts from neem, Azadirachta indica, to strawberry aphid, Chaetosiphon fragaefolii. J. Chem. Ecol. 1993, 19, 1761–1773. [Google Scholar] [CrossRef] [PubMed]
71. Deepika, S.; Manoranjitham, S.; Sendhilvel, V.; Karthikeyan, G.; Kavitha, C. Foliar nutrition enhances the host immunity against papaya ringspot virus. Pharma Innov. 2021, 10, 165–169. [Google Scholar]
72. Reena, B.; Kavitha, C.; Pugalendhi, L.; Kalarani, M.; Manoranjitham, S. Effect of foliar application of nutrient formulation on growth, yield and PRSV incidence of papaya (Carica papaya L.). Biol. Forum—Int. J. 2022, 14, 53–56. [Google Scholar]
73. More, P.; Agarwal, P.; Agarwal, P.K. The Jatropha leaf curl Gujarat virus on infection in Jatropha regulates the sugar and tricarboxylic acid cycle metabolic pathways. 3 Biotech 2022, 12, 275. [Google Scholar] [CrossRef]
74. Chen, H.-C.; Zhang, S.-L.; Wu, K.-J.; Li, R.; He, X.-R.; He, D.-N.; Huang, C.; Wei, H. The effects of exogenous organic acids on the growth, photosynthesis and cellular ultrastructure of Salix variegata Franch. Under Cd stress. Ecotoxicol. Environ. Saf. 2020, 187, 109790. [Google Scholar] [CrossRef]
75. Tauzin, A.S.; Giardina, T. Sucrose and invertases, a part of the plant defense response to the biotic stresses. Front. Plant Sci. 2014, 5, 293. [Google Scholar] [CrossRef]
76. Cvetkovska, M.; Vanlerberghe, G.C. Coordination of a mitochondrial superoxide burst during the hypersensitive response to bacterial pathogen in Nicotiana tabacum. Plant Cell Environ. 2012, 35, 1121–1136. [Google Scholar] [CrossRef] [PubMed]
77. Colombatti, F.; Gonzalez, D.H.; Welchen, E. Plant mitochondria under pathogen attack: A sigh of relief or a last breath? Mitochondrion 2014, 19, 238–244. [Google Scholar] [CrossRef] [PubMed]
78. Araújo, W.L.; Martins, A.O.; Fernie, A.R.; Tohge, T. 2-Oxoglutarate: Linking TCA cycle function with amino acid, glucosinolate, flavonoid, alkaloid, and gibberellin biosynthesis. Front. Plant Sci. 2014, 5, 552. [Google Scholar] [CrossRef]
79. Wu, N.; Yang, M.; Gaur, U.; Xu, H.; Yao, Y.; Li, D. Alpha-ketoglutarate: Physiological functions and applications. Biomol. Ther. 2016, 24, 1–8. [Google Scholar] [CrossRef]
80. Boubakri, H. The role of ascorbic acid in plant–pathogen interactions. In Ascorbic Acid in Plant Growth, Development and Stress Tolerance; Hossain, M.A., Munné-Bosch, S., Burritt, D.J., Diaz-Vivancos, P., Fujita, M., Lorence, A., Eds.; Springer: Cham, Switzerland, 2017; pp. 255–271. [Google Scholar]
81. Suekawa, M.; Fujikawa, Y.; Esaka, M. Physiological role of ascorbic acid recycling enzymes in plants. In Ascorbic Acid in Plant Growth, Development and Stress Tolerance; Hossain, M.A., Munné-Bosch, S., Burritt, D.J., Diaz-Vivancos, P., Fujita, M., Lorence, A., Eds.; Springer: Cham, Switzerland, 2017; pp. 355–373. [Google Scholar]
82. Wang, S.-D.; Zhu, F.; Yuan, S.; Yang, H.; Xu, F.; Shang, J.; Xu, M.-Y.; Jia, S.-D.; Zhang, Z.-W.; Wang, J.-H. The roles of ascorbic acid and glutathione in symptom alleviation to SA-deficient plants infected with RNA viruses. Planta 2011, 234, 171–181. [Google Scholar] [CrossRef]
83. Burbidge, C.A.; Ford, C.M.; Melino, V.J.; Wong, D.C.J.; Jia, Y.; Jenkins, C.L.D.; Soole, K.L.; Castellarin, S.D.; Darriet, P.; Rienth, M. Biosynthesis and cellular functions of tartaric acid in grapevines. Front. Plant Sci. 2021, 12, 643024. [Google Scholar] [CrossRef] [PubMed]
84. An, C.; Mou, Z. Salicylic acid and defense responses in plants. In Phytohormones: A Window to Metabolism, Signaling and Biotechnological Applications; Tran, L.-S.P., Pal, S., Eds.; Springer: New York, NY, USA, 2014; pp. 191–219. [Google Scholar]
85. Singh, D.P.; Moore, C.A.; Gilliland, A.; Carr, J.P. Activation of multiple antiviral defence mechanisms by salicylic acid. Mol. Plant Pathol. 2004, 5, 57–63. [Google Scholar] [CrossRef] [PubMed]
86. Lattanzio, V.; Lattanzio, V.M.; Cardinali, A. Role of phenolics in the resistance mechanisms of plants against fungal pathogens and insects. Phytochem. Adv. Res. 2006, 661, 23–67. [Google Scholar]
87. Dixon, R.A.; Barros, J. Lignin biosynthesis: Old roads revisited and new roads explored. Open Biol. 2019, 9, 190215. [Google Scholar] [CrossRef] [PubMed]
88. Wang, Y.; Sheng, L.; Zhang, H.; Du, X.; An, C.; Xia, X.; Chen, F.; Jiang, J.; Chen, S. CmMYB19 over-expression improves aphid tolerance in chrysanthemum by promoting lignin synthesis. Int. J. Mol. Sci. 2017, 18, 619. [Google Scholar] [CrossRef] [PubMed]
Chinnasamy K, Krishnan NK, Balasubramaniam M, Balamurugan R, Lakshmanan P, Karuppasami KM, Karuppannan MS, Thiyagarajan E, Alagarswamy S, Muthusamy S. Nutrient Formulation—A Sustainable Approach to Combat PRSV and Enhance Productivity in Papaya. Agriculture. 2025; 15(2):201. https://doi.org/10.3390/agriculture15020201
Перевод статьи «Nutrient Formulation—A Sustainable Approach to Combat PRSV and Enhance Productivity in Papaya» авторов Chinnasamy K, Krishnan NK, Balasubramaniam M, Balamurugan R, Lakshmanan P, Karuppasami KM, Karuppannan MS, Thiyagarajan E, Alagarswamy S, Muthusamy S., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык

































































































Комментарии (0)