Секрет быстрого откорма: меласса и особая мочевина увеличивают привесы быков голштинской породы
Целью данного исследования было изучение влияния различных комбинаций уровней патоки и медленнодействующей мочевины на бычков голштинской породы на откорме. Шестьдесят бычков голштинской породы схожего возраста, веса и состояния здоровья были случайным образом разделены на четыре группы по пятнадцать голов в каждой. Все схемы кормления были следующими: (1) группа на основном рационе (CON, контроль); (2) группа с 2% патоки и медленнодействующей мочевиной (LMU); (3) группа с 4% патоки и медленнодействующей мочевиной (MMU); (4) группа с 6% патоки и медленнодействующей мочевиной (HMU).
Аннотация
Результаты исследования показали, что группа MMU продемонстрировала выдающиеся показатели: средний суточный привес увеличился на 13,3% по сравнению с контрольной группой, конверсия корма достоверно снизилась (p < 0,05), а кажущаяся переваримость сырого протеина достоверно возросла (p < 0,05). В отношении биохимических показателей сыворотки крови, концентрации аммиака и аланинаминотрансферазы (АЛТ) в крови были достоверно выше в группе MMU по сравнению с CON (p < 0,05). Уровень pH рубца во всех опытных группах был ниже, чем в контроле (p < 0,05), тогда как концентрации микробного сырого протеина (MCP), а также уксусной, пропионовой кислот и общих летучих жирных кислот (TVFA) были достоверно выше в группах MMU и HMU (p < 0,05).
Доминирующими типами микроорганизмов во всех группах были Bacteroidetes, Firmicutes и Patescibacteria. Относительная численность Bacteroidetes в группе MMU увеличилась на 5,47% по сравнению с контрольной группой. В группе MMU по сравнению с контролем относительная численность семейств Prevotellaceae, Lachnospiraceae и Ruminococcaceae увеличилась на 9,03%, 0,67% и 3,43% соответственно.
Анализ экономической эффективности показал, что в группе MMU стоимость суточного рациона откормочного бычка снизилась на 1,62 юаня (RMB), а суточная прибыль от содержания каждого животного увеличилась на 7,19 юаня.
В заключение, рацион с 4% патоки и медленнодействующей мочевиной (MMU) эффективно улучшил продуктивность роста откармливаемых бычков, оптимизировал рубцовое брожение, снизил затраты и повысил прибыль, что делает его питательной стратегией, имеющей высокую практическую ценность.
1. Введение
Белок в корме предоставляет незаменимые аминокислоты и источники азота для микроорганизмов рубца у жвачных животных; однако пищевые белки обычно получают из более дорогих кормов, таких как соевый шрот. Небелковый азот широко используется в рационах жвачных для замены части кормовых белков из-за его низкой стоимости [1]. Азот в корме часто не полностью используется микроорганизмами рубца из-за асинхронности поставки и высвобождения энергии, что приводит к увеличению выбросов азота с мочой, которые преобразуются в аммиак или закись азота, усиливая выбросы парниковых газов. Бактерии, растворяющие мочевину, являются наиболее важными организмами в рубце, производящими фермент уреазу, который расщепляет мочевину до NH₃ для синтеза микробного белка [2]. Гидролиз мочевины с образованием NH₃ происходит быстро и превышает его утилизацию микроорганизмами рубца для производства микробных белков, вызывая высвобождение энергии азота, которое не синхронизировано, и приводя к потере азота и загрязнению окружающей среды [3,4]. Когда концентрация NH₃-N превышала 30 мг/л, эффективность утилизации аммиака значительно снижалась, а избыточный аммиак всасывался в кровоток и превращался в аммиак крови, что могло привести к гипераммониемии и метаболической нагрузке на печень. Дальнейшие исследования показали, что высокие концентрации NH₃ также косвенно снижали использование корма, влияя на баланс pH рубца и подавляя активность рубцовых бактерий, разлагающих клетчатку [5]. Поэтому для оптимизации среды рубца и здоровья животных необходимо регулировать поставку азота путем точного составления рациона, чтобы поддерживать концентрацию NH₃-N в соответствующем диапазоне. Мочевина гидролизуется и высвобождает избыточный аммиак (NH₃) в желудочно-кишечный тракт, где он всасывается и вызывает гипераммониемию [6]. Таким образом, баланс между скоростями гидролиза и усвоения NH₃ имеет ключевое значение для эффективного использования жвачными любого азота. Для замедления скорости гидролиза мочевины использовались различные методы, такие как увеличение скорости высвобождения энергии и замедление высвобождения мочевины [7].
Предыдущие исследования показали, что с увеличением общего содержания сахара в рационе концентрация аммиачного азота в рубце снижалась линейно, а скорость потери мочевины через рубец значительно снижалась [8,9]. По сравнению с другими источниками углерода (такими как крахмал или целлюлоза) патока может предоставить большое количество легкодоступной энергии за короткий период времени, что может эффективно улучшить коэффициент использования азота и скорость синтеза белка микроорганизмами [10]. Улучшение статуса брожения увеличило потребность в NH₃-N для рубцовых бактерий [11]. Для полного использования мочевины и поддержания эффективности рубцовой микробиоты добавки на основе крахмала и патоки использовались для достижения баланса энергии и азота у коз [12,13].
Многочисленные исследования подтвердили, что использование мочевины жвачными животными может быть улучшено путем корректировки стратегий кормления. Однако использование патоки в качестве источника энергетической добавки для улучшения использования азота мочевины у откармливаемых бычков голштинской породы не изучалось. Следовательно, целью данного эксперимента было изучение влияния добавления различных уровней патоки и медленнодействующей мочевины на показатели, биохимические показатели сыворотки крови и микробиоту рубца откармливаемых коров голштинской породы. Хотя результаты исследования способствовали пониманию функции рубца, все еще существует необходимость в углубленном изучении их влияния на качество мяса бычков на откорме. Однако различия в источнике патоки и процессе приготовления могут повлиять на обобщаемость результатов, и из-за короткого экспериментального периода длительные и кумулятивные эффекты двух продуктов требуют дополнительного исследования. Тем не менее, мы считаем, что соответствующие дозы патоки и медленнодействующей мочевины могут регулировать структуру сообществ микроорганизмов рубца и улучшать эффективность использования корма, тем самым способствуя росту.
2. Материалы и методы
2.1. Животные, рационы и схема эксперимента
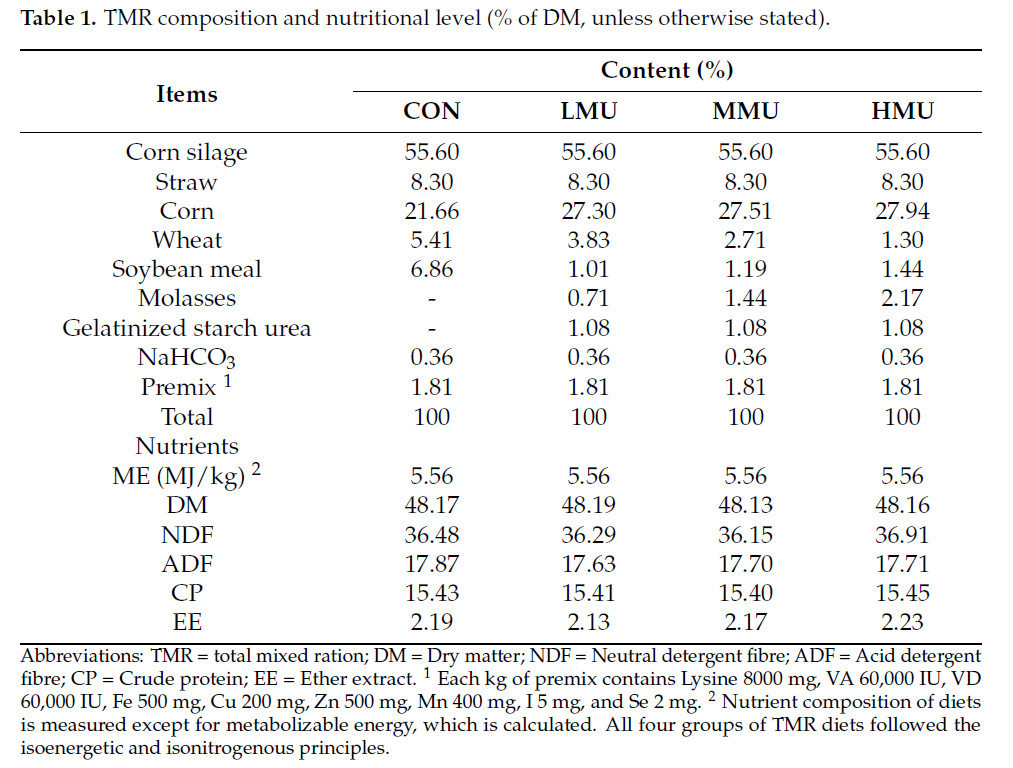
Данный эксперимент был одобрен Комитетом Колледжа зоотехники и технологий Аньхойского сельскохозяйственного университета (№ SYDW-P20190600601). Период испытания — с 28 января 2024 г. по 26 февраля 2024 г. Шестьдесят бычков голштинской породы на откорме схожего возраста (13,5 ± 2 мес.), живой массы (450 ± 30 кг) и состояния здоровья были случайно отобраны и разделены на четыре группы по пятнадцать бычков в каждой: (1) контрольная группа (CON): группа получала полносмешанный рацион (TMR) без патоки и медленнодействующей мочевины; (2) группа с низким уровнем патоки и медленнодействующей мочевиной (LMU): использование 2% (от сухого вещества TMR) патоки (содержание общего сахара 41%, Heli Co., Ltd., Вэйфан, Китай) и 3% (от сухого вещества TMR) желатинизированной крахмальной мочевины (70% мочевины, Huarui, Co., Ltd., Хэфэй, Китай) для замены изокалорийных и изоазотистых частей в TMR; (3) группа со средним уровнем патоки и медленнодействующей мочевиной (MMU): 4% (от сухого вещества TMR) патоки и 3% (от сухого вещества TMR) желатинизированной крахмальной мочевины использовались для замены изокалорийных и изоазотистых частей в TMR; и (4) группа с высоким уровнем патоки и медленнодействующей мочевиной (HMU): 6% (от сухого вещества TMR) патоки и 3% (от сухого вещества TMR) желатинизированной крахмальной мочевины использовались для замены изокалорийных и изоазотистых частей в TMR. Предварительный период длился 7 дней, а весь эксперимент — 30 дней. Бычкам голштинской породы на откорме скармливали рацион вволю, с целевым уровнем остатков 5%. Экспериментальные группы получали рацион TMR два раза в день в 9:00 и 16:00, и скот кормили и поили свободно. Каждый день во второй половине дня навоз, скопившийся в коровнике, убирали, а коровник опрыскивали для дезинфекции. Все рационы были составлены в соответствии с NRC (2001) и стандартом кормления молочного скота Министерства сельского хозяйства Китая (NY/T 34-2004). В таблице 1 показан состав TMR и уровни питательных веществ.
Таблица 1. Состав TMR и уровень питательных веществ (% от СВ, если не указано иное).
2.2. Анализ корма
В течение испытательного периода образцы TMR отбирали в течение 2 последовательных дней в неделю методом 5-точечного отбора проб, собранные образцы смешивали, сушили при 65 °C в течение 48 ч, измельчали и гомогенно смешивали, а затем герметично упаковывали в самозакрывающиеся пакеты для определения питательного состава кормов. Перед окончанием эксперимента из каждой группы случайным образом отбирали 10 бычков голштинской породы на откорме, и образцы фекалий собирали через прямую кишку на 30-й и 31-й дни. Образцы фекалий, собранные за 2 дня, разделяли на две части. В каждые 100 г свежего навоза добавляли 10 мл 10% HCl, часть образца обрабатывали для фиксации азота, а другую часть образца тщательно смешивали и замораживали при -20 °C для последующего определения кажущейся переваримости. Стандартная процедура Ассоциации официальных химиков-аналитиков [14] использовалась для анализа СВ (сухого вещества), ОВ (органического вещества), сырого протеина (CP) и содержания золы в корме. Нейтрально-детергентная клетчатка (NDF) и кислотно-детергентная клетчатка (ADF) измерялись согласно Ван Сусту и др. [15].
2.3. Отбор и анализ крови
Из каждой группы отбирали по десять бычков голштинской породы на откорме, и кровь собирали через хвостовую вену перед утренним кормлением на 30-й день экспериментального периода, помещая ее в 10-миллилитровые пробирки без антикоагулянта (Kangwei Shi Medical Technology, Co., Ltd., Шицзячжуан, Китай). Крови давали отстояться до отделения супернатанта, а затем центрифугировали (3500 об/мин, 15 мин, Shanghai Lu Xiangyi Centrifuge Instrument, Co., Ltd., Шанхай, Китай). После центрифугирования сыворотку и плазму разделяли в пробирки объемом 1,5 мл (Beijing Labgic Technology Co., Ltd., Пекин, Китай) и хранили при -20 °C. Измерения включали общий белок (TP), альбумин (ALB), аланинаминотрансферазу (ALT), аспартатаминотрансферазу (AST), щелочную фосфатазу (ALP), лактатдегидрогеназу (LDH), азот мочевины, азот мочевины крови (BUN), аммиак (AN), мочевую кислоту (UA) и креатинин (CREA). Анализы образцов крови выполняла компания Beijing Huaying Biotechnology.
2.4. Отбор и анализ рубцовой жидкости
На 30-й день экспериментального периода, через 2 ч после кормления бычков, из каждой группы отбирали по 6 животных для сбора рубцовой жидкости. Рубцовую жидкость собирали с помощью пробоотборника рубцовой жидкости (Kelibo, Co., Ltd., Ухань, Китай), и через рот и пищевод вводили катетер для отбора проб в рубец; 100 мл рубцовой жидкости, собранной в начале сбора, отбрасывали, и продолжали сбор примерно 200 мл рубцовой жидкости. Уровень pH образцов рубцовой жидкости измеряли сразу после сбора с помощью портативного pH-метра (Yidian Scientific Instrument Co., Ltd., Шанхай, Китай). Каждый образец рубцовой жидкости фильтровали через четыре слоя марли, и одну часть образца хранили в холодильнике при -20 °C для анализа NH₃-N, микробного белка (MCP) и летучих жирных кислот (VFA) соответственно. Другую часть быстро упаковывали в криопробирки и сохраняли в сосудах Дьюара с жидким азотом. Впоследствии их переносили для замораживания и хранения при -80° C и использовали для определения 16S рРНК рубцовых бактерий. Содержание MCP определяли методом Кумасси Бриллиантового Синего, абсорбцию профильтрованной ферментационной жидкости определяли с помощью спектрофотометра, а содержание MCP рассчитывали по регрессионной формуле на основе свойства связывания красителя Кумасси Бриллиантовый Синий G-250 с белком [16]. Аммиачный азот измеряли с помощью фенол-гипохлоритного метода [17].
Для определения летучих жирных кислот в рубцовой жидкости использовали газовый хроматограф GC-2010 (Shimadzu, Япония). Обработку рубцовой жидкости проводили следующим образом: Рубец центрифугировали при 12000 об/мин в течение 10 мин, затем к 1 мл супернатанта добавляли 0,2 мл смеси кротоновой кислоты и метафосфорной кислоты, тщательно перемешивали, снова фильтровали через игольчатую фильтровальную мембрану, а затем автоматически вводили в систему для анализа. Условия определения: колонка представляла собой капиллярную колонку wonda cap wax (длиной 30,0 мм, толщиной пленки 0,25 мкм и внутренним диаметром 0,25 мм). Температура испарительной камеры составляла 200 °C, а температура детектора FID — 220 °C. Температуру колонки определяли методом программируемого повышения температуры, с начальной температурой 80 °C, конечной температурой 170 °C и скоростью повышения 15 °C/мин, а в качестве внутреннего стандарта использовали кротоновую кислоту.
2.5. Измерение продуктивности роста
Взвешивание проводили один раз в начале экспериментального периода и один раз в конце экспериментального периода, каждый раз перед утренним кормлением. В течение экспериментального периода потребление корма подопытными животными регистрировали в течение 2 последовательных дней в неделю, а также рассчитывали среднесуточный прирост и коэффициент затрат корма на прирост.
Среднесуточный прирост (ADG) = (конечный вес − начальный вес) / дни испытания
Суточное потребление сухого вещества (DMI) = количество корма − количество остаточного корма
Коэффициент затрат корма на прирост (F/G) = общее потребление корма / общий привес
2.6. Анализ бактериального сообщества в рубце
Геномную ДНК экстрагировали из рубцовой жидкости с помощью набора FastDNA Spin Kit for Soil (Meiji Bio Ltd., Шанхай, Китай) после оттаивания 1 мл рубцовой жидкости при 4 °C. Концентрацию и чистоту геномной ДНК определяли с помощью ультрамикроспектрофотометра (NanoDrop2000, Thermo Fisher Scientific, Уолтем, Массачусетс, США). Для этой цели были выбраны фрагменты универсального бактериального гена 16S рРНК в области V3–V4, и для ПЦР-амплификации использовались бактериальные прямой праймер 338F (5′-ACTCCTACGGGGAGGCAGCAG-3′) и обратный праймер 806R (5′-GGACTACHVGGGTWTCTAAT3′). Продукты ПЦР идентифицировали, очищали и количественно определяли с помощью электрофореза в 2% агарозном геле, а очистку проводили с использованием набора для выделения и очистки ДНК из геля (PCR Clean-Up Kit, Passover, Шанхай, Китай). Продукты ПЦР детектировали и количественно определяли с использованием прибора Qubit 4.0 (Thermo Fisher Scientific, США). Библиотеки строили с использованием набора NEXTFLEX Rapid DNA-Seq Kit, а полученные амплифицированные фрагменты секвенировали на платформе для секвенирования Illumina Miseq PE300. Необработанные последовательности контролировали по качеству с помощью программного обеспечения fastp (версия 20.0) и соединяли с помощью программного обеспечения FLASH (версия 1.2.7). Используя программное обеспечение UPARSE (версия 11), в соответствии с 97% сходством последовательностей проводили кластеризацию в операционные таксономические единицы (OTU), последовательности после кластеризации и фильтрации химер использовали для получения репрезентативных последовательностей OTU, используемых для классификации видов. Таксономическую аннотацию видов OTU выполняли с помощью классификатора RDP (версия 2.11) с порогом достоверности 70% и подсчитывали состав сообщества каждого образца на разных уровнях таксономии видов (Тип, Семейство, Род). Все анализы данных выполнялись на платформе Meggie BioCloud (https://cloud.majorbio.com, доступ 11 марта 2024 г.), как описано ниже.
Анализ разнообразия в основном включает альфа-разнообразие и бета-разнообразие. Альфа-разнообразие содержит два фактора: богатство и выравненность видового состава в образцах, которые обычно оцениваются по индексам ACE, Chao1, Шеннона и Симпсона. Бета-разнообразие сравнивает состав микробных сообществ разных образцов. Здесь различия между образцами различных обработок в основном демонстрировались с помощью анализа главных координат (PCoA). Пакет vegan в R использовался для анализа PCoA сообществ рубцовых микроорганизмов на основе алгоритма расстояния Брея–Кертиса и визуализировался с помощью пакета ggplot2. Анализ сходства также проводился с помощью пакета vegan (ANOSIM) для указания сходства сообществ. Анализ различий между группами: различия в микробных компонентах анализировались в основном с помощью линейного дискриминантного анализа (LDA), анализа эффекта размера (LEfSE), а также, во вторую очередь, с помощью LDA для оценки величины влияния численности каждого вида на дифференциальный эффект.
2.7. Статистический анализ
Статистический анализ проводили с использованием SPSS (версия 26, IBM, США) для оценки межгрупповых различий в продуктивности роста, сывороточных параметрах, рубцовых параметрах и численности бактерий у откармливаемых коров голштинской породы при использовании различных комбинаций кормления. Нормальность распределения переменных оценивали с помощью теста Шапиро–Уилка, который показал, что ни одна из переменных существенно не отклонялась от нормального распределения (p > 0,05), и предположение о нормальности выполнялось. Впоследствии однородность дисперсии проверяли с помощью теста Левена, и результаты показали, что предположение об однородности дисперсии выполнялось (p > 0,05). На этой основе изменения зависимых переменных при различных комбинациях кормления оценивали с помощью однофакторного дисперсионного анализа (ANOVA), при этом уровень значимости был установлен на p < 0,05. Если наблюдались значительные различия, множественные сравнения проводились с использованием апостериорного теста Дункана для выявления различий между группами.
3. Результаты
3.1. Продуктивность роста
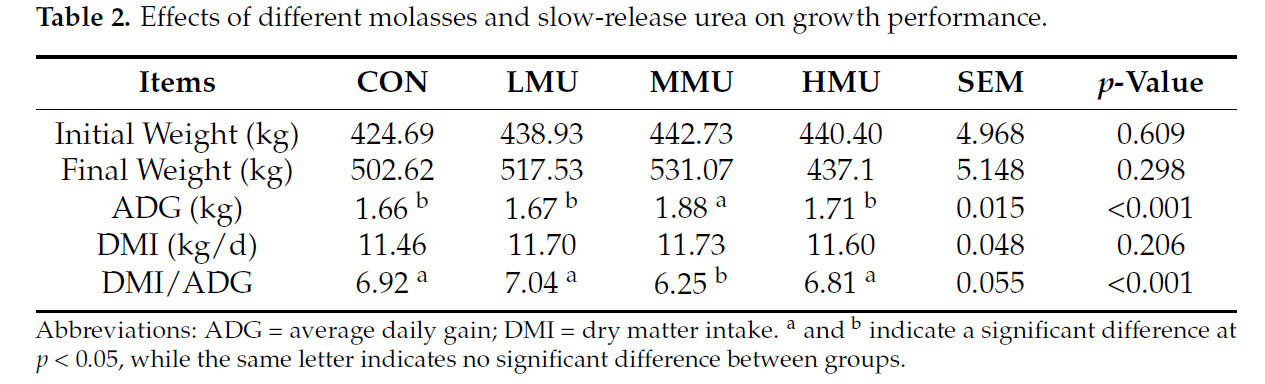
Результаты продуктивности роста представлены в таблице 2. ADG и FCR в группе MMU были значительно выше, чем в группе CON и других опытных группах (p < 0,05), а DMI в группе MMU не отличался значительно от такового в группе CON и других опытных группах.
Таблица 2. Влияние различных уровней патоки и медленнодействующей мочевины на продуктивность роста.
3.2. Переваримость питательных веществ
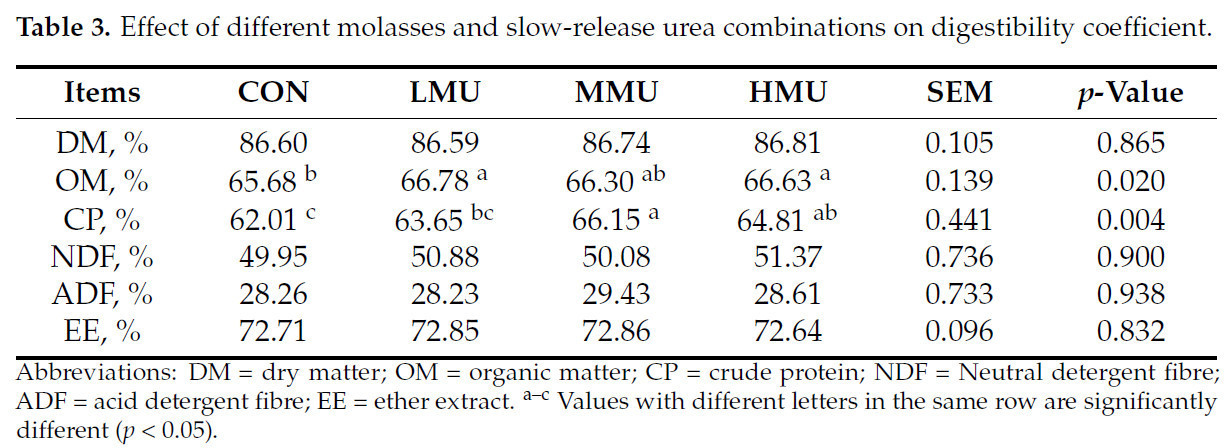
Переваримость питательных веществ показана в таблице 3. Кажущаяся переваримость ОВ и СР была выше, чем в CON, во всех опытных группах. Кажущаяся переваримость ОВ была значительно выше, чем в CON, как в группе LMU, так и в группе HMU (p < 0,05). Кажущаяся переваримость СР была значительно выше, чем в CON и LMU, в группе MMU (p < 0,05), и не отличалась от таковой в группе HMU. Различия в кажущейся переваримости СВ и СЖ между опытными группами были не значительны.
Таблица 3. Влияние различных комбинаций патоки и медленнодействующей мочевины на коэффициент переваримости.
3.3. Биохимия сыворотки крови
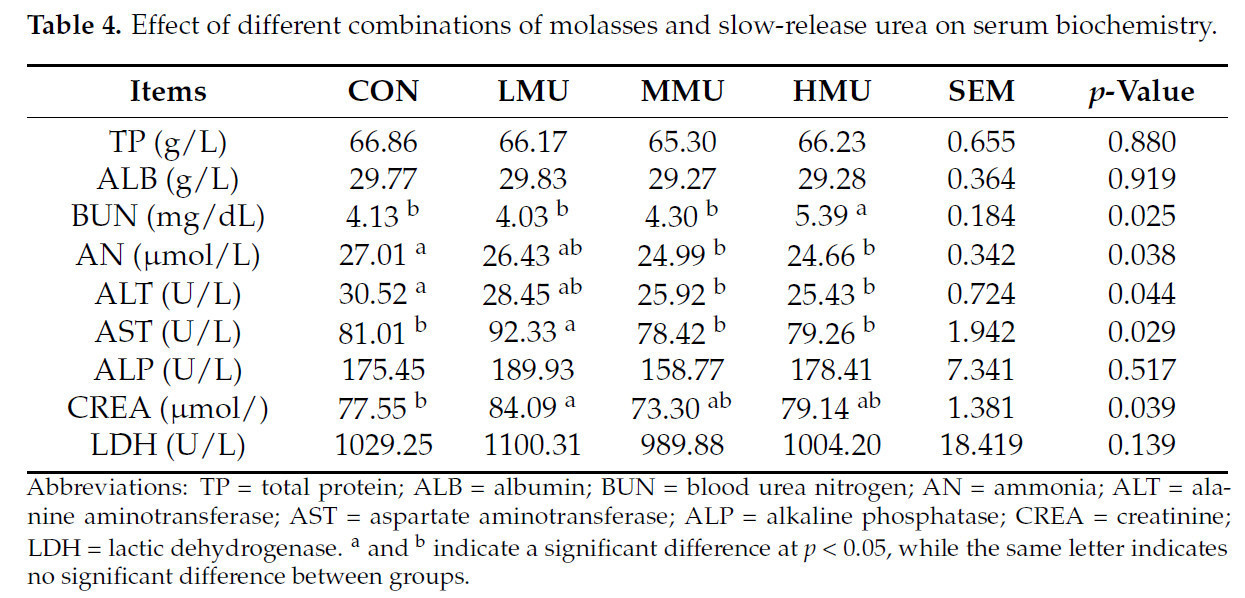
Результаты испытаний сывороточных показателей показаны в таблице 4. Концентрация BUN в группе HMU была значительно выше, чем в трех других группах (p < 0,05). Концентрация AN и ALT как в группе MMU, так и в группе HMU была значительно ниже, чем в группе CON (p < 0,05). Концентрация AST и CREA в группе LMU была значительно выше, чем в группе CON (p < 0,05), и не было значительных различий в TP, ALB, UA и LDH между опытными группами.
Таблица 4. Влияние различных комбинаций патоки и медленнодействующей мочевины на биохимию сыворотки крови.
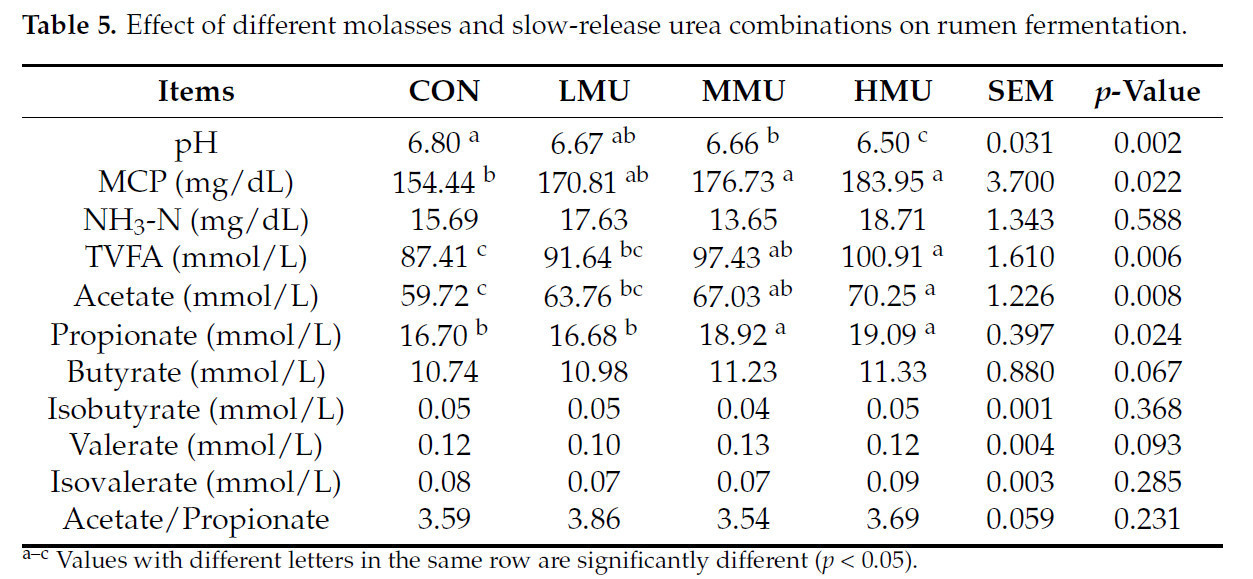
3.4. Рубцовое брожение
Результаты испытаний рубцовой жидкости показаны в таблице 5. Рубецовый pH был значительно ниже (p < 0,05) во всех опытных группах по сравнению с CON. Содержание MCP было значительно выше (p < 0,05) во всех опытных группах по сравнению с CON, а содержание уксусной кислоты, пропионовой кислоты и TVFA было значительно выше (p < 0,05) в группах MMU и HMU по сравнению с CON. Не было значительных различий в NH₃-N, масляной кислоте, изомасляной кислоте, валериановой кислоте, изовалериановой кислоте или соотношении пропионат/ацетат между опытными группами.
Таблица 5. Влияние различных комбинаций патоки и медленнодействующей мочевины на рубцовое брожение.
3.5. Анализ разнообразия рубцовой микробиоты
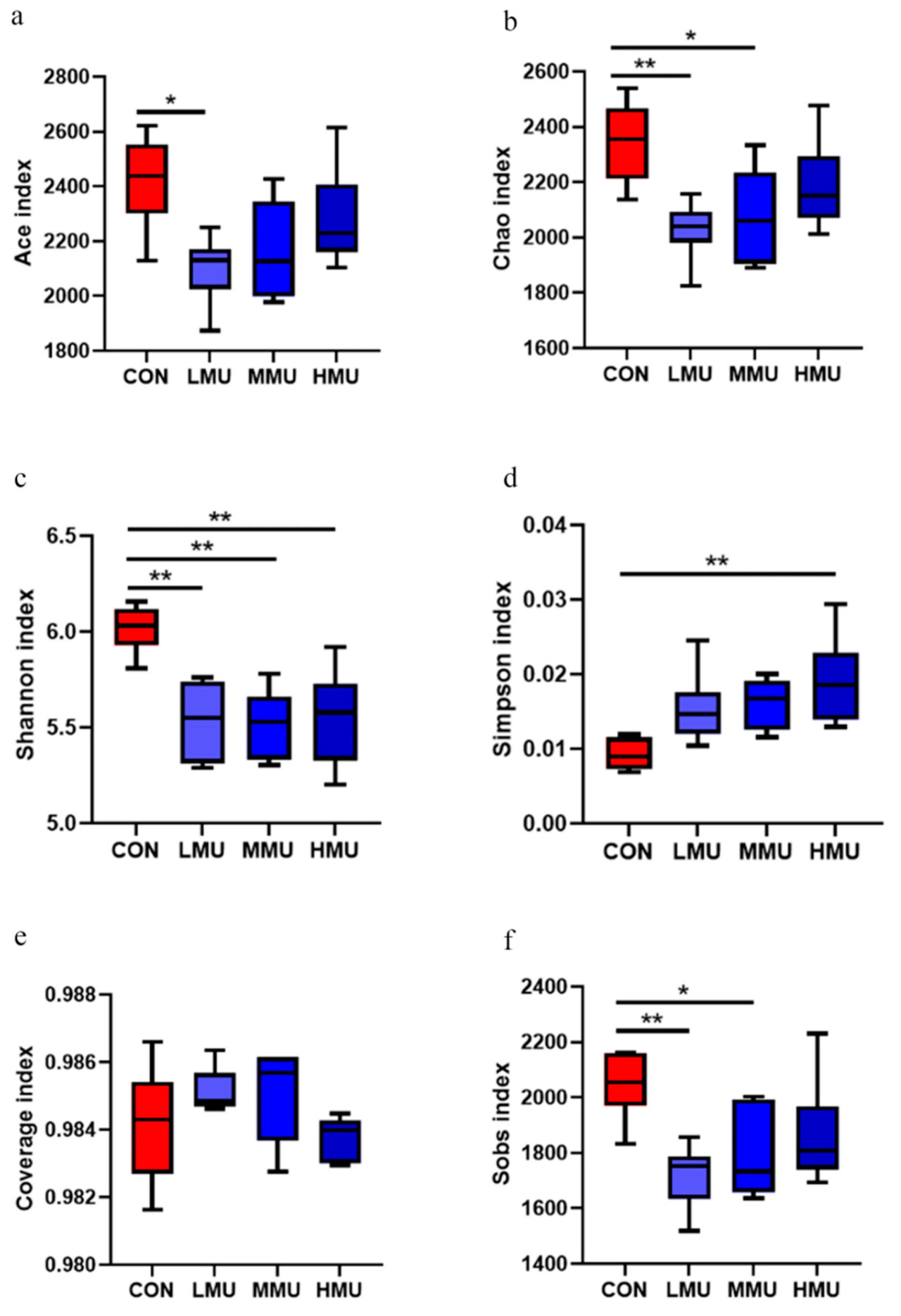
Расчетный индекс α-разнообразия библиотеки генов 16S рРНК рубца откармливаемых бычков голштинской породы, полученный путем анализа секвенирования, показан на рисунке 1. Результаты показали, что индекс Chao 1 и индекс Шеннона были значительно ниже (p < 0,05), а индекс Симпсона был значительно выше (p < 0,05) в каждой опытной группе по сравнению с контрольной группой. Не было значительных различий между различными опытными группами по покрытию бактериального сообщества и индексу Ace.
Рисунок 1. Статистическая карта индексов α-разнообразия рубцовой микрофлоры ( 0,05 < p < 0,1, p < 0,05). (a) индекс ACE, (b) индекс Chao 1, (c) индекс Шеннона, (d) индекс Симпсона, (e) индекс Coverage, (f) индекс Sobs.
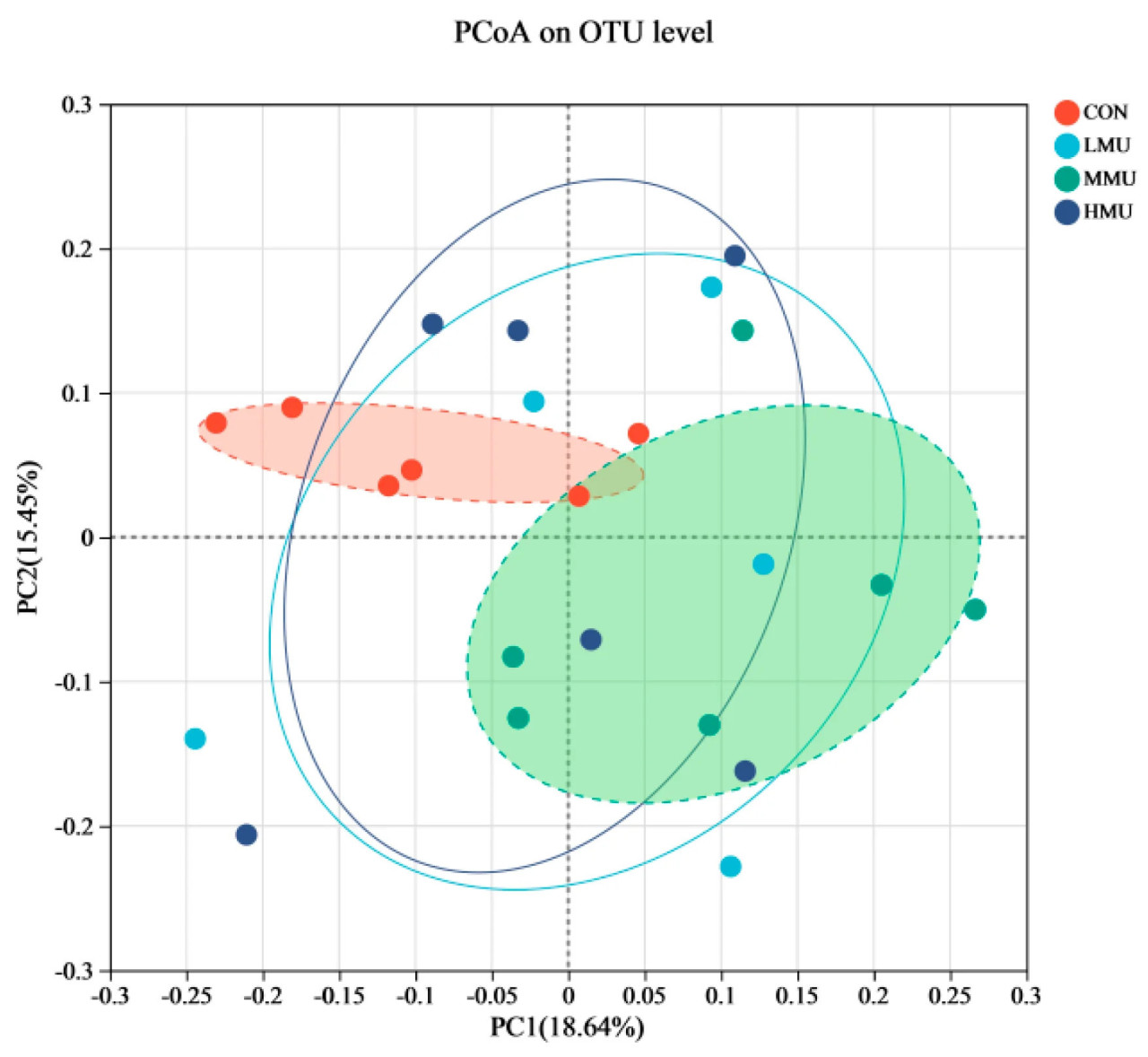
Для сравнения различий в структуре бактериальных колоний между опытными группами различия между опытными группами сравнивали более наглядно с помощью диаграммы размаха на основе анализа главных координат (PCoA) алгоритма расстояния Брея–Кертиса. Как показано на рисунке 2, различия в составе сообщества между CON и MMU были велики, в то время как состав сообщества LMU и HMU был более схож с составом как CON, так и MMU (между ними).
Рисунок 2. Диаграмма анализа главных координат алгоритма расстояния Брея–Кертиса.
3.6. Анализ относительной численности рубцовых бактерий
На основе 2218 OTU в этом эксперименте было идентифицировано всего 20 типов, 43 класса, 106 отрядов, 195 семейств и 402 рода бактерий. Столбчатая диаграмма показывает тенденцию изменений видов в микробных сообществах различных подгрупп, в то время как тепловая карта показывает микробные сообщества доминирующих видов в каждой группе, что дополняет столбчатую диаграмму.
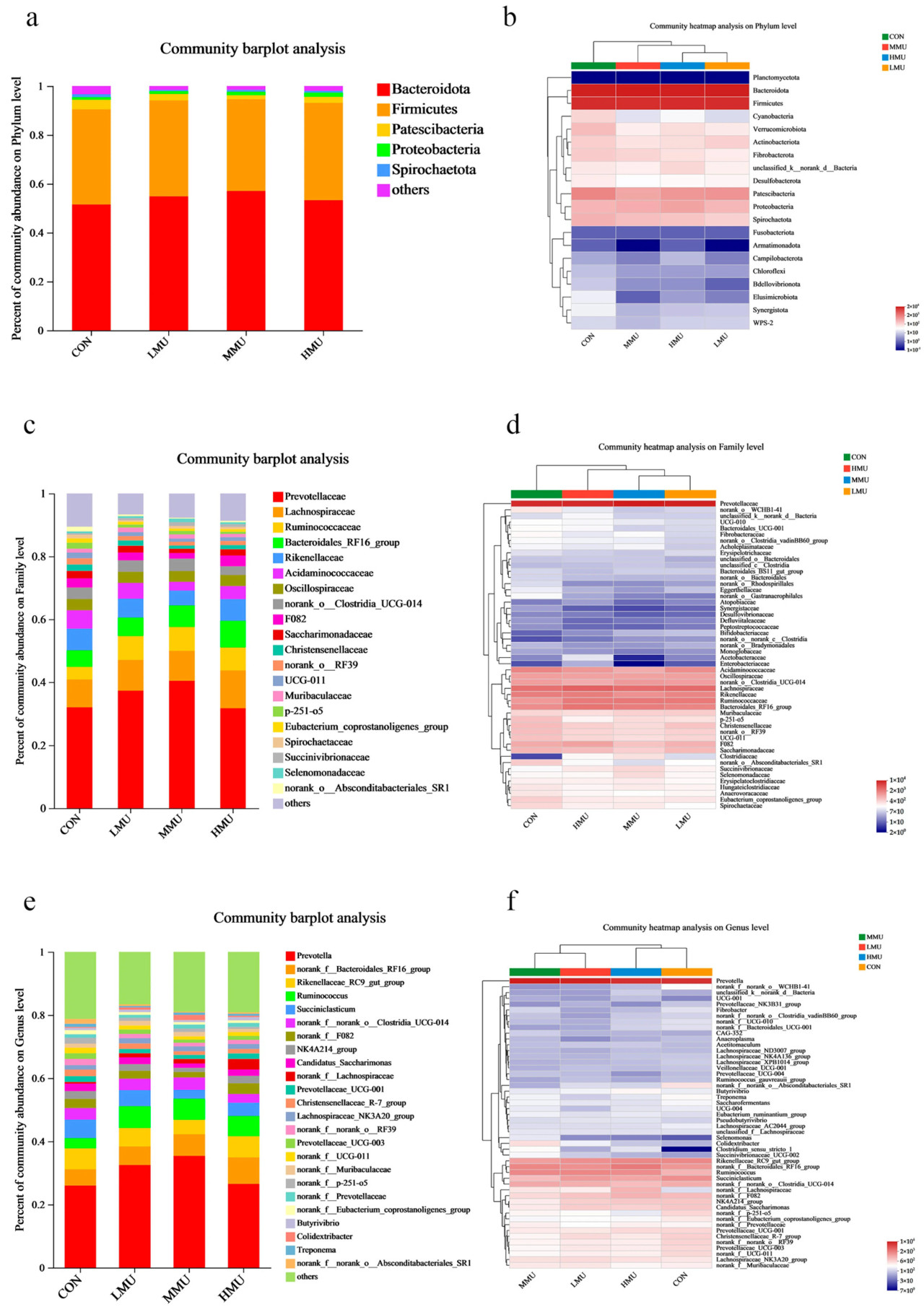
На уровне типа доминирующими типами рубцовых бактерий у мясного скота были Bacteroidetes, Firmicutes и Patescibacteria, с относительной численностью 51,52%, 38,91% и 3,90% соответственно в CON, 54,98%, 39,21% и 2,66% соответственно в LMU, 56,99%, 37,65% и 1,64% соответственно в MMU и 53,16%, 39,98% и 2,47% соответственно в HMU (рисунок 3а).
Рисунок 3. Контрольная группа (CON) и различные уровни патоки в комбинации с медленнодействующей мочевиной. Столбчатая диаграмма относительной численности микроорганизмов на уровне типа (а) и тепловая карта (b). Столбчатые диаграммы (c) и тепловая карта (d) относительной численности микроорганизмов на уровне семейства CON и различных уровней патоки в комбинации с медленнодействующей мочевиной. Столбчатая диаграмма (e) и тепловая карта (f) относительной численности микроорганизмов, получавших CON и различные уровни патоки в комбинации с медленнодействующей мочевиной, на уровне рода.
На уровне семейства Prevotellaceae (31,40%, 37,30%, 40,43%, 31,71%), Lachnospiraceae (8,86%, 9,78%, 9,53%, 12,03%), Ruminococcaceae (4,02%, 7,61%, 7,62%, 7,33%), Bacteroidales_RF16_group (5,22%, 5,85%, 6,83%, 8,41%) и Rikenellaceae (6,90%, 5,99%, 4,71%, 6,90%) были в группах CON, LMU, MMU и HMU соответственно доминирующими бактериальными семействами (рисунок 3c).
На уровне рода Prevotella (25,98%, 32,51%, 35,41%, 26,51%), norank_f__Bacteroidales_RF16_group (5,19%, 5,87%, 6,84%, 8,40%), Rikenellaceae_RC9_gut_group (6,65%, 5,87%, 4,62%, 6,76%), Ruminococcus (3,20%, 6,90%, 6,63%, 6,34%), Succiniclasticum (5,9%, 5,07%, 2,80%, 4,22%), Clostridium spp. UCG-014 (3,65%, 3,65%, 3,95%, 2,78%) и norank_f__F082 (2,94%, 2,49%, 1,74%, 3,38%) были доминирующими родами в группах CON, LMU, MMU и HMU соответственно (рисунок 3е).
3.7. Анализ LEfSe и обогащения значимо различающихся видов
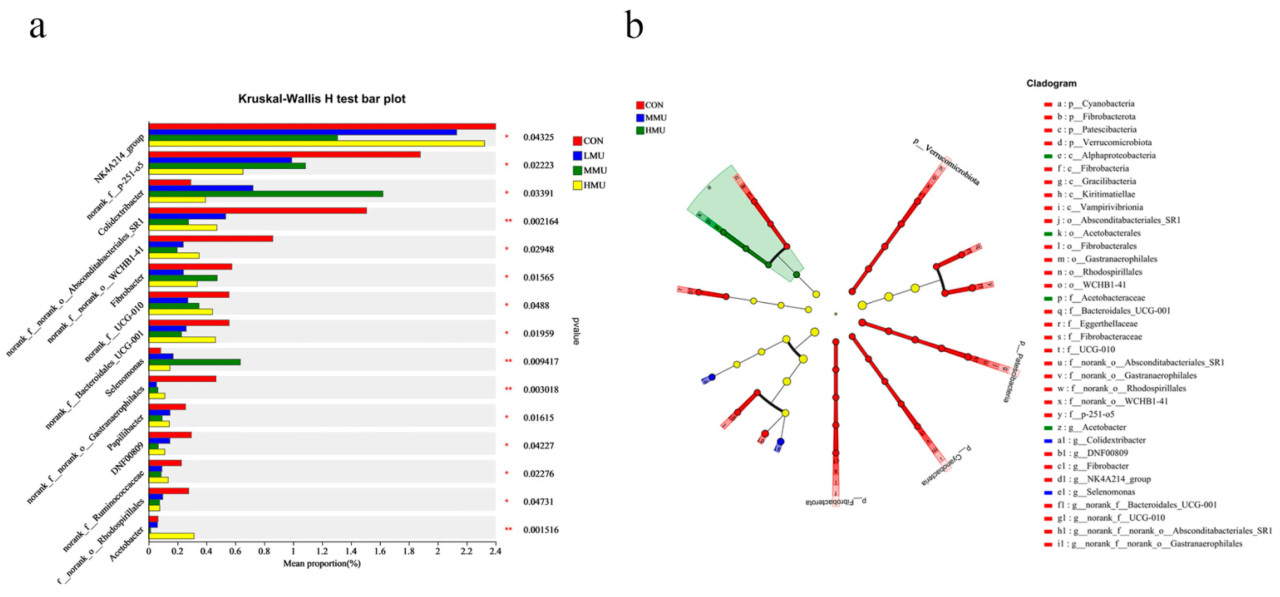
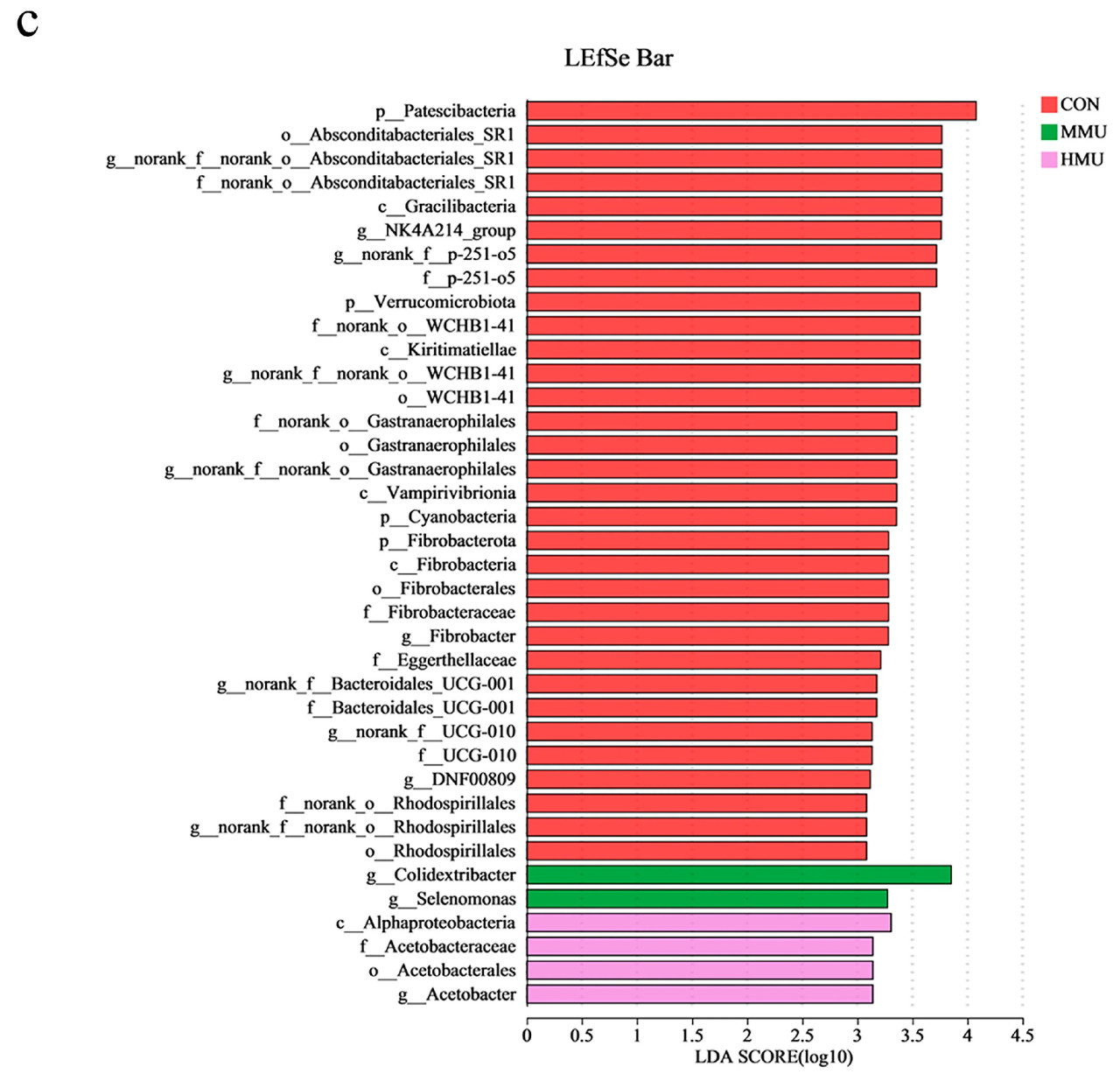
На основе данных о численности сообщества, полученных с помощью рангового критерия Крускала–Уоллиса, было проведено проверочное тестирование для видов между микробными сообществами различных опытных групп для оценки уровня значимости различий в численности видов, а затем были получены значимо различающиеся виды между группами. Как видно на рисунке 4а, на уровне рода NK4A214_group, norank__f__p-251-o5, norank__f__norank__o__Absconditabacteriales_SR1 и Fibrobacter были значительно повышены в CON по сравнению с другими группами, в то время как в MMU значительно повысились Colidextribacter и Selenomonas. Видовые различия на различных уровнях таксономии показаны в форме дендрограмм развития, которые наглядно отражают дифференциальные виды на уровне различных иерархий видов, полученных между различными опытными группами. LEfSe, показанный на рисунке 4b,c, в основном анализировал опытные группы (CON, LMU, MMU и HMU) и дал в общей сложности 38 значимо различающихся микробиот с порогом LDA 3. Из них 32 вида были значимо обогащены в CON и 4 микроорганизма были значимо обогащены в HMU. Было определено, что в CON присутствуют следующие типы: Cyanobacteria (p = 0,002, LDA: 3,35), Fibrobacterota (p = 0,016, LDA: 3,28), Patescibacteria (p = 0,032, LDA: 4,08) и Verrucomicrobiota (p = 0,026, LDA: 3,57). На уровне рода относительная численность родов Fibrobacter (p = 0,016, LDA: 3,28) и UCG-010 (p = 0,049, LDA: 3,13) была значительно выше, а относительная численность родов Colidextribacter (0,032, LDA: 3,85) и Selenomonas (p = 0,01, LDA: 3,28) была значительно выше в MMU. Роды были значительно выше по относительной численности, и род Acetobacter был значительно выше в HMU (p = 0,001, LDA: 3,14).
Рисунок 4. Тест на различия между группами (a), дискриминантный анализ LEfSe многоуровневых видовых различий между группами (b,c).
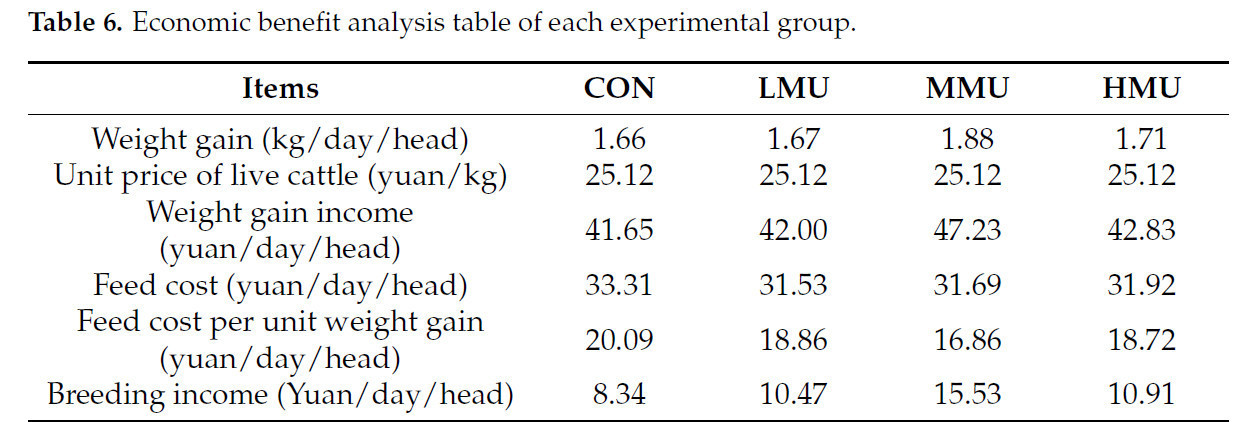
3.8. Анализ экономической выгоды
Основываясь на расчете цен на сырье для пастбищ в январе 2024 года, цена готового кукурузного силоса составляет 600 юаней/тонну, рисовой соломы — 500 юаней/тонну, кукурузы — 2300 юаней/тонну, пшеничных отрубей — 1750 юаней/тонну и соевого шрота — 3600 юаней/тонну. Кроме того, текущая цена патоки составляет 2000 юаней/тонну, медленнодействующей мочевины — 2400 юаней/тонну, пищевой соды — 2300 юаней/тонну, а премикса для мясного скота — 3200 юаней/тонну. Анализ комплексных экономических выгод с учетом различных среднесуточных привесов в каждой группе указывает на то, что включение 4% патоки и 3% медленнодействующей мочевины в рационы откормочного скота — с заменой части концентратов — дает наибольшее экономическое преимущество. Этот модифицированный рацион приводит к стоимости корма, которая ниже, чем у CON, экономя 1,62 юаня в день на голову. Дополнительно, доход от выращивания увеличивается на 7,19 юаня в день на голову по сравнению с CON, как иллюстрируется в таблице 6.
Таблица 6. Таблица анализа экономической выгоды каждой экспериментальной группы.
4. Обсуждение
В этом эксперименте не было значительной разницы в потреблении сухого вещества между всеми группами, но была значительная разница в переваримости органического вещества и сырого протеина. Чибиза и др. обнаружили, что добавление чистой лактозы в рацион на основе ячменя или кукурузы не оказывало значительного влияния на DMI у молочных коров [18], и Серам и др. обнаружили такой же результат [11]. Сильвия Гросси и др. обнаружили, что медленнодействующая мочевина, заменяющая часть соевого шрота, увеличивала переваримость сырого протеина и клетчатки без значительного влияния на DMI [19]. Мета-анализ для оценки влияния медленнодействующей мочевины на молочное производство показал отсутствие значительного эффекта DMI и значительное увеличение переваримости как СВ, так и СР [20], что согласуется с результатами настоящего испытания. Отсутствие различий в DMI обычно означает, что пищевое поведение стабильно при различных обработках корма, тогда как увеличение переваримости предполагает, что жвачные животные способны лучше использовать питательные вещества, которые они потребляли бы на аналогичном уровне потребления, с увеличением производственных показателей, улучшением здоровья и снижением воздействия на окружающую среду. Адейоро и др. изучали влияние добавления мочевины и нитрата на откармливаемых ягнят и обнаружили, что потребление сухого вещества ягнят не зависело от источника азота [21]. Это согласуется с результатами данного эксперимента. Бродерик и др. также обнаружили, что когда молочных коров голштинской породы на основе кукурузного силоса кормили сахарозой вместо кукурузного крахмала, быстроразлагающийся источник углерода сахароза увеличивал надой молока и содержание молочного белка. Это указывает на то, что степень соответствия пищевой сахарозы и источников азота выше, чем у кукурузного крахмала [22]. Сямси и др. обнаружили, что опытная группа с хорошей синхронизацией высвобождения азота оказывала значительное влияние на переваримость СВ и ОВ у коз [23]. С улучшением переваримости ОВ и СР больше питательных веществ переваривалось, усваивалось и использовалось, что увеличивало среднесуточный прирост каждой опытной группы. Одновременная скорость деградации источников углерода и азота в MMU помогает животным улучшить эффективность использования белка, более эффективно использовать источники энергии и азота в пище и уменьшить потери азота.
ALT и AST значительно снизились в группе MMU, что может быть связано с тем, что источник азота, высвобождаемый в группе MMU, может быть лучше использован для синтеза MCP, что также перекликается со значительным увеличением содержания MCP в группе MMU. С уменьшением аммиака крови количество аммиака, поступающего в печень, также относительно уменьшается, нагрузка на печень снижается, а метаболические отходы ALT и AST, вырабатываемые печенью, также уменьшаются. Интересно, что это похоже на результаты исследования Долатха и др. [24]. Исследования показали, что кормление коров высокими концентрациями может привести к увеличению содержания BUN [25]. Это согласуется с результатами данного эксперимента. По сравнению с другими опытными группами содержание BUN в HMU значительно увеличилось, что может быть связано с нарушением метаболизма рубцовой микробиоты, вызванным увеличением содержания патоки.
Сямси и др. обнаружили, что рубцовый pH у коз в опытной группе с хорошей синхронизацией высвобождения азота был значительно снижен [23]. В исследованиях in vitro Ли и др. обнаружили, что pH снижался с увеличением содержания водорастворимых углеводов (WSC) после добавления смеси WSC (инулин и сахароза; 80:20) к райграсу [26]. Колебания pH рубца напрямую влияют на эффективность брожения и здоровье животного, в то время как увеличение летучих кислот сопровождается снижением pH [27]. Это согласуется с результатами настоящего эксперимента, где pH был ниже во всех опытных группах, чем в контрольной группе, что соответствовало увеличению продукции VFA при рубцовом брожении. NH₃-N является наиболее важным источником синтеза MCP, и скорость синтеза MCP также зависит от ферментируемых CHO. Когда энергия ограничена или NH₃-N недостаточно, MCP не может быть эффективно синтезирован, что приводит к накоплению аммиака в рубце и повышению уровня аммиака [28]. Содержание MCP во всех опытных группах было выше, чем в CON, а содержание MCP в группах MMU и HMU было значительно выше, чем в CON. Синхронизация высвобождения энергии и азота значительно влияет на синтез микробного белка [29]. В MMU синхронизация высвобождения энергии и азота лучше, больше аммиака эффективно используется для производства MCP, а содержание аммиачного азота ниже.
Симбиотические отношения между молочными коровами и рубцовой микробиотой позволяют им использовать небелковый азот (мочевину и аммиак) и повышать биологическую ценность пищевого белка посредством синтеза рубцового микробного белка [30,31,32]. Аммиак всасывается через стенки рубца и попадает в печень, где метаболизируется в мочевину и снова поступает в рубец или транспортируется в почки [33]. Уреаза гидролизует мочевину в аммиак, который может выводиться с фекалиями или снова всасываться стенкой рубца и впоследствии метаболизироваться в мочевину в печени [33]. Однако это повторное производство мочевины может быть энергозатратным процессом [34]. Чем быстрее микробный источник энергии, тем выше производство VFA. Цяо и др. оценили влияние синхронизации энергии и азота в рационе на рубцовое брожение молочных коров голштинской породы и обнаружили, что TVFA увеличивался линейно с увеличением синхронизации высвобождения энергии и азота [35]. Аналогичные результаты были обнаружены в этом исследовании, при этом TVFA в опытной группе был значительно выше, чем в контрольной группе. Углеводы, которые легко ферментируются, могут увеличить производство уксусной кислоты, в то время как белки и неструктурные углеводы могут увеличить производство пропионовой кислоты. Одновременное высвобождение энергии и азота оптимизирует процесс рубцового брожения и способствует производству определенных VFA. Было обнаружено, что концентрации пропионовой и масляной кислот значительно увеличивались, когда скорости высвобождения источников энергии и азота совпадали [29].
Согласно результатам альфа-разнообразия, по сравнению с CON, богатство микрофлоры во всех опытных группах уменьшилось, но однородность сообщества увеличилась, что может быть связано с балансом энергии и азота в рубце и может способствовать росту доминирующей микробной флоры в рубце. Было показано, что различные уровни синхронизации энергии и азота значительно изменяют относительную численность рубцовых микроорганизмов. Например, относительная численность некоторых бактериальных типов, таких как Bacteroidetes и Firmicutes, увеличивалась с повышением уровней синхронизации энергии и азота [29].
Исследования показали, что Prevotellaceae могут использовать углеводы и белки в корме, а основными продуктами брожения являются уксусная кислота, пропионовая кислота и янтарная кислота. Пропионовая кислота является субстратом глюконеогенеза, который может активировать глюконеогенез и поддерживать стабильность энергии [36,37]. В соответствии с результатами этого эксперимента концентрации уксусной и пропионовой кислот также увеличивались с увеличением относительной численности Prevotellaceae. На уровне семейства Prevotellaceae была доминирующей, и относительная численность Prevotellaceae в MMU была выше, чем в других группах, что соответствовало таковой для Bacteroidetes на уровне типа. Lachnospiraceae — наиболее распространенные Firmicutes в рубцовой среде, и они относятся к Firmicutes вместе с Ruminococcaceae. Большинство видов, положительно коррелирующих с метаболизмом углеводов, относятся к Lachnospiraceae, многие члены которых обладают активностью расщепления целлюлозы и связаны с производством масляной кислоты, которая является важным источником энергии для клеток эпителия рубца, играя роль в регуляции барьерной функции рубца и потенциально влияя на конверсию корма [38,39]. В этом эксперименте по сравнению с CON относительная численность Lachnospiraceae и Ruminococcaceae во всех опытных группах увеличилась, что может быть причиной увеличения относительной численности Firmicutes во всех опытных группах. Более того, мы также обнаружили, что концентрация масляной кислоты в рубцовом ферментативном индексе показала тенденцию к росту. Это согласуется с результатами Му и др. [40]
На уровне рода Prevotella может использовать ферментируемые углеводы, включая патоку и растворимую клетчатку из жидкого сырья [41]. Это согласуется с результатами данного исследования. Исследования показали, что Ruminococcus и Prevotella являются бактериями, которые играют основную роль в разложении кормовой клетчатки и крахмала в рубце. Относительная численность этих двух родов бактерий во всех опытных группах увеличилась по сравнению с другими опытными группами, что может быть связано с тем, что эксперимент изменил синхронизацию высвобождения энергии и азота сырья в формуле рациона, что привело к увеличению относительной численности этих двух родов бактерий. Было обнаружено, что численность бактерий norank_f__Bacteroidales_RF16_group в рубце яков с различными типами кормов была разной; микробная численность рубца яков, получавших грубые корма, была выше, чем у получавших концентраты [42]. В этом эксперименте бактериальная численность RF16_group постепенно увеличивалась, возможно, потому, что с увеличением патоки она соответствовала скорости высвобождения азота из медленнодействующей мочевины, способствуя росту микроорганизмов и, таким образом, увеличивая обильность этой бактерии. Succiniclasticum имела наивысшую численность в CON и снижалась во всех опытных группах, при этом MMU имела самую низкую численность. Углеводная патока, которая легче ферментируется, чем крахмал, была добавлена в каждую опытную группу, поэтому относительная численность Succiniclasticum снизилась.
Результаты показали, что CON и MMU имели значительные различия в структуре бактериальной флоры рубца. В этом эксперименте обильность цианобактерий в CON была значительно выше, чем в других опытных группах, и исследование показало, что большинство бактерий цианобактерий отрицательно коррелировали с производством общих летучих жирных кислот, уксусной кислоты, пропионовой кислоты и масляной кислоты в рубце [43]. Это согласуется с результатами данного эксперимента, и выходы общих летучих жирных кислот, уксусной кислоты, пропионовой кислоты и масляной кислоты в опытной группе были выше, чем в CON. Fibrobacterita может значительно усиливать синергетический эффект микроорганизмов в процессе деградации лигноцеллюлозы в рубцовой среде. Хорошо известно, что метаболическое недоедание может усиливать сотрудничество между микробными сообществами, тем самым способствуя стабильности всей микробиоты [44]. Patescibacteria, ранее известные как кандидатные типы излучения (CPR), представляют собой класс генов, которые потеряли основные метаболические пути, такие как аминокислоты, нуклеотиды, жирные кислоты и кофакторы для de novo синтеза, и зависят от других микроорганизмов. Поэтому он считается типом недоедания [44].
В этом эксперименте относительная численность Fibrobacterita и Patescibacteria в опытной группе была ниже, чем в CON, что указывает на то, что рацион в опытной группе больше соответствовал пищеварению и абсорбции рубцовой микрофлоры, чем в CON, дальнейшим образом указывая на необходимость синхронизации высвобождения энергии и азота в питании жвачных. Colidextribacter и Selenomonas были значимо обогащены в MMU. Colidextribacter и Selenomonas играют важную роль в метаболизме углеводов рубца; Colidextribacter способен расщеплять сложные углеводы, такие как целлюлоза, и преобразовывать их в простые сахара, которые предоставляют больше энергии животному и помогают поддерживать здоровый рубец, участвуя в синтезе короткоцепочечных жирных кислот [45]. Selenomonas, с другой стороны, использует молочную кислоту в качестве источника энергии и преобразует ее в пропионовую кислоту и другие метаболиты, тем самым снижая концентрацию молочной кислоты в рубце и предотвращая ацидоз, вызванный накоплением молочной кислоты. Дополнительно, Selenomonas может расщеплять сложные углеводы до простых сахаров и короткоцепочечных жирных кислот, дальнейшим образом способствуя энергетическому метаболизму и стабильности рубцовой среды [46]. Сообщалось, что относительная численность Colidextribacter положительно коррелирует с концентрацией пропионовой кислоты [47]. Исследование показало, что регулирование уровня Colidextribacter в модели коз увеличивало концентрацию масляной кислоты в опытной группе [48], что было похоже на результаты этого эксперимента. Colidextribacter был значимо обогащен в группе MMU, и Colidextribacter производил SCFA (в основном бутират). Selenomonas может сбраживать молочную кислоту с образованием пропионовой кислоты, что играет ключевую роль в утилизации молочной кислоты и снижении производства метана в рубце [49]. Увеличение относительной численности двух штаммов привело к увеличению концентрации пропионовой кислоты, что соответствовало изменению рубцовых ферментативных параметров в MMU. Лайонс и др. обнаружили, что относительная численность Acetobacter в рубце коров в середине лактации была значительно выше, чем в конце лактации [50]. Acetobacter может производить уксусную кислоту путем окисления сахара, и большинство его членов являются аэробными бактериями, что может быть причиной увеличения концентрации уксусной кислоты в HMU.
5. Выводы
Настоящее исследование было поисковым исследованием, направленным на предварительное изучение влияния различных уровней патоки и медленнодействующей мочевины на активность рубцовых микроорганизмов, брожение и концентрацию аммиака у откармливаемых коров голштинской породы. В заключение, настоящее исследование показало, что использование 3% медленнодействующей мочевины и 4% патоки в качестве частичных заменителей концентратов может эффективно улучшить продуктивность роста и рубцовое брожение откармливаемых бычков голштинской породы, повлиять на рубцовую микробиоту и улучшить производственные показатели. Было обнаружено, что соответствующая доза патоки и медленнодействующей мочевины может улучшить эффективность использования корма откармливаемыми бычками голштинской породы путем регулирования структуры сообщества рубцовых микроорганизмов, что, в свою очередь, может способствовать продуктивности роста откармливаемых бычков голштинской породы. По сравнению с CON, скот, получавший комбинацию 4% патоки и 3% медленнодействующей мочевины, мог снизить стоимость кормления на 1,62 юаня RMB в день и увеличить доход от выращивания на 7,19 юаня на корову в день. Это предоставляет экономически эффективную стратегию для улучшения производственных показателей и снижения затрат на кормление. Различные источники патоки и процессы приготовления могут привести к различиям в результатах, что в некоторой степени влияет на обобщаемость результатов. Дополнительно, экспериментальный период настоящего исследования был относительно коротким, и длительные эффекты комбинации патоки и медленнодействующей мочевины и ее потенциальные кумулятивные эффекты необходимо дополнительно изучить.
Ссылки
1. Zhou, Z.; Meng, Q.; Li, S.; Jiang, L.; Wu, H. Effect of urea-supplemented diets on the ruminal bacterial and archaeal community composition of finishing bulls. Appl. Microbiol. Biotechnol. 2017, 101, 6205–6216. [Google Scholar] [CrossRef] [PubMed]
2. Jin, D.; Zhao, S.; Zheng, N.; Bu, D.; Beckers, Y.; Denman, S.E.; McSweeney, C.S.; Wang, J. Differences in Ureolytic Bacterial Composition between the Rumen Digesta and Rumen Wall Based on ureC Gene Classification. Front. Microbiol. 2017, 8, 385. [Google Scholar] [CrossRef] [PubMed]
3. Jonker, J.S.; Kohn, R.A.; High, J. Dairy herd management practices that impact nitrogen utilization efficiency. J. Dairy Sci. 2002, 85, 1218–1226. [Google Scholar] [CrossRef] [PubMed]
4. Patra, A.K.; Aschenbach, J.R. Ureases in the gastrointestinal tracts of ruminant and monogastric animals and their implication in urea-N/ammonia metabolism: A review. J. Adv. Res. 2018, 13, 39–50. [Google Scholar] [CrossRef]
5. Comparing the effectiveness of different roughage sources in Brazilian cattle feed. J. Anim. Sci. 2020, 98. [CrossRef]
6. Thompson, L. Nonprotein Nitrogen Poisoning in Animals. Available online: https://www.merckvetmanual.com/toxicology/nonprotein-nitrogen-poisoning/nonprotein-nitrogen-poisoning-in-animals (accessed on 1 November 2024).
7. Taylor-Edwards, C.C.; Hibbard, G.; Kitts, S.E.; McLeod, K.R.; Axe, D.E.; Vanzant, E.S.; Kristensen, N.B.; Harmon, D.L. Effects of slow-release urea on ruminal digesta characteristics and growth performance in beef steers. J. Anim. Sci. 2009, 87, 200–208. [Google Scholar] [CrossRef]
8. Brito, A.F.; Petit, H.V.; Pereira, A.B.D.; Soder, K.J.; Ross, S. Interactions of corn meal or molasses with a soybean-sunflower meal mix or flaxseed meal on production, milk fatty acid composition, and nutrient utilization in dairy cows fed grass hay-based diets. J. Dairy Sci. 2015, 98, 443–457. [Google Scholar] [CrossRef]
9. de Ondarza, M.B.; Emanuele, S.M.; Sniffen, C.J. Effect of increased dietary sugar on dairy cow performance as influenced by diet nutrient components and level of milk production. Prof. Anim. Sci. 2017, 33, 700–707. [Google Scholar] [CrossRef]
10. Hussein, A.S.; Ayoub, M.A.; Elhwetiy, A.Y.; Ghurair, J.A.; Sulaiman, M.; Habib, H.M. Effect of dietary inclusion of sugar syrup on production performance, egg quality and blood biochemical parameters in laying hens. Anim. Nutr. 2018, 4, 59–64. [Google Scholar] [CrossRef]
11. De Seram, E.L.; Penner, G.B.; Mutsvangwa, T. Nitrogen utilization, whole-body urea-nitrogen kinetics, omasal nutrient flow, and production performance in dairy cows fed lactose as a partial replacement for barley starch. J. Dairy Sci. 2019, 102, 6088–6108. [Google Scholar] [CrossRef]
12. Aguiar, A.D.; Vendramini, J.M.B.; Arthington, J.D.; Sollenberger, L.E.; DiLorenzo, N.; Hersom, M.J. Performance of beef cows and calves fed different sources of rumen-degradable protein when grazing stockpiled limpograss pastures. J. Anim. Sci. 2015, 93, 1923–1932. [Google Scholar] [CrossRef] [PubMed]
13. Liang, Z.; Jin, C.; Bai, H.; Liang, G.; Su, X.; Wang, D.; Yao, J. Low rumen degradable starch promotes the growth performance of goats by increasing protein synthesis in skeletal muscle via the AMPK-mTOR pathway. Anim. Nutr. 2023, 13, 1–8. [Google Scholar] [CrossRef] [PubMed]
14. Hasan, M.T.; AOAC. Official Methods of Analysis, 15th ed.; Association of Official Analytical Chemists: Artington, VA, USA, 1990. [Google Scholar]
15. Van Soest, P.J.; Robertson, J.B.; Lewis, B.A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition. J. Dairy Sci. 1991, 74, 3583–3597. [Google Scholar] [CrossRef]
16. Bradford, M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 1976, 72, 248–254. [Google Scholar] [CrossRef]
17. Broderick, G.A.; Kang, J.H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media. J. Dairy Sci. 1980, 63, 64–75. [Google Scholar] [CrossRef]
18. Chibisa, G.E.; Mutsvangwa, T. Effects of feeding wheat or corn-wheat dried distillers grains with solubles in low- or high-crude protein diets on ruminal function, omasal nutrient flows, urea-N recycling, and performance in cows. J. Dairy Sci. 2013, 96, 6550–6563. [Google Scholar] [CrossRef]
19. Grossi, S.; Compiani, R.; Rossi, L.; Dell’Anno, M.; Castillo, I.; Sgoifo Rossi, C.A. Effect of Slow-Release Urea Administration on Production Performance, Health Status, Diet Digestibility, and Environmental Sustainability in Lactating Dairy Cows. Animals 2021, 11, 2405. [Google Scholar] [CrossRef]
20. Salami, S.A.; Moran, C.A.; Warren, H.E.; Taylor-Pickard, J. Meta-analysis and sustainability of feeding slow-release urea in dairy production. PLoS ONE 2021, 16, e0246922. [Google Scholar] [CrossRef]
21. Adejoro, F.A.; Hassen, A.; Akanmu, A.M.; Morgavi, D.P. Replacing urea with nitrate as a non-protein nitrogen source increases lambs’ growth and reduces methane production, whereas acacia tannin has no effect. Anim. Feed. Sci. Technol. 2020, 259, 114360. [Google Scholar] [CrossRef]
22. Broderick, G.A.; Luchini, N.D.; Reynal, S.M.; Varga, G.A.; Ishler, V.A. Effect on production of replacing dietary starch with sucrose in lactating dairy cows. J. Dairy Sci. 2008, 91, 4801–4810. [Google Scholar] [CrossRef]
23. Syamsi, A.N.; Ifani, M. Rumen Fermentation Profiles of Protein-Energy Synchronization Index-Based Ration: An In Vitro Study. J. Ilmu Ternak Dan Vet. 2023, 28, 22–33. [Google Scholar] [CrossRef]
24. Dolatkhah, B.; Ghorbani, G.R.; Alikhani, M.; Hashemzadeh, F.; Mahdavi, A.H.; Sadeghi-Sefidmazgi, A.; Erfani, H.; Rezamand, P. Effects of hydrolyzed cottonseed protein supplementation on performance, blood metabolites, gastrointestinal development, and intestinal microbial colonization in neonatal calves. J. Dairy Sci. 2020, 103, 5102–5117. [Google Scholar] [CrossRef] [PubMed]
25. Malekkhahi, M.; Tahmasbi, A.M.; Naserian, A.A.; Danesh-Mesgaran, M.; Kleen, J.L.; AlZahal, O.; Ghaffari, M.H. Effects of supplementation of active dried yeast and malate during sub-acute ruminal acidosis on rumen fermentation, microbial population, selected blood metabolites, and milk production in dairy cows. Anim. Feed. Sci. Technol. 2016, 213, 29–43. [Google Scholar] [CrossRef]
26. Lee, M.R.F.; Merry, R.J.; Davies, D.R.; Moorby, J.M.; Humphreys, M.O.; Theodorou, M.K.; MacRae, J.C.; Scollan, N.D. Effect of increasing availability of water-soluble carbohydrates on in vitro rumen fermentation. Anim. Feed. Sci. Technol. 2003, 104, 59–70. [Google Scholar] [CrossRef]
27. Dijkstra, J.; Ellis, J.L.; Kebreab, E.; Strathe, A.B.; López, S.; France, J.; Bannink, A. Ruminal pH regulation and nutritional consequences of low pH. Anim. Feed. Sci. Technol. 2012, 172, 22–33. [Google Scholar] [CrossRef]
28. Anggraeny, Y.N.; Mariyono; Pamungkas, D.; Soetanto, H.; Kusmartono; Hartutik. Effect of synchronizing the rate degradation of protein and organic matter of feed base on corn waste on fermentation characteristic and synthesis protein microbial. IOP Conf. Ser. Earth Environ. Sci. 2021, 788, 012042. [Google Scholar] [CrossRef]
29. Zhang, J.; Zheng, N.; Shen, W.; Zhao, S.; Wang, J. Synchrony Degree of Dietary Energy and Nitrogen Release Influences Microbial Community, Fermentation, and Protein Synthesis in a Rumen Simulation System. Microorganisms 2020, 8, 231. [Google Scholar] [CrossRef]
30. Bryant, M.P. Normal Flora—Rumen Bacteria1. Am. J. Clin. Nutr. 1970, 23, 1440–1450. [Google Scholar] [CrossRef]
31. Huber, J.T.; Kung, L. Protein and Nonprotein Nitrogen Utilization in Dairy Cattle1. J. Dairy Sci. 1981, 64, 1170–1195. [Google Scholar] [CrossRef]
32. Tan, P.; Liu, H.; Zhao, J.; Gu, X.; Wei, X.; Zhang, X.; Ma, N.; Johnston, L.J.; Bai, Y.; Zhang, W.; et al. Amino acids metabolism by rumen microorganisms: Nutrition and ecology strategies to reduce nitrogen emissions from the inside to the outside. Sci. Total Environ. 2021, 800, 149596. [Google Scholar] [CrossRef]
33. Lapierre, H.; Lobley, G.E. Nitrogen Recycling in the Ruminant: A Review. J. Dairy Sci. 2001, 84, E223–E236. [Google Scholar] [CrossRef]
34. McBride, B.W.; Kelly, J.M. Energy cost of absorption and metabolism in the ruminant gastrointestinal tract and liver: A review. J. Anim. Sci. 1990, 68, 2997–3010. [Google Scholar] [CrossRef] [PubMed]
35. Qiao, G.H.; Xiao, Z.G.; Li, Y.; Li, G.J.; Zhao, L.C.; Xie, T.M.; Wang, D.W. Effect of diet synchrony on rumen fermentation, production performance, immunity status and endocrine in Chinese Holstein cows. Anim. Prod. Sci. 2019, 59, 664–672. [Google Scholar] [CrossRef]
36. Guo, H.; Zhou, G.; Tian, G.; Liu, Y.; Dong, N.; Li, L.; Zhang, S.; Chai, H.; Chen, Y.; Yang, Y. Changes in Rumen Microbiota Affect Metabolites, Immune Responses and Antioxidant Enzyme Activities of Sheep under Cold Stimulation. Animals 2021, 11, 712. [Google Scholar] [CrossRef]
37. Guo, Y.; Wang, F.; Mao, Y.; Kong, W.; Wang, J.; Zhang, G. Influence of Parturition on Rumen Bacteria and SCFAs in Holstein Cows Based on 16S rRNA Sequencing and Targeted Metabolomics. Animals 2023, 13, 782. [Google Scholar] [CrossRef]
38. Shen, H.; Xu, Z.; Shen, Z.; Lu, Z. The Regulation of Ruminal Short-Chain Fatty Acids on the Functions of Rumen Barriers. Front. Physiol. 2019, 10, 1305. [Google Scholar] [CrossRef]
39. Xie, Y.; Sun, H.; Xue, M.; Liu, J. Metagenomics reveals differences in microbial composition and metabolic functions in the rumen of dairy cows with different residual feed intake. Anim. Microbiome 2022, 4, 19. [Google Scholar] [CrossRef]
40. Mu, Y.Y.; Qi, W.P.; Zhang, T.; Zhang, J.Y.; Mei, S.J.; Mao, S.Y. Changes in rumen fermentation and bacterial community in lactating dairy cows with subacute rumen acidosis following rumen content transplantation. J. Dairy Sci. 2021, 104, 10780–10795. [Google Scholar] [CrossRef]
41. Hagey, J.V.; Laabs, M.; Maga, E.A.; DePeters, E.J. Rumen sampling methods bias bacterial communities observed. PLoS ONE 2022, 17, e0258176. [Google Scholar] [CrossRef]
42. Liu, C.; Wu, H.; Liu, S.; Chai, S.; Meng, Q.; Zhou, Z. Dynamic Alterations in Yak Rumen Bacteria Community and Metabolome Characteristics in Response to Feed Type. Front. Microbiol. 2019, 10, 1116. [Google Scholar] [CrossRef]
43. Beauchemin, K.A.; Yang, W.Z.; Rode, L.M. Effects of Particle Size of Alfalfa-Based Dairy Cow Diets on Chewing Activity, Ruminal Fermentation, and Milk Production. J. Dairy Sci. 2003, 86, 630–643. [Google Scholar] [CrossRef] [PubMed]
44. Gharechahi, J.; Sarikhan, S.; Han, J.L.; Ding, X.Z.; Salekdeh, G.H. Functional and phylogenetic analyses of camel rumen microbiota associated with different lignocellulosic substrates. NPJ Biofilms Microbiomes 2022, 8, 46. [Google Scholar] [CrossRef] [PubMed]
45. Xue, M.Y.; Xie, Y.Y.; Zhong, Y.; Ma, X.J.; Sun, H.Z.; Liu, J.X. Integrated meta-omics reveals new ruminal microbial features associated with feed efficiency in dairy cattle. Microbiome 2022, 10, 32. [Google Scholar] [CrossRef]
46. Xue, M.Y.; Xie, Y.Y.; Zang, X.W.; Zhong, Y.F.; Ma, X.J.; Sun, H.Z.; Liu, J.X. Deciphering functional groups of rumen microbiome and their underlying potentially causal relationships in shaping host traits. iMeta 2024, 3, e225. [Google Scholar] [CrossRef]
47. Takizawa, S.; Shinkai, T.; Saito, K.; Fukumoto, N.; Arai, Y.; Hirai, T.; Maruyama, M.; Takeda, M. Effect of rumen microbiota transfaunation on the growth, rumen fermentation, and microbial community of early separated Japanese Black cattle. Anim. Sci. J. 2023, 94, e13876. [Google Scholar] [CrossRef]
48. Wang, D.; Tang, G.; Zhao, L.; Wang, M.; Chen, L.; Zhao, C.; Liang, Z.; Chen, J.; Cao, Y.; Yao, J. Potential roles of the rectum keystone microbiota in modulating the microbial community and growth performance in goat model. J. Anim. Sci. Biotechnol. 2023, 14, 55. [Google Scholar] [CrossRef]
49. Smith, P.E.; Kelly, A.K.; Kenny, D.A.; Waters, S.M. Differences in the Composition of the Rumen Microbiota of Finishing Beef Cattle Divergently Ranked for Residual Methane Emissions. Front. Microbiol. 2022, 13, 855565. [Google Scholar] [CrossRef]
50. Lyons, T.; Bielak, A.; Doyle, E.; Kuhla, B. Variations in methane yield and microbial community profiles in the rumen of dairy cows as they pass through stages of first lactation. J. Dairy Sci. 2018, 101, 5102–5114. [Google Scholar] [CrossRef]
Xu Z, Li S, Yu F, Huang Y, Xie T, Bian H, Lv L, Hu Y, Tao R, Fan C, et al. Effects of Different Molasses Levels and Slow-Release Urea Combinations on Growth Performance, Serum Biochemistry, Rumen Fermentation, and Microflora of Holstein Fattening Bulls. Agriculture. 2025; 15(2):183. https://doi.org/10.3390/agriculture15020183
Перевод статьи «Effects of Different Molasses Levels and Slow-Release Urea Combinations on Growth Performance, Serum Biochemistry, Rumen Fermentation, and Microflora of Holstein Fattening Bulls» авторов Xu Z, Li S, Yu F, Huang Y, Xie T, Bian H, Lv L, Hu Y, Tao R, Fan C, et al., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
































































































Комментарии (0)