Умное земледелие: как спектроскопия (NIRS) меняет подход к использованию органических удобрений
Уровень питательных веществ в жидких органических удобрениях (ЖОУ) сильно варьируется, поэтому важно определять их концентрацию перед внесением в поле, чтобы обеспечить точное соответствие удобрения потребностям сельскохозяйственных культур. Точное знание содержания питательных веществ в ЖОУ является основным условием для оптимального снабжения ими растений и предотвращения экологических проблем, вызванных чрезмерным внесением удобрений.
Аннотация
Состав ЖОУ можно определить непосредственно на месте с помощью различных методов. Одна из возможностей — спектроскопия ближнего инфракрасного диапазона (БИК-спектроскопия). Этот метод уже является распространенной лабораторной процедурой. Данный обзор рассматривает пригодность использования БИК-спектроскопии для анализа характеристик ЖОУ непосредственно на ферме.
Для применения на ферме существует множество факторов, таких как температура окружающей среды, движение и вибрация техники, которые могут влиять на измерения сенсоров и, следовательно, на получаемые значения. Поэтому следует учитывать эти влияющие факторы. Надежность систем БИК-спектроскопии для фермерского анализа навоза проверяется Немецким сельскохозяйственным обществом (DLG). Для испытаний различные ЖОУ с разных ферм измеряются с помощью БИК-сенсоров, и качество соответствия данных БИК-спектроскопии лабораторным тестам сертифицируется для каждого типа ЖОУ по соответствующим компонентам.
Чтобы в полной мере реализовать потенциал технологии БИК-спектроскопии в будущем, необходимы расширение и улучшение обязательных калибровок. Это позволит сенсорам выдавать точные и воспроизводимые результаты для различных типов ЖОУ в практических условиях применения.
1. Введение
Эффективное использование органических удобрений является незаменимым компонентом мирового производства сельскохозяйственных культур. Органические удобрения — это ресурсы, доступные на ферме, которые содержат питательные вещества, важные для растений [1]. К ним относятся макроэлементы азот (N), фосфор (P), калий (K), магний (Mg), кальций (Ca) и сера (S), а также микроэлементы. Эффективное использование этих органических удобрений и остатков является важным стратегическим компонентом для сокращения потребности в минеральных удобрениях. Таким образом можно сохранить ограниченные ресурсы, такие как фосфор и калий, и значительно сократить потребление ископаемого топлива (особенно природного газа) для процесса Габера–Боша по синтезу аммиака. В отличие от минеральных удобрений, основные части питательных веществ в органических удобрениях постепенно высвобождаются в почвенный раствор, обеспечивая тем самым сбалансированное поставка питательных веществ в почве для роста здоровых сельскохозяйственных культур [2].
Помимо питательных веществ для растений, органические удобрения, такие как компост, навоз, жижа и остатки биогаза, содержат органическое вещество, которое является основой для поддержания содержания органического вещества в почве и образования гумуса. Они также имеют особое значение для биологической активности в почве [3]. Таким образом, органические удобрения служат источником энергии для почвенных микробов, которые, помимо прочего, улучшают структуру почвы и, следовательно, косвенно также рост растений. Более высокое содержание органического вещества в почве также приводит к лучшей инфильтрации воды и водоудерживающей способности, а также к улучшенному общему плодородию почвы [3].
Также важно, что эти органические удобрения для фермера в основном бесплатны или, если они приобретаются, то они значительно дешевле обычных минеральных удобрений, поскольку являются побочным продуктом животноводства или биогазовых установок.
Однако неправильное использование органических удобрений приводит либо к чрезмерному удобрению, либо к дефициту питательных веществ в почве. Избыток питательных веществ, особенно нитратов и фосфора, может привести к загрязнению питательными веществами грунтовых или поверхностных вод, что может вызвать экологические проблемы, такие как эвтрофикация несельскохозяйственных экосистем, или проблемы со здоровьем человека из-за чрезмерных концентраций нитратов в питьевой воде [4]. Ответственное использование органических удобрений, следовательно, важно для предотвращения этих эффектов и достижения устойчивых урожаев [2].
2. Состав жидких органических удобрений
Жидкие органические удобрения производятся, в частности, при интенсивном
животноводстве
и сбраживании на биогазовых установках на фермах [5]. Например,
почти 190 миллионов м³ ЖОУ было внесено на пашню в Германии в 2020 году. Три
наиболее важных типа ЖОУ — это жидкий навоз КРС
с 95 миллионами м³, биогазовый
дигестат с 63 миллионами м³ и жидкий свиной навоз с 28 миллионами м³ [6].
Состав ЖОУ сильно варьируется. Это связано с тем, что многие факторы, такие как вид животного, система содержания, а также тип корма, влияют на питательный состав [7]. В зависимости от переваримости кормового рациона зачастую хорошо более половины питательных веществ снова выделяется (примерно 60–80% для N, 50–85% для P и 85–95% для K). Точное количество выделяемых питательных веществ зависит, среди прочего, от выбора корма и кормовых добавок, вида скота, возраста и производительности [7]. Количество и выбор подстилочного материала, а также поступление воды в качестве фактора разбавления [8] дополнительно влияют на содержание питательных веществ и реологические свойства.
Согласно официальной консультационной службе Нижней Саксонии [9], жидкий навоз КРС находится в диапазоне 4–10% сухого вещества (СВ), 3.7–4.8 кг м⁻³ общего азота (TN), 1.7–2.6 кг м⁻³ аммонийного азота (AN), 0.7–1 кг м⁻³ P и 3.7–4.8 K, тогда как жидкий свиной навоз обычно содержит 4–7% СВ, 3.7–7.2 кг м⁻³ TN, 2.3–4.3 кг м⁻³ AN, 0.8–1.6 кг м⁻³ P и 2–3.7 кг м⁻³ K. Дигестаты состоят из различных субстратов, сброженных на биогазовой установке [10]. Питательный состав таких дигестатов может сильно варьироваться в зависимости от количества и типа используемого субстрата, технологии биогаза, температуры и длительности процесса сбраживания [11]. Типичные жидкие сброженные остатки из возобновляемого сырья (например, силоса кукурузы) содержат 4.6–10.1% СВ, 3.3–7.1 кг м⁻³ TN, 1.0–4.5 кг м⁻³ AN, 0.4–1.6 кг м⁻³ P и 3–5.5 кг м⁻³ K [12].
По сравнению с минеральными удобрениями, при использовании жидких удобрений фермы существует значительно более высокий риск выбросов аммиака и вымывания нитратов. Особенно время и количество выделения N гораздо труднее оценить из-за неоднородности этих органических удобрений [13]. Что касается общих выбросов аммиака в сельском хозяйстве, 50% происходят от внесения навоза, 36% — из животноводческих помещений и хранилищ навоза и 14% — от выпаса [14].
Содержание питательных веществ в удобрениях на основе хозяйств следует определять незадолго до внесения в поле и как можно точнее, чтобы определить количество ЖОУ для покрытия конкретных потребностей культуры в питательных веществах [15]. Цель состоит в том, чтобы вносить удобрения в соответствии с потребностями, например, чтобы предотвратить чрезмерные выбросы аммиака и сократить вымывание нитратов в грунтовые воды. Целевое внесение также важно, поскольку использование навоза может привести к сильному, временному увеличению доступного фосфора в верхнем слое почвы [16].
Кроме того, потери N в виде аммиака в животноводческом помещении и во время хранения могут изменить концентрацию аммония в ЖОУ. Возможные физические методы снижения потерь аммиака во время хранения и после внесения жидких органических удобрений включают укрытие во время хранения или разделение твердой и жидкой фракций и разбавление ЖОУ перед внесением и заделку в почву во время внесения.
3. Методы определения концентраций питательных веществ в жидких органических удобрениях
Существуют различные способы определения концентраций питательных веществ в ЖОУ. Согласно оценкам различных лабораторий, регулярно тестирующих ЖОУ, а также сельскохозяйственных консультантов, многие фермеры в Германии до сих пор используют табличные справочные значения, опубликованные официальными консультационными органами для различных типов ЖОУ в их регионе, для определения нормы внесения ЖОУ для конкретного поля или культуры. Вероятно, это относится ко многим фермерам и в других странах. Преимущество этого варианта в том, что никакие затраты не возникают, но следует иметь в виду, что эти табличные значения могут сильно отклоняться от фактического содержания элементов в ЖОУ из-за конкретной производственной ситуации [17].
В качестве альтернативы образцы ЖОУ могут быть отправлены на лабораторный анализ, что дает очень точные данные о питательном составе. Однако для фермера репрезентативный отбор проб выполнить непросто, и требуется некоторое время и усилия (например, дизельное топливо или электроэнергия для перемешивания) для гомогенизации хранилища ЖОУ. Неправильный отбор проб может привести к значительным отклонениям от фактических концентраций СВ или питательных веществ, что ограничит оптимальное поставка питательных веществ для культуры и может вызвать экологические проблемы. Дальнейшие недостатки этого подхода — более высокие затраты и задержка до получения фермером результатов анализа [18].
Третий вариант — определять концентрации питательных веществ на месте [17,19]. Такой анализ питательных веществ на месте можно проводить с помощью широкого спектра различных методов. Для измерения содержания AN, который является наиболее важным компонентом в ЖОУ, поскольку эта форма N непосредственно доступна растениям, на рынке представлены два устройства с различной конструкцией, но одинаковым принципом измерения. В волюметре Quantofix-N (Terraflor GmbH, Изерлон, Германия) аммоний превращается в N₂ путем добавления раствора гипохлорита натрия в ЖОУ. В устройстве производимый газ N₂ вытесняет определенное количество воды, которое используется для количественного определения газовыделения [20]. Содержание аммонийного азота в образце затем можно считать непосредственно с откалиброванной шкалы измерительного цилиндра в кг м⁻³ на основе уровня воды [17]. Устройство Agros Nova (Agros, Лидчёпинг, Швеция) основано на том же принципе и состоит из ПВХ-трубки с реакционной камерой и манометром. Здесь содержание аммонийного-N можно считать непосредственно с манометра [21].
Электрическая проводимость (EC) является косвенной мерой потока электронов из-за концентрации катионов и анионов в растворе. Эта методика измерения используется для определения концентраций аммония и калия, которые обычно являются доминирующими катионами в ЖОУ [17]. Для таких измерений проводимости используются датчики ЕС или так называемые «ручки». Значения измерителя ЕС и «ручек» хорошо согласуются с лабораторными значениями для NH₄⁺ [19]. Однако обе методики измерения имеют тенденцию завышать NH₄⁺ при высоких концентрациях и занижать при низких [19]. Согласно Piepel и др. [17], точность измерения аммония с использованием электрической проводимости ниже, чем у волюметра Quantofix-N.
Количественное определение общего азота (TN) может быть основано на измеренных значениях волюметра Quantofix-N в сочетании с гравиметрически определенной концентрацией сухого вещества [17]. При оценке 391 образца жидкого свиного навоза с практических ферм северо-западной Германии комбинация этих двух методик измерения для определения TN показала очень высокую корреляцию (R²) 0.95 с лабораторными значениями [17]. Также для определения концентраций TN или P в жиже используются ареометры. В этом подходе концентрация TN или P основана на содержании сухого вещества, но сопоставимость этого метода с лабораторными значениями довольно плохая [17,19].
Использование этих экспресс-тестов на практике на уровне фермы часто является слишком неточным и обычно можно определить только один параметр [20]. По этой причине спектроскопия ближнего инфракрасного диапазона (NIRS) рассматривается как перспективный метод, и она уже широко используется для сельскохозяйственных испытаний во многих областях [22]. NIRS хорошо зарекомендовала себя, например, для определения компонентов кормов, таких как сырой протеин [23], сырая клетчатка [24] и сырой жир, для содержания масла в зернах рапса [24] или содержания белка в бобовых [25]. Даже заражение патогенами в зерновых культурах можно определить [26]. Поэтому очень важно оценить производительность NIRS для определения содержания питательных веществ в ЖОУ.
4. Спектроскопия ближнего инфракрасного диапазона — принцип измерения
В общем, спектроскопические методы используются для получения химической, физической, качественной и количественной информации о данном образце посредством взаимодействия электромагнитного излучения с атомами и молекулами. Эта информация находится в определенной длине волны или частоте энергетического спектра [27]. В спектроскопии ближнего инфракрасного диапазона образец облучается светом в диапазоне длин волн 800–2500 нм. Комбинационные и гармонические полосы связей OH, NH и CH в образцах приводятся в движение этим облучением. Взаимодействие излучения с компонентами образца приводит к разным долям отражения, пропускания и поглощения света, но часть поглощения можно определить только косвенно, измеряя отражение и/или пропускание [28].
В режиме измерения отражения часть падающего света рассеивается обратно с поверхности образца и передается на детектор NIR. При измерении пропускания-отражения сигнал, принимаемый детектором NIR, состоит из двух частей. Одна часть падающего света может быть передана через образец и обратно на детектор NIR, в то время как вторая часть сигнала поступает от света, который отражается обратно от поверхности образца. Для жидких образцов с небольшим количеством частиц будет доминировать пропускание света, и использование метода пропускания-отражения может быть целесообразным. Однако для жидких образцов с высокой концентрацией частиц, таких как ЖОУ, измерение пропускания-отражения затруднено, потому что взвешенные частицы значительно уменьшают пропускание света через образец [29].
После записи спектров во время измерения NIRS образца математическая зависимость между спектрами и соответствующими референсными значениями определяется с использованием регрессионной модели, чтобы можно было предсказать компоненты на основе спектров. Для интерпретации спектров доступны сложные хемометрические методы. Часто несколько методов предварительной обработки используются для всего спектра или выбранных длин волн спектра, чтобы скорректировать сигналы от шума, удалить сдвиги базовой линии или уменьшить размер данных перед проведением окончательного статистического анализа [30]. После этапа предварительной обработки должна быть установлена регрессионная модель. Это включает в себя поиск надежной математической зависимости между спектрами и соответствующими значениями для анализируемых образцов сравнения.
Для этой цели был разработан метод регрессии методом частичных наименьших квадратов (PLSR) [31]. В PLSR переменные прогнозирования (т.е. длины волн спектров NIR) сводятся к нескольким некоррелированным компонентам. Затем определяются ошибки наименьших квадратов, чтобы вычислить наилучшее регрессионное уравнение. PLSR часто выбирают, когда существует много сильно коллинеарных переменных-предикторов, связанных с небольшим количеством образцов [32]. На основе «искусственного интеллекта» и «нейронных сетей» в последние годы были разработаны дополнительные регрессионные методы, подходящие для обработки спектральных данных (например, LASSO-регрессия, ридж-регрессия, регрессия наименьшего угла, случайный лес) [30].
Основное преимущество NIRS — это быстрый и бесконтактный процесс измерения. Кроме того, для измерения не требуются химические вещества или диапазоны излучения высокого риска, что означает, что анализ не представляет рисков для человека или окружающей среды во время анализа [33]. Дальнейшие преимущества методики NIRS заключаются в том, что питательные вещества определяются непрерывно, со сравнительно небольшими техническими усилиями, и информация о компонентах доступна немедленно. Затратная разработка и поддержание калибровок NIRS и обязательный и трудоемкий контроль качества рассматриваются как определенные недостатки [18].
Поскольку спектроскопия ближнего инфракрасного диапазона является косвенным методом измерения, для создания калибровки требуются альтернативные методы анализа — обычно методы мокрой химии — в качестве эталона [22]. Должны быть разработаны калибровки, которые показывают тесную корреляцию между результатами измерений NIRS и результатами эталонных методов. Следует также отметить, что в спектроскопии ближнего инфракрасного диапазона точность сильно зависит от физического состояния образца, т.е., среди прочего, от размера частиц, объемной плотности и температуры [34].
5. Использование NIRS для характеристики жидких органических удобрений в лаборатории
Все компоненты в ЖОУ имеют свои индивидуальные свойства (например, из-за водородных связей) и, следовательно, уникальный спектр NIR. Эти особые характеристики являются спектральной основой для прогнозирования питательного состава ЖОУ с использованием NIRS [18].
В своем обзоре Horf и др. [30] описали, что в контролируемых условиях в лаборатории для анализа свойств ЖОУ используется различное оборудование. Например, существуют спектрометры с дисперсионной решеткой и сканирующим монохроматором, такие как система NIR System 6500 от FOSS (Хиллерёд, Дания). Этот тип спектрометра имеет высокое разрешение, но низкую скорость сканирования. Кроме того, он имеет движущиеся части, чувствительные к вибрациям, что явно ограничивает использование на ферме. Дисперсионные NIR-спектрометры с диодной матрицей (например, Corona®45, Carl Zeiss Spectroscopy GmbH, Йена, Германия) имеют — в отличие от упомянутого выше типа спектрометра — высокую скорость сканирования. Эти надежные приборы подходят как в качестве настольных устройств для лабораторных применений, так и в портативной версии для использования на ферме. Фурье-спектрометры имеют преимущество перед дисперсионными спектрометрами в том, что они быстрее и имеют более высокое разрешение. Хотя изначально они предназначались только для использования в среднем инфракрасном диапазоне, теперь устройства доступны и в ближнем инфракрасном диапазоне (например, NIRFlex N-500, BÜCHI Labortechnik AG, Флавиль, Швейцария). Кроме того, для лабораторных измерений используются так называемые спектрометры с полосовым фильтром со специальными фильтрами для выбранных длин волн (например, устройство MM55, NDC Infrared Engineering Ltd., Малдон, Англия). Это сравнительно недорогие устройства NIRS, но они могут выполнять измерения только в очень ограниченных диапазонах длин волн.
В литературе много свидетельств того, что спектроскопия ближнего инфракрасного диапазона технически хорошо работает для измерений ЖОУ в лабораторных условиях [35,36,37,38,39]. Точность измерений NIRS обычно оценивается с использованием коэффициентов корреляции (R²), которые указывают на взаимосвязь между значениями, предсказанными измерениями NIRS, и значениями, измеренными с использованием эталонного метода [40]. Согласно Williams [41], значение R² от 0.66 до 0.81 означает, что возможно «приблизительное количественное» прогнозирование, в то время как значение R² от 0.82 до 0.90 означает «хорошее» прогнозирование. Калибровочные модели со значением R² выше 0.91 считаются «отличными». Среднеквадратичная ошибка прогноза (RMSEP) является дополнительной статистической мерой, используемой для оценки качества прогнозирования модели. Низкое значение RMSEP указывает на хорошую прогнозную модель [41].
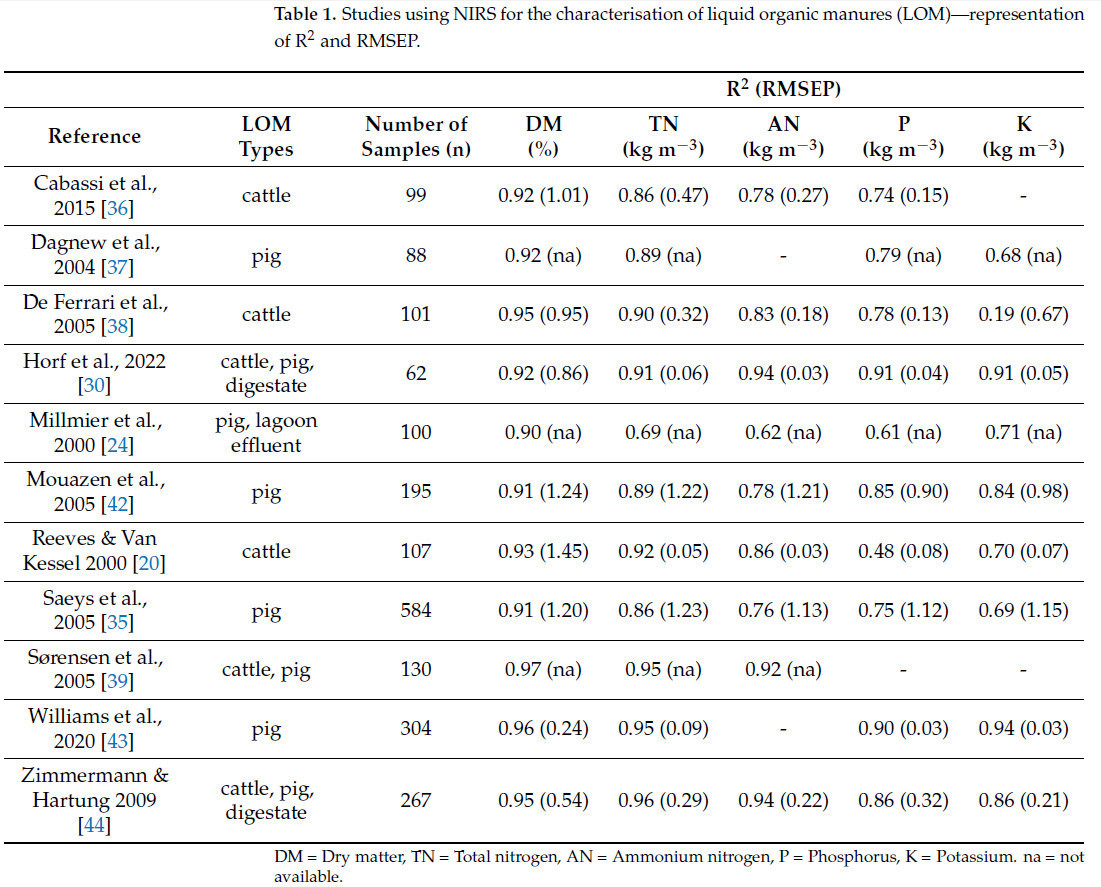
За последние два с половиной десятилетия было проведено несколько исследований, посвященных производительности NIRS для измерения характеристик ЖОУ, имеющих значение для принятия фермерами решений о нормах внесения. Большинство исследований посвящены анализу ЖОУ КРС или свиней. В дополнение, в таблице перечислены два исследования с биогазовыми остатками. Количество образцов колеблется от 62 до 584 образцов (Таблица 1).
Таблица 1. Исследования с использованием NIRS для характеристики жидких органических удобрений (ЖОУ) — представление R² и RMSEP.
В целом эти исследования показывают очень хорошую точность прогнозирования для СВ (значения R² выше 0.9). Также содержание TN и AN в ЖОУ, как правило, можно хорошо оценить с использованием технологии NIRS. Коэффициенты корреляции для этих двух компонентов были чуть выше 0.6 только в исследовании Millmier и др. [24], что может быть связано с выбором трех совершенно разных типов органических удобрений, два из которых находятся в жидкой форме, а один — в твердой.
На основе оцененных исследований точность определения P и K с помощью NIRS менее надежна. В исследованиях, проведенных Cabassi и др. [36], Dagnew и др. [37], De Ferrari и др. [38], Horf и др. [30], Saeys и др. [35] и Zimmermann и Hartung [44], P был определен с приемлемыми коэффициентами корреляции (R² > 0.7). Millmier и др. [24] и Reeves и Van Kessel [20], напротив, не показали приемлемых корреляций между референсными данными и данными NIRS. Определение K полностью не удалось в двух из одиннадцати исследований [37,40] и было определено очень хорошо только в исследованиях Zimmermann и Hartung [44], Horf и др. [30], Mouazen и др. [42] и Williams и др. [43].
Одна из возможных причин различной точности прогнозирования датчиков NIRS в отдельных исследованиях может также заключаться в типе подготовки образца (т.е., жидкий или высушенный), который затем измеряется с помощью NIRS. В лаборатории образцы ЖОУ обычно предварительно обрабатывают перед измерением с помощью NIRS. Horf и др. [45] обнаружили, что ни фильтрация, ни центрифугирование, ни сушка образцов жидкого навоза не улучшают точность прогнозирования содержания питательных веществ и сухого вещества по сравнению с сырыми образцами ЖОУ. Результаты также не зависели от того, были ли концентрации основаны на сыром или сухом веществе.
Следует также отметить, что результаты могут различаться в зависимости от типа оценки, например, какой алгоритм использовался для расчета данных. Существуют различные программы, которые математически оценивают взаимосвязь между спектрами и измеренными значениями. Для анализа спектров NIR используются различные методы многомерного анализа, совокупность которых обозначается как хемометрия. Для калибровок можно использовать не одну точку данных, а определенные участки или весь спектр. Из-за количества структурной информации, используемой для создания метода, даже мельчайшие различия в спектрах должны быть записаны и проанализированы. В будущем алгоритмы на основе ИИ также могут привести к значительным улучшениям в оценке спектров.
В целом можно сказать, что NIRS подходит для определения СВ и важных питательных веществ в ЖОУ. Если бы этот метод также можно было использовать онлайн и на ферме, было бы возможно гораздо более целенаправленное использование ЖОУ.
6. Использование NIRS для характеристики ЖОУ на ферме
Хотя NIRS, очевидно, подходит для характеристики ЖОУ, необходимо учитывать, что на сегодняшний день большинство исследований были посвящены экспериментам в лаборатории, т.е. в контролируемых условиях. Только очень немного исследований о надежности данных, собранных с помощью датчиков NIRS, фактически проводились на фермах в реальных условиях.
6.1. Испытания датчиков NIRS для измерения питательных веществ в ЖОУ на ферме
В экспериментах, проведенных Zimmermann и др. [46], система NIRS была установлена на навозоразбрасывателе объемом 18 м³ для онлайн-мониторинга концентрации питательных веществ во время внесения ЖОУ. Испытания проходили в Шлезвиг-Гольштейне, Германия, и использовались разные типы навоза: крупного рогатого скота, свиней и биогазовые дигестаты. Оптимальное положение установки измерительной головки NIRS было определено в предварительных испытаниях. Использовался NIR-спектрометр Polytec PSS 1720 (Polytec GmbH, Вальдбронн, Германия), который охватывает диапазон длин волн от 850 до 1650 нм. Было разработано специальное защитное корпусное устройство для защиты датчика во время полевых испытаний по внесению. Образцы сравнения отбирались через отсечной клапан, а затем анализировались в аккредитованной лаборатории. Система NIRS показала воспроизводимые результаты, и были рассчитаны коэффициенты корреляции между лабораторными данными и NIRS для СВ, TN, AN, P и K. Были обнаружены высокие корреляции между значениями NIRS и референсными значениями, проанализированными в лаборатории (R² = 0.95–0.99).
В 2009 году Zimmermann и Hartung [44] опубликовали всесторонний отчет. Целью этих испытаний была оценка возможности калибровки датчика NIRS для мобильного определения питательных веществ на ферме. Образцы сравнения отбирались во время текущих NIR-измерений. Калибровки NIRS были созданы с использованием алгоритма частичных наименьших квадратов и валидированы с использованием так называемого метода «полной перекрестной» проверки на основе в общей сложности 206 образцов навоза. Наивысшие корреляции для СВ (R² = 0.95) были достигнуты с жидким навозом КРС (n = 61). Для параметров TN, AN, P и K были проанализированы 49 образцов свиной жижи. Были получены следующие коэффициенты корреляции: TN = 0.96, AN = 0.94, P = 0.86. Лучший результат для смешанного навоза (n = 96) был показан для K с R² 0.86.
В исследовании Stenberg и Gustafsson [47] 73 образца навоза молочного скота, свиней и биогаза были проанализированы на испытательном стенде, имитирующем реальный разбрасыватель навоза. Кроме того, 13 образцов биогазовой жижи были проанализированы во время полевого внесения. Для этих экспериментов использовался NIR-датчик от Tec5 (Оберурзель, Германия) с детектором PGS-NIR1.7 (Carl Zeiss AG, Оберкохен, Германия). На испытательном стенде измерительная головка NIRS была прикреплена к трубке диаметром 100 мм и подключена к контейнеру, содержащему 100 л тестовой жижи. Жижа перекачивалась через трубную систему стенда, чтобы имитировать поток навоза в реальном разбрасывателе. Каждая жижа анализировалась при трех различных скоростях перекачки для повышения устойчивости калибровок. Для референсного анализа во время циркуляции жижи отбирались пробы объемом 1 л и анализировались в лаборатории. Во время полевого внесения биогазовой жижи с каждой загрузки записывалось 38 спектров. Калибровки были созданы с использованием PLSR и лучше всего работали для СВ. В целом концентрации питательных веществ в жидком навозе КРС показали лучшие прогнозы, чем в свиной жиже или биогазовых дигестатах. Были получены следующие коэффициенты корреляции для СВ для отдельных типов навоза: Жидкий навоз КРС 0.90 (n = 22), свиная жижа 0.74 (n = 27) и биогазовый дигестат 0.67 (n = 24). Для TN и AN результаты были даны только для жидкого навоза КРС (R² = 0.81 и 0.44) и свиной жижи (R² = 0.46 и 0.24). Для фосфора коэффициенты корреляции составили: Жидкий навоз КРС 0.61 (n = 22), свиная жижа 0.57 (n = 27) и биогазовый дигестат 0.39 (n = 24).
Thiessen и др. [48] построили испытательный стенд, на котором установили пять различных датчиков NIRS. Для гомогенизации жижи путем ее циркуляции на испытательном стенде использовался цистерна-разбрасыватель. Эта система была протестирована на 13 фермах в северной Германии. Всего было отобрано 51 различных типов навоза, включая свиной, крупного рогатого скота, биогазовый и смешанный навоз. Для измерения примерно 6 м³ навоза перекачивали через испытательный стенд до тех пор, пока навоз не становился хорошо гомогенизированным. Датчики NIRS показали средние отклонения 22–23% от референсного результата для СВ. Для TN четыре из пяти датчиков показали отклонения 24–38%. Для параметров AN, P и K датчики показали столь же высокие отклонения 38–54%, 36–69% и 25–72% соответственно. По мнению авторов, хорошие результаты для СВ были связаны с зависимостью между водой и СВ, поскольку вода приводит к сильным сигналам в спектре NIR. Авторы предполагают, что результаты для других питательных веществ были плохими по сравнению с другими исследованиями, потому что датчики измеряли неизвестные образцы в условиях фермы, и измеренные значения плохо вписывались в существующие калибровочные модели.
6.2. Процедуры испытаний коммерчески доступных датчиков NIRS в Германии
Более 15 лет несколько компаний предлагают в Германии датчики NIRS для использования на ферме и установки на стационарные насосы для заполнения транспортных средств для жидкого навоза непосредственно на месте хранения или на машины для внесения для измерения проходящих ЖОУ. Три соответствующих поставщика включают John Deere GmbH & Co., KG (Валльдорф, Германия), m-u-t GmbH (Ведель, Германия) в сотрудничестве с Zunhammer GmbH (Траунройт, Германия) и Dinamica Generale S.p.A. (Поджо-Руско, Италия). Насосы для навозной жижи или цистерны-разбрасыватели с соответствующей сенсорной технологией либо эксплуатируются подрядчиками, либо самими фермерами. Одной из мотиваций для фермеров покупать такие датчики NIRS является возможность использовать измеренные значения NIRS для документации компонентов ЖОУ в соответствии с положениями законодательства об удобрениях при размещении ЖОУ на рынке и непосредственно перед внесением ЖОУ в поле. Поэтому для фермеров, использующих датчики NIRS, важно, чтобы качество устройств было сертифицировано, поскольку в Германии для официальной документации разрешены только научно признанные методы.
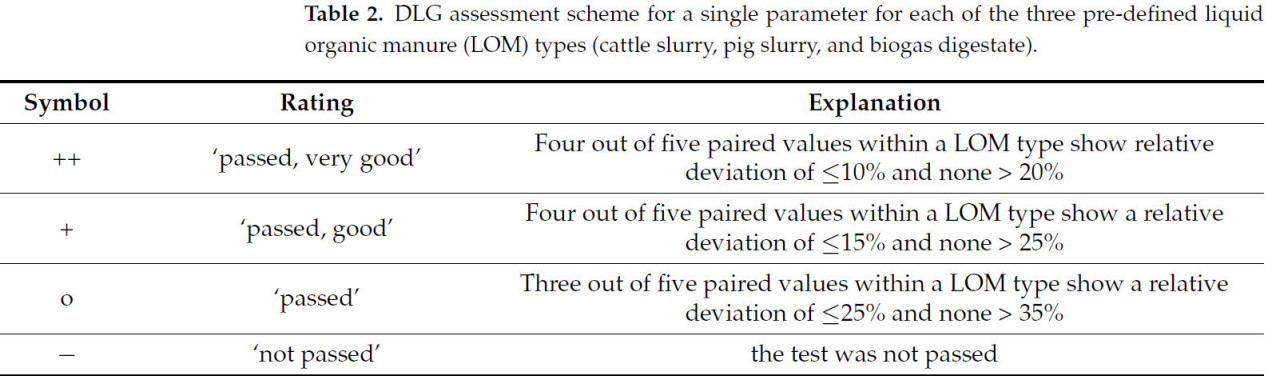
Немецкое сельскохозяйственное общество (DLG) проводит испытания в условиях, близких к фермерским. Они тестируют мобильные датчики NIRS для определения компонентов в ЖОУ (т.е., жидкого навоза животноводческих ферм (жидкий навоз КРС, свиная жижа и смешанный навоз из жидкого навоза КРС и свиной жижи) и биогазовых остатков от сбраживания жидкого навоза КРС и свиней с добавлением возобновляемого сырья) для определения эквивалентности с лабораторным анализом с использованием официально признанных методов [49]. Этот тест DLG охватывает параметры: СВ, TN, AN, P и K, и для этих испытаний выбираются пять типичных ЖОУ с разных ферм на основе содержания сухого вещества (жидкий навоз КРС с 4–9% СВ, свиная жижа с 2–7% СВ и дигестат с 5–8% СВ). Для каждого испытания количество от 3 до 5 м³ ЖОУ перекачивается в контейнер, оборудованный насосом и стандартной трубной системой. Затем к трубной системе подключаются датчики, подлежащие испытанию, и байпас для отбора лабораторного образца сравнения. На первом этапе ЖОУ тщательно гомогенизируется путем непрерывной перекачки. Затем датчики NIRS включаются. Как только отображаемые измеренные значения стабилизируются, данные NIRS документируются, и образцы отбираются через байпас для референсного анализа в лаборатории. Образцы ЖОУ сразу после сбора глубоко замораживаются при -18 °C и отправляются в пять различных аккредитованных лабораторий для анализа. Затем относительное отклонение значения датчика для каждого параметра по сравнению с референсным значением (рассчитанное как среднее арифметическое пяти лабораторных результатов) используется для проверки точности измерения датчиков NIRS. Отдельные параметры типа ЖОУ сертифицируются в соответствии с каталогом критериев, разработанным испытательным центром DLG (Таблица 2). В качестве минимального требования DLG установила, что содержание TN должно надежно определяться с помощью датчика NIRS, т.е., испытание для этого компонента должно быть пройдено.
Таблица 2. Схема оценки DLG для отдельного параметра для каждого из трех предопределенных типов жидких органических удобрений (ЖОУ) (жидкий навоз КРС, свиная жижа и биогазовый дигестат).
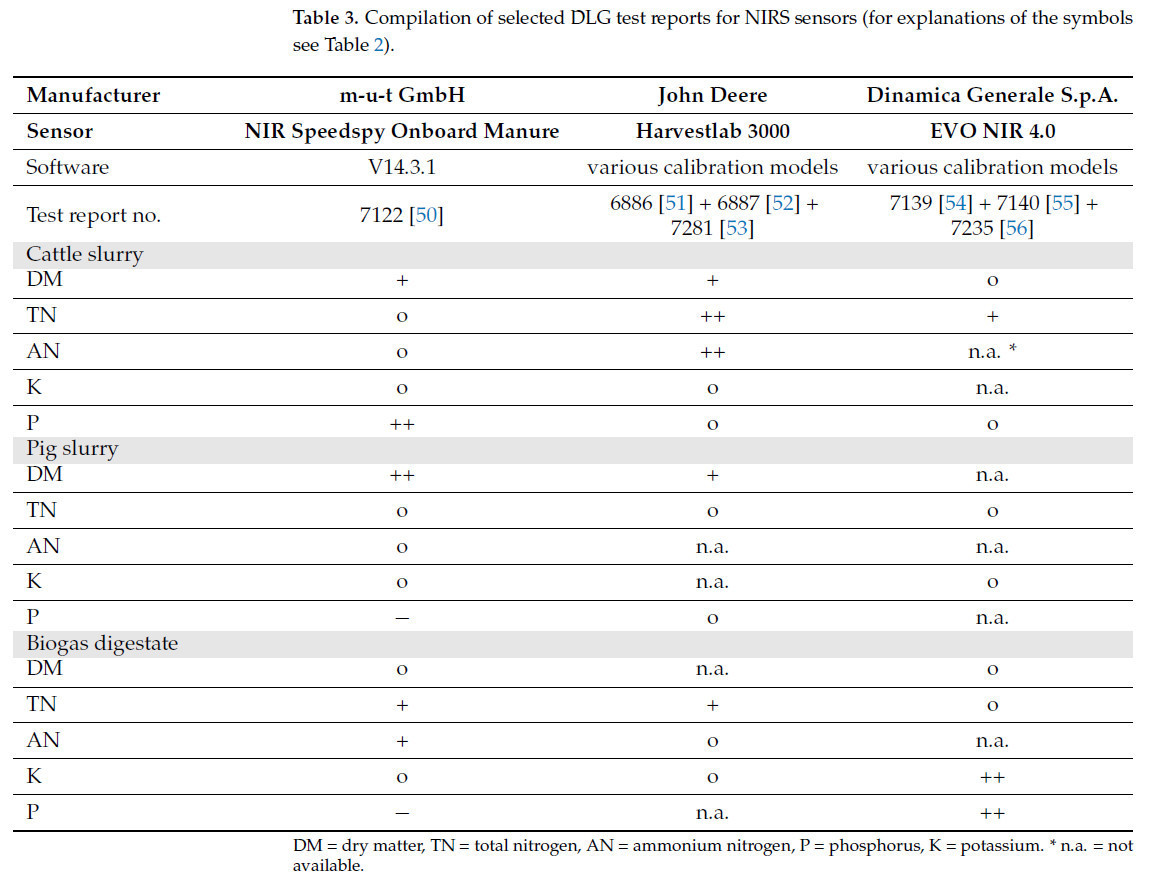
Таблица 3 обобщает отчеты об испытаниях DLG для датчиков NIRS от трех производителей, которые предлагают соответствующие устройства для использования на ферме в Германии, классифицированные по соответствующим компонентам для типов ЖОУ: жидкий навоз КРС, свиная жижа и биогазовый дигестат.
Таблица 3. Сводка выбранных отчетов об испытаниях DLG для датчиков NIRS (пояснения к символам см. в Таблице 2).
Среди трех коммерчески доступных датчиков NIRS для использования на ферме в Германии определение СВ в жидком навозе КРС классифицируется как «хорошее» для датчиков от m-u-t GmbH и John Deere согласно классификации DLG. Напротив, датчик от Dinamica Generale S.p.A. прошел испытание только для СВ в жидком навозе КРС. Для анализа TN и AN в жидком навозе КРС только Harvestlab 3000 от John Deere получил оценку «очень хорошо». Датчик от m-u-t GmbH достиг оценок «пройдено» в испытании для TN и AN. Согласно тесту DLG, EVO NIR 4.0 от Dinamica Generale S.p.A. был «хорошим» для определения TN, в то время как данные для AN отсутствуют. Что касается K в жидком навозе КРС, два из трех датчиков получили оценку «пройдено», в то время как данные для датчика от Dinamica Generale S.p.A. отсутствуют. Для P только датчик от m-u-t GmbH был оценен как «очень хорошо», тогда как два других датчика получили только оценку «пройдено» для этого параметра.
В случае свиной жижи СВ можно определять с оценкой «хорошо» или «очень хорошо» двумя датчиками, однако для этого параметра для датчика от Dinamica Generale S.p.A. данные отсутствуют. Все датчики успешно прошли испытание для TN в свиной жиже. Для AN датчик от m-u-t GmbH получил оценку «пройдено», тогда как для двух других датчиков данные отсутствуют. Для K в свиной жиже два датчика завершили испытание с оценкой «пройдено», в то время как данные для датчика от John Deere отсутствуют. Согласно оценке DLG, только датчик от John Deere надежно измерял P в свиной жиже. Два других датчика либо не прошли испытание на фосфор (m-u-t GmbH), либо не предоставили данных (Dinamica Generale S.p.A.).
Для биогазовых остатков испытание на измерение СВ получило оценку «пройдено» для двух датчиков, в то время как данные для датчика от John Deere отсутствуют. TN в биогазовом дигестате был определен как «хороший» датчиками от m-u-t GmbH и John Deere, тогда как датчик от Dinamica Generale S.p.A. завершил испытание только с оценкой «пройдено». Для AN оценки различались среди трех датчиков: датчик m-u-t GmbH был оценен как «хороший», датчик John Deere был оценен как «пройдено», а данные для датчика Dinamica Generale S.p.A. отсутствуют. Согласно оценке DLG, P и K в биогазовых остатках были оценены как «очень хорошо» только для датчика Dinamica Generale S.p.A. Два других датчика получили «пройдено» для K. Что касается P, NIR speedspy onboard manure от m-u-t GmbH был оценен как «не пройден», и данные для Harvestlab 3000 от John Deere отсутствуют.
6.3. Факторы, влияющие на надежность измерений NIRS на ферме
При использовании датчиков NIRS для практического применения на фермах или непосредственно для внесения в поле существует множество факторов, которые могут повлиять на измерение и поэтому должны быть приняты во внимание. В отличие от измерения NIRS в лаборатории с контролируемыми условиями, температура окружающей среды, движения и вибрации машин, температура измеряемой жижи и ограниченные навыки недостаточно обученных пользователей, например, могут играть важную роль в практических условиях фермерского хозяйства и влиять на измерение с помощью датчиков и, следовательно, на надежность измеренных значений.
Гомогенизация ЖОУ перед измерением также может влиять на измерение NIRS и надежность определяемых значений. Жидкие органические удобрения быстро расслаиваются, поскольку более тяжелые компоненты опускаются на дно, а более легкие образуют плавающий слой наверху. Твердая фаза в основном содержит органически связанные элементы в более высоких концентрациях, такие как P, Mg, Ca и N, в то время как AN и K растворены в жидкой фазе [14]. Поэтому хорошая гомогенизация важна, потому что чем равномернее компоненты распределены в ЖОУ, тем лучше датчики NIRS могут измерять компоненты, поскольку мелкомасштабная неоднородность в ЖОУ ниже, не возникают очень кратковременные колебания концентрации.
В лабораторной эксплуатации датчиков NIRS измерение, а также документирование и интерпретация измеренных значений выполняются обученным персоналом, чтобы минимизировать ошибки измерения. Кроме того, обязательной является процедура непрерывного контроля качества в аккредитованных лабораториях. Использование датчиков NIRS на ферме вовлекает множество разных людей, таких как управляющие фермами и сотрудники сельскохозяйственных подрядчиков, которым необходимо научиться пользоваться датчиками, чтобы обеспечить надежные измерения. Это требует открытости и готовности операторов ознакомиться с новой технологией. Это особенно ключевой момент, потому что основное внимание подрядчиков, например, обычно сосредоточено не на проведении высококачественных измерений, а на внесении определенного количества питательных веществ с помощью датчика NIRS. Регулярное обучение и повышение квалификации в этом отношении также могут помочь обеспечить правильную эксплуатацию датчиков.
Поскольку ЖОУ сильно различаются по своему составу, пользователь должен знать, какой тип ЖОУ следует измерять с помощью датчика, т.е., в каком диапазоне вероятно ожидать концентраций СВ и питательных веществ. Также следует отметить, что датчики NIRS подходят в очень ограниченной степени для измерения специальных ЖОУ, таких как ЖОУ с очень низким или очень высоким содержанием СВ, биогазовые остатки от биогазовых установок с высоким поступлением сухого птичьего помета, производственные отходы пищевой промышленности или аналогичные вещества. Физически или химически действующие добавки к ЖОУ, такие как глинистые минералы, кислоты, хлорид железа-III или ингибиторы нитрификации, а также физически действующие меры, такие как разделение и массивное добавление воды (разбавление), изменяют оптический спектр ЖОУ. Таким образом, ЖОУ, обработанные таким образом, не могут быть определены с помощью NIRS.
6.4. Плюсы и минусы технологии измерения NIRS для тестирования ЖОУ
Непрерывная регистрация с помощью измерений NIRS во время внесения ЖОУ в поле позволяет целенаправленно вносить предопределенное количество питательных веществ в кг на гектар (а не просто определенное количество ЖОУ на гектар) на площадь. Датчик позволяет регулировать норму внесения на ходу в соответствии с измеренными концентрациями питательных веществ в ЖОУ и скоростью транспортного средства, и количество внесенных питательных веществ также автоматически документируется. На основе ранее созданных карт внесения также возможно переменное внесение питательных веществ в пределах поля [57]. Таким образом, например, можно компенсировать различия в поставке определенных питательных веществ в почву или растительный покров. Скорее всего, внесение тогда будет сосредоточено на доступном для растений азоте (т.е., содержании AN) в ЖОУ, который необходимо внести, поскольку N имеет первостепенное значение для роста сельскохозяйственных культур в текущий вегетационный период и, в конечном итоге, для урожайности и качества культуры. Потребность в других питательных веществах может быть удовлетворена с помощью прецизионного внесения минеральных удобрений.
Недостатками использования датчиков NIRS на ферме являются то, что измерение охватывает только определенные параметры, а точность, а также воспроизводимость значений NIRS сильно зависят от качества калибровки (т.е., силы взаимосвязи между лабораторными значениями и значениями NIRS и репрезентативности образцов ЖОУ, использованных для этой калибровки). Также необходимо учитывать затраты на использование системы NIRS. Они возникают непосредственно у фермера при покупке систем NIRS или передаются фермеру косвенно подрядчиком через цену за внесение. Как упоминалось ранее, диапазон параметров, которые можно регистрировать при измерении ЖОУ с использованием технологии NIRS, ограничен. Кроме того, необходимо иметь в виду, что разные виды животных, корма или добавки к навозу влияют на измерение, поэтому для каждого типа навозной жижи должны быть доступны всеобъемлющие калибровочные модели [58]. Для калибровки рассчитывается регрессия спектральных данных с лабораторными данными для соответствующих компонентов соответствующих образцов сравнения [59]. Чем точнее референсный метод, тем выше точность измерения NIRS [59].
7. Выводы
Спектроскопия ближнего инфракрасного диапазона хорошо зарекомендовала себя в лабораториях для анализа многих различных сельскохозяйственных продуктов, включая ЖОУ. Преимущества NIRS заключаются в том, что она быстрая, бесконтактная и способна непрерывно генерировать большое количество измеренных значений.
Для повышения точности калибровка датчиков должна быть дальнейшим образом разработана. Это самый важный способ предоставить фермеру надежные данные. Более того, надежность технологии NIRS в практическом использовании должна быть дальнейшим образом улучшена. Например, необходимо оценить влияние различных мест установки датчика NIRS (особенно в отношении так называемой напорной стороны по сравнению с всасывающей). Кроме того, экстремальные отклонения от обычных стандартных значений для определенного типа ЖОУ должны указываться пользователю. Кроме того, репрезентативные образцы ЖОУ также следует отбирать несколько раз в течение периода внесения ЖОУ при использовании технологии NIRS. Эти образцы затем анализируются в лаборатории, чтобы сравнить содержание питательных веществ со значениями, измеренными датчиком NIRS, и, при необходимости, скорректировать значения NIRS с использованием поправочного коэффициента.
Следует также отметить, что в настоящее время, насколько нам известно, в Германии, Европе или других регионах мира не существует стандартизированной процедуры утверждения устройств NIRS. Например, в различных федеральных землях Германии существуют разные правила относительно того, в какой степени NIRS разрешена для регистрации содержания питательных веществ в ЖОУ или могут ли значения, определенные с помощью NIRS, использоваться для целей документации в рамках Немецкого постановления об удобрениях. В настоящее время некоторые официальные консультационные органы (например, Бавария, Северный Рейн-Вестфалия) разрешают использование данных NIRS для целей документации, в то время как в других регионах (например, Нижняя Саксония) это не разрешено.
Для того чтобы оптимально использовать потенциал технологии измерения NIRS в будущем, калибровки необходимо расширить и улучшить, чтобы датчики могли выдавать точные и воспроизводимые результаты для различных типов ЖОУ. Также следует внедрить регулярное техническое обслуживание и проверку технических характеристик устройств NIPS независимой организацией. Для достижения высокого уровня принятия среди фермеров на практике должна быть введена официальная система обеспечения качества для датчиков NIRS (сопоставимая с обязательным техническим осмотром опрыскивателей для защиты растений в Германии). Основываясь на представленном здесь обзоре, мы видим, что это единственный способ гарантировать, что будут достигнуты надежные результаты (т.е. значения содержания питательных веществ, которые хорошо соответствуют лабораторным значениям), чтобы анализ питательных веществ с помощью NIRS мог, наконец, также использоваться для повышения точности внесения и для целей документации.
Ссылки
1. Herrera, A.; D’Imporzano, G.; Zilio, M.; Pigoli, A.; Rizzi, B.; Meers, E.; Schouman, O.; Schepis, M.; Barone, F.; Giordano, A.; et al. Environmental performance in the production and use of recovered fertilizers from organic wastes treated by anaerobic digestion vs synthetic mineral fertilizers. ACS Sustain. Chem. Eng. J. 2022, 10, 986–997. [Google Scholar] [CrossRef] [PubMed]
2. Shaji, H.; Chandran, V.; Mathew, L. Organic fertilizers as a route to controlled release of nutrients. Control. Release Fertil. Sustain. Agric. 2021, 231–245. [Google Scholar]
3. Lin, Y.; Ye, G.; Kuzyakov, Y.; Liu, D.; Fan, J.; Ding, W. Long-term manure application increases soil organic matter and aggregation, and alters microbial community structure and keystone taxa. Soil Biol. Biochem. 2019, 134, 187–196. [Google Scholar] [CrossRef]
4. Withers, P.; Haygarth, P.M. Agriculture, phosphorus and eutrophication. Soil Use Manag. 2007, 23, 1–4. [Google Scholar] [CrossRef]
5. Saeys, W.; Watté, R.; Postelmans, A. The Role of NIR Spectroscopy in Precision Fertilisation with Manure; IFS Proceedings 840, 1-22; International Fertiliser Society: York, UK, 2019. [Google Scholar]
6. DESTATIS. Wirtschaftsdünger tierischer Herkunft in landwirtschaftlichen Betrieben/Landwirtschaftszählung—Fachserie 3 Reihe 2.2.2—2020. Available online: https://www.destatis.de/DE/Themen/Branchen-Unternehmen/Landwirtschaft-Forstwirtschaft-Fischerei/Produktionsmethoden/Publikationen/Downloads-Produktionsmethoden/wirtschaftsduenger-2030222209004.pdf?_blob=publicationFile (accessed on 19 August 2024).
7. Chen, L.; Xing, L.; Han, L.; Yang, Z. Evaluation of physicochemical models for rapidly estimating pig manure nutrient content. Biosyst. Eng. 2009, 103, 313–320. [Google Scholar] [CrossRef]
8. Martínez-Suller, L.; Azzellino, A.; Provolo, G. Analysis of livestock slurries from farms across Northern Italy: Relationship between indicators and nutrient content. Biosyst. Eng. 2008, 99, 540–552. [Google Scholar] [CrossRef]
9. Landwirtschaftskammer Niedersachsen. Nährstoffgehalte in Organischen Wirtschaftsdüngern und Mineralischen Düngemitteln. Available online: https://www.duengebehoerde-niedersachsen.de/duengebehoerde/news/32460_Naehrstoffgehalte_in_organischen_Wirtschaftsduengern_und_mineralischen_Duengemitteln (accessed on 1 October 2024).
10. Boxberger, J. Gülleaufbereitung. In Praxishandbuch Oganische Düngung; Boxberger, J., Mayer, J., Möller, K., Pöllinger, A., Eds.; Erling Verlag: Clenze, Germany, 2020; pp. 502–520. [Google Scholar]
11. Alburquerque, J.A.; de La Fuente, C.; Bernal, M.P. Chemical properties of anaerobic digestates affecting C and N dynamics in amended soils. Agric. Ecosyst. Environ. 2012, 160, 15–22. [Google Scholar] [CrossRef]
12. DLG-Merkblatt 397: Gärreste im Ackerbau effizient nutzen. Available online: https://www.dlg.org/mediacenter/dlg-merkblaetter/dlg-merkblatt-397-gaerreste-im-ackerbau-effizient-nutzen (accessed on 1 October 2024).
13. Mahmud, K.; Panday, D.; Mergoum, A.; Missaoui, A. Nitrogen losses and potential mitigation strategies for a sustainable agroecosystem. Sustainability 2021, 13, 2400. [Google Scholar] [CrossRef]
14. Saeys, W. Technical Tools for the Optimal Use of Animal Manure as a Fertiliser: On-line Composition Measurement and Manure Injection Control. Ph.D. Dissertation, Katholieke Universiteit Leuven, Leuven, Belgium, 2006. [Google Scholar]
15. Piepel, M.-F.; Olfs, H.-W. Development of a physicochemical test kit for on-farm measurement of nutrients in liquid organic manures. Agriculture 2023, 13, 477. [Google Scholar] [CrossRef]
16. Lugo-Ospina, A.; Dao, T.H.; Van Kessel, J.A.; Reeves, J.B. Evaluation of quick tests for phosphorus determination in dairy manures. Environ. Pollut. 2005, 135, 155–162. [Google Scholar] [CrossRef]
17. Piepel, M.-F.; Dittert, K.; Olfs, H.-W. Evaluation of physicochemical on-farm quick tests for estimating nutrient concentrations in pig slurry and development of an application for mobile devices. Agronomy 2022, 12, 2809. [Google Scholar] [CrossRef]
18. Chen, L.; Xing, L.; Han, L. Review of the application of near-infrared spectroscopy technology to determine the chemical composition of animal manure. J. Environ. Qual. 2013, 42, 1015–1028. [Google Scholar] [CrossRef]
19. Van Kessel, J.S.; Thompson, R.B.; Reeves, J.B. Rapid on-farm analysis of manure nutrients using quick tests. J. Prod. Agric. 1999, 12, 215–224. [Google Scholar] [CrossRef]
20. Van Kessel, J.S.; Reeves, J.B. On-farm quick tests for estimating nitrogen in dairy manure. J. Dairy Sci. 2000, 83, 1837–1844. [Google Scholar] [CrossRef]
21. Singh, A.; Bicudo, J.R. Dairy manure nutrient analysis using quick tests. Environ. Technol. 2005, 26, 471–478. [Google Scholar] [CrossRef] [PubMed]
22. Chakravarthy, K.; Nekwaya, L.; Nabeneza, S.; Tillard, E.; Marblé, Y.; Salgado, P.; Lecomte, P. Literature review on the applicability of near infrared reflectance spectroscopy (NIRS) to predict the chemical composition of forages, soil and animal organic matter samples. In Proceedings of the International Conference ‘INDIGENOUS’, Hyderabad, India, 28–31 January 2016. [Google Scholar]
23. Noack, P.O. Einsatz von Multi- und Hyperspektralsensoren in der Landwirtschaft. Available online: https://www.dgpf.de/src/tagung/jt2018/proceedings/proceedings/papers/16_PFGK18_Noack.pdf (accessed on 7 October 2024).
24. Millmier, A.; Lorimor, J.; Hurburgh, C.J.R.; Fulhage, C.; Hattey, J.; Zhang, H. Near-infrared sensing of manure nutrients. Trans. ASAE 2000, 43, 903–908. [Google Scholar] [CrossRef]
25. Quiñones, M.d.C.S.; Martinez, L.A.O.; Herrera, S.M.G.; Quiñones, O.M.R.; Laredo, R.F.G. Near-infrared spectroscopy (NIRS) applied to legume analysis: A review. Int. J. Eng. Innov. Technol. 2018, 8, 29–39. [Google Scholar]
26. Cozzolino, D.; Fassio, A.; Fernández, E.; Restaino, E.; La Manna, A. Measurement of chemical composition in wet whole maize silage by visible and near-infrared reflectance spectroscopy. Anim. Feed Sci. Technol. 2006, 129, 329–336. [Google Scholar] [CrossRef]
27. Scotter, C.N.G. Non-destructive spectroscopic techniques for the measurement of food quality. Trends Food Sci. Technol. 1997, 9, 285–292. [Google Scholar] [CrossRef]
28. Schmidt, W. Optical Spectroscopy in Chemistry and Life Sciences; Wiley-VCH Verlag: Weinheim, Germany, 2005. [Google Scholar]
29. Tsenkova, R.; Atanassova, S.; Kawano, S.; Toyoda, K. Somatic cell count determination in cow’s milk by near-infrared spectroscopy: A new diagnostic tool. J. Anim. Sci. 2001, 79, 2550–2557. [Google Scholar] [CrossRef]
30. Horf, M.; Vogel, S.; Drücker, H.; Gebbers, R.; Olfs, H.-W. Optical spectrometry to determine nutrient concentrations and other physicochemical parameters in liquid organic manures: A review. Agronomy 2022, 12, 514. [Google Scholar] [CrossRef]
31. Wold, H. Soft modelling by latent variables: The non-linear iterative partial least squares (NIPALS) approach. J. Appl. Probab. 1995, 12, 117–142. [Google Scholar] [CrossRef]
32. Mevik, B.-H.; Wehrens, R. The pls package: Principal component and partial least squares regression in R. J. Stat. Softw. 2007, 18, 1–23. [Google Scholar] [CrossRef]
33. Burns, D.A.; Ciurczak, E.W. Handbook of Near-Infrared Analysis; CRC Press: Boca Raton, FL, USA; Taylor & Francis Group: New York, NY, USA, 2008; Volume 35. [Google Scholar]
34. Restaino, E.A.; Fernández, E.G.; La Manna, A.; Cozzolino, D. Prediction of the nutritive value of pasture silage by near infrared spectroscopy (NIRS). Chil. J. Agric. Res. 2008, 69, 560–566. [Google Scholar] [CrossRef]
35. Saeys, W.; Mouazen, A.M.; Ramon, H. Potential for onsite and online analysis of pig manure using visible and near infrared reflectance spectroscopy. Biosyst. Eng. 2005, 91, 393–402. [Google Scholar] [CrossRef]
36. Cabassi, G.; Cavalli, D.; Fuccella, R.; Marino Gallina, P. Evaluation of four NIR spectrometers in the analysis of cattle slurry. Biosyst. Eng. 2015, 133, 1–13. [Google Scholar] [CrossRef]
37. Dagnew, M.; Crowe, T.; Schoenau, J. Measurement of nutrients in Saskatchewan hog manures using near-infrared spectroscopy. Can. Biosyst. Eng. 2004, 46, 33–37. [Google Scholar]
38. De Ferrari, G.; Gallina, P.M.; Cabassi, G.; Bechini, L.; Maggiore, T. Near infrared spectral analysis of cattle slurries from Lombardy (Northern Italy) breeding farms. In NZNIRSS—The New Zealand Near Infrared Spectroscopy Society (Eds.) NIR 2005-NIR in Action. Making a Difference; NZNIRSS: Auckland, New Zealand, 2005; pp. 376–383. [Google Scholar]
39. Sørensen, P.; Birkmose, T.S.; Hansen, M.; Sørensen, L.K. Rapid analysis of animal slurry by NIR spectroscopy. In Proceedings from the Seminar Manure—An Agronomic and Environmental Challenge; Stenberg, M., Nilsson., H., Brynjolfsson, R., Kapuinen, P., Morken, J., Søndergaard, B., Eds.; Nordiska Jordbruksforskares Förening (NJF): Uppsala, Sweden, 2005; pp. 94–95. [Google Scholar]
40. Evangelista, C.; Basiricò, L.; Bernabucci, U. An overview on the use of near infrared spectroscopy (NIRS) on farms for the management of dairy cows. Agriculture 2021, 11, 296. [Google Scholar] [CrossRef]
41. Williams, P. Near-Infrared Technology—Getting the Best Out of Light; PDK Grain: Nanaimo, BC, Canada, 2003. [Google Scholar]
42. Mouazen, A.M.; Saeys, W.; Xing, J.; de Baerdemaeker, J.; Ramon, H. Near infrared spectroscopy for agriculture materials: An instrument comparison. J. Near Infrared Spectrosc. 2005, 13, 87–97. [Google Scholar] [CrossRef]
43. Williams, P.; Eising, E.; Malley, D.F. Industrial-scale continuous on-line analysis of liquid hog manure by NIRS. NIR News 2020, 31, 25–29. [Google Scholar] [CrossRef]
44. Zimmermann, A.; Hartung, E. Nährstoffgesteuerte Gülleausbringung; Christian-Albrechts-Universität, Institut für Landwirtschaftliche Verfahrenstechnik: Kiel, Germany, 2009; pp. 1–130. [Google Scholar]
45. Horf, M.; Gebbers, R.; Olfs, H.-W.; Vogel, S. Effects of sample pre-treatments on the analysis of liquid organic manures by visible and near-infrared spectrometry. Heliyon 2024, 10, e27136. [Google Scholar] [CrossRef] [PubMed]
46. Zimmermann, A.; Thiessen, E.; Hartung, E. Near-Infrared Spectroscopy (NIRS) for a Nutrient Based Slurry Application. Available online: https://www.cabidigitallibrary.org/doi/pdf/10.5555/20103074871 (accessed on 27 August 2024).
47. Stenberg, B.; Gustafsson, K. On-line measurement of animal and bio slurry quality variations with near infrared spectroscopy. Precis. Agric. 2013, 13, 337–342. [Google Scholar]
48. Thiessen, E.; Eslamifar, M.; Kock, R.; Hartung, E. On farm validation of different NIR sensors for manure sensing. VDI-Berichte 2022, 2406, 9–16. [Google Scholar]
49. DLG. Qualität auf den Punkt gebracht. Available online: https://www.dlg.org/tests/landtechnik-betriebsmittel/dlg-auszeichnungen-im-ueberblick#c30255 (accessed on 7 October 2024).
50. DLG. Test Report 7122 (m-u-t GmbH). Available online: https://pruefberichte.dlg.org/filestorage/7122.pdf (accessed on 21 August 2024).
51. DLG. Test Report 6886 (John Deere). Available online: https://pruefberichte.dlg.org/filestorage/6886.pdf (accessed on 21 August 2024).
52. DLG. Test Report 6887 (John Deere). Available online: https://pruefberichte.dlg.org/filestorage/6887.pdf (accessed on 21 August 2024).
53. DLG. Test Report 7281 (John Deere). Available online: https://pruefberichte.dlg.org/filestorage/7281.pdf (accessed on 21 August 2024).
54. DLG. Test Report 7139 (Dinamica Generale S.p.A.). Available online: https://pruefberichte.dlg.org/filestorage/7139.pdf (accessed on 21 August 2024).
55. DLG. Test Report 7140 (Dinamica Generale S.p.A.). Available online: https://pruefberichte.dlg.org/filestorage/7140.pdf (accessed on 21 August 2024).
56. DLG. Test Report 7235 (Dinamica Generale S.p.A.). Available online: https://pruefberichte.dlg.org/filestorage/7235.pdf (accessed on 21 August 2024).
57. Schlagge, B. Was NIR-Sensoren können. Überzeugt Nahinfrarotspektroskopie in der Düngepraxis? Bauernblatt 2022, 22, 8–10. [Google Scholar]
58. Hoffmann, A.; Lichti, F.; Olfs, H.-W.; Tillmann, P.; Severin, K.; Rest, T. Die Nahinfrarotspektroskopie (NIRS) zur Untersuchung von Güllen und Gärresten. Standpunkt des Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten e.V. (VDLUFA). Available online: https://www.vdlufa.de/wp-content/uploads/2022/06/2019-Standpunkt-NIRS-zur-Untersuchung-von-Guellen-und-Gaerresten-1.pdf (accessed on 7 October 2024).
59. Rubenschuh, U.; Volz, F. Nährstoffgehalte in Gülle online mit Sensoren bestimmen. Available online: https://www.dlg.org/fileadmin/downloads/Kompakt/DLGKompakt_08_19.pdf (accessed on 4 October 2024).
Höpker C, Dittert K, Olfs H-W. On-Farm Application of Near-Infrared Spectroscopy for the Determination of Nutrients in Liquid Organic Manures: Challenges and Opportunities. Agriculture. 2025; 15(2):185. https://doi.org/10.3390/agriculture15020185
Перевод статьи «On-Farm Application of Near-Infrared Spectroscopy for the Determination of Nutrients in Liquid Organic Manures: Challenges and Opportunities» авторов Höpker C, Dittert K, Olfs H-W., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
































































































Комментарии (0)