Как увеличить урожай чая: научный метод борьбы с цветением и вредителями
Чайные растения Camellia sinensis (L.) O. Kuntze потребляют значительное количество воды и питательных веществ в период цветения, что может негативно сказываться на урожайности и качестве чайного листа. Поэтому были исследованы эффекты тидиазурона, карбарила, этрела и известковой серы на цветочные почки и опадение цветков у чайных растений. После экзогенной обработки этими химическими веществами оценивались фотосинтетические характеристики и биохимический состав листьев, их электропроводность, а также распространенность насекомых-вредителей и повреждений от заморозков.
Аннотация
Результаты показали, что тидиазурон в концентрациях 0,015%, 0,03% и 0,06%, этрел в концентрации 0,08%, а также известковая сера в концентрациях 2,0% и 3,0% достоверно стимулировали опадение цветочных почек и цветков чая. Тидиазурон значительно повышал концентрации общих аминокислот, кофеина, катехинов и растворимых сахаров в чайных листьях, одновременно несколько снижая электропроводность листьев. Кроме того, он подавлял распространенность таких вредителей, как Empoasca onukii Matsuda (Hemiptera: Cicadellidae) и Apolygus lucorum Meyer-Dür (Hemiptera: Miridae). Более того, тидиазурон увеличивал длину и вес чайных побегов следующей ранней весной.
Обработка 3,0% известковой серой повышала содержание хлорофилла a и b, каротиноидов, катехинов и кофеина, а также уменьшала количество Aleurocanthus spiniferus Quaintanca (Hemiptera: Aleyrodidae) на чайных растениях. Однако существенных различий в степени повреждения заморозками между вариантами обработки выявлено не было.
В целом, экзогенное применение исследованных химических веществ, особенно тидиазурона, эффективно снижало образование цветков, изменяло ключевые биохимические компоненты листа, контролировало основных вредителей чая и, в конечном счете, способствовало повышению продуктивности чайного растения.
1. Введение
Чайное растение (Camellia sinensis (L.) O. Kuntze) является важной экономической культурой во многих странах, а чай, изготавливаемый из нежных побегов и листьев чайных растений, — один из трех самых популярных безалкогольных напитков в мире [1]. Чайные растения обильно цветут с сентября по декабрь, с ежегодной урожайностью цветков от 3000 до 12 000 кг/гектар чайных плантаций [2]. Цветочные и листовые почки сосуществуют в пазухах ветвей чайных растений. Прорастание и рост листовых почек подавляются, когда у чайных растений происходит дифференциация и развитие цветочных почек. Обилие цветков и конкуренция за питательные вещества между цветками и листьями чая могут вызывать заметную конкуренцию между вегетативным и репродуктивным ростом чайных растений, что не способствует высокой урожайности и хорошему качеству чая [3,4]. Удаление цветочных почек и цветков с чайных растений снижает потерю питательных веществ, которые в противном случае использовались бы для цветения, и вместо этого перераспределяет эти питательные вещества на рост чайных побегов и листьев, тем самым повышая их урожайность и качество.
Различные обработки растений, такие как регуляторы роста растений, выполняют множество функций в контроле роста и развития растений и их адаптационных реакций на условия окружающей среды [5]. Эти обработки предоставляют широкий спектр возможностей для влияния на рост и развитие растений. Исследования показали, что эти химические вещества могут ускорять или откладывать прорастание семян, ослаблять покой у растений, стимулировать или подавлять удлинение стебля, увеличивать или уменьшать образование цветков и плодов, а также ускорять или замедлять процесс старения органов растений [6,7]. Дополнительно, внешнее применение этих веществ может улучшать морфологию, фотосинтетическую способность, параметры газообмена, активность ферментов и другие показатели, которые, в свою очередь, регулируют различную устойчивость растения к стрессам окружающей среды [8,9,10]. Конкретные аспекты внешнего применения этих обработок для управления процессами цветения растений включают задержку формирования цветочных почек и раскрытия цветков, ускорение старения лепестков и стимулирование опадения цветочных почек и раскрытых цветков [11,12,13]. В сельскохозяйственном производстве определенные обработки растений, включая регуляторы роста растений, используются для удаления избыточных цветков для обеспечения количества и качества сельскохозяйственной продукции [14]. Тидиазурон, карбарил, этрел и известковая сера были выбраны для данного исследования из-за их роли в производстве чая. Тидиазурон, синтетический цитокинин, способствует делению клеток и широко используется для индукции цветения у растений [15]. Карбарил, инсектицид, контролирует вредителей и может косвенно влиять на цветение, ослабляя стресс [16]. Этрел высвобождает этилен, который способствует опадению цветков [17]. Известковая сера, в первую очередь фунгицид, также регулирует рост и контролирует вредителей [18,19]. Хотя эти соединения служат различным основным функциям, они в совокупности применяются в чайном производстве для регулирования цветения.
Хотя многие исследования были сосредоточены на химическом прореживании цветков у садовых культур, несколько исследований изучили влияние определенных химических веществ, включая регуляторы роста растений, как на прореживание цветков чая, так и на общий рост и развитие чайных растений [20,21,22]. Следовательно, в данном исследовании оценивалось, как различный концентрации химических веществ, включая тидиазурон, карбарил, этрел и известковую серу, влияют на количество цветков и цветочных почек чая, а также на некоторые физиологические и биохимические параметры чайных растений. Также исследовалась численность трех основных сосущих вредителей чайных растений: Apolygus lucorum (Hemiptera: Miridae), Empoasca onukii (Hemiptera: Cicadellidae) и Aleurocanthus spiniferus (Hemiptera: Aleyrodidae). В этом исследовании также оценивалось повреждение клеток, вызванное обработками, через электропроводность (ЭП), и оценивалась устойчивость чайных растений к стрессам окружающей среды. Дополнительно, после естественного заморозка через 50 дней после обработки, оценивались повреждения от мороза, чтобы исследовать потенциальную связь между экзогенными химическими веществами для управления чаем и повышенной морозоустойчивостью.
2. Материалы и методы
2.1. Полевые эксперименты и обследования
Полевое исследование проводилось на Чайной опытной плантации в уезде Фэйчэн, Тайань, провинция Шаньдун (36,17° с.ш., 116,49° в.д.), с 10-летними чайными деревьями сорта Фудиндабай. Дата начала эксперимента — 23 октября 2022 года, когда 50% цветков чая находилось в фазе цветения. Каждое испытуемое соединение в каждой концентрации вносилось методом опрыскивания на трех различных чайных делянках (5 × 5 м), и каждая делянка считалась отдельной повторностью. Испытуемые соединения наносились с помощью ранцевого опрыскивателя MATABI-16 (Matabi, Таррагона, Испания) с давлением 0,3 МПа, конусной насадкой и расходом 650 мл/мин, обеспечивая объем распыла 675 л га⁻¹. Этрел (≥85,0%), тидиазурон (≥93,0%) и карбарил (≥98,0%) были получены от Solarbio Science and Technology Co., (Пекин, Китай), а 45,0% известковая сера была приобретена у Wuhan Kemike Biomedical Technology Co., Ltd. (Ухань, Китай). Каждое химическое вещество готовили путем разбавления в воде, содержащей 1,0% спирта, для получения различных концентраций, без использования какого-либо поверхностно-активного вещества. Применялись следующие концентрации: 0,015; 0,03 и 0,06% (масса/объем) тидиазурона; 0,04; 0,06 и 0,08% карбарила; 0,08 и 0,12% (масса/объем) этрела; и 2,0 и 3,0% (масса/объем) известковой серы. Выбор этих концентраций был основан на обычно используемых эффективных диапазонах концентраций, сообщенных в литературе, и дальнейший скорректирован на основе предварительных экспериментов [23,24,25,26]. Эти концентрации эффективно индуцировали желаемые реакции у чайного дерева. Вода, содержащая 1,0% спирта, служила контролем.
Учет количества цветочных почек и цветков чая, измерение физиологических и биохимических параметров, а также учет встречаемости A. lucorum, E. onukii и A. spiniferus регистрировались через 10 дней после нанесения химикатов на чайные растения. Подсчет цветков чая проводился для каждой субделянки (1 × 1 м) в пределах делянки. Для оценки эффективности химических агентов в контроле вредителей на чайных растениях применялся метод желтых клеевых ловушек размером 25 × 20 см (Zhangzhou Enjoy Agriculture Technology Co., Ltd., Чжанчжоу, Китай). Количество A. lucorum, E. onukii и A. spiniferus на чайных полях, обработанных в течение последних десяти дней, измерялось в периоды пика численности вредителей. 12 ноября 2022 года, через 50 дней после обработки, после естественного заморозка регистрировалась встречаемость повреждений морозом листьев чайных растений на субделянках 1 × 1 м в пределах каждой делянки. Повреждение морозом оценивалось по шкале от 0 до 5: 0 = нет повреждений морозом, 1 = повреждение <20% листа, 2 = повреждено 21–50% листа, 3 = повреждено 51–75% листа, 4 = повреждено 76–90% листа и 5 = повреждение морозом > 90% листа. Степень повреждения морозом рассчитывалась по формуле = [Σ (количество поврежденных морозом листьев в каждой субделянке × оценка)/(общее количество чайных листьев × 5)] × 100.
13 мая 2023 года, следующей весной, на субделянках 1 × 1 м проводился подсчет чайных побегов, а также регистрировались длина и вес двух листьев, а также средняя длина и вес побегов, содержащих два листа и одну почку, как средние значения для каждой делянки.
2.2. Определение электропроводности
Третий-пятый функциональные листья одинакового размера с ветвей текущего года собирались случайным образом в случайных точках для измерений. Для сохранения состояния чайных листьев при сборе сохранялись только части минимальных узлов стебля. Листья промывали водопроводной водой, затем трижды ополаскивали дистиллированной водой и промокали фильтровальной бумагой. Длинные полоски листьев с удаленными главными жилками нарезали на подходящие длины и быстро разделяли на три равные части по 0,1 г. Образец листа (0,1 г) переносили в центрифужную пробирку на 50 мл с 10 мл деионизированной воды, закрывали пробкой и оставляли при комнатной температуре на 12 ч для инкубации, встряхивая 3–4 раза в течение этого периода. Проводимость экстракта определяли с помощью кондуктометра (DDS-11A, INESA, Шанхай, Китай) и записывали как S1. Затем экстракт переносили на водяную баню при 100 °C на 30 мин, после чего постепенно охлаждали до комнатной температуры. Проводимость экстракта измеряли повторно, и полученное значение обозначали как S2. Значение проводимости дважды дистиллированной воды обозначали как S0. Электропроводность чайных листьев рассчитывали по формуле: электропроводность = (S1 − S0)/(S2 − S0) ×100%.
2.3. Определение содержания фотосинтетических пигментов
Экстракты пигментов получали путем измельчения 0,2 г свежих листьев (третий лист с каждой ветви) в 60 мл 80% ацетона и инкубировали смесь в темноте в течение 36 ч с использованием гомогенизатора тканей до тех пор, пока листья не становились полностью бесцветными. Спектрофотометр (UV-2450, Shimadzu, Киото, Япония) использовали для измерения оптической плотности при трех длинах волн: 663, 646 и 470 нм и для определения концентраций хлорофилла a и b и каротиноидов. Концентрации хлорофилла a, хлорофилла b и каротиноидов рассчитывали по следующим уравнениям: Cхл. a (мг г⁻¹ сырого веса) = (OD663 × 12,21 − OD646× 2,81)/(W × 1000) × V; Cхл. b (мг г⁻¹ сырого веса) = (OD646 ×20,13 − OD663×5,03)/(W × 1000) × V; Cкар. (мг г⁻¹ сырого веса) = (OD470 ×1000 − Cхл. a ×3,27 − Cхл. b× 104)/(W × 229 × 1000) × V [27]. В этом уравнении V представляет объем экстракта (в мл), а свежий вес (сырого веса) образца листа (в граммах) представлен W; OD470, OD646 и OD663 соответствуют оптической плотности при 470, 646 и 663 нм.
2.4. Определение флуоресценции хлорофилла листа
Флуоресценцию хлорофилла количественно определяли с помощью анализатора флуоресценции на основе модуляции (Hansatech, Кингс-Линн, Норфолк, Великобритания). Девять повторностей использовали для измерения третьего листа с различных чайных побегов со сходной световой ориентацией. Перед измерением чайные листья покрывали примерно на 20 мин с помощью специально разработанных зажимов. После темновой адаптации применяли импульс высокий интенсивности света (PPFD = 3000 мкмоль м⁻²с⁻¹) для оценки максимальной флуоресценции (Fm). Затем применяли актиничный свет с PPFD 1200 мкмоль м⁻² с⁻¹, достаточный для поддержания фотосинтеза, в течение 30 мин. Фактическую фотохимическую эффективность фотосистемы II (ΦPSII) и максимальную флуоресценцию в стационарных условиях (F’m) измеряли, применяя импульсы насыщенного белого света каждую 1 мин, при этом актиничный свет оставался включенным на протяжении всего времени. Нефотохимическое тушение (NPQ) определяли по формуле NPQ = (Fm − F’m)/F’m.
2.5. Определение биохимических компонентов
Аминокислоты, чайные полифенолы, кофеин и растворимые сахара в чайных побегах с двумя листьями и одной почкой количественно определяли с использованием пяти повторностей, следуя методологии Tian и др. [25]. Свежие чайные побеги подвергали нагреванию в микроволновой печи в течение 70 с, затем сушке при 80 °C около 6 ч, после чего их измельчали в мелкий порошок. Образцы высушенного чайного листа хранили при −20 °C до измерения биохимических компонентов.
Содержание свободных аминокислот оценивали с помощью нингидринового колориметрического метода. Порцию высушенного образца листа массой 3 г помещали в колбу, которую затем заполняли 450 мл деионизированной воды. Смесь подвергали экстракции в течение 45 мин на кипящей водяной бане, после чего фильтровали в горячем виде. Объем фильтрата доводили до 500 мл добавлением H₂O. Аликвоту разбавленного фильтрата объемом 1 мл переносили в мерную колбу на 25 мл, содержащую 0,5 мл 2% раствора нингидрина (приготовленного путем растворения 80 мг SnCl₂·2H₂O и 2 г нингидрина в 100 мл H₂O) и 0,5 мл буфера (состоящего из 3 мM KH₂PO₄ и 63 мM Na₂HPO₄, pH 8,0). После 15-минутной инкубации на кипящей водяной бане раствор доводили до конечного объема 25 мл добавлением воды. После 10-минутного отстаивания определяли оптическую плотность раствора при 570 нм с помощью спектрофотометра (UV-2450, Shimadzu, Япония). Для расчета содержания свободных аминокислот использовали калибровочную кривую, построенную с разными концентрациями глутамина.
Катехины количественно определяли с помощью ванилинового колориметрического метода. Высушенный образец листа (1 г) помещали в коническую колбу на 100 мл, содержащую 20 мл 95% этилового спирта, и нагревали с обратным холодильником при 80 °C в течение 30 мин. После фильтрации отфильтрованный экстракт доводили до 25 мл 95% этиловым спиртом в качестве растворителя. Аликвоту фильтрата объемом 20 мкл смешивали с 1 мл 95% этилового спирта и 5 мл ванилинового солянокислого реагента (1 г ванилина в 100 мл концентрированной HCl) в пробирке на 20 мл. Через 40 мин регистрировали оптическую плотность при 500 нм спектрофотометрически (UV-2450, Shimadzu, Япония). Для измерения концентрации катехинов использовали калибровочную кривую, созданную с разведениями катехина.
Содержание чайных полифенолов количественно определяли с использованием метода реактива Фолина–Чокальтеу. Сначала 200 мг высушенного образца чайного листа помещали в центрифужную пробирку на 10 мл и добавляли 5 мл 70% метанола при температуре 70 °C. Смесь подвергали экстракции на водяной бане при 70 °C в течение 10 мин, затем центрифугировали при 3500 об/мин в течение 10 мин. Аликвоту супернатанта объемом 1,0 мл затем переносили в мерную колбу на 10 мл. В мерную колбу добавляли 5 мл 10% реактива Фолина–Чокальтеу, затем через 5 мин добавляли 4 мл 7,5% Na₂CO₃. После 10-минутного периода отстаивания раствор анализировали при оптической плотности 765 нм спектрофотометрически. Чайные полифенолы количественно определяли с использованием калибровочной кривовой, полученной из серии разведений галловой кислоты.
Метод основного ацетата свинца использовали для определения содержания кофеина. Образец высушенного чайного листа массой 3 г экстрагировали в 450 мл H₂O и подвергали экстракции на кипящей водяной бане в течение 45 мин с интервалами встряхивания 10 мин. Фильтрат доводили до конечного объема 500 мл добавлением H₂O в мерную колбу на 500 мл после фильтрации. В центрифужную пробирку на 100 мл смешивали 10 мл разбавленного фильтрата с 1 мл 0,5 г мл⁻¹ основного ацетата свинца и 4 мл 0,01 моль л⁻¹ соляной кислоты. Раствор доводили до конечного объема 100 мл водой. После 30-минутного отстаивания 25 мл супернатанта помещали в плоскодонную колбу на 50 мл, к которой добавляли 100 мкл 4,5 моль л⁻¹ раствора серной кислоты, а объем затем доводили до 25 мл водой. Значения оптической плотности экстракта при 274 нм определяли спектрофотометрически. Для определения содержания кофеина использовали калибровочную кривую, приготовленную из ряда концентраций кофеина.
Антроновую колориметрию применяли для измерения уровня растворимых сахаров. Высушенный образец чайного листа (1 г) экстрагировали 80 мл H₂O. Смесь подвергали экстракции на кипящей водяной бане в течение 45 мин и затем фильтровали в горячем виде. Для достижения конечного объема 500 мл к фильтрату добавляли воду. К смеси добавляли 1 мл антронового реагента, затем добавляли 8 мл реагента. Оптическую плотность смеси определяли при 620 нм с использованием спектрофотометра.
2.6. Статистический анализ
Статистический анализ данных проводился с использованием программного обеспечения Microsoft Excel (версия 2017) и SPSS (версия 20.0, SPSS Inc., Чикаго, Иллинойс, США). Для статистического анализа использовали однофакторный дисперсионный анализ (ANOVA), с применением теста Тьюки HSD (p < 0,05) для сравнений. Перед анализом процент прореживания цветков чая, электропроводность, содержание биохимических компонентов, количество насекомых-вредителей и степень повреждения морозом подвергали преобразованию с использованием метода арксинуса квадратного корня, при этом для справки представлены непреобразованные данные.
3. Результаты
3.1. Влияние химических веществ на опадение цветков чая и электропроводность
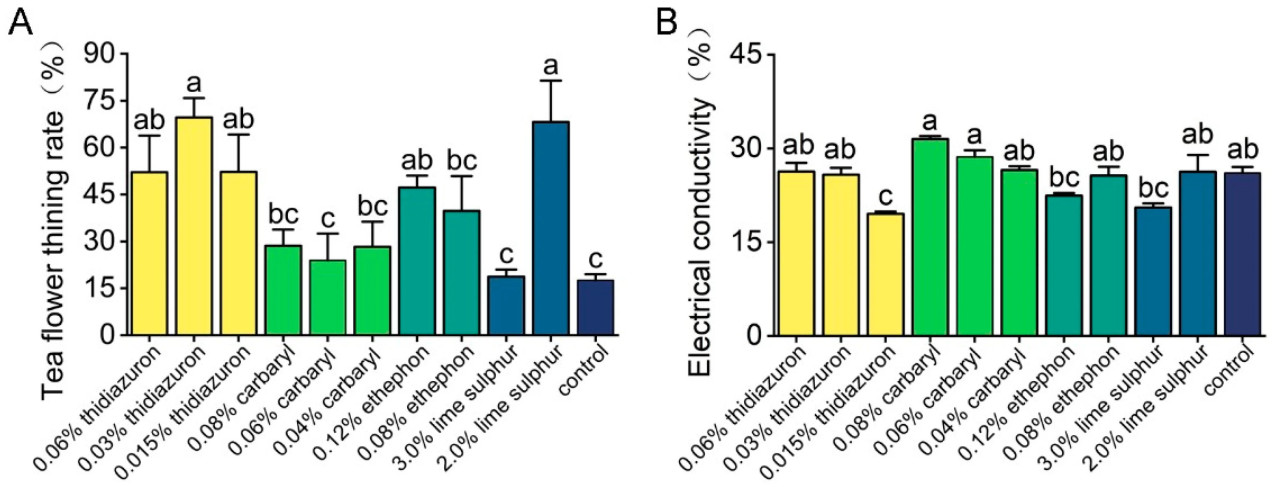
0,015; 0,03 и 0,06% тидиазурон значительно снизили количество цветков чая на 52,13; 69,63 и 52,24% соответственно (F = 4,74, p = 0,008). 2,0% известковая сера также привела к значительному снижению количества цветков чая на 68,21%. Не наблюдалось значительных различий в процентах снижения количества цветков чая между обработанными карбарилом и этрелом растениями и необработанным контролем. Не было обнаружено значительных различий в электропроводности чайных листьев между химически обработанными чайными растениями и необработанным контролем, за исключением листьев чайных растений, обработанных 0,015% тидиазуроном (F = 3,050, p = 0,014) (Рисунок 1).
Рисунок 1. Влияние тидиазурона, карбарила, этрела и известковой серы на количество цветочных почек и цветков чая на чайных плантациях (A) и на электропроводность чайных листьев (B). Разные буквы указывают на значительные различия между различными обработками (тест Тьюки HSD, p < 0,05). Данные представляют собой средние значения трех независимых делянок ± стандартная ошибка.
3.2. Влияние химических веществ на пигменты и фотосинтетические характеристики
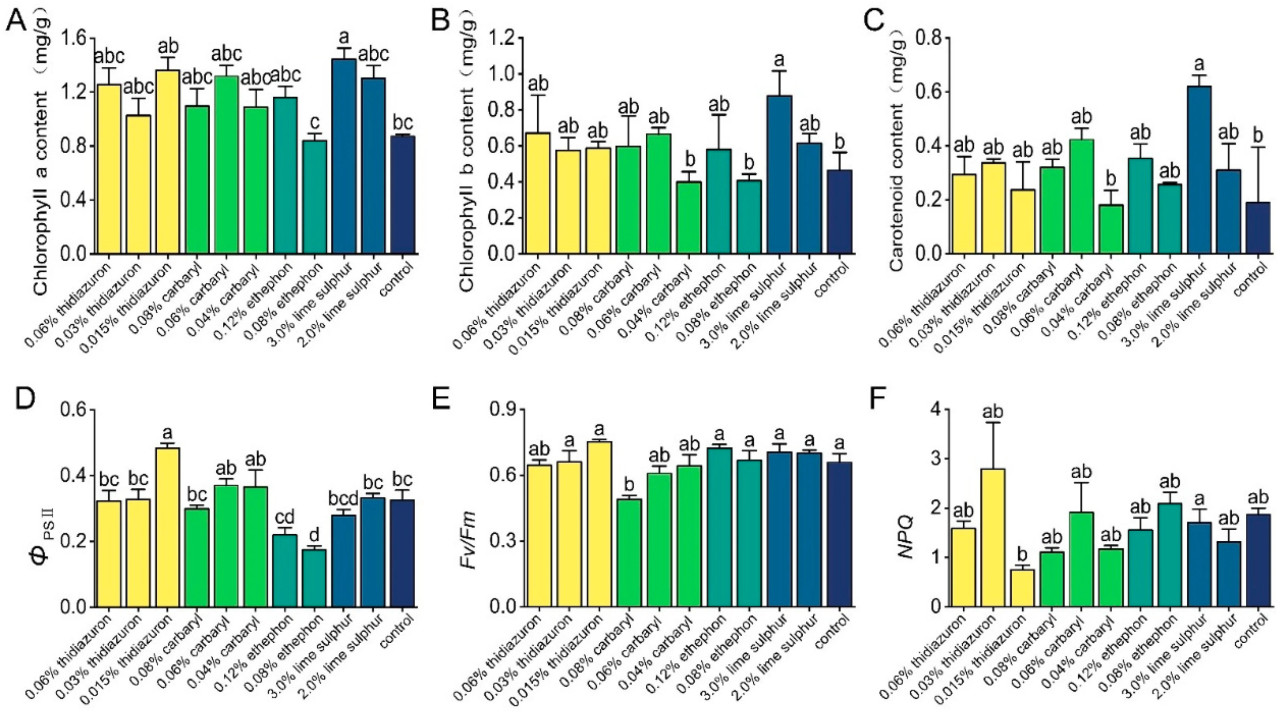
Уровни хлорофилла a, хлорофилла b и каротиноидов в чайных листьях, обработанных 3,0% известковой серой, были значительно выше по сравнению с необработанными контрольными чайными листьями (хлорофилл a: F = 3,992, p = 0,003; хлорофилл b: F = 2,844, p = 0,002; каротиноид: F = 3,992, p = 0,003). Не было обнаружено значительных различий в содержании фотосинтетических пигментов среди других различных химических обработок. Чайные листья, обработанные 0,015% тидиазуроном, показали значительно более высокий ΦPSII, чем в необработанных контрольных чайных листьях. 0,08% этрел значительно снизил ΦPSII в листьях чайного растения (F = 10,741, p < 0,001). Также 0,08% карбарил значительно снизил Fv/Fm в листьях чайного растения (F = 4,197, p < 0,001). Не наблюдалось значительных различий в ΦPSII, Fv/Fm или NPQ среди других различных химических обработок (Рисунок 2).
Рисунок 2. Влияние тидиазурона, карбарила, этрела и известковой серы на концентрации хлорофилла a (A), хлорофилла b (B) и каротиноидов (C) в чайном растении и на показатели фотосинтеза чайных растений, включая фактическую фотохимическую эффективность ФСII (ΦPSII) (D), максимальный квантовый выход фотосистемы II (Fv/Fm) (E) и нефотохимическое тушение (NPQ) (F). Разные буквы указывают на значительные различия между различными обработками (тест Тьюки HSD, p < 0,05). Данные представляют собой средние значения трех независимых делянок ± стандартная ошибка.
3.3. Влияние химических веществ на биохимические компоненты
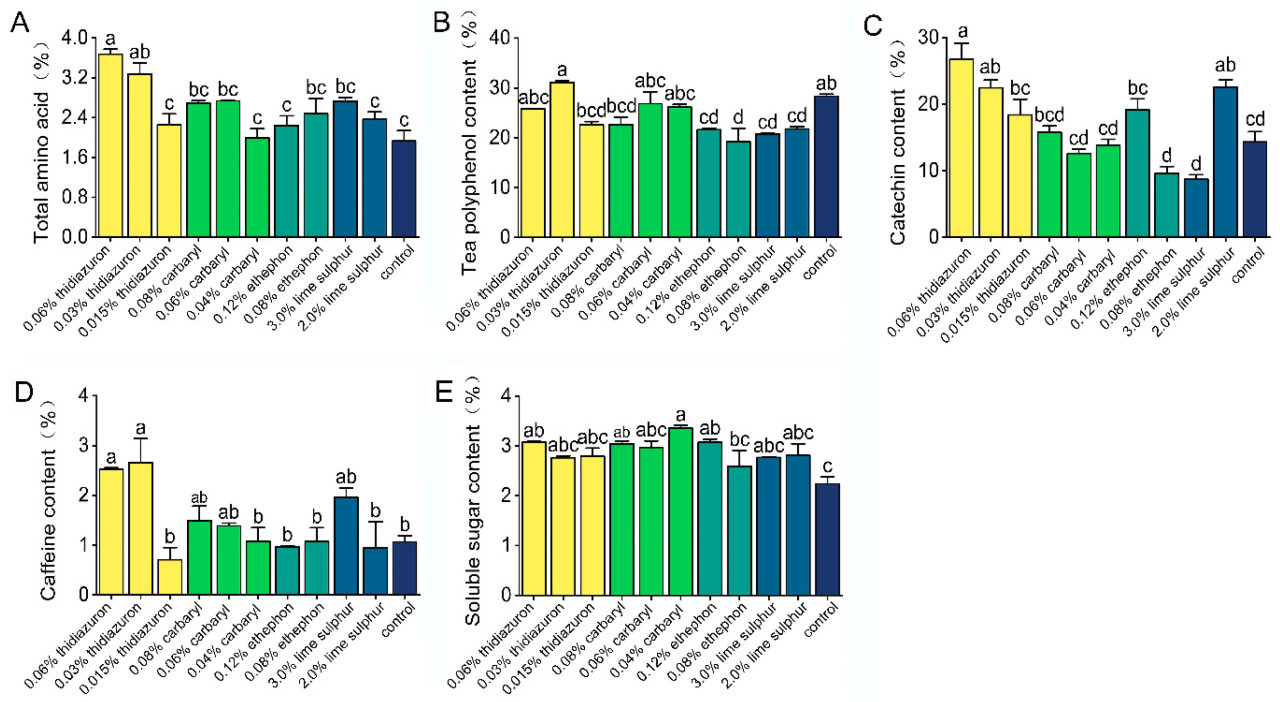
0,03 и 0,06% тидиазурон значительно увеличили содержание общих аминокислот и кофеина в листьях чайного растения соответственно (общие аминокислоты: F = 8,981, p < 0,001; кофеин: F = 5,598, p < 0,001). 0,08 и 0,12% этрел и 2,0% известковая сера значительно снизили содержание чайных полифенолов в листьях чайного растения (F = 8,355, p < 0,001). Чайные листья, обработанные 0,03% и 0,06% тидиазуроном и 2,0% известковой серой, показали значительно более высокий уровень катехинов по сравнению с необработанными контрольными листьями (F = 15,637, p < 0,001). 0,06% тидиазурон, 0,04 и 0,08% карбарил и 0,12% этрел значительно увеличили содержание растворимого сахара в листьях чайного растения (F = 4,051, p = 0,003) (Рисунок 3).
Рисунок 3. Влияние тидиазурона, карбарила, этрела и известковой серы на содержание общих аминокислот (A), чайных полифенолов (B), катехинов (C), кофеина (D) и растворимого сахара (E) в чайном растении. Разные буквы указывают на значительные различия между различными обработками (тест Тьюки HSD, p < 0,05). Данные представляют собой средние значения трех независимых делянок ± стандартная ошибка.
3.4. Влияние химических веществ на насекомых-вредителей и повреждения морозом чайных растений
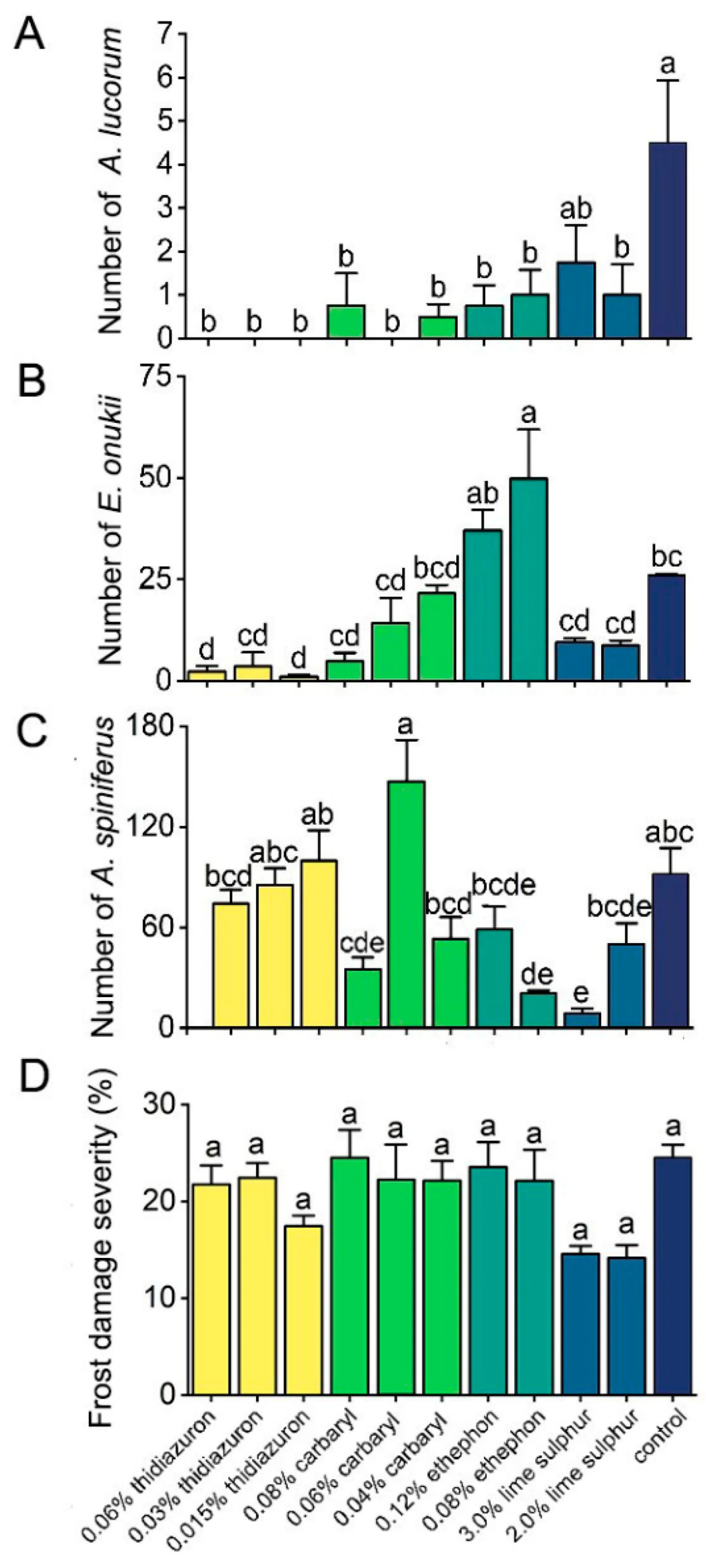
Чайные растения, обработанные тидиазуроном, карбарилом, этрелом и 2,0% известковой серой, имели значительно меньше A. lucorum по сравнению с необработанными контрольными растениями (F = 4,170, p < 0,001). Чайные растения, обработанные 0,08% этрелом и 3,0% известковой серой, имели значительно меньше A. spiniferus по сравнению с необработанными растениями (F = 9,06, p < 0,001). 0,015 и 0,06% тидиазурон значительно снизили количество E. onukii на чайных растениях (F = 11,549, p < 0,001). Обработка известковой серой снизила повреждения морозом на чайных растениях по сравнению с необработанными растениями, хотя статистически значительных эффектов не наблюдалось (F = 2,816, p = 0,007) (Рисунок 4).
Рисунок 4. Влияние тидиазурона, карбарила, этрела и известковой серы на количество A. lucorum (A), E. onukii (B) и A. spiniferus (C) на ловушках рядом с чайным растением. Ловушки устанавливались сразу после опрыскивания, а измерения проводились через 10 дней после обработки. Также измерялась степень повреждения морозом (D) на чайном растении. Разные буквы указывают на значительные различия между различными обработками (тест Тьюки HSD, p < 0,05). Данные представляют собой средние значения трех независимых делянок ± стандартная ошибка.
3.5. Влияние химических веществ на чайные побеги следующей весной
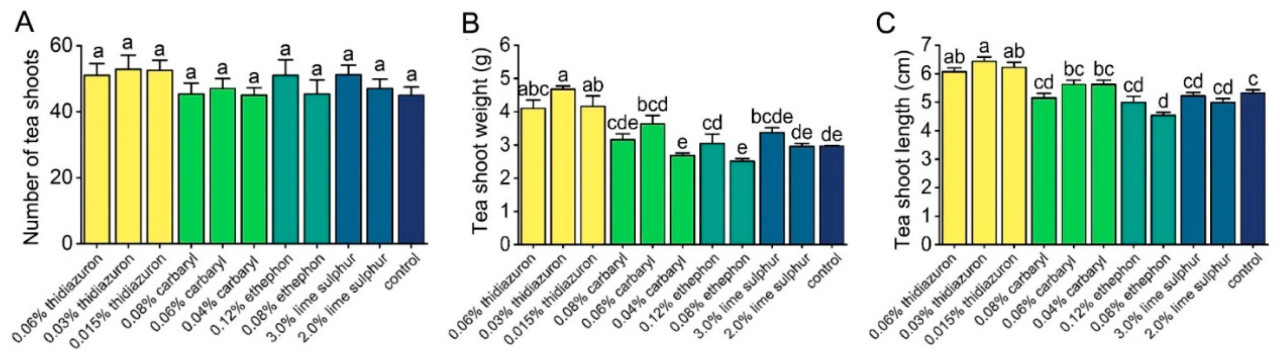
Ни одно из четырех испытанных химических веществ не оказало заметного влияния на количество чайных побегов следующей весной. Напротив, 0,015; 0,03 и 0,06% тидиазурон значительно способствовали увеличению длины и веса чайных побегов (длина: F = 15,161, p < 0,001; вес: F = 13,126, p < 0,001). Не наблюдалось значительных различий в длине и весе чайных побегов среди других различных химических обработок (Рисунок 5).
Рисунок 5. Влияние тидиазурона, карбарила, этрела и известковой серы на количество чайных побегов (A), а также на вес (B) и длину (C) чайных побегов. Разные буквы указывают на значительные различия между различными обработками (тест Тьюки HSD, p < 0,05). Данные представляют собой средние значения трех независимых делянок ± стандартной ошибки.
4. Обсуждение
Применение тидиазурона способствовало опадению цветков чая на плантациях. Хотя несколько исследований изучали индуцированное тидиазуроном опадение цветков, многочисленные исследования показали, что индуцированное тидиазуроном опадение листьев было связано с повышением уровня эндогенного этилена, накоплением абсцизовой кислоты (ABA) и снижением уровня эндогенной индол-3-уксусной кислоты (IAA) в обработанных листьях и зонах опадения [28,29]. Поэтому мы предположили, что опосредованное тидиазуроном опадение цветков чая может быть связано с его координацией с синтезом, метаболизмом и транспортом эндогенных гормонов этилена, IAA и ABA. Хотя тидиазурон мало влиял на количество чайных побегов, это соединение значительно увеличило длину и вес чайных побегов следующей весной. При обработке определенными концентрациями тидиазурона многие растения демонстрировали высокую способность к росту и развитию [30]. Удлинение и увеличение веса ветвей также может быть связано с влиянием тидиазурона на уровни эндогенных растительных гормонов и взаимодействием с эндогенными растительными гормонами, такими как этилен, гибберелловая кислота, транс-зеатин-рибозид и IAA [31,32].
Клеточные мембраны растений ключевой для поддержания микросреды клетки и нормального метаболизма [12,33]. В нормальных условиях клеточные мембраны растений способны определять проницаемость веществ. Когда растение подвергается неблагоприятным условиям окружающей среды, его клеточная мембрана нарушается, что приводит к увеличению проницаемости мембраны. Это приводит к выходу внутриклеточных электролитов, тем самым увеличивая электропроводность клеточного экстракта [34,35]. Увеличение проницаемости мембраны коррелирует с тяжестью стресса и устойчивостью растения к вызовам окружающей среды [36]. Поэтому исследования электропроводности стали точным и практичным методом для определения устойчивости растений к стрессу. В этом исследовании почти неизменная электропроводность указывала на то, что чайные листья, обработанные различными испытанными химическими веществами, находились в условиях сходного экологического стресса. Немного сниженные повреждения от мороза могли быть связаны с более низкой электропроводностью чайных листьев, обработанных тидиазуроном в низких концентрациях. Некоторые исследования показали, что тидиазурон может усиливать способность растения адаптироваться к стрессу [37,38].
Предыдущие исследования показали, что тидиазурон может значительно увеличивать содержание биохимических компонентов в листьях растений [39,40]. Чайные растения богаты различными биохимическими компонентами и вторичными метаболитами, которые обеспечивают уникальный вкус и обладают разнообразными питательными и оздоровительными функциями [9,41,42]. Результаты показали, что тидиазурон также увеличивал содержание аминокислот, катехинов, кофеина и растворимого сахара в определенной степени. Этот эффект, вероятно, обусловлен влиянием тидиазурона на вторичный и азотный метаболизм чайных растений, что, в свою очередь, влияет на уровни этих ключевой биохимических компонентов. Катехины и кофеин были признаны важнейший соединениями, которые повышают устойчивость чайных растений к насекомым-вредителям [43,44]. Плотность популяций A. lucorum и E. onukii была заметно influenced экзогенным применением тидиазурона. Низкая плотность популяций вредителей чая на обработанных тидиазуроном растениях может быть связана с очень высокий содержанием катехинов и кофеина в чайных листьях. Более того, увеличение содержания аминокислот, катехинов, кофеина и растворимого сахара в свежих чайных листьях может улучшить органолептическое качество заваренного чая [45,46].
Известковая сера обычно используется для защиты чайных растений от мороза зимой на китайских чайных плантациях [47]. Наши исследования показали, что известковая сера в высокий концентрациях значительно регулировала опадение цветков чая. Некоторые исследования показали, что более низкие концентрации известковой серы оказывали эффект прореживания цветков за счет ингибирования роста пыльцевой трубки [18,48]. Дополнительно, известковая сера при × 1,0 значительно увеличивала содержание фотосинтетических пигментов в чайных листьях, что могло быть полезным для холодостойкости чайных растений. Мы предположили, что увеличение фотосинтетических пигментов увеличило бы фотосинтез у чайных растений, приводя к накоплению глюкозы и других углеводов в клетках чайного растения, связанных с холодостойкостью [49]. В качестве инсектицида известковая сера эффективно контролирует различных вредоносных насекомых, таких как представители Hemiptera, Cryptoptera и вредоносные клещи [50,51,52,53]. Известковая сера уменьшала количество A. spiniferus, A. lucorum и E. onukii на чайных растениях, когда популяции вредителей чая достигали пика осенью, что также было связано с изменениями биохимических компонентов чайных растений, таких как катехины и кофеин.
Применение 0,12% этрела может в определенной степени способствовать опадению цветков. Внешнее применение внешне усиливает синтез эндогенного этилена, который, в свою очередь, запускает индуцированное этиленом опадение цветков [54,55]. После обработки этрелом крупные центральные вакуоли и другие органеллы в клетках цветка были существенно повреждены, многие клетки лепестков были деформированы и разрушены из-за потери цитоплазмы, и происходили два типа запрограммированной гибели клеток (включая сморщивание ядра и фрагментацию ДНК) [56]. Затем лепестки цветков чая старели, быстро бурели и частично увядали [57]. Этилен запускает экспрессию генов в путях биосинтеза и сигналинга, что в конечном итоге способствует опадению цветков [58,59]. Tian и др. [25] обнаружили, что влияние этрела на опадение цветков коррелирует с экспрессией генов, вовлеченных в передачу сигналов этилена, таких как 1-аминоциклопропан-1-карбоновая кислота синтаза и рецепторы этилена.
5. Выводы
В заключение, тидиазурон оказывал влияние в разной степени на опадение цветков чая и способствовал росту чайных побегов, увеличивая их длину и вес. Одновременно с эффектом прореживания цветков тидиазурон мог изменять соединения чайного листа и электропроводность и дальнейший влиять на встречаемость A. spiniferus и E. onukii. Известковая сера в высокий концентрациях способствовала опадению цветков чая и уменьшала количество трех насекомых-вредителей чая на растениях. Результаты помогут понять влияние экзогенного применения некоторых химических веществ на опадение цветков, а также на рост и защиту чайных растений, в частности осенью и зимой.
Ссылки
1. Chen, Z.-M.; Chen, L. Delicious and Healthy Tea: An Overview. In Global Tea Breeding: Achievements, Challenges and Perspectives; Chen, L., Apostolides, Z., Chen, Z.-M., Eds.; Springer: Berlin/Heidelberg, Germany, 2012; pp. 1–11. [Google Scholar]
2. Chen, D.; Chen, G.; Sun, Y.; Zeng, X.; Ye, H. Physiological genetics, chemical composition, health benefits and toxicology of tea (Camellia sinensis L.) flower: A review. Food Res. Int. 2020, 137, 109584. [Google Scholar] [CrossRef] [PubMed]
3. Fan, K.; Zhang, Q.F.; Liu, M.Y.; Ma, L.F.; Shi, Y.Z.; Ruan, J.Y. Metabolomic and transcriptional analyses reveal the mechanism of C, N allocation from source leaf to flower in tea plant (Camellia sinensis. L). J. Plant Physiol. 2019, 232, 200–208. [Google Scholar] [CrossRef] [PubMed]
4. Huang, Y.H. Analyses the way of controlling reproductive growth in tea plants. Chin. Tea 1997, 4, 6–7. [Google Scholar]
5. Jiang, K.; Asami, T. Chemical regulators of plant hormones and their applications in basic research and agriculture. Biosci. Biotechnol. Biochem. 2018, 82, 1265–1300. [Google Scholar] [CrossRef] [PubMed]
6. Abdelgadir, H.A.; Jäger, A.K.; Johnson, S.D.; Van Staden, J. Influence of plant growth regulators on flowering, fruiting, seed oil content, and oil quality of Jatropha curcas. S. Afr. J. Bot. 2010, 76, 440–446. [Google Scholar] [CrossRef]
7. Shah, S.H.; Islam, S.; Alamri, S.; Parrey, Z.A.; Mohammad, F.; Kalaji, H.M. Plant Growth Regulators Mediated Changes in the Growth, Photosynthesis, Nutrient Acquisition and Productivity of Mustard. Agriculture 2023, 13, 570. [Google Scholar] [CrossRef]
8. Agami, R.A.; Alamri, S.A.M.; Abd El-Mageed, T.A.; Abousekken, M.S.M.; Hashem, M. Salicylic acid and proline enhance water use efficiency, antioxidant defense system and tissues’ anatomy of wheat plants under field deficit irrigation stress. J. Appl. Bot. Food Qual. 2019, 92, 360–370. [Google Scholar]
9. Khan, N.; Mukhtar, H. Tea and Health: Studies in Humans. Curr. Pharm. Des. 2013, 19, 6141–6147. [Google Scholar] [CrossRef]
10. Tao, Q.; Zhou, Y.Y.; Guo, Q.; Liu, Y.R.; Yu, S.; Yu, C.X.; Zhang, M.C.; Li, Z.H.; Duan, L.S. A Novel Plant Growth Regulator Alleviates High-Temperature Stress in Maize. Agron. J. 2018, 110, 2350–2359. [Google Scholar] [CrossRef]
11. Barchenger, D.W.; Coon, D.L.; Bosland, P.W. Efficient Breeder Seed Production Utilizing Ethephon to Promote Floral and Fruit Abscission in Ornamental Chile Peppers. Horttechnology 2016, 26, 30–35. [Google Scholar] [CrossRef]
12. Gill, R.A.; Ahmar, S.; Ali, B.; Saleem, M.H.; Khan, M.U.; Zhou, W.; Liu, S. The Role of Membrane Transporters in Plant Growth and Development, and Abiotic Stress Tolerance. Int. J. Mol. Sci. 2021, 22, 12792. [Google Scholar] [CrossRef] [PubMed]
13. Ma, J.; Li, Z.; Wang, B.; Sui, S.; Li, M. Cloning of an Expansin Gene from Chimonanthus praecox Flowers and Its Expression in Flowers Treated with Ethephon or 1-Methylcyclopropene. HortScience 2012, 47, 1472–1477. [Google Scholar] [CrossRef]
14. Rademacher, W. Plant Growth Regulators: Backgrounds and Uses in Plant Production. J. Plant Growth Regul. 2015, 34, 845–872. [Google Scholar] [CrossRef]
15. Zhu, P.; Zhang, J. Effects of pre-bloom spraying thidiazuron and different embryo development media on seedless grape embryo rescue. N. Z. J. Crop Hortic. Sci. 2025, 53, 113–140. [Google Scholar] [CrossRef]
16. Wertheim, S.J. Developments in the chemical thinning of apple and pear. Plant Growth Regul. 2000, 31, 85–100. [Google Scholar] [CrossRef]
17. Zhang, X.; Li, B.; Zhang, X.; Wang, C.; Zhang, Z.; Sun, P. Exogenous application of ethephon regulates flower abscission, shoot growth, and secondary metabolites in Camellia sinensis. Sci. Hortic. 2022, 304, 111333. [Google Scholar] [CrossRef]
18. Li, Y.; Liu, Y.; Wu, C.; Zhao, R.; Li, M.; Cai, J.; Ma, L.; He, X.; Wu, X.; Zhenhua, Z. Effect of adjuvants on physicochemical properties of lime sulfur on flower/paraffin and application on flower thinning. Front. Plant Sci. 2023, 14, 1257672. [Google Scholar] [CrossRef] [PubMed]
19. Kim, D.S.; Seo, Y.D.; Choi, K.S. The effects of petroleum oil and lime sulfur on the mortality of Unaspis yanonensis and Aculops pelekassi in the laboratory. J. Asia-Pac. Entomol. 2010, 13, 283–288. [Google Scholar] [CrossRef]
20. Robinson, T. Advances in apple culture worldwide. Rev. Bras. Frutic. 2011, 33, 37–47. [Google Scholar] [CrossRef]
21. Rutkowski, K.; Łysiak, G.P. Thinning Methods to Regulate Sweet Cherry Crops—A Review. Appl. Sci. 2022, 12, 1280. [Google Scholar] [CrossRef]
22. Dutta, S.K.; Gurung, G.; Yadav, A.; Laha, R.; Mishra, V.K. Factors associated with citrus fruit abscission and management strategies developed so far: A review. N. Z. J. Crop Hortic. Sci. 2023, 51, 467–488. [Google Scholar] [CrossRef]
23. Ren, S.; Hu, M.; Wu, Q.; Wang, L.; Gu, H.; Chen, Z.; Ming, Z.; Li, Z. Flowering Time and Physiological Reaction of Dendrobium nobile Lindl in Response to TDZ Application. Horticulturae 2023, 9, 129. [Google Scholar] [CrossRef]
24. McArtney, S.; Greene, D.; Schmidt, T.; Yuan, R. Naphthaleneacetic Acid and Ethephon Are Florigenic in the Biennial Apple Cultivars Golden Delicious and York Imperial. HortScience 2013, 48, 742–746. [Google Scholar] [CrossRef]
25. Tian, Y.Y.; Chen, Z.J.; Jiang, Z.L.; Huang, X.Q.; Zhang, L.X.; Zhang, Z.Q.; Sun, P. Effects of Plant Growth Regulators on Flower Abscission and Growth of Tea Plant Camellia sinensis (L.) O. Kuntze. J. Plant Growth Regul. 2022, 41, 1161–1173. [Google Scholar] [CrossRef]
26. Johnson, K.B.; Temple, T.N. Evaluation of Strategies for Fire Blight Control in Organic Pome Fruit Without Antibiotics. Plant Dis. 2013, 97, 402–409. [Google Scholar] [CrossRef] [PubMed]
27. Wellburn, A.R. The Spectral Determination of Chlorophylls a and b, as well as Total Carotenoids, Using Various Solvents with Spectrophotometers of Different Resolution. J. Plant Physiol. 1994, 144, 307–313. [Google Scholar] [CrossRef]
28. Li, F.; Wu, Q.; Liao, B.; Yu, K.; Huo, Y.; Meng, L.; Wang, S.; Wang, B.; Du, M.; Tian, X.; et al. Thidiazuron Promotes Leaf Abscission by Regulating the Crosstalk Complexities between Ethylene, Auxin, and Cytokinin in Cotton. Int. J. Mol. Sci. 2022, 23, 2696. [Google Scholar] [CrossRef]
29. Shu, H.M.; Sun, S.W.; Wang, X.J.; Chen, J.; Yang, C.Q.; Zhang, G.W.; Han, H.Y.; Li, Z.K.; Liang, T.; Liu, R.X. Thidiazuron combined with cyclanilide modulates hormone pathways and ROS systems in cotton, increasing defoliation at low temperatures. Front. Plant Sci. 2024, 15, 1333816. [Google Scholar] [CrossRef] [PubMed]
30. Guo, B.; Abbasi, B.H.; Zeb, A.; Xu, L.L.; Wei, Y.H. Thidiazuron: A multi-dimensional plant growth regulator. Afr. J. Biotechnol. 2011, 10, 8984–9000. [Google Scholar]
31. Padmanabhan, P.; Murch, S.J.; Sullivan, J.A.; Saxena, P.K. Micropropagation of Primulina dryas (Dunn) Mich. Möller & A. Webber: High. frequency regeneration from leaf explants. Sci. Hortic. 2015, 192, 250–255. [Google Scholar]
32. Yu, L.; Li, X.; Tian, H.; Liu, H.; Xiao, Y.; Liang, N.; Zhao, X.; Zhan, Y. Effects of Hormones and Epigenetic Regulation on the Callus and Adventitious Bud Induction of Fraxinus mandshurica Rupr. Forests 2020, 11, 590. [Google Scholar] [CrossRef]
33. Niu, Y.; Xiang, Y. An Overview of Biomembrane Functions in Plant Responses to High-Temperature Stress. Front. Plant Sci. 2018, 9, 915. [Google Scholar] [CrossRef] [PubMed]
34. Lian, X.Y.; Gao, H.N.; Jiang, H.; Liu, C.; Li, Y.Y. MdKCS2 increased plant drought resistance by regulating wax biosynthesis. Plant Cell Rep. 2021, 40, 2357–2368. [Google Scholar] [CrossRef] [PubMed]
35. Yun, H.S.; Kwon, C. Trafficking at the host cell surface during plant immune responses. J. Plant Biol. 2012, 55, 185–190. [Google Scholar] [CrossRef]
36. Rosisca, J.R.; de Oliveira, C.M.G.; Sartori, A.V.D.; Stolf-Moreira, R.; Silva, M.; Morais, H. Electrical conductivity as an indicator of damage due to low temperatures in beans leaves. Semin. Cienc. Agrar. 2019, 40, 1011–1022. [Google Scholar] [CrossRef]
37. Ali, H.; Khan, M.A.; Kayani, W.K.; Khan, T.; Mashwani, Z.-u.-R.; Nazif, U.; Khan, R.S. Thidiazuron regulated growth, secondary metabolism and essential oil profiles in shoot cultures of Ajuga bracteosa. Ind. Crops Prod. 2018, 121, 418–427. [Google Scholar] [CrossRef]
38. Erland, L.A.E.; Giebelhaus, R.T.; Victor, J.M.R.; Murch, S.J.; Saxena, P.K. The Morphoregulatory Role of Thidiazuron: Metabolomics-Guided Hypothesis Generation for Mechanisms of Activity. Biomolecules 2020, 10, 1253. [Google Scholar] [CrossRef] [PubMed]
39. Meléndez, L.R.O.; Rodríguez, O.A.H.; Alvarez, O.C.; Mendoza, A.B.; Jurado, M.C.; Barrios, D.L.O. Does the application of growth bioregulators improve the foliar concentration of nutrients, non-structural carbohydrates and yield in pecan? Cienc. Agrotecnol. 2021, 45, e004721. [Google Scholar] [CrossRef]
40. Ojeda-Barrios, D.L.; Orozco-Meléndez, L.R.; Cano-Medrano, R.; Sánchez-Chávez, E.; Parra-Quezada, R.Á.; Calderón-Jurado, M.; Jacobo-Cuellar, J.L.; Hernández-Ordoñez, E.; Cruz-Álvarez, O. Non-Structural Carbohydrates, Foliar Nutrients, Yield Components and Oxidative Metabolism in Pecan Trees in Response to Foliar Applications of Growth Regulators. Agriculture 2022, 12, 688. [Google Scholar] [CrossRef]
41. Samanta, S. Potential Bioactive Components and Health Promotional Benefits of Tea (Camellia sinensis). J. Am. Nutr. Assoc. 2022, 41, 65–93. [Google Scholar] [CrossRef]
42. Senanayake, S. Green tea extract: Chemistry, antioxidant properties and food applications—A review. J. Funct. Foods 2013, 5, 1529–1541. [Google Scholar] [CrossRef]
43. Yao, Q.; Wang, M.; Chen, Z. The Relative Preference of Empoasca onukii (Hemiptera: Cicadellidae) for Oviposition on Twenty-Four Tea Cultivars. J. Econ. Entomol. 2022, 115, 1521–1530. [Google Scholar] [CrossRef] [PubMed]
44. Zeng, L.; Zhou, X.; Liao, Y.; Yang, Z. Roles of specialized metabolites in biological function and environmental adaptability of tea plant (Camellia sinensis) as a metabolite studying model. J. Adv. Res. 2021, 34, 159–171. [Google Scholar] [CrossRef]
45. He, Y.; Zhang, Q.; Inostroza, A.C.; Kierszniowska, S.; Liu, L.; Li, Y.; Ruan, J. Application of metabolic fingerprinting in tea quality evaluation. Food Control 2024, 160, 110361. [Google Scholar] [CrossRef]
46. Pang, X.M.; Chen, F.Y.; Liu, G.Y.; Zhang, Q.; Ye, J.H.; Lei, W.X.; Jia, X.L.; He, H.B. Comparative analysis on the quality of Wuyi Rougui (Camellia sinensis) tea with different grades. Food Sci. Technol. 2022, 42, e115321. [Google Scholar] [CrossRef]
47. Yuan, A.; Liu, Z. Pollution-free organic tea garden management technology in northern China. Agric. Dev. Equip. 2013, 5, 107–108. [Google Scholar]
48. Marchioretto, L.D.R.; De Rossi, A.; Amaral, L.O.d.; Ribeiro, A.M.A.d.S. Efficacy and mode of action of blossom thinners on ‘Fuji More’ apple trees. Sci. Hortic. 2019, 246, 634–642. [Google Scholar] [CrossRef]
49. Shahryar, N.; Maali-Amiri, R. Metabolic acclimation of tetraploid and hexaploid wheats by cold stress-induced carbohydrate accumulation. J. Plant Physiol. 2016, 204, 44–53. [Google Scholar] [CrossRef] [PubMed]
50. Bellon, P.P.; Pietrowski, V.; Alves, L.F.A.; Rheinheimer, A.R.; Miranda, A.M.; Gazola, D. Agroecologic phytosanitary products for the control of lace bug (Vatiga manihotae) (Hemiptera: Tingidae) of Cassava. Interciencia 2014, 39, 40–45. [Google Scholar]
51. Capinera, J.L. Assessment of barrier materials to protect plants from Florida leatherleaf slug (Mollusca: Gastropoda: Veronicellidae). Fla. Entomol. 2018, 101, 373–381. [Google Scholar] [CrossRef]
52. Efrom, C.F.S.; Redaelli, L.R.; Meirelles, R.N.; Ourique, C.B. Selectivity of phytosanitary products used in organic farming on adult of Cryptolaemus montrouzieri (Coleoptera, Coccinellidae) under laboratory conditions. Semin. Cienc. Agrar. 2011, 32, 1429–1437. [Google Scholar] [CrossRef]
53. Venzon, M.; Oliveira, R.M.; Perez, A.L.; Rodriguez-Cruz, F.A.; Martins, S. Lime sulfur toxicity to broad mite, to its host plants and to natural enemies. Pest Manag. Sci. 2013, 69, 738–743. [Google Scholar] [CrossRef]
54. Ferrara, G.; Mazzeo, A.; Matarrese, A.M.S.; Pacucci, C.; Trani, A.; Fidelibus, M.W.; Gambacorta, G. Ethephon As a Potential Abscission Agent for Table Grapes: Effects on Pre-Harvest Abscission, Fruit Quality, and Residue. Front. Plant Sci. 2016, 7, 620. [Google Scholar] [CrossRef] [PubMed]
55. Paul, V.; Pandey, R.; Srivastava, G.C. The fading distinctions between classical patterns of ripening in climacteric and non-climacteric fruit and the ubiquity of ethylene-An overview. J. Food Sci. Technol. 2012, 49, 1–21. [Google Scholar] [CrossRef] [PubMed]
56. Battelli, R.; Lombardi, L.; Rogers, H.J.; Picciarelli, P.; Lorenzi, R.; Ceccarelli, N. Changes in ultrastructure, protease and caspase-like activities during flower senescence in Lilium longiflorum. Plant Sci. 2011, 180, 716–725. [Google Scholar] [CrossRef]
57. Zou, J.J.; Zhou, Y.; Cai, X.; Wang, C.Y. Increase in DNA fragmentation and the role of ethylene and reactive oxygen species in petal senescence of Osmanthus fragrans. Postharvest Biol. Technol. 2014, 93, 97–105. [Google Scholar] [CrossRef]
58. Cheng, Y.Q.; Liu, J.F.; Yang, X.D.; Ma, R.; Liu, C.M.; Liu, Q. RNA-seq Analysis Reveals Ethylene-Mediated Reproductive Organ Development and Abscission in Soybean (Glycine max L. Merr.). Plant Mol. Biol. Rep. 2013, 31, 607–619. [Google Scholar] [CrossRef]
59. Li, C.Q.; Wang, Y.; Ying, P.Y.; Ma, W.Q.; Li, J.G. Genome-wide digital transcript analysis of putative fruitlet abscission related genes regulated by ethephon in litchi. Front. Plant Sci. 2015, 6, 502. [Google Scholar] [CrossRef] [PubMed]
Jin M, Lun X, Zhang R, Zhang Y, Zhang X, Guan F, Wang L, Ying Y, Zhang Z, Xu X. Exogenous Application of Thidiazuron, Carbaryl, Ethephon, and Lime Sulphur Promotes Flower Abscission and Suppresses Tea Pests in the Tea Plant Camellia sinensis (L.) O. Kuntze. Agriculture. 2025; 15(2):150. https://doi.org/10.3390/agriculture15020150
Перевод статьи «Exogenous Application of Thidiazuron, Carbaryl, Ethephon, and Lime Sulphur Promotes Flower Abscission and Suppresses Tea Pests in the Tea PlantCamellia sinensis(L.) O. Kuntze» авторов Jin M, Lun X, Zhang R, Zhang Y, Zhang X, Guan F, Wang L, Ying Y, Zhang Z, Xu X., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
Фото: freepik.com






























































































Комментарии (0)