Место жительства меняет агаву: почему родственные виды так отличаются из-за почвы и климата
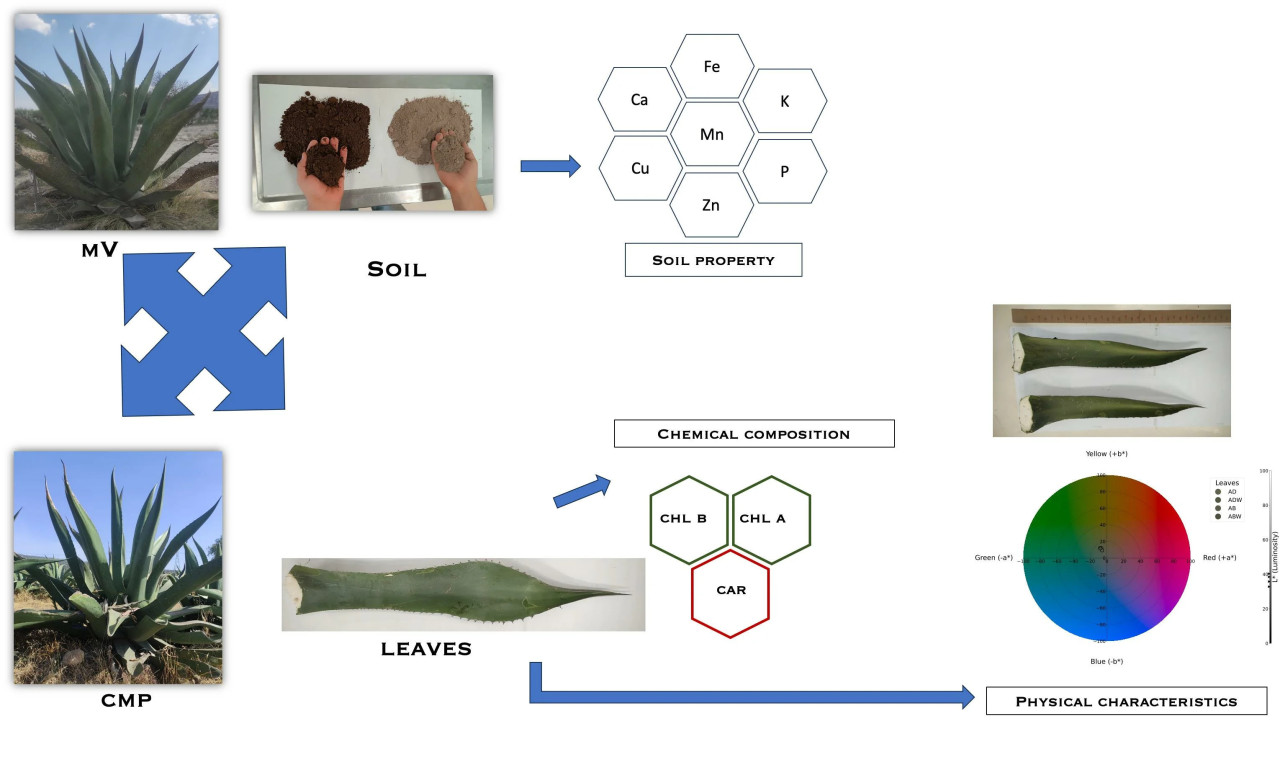
Процесс одомашнивания агав позволил этому растению адаптироваться к различным условиям окружающей среды, что привело к появлению подвидов одного вида с изменёнными морфологическими характеристиками. Это может вызывать различия в их питательных свойствах. По этой причине целью данного исследования было определение различий в физико-химических свойствах двух подвидов Agave salmiana (crassispina и salmiana), выращенных в регионах с различными экологическими характеристиками.
Аннотация
Несмотря на то, что оба региона имеют глинистые почвы, были обнаружены некоторые различия в ёмкости катионного обмена (ЕКО) и концентрации питательных веществ, которые могли привести к изменению размера листьев агавы в процессе адаптации. Незначительные различия наблюдались в толщине кутикулярной мембраны у обоих видов агав, но значительные различия были обнаружены между адаксиальной и абаксиальной сторонами. Кроме того, только некоторые макроэлементы существенно различались у обоих видов агав, поэтому подвид и зона произрастания, по-видимому, не влияют на их состав. Существенных различий в цвете листьев в зависимости от региона произрастания агав обнаружено не было. Однако удаление кутикулы влияет на восприятие цвета: наблюдаются значительные различия между листьями с кутикулой и без неё. Согласно полученным результатам, регион произрастания подвидов агавы оказывает существенное влияние на размер растения, а также на некоторые питательные свойства и пигменты, но меньшее влияние на общую окраску. Два подвида Agave salmiana, crassispina и salmiana, обладают разными характеристиками, которые позволяют им эффективно адаптироваться.
1. Введение
Агава относится к семейству Агавовые (Agavaceae) и представляет собой многолетнее, гермафродитное и однодольное растение, листья которого образуют розетку, а жизненный цикл составляет от 7 до 12 лет [1]. Это растение может адаптироваться к неблагоприятным климатическим условиям с помощью различных физиологических и морфологических адаптаций, таких как суккулентные листья, поверхностная корневая система (образование полостей) и толстая эпидерма листа с высоким накоплением воска [2,3]; дополнительно, метаболизм толстянковых кислот (CAM) рода Агава позволяет снизить потерю воды в процессе эвапотранспирации, поскольку устьица остаются закрытыми в течение дня [4,5]. Также сообщалось, что у агав синтез фруктанов играет важную роль в защите их клеток при высоких и низких температурах, действуя как осмо-протекторы, регулирующие осмос клеток, или крио-протекторы, стабилизирующие клеточную мембрану [6,7]. Кроме того, при высоких температурах увеличивается синтез дополнительных пигментов, таких как каротиноиды, что, по-видимому, позволяет агавам рассеивать избыточную радиацию и защищает растение от теплового повреждения [8]. Однако при низких температурах концентрации хлорофилла и каротиноидов в листьях значительно снижаются, что ухудшает способность растений регулировать термический и окислительный стресс [9]. Другие изменения, наблюдаемые у растений, растущих при низких температурах, включают увеличение синтеза ферментов, ответственных за образование метаболитов, таких как флавоноиды, которые действуют как антиоксиданты, криопротекторы и стабилизаторы клеточной мембраны [10]. С другой стороны, водный стресс у растений Агава был зарегистрирован только во время прорастания семян, которое умеренно зависит от него и частично определяется их экологическим распространением [11], поэтому адаптивность этого рода к засушливым условиям высока.
Однако температура роста приводит к изменениям концентраций химических соединений в агавах, как и состав почвы. Например, бедные питательными веществами почвы могут способствовать усиленному синтезу вторичных метаболитов в качестве защитной стратегии, тогда как почвы с высокими концентрациями питательных веществ приводят к интенсивному росту и производству большого количества биомассы [12]. Рейес-Самильпа и др. [13] отметили, что свойства волокон (иштле) Agave salmiana, произрастающих в местах с разным составом почв, значительно различаются, но также отметили, что степень орошения Agave salmiana не влияет на свойства ее волокон.
С другой стороны, существуют доказательства того, что этот вид включает несколько подвидов, которые считаются морфами, такие как Agave striata Zucc., различающиеся окраской листьев, или Agave salmiana, где рассматриваются два подвида: salmiana и crassispina. Однако несколько исследований изучали физические и химические характеристики подвидов и влияние географического положения растений на изменения в развитии листьев. Хотя устойчивость растений Агава к экстремальным абиотическим условиям задокументирована, исследования подвидов, выращиваемых в разных экосистемах, не проводились. По этой причине в данном исследовании мы изучили различия в физических и химических характеристиках двух подвидов растений Agave salmiana, один из которых произрастает в регионе с ксерофитной растительностью (долина Мескиталь, MV), а другой — в регионе с пастбищными угодьями (Центральное Мексиканское плато, CMP).
2. Материалы и методы
2.1. Растительный материал
Образцы Agave salmiana subsp. crassispina (Trel) были получены из местности Дуранго Дабоктха в долине Мескиталь штата Идальго, Мексика (координаты 20°32′28.2 с.ш., 99°04′21.7 з.д.). Экологические условия в этом регионе включают среднюю температуру 19,3 °C (макс. 40 °C и мин. −18 °C) [14], высоту 1863 м над уровнем моря и среднее количество осадков 363,8 мм. Agave salmiana Otto ex Salm-Dyck subsp. salmiana была получена из местности Сан-Матео-Тлахомулько на Центральном Мексиканском плато в штате Идальго, Мексика (координаты 19°53′42.3 с.ш., 98°33′06.2 з.д.). Экологические условия в этом регионе включают среднюю температуру 14,6 °C (макс. 17,3 °C и мин. 12 °C) и высоту 2661 м над уровнем моря, со средним количеством осадков 529 мм в год [15]. С помощью местных специалистов в каждом регионе были отобраны 12-летние растения как из MV, так и из CMP. Листья двух подвидов были разделены на две группы: молодые листья, расположенные непосредственно снаружи от центрально расположенных закрытых листьев растения, и старые листья, находящиеся на расстоянии четырех-шести рядов от закрытых листьев.
Оба вида агавы, Agave salmiana subsp. crassispina (Trel) и Agave salmiana Otto ex Salm-Dyck subsp. salmiana, были идентифицированы доктором Абисаи Хосуэ Гарсиа Мендосой из Ботанического сада Национального автономного университета Мексики.
2.2. Физико-химический анализ почв
Для анализа почвы использовалась объединенная проба следующим образом: 19 случайных образцов почвы были отобраны с помощью цилиндрического бура диаметром 10 см и на глубину 30 см. Все образцы были смешаны, и были взяты субпробы по 1,5 кг и хранились в полиэтиленовых пакетах до анализа.
Текстура, pH и влажность почв определялись с использованием методов Уокли-Блэка [16], общее содержание азота определялось микрометодом Кьельдаля в соответствии с AOAC [17], содержание фосфора определялось методом Олсена и др. [18], а содержание магния, кальция и калия определялось с помощью пламенного атомно-абсорбционного спектрометра (GBC, модель SensAA; Дандено́нг, Австралия). Микроэлементы и следовые элементы количественно определялись, как описано Диас-Ромеу [19]. К 10 г образца почвы в пробирку добавляли 20 мл экстрагирующего раствора Мехлиха и встряхивали при 180 об/мин при комнатной температуре в течение шести минут. Затем образец фильтровали для удаления осадка, а концентрации микроэлементов и следовых элементов определяли методом пламенной атомно-абсорбционной спектроскопии.
2.3. Физическая характеристика агав и листьев
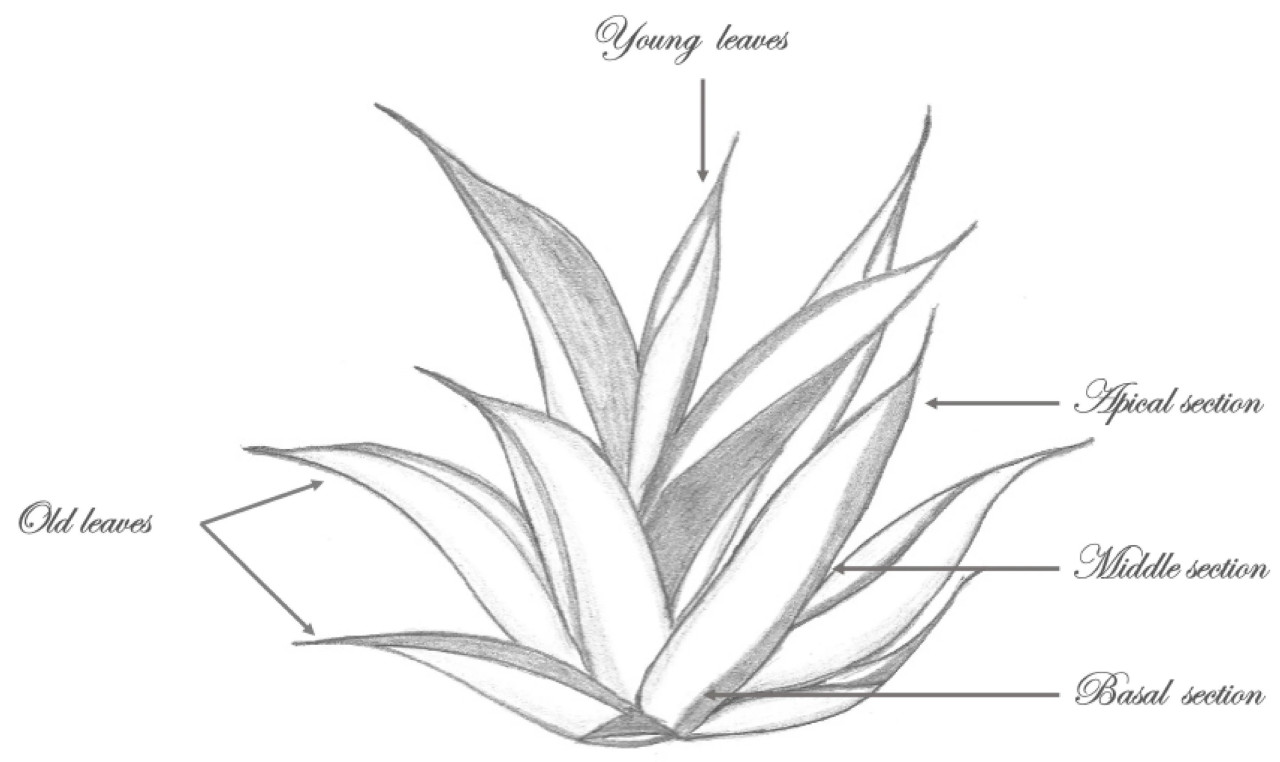
Растения агавы и их листья измеряли рулеткой. Для всего растения определяли общее количество листьев, их ширину и высоту. Для других анализов листья делили на молодые и старые следующим образом: листья рядов, близких к земле в розетке, считались старыми, тогда как средние листья розетки считались молодыми. Затем для трех растений каждого подвида агавы определяли ширину, длину и вес каждого листа. Каждая часть двух подвидов Агавы была промаркирована, как показано на Рисунке 1.
Рисунок 1. Схематическое изображение Agave salmiana (молодые и старые листья и их секции). Источник: собственная иллюстрация.
Терминальные и латеральные шипы были идентифицированы в соответствии с информацией из базы данных CONABIO. Толщину кутикулы (мишоте) измеряли аналоговым микрометром (серия Moore and Wright, 1961, Browers Group Co., Кэмберли, Великобритания). Содержание растворимых сухих веществ в листьях определяли на месте в зеленом соке с помощью портативного рефрактометра (модель Sper scientific 300003, Sper scientific, Ltd., Скоттсдейл, Аризона, США).
Для анализа площади листа использовали метод, описанный Мартином и др. [20], т.е. фотографировали по одному листу каждого из двух подвидов (crassispina и salmiana), затем изображения конвертировали в 8 бит и настраивали цвет. Далее фотографии обрабатывали с помощью программного обеспечения ImageJ (обработка и анализ изображений на Java, Уэйн Расбэнд, версия 1.x), при этом масштаб меняли с сантиметров на мегапиксели. Затем вносили соответствующие корректировки до достижения линии цветового тона, которую получали, соединяя концы листа для захвата всей площади листа. Впоследствии оценивали площадь, среднее значение и стандартное отклонение трех образцов.
Для определения цвета каждого листа использовали колориметр Konika Minolta (Konica Minolta, модель CR-400, Токио, Япония). Цвет измеряли на адаксиальной и абаксиальной сторонах каждого листа, а также с кутикулой и без нее. Во всех тестах определяли значения цвета L, a и b. Различия в цвете между двумя листьями рассчитывали с использованием CIE Delta E (CIE ΔE) согласно Уравнению (1) [21].
где ∆𝐿=𝐿∗𝑚1−𝐿∗𝑚2; ∆𝑎=𝑎∗𝑚1−𝑎∗𝑚2; и ∆𝑏=𝑏∗𝑚1−𝑏∗𝑚2.
Значения C и h°ab рассчитывались по Уравнению (2) и Уравнению (3) соответственно, как описано Кимом и др. [21]. Для создания хроматических графиков использовали программное обеспечение с открытым кодом Python 3.8.
2.4. Приблизительный химический состав листьев агавы
Для определения приблизительного химического состава листья нарезали на полоски длиной 5 см и толщиной 1 см, которые сушили в конвекционной печи (Binder, модель FD115, Туттлинген, Германия) при 40 °C в течение 120 ч. Высушенные образцы затем измельчали в промышленном блендере (International® модель LI-5, Veca International S.A., Мехико, Мексика). Порошок просеивали через сито № 40 (0,4 мм) и хранили в стеклянных банках при 25 °C до анализа.
Химический состав порошка листьев агавы определяли в соответствии с методами AOAC [17]: влажность (метод 925.05), содержание белка (коэффициент N × 6,25, метод 955.04), экстракт эфира (метод 920.9), содержание золы (метод 923.03) и содержание сырой клетчатки (метод 962.09). Результаты выражены в процентах на сухой вес.
2.5. Количественное определение общих углеводов и редуцирующих сахаров
Для количественного определения общих углеводов и редуцирующих сахаров 1 г порошка из листьев агавы смешивали с 50 мл дистиллированной воды, и смесь нагревали до 90 °C в течение 40 мин. Затем смесь фильтровали и хранили при 4 °C до использования.
Содержание общих углеводов определяли с использованием сернокислотно-антронового метода согласно Ло и др. [22]. В реакционную пробирку добавляли 1 мл смеси листового порошка и 3 мл смеси серная кислота–антрон (1 мг/мл), нагревали при 100 °C в течение 15 мин, и реакцию останавливали погружением в лед на 5 мин. Затем оптическую плотность измеряли при 625 нм с помощью спектрофотометра (Optima Plus, SP-3000 nano, Токио, Япония). Содержание общих углеводов рассчитывали с использованием калибровочной кривой сахарозы.
Свободные редуцирующие сахара определяли согласно методу, описанному Миллером [23], с использованием реагента 3,5-динитросалициловой кислоты (DNS). К 100 мкл смеси листового порошка добавляли 100 мкл реагента DNS (10 г/л DNS, 300 г/л калия тартрата и 16 г/л NaOH), затем встряхивали и нагревали при 100 °C в течение 5 мин. Раствор помещали в ледяную баню для остановки реакции. Свободные редуцирующие сахара определяли с использованием калибровочной кривой для фруктозы, измеряя оптическую плотность при 540 нм. Общее содержание фруктанов определяли с использованием Уравнения (4) согласно Арризону и др. [24].
где ОУ — содержание общих углеводов, а РС — содержание свободных редуцирующих сахаров.
2.6. Содержание хлорофилла a, b и каротиноидов
В колбу помещали 400 мг порошка из листьев агавы, диспергировали в 20 мл 80% ацетона (об./об.) и перемешивали смесь в течение 2 ч при 150 об/мин (в темноте при 4 °C). Дисперсию центрифугировали при 3000 об/мин в течение 5 мин, и оптическую плотность измеряли при 663, 646 и 470 нм на спектрофотометре (Optima Plus, SP-3000 nano, Токио, Япония) согласно Уравнениям (5)–(7) для определения содержания хлорофилла a, b и каротиноидов [25,26].
Для пересчета концентрации пигментов использовали Уравнение (8):
где P — конкретный пигмент.
2.7. Статистический анализ
Использовали полностью рандомизированный экспериментальный план, и результаты выражены как средние значения ± стандартные отклонения трех или шести равноудаленных образцов. Для определения различий между средними значениями проводили непарный t-критерий Стьюдента с p < 0,05. Данные, выраженные в процентах, трансформировали с использованием функции арксинуса перед статистическим анализом. Статистический анализ выполняли с использованием статистического пакета GraphPad Prism 10.0 (GraphPad Software, Inc., Сан-Диего, Калифорния, США). Многомерный анализ (анализ главных компонент) проводили с помощью статистического программного обеспечения XLSTAT® вер. 2024 (Lumivero, Денвер, Колорадо, США).
3. Результаты и обсуждение
3.1. Характеристика почвы
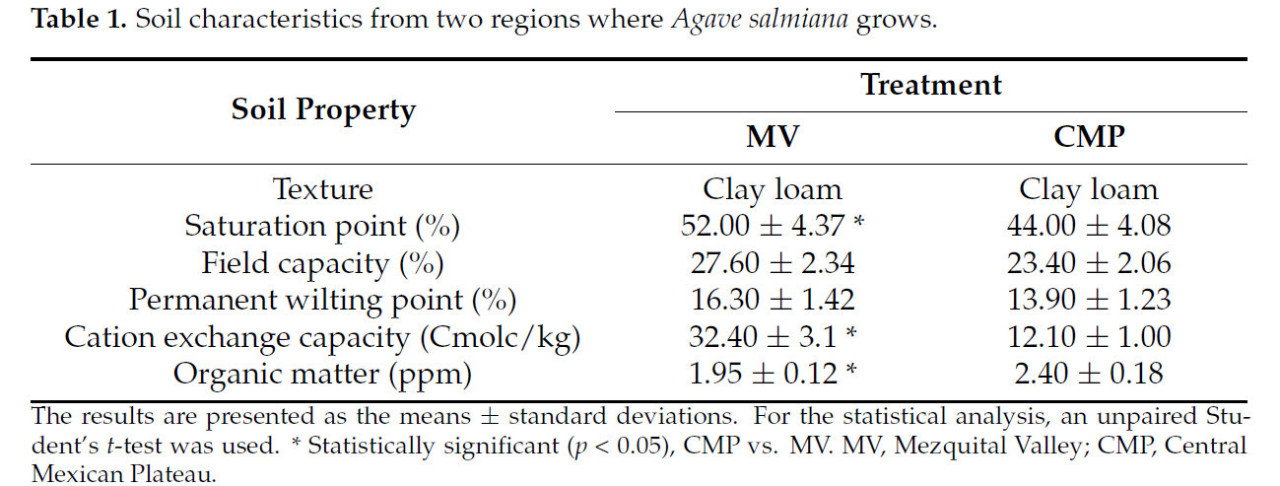
Таблица 1 показывает, что обе почвы, CMP и MV, являются суглинистыми. Однако были отмечены некоторые различия в их свойствах, например, в физических свойствах почв. Точка насыщения, полевая влагоемкость и точка увядания были в 18 и 17 раз больше в почве MV, чем в почве CMP. Емкость катионного обмена (ЕКО) была в 1,6 раза выше в почве MV, чем в почве CMP. Почва CMP имела на 23% более высокую концентрацию органического вещества, чем почва MV, что указывает на более высокое плодородие.
Таблица 1. Характеристики почвы из двух регионов произрастания Agave salmiana.
Почва в MV, по-видимому, имела лучшие свойства. Однако, помимо различий, обусловленных подвидами Agave salmiana, важно отметить, что почва, атмосфера и растение действуют как непрерывные единицы. Поэтому данные актуальны, если учитывать, что в MV выпадает меньше осадков (363,8 мм) и что из этого количества воды, хранящейся в почве, лишь небольшая часть перемещается в растение и через него [27], что, вероятно, и вызывает различия между культивируемыми формами. Значение ЕКО в почве MV выше, чем в почве CMP, что связано с минеральным составом и может зависеть от концентрации минерального азота (NO3-N). Высокая ЕКО может снижать скорость аммонификации и нитрификации при внесении мочевины [28], что особенно важно для почвы MV, так как она является щелочной.
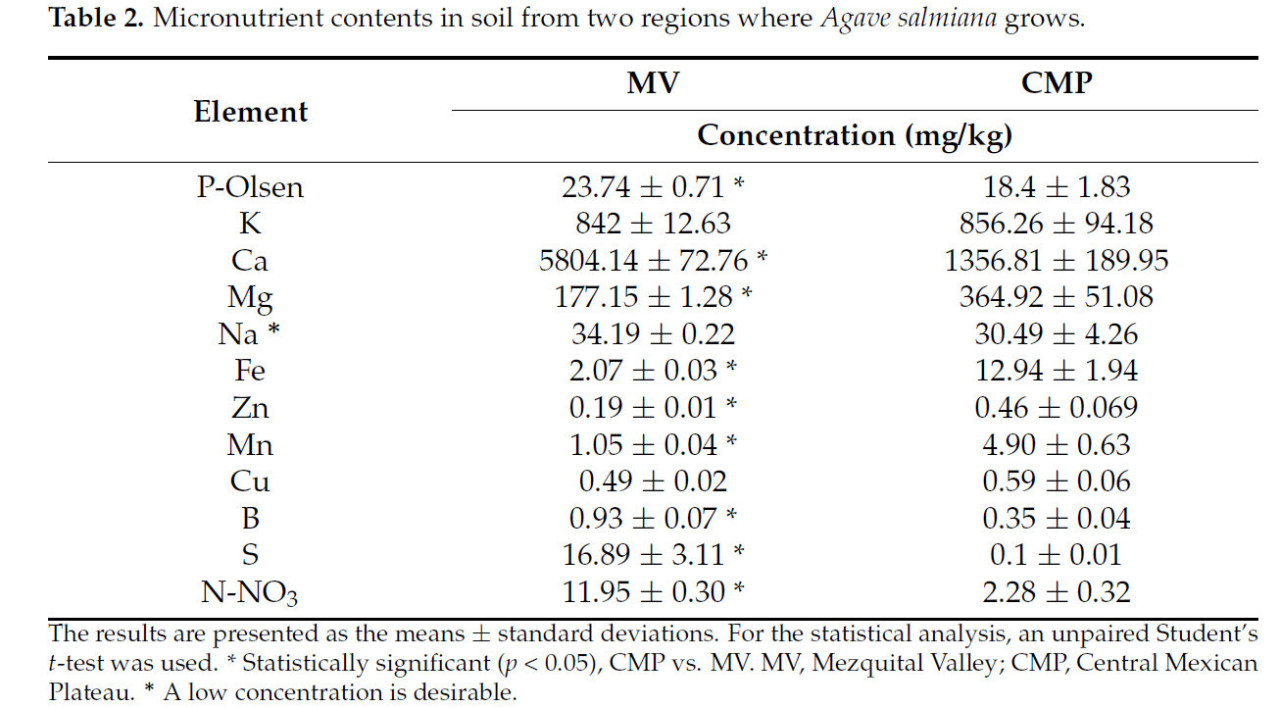
Концентрация макроэлементов отражает свойства почвы, поскольку почва MV имеет более высокие концентрации Ca (в 3,2 раза), S (в 190 раз) и P (на 27%), а также микроэлементов, таких как B (в 1,8 раза) и Na (на 12%), по сравнению с почвой CMP (Таблица 2). По сравнению с почвой MV, почва CMP имела более высокие концентрации микроэлементов Fe (в 5,1 раза), Zn (в 1,3 раза), Mn (в 3,8 раза) и Cu (на 15%). Дополнительно, в почве CMP наблюдалась на 23% более высокая концентрация органического вещества, чем в почве MV.
Таблица 2. Содержание микроэлементов в почве из двух регионов произрастания Agave salmiana.
Более высокая концентрация органического вещества в почве CMP (на 23%), чем в почве MV, определяла доступность микроэлементов для растений. Кроме того, в почве поддерживается высокое содержание органического углерода, что обеспечивает фиксацию органических питательных веществ, таких как N и S [29], и может поставляться растению в достаточных концентрациях. По мнению некоторых авторов, микроэлементы играют важную роль в метаболизме, росте и развитии растений [30]. Результаты показывают, что почва CMP имеет лучший состав микроэлементов, которые в синергии с органическим веществом благоприятствуют поглощению питательных веществ растением.
3.2. Влияние региона произрастания на морфологические характеристики
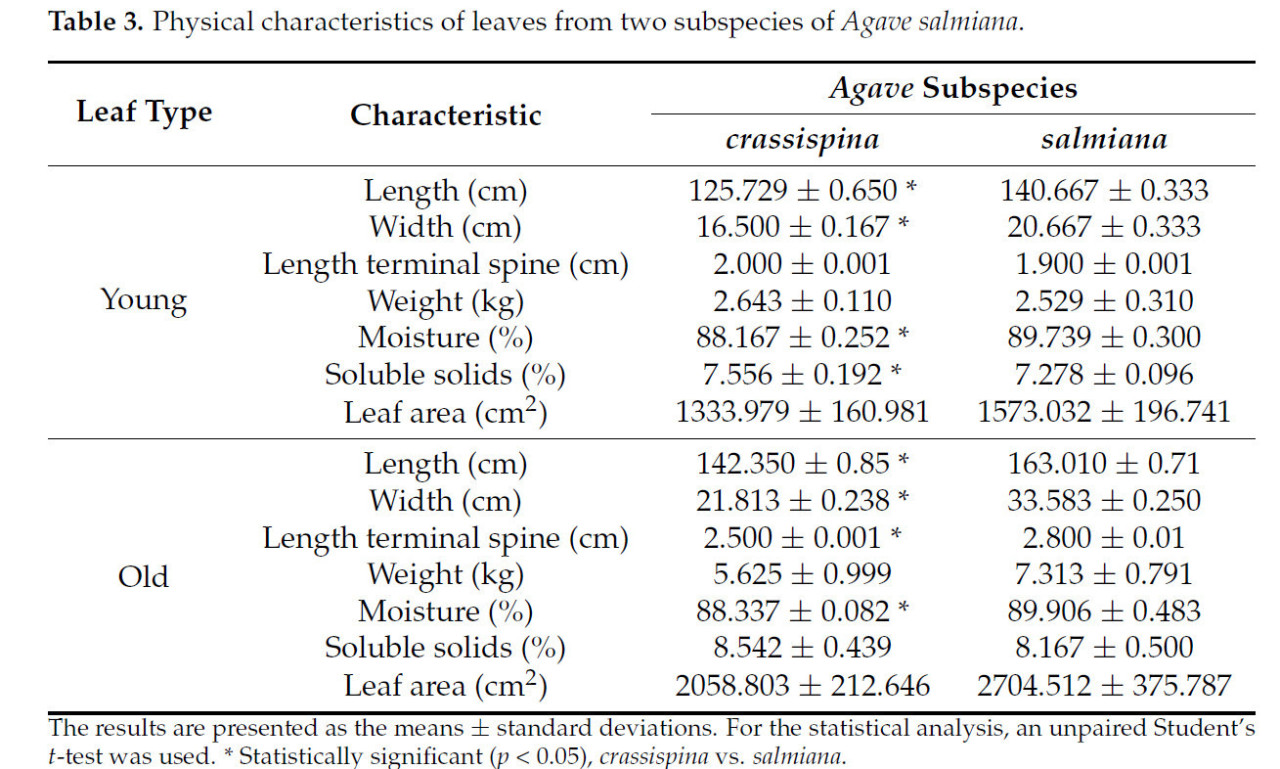
Между агавами, произрастающими на Центральном Мексиканском плато (CMP), и теми, что произрастают в долине Мескиталь (MV), были обнаружены существенные различия в размерах, но они имели одинаковое количество листьев, что указывает на одинаковый возраст растений. Растения, произрастающие на Центральном Мексиканском плато, были на 20% выше и на 5% шире, чем агавы, произрастающие в долине Мескиталь (Таблица 3).
Таблица 3. Физические характеристики листьев двух подвидов Agave salmiana.
Сообщалось, что тип почвы может определять размер агав, что отражается на длине их волокон [13]. Больший размер подвида salmiana объясняется тем, что агавы при выращивании в мезических условиях могут производить количество биомассы, сопоставимое с другими высокопродуктивными сельскохозяйственными и лесными видами C3 и C4 [31,32]. Однако на маргинальных, засушливых и полузасушливых почвах агавы сохраняют потенциал для производства большого количества биомассы. Другие авторы, такие как Гарсия-Мойя и др. [12] и Гарсия-Мойя и Нобель [33], сообщали, что размер листьев Agave salmiana может варьироваться от 1,66 до 2,28 м в одном и том же регионе. Другие авторы, такие как Фигероа-Урбина и др. [34], отметили, что различия между некоторыми подвидами Agave salmiana, такими как crassispina, связаны с отсутствием морфологических признаков, ассоциированных с синдромом доместикации, по сравнению с другим испытанным подвидом, salmiana, который находился в постоянном взаимодействии с человеком, создавая эволюционное давление. По этой причине в данном исследовании длина листьев подвида Agave salmiana salmiana, произрастающего в MV, достигала 188,43 см, что на 25% больше, чем длина листьев подвида Agave salmiana salmiana, произрастающего на CMP.
3.3. Различия в толщине кутикулы между подвидами Agave salmiana
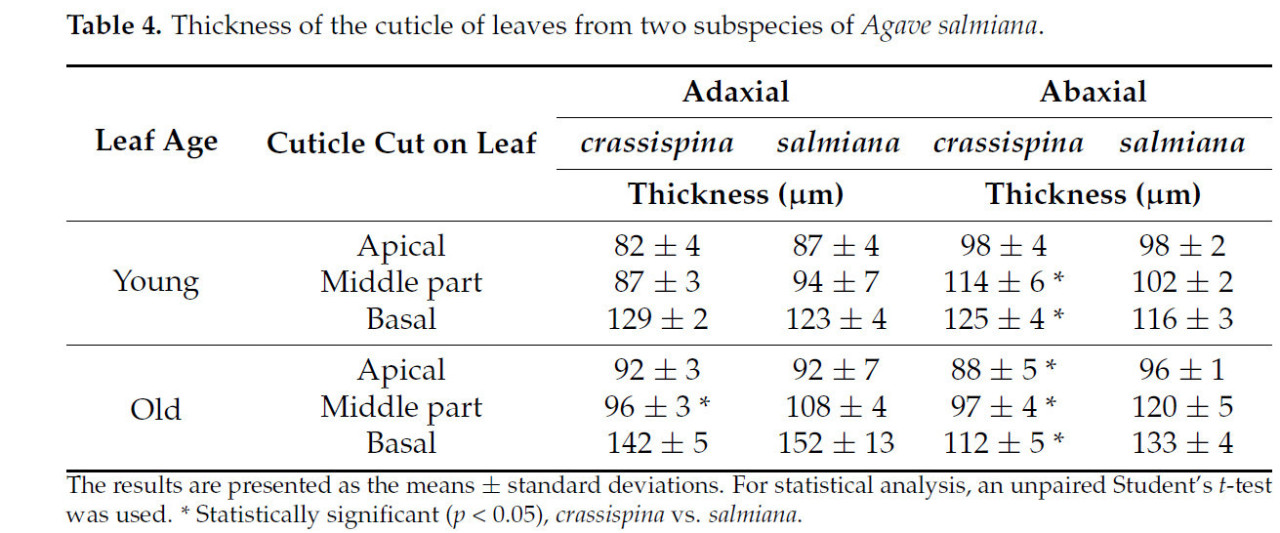
Зона произрастания немного влияет на толщину кутикулы листьев Agave salmiana. Кутикула агав, произрастающих на CMP (подвид salmiana), была толще, чем кутикула агав, произрастающих в MV (подвид crassispina). Листья существенно различались по толщине кутикулы между молодыми и старыми листьями на обеих сторонах листа, адаксиальной и абаксиальной.
Как показано в Таблице 4, толщина кутикулярной мембраны была значительно больше в базальной части листьев, чем на абаксиальной стороне листьев в обеих зонах произрастания. В большинстве данных, касающихся толщины средней и апикальной частей, абаксиальная сторона толще, чем адаксиальная. Толщина кутикулярной мембраны листьев существенно различалась в зависимости от зоны среза на листе, причем базальная часть была самой толстой.
Таблица 4. Толщина кутикулы листьев двух подвидов Agave salmiana.
Кутикулы растений напрямую взаимодействуют с окружающей средой и служат изоляцией и защитой от внешних экологических воздействий. Структура кутикулы может сильно варьировать от вида к виду. У рода Агава кутикула служит защитным механизмом против засухи или защиты от термического и водного стресса [35]. По этим причинам кутикула Agave salmiana, как сообщается, толстая, и поэтому она используется в мексиканской гастрономии в качестве оболочки при приготовлении «мишиотес». Полученные результаты по толщине кутикулы Agave salmiana подвидов crassispina и salmiana согласуются с результатами, полученными другими авторами, такими как Арредондо и др. [36], которые сообщили, что толщина кутикулы Agave salmiana, используемой в качестве биомембраны, составляет 80 мкм, тогда как Перес-Эспанья и др. [35] сообщили, что толщина составляет 129 мкм для Agave salmiana. Для других видов, таких как Agave atrovirens, Бернардино и др. [37] сообщили о толщине кутикулы 130 мкм, что позволяет предположить, что сходная толщина может быть общей для агав.
По-видимому, большая толщина, наблюдаемая на абаксиальной стороне по сравнению с адаксиальной стороной молодых листьев, обусловлена их большей подверженностью УФ-излучению от сильного солнечного света и других факторов окружающей среды [38,39]. Кроме того, растение может реагировать на наибольшую степень водного стресса, формируя более толстый слой кутикулы, что позволяет ему выживать [40].
3.4. Влияние подвида на химический состав
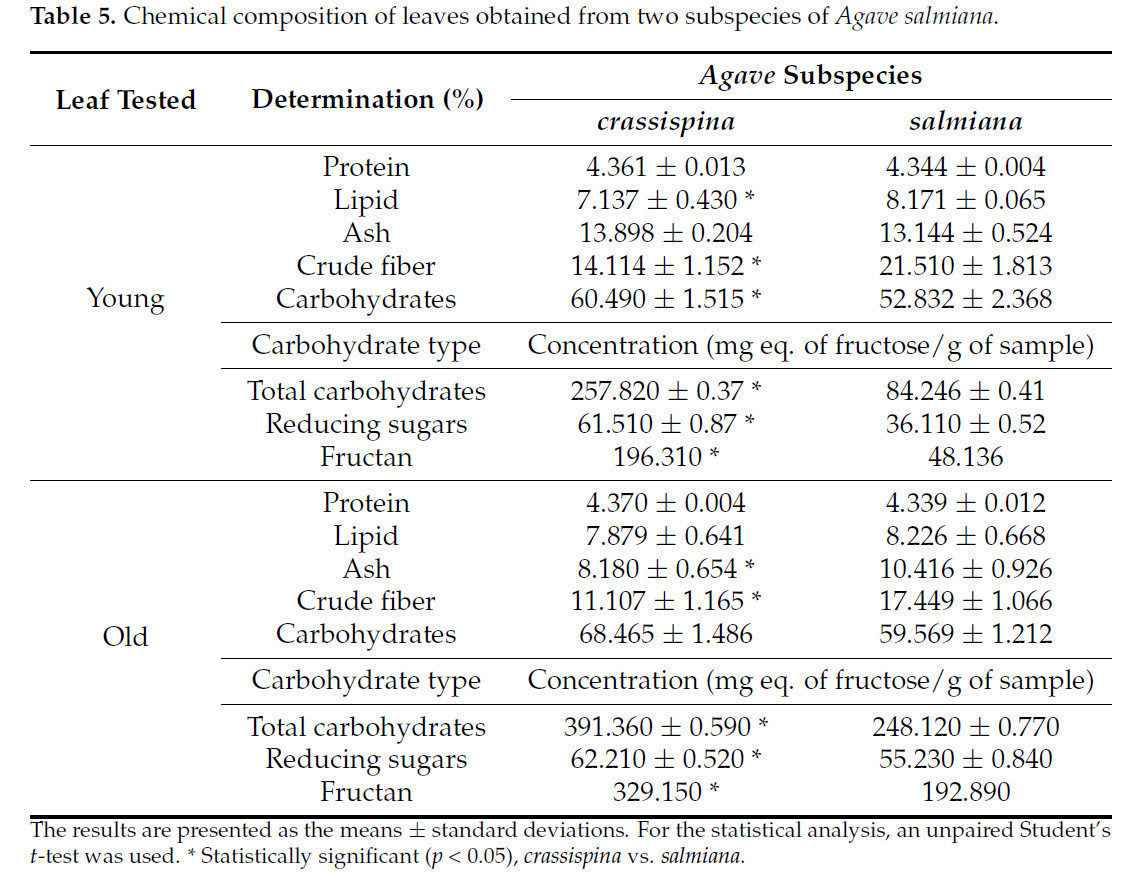
Не было обнаружено существенных различий в концентрациях липидов, белков или золы между молодыми и старыми листьями двух подвидов агавы (Таблица 5). Однако были обнаружены существенные различия между агавами из обоих регионов. Например, концентрации липидов и клетчатки в молодых листьях подвида salmiana были на 14% и 27% выше соответственно, чем в молодых листьях подвида crassispina, тогда как существенных различий для белков и золы не обнаружено. В старых листьях разница между подвидами salmiana и crassispina была меньше. Примечательно, что концентрация углеводов была относительно выше у подвида crassispina. Кроме того, концентрация фруктанов была в 3 раза больше у подвида crassispina, чем у подвида salmiana, в основном в молодых листьях.
Таблица 5. Химический состав листьев, полученных от двух подвидов Agave salmiana.
Более высокая концентрация золы в молодых листьях по сравнению со старыми указывает на активное развитие. Некоторые авторы [41] отмечают, что листья обладают способностью модифицировать экспорт или импорт ассимилятов в зависимости от возраста листьев. С другой стороны, помимо транслокации питательных веществ, вызванной стрессовыми условиями, процесс старения включает деградацию клеточных компонентов в старых листьях, что приводит к более низкой концентрации питательных веществ в старых листьях [42], как показано полученными результатами.
Различия в концентрациях липидов в листьях между подвидами salmiana и crassispina обусловлены регионом и климатическими условиями произрастания агавы, поскольку сообщалось, что воздействие на растения стрессовых условий или наличие хищников увеличивает концентрацию кутикулярного воска, что ингибирует проникновение некоторых патогенов [43,44]. У агавы также сообщалось об увеличении концентрации липофильных соединений, помимо увеличения лигнина в кутикуле для снижения потери воды [42,43,44]. Более высокая концентрация липидов у подвида salmiana по сравнению с подвидом crassispina, по-видимому, обусловлена большим количеством хищников, а не экологическими условиями.
Концентрации белков были сходными в листьях подвидов salmiana и crassispina, что указывает на то, что разновидность и зона развития не влияли на концентрацию белка. Согласно некоторым авторам, более высокие концентрации общих углеводов и фруктанов у подвида crassispina могут быть обусловлены экстремальными условиями окружающей среды во время роста, поскольку в MV преобладают экстремальные температуры с минимальной температурой −18 °C и максимальной 40 °C [45].
3.5. Концентрация фотосинтетических пигментов
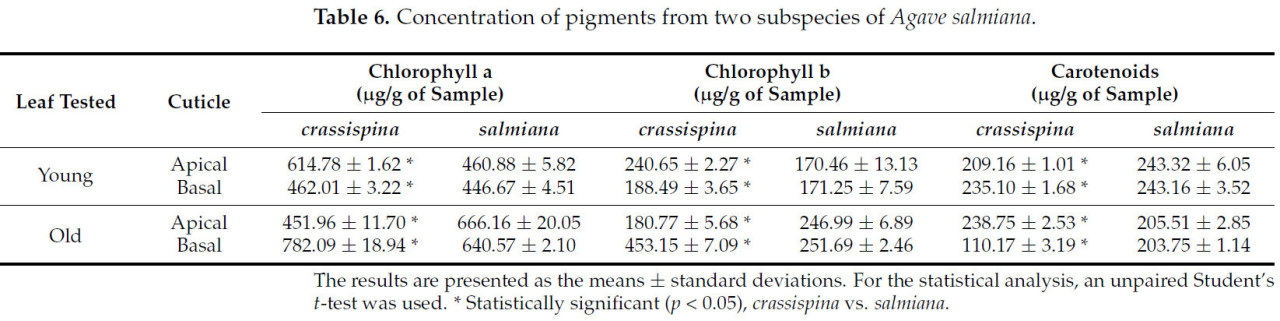
Как показано в Таблице 6, концентрация хлорофилла a (Chl a) была больше в молодых листьях подвида crassispina, чем в молодых листьях подвида salmiana, как в апикальной, так и в базальной секциях. Однако противоположный результат наблюдался для апикальной части старых листьев. Аналогичные результаты наблюдаются для хлорофилла b (Chl b). Что касается содержания каротиноидов, большинство молодых листьев имели самую высокую концентрацию, и в отличие от хлорофилла a и b, относительно высокая концентрация каротиноидов была обнаружена в апикальной части старых листьев.
Таблица 6. Концентрация пигментов у двух подвидов Agave salmiana.
Полученные результаты по общему содержанию хлорофилла согласуются с данными Фондома и др. [46] для Agave striata, которые сообщили, что содержание хлорофилла больше в старых листьях, чем в молодых. Несколько авторов указали, что у растений при дефиците воды старые листья содержат более высокие концентрации хлорофилла a, чем молодые [47]. В некоторых случаях, например, в листьях Pandanus amaryllifolius Roxb., концентрация хлорофилла в два раза больше в старых листьях, чем в молодых [48]. Полученные результаты согласуются с данными, сообщенными Сумендой и др. [49], которые сообщили, что захват и переработка солнечного света и углекислого газа для фотосинтеза увеличиваются до завершения развития листа, а затем медленно снижаются [50], и, по-видимому, по этой причине содержание хлорофилла больше в старых листьях, чем в молодых.
У растений каротиноиды являются важными пигментами, которые способствуют фотосинтезу, поглощая солнечный свет в диапазоне 450–550 нм, но также действуют как защитные агенты против вредного воздействия чрезмерного воздействия света на растения [51,52]. По-видимому, относительно высокая концентрация каротиноидов в молодых листьях обусловлена их фотозащитной ролью, поскольку, как упоминают дос Сантос и др. [53], незрелая листовая ткань содержит развивающийся фотосинтетический аппарат и, по этой причине, полагается на высокую концентрацию каротиноидов и других соединений для снижения повреждения листа.
3.6. Различия в цвете листьев
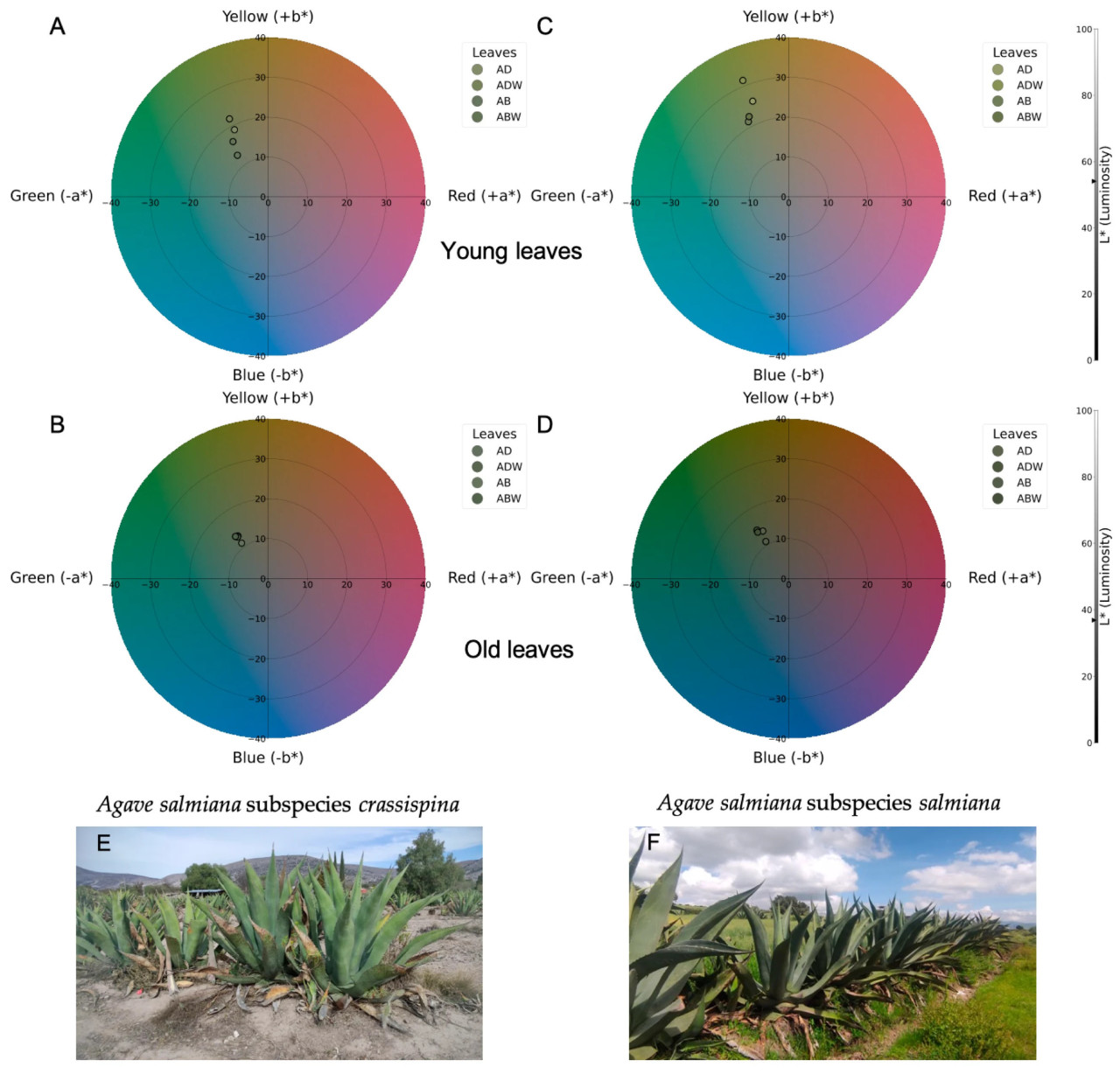
Цвет листьев обоих подвидов Agave salmiana был сгруппирован в зеленовато-желтом квадранте, как показано на Рисунке 2E,F. В большинстве листьев не было заметных различий в цвете (Рисунок 2A,B,D) между образцами с кутикулой и без нее как на адаксиальной, так и на абаксиальной сторонах. Однако восприятие цвета различалось между адаксиальной и абаксиальной сторонами и было наиболее заметно в молодых листьях подвида salmiana (Рисунок 2C). Как показано на Рисунке 2, молодые листья имеют большую светлоту, что обусловлено их более сильным желтым оттенком.
Рисунок 2. Хроматические графики Agave salmiana. (A) Молодые листья подвида crassispina; (B) старые листья подвида crassispina; (C) молодые листья подвида salmiana; (D) старые листья подвида salmiana. (E) Растения Agave salmiana подвида crassispina. (F) Растения Agave salmiana подвида salmiana. Сокращения: AB, абаксиальная сторона с кутикулой; ABW, абаксиальная сторона без кутикулы; AD, адаксиальная сторона с кутикулой; ADW, адаксиальная сторона без кутикулы.
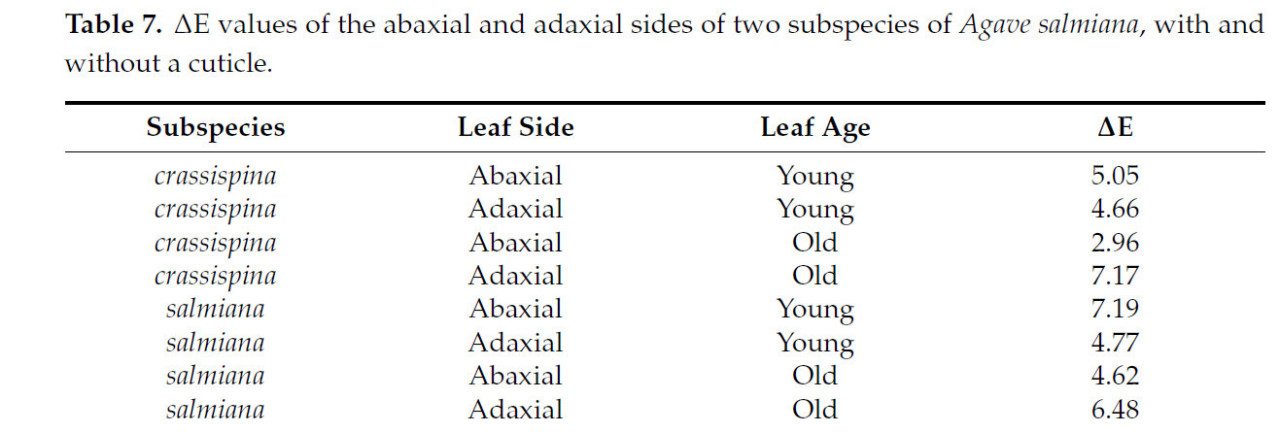
Различия в ΔE между листьями с кутикулой и без нее наблюдались как на абаксиальной, так и на адаксиальной сторонах (Таблица 7). Для большинства листьев воспринимаемый цвет считается существенно различным согласно полученному значению ΔE; согласно Киму и др. [21], значения ΔE находятся в диапазоне от 3,0 до 6,0. Значения выше 6,0 наблюдались на адаксиальной стороне старых листьев подвида crassispina и старых листьев подвида salmiana, а также на абаксиальной стороне молодых листьев подвида salmiana; следовательно, цвет считается крайне различным. Светлота больше в молодых листьях, чем в старых, у обоих подвидов, и это можно объяснить более высокими значениями b, указывающими на то, что желтая окраска преобладает над синей, тогда как значение a отрицательно во всех измерениях, указывая на то, что зеленый тон преобладает над красным, помимо значений L выше 50.
Таблица 7. Значения ΔE абаксиальной и адаксиальной сторон двух подвидов Agave salmiana, с кутикулой и без.
Удаление кутикулы приводит к изменению восприятия цвета у большинства листьев, и некоторые авторы отмечают, что различий в восприятии цвета не обнаруживается, когда значение меньше трех ΔE [54]. В данном исследовании можно предположить различный оттенок, поскольку ΔE был >3, что обусловлено обнажением пигментов без защиты кутикулы, тем самым изменяя воспринимаемый цвет.
Большая светлота в молодых листьях может быть объяснена преобладающей желтой окраской, что обусловлено более высокой концентрацией общих пигментов в молодых листьях, чем в старых, что свидетельствует о том, что отражение зависит от концентрации отдельных пигментов. У других видов агавы было обнаружено, что у более молодых растений содержание каротиноидов выше, чем у старых [55], что может быть связано с разными стадиями развития листьев одного и того же растения. Лишь некоторые свидетельства различных оттенков у подвидов Agave salmiana, crassispina и salmiana, были сообщены Фигероа-Урбиной и др. [34], которые сообщили, что можно наблюдать желтые и зеленые оттенки, что согласуется с результатами, полученными в данном исследовании.
Отделение кутикулы листа приводит к изменениям в восприятии цвета и снижению светлоты. Это связано с тем, что компоненты в основном состоят из воскового слоя кутина, который может действовать как терморегулятор и обеспечивать защиту от УФ-лучей. Некоторые авторы отмечали, что кутикула листьев агав прозрачна [56]; однако светлота кутикулы агав составляет приблизительно 70 [35].
3.7. Анализ главных компонент (PCA)
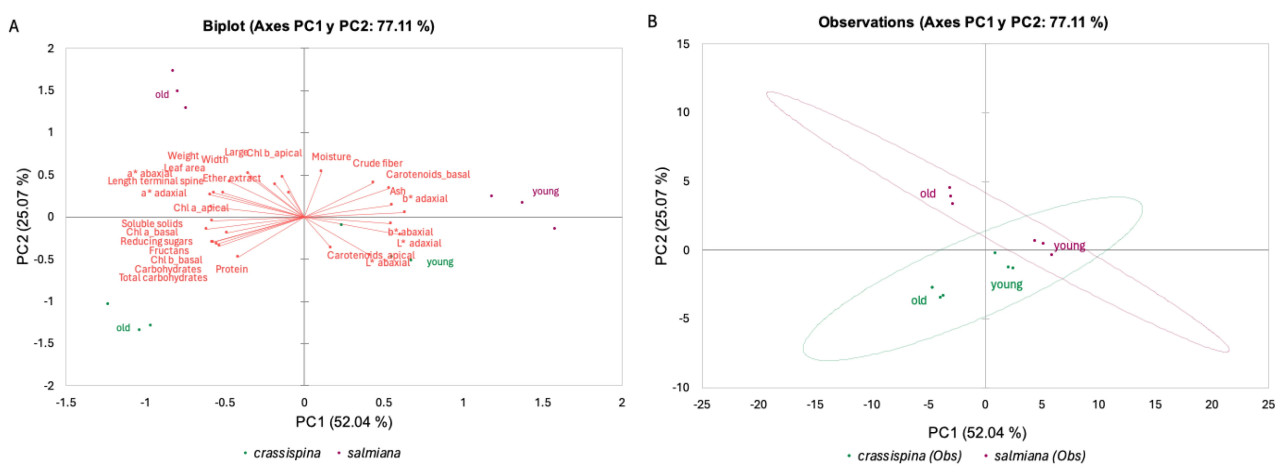
График оценок PCA (Рисунок 3A) и график нагрузок (Рисунок 3B) определяются первой и второй главными компонентами (PC1 и PC2), которые объясняют 77,11% дисперсии. Молодые листья расположены в положительном квадранте PC1 для обоих подвидов и вносят 52,04% в дисперсию. Наиболее важными переменными, влияющими на PC1, являются концентрация каротиноидов в апикальной части и высокая светлота на адаксиальной и абаксиальной сторонах.
Рисунок 3. Биплот анализа главных компонент физических и химических параметров подвидов Agave salmiana. (A) График оценок PCA, (B) график нагрузок.
С другой стороны, старые листья двух подвидов, crassispina и salmiana, расположены в отрицательной и положительной секциях PC2 соответственно и вносят 25,07% в дисперсию. Подвид salmiana характеризуется содержанием хлорофилла a и b в апикальной части, а также его большим размером, тогда как подвид crassispina характеризуется содержанием углеводов, редуцирующих сахаров и фруктанов, а также растворимых сухих веществ и хлорофилла a и b в базальной части.
4. Выводы
Это исследование показало, что регион развития влияет на физические характеристики подвидов Agave salmiana. Больший размер растения наблюдался у подвида salmiana, что, по-видимому, обусловлено не только экологическими условиями CMP. Качество почвы также является важным фактором, особенно с точки зрения содержания органического вещества, которое позволяет лучше усваивать микроэлементы. По этой причине растения в CMP на 20% выше и на 5% шире, чем в MV. Кутикула абаксиальной стороны существенно толще в листьях агав из MV, чем из CMP, по-видимому, в качестве формы защиты от солнечной радиации. Подвиды имеют значение с точки зрения некоторых химических компонентов, но стоит отметить, что подвид crassispina имеет самую высокую концентрацию углеводов, которые являются наиболее важными соединениями в агавах. Различия в пигментах были обнаружены между двумя подвидами, которые зависели не только от возраста листьев, но и от изучаемой части. Удаление кутикулы листьев влияет на их светлоту. Согласно данным, молодые листья имеют тенденцию к желтому оттенку, в то время как старые листья имеют тенденцию к зеленому оттенку как у подвидов crassispina, так и salmiana, а молодые листья имеют большую светлоту. В целом, подвиды влияют на некоторые физико-химические свойства агав, но каждый из них имеет уникальные характеристики, которые используются жителями каждой зоны произрастания, особенно для производства пульке. Результаты этого исследования важны, поскольку была обнаружена более высокая концентрация углеводов у подвида crassispina, чем у подвида salmiana, что будет коррелировано с концентрацией фруктанов и степенью их полимеризации в будущих исследованиях.
Ссылки
1. Ávila-Núñez, R.; Rivas-Pérez, B.; Hernández-Motzezak, R.; Chirinos, M. Contenido de azúcares totales, reductores y no reductores en Agave cocui Trelease. Multiciencias 2012, 12, 129–135. [Google Scholar]
2. García-Mendoza, A.J. Los agaves de México. Ciencias 2007, 87, 14–23. [Google Scholar]
3. Pena-Valdivia, C.B.; Sánchez-Urdaneta, A.B. Effects of substrate water potential in root growth of Agave salmiana Otto ex Salm-Dyck seedlings. Biol. Res. 2009, 42, 239–248. [Google Scholar] [CrossRef] [PubMed][Green Version]
4. Yamori, W.; Hidosaka, K.; Way, D.A. Temperature response of photosynthesis in C 3, C 4, and CAM plants: Temperature acclimation and temperature adaptation. Photosynth. Res. 2014, 119, 101–117. [Google Scholar] [CrossRef] [PubMed]
5. Davis, S.C. Agave americana: Characteristics and potential breeding priorities. Plants 2022, 11, 2305. [Google Scholar] [CrossRef]
6. Benkeblia, N. Insights on fructans and resistance of plants to drought stress. Front. Sustain. Food Syst. 2022, 6, 827758. [Google Scholar] [CrossRef]
7. Livingston, D.P.; Hincha, D.K.; Heyer, A.G. Fructan and its relationship to abiotic stress tolerance in plants. Cell. Mol. Life Sci. 2009, 66, 2007–2023. [Google Scholar] [CrossRef] [PubMed]
8. Reol, E.M. Los pigmentos fotosintéticos, algo más que la captación de luz para la fotosíntesis. Ecosistemas 2003, 12, 1–11. [Google Scholar]
9. Yuan, L.; Zhang, L.; Wu, Y.; Zheng, Y.; Nie, L.; Zhang, S.; Wang, C. Comparative transcriptome analysis reveals that chlorophyll metabolism contributes to leaf color changes in wucai (Brassica campestris L.) in response to cold. BMC Plant Biol. 2021, 21, 438. [Google Scholar] [CrossRef] [PubMed]
10. Theocharis, A.; Clément, C.; Barka, E.A. Physiological and molecular changes in plants grown at low temperatures. Planta 2012, 235, 1091–1105. [Google Scholar] [CrossRef]
11. Ramírez-Tobías, H.M.; Peña-Valdivia, C.B.; Trejo, C.; Aguirre, R.J.R.; Vaquera, H.H. Seed germination of Agave species as influenced by substrate water potential. Biol. Res. 2014, 47, 11. [Google Scholar] [CrossRef]
12. García-Moya, E.; Romero-Manzanares, A.; Nobel, P.S. Highlights for Agave productivity. GCB Bioenergy 2011, 3, 4–14. [Google Scholar] [CrossRef]
13. Reyes-Samilpa, A.; Reyes-Agüero, J.A.; van‘t Hooft, A.; Álvarez-Fuentes, G.; Rössel Kipping, E.D. Fibers of Agave salmiana cultivar Xa’mni: Physical characterization and comparison between leaf maturity and growth environment. Emerg. Mater. 2023, 6, 543–549. [Google Scholar] [CrossRef]
14. Sistema Metereológico Nacional. Available online: https://smn.conagua.gob.mx/es/ (accessed on 25 November 2024).
15. Jimenez-Torres, J.A.; Peña-Valdivia, C.B.; Padilla-Chacón, D.; García-Nava, R. Physiological and biochemical responses of Agave to temperature and climate of their native environment. Flora 2021, 278, 151797. [Google Scholar] [CrossRef]
16. Walkley, A.; Black, I.A. An examination of the Degtjareff method for determining soil organic matter, and a proposed modification of the chromic acid titration method. Soil Sci. 1934, 37, 29–38. [Google Scholar] [CrossRef]
17. AOAC (Association of Official Analytical Chemists). Official Methods of Analysis, 15th ed.; AOAC International: Arlington, VA, USA, 1990. [Google Scholar]
18. Olsen, S.R.; Cole, C.V.; Watanabe, F.S.; Dean, L.A. Estimation of Available Phosphorus in Soils by Extraction with Sodium Bicarbonate; USDA Circular 939; U.S. Government Printing Office: Washington, DC, USA, 1954. [Google Scholar]
19. Díaz-Romeu, R.; Hunter, A. Metodología de Muestreo de Suelos, Análisis Químico de Suelos y Tejido Vegetal e Investigación en Invernadero. Centro Agronómico Tropical de Investigación y Enseñanza. Proyecto Centroamericano de Fertilidad de Suelos; CATIE: Turrialba, Costa Rica, 1978; pp. 1–70. [Google Scholar]
20. Martin, T.N.; Fipke, G.M.; Minussi Winck, J.E.; Márchese, J.A. ImageJ software as an alternative method for estimating leaf area in oats. Acta Agron. 2020, 69, 162–169. [Google Scholar] [CrossRef]
21. Kim, S.; Park, J.; Hwang, I.K. Quality attributes of various varieties of Korean red pepper powders (Capsicum annuum L.) and color stability during sunlight exposure. J. Food Sci. 2002, 67, 2957–2961. [Google Scholar] [CrossRef]
22. Luo, D.; Qu, C.; Lin, G.; Zhang, Z.; Xie, J.; Chen, H.; Liang, J.; Cailan, L.; Wang, H.; Su, Z. Character and laxative activity of polysaccharides isolated from Dendrobium officinale. J. Funct. Foods. 2017, 34, 106–117. [Google Scholar] [CrossRef]
23. Miller, G.L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal. Chem. 1959, 31, 426–428. [Google Scholar] [CrossRef]
24. Arrizon, J.; Morel, S.; Gschaedler, A.; Monsan, P. Comparison of the water-soluble carbohydrate composition and fructan structures of Agave tequilana plants of different ages. Food Chem. 2010, 122, 123–130. [Google Scholar] [CrossRef]
25. Lichtethaler, H.K.; Wellburn, A.R. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents. Biochem. Soc. Trans. 1983, 11, 591–592. [Google Scholar] [CrossRef]
26. Mancera-Castro, P.; Bernardino-Nicanor, A.; Juárez-Goiz, J.M.S.; Teniente-Martínez, G.; González-Cruz, L. Effect of the type of thermal treatment on the nutritional and nutraceutical characteristics of pacaya inflorescences (Chamaedorea tepejilote Liebm). Biol. Life Sci. Forum 2022, 18, 36. [Google Scholar] [CrossRef]
27. Tolk, J.A. Soils, permanent wilting points. Encycl. Water Sci. 2003, 92, 927–929. [Google Scholar]
28. Li, X.; Xu, S.; Neupane, A.; Abdoulmoumine, N.; DeBruyn, J.M.; Walker, F.R.; Jagadamma, S. Co-application of biochar and nitrogen fertilizer reduced nitrogen losses from soil. PLoS ONE 2021, 16, e0248100. [Google Scholar] [CrossRef]
29. Gerke, J. The central role of soil organic matter in soil fertility and carbon storage. Soil Syst. 2022, 6, 33. [Google Scholar] [CrossRef]
30. Gupta, R.; Verma, N.; Tewari, R.K. Micronutrient deficiency-induced oxidative stress in plants. Plant Cell Rep. 2024, 43, 213. [Google Scholar] [CrossRef]
31. Wahid, A.; Gelani, S.; Ashraf, M.; Foolad, M.R. Heat tolerance in plants: An overview. Environ. Exp. Bot. 2007, 61, 199–223. [Google Scholar] [CrossRef]
32. Martínez Salvador, M.; Mata-González, R.; Morales-Nieto, C.; Valdez-Cepeda, R. Agave salmiana plant communities in central Mexico as affected by commercial use. Environ. Manag. 2012, 49, 55–63. [Google Scholar] [CrossRef][Green Version]
33. García-Moya, E.; Nobel, P.S. Leaf unfolding rates and responses to cuticle damaging for pulque agaves in Mexico. Desert Plants 1990, 10, 55–57. [Google Scholar]
34. Figueredo-Urbina, C.J.; Álvarez-Ríos, G.D.; García-Montes, M.A.; Octavio-Aguilar, P. Morphological and genetic diversity of traditional varieties of agave in Hidalgo State, Mexico. PLoS ONE 2021, 16, e0254376. [Google Scholar] [CrossRef]
35. Perez-Espana, V.H.; Cuervo-Parra, J.A.; Paz-Camacho, C.; Morales-Ovando, M.A.; Gomez-Aldapa, C.A.; Rodriguez-Jimenes, G.C.; Romero-Cortes, T. General characterization of cuticular membrane isolated from Agave salmiana. Int. J. Bio-Resour. Stress Manag. 2019, 10, 046–052. [Google Scholar] [CrossRef]
36. Arredondo, C.H.; Aguilar-Lira, G.; Perez-Silva, I.; Rodriguez, J.A.; Islas, G.; Hernandez, P. Characterization and application of Agave salmiana cuticle as bio-membrane in low-temperature electrolyzer and fuel cells. Appl. Sci. 2019, 9, 4461. [Google Scholar] [CrossRef]
37. Bernardino-Nicanor, A.; Teniente-Martínez, G.; Juarez-Goiz, J.M.S.; Filardo-Kerstupp, S.; Montañez-Soto, J.L.; González-Cruz, L. Changes in the concentration and characteristics of calcium oxalate crystals during development stages of Agave atrovirens. Adv. Biores. 2012, 3, 22–28. [Google Scholar]
38. Chen, M. The tea plant leaf cuticle: From plant protection to tea quality. Front. Plant Sci. 2021, 12, 751547. [Google Scholar] [CrossRef]
39. Chen, M.; Zhang, Y.; Kong, X.; Du, Z.; Zhou, H.; Yu, Z.; Qin, J.; Chen, C. Leaf cuticular transpiration barrier organization in tea tree under normal growth conditions. Front. Plant Sci. 2021, 12, 655799. [Google Scholar] [CrossRef] [PubMed]
40. Silva, H.; Sagardia, S.; Ortiz, M.; Franck, N.; Opazo, M.; Quiroz, M.; Tapia, C. Relationships between leaf anatomy, morphology, and water use efficiency in Aloe vera (L.) Burm f. as a function of water availability. Rev. Chil. Hist. Nat. 2014, 87, 13. [Google Scholar] [CrossRef]
41. Hill, J. The remobilization of nutrients from leaves. J. Plant Nutr. 1980, 2, 407–444. [Google Scholar] [CrossRef]
42. Ortega, Z.; Castellano, J.; Suárez, L.; Paz, R.; Díaz, N.; Benítez, A.N.; Marrero, M.D. Characterization of Agave americana L. plant as potential source of fibres for composites obtaining. SN Appl. Sci. 2019, 1, 987. [Google Scholar] [CrossRef]
43. Monja-Mio, K.M.; Escalante-Erosa, F.; Eb-Puc, X.M.; Herrera-Alamillo, M.Á.; Peña-Rodríguez, L.M.; Robert, M.L. Epicuticular wax analysis of wild and agronomically important Agave species. Phytochem. Lett. 2019, 34, 103–107. [Google Scholar] [CrossRef]
44. Yeats, T.H.; Rose, J.K. The formation and function of plant cuticles. Plant Physiol. 2013, 163, 5–20. [Google Scholar] [CrossRef] [PubMed]
45. Montelongo-Reyes, M.M.; Otazo-Sánchez, E.M.; Romo-Gómez, C.; Gordillo-Martínez, A.J.; Galindo-Castillo, E. GHG and black carbon emission inventories from Mezquital Valley: The main energy provider for Mexico Megacity. Sci. Total Environ. 2015, 527, 455–464. [Google Scholar] [CrossRef]
46. Fondom, N.Y.; Castro-Nava, S.; Huerta, A.J. Photoprotective mechanisms during leaf ontogeny: Cuticular development and anthocyanin deposition in two morphs of Agave striata that differ in leaf coloration. Botany 2009, 87, 1186–1197. [Google Scholar] [CrossRef]
47. Nio, S.A.; Songke, N.G.; Ludong, D.P.M. The content of chlorophyll a in croton (Codiaeum variegatum L.) leaves under water deficit. In AIP Conference Proceedings; AIP Publishing: New York, NY, USA, 2023; Volume 2694. [Google Scholar]
48. Adhamatika, A.; Murtini, E.S.; Sunarharum, W.B. The effect of leaf age and drying method on physico-chemical characteristics of pandan (Pandanus amaryllifolius Roxb.) leaves powder. In IOP Conference Series: Earth and Environmental Science; Purpose-Led Publishing: Lake Forest, CA, USA, 2021; Volume 733, pp. 1–9. [Google Scholar]
49. Sumenda, L.; Rampe, H.; Mantiri, F.R. Analisis Kandungan Klorofil Daun Mangga (Mangifera indica L.) pada Tingkat Perkembangan Daun yang Berbeda. J. Bios Logos. 2011, 1, 21–24. [Google Scholar] [CrossRef][Green Version]
50. Wanda, I.F.; Rachmadiyanto, A.N.; Oksari, A.A. Leaf Morphometric and Chlorophyll Content Study of Bisbul (Diospyros discolor Willd.) at the Bogor Botanical Garden. J. Trop. Biodivers. Biotechnol. 2022, 7, 72565. [Google Scholar] [CrossRef]
51. Zulfiqar, S.; Sharif, S.; Saeed, M.; Tahir, A. Role of carotenoids in photosynthesis. In Carotenoids: Structure and Function in the Human Body; Zia-Ul-Haq, M., Dewanjee, S., Riaz, M., Eds.; Springer: Cham, Switzerland, 2021; pp. 147–187. [Google Scholar] [CrossRef]
52. Hashimoto, H.; Sugai, Y.; Uragami, C.; Gardiner, A.T.; Cogdell, R.J. Natural and artificial light-harvesting systems utilizing the functions of carotenoids. J. Photochem. Photobiol. C Photochem. Rev. 2015, 25, 46–70. [Google Scholar] [CrossRef]
53. dos Santos, G.F.; Kuster, V.C.; de Melo Silva, A.F.; Faria, A.P.; Moreira, A.S.F.P. Changes in colour during leaf development of Eugenia uniflora (Myrtaceae): Different strategies for integrity conservation of the photosynthetic apparatus. Aust. J. Bot. 2021, 69, 247–257. [Google Scholar] [CrossRef]
54. Paravina, R.D.; Perez, M.M.; Ghinea, R. Acceptability and perceptibility thresholds in dentistry: A comprehensive review of clinical and research applications. J. Esthet. Restor. Dent. 2019, 31, 103–112. [Google Scholar] [CrossRef] [PubMed]
55. Aragón-Gastélum, J.L.; Ramírez-Benítez, J.E.; González-Durán, E.; González-Salvatierra, C.; Ramírez-Tobías, H.M.; Flores, J.; Gutierréz-Alcára, E.J.; Méndez-Guzmán, E.; Jarquín-Gálvez, R. Photochemical activity in early-developmental phases of Agave angustifolia subsp. tequilana under induced global warming: Implications to temperature stress and tolerance. Flora 2020, 263, 151535. [Google Scholar] [CrossRef]
56. Chávez-Guerrero, L.; Silva-Mendoza, J.; Cantú-Cárdenas, M.E.; Sepúlveda-Guzmán, S. Enzymatic Hydrolysis of Agave salmiana Cellulose. Int. Proc. Chem. Biol. Environ. Eng. 2016, 99, 19–25. [Google Scholar]
Campos-Herrera O, González-Cruz L, Silva-Martínez GA, Flores-Martínez NL, Ortíz-Basurto RI, Bernardino-Nicanor A. Physicochemical Differences in the Leaves of the Two Agave salmiana Subspecies Grown in Different Regions. Agriculture. 2025; 15(2):134. https://doi.org/10.3390/agriculture15020134
Перевод статьи «Physicochemical Differences in the Leaves of the TwoAgave salmianaSubspecies Grown in Different Regions» авторов Campos-Herrera O, González-Cruz L, Silva-Martínez GA, Flores-Martínez NL, Ortíz-Basurto RI, Bernardino-Nicanor A., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
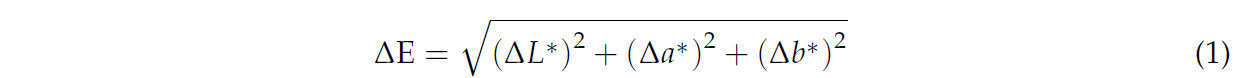
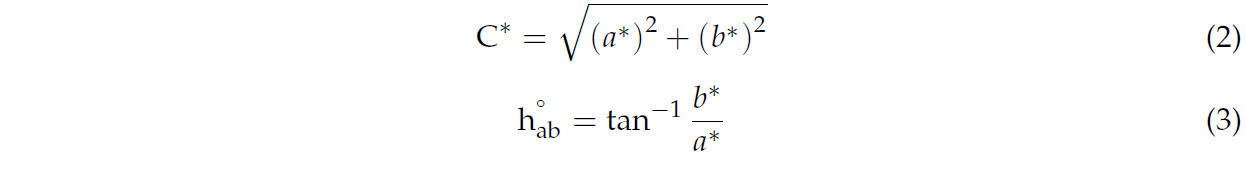
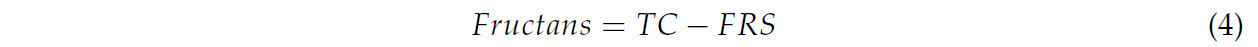
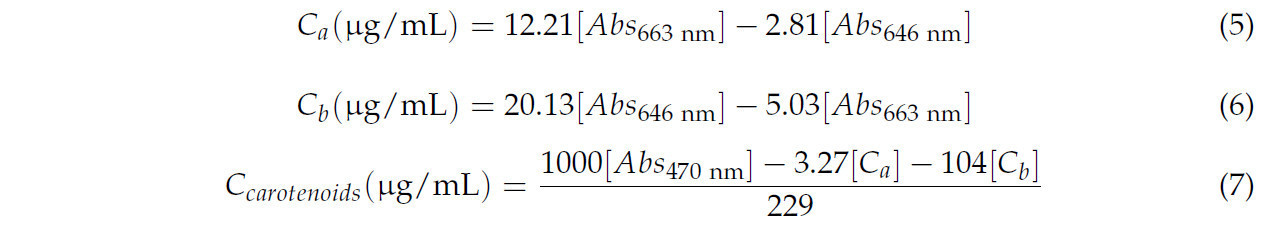
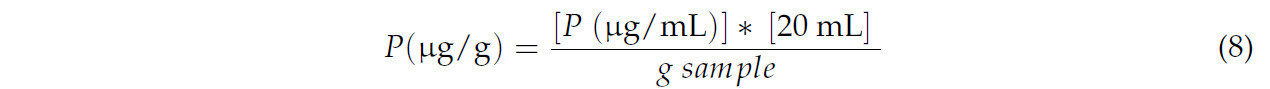






























































































Комментарии (0)