Красный и синий свет — ключ к сочному и полезному пак-чою в условиях искусственного освещения
Свет является ключевым фактором, влияющим на рост и качество сельскохозяйственных культур в условиях закрытого грунта (plant factories). Для определения оптимального светового спектра для производства пак-чоя, сорт 'Югуань №3' выращивали под пятью вариантами освещения на основе светодиодов (LED): белый свет (W; контроль, CK); белый/красный = 4:1 (WR); белый/синий = 4:1 (WB); белый/красный/синий = 3:1:1 (WRB); и белый/зеленый = 4:1 (WG). Интенсивность света во всех вариантах составляла 250 ± 10 мкмоль·м⁻²·с⁻¹.
Результаты показали существенные различия в показателях роста, питательном качестве, активности ферментов и других параметрах в зависимости от качества света. Наилучшие результаты роста наблюдались при варианте освещения WRB. Хлоропласты растений под светом WRB были хорошо развиты, с четкими гранальными ламеллами. Тилакоиды в гранах хлоропластов растений WRB были плотно уложены, также было обнаружено большое количество крахмальных зерен.
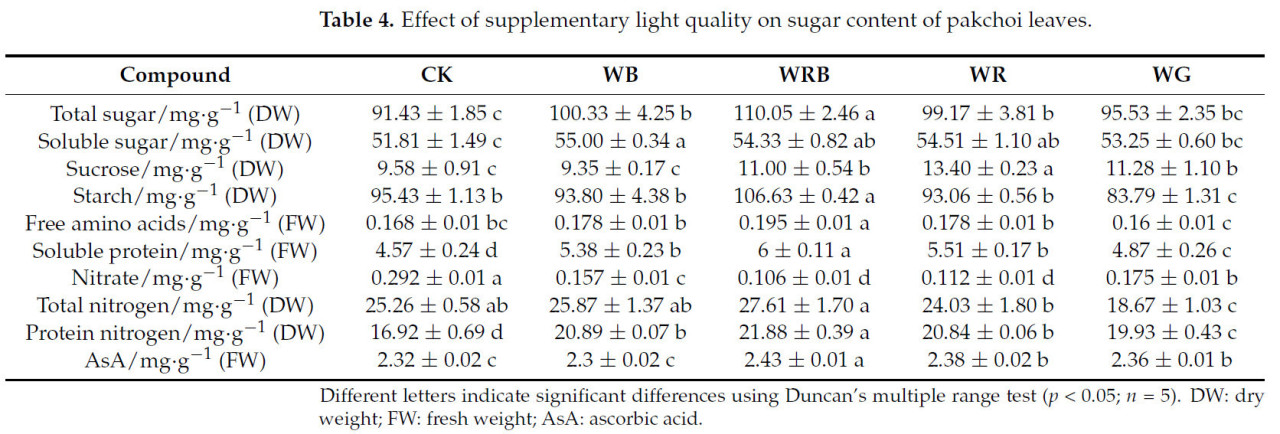
Содержание общего сахара, растворимого сахара, растворимого белка и белкового азота было достоверно выше при вариантах WB, WRB и WR по сравнению с контролем (CK), наряду со значительным снижением содержания нитратов. Среди всех вариантов обработка WRB привела к наивысшим уровням общего сахара, крахмала, свободных аминокислот, растворимого белка, общего азота, белкового азота и аскорбиновой кислоты (AsA).
Анализ ферментативной активности показал, что активность сахарозофосфатсинтазы (SPS), нитратредуктазы (NR), глутаминсинтетазы (GS), глутаматсинтетазы (GOGAT) и глутаматдегидрогеназы (GDH) была наивысшей при варианте освещения WRB.
Таким образом, дополнительное освещение смесью красного и синего света может эффективно улучшать рост и питательные свойства пак-чоя, выращиваемого под белым светом. Данная стратегия дополнительного освещения предлагает новый способ повышения питательной ценности листовых овощей в условиях растительных ферм.
1. Введение
Пак-чой (Brassica campestris L.) — один из наиболее широко потребляемых овощей в азиатских странах, известный высоким содержанием минералов, витаминов и глюкозинолатов [1]. Его можно производить в plant factories, что позволяет круглогодичное культивирование [2]. В последние годы интенсивное возделывание овощей в условиях защищенного грунта привело к усилению засоления почв, что привело к снижению урожайности и качества. Чрезмерное накопление нитратов в засоленных почвах стало главной проблемой, сдерживающей развитие отрасли овощеводства защищенного грунта в Китае [3]. В то же время, с улучшением уровня жизни, потребители все больше отдают предпочтение овощам высокого качества. Поэтому крайне важно исследовать эффективные методы выращивания и технологии улучшения качества для пак-чоя.
Plant factories — это современные агротехнологии, направленные на достижение эффективного и устойчивого производства сельскохозяйственных культур. Свет, являясь одновременно источником энергии и сигналом, играет ключевую роль в росте и развитии растений через такие факторы, как качество света, интенсивность света и фотопериод [4,5]. Что касается качества света, красный (R) и синий (B) свет привлекают наибольшее внимание из-за их значительного поглощения фотосинтетическими пигментами, что влияет на развитие различных органов растений [6]. Предыдущие исследования показали, что красный свет заметно увеличивает содержание углеродных метаболитов в растениях [4,7], в то время как синий свет регулирует физиологические процессы, такие как накопление белка, открытие устьиц и развитие хлоропластов [8,9]. Соответствующая обработка синим светом также полезна для увеличения содержания важных питательных веществ, таких как фенольные кислоты, глюкозинолаты и флавоноиды [10]. Дополнительно, исследования показали, что добавка зеленого света может существенно способствовать фотосинтетической ассимиляции углерода и улучшать как урожайность, так и питательное качество растений [3,11,12]. Однако растения, растущие при монохроматическом свете, часто испытывают физиологические проблемы, такие как снижение фотосинтетической способности и ингибирование роста [13]. Например, из-за коротковолнового и высокоэнергетического излучения синего света, сильное воздействие монохроматического синего света может вызвать усыхание листьев растений и замедление роста [14]. Чтобы избежать этого явления, наше исследование дополняет белый свет красным, синим и зеленым светом.
Рост и качество растений тесно связаны с метаболизмом углерода и азота [15,16]. Ключевые показатели качества, такие как сахар, крахмал, белок и нитраты, являются продуктами метаболизма углерода и азота, и их метаболизм и накопление регулируются такими ферментами, как сахарозофосфатсинтетаза (SPS), сахарозосинтаза (SS), нитратредуктаза (NR), глутаминсинтетаза (GS), глутаматсинтетаза (GOGAT) и глутаматдегидрогеназа (GDH) [17,18]. Качество света играет ключевую роль в регуляции метаболизма углерода и азота у растений [19]. Активность ферментов, участвующих в метаболизме углерода, зависит от монохроматического красного (R) света и комбинации красного и синего (R + B) света, что, в свою очередь, влияет на содержание растворимых сахаров в растениях [20,21]. Дополнительно, качество света (R, B, G или R + B) также влияет на активность ферментов, таких как NR и GS, путем регуляции экспрессии генов, в конечном итоге влияя на накопление азотных метаболитов [17,18,22].
Plant factories сталкиваются с проблемами, такими как низкая световая эффективность и высокое энергопотребление. В соответствии с предыдущими исследованиями, оптимизация условий качества света крайне важна для улучшения как урожайности, так и качества. Красный и синий свет широко изучались в экспериментах по выращиванию в plant factories, а зеленый свет также был частично изучен. Однако исследования по дополнению белого света красным, синим и зеленым светом все еще редки. В этом эксперименте в качестве источника света использовались светодиоды (LED), с добавлением качества света на основе белого света, при сохранении того же фотонного потока, чтобы определить оптимальный световой режим для улучшения роста и качества пак-чоя. Мы исследовали различные показатели роста пак-чоя, наблюдали ультраструктуру листьев пак-чоя и измеряли содержание продуктов метаболизма углерода и азота, таких как общий сахар, растворимый сахар, сахароза, свободные аминокислоты, растворимый белок, общий азот и нитраты, наряду с активностью ключевых ферментов, участвующих в метаболизме углерода и азота. Дополнительно, мы сравнили и проанализировали содержание основных питательных показателей пак-чоя в контролируемой среде и при полевом выращивании. Это исследование предоставляет понимание эффектов дополнения качества света к белому свету на рост и питательные свойства пак-чоя. Ожидается, что результаты предложат теоретическую основу и технические параметры для дополнительного освещения в сельскохозяйственных сооружениях.
2. Материалы и методы
2.1. Условия роста растений и световые обработки
В качестве тестового материала использовался пак-чой сорта «Югуань №3». Семена высевали в 50-луночные кассеты (52 см × 26 см, с лунками 4,8 см × 4,8 см), заполненные субстратом для рассады (почва/субстрат/куриный помет = 4:2:1), и помещали в теплицу для выращивания рассады. Когда у сеянцев развивались два листа, их пересаживали в горшки (диаметром 12 см, высотой 10 см, заполненные тем же субстратом), по одному растению на горшок. После восстановления сеянцы переносили в климатическую камеру (Zhejiang Qiushi Artificial Environment Co., Ltd., Ханчжоу, Китай) для дальнейшего выращивания. Каждая обработка повторялась 3 раза, по 18 горшков на повтор. Пробы отбирали через 25 дней после обработки в камере.
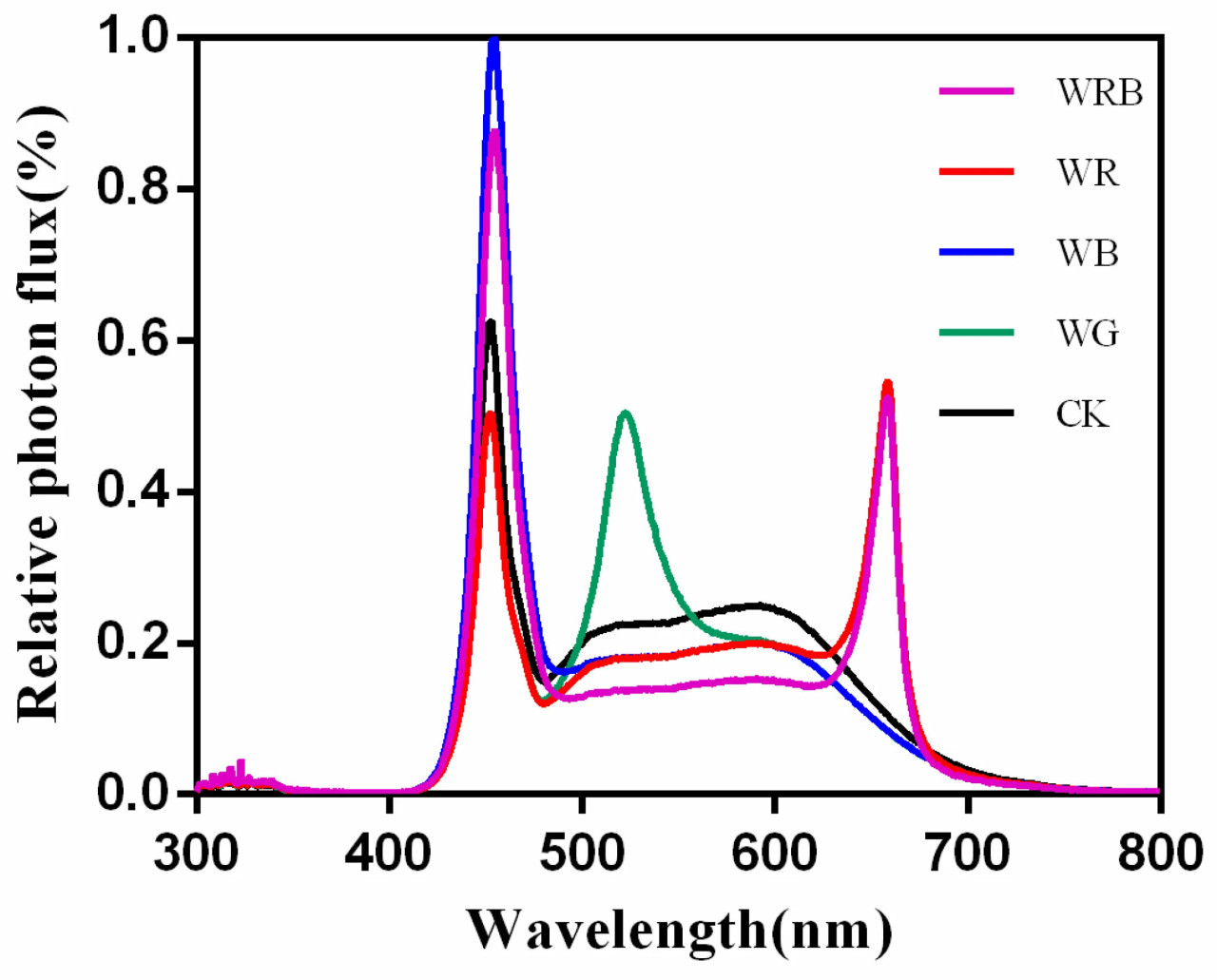
Источник света, использованный в этом эксперименте, представлял собой светодиодную трубчатую лампу для растений нового типа (Jishi Technology Lighting Co., Ltd., Чжуншань, Китай), длина каждой трубки составляла 1,2 м, диаметр — 4 см. Трубка содержала белый (W), красный (R), синий (B) и зеленый (G) свет, каждая лампа имела мощность 18 Вт. Были протестированы пять световых режимов: белые светодиоды (W; контроль, CK); белый/красный = 4:1 (WR); белый/синий = 4:1 (WB); белый/красный/синий = 3:1:1 (WRB); и белый/зеленый = 4:1 (WG). Количество светодиодных трубок и высота стеллажа регулировались для поддержания плотности потока фотосинтетических фотонов (PPFD) на уровне (250 ± 10) мкмоль·м⁻²·с⁻¹ для каждого режима (Рисунок 1, Таблица 1). PPFD измеряли с помощью фотометра 3415FX (Spectrum Technologies, Аврора, Иллинойс, США). Условия окружающей среды в климатической камере были следующими: дневная температура (20 ± 1) °C, ночная температура (15 ± 1) °C, относительная влажность воздуха 60–80%, концентрация CO₂ 380–400 мкл·л⁻¹ и фотопериод 12 ч в сутки.
Рисунок 1. Относительные спектральные значения четырех обработок.
Таблица 1. Параметры качества света для четырех обработок.
2.2. Определение углеводов
Метод Maness использовали для экстракции и определения содержания растворимого сахара в листьях пак-чоя [23]. После гомогенизации 0,1 г свежих листьев кипятили в 1 мл деионизированной воды. Затем смесь центрифугировали при 8000 об/мин в течение 15 мин и собирали супернатант. Соответствующее количество деионизированной воды и супернатанта смешивали с антроновым реагентом, а затем помещали на водяную баню при 95 °C на 10 мин. После охлаждения спектр поглощения измеряли при 620 нм для определения содержания растворимого сахара. Содержание крахмала измеряли с использованием набора (Grace Biotechnology, G0551W, Сучжоу, Китай) [24]. Для удаления жира 0,1 г свежего образца растирали с 0,5 мл петролейного эфира. Образец переносили в пробирку Eppendorf объемом 2 мл, и объем доводили до 1 мл. Пробирку встряхивали на водяной бане при 50 °C в течение 30 мин, затем центрифугировали при 12 000 об/мин в течение 5 мин при комнатной температуре для сбора осадка. После удаления сахара этанолом к смеси добавляли 1 мл ДМСО и встряхивали. Затем 0,1 мл образца смешивали с 0,9 мл разбавляющего раствора и кипятили в течение 15 мин перед определением содержания крахмала с помощью ферментного анализатора. Метод Li использовали для экстракции общего сахара [25]. Концентрацию сахарозы определяли с помощью антронового колориметрического метода, а поглощение измеряли при 620 нм [26].
2.3. Определение нитратов, свободных аминокислот, растворимого белка, общего азота и белкового азота
Содержание белка экстрагировали и определяли в соответствии с методом Li и др. [27]. Свежую ткань листьев пак-чоя тщательно растирали и гомогенизировали с экстракционным буфером в ледяной водяной бане. Затем гомогенат центрифугировали при 4 °C и 15 000 об/мин в течение 25 мин. Концентрацию растворимого белка измеряли с использованием реагента Coomassie Plus Protein Assay Reagent (Pierce, Рокфорд, Иллинойс, США). Содержание нитратов определяли салициловым методом. К 0,1 г образца листовой ткани добавляли 10 мл деионизированной воды, кипятили на водяной бане в течение 25 мин, а затем супернатант разбавляли до конечного объема 20 мл. Аликвоту 0,1 мл супернатанта смешивали с 0,4 мл раствора салициловой кислоты и серной кислоты, хорошо встряхивали и оставляли на 20 мин. После этого добавляли 9,5 мл раствора NaOH и измеряли поглощение при 410 нм [9]. Содержание свободных аминокислот в листьях пак-чоя экстрагировали и определяли в соответствии с методом Cao и др. [28]. Общий азот и белок определяли с использованием набора. Использовали набор BCA Protein Assay Kit (Shanghai Enzyme-linked Biotechnology, Шанхай, Китай), а общий азот и белковый азот экстрагировали и определяли в соответствии с инструкциями производителя.
2.4. Определение содержания AsA
Содержание аскорбиновой кислоты (AsA) определяли с использованием модифицированного метода Chen и др. [29]. Всего 0,2 г высушенных листьев пак-чоя смешивали с 15 мл 4,5% водной фосфорной кислоты. После встряхивания при 300 об/мин в течение 30 мин в темноте смеси центрифугировали при 16 000 об/мин в течение 10 мин. Содержание AsA определяли путем анализа супернатантов с использованием системы ВЭЖХ (Agilent, модель-1100, Санта-Клара, Калифорния, США), оснащенной колонкой C18 (внутренний диаметр 4,6 мм, длина 250 мм, размер частиц 5 мкм, Restek, Маунт-Эйр, Пенсильвания, США). Затем 0,21% фосфорную кислоту использовали для элюирования экстракта со скоростью потока 0,8 мл/мин, а концентрации измеряли при 254 нм относительно стандартов AsA (Standard Substance Center, Пекин, Китай).
2.5. Определение ферментативной активности
Активность глутаматсинтетазы (GOGAT) и глутаминсинтетазы (GS) измеряли в соответствии с методом Fan и др. [2]. Всего 0,5 г листовой ткани гомогенизировали в 50 ммоль·л⁻¹ буфере (содержащем 1% (мас./об.) нерастворимого поливинилпирролидона, 1,5% (мас./об.) растворимого казеина, 2 ммоль·л⁻¹ дитиотреитола и 2 ммоль·л⁻¹ ЭДТА) в ледяной водяной бане. Затем смесь центрифугировали при 18 000 об/мин и 4 °C в течение 20 мин. Супернатант сохраняли для определения активности ферментов GOGAT и GS.
Активность нитратредуктазы (NR) определяли в соответствии с методом предыдущих исследований [30]. К 0,1 г образца листовой ткани добавляли 4 мл фосфатного буфера и гомогенизировали, затем центрифугировали при 4 °C и 18 000 об/мин в течение 15 мин. После этого к 200 мкл супернатанта добавляли 0,5 мл 100 мМ KNO₃ и 0,3 мл 2,5 мМ никотинамидадениндинуклеотида и инкубировали при 25 °C в течение 30 мин. Затем добавляли 1 мл 30% трихлоруксусной кислоты для остановки реакции. Наконец, добавляли 2 мл сульфаниламидного реагента и 2 мл 1-нафтиламина. После 15 мин реакции поглощение измеряли при 520 нм для определения активности нитратредуктазы.
Активность сахарозофосфатсинтетазы (SPS) и сахарозосинтазы (SS) определяли в соответствии с методом Solomakhin и Blanke [31]. Активность глутаматдегидрогеназы (GDH) измеряли колориметрически при 340 нм с использованием набора для анализа GDH (Comin Biotechnology Co., Ltd., Сучжоу, Китай). Активность фермента определяли как количество молей NADH, потребляемое в минуту.
2.6. Наблюдение ультраструктуры хлоропластов
Наблюдение ультраструктуры хлоропластов основывалось на методах наших предшественников, с некоторыми модификациями. После обработки выбирали третий полностью развернутый настоящий лист, без болезненных пятен и однородного размера. Тканевые блоки (1 мм × 1 мм) вырезали с обеих сторон главной жилки и немедленно погружали в 1% глутаровый альдегид, приготовленный на 0,1 моль·л⁻¹ фосфатно-солевом буфере (PBS, pH 6,8). Ткань подвергали вакуумной инфильтрации в течение примерно 5 мин, пока блоки не опускались на дно, с последующей фиксацией в 4% глутаровом альдегиде, приготовленном на PBS при 4 °C в течение 3 ч. Затем ткань промывали PBS 4–6 раз, каждый раз по 30 мин, и докрашивали 1% тетроксидом осмия, приготовленным на PBS при 4 °C в течение 2 ч. После промывки PBS 4–6 раз, каждый раз по 30 мин, удаляли избыточный фиксатор. Ткань обезвоживали через серию ацетона возрастающей концентрации (30%, 50%, 70%, 80%, 90% и 95% ацетона), каждый градиент длился 30 мин, с последующими тремя сменами 100% ацетона, каждый раз по 30 мин. После обезвоживания образцы пропитывали и заливали. Пропитку проводили с использованием смеси 100% ацетона и заливочной смолы в соотношениях 3:1 в течение 3 ч, 1:1 в течение 5 ч и 1:3 в течение 12 ч. Затем образцы заливали чистой заливочной смолой на 24 ч. Заливочная смола состояла из 10 мл эпоксидной смолы Epon812, 4 мл отвердителя DDSA, 7 мл пластификатора MNA и 0,3 мл катализатора DMP-30. Полимеризация происходила при 30 °C в течение 12 ч и 60 °C в течение 48 ч. Выбирали репрезентативные полимеризованные блоки, и ультратонкие срезы толщиной 70 нм вырезали с помощью ультрамикротома Leica Ultracut UCT (Leica Microsystems, Вецлар, Германия). Срезы окрашивали двойным методом окрашивания уранилацетатом и цитратом свинца. Ультраструктуру листьев наблюдали и фотографировали с помощью просвечивающего электронного микроскопа JEM-1400 Plus (JEOL Ltd., Токио, Япония) при увеличениях 25 000 об/мин для исследования крахмальных зерен и хлоропластов и 50 000 об/мин для анализа толщины граны и количества гранных ламелл.
2.7. Статистический анализ
Данные обрабатывали с использованием SigmaPlot 10.0, и проводили однофакторный дисперсионный анализ с помощью SPSS 22.0 [32]. Для множественных сравнений применяли тест Дункана для оценки значимых различий (p < 0,05).
3. Результаты
3.1. Влияние дополнительного качества света на морфологические показатели роста у пак-чоя
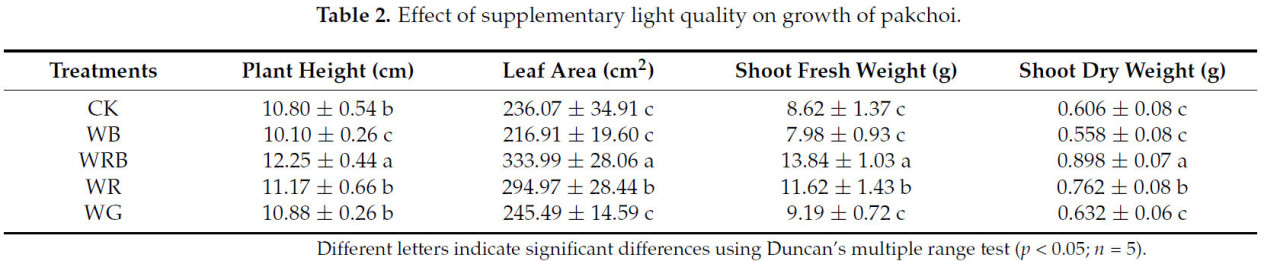
Как показано в Таблице 2, при обработке WRB морфологические показатели роста (высота растения, площадь листа, сырая масса побегов, сухая масса побегов) были значительно выше, чем при других обработках. По всем обработкам показатели роста следовали стабильной нисходящей тенденции, в порядке от наивысшего к наименьшему: WRB > WR > WG > CK > WB. Это указывает на то, что обработка WRB привела к наилучшим показателям роста пак-чоя.
Таблица 2. Влияние дополнительного качества света на рост пак-чоя.
3.2. Влияние дополнительного качества света на ультраструктуру хлоропластов в листьях пак-чоя
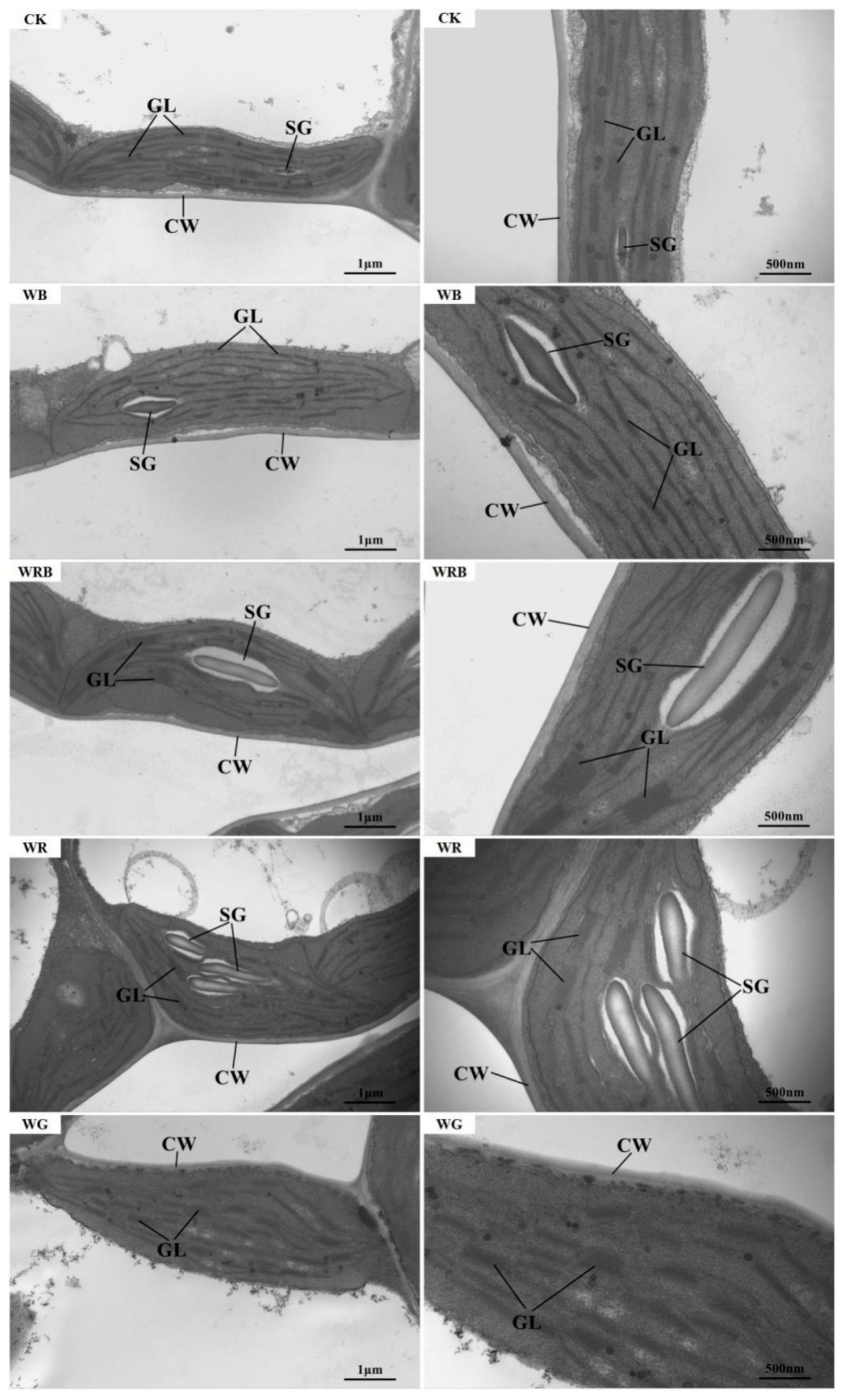
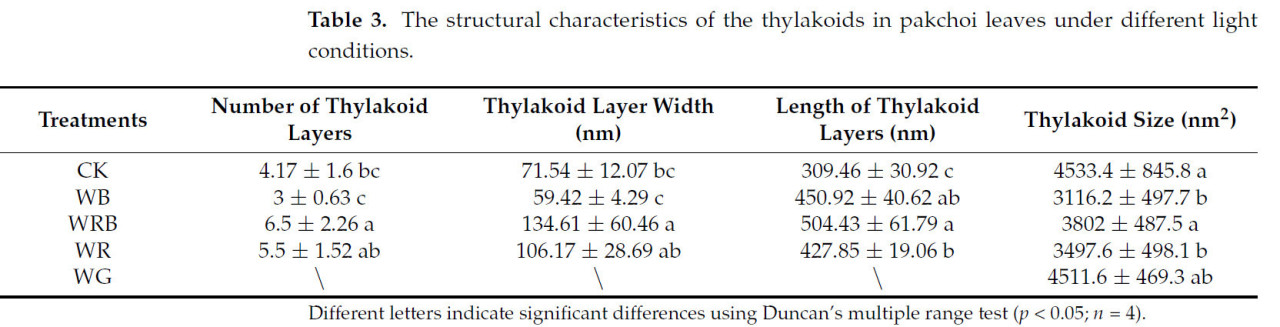
При контрольной обработке (CK) хлоропласты были веретеновидной формы, тесно прилегали к неповрежденной клеточной стенке, с упорядоченными тилакоидными ламеллами и мелкими крахмальными зернами (Рисунок 2, Таблица 3). При обработке WB гранальные ламеллы были многочисленными, но менее уложенными, с более узкими ламеллами. При обработке WRB хлоропласты были полными и плотно прилегали к клеточной стенке, с хорошо выраженными гранальными ламеллами, плотно уложенными тилакоидами и более крупными крахмальными зернами. При обработке WR хлоропласты имели четкие гранальные ламеллы, больше уложенных тилакоидов и много крупных крахмальных зерен. При обработке WG хлоропласты были размытыми, с разрушенной оболочкой, нечетким уложением тилакоидов и без крахмальных зерен. Эти результаты показывают, что дополнительный красно-синий смешанный свет, добавленный к белому свету, наиболее эффективно способствовал развитию хлоропластов в листьях пак-чоя.
Рисунок 2. Влияние дополнительного качества света на ультраструктуру хлоропластов листьев пак-чоя. Левая сторона увеличена в 2500 раз, правая сторона увеличена в 5000 раз. CW: клеточная стенка; SG: крахмальное зерно; GL: гранальная ламелла.
Таблица 3. Структурные характеристики тилакоидов в листьях пак-чоя при различных световых условиях.
3.3. Влияние дополнительного качества света на качество пак-чоя
Содержание общего сахара и растворимого сахара было значительно повышено при обработках WB, WRB и WR по сравнению с CK, при этом содержание сахарозы также было выше при обработках WRB, WR и WG (Таблица 4). Содержание крахмала было значительно повышено только при обработке WRB. Добавление зеленого света к белому свету привело к снижению накопления сахарозы в листьях пак-чоя. Примечательно, что наивысшее содержание общего сахара и крахмала наблюдалось при обработке WRB. По сравнению с контрольной обработкой (CK), содержание растворимого белка и белкового азота было значительно увеличено при обработках WB, WRB, WR и WG, в то время как содержание нитратов было значительно снижено. Анализ содержания свободных аминокислот и общего азота показал, что свободные аминокислоты немного уменьшились, а общий азот значительно снизился при обработке WG. Однако при обработке WRB содержание свободных аминокислот, растворимого белка, общего азота и белкового азота было наивысшим среди всех обработок, в то время как содержание нитратов было самым низким. Содержание AsA в пак-чое было значительно выше при обработках WRB, WR и WG по сравнению с CK, при этом не было значимой разницы, наблюдаемой при обработке WB. Эти результаты показывают, что синий свет не оказывал значимого эффекта на накопление AsA, но добавление красного или зеленого света к белому свету эффективно способствовало накоплению AsA и улучшило питательное качество пак-чоя.
Таблица 4. Влияние дополнительного качества света на содержание сахара в листьях пак-чоя.
3.4. Влияние дополнительного качества света на активность ключевых ферментов
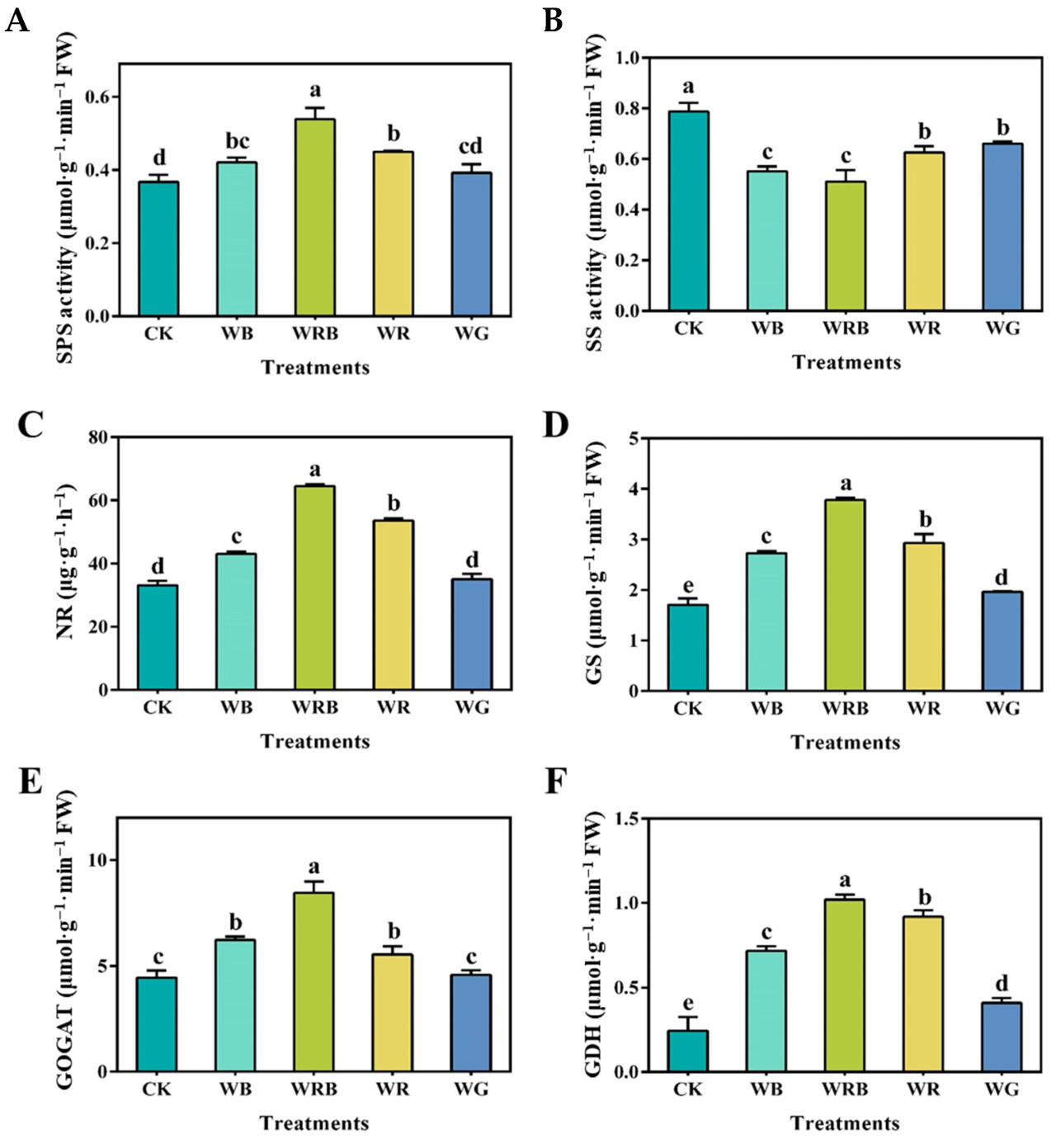
Активность SPS была на 46,9%, 22,3% и 14,7% выше при обработках WRB, WR и WB соответственно, по сравнению с CK (Рисунок 3А). Не было значимой разницы между обработками WG и CK. Дополнительно, активность SPS была значительно выше при обработке WRB, чем в других группах обработки. Напротив, активность SS была значительно снижена во всех обработках по сравнению с CK, причем обработки WRB и WB показали наименьшую активность (Рисунок 3B). Наивысшая активность нитратредуктазы (NR) наблюдалась в группе обработки WRB, с увеличением на 94%, 61,9% и 29,9% по сравнению с CK при обработках WRB, WR и WB соответственно. Не было значимой разницы между обработками WG и CK (Рисунок 3C). Активность глутаминсинтетазы (GS) следовала порядку WRB > WR > WB > WG > CK (Рисунок 3D). Активность глутаматсинтетазы (GOGAT) была значительно выше при обработке WRB, чем при других обработках (Рисунок 3E). Не было значимой разницы между обработками WR и WB, обе из которых были значительно выше, чем CK, в то время как разница между WG и CK не была значимой. Наивысшая активность глутаматдегидрогеназы (GDH) наблюдалась при обработке WRB, за которой следовала WR, в то время как контрольная обработка (CK) показала значительно более низкую активность по сравнению с другими обработками (Рисунок 3F).
Рисунок 3. Влияние дополнительного качества света на активность различных ферментов листьев пак-чоя. (A) Сахарозофосфатсинтетаза (SPS); (B) сахарозосинтаза (SS); (C) нитратредуктаза (NR); (D) глутаминсинтетаза (GS); (E) глутаматсинтетаза (GOGAT); и (F) глутаматдегидрогеназа (GDH). Разные буквы указывают на значимые различия с использованием множественного диапазонного теста Дункана (p < 0,05; n = 5).
3.5. Качество пак-чоя, выращенного в различных условиях
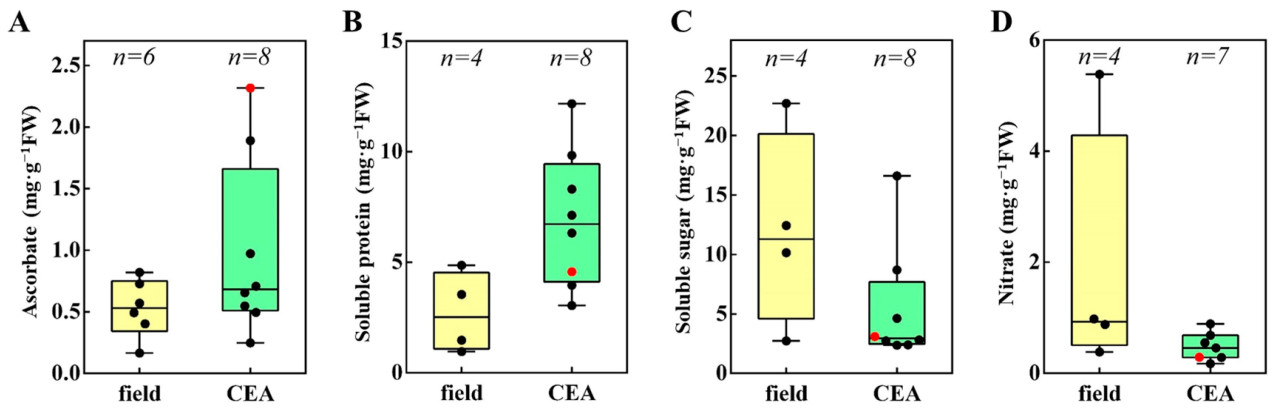
Для сравнения содержания типичных показателей качества в пак-чое, выращенном в различных условиях, были рассчитаны средние значения для растворимого сахара, растворимого белка, AsA и нитратов, которые показаны на Рисунке 4. Предыдущие исследования показали, что пак-чой, выращенный в контролируемых условиях, имел значительно более высокие уровни AsA и растворимого белка по сравнению с пак-чоем, выращенным в поле, в то время как уровни растворимого сахара и нитратов были ниже. В этом эксперименте пак-чой, выращенный в контролируемых условиях окружающей среды, показал значительно более высокие уровни AsA по сравнению с другими методами выращивания, в то время как уровни растворимого белка, растворимого сахара и нитратов были ниже.
Рисунок 4. Качество пак-чоя, выращенного в различных условиях. Красные точки указывают на содержание показателей качества в этом исследовании. Черные точки указывают на содержание показателей качества в предыдущих исследованиях. Field: пак-чой, выращенный в поле; CEA: пак-чой, выращенный в условиях контролируемого сельского хозяйства (controlled environmental agriculture); (A) Содержание аскорбата; (B) Содержание растворимого белка; (C) Содержание растворимого сахара; (D) Содержание нитратов.
4. Обсуждение
Качество света является ключевым фактором окружающей среды, влияющим на рост и питательное качество зеленых садовых культур [33]. С растущим спросом и развитием технологий, светодиоды с управляемым динамическим спектром стали широко использоваться. Эти светодиоды предлагают широкий диапазон длин волн, включая красный, синий, зеленый и дальний красный свет, что улучшает эффективность преобразования и использования света растениями [34,35]. Поэтому оптимизация комбинации фотосинтетически эффективных спектров для каждой культуры может улучшить световую эффективность, сэкономить энергию и улучшить как урожайность, так и питательное качество. В этом исследовании растения пак-чоя подвергались воздействию белого светодиодного света с различными дополнительными качествами света. Влияние этих световых обработок на рост и качество оценивали с помощью показателей роста и различных биохимических параметров. Результаты показали, что дополнение белого света смешанным красно-синим светом было наиболее эффективным режимом для оптимизации роста пак-чоя и улучшения его качества (Таблица 2 и Таблица 4).
Рост и развитие растений зависят от качества света. Было показано, что растения, выращенные при красном свете, улучшают эффективность захвата световой энергии, что приводит к повышенному накоплению фотосинтетических продуктов в фотосинтетических структурах, что увеличивает содержание углеводов и способствует росту растений [4,36]. Это было подтверждено в нашем эксперименте. По сравнению с контрольной обработкой (CK), пак-чой при дополнении красным светом (WR) показал больше и крупнее крахмальных зерен в хлоропластах, наряду с более высоким содержанием углеводов (общий сахар, растворимый сахар и сахароза) в листьях (Рисунок 2 и Таблица 4). В то же время, дополнение белого света синим светом (WB) только увеличивало содержание растворимых сахаров; однако после дополнения белого света смешанным красно-синим светом содержание углеводов было значительно выше, чем в других группах обработки, и активность ферментов, связанных с метаболизмом сахарозы, таких как SPS, была значительно повышена (Рисунок 2). Это указывает на то, что комбинация красного и синего света не является простым аддитивным эффектом, но может регулировать производство и накопление углеводов путем регуляции активности ферментов, связанных с метаболизмом углерода. Согласно исследованию Ren и др., комбинированная обработка красным и синим светом может увеличить экспрессию различных генов, связанных с метаболизмом углерода, включая ген SPS1, связанный с SPS [18]. Интересно, что тенденция изменения активности SS при обработке WRB полностью противоположна SPS, что может быть связано с тем, что большая часть SS использовалась для разложения сахарозы, а не для синтеза сахарозы. Дополнительно, дополнение красного и синего света к белому свету было более полезным для развития тилакоидов. Обработка WRB привела к большему количеству слоев тилакоидов и большему размеру тилакоидов (Таблица 3). Этот улучшенный фотосинтетический аппарат усилил фотосинтез листьев и способствовал накоплению углеводов в пак-чое, что способствовало более высокой биомассе, наблюдаемой при обработке WRB.
Различные качества света оказывают различное влияние на биосинтез питательных веществ у растений [29]. Пак-чой особенно подвержен избыточному накоплению нитратов во время производства, особенно в условиях гидропоники [37]. Метаболизм нитратов в растениях значительно зависит от азотных ферментов, таких как нитратредуктаза (NR), глутаминсинтетаза (GS) и глутаматсинтетаза (GOGAT). NR непосредственно восстанавливает нитрат до нитрита, который затем восстанавливается до аммония нитритредуктазой, в то время как GS и GOGAT косвенно регулируют метаболизм нитратов, участвуя в ассимиляции аммония [22,38]. Sun и др. [39] обнаружили, что комбинация синего и красного света усиливает активность GS и GOGAT в листьях томата, увеличивая содержание общего азота, нитратного азота, свободных аминокислот и растворимого белка. В этом эксперименте обработки WB, WRB и WR значительно снизили содержание нитратов, причем обработка WRB показала самое низкое содержание нитратов и самую высокую активность NR, GS, GOGAT и GDH. Эти эффекты могут быть связаны с тем, что синий и красный свет способствуют синтезу растворимых белков, тем самым увеличивая поставку ферментов, восстанавливающих нитраты, и NADPH в листьях, а накопление высоких уровней аминокислот также отрицательно регулирует поглощение нитратов [2,40]. Комбинация красного и синего света дополнительно усиливает активность ферментов метаболизма азота, что приводит к большему синтезу аминокислот и растворимых белков, приводя к более низкому содержанию нитратов. Однако молекулярный механизм того, как комбинация красного и синего света усиливает активность ферментов метаболизма азота, все еще требует дальнейшего исследования. В то же время, дополнение зеленого света может эффективно снизить содержание нитратов, что согласуется с результатами исследований Bian и др. [22]. Однако в этом эксперименте зеленый свет не оказывал значимого влияния на активность NR, что, предполагается, связано с синтезом растворимых белков.
AsA является ключевым антиоксидантом в растениях, который эффективно удаляет активные формы кислорода, играя ключевую роль в предотвращении цинги и поддержании здоровья кожи, десен и кровеносных сосудов. Поскольку организм человека не может синтезировать или хранить AsA, его необходимо получать через потребление фруктов и овощей [41,42]. Свет является важным фактором окружающей среды, который регулирует уровни AsA в растениях. Однако в условиях plant factories световое излучение намного ниже, чем в естественных условиях, что приводит к снижению уровней AsA в овощах [43,44]. Оптимизация световых условий для листовых овощей не только увеличивает уровни AsA и продлевает срок хранения, но и улучшает их питательную ценность, что крайне важно для продвижения культивирования в условиях защищенного грунта [45,46]. Ma и др. [47] показали, что обработка красным светом может увеличить содержание AsA в брокколи, задерживая деградацию AsA, в то время как обработка синим светом не оказывает влияния на метаболизм AsA. В этом исследовании содержание AsA в пак-чое при обработке WRB было значительно выше, чем при других обработках. Кроме того, содержание AsA в условиях красного и зеленого света было значительно выше, чем в условиях контроля и синего света. Эти результаты показывают, что зеленый свет также увеличивает содержание AsA, и что комбинация красного и синего света более эффективна, чем только красный свет, для увеличения уровней AsA в пак-чое. Это предполагает, что смешивание красного, синего и зеленого света может дать лучшие результаты.
Растворимые сахара являются основным источником энергии и вкуса в растениях и важным питательным параметром. В исследованиях листьев яблони, обработанных различными качествами света, было обнаружено, что синий свет способствовал увеличению содержания растворимого сахара, в то время как красный свет ингибировал накопление крахмала [48]. Di и др. [49] наблюдали, что уровень метаболизма углерода в баклажанах был выше при комбинации обработки красным и синим светом по сравнению с монохроматическими или белыми световыми обработками. Lin и др. [9] дальнейшим образом продемонстрировали, что в гидропонном салате комбинация красного и синего света с белым светом значительно увеличивала содержание растворимого сахара по сравнению с только красным и синим светом. В нашем исследовании обработки WR и WB значительно увеличивали содержание общего сахара и растворимого сахара в листьях пак-чоя, но не оказывали значимого влияния на содержание крахмала. Обработка WRB способствовала накоплению крахмала, одновременно увеличивая содержание сахара. Обработка WG не показала значимого влияния на метаболизм сахара, но ингибировала накопление крахмала. Это может быть связано с более низким поглощением зеленого света во время фотосинтеза [50]. Предыдущие исследования показали, что растворимые углеводы и нитраты в растениях дополняют друг друга в поддержании осмотического давления клеток [51]. В этом исследовании добавление красного и синего света снизило содержание нитратов в листьях капусты, что также может быть причиной увеличения содержания растворимого сахара. Содержание растворимого сахара в пак-чое в этом исследовании было ниже, чем у растений, выращенных в поле, что может способствовать менее благоприятному вкусу, но оно было аналогично таковому при выращивании в теплице. Это может быть связано с отсутствием неблагоприятных условий, и для увеличения содержания сахара в производстве можно применять краткосрочные предуборочные стрессовые обработки, такие как дополнительное освещение и прекращение подачи азота [52].
5. Выводы
В заключение, наши результаты показывают, что дополнение белого света красным и синим светом является оптимальным световым режимом для выращивания пак-чоя. Эта световая комбинация значительно увеличила активность сахарозофосфатсинтазы и сахарозосинтазы, что привело к более высокой биомассе. Она также улучшила морфологию хлоропластов, ассимиляцию и транспорт углерода в листьях-источниках и накопление углеводов в стоках. Дополнительно, красно-синий смешанный свет повлиял на активность NR, GS, GOGAT и GDH в метаболизме азота, усиливая превращение неорганического азота в белок. Наши результаты исследований дальнейшим образом подтверждают функциональные эффекты красного, синего и зеленого света на растения, предоставляя соответствующие технические рекомендации для искусственных световых конфигураций для листовых овощей в plant factories, и улучшая коммерческую экономическую выгоду пак-чоя в plant factories. Поэтому дополнение белого света красным и синим светом является подходящим вариантом для выращивания пак-чоя в plant factories или теплицах. Однако эффективность этой схемы дополнительного освещения в улучшении роста и качества других нелистовых овощей остается подлежащей проверке, и молекулярный механизм регуляции метаболизма углерода и азота красно-синим смешанным светом также требует дальнейшего подробного исследования.
Ссылки
1. Liu, X.; Li, Y.; Zhu, J.; Li, P. Integrative analysis of transcriptome reveals the possible mechanism of delayed leaf senescence in pak choi (Brassica rapa subsp. chinensis) following melatonin treatment. Food Qual. Saf. 2022, 7, fyac064. [Google Scholar] [CrossRef]
2. Fan, X.; Xue, F.; Song, B.; Chen, L. Effects of blue and red light on growth and nitrate metabolism in pakchoi. Open Chem. 2019, 17, 456–464. [Google Scholar] [CrossRef]
3. Bai, X.; Jiang, Y.; Miao, H.; Xue, S.; Chen, Z.; Zhou, J. Intensive vegetable production results in high nitrate accumulation in deep soil profiles in China. Environ. Pollut. 2021, 287, 117598. [Google Scholar] [CrossRef] [PubMed]
4. Wang, J.; Lu, W.; Tong, Y.; Yang, Q. Leaf Morphology, Photosynthetic Performance, Chlorophyll Fluorescence, Stomatal Development of Lettuce (Lactuca sativa L.) Exposed to Different Ratios of Red Light to Blue Light. Front. Plant Sci. 2016, 7, 250. [Google Scholar] [CrossRef] [PubMed]
5. Kharshiing, E.; Mawphlang, O.; Lama, V.; Bhattacharjee, R.; Sahoo, L. Manipulation of light environment for optimising photoreceptor activity towards enhancing plant traits of agronomic and horticultural importance in crops. J. Hortic. Sci. Biotechnol. 2022, 97, 535–551. [Google Scholar] [CrossRef]
6. Chen, X.; Yang, Q.; Song, W.; Wang, L.; Guo, W.; Xue, X. Growth and nutritional properties of lettuce affected by different alternating intervals of red and blue LED irradiation. Sci. Hortic. 2017, 223, 44–52. [Google Scholar] [CrossRef]
7. Sæbø, A.; Krekling, T.; Appelgren, M. Light quality affects photosynthesis and leaf anatomy of birch plantlets in vitro. Plant Cell Tissue Organ Cult. 1995, 41, 177–185. [Google Scholar] [CrossRef]
8. Urbonaviciute, A.; Pinho, P.; Samuoliene, G.; Duchovskis, P.; Vitta, P.; Stonkus, A.; Tamulaitis, G.; Zukauskas, A.; Halonen, L. Effect of short-wavelength light on lettuce growth and nutritional quality. Sodininkystė ir daržininkystė 2007, 26, 157–165. [Google Scholar]
9. Wu, W.; Chen, L.; Liang, R.; Huang, S.; Li, X.; Huang, B.; Luo, H.; Zhang, M.; Wang, X.; Zhu, H. The role of light in regulating plant growth, development and sugar metabolism: A review. Front. Plant Sci. 2025, 15, 1507628. [Google Scholar] [CrossRef]
10. Zhang, R.; He, Q.; Pan, Q.; Feng, Y.; Shi, Y.; Li, G.; Zhang, Y.; Liu, Y.; Khan, A. Blue-green light treatment enhances the quality and nutritional value in postharvest Chinese cabbage (Brassica rapa L. ssp. pekinensis). Food Chem. 2024, 24, 102004. [Google Scholar] [CrossRef]
11. Schenkels, L.; Saeys, W.; Lauwers, A.; Proft, M.P.D. Green light induces shade avoidance to alter plant morphology and increases biomass production in Ocimum basilicum L. Sci. Hortic. 2020, 261, 109002. [Google Scholar] [CrossRef]
12. Zhang, R.; Liu, Y.; Pan, Q.; Khan, A.; Bai, X.; Ali, M.; Yang, W.; Zhang, L.; Li, B. The effects of short term blue light treatment on promoting nutrition value in Chinese cabbage. Food Chem. 2023, 412, 135542. [Google Scholar] [CrossRef]
13. Izzo, L.G.; Arena, C.; De Micco, V.; Capozzi, F.; Aronne, G. Light quality shapes morpho-functional traits and pigment content of green and red leaf cultivars of Atriplex hortensis. Sci. Hortic. 2019, 246, 942–950. [Google Scholar] [CrossRef]
14. Izzo, L.G.; Hay Mele, B.; Vitale, L.; Vitale, E.; Arena, C. The role of monochromatic red and blue light in tomato early photomorphogenesis and photosynthetic traits. Environ. Exp. Bot. 2020, 179, 104195. [Google Scholar] [CrossRef]
15. Commichau, F.; Forchhammer, K.; Stülke, J. Regulatory links between carbon and nitrogen metabolism. Curr. Opin. Microbiol. 2006, 9, 167–172. [Google Scholar] [CrossRef] [PubMed]
16. Baslam, M.; Mitsui, T.; Sueyoshi, K.; Ohyama, T. Recent Advances in Carbon and Nitrogen Metabolism in C3 Plants. Int. J. Mol. Sci. 2021, 22, 318. [Google Scholar] [CrossRef]
17. Zhang, T.; Shi, Y.; Piao, F.; Sun, Z. Effects of different LED sources on the growth and nitrogen metabolism of lettuce. Plant Cell Tissue Organ Cult. 2018, 134, 231–240. [Google Scholar] [CrossRef]
18. Ren, M.; Liu, S.; Mao, G.; Tang, C.; Gai, P.; Guo, X.; Zheng, H.; Wang, W.; Tang, Q. Simultaneous Application of Red and Blue Light Regulate Carbon and Nitrogen Metabolism, Induces Antioxidant Defense System and Promote Growth in Rice Seedlings under Low Light Stress. Int. J. Mol. Sci. 2023, 24, 10706. [Google Scholar] [CrossRef] [PubMed]
19. Dou, H.; Niu, G.; Gu, M.; Masabni, J. Effects of Light Quality on Growth and Phytonutrient Accumulation of Herbs under Controlled Environments. Horticulturae 2017, 3, 36. [Google Scholar] [CrossRef]
20. Shin, K.; Murthy, H.; Heo, J.; Hahn, E.; Paek, K. The effect of light quality on the growth and development of in vitro cultured Doritaenopsis plants. Acta Physiol. Plant. 2008, 30, 339–343. [Google Scholar] [CrossRef]
21. Li, Y.; Xin, G.; Wei, M.; Shi, Q.; Yang, F.; Wang, X. Carbohydrate accumulation and sucrose metabolism responses in tomato seedling leaves when subjected to different light qualities. Sci. Hortic. 2017, 225, 490–497. [Google Scholar] [CrossRef]
22. Bian, Z.; Cheng, R.; Wang, Y.; Yang, Q.; Lu, C. Effect of green light on nitrate reduction and edible quality of hydroponically grown lettuce (Lactuca sativa L.) under short-term continuous light from red and blue light-emitting diodes. Environ. Exp. Bot. 2018, 153, 63–71. [Google Scholar] [CrossRef]
23. Maness, N. Extraction and analysis of soluble carbohydrates. In Plant Stress Tolerance; Methods in Molecular Biology; Humana Press: Clifton, NJ, USA, 2010; Volume 639, pp. 341–370. [Google Scholar]
24. Wei, J.; Song, K.; Zang, Z.; Yang, H.; Gao, Y.; Zhang, J.; Wang, Z.; Liu, C. Influence of specific tobacco endophytic Bacillus on tobacco leaf quality enhancement during fermentation. Front. Microbiol. 2024, 15, 1468492. [Google Scholar] [CrossRef] [PubMed]
25. Li, H.; Tang, C.; Xu, Z. The effects of different light qualities on rapeseed (Brassica napus L.) plantlet growth and morphogenesis in vitro. Sci. Hortic. 2013, 150, 117–124. [Google Scholar] [CrossRef]
26. Shi, R.; Liu, W.; Liu, J.; Zeb, A.; Wang, Q.; Wang, J.; Li, J.; Yu, M.; Ali, N.; An, J. Earthworms improve the rhizosphere micro-environment to mitigate the toxicity of microplastics to tomato (Solanum lycopersicum). J. Hazard. Mater. 2024, 472, 134578. [Google Scholar] [CrossRef] [PubMed]
27. Li, H.; Liang, Z.; Ding, G.; Shi, L.; Xu, F.; Cai, H. A natural light/dark cycle regulation of carbon-nitrogen metabolism and gene expression in rice shoots. Front. Plant Sci. 2016, 7, 1318. [Google Scholar] [CrossRef]
28. Cao, H.; Zhang, M.; Zhao, H.; Zhang, Y.; Wang, X.; Guo, S.; Zhang, Z.; Liu, T. Deciphering the mechanism of β-aminobutyric acid-induced resistance in wheat to the grain aphid, Sitobion avenae. PLoS ONE 2014, 9, e91768. [Google Scholar] [CrossRef]
29. Chen, X.; Xue, X.; Guo, W.; Wang, L.; Qiao, X. Growth and nutritional properties of lettuce affected by mixed irradiation of white and supplemental light provided by light-emitting diode. Sci. Hortic. 2016, 200, 111–118. [Google Scholar] [CrossRef]
30. Li, J.; Yang, P.; Sohail, H.; Du, H.; Li, J. The impact of short-term nitrogen starvation and replenishment on the nitrate metabolism of hydroponically grown spinach. Sci. Hortic. 2023, 309, 111632. [Google Scholar] [CrossRef]
31. Solomakhin, A.; Blanke, M. Mechanical flower thinning improves the fruit quality of apples. J. Sci. Food Agric. 2010, 90, 735–741. [Google Scholar] [CrossRef]
32. Qian, C.; Chen, Q.; Jiang, L.; Yang, X.; Rao, S.; Zhang, W.; Xu, F. Physiological Mechanism of Exogenous Selenium in Alleviating Mercury Stress on Pakchoi (Brassica campestris L.). Phyton-Int. J. Exp. Bot. 2024, 93, 951–962. [Google Scholar] [CrossRef]
33. Lauria, G.; Lo Piccolo, E.; Ceccanti, C.; Guidi, L.; Bernardi, R.; Araniti, F.; Cotrozzi, L.; Pellegrini, E.; Moriconi, M.; Giordani, T.; et al. Supplemental red LED light promotes plant productivity, “photomodulates” fruit quality and increases Botrytis cinerea tolerance in strawberry. Postharvest Biol. Technol. 2023, 198, 112253. [Google Scholar] [CrossRef]
34. Kozai, T. Resource use efficiency of closed plant production system with artificial light: Concept, estimation and application to plant factory. Proc. Jpn. Acad. Ser. B Phys. Biol. Sci. 2013, 89, 447–461. [Google Scholar] [CrossRef]
35. Son, K.; Jeon, Y.; Oh, M. Application of supplementary white and pulsed light-emitting diodes to lettuce grown in a plant factory with artificial lighting. Hortic. Environ. Biotechnol. 2016, 57, 560–572. [Google Scholar] [CrossRef]
36. Wang, X.; Xu, X.; Cui, J. The importance of blue light for leaf area expansion, development of photosynthetic apparatus, and chloroplast ultrastructure of Cucumis sativus grown under weak light. Photosynthetica 2015, 53, 213–222. [Google Scholar] [CrossRef]
37. Chen, B.; Wan, Z.; Li, S.; Wang, G.; Song, H.; Wang, X. Effects of nitrate supply on plant growth, nitrate accumulation, metabolic nitrate concentration and nitrate reductase activity in three leafy vegetables. Plant Sci. 2004, 167, 635–643. [Google Scholar] [CrossRef]
38. Chen, Y.; Liu, W. Substituting green light for partial red light promoted the growth and quality, and regulated the nitrogen metabolism of Medicago sativa grown under red-blue LEDs. Environ. Exp. Bot. 2024, 220, 105623. [Google Scholar] [CrossRef]
39. Sun, N.; Wei, M.; Li, Y.; Wang, X.; Yang, F.; Shi, Q. Effects of light quality on carbon and nitrogen metabolism and enzyme activities in tomato seedlings. Acta Hortic. Sin. 2016, 43, 80–88. [Google Scholar]
40. Li, J.; Liu, Y.; Wang, J.; Liu, M.; Li, Y.; Zheng, J. Effects of Different LED Spectra on the Antioxidant Capacity and Nitrogen Metabolism of Chinese Cabbage (Brassica rapa L. ssp. Pekinensis). Plants 2024, 13, 2958. [Google Scholar] [CrossRef]
41. Phillips, K.; Tarragó-Trani, M.; Gebhardt, S.; Exler, J.; Patterson, K.; Haytowitz, D.; Holden, J. Stability of Vitamin C in frozen raw fruit and vegetable homogenates. J. Food Compos. Anal. 2010, 23, 253–259. [Google Scholar] [CrossRef]
42. Mastrangelo, D.; Massai, L.; Fioritoni, G.; Lo Coco, F.; Noguera, N.; Testa, U. High Doses of Vitamin C and Leukemia: In Vitro Update. In Myeloid Leukemia; Lasfer, A., Ed.; InTech: London, UK, 2018. [Google Scholar][Green Version]
43. Ntagkas, N.; Woltering, E.; Marcelis, L. Light regulates ascorbate in plants: An integrated view on physiology and biochemistry. Environ. Exp. Bot. 2018, 147, 271–280. [Google Scholar] [CrossRef]
44. Massot, C.; Genard, M.; Stevens, R.; Gautier, H. Fluctuations in sugar content are not determinant in explaining variations in vitamin C in tomato fruit. Plant Physiol. Biochem. 2010, 48, 751–757. [Google Scholar] [CrossRef] [PubMed]
45. Min, Q.; Marcelis, L.; Nicole, C.; Woltering, E. High light intensity applied shortly before harvest improves lettuce nutritional quality and extends the shelf life. Front. Plant Sci. 2021, 12, 615355. [Google Scholar] [CrossRef]
46. Zhou, C.; Li, Z.; Liu, W.; Bian, Z.; Lu, W.; Zhou, B.; Wang, S.; Li, Q.; Yang, Q. High-Proportion Blue Light Irradiation at the End-of-Production Stage Promotes the Biosynthesis and Recycling of Ascorbate in Lettuce. Int. J. Mol. Sci. 2023, 24, 16524. [Google Scholar] [CrossRef]
47. Ma, G.; Zhang, L.; Setiawan, C.K.; Yamawaki, K.; Asai, T.; Nishikawa, F.; Maezawa, S.; Sato, H.; Kanemitsu, N.; Kato, M. Effect of red and blue LED light irradiation on ascorbate content and expression of genes related to ascorbate metabolism in postharvest broccoli. Postharvest Biol. Technol. 2014, 94, 97–103. [Google Scholar] [CrossRef]
48. Li, Z.; Chen, Q.; Xin, Y.; Mei, Z.; Gao, A.; Liu, W.; Yu, L.; Chen, X.; Chen, Z.; Wang, N. Analyses of the photosynthetic characteristics, chloroplast ultrastructure, and transcriptome of apple (Malus domestica) grown under red and blue lights. BMC Plant Biol. 2021, 21, 483. [Google Scholar] [CrossRef]
49. Di, Q.; Li, J.; Du, Y.; Wei, M.; Shi, Q.; Li, Y.; Yang, F. Combination of Red and Blue Lights Improved the Growth and Development of Eggplant (Solanum melongena L.) Seedlings by Regulating Photosynthesis. J. Plant Growth Regul. 2021, 40, 1477–1492. [Google Scholar] [CrossRef]
50. Terashima, I.; Fujita, T.; Inoue, T.; Chow, W.; Oguchi, R. Green Light Drives Leaf Photosynthesis More Efficiently than Red Light in Strong White Light: Revisiting the Enigmatic Question of Why Leaves are Green. Plant Cell Physiol. 2009, 50, 684–697. [Google Scholar] [CrossRef] [PubMed]
51. Li, J.; Wu, T.; Huang, K.; Liu, Y.; Liu, M.; Wang, J. Effect of LED Spectrum on the Quality and Nitrogen Metabolism of Lettuce Under Recycled Hydroponics. Front. Plant Sci. 2021, 12, 678197. [Google Scholar] [CrossRef]
52. Yang, X.; Hu, J.; Wang, Z.; Huang, T.; Xiang, Y.; Zhang, L.; Peng, J.; Tomás-Barberán, F.; Yang, Q. Pre-harvest Nitrogen Limitation and Continuous Lighting Improve the Quality and Flavor of Lettuce (Lactuca sativa L.) under Hydroponic Conditions in Greenhouse. J. Agric. Food Chem. 2023, 71, 710–720. [Google Scholar] [CrossRef] [PubMed]
Zhou C, Zhou K, Hu J, Zhang X, Li Q. Optimization of Light Quality for Plant Factory Production of Brassica campestris (Pakchoi). Agriculture. 2025; 15(3):347. https://doi.org/10.3390/agriculture15030347
Перевод статьи «Optimization of Light Quality for Plant Factory Production ofBrassica campestris(Pakchoi)» авторов Zhou C, Zhou K, Hu J, Zhang X, Li Q., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
Фото: freepik






























































































Комментарии (0)