Исследование меда: натуральный против магазинного — что показывают анализы?
Исследование меда в Ясском уезде раскрывает его экологическую, экономическую и оздоровительную ценность, подчеркивая уникальные свойства, роль в поддержании биоразнообразия и важность для развития устойчивого пчеловодства и региональной идентичности. Целью данного исследования было изучение характеристик меда из уезда Яссы в Румынии на основе анализа 27 образцов, собранных в 2020 и 2021 годах. Образцы включали липовый (8 сырых, 7 коммерческих), акациевый (2 сырых, 2 коммерческих), рапсовый (3 сырых), подсолнечный (3 сырых) и лавандовый
(2 сырых) мед. Анализы проводились в соответствии с румынскими и общеевропейскими стандартами и включали оценку таких параметров, как цвет, электропроводность, влажность, общее содержание растворимых сухих веществ (TSS), кислотность (свободная, лактонная, общая), pH, гидроксиметилфурфурол (HMF), зольность и минеральный состав (Na, K, Ca, Mg, Cu, Zn, Mn и Fe).
Аннотация
Результаты выявили значительные различия между сырым и коммерческим медом. В частности, в коммерческом липовом меде были обнаружены более высокие значения по цвету (38,58 мм Пфунда против 24,14 мм Пфунда), общей кислотности (25,93 мэкв·кг−1 против 17,36 мэкв·кг−1) и уровню HMF (8,84 мг·кг−1 против 3,68 мг·кг−1). Напротив, содержание нерастворимых в воде веществ (0,08% против 0,15%) и зольность (0,21% против 0,30%) в коммерческих образцах были ниже. Калий оказался наиболее распространенным минералом, тогда как уровни меди и цинка были самыми низкими. Были выявлены значимые корреляции между несколькими параметрами, включая корреляцию зольности с электропроводностью и HMF с кислотностью. Данное исследование подчеркивает влияние обработки на качество меда и важность понимания его состава как для потребителей, так и для производителей.
1. Введение
Мед, натуральный продукт, производимый пчелами из цветочного нектара, известен своей пользой для здоровья, питательной ценностью и уникальными вкусовыми качествами. В Румынии мед имеет большое культурное и сельскохозяйственное значение. Разнообразие видов меда, производимых в регионе, отражает не только богатое флористическое биоразнообразие страны, уникальный местный климат и давние пчеловодческие традиции, но и глубокую гармоничную связь между природой и человеком [1,2].
Ботаническое происхождение меда является ключевым фактором, определяющим его уникальные свойства и качество. Для всестороннего понимания его ботанического источника требуется интегрированный подход, сочетающий мелиссопалинологический, сенсорный и физико-химический анализ. В совокупности эти методы дают ясное и надежное понимание происхождения и подлинности меда. Мелиссопалинологический анализ особенно важен, поскольку он идентифицирует типы пыльцы, связанные с географическим и экологическим происхождением меда. Анализ пыльцы с помощью мелиссопалинологии имеет ключевое значение для понимания того, как характеристики меда связаны со специфическим региональным биоразнообразием, где он производится [3,4].
Научный интерес к характеристике и оценке качества меда возрос в связи с необходимостью обеспечения как подлинности, так и пользы для здоровья меда, потребляемого населением. Состав меда варьирует в зависимости от источника нектара, вида пчел, географических форм рельефа, характеристик почвы, потенциальных загрязнителей окружающей среды, методов пчеловодства и способов обработки меда, влияющих на его вкус, цвет и питательные свойства. В результате мед различается по своим физико-химическим свойствам, которые существенно влияют на его качество, чистоту и пригодность для коммерческого использования [2,5,6].
Качество меда оценивается по таким физико-химическим параметрам, как цвет, содержание влаги, удельный вес и общее содержание растворимых сухих веществ, которые являются ключевыми показателями его состава и стандартов производства [7,8,9].
Такие факторы, как свободная кислотность, содержание лактонов, общая кислотность, pH, зольность и электропроводность, необходимы для оценки чистоты, подлинности меда и влияния окружающей среды [10,11,12].
Цвет меда варьирует в зависимости от источника нектара, предоставляя важную информацию о его ботаническом происхождении; избыточное содержание влаги в меде может вызвать брожение, приводя к значительному сокращению срока годности продукта; уровень кислотности влияет на вкус и сохранность меда [13,14,15]. pH влияет на его стабильность и вкусовой профиль, в то время как зольность и электропроводность отражают содержание минералов и используются для дифференциации ботанического происхождения меда; гидроксиметилфурфурол ( HMF ) указывает на качество и свежесть меда [16,17,18].
Минеральные элементы, присутствующие в меде, такие как калий (K), натрий (Na), кальций (Ca), магний (Mg), марганец (Mn), медь (Cu), железо (Fe) и цинк (Zn), существенно способствуют его питательным и оздоровительным свойствам [15,19,20].
Их концентрации, отражающие экологические и географические характеристики региона, находятся под влиянием ботанического источника нектара и состава почвы [21,22]. Кроме того, эти элементы предоставляют ценную информацию об условиях окружающей среды, выступая в качестве биоиндикаторов загрязнения и экологического здоровья [23,24].
Для обеспечения качества и подлинности европейские нормативы устанавливают минимальные пределы содержания пыльцы для характеристики монофлорного меда. Мелиссопалинологический анализ обычно используется для идентификации ботанического происхождения, типов пыльцы и других характеристик образцов меда. Согласно Директиве Совета Европейского союза 2001/110/EC, мед должен соответствовать определенным физико-химическим критериям, чтобы считаться соответствующим; к ним относятся следующие пределы: нерастворимые в воде вещества: ≤0,1% (≤0,5% для прессованного меда); содержание влаги: ≤20%; свободная кислотность: ≤50 мэкв/кг; электропроводность: ≤0,8 мСм/см для цветочных медов (одним из исключений является липовый мед, который может превышать этот порог) [25].
Несмотря на его широкое использование, знание химического состава сырого и коммерческого меда остается ключевым для обеспечения его качества, подлинности и безопасности для потребителей.
Различия в составе между сырым и промышленно обработанным медом, особенно в отношении сохранения или потери питательных веществ, подчеркивают важность проведения тщательного научного анализа. Изменчивость химических свойств дает представление о происхождении меда, процессах производства, а также о его потенциале сохранения во время хранения [26].
Понимание химического состава и физико-химических свойств меда необходимо для поддержания стандартов качества в медовой промышленности. Анализ влажности, цвета, pH, общего содержания растворимых сухих веществ, кислотности, зольности, электропроводности, HMF и минеральных элементов предоставляет ценные данные для оценки качества меда и обеспечения его соответствия как коммерческим, так и нормативным стандартам [27,28]. Эта статья предоставляет всесторонний анализ разнообразия румынского сырого и коммерческого меда, уделяя особое внимание его химическому составу. Оценивая ключевые физико-химические параметры, исследование подчеркивает важность понимания химического состава меда для обеспечения безопасности потребителей и защиты целостности рынка меда. Результаты демонстрируют значительное влияние методов обработки на качество меда, подчеркивая необходимость для как потребителей, так и производителей понимать состав меда, чтобы делать осознанный выбор и сохранять подлинность продукта.
2. Материалы и методы
2.1. Исследуемые образцы меда
Двадцать семь образцов сырого и коммерческого меда Apis mellifera были собраны в жудеце Яссы, северо-восточном регионе Румынии, в 2020 и 2021 годах (Рисунок 1). Набор образцов включал различные виды меда: липовый (Tilia spp.) (T), с 8 образцами сырого меда (T-R) и 7 образцами коммерческого меда (T-C); акациевый (Robinia pseudoacacia) (A), с 2 образцами сырого меда (A-R) и 2 образцами коммерческого меда (A-C); рапсовый (Brassica napus) (R), с 3 образцами сырого меда (R-R); подсолнечный (Helianthus annuus) (SF), с 3 образцами сырого меда (SF-R); и лавандовый (Lavandula spp.) (L), с 2 образцами сырого меда (L-R).
Рисунок 1. Районы сбора в уезде Яссы.
Сырые (R) образцы меда были получены от частных пчеловодов (T1, T3, T4, T5, T6, T9, T12, T15, A17, A19, R20, R21, R22, SF23, SF24, SF25, L26, L27). Все коммерческие (C) образцы меда были приобретены в магазинах Ясс (T2, T7, T8, T10, T11, T13, T14, A16, A18). В Таблице 1 представлен список кодов образцов, мест сбора и соответствующих годов сбора.
Таблица 1. Идентификационный код образцов, места сбора и соответствующие годы сбора.
2.2. Мелиссопалинологический анализ
Ботаническое происхождение 27 исследованных монофлорных образцов меда было идентифицировано с помощью мелиссопалинологического метода, предложенного Louvreaux et al. (1978) [29], с некоторыми модификациями процесса растворения образца и этапа центрифугирования (оптимизация времени и скорости) для улучшения отделения пыльцы. Десять граммов образца растворяли в 20 мл дистиллированной воды при 40–45 °C и тщательно перемешивали для растворения кристаллов сахара. Раствор дважды центрифугировали при 3500 об/мин в течение 30 мин. Надосадочную жидкость удаляли, к осадку добавляли раствор 5‰ серной кислоты (Merck KGaA, Дармштадт, Германия), а затем дважды центрифугировали при том же времени и скорости с использованием центрифуги UNIVERSAL 320 HETTICH (Hettich GMBH, Туттлинген, Германия). Осадок переносили на предметное стекло в двух каплях, накрывали покровным стеклом и исследовали путем подсчета не менее 800 пыльцевых зерен с использованием оптического микроскопа (Optika, Италия) с объективами 40× и 100× [30,31].
2.3. Значение Пфунда и цвет
Значение мм Пфунда образцов меда измеряли спектрофотометрически с использованием прибора Shimadzu UV-1700 Pharma Spec (производитель: Shimadzu Corporation, Analytical Instruments Division, Киото, Япония). 50%-ный водный раствор меда центрифугировали при 3200 об/мин в течение 5 мин на центрифуге UNIVERSAL 320 HETTICH (Hettich GMBH, Туттлинген, Германия) и измеряли при длине волны 635 нм. Значения поглощения преобразовывали в мм Пфунда по формуле [17]:
где Pfund = значение цвета меда по шкале Pfund [мм]; Abs = значение поглощения, измеренное при 635 нм
2.4. Нерастворимые в воде вещества (WIS)
Десять граммов образца меда взвешивали на аналитических весах PI-214 DENVER (Denver Instrument GMBH, Гёттинген, Германия), растворяли в дистиллированной воде, фильтровали через предварительно взвешенную фильтровальную бумагу и промывали несколько раз. Образец затем сушили в сушильном шкафу ESAC 100 при 105 °C (SC Electronic April Aparatura Electronica Speciala S.R.L, Клуж-Напока, Румыния). Содержание нерастворимых в воде веществ (WIS) рассчитывали путем вычитания веса фильтровальной бумаги из веса фильтровальной бумаги с нерастворимыми веществами, результат выражали в процентах [31].
2.5. Влажность (M), Общее содержание растворимых сухих веществ (TSS), Удельный вес (SG)
Содержание влаги (M) в меде определяли с помощью измерений показателя преломления (RI) с использованием рефрактометра ABBÉ Kruss AR 2008 (Kruss Scientific GMBH, Гамбург, Германия). Образцы меда осторожно нагревали до температуры около 45 °C, чтобы обеспечить растворение всех кристаллов. Температуру образцов меда устанавливали с помощью датчика температуры Heidolph EKT Hei-Con (Heidolph Scientific Products GmbH, Швабах, Германия), и показатель преломления корректировали, добавляя 0,00023 на каждый градус Цельсия выше 20 °C. Зная скорректированный показатель преломления, содержание влаги определяли с использованием таблицы преобразования IR-M, выраженное в процентах [31].
Общее содержание растворимых сухих веществ (TSS), которое представляет собой общее содержание растворимых сахаров, выраженное в градусах Брикса (1 °Брикс соответствует 1% сахара при 20 °C), определяли с использованием таблицы преобразования показателя преломления в градусы Брикса при 20 °C [32].
Удельный вес определяли гравиметрическим методом с использованием пикнометра, полученные значения указывали в г/см³ [33].
2.6. pH, Свободная кислотность (FA), Лактонная кислотность (LA) и Общая кислотность (TA)
Значения pH растворов меда измеряли путем растворения 10 г образца в 75 мл дистиллированной воды. Измерения проводили с использованием мультипараметрического прибора MULTI 3320 (WTW GMBH, Вайльхайм, Германия) [33]. Для оценки свободной кислотности растворы меда титровали раствором NaOH 0,05 Н (Chemical Company, Румыния) до pH 8,5. Лактонную кислотность определяли путем немедленного добавления 10 мл NaOH 0,05 Н и титрования раствором HCl 0,05 Н (Merck KGaA, Дармштадт, Германия) до значения pH 8,3. Общую кислотность образцов меда рассчитывали путем суммирования значений свободной и лактонной кислотности, с результатами, выраженными в мэкв·кг⁻¹ [34].
2.7. Зола и Электропроводность (EC)
Содержание золы в меде определяли в два этапа: сжигание и прокаливание в печи (Nabertherm B180, Nabertherm GMBH, Лилиенталь, Германия); содержание золы выражали в г/100 г [31].
Электропроводность измеряли с помощью мультипараметрического прибора MULTI 3320 (WTW GMBH, Вайльхайм, Германия) в 20%-ном растворе образца (на основе сухого веса), приготовленном с использованием ультрачистой воды (Barnstead EASY PURE II, Thermo Fisher Scientific Co. Ltd., Айова-Сити, США). Результат указывали в мСм·см⁻¹ [33].
2.8. Гидроксиметилфурфурол (HMF)
Для количественного определения содержания гидроксиметилфурфурола ( HMF ) в меде использовали спектрофотометрический метод, описанный Уайтом. Пять граммов меда растворяли в 25 мл дистиллированной воды и переносили в мерную колбу на 50 мл. К медовому раствору добавляли по 0,5 мл каждого из растворов Карреза I и Карреза II (Merck KGaA, Дармштадт, Германия), и доводили конечный объем до 50 мл дистиллированной водой. Полученный раствор фильтровали через фильтровальную бумагу. Первые 10 мл фильтрата удаляли, а следующие 5 мл каждой аликвоты фильтрованного раствора переносили в две отдельные пробирки. Раствор образца готовили, добавляя дистиллированную воду до метки в одну пробирку, а контрольный раствор готовили, добавляя 5 мл 0,2%-ного раствора бисульфита натрия (Acros Organics, Геел, Бельгия) в другую пробирку. Спектрофотометр Shimadzu UV-1700 Pharma Spec (Shimadzu Corporation, Analytical Instruments Division, Киото, Япония) использовали для измерения поглощения обоих растворов при 284 нм и 336 нм. Затем концентрацию HMF в образцах меда рассчитывали по определенной формуле и выражали в мг·кг⁻¹ [35].
2.9. Минеральные элементы
Для анализа образцы меда растворяли в деионизированной воде, полученной с помощью Milli-Q Integral Ultrapure Water-Type 1 при 18,2 МОм·см⁻¹ (Merck, Дармштадт, Германия) при 65 °C. Полученные растворы затем минерализовали (система для микроволнового разложения Milestone START D (Соризоле, Италия). Все реактивы и химикаты аналитической степени чистоты были получены из признанных источников (Merck и Sigma Aldrich, Дармштадт, Германия) для обеспечения точности и надежности. Калибровочные кривые строили с использованием высокочистого ICP многоэлементного стандартного раствора (Merck, Дармштадт, Германия).
Концентрации минеральных элементов в образцах меда определяли методом масс-спектрометрии с индуктивно связанной плазмой (ICP-MS) (iCAP Q ICP-MS, Thermo Fisher Scientific, Уолтем, США). Стандартные растворы для калибровки готовили путем разбавления из ICP многоэлементного стандартного раствора (Merck, Дармштадт, Германия).
Все операции, этапы и процедуры определения элементов проводились в соответствии с описанными Bora et al. (2024), включая условия экстракции, инструментальный анализ (калибровку и рабочие параметры), меры контроля качества и параметры аналитической производительности [19].
2.10. Статистический анализ
Результаты были статистически обработаны с использованием программного пакета STATISTICA 12.0 (StatSoft Inc., Гамбург, Германия). Коэффициент корреляции Пирсона использовали для проверки возможных значимых корреляций между исследуемыми параметрами. Факторный анализ (FA, Varimax-нормализованный) применяли для получения дополнительной информации о вкладах исследуемых параметров.
3. Результаты
3.1. Мелиссопалинологический анализ
Мелиссопалинологический анализ подтвердил ботаническое происхождение всех изученных образцов, как образцов меда, указанных пчеловодами, так и образцов меда, собранных в магазинах.
Все образцы меда были классифицированы как монофлорные на основе преобладающего наблюдаемого типа пыльцы. Наиболее распространенные семейства растений, обнаруженные в исследованных образцах меда, представлены на Рисунке 2.
Рисунок 2. Распределение наиболее распространенных семейств растений, идентифицированных в исследуемых образцах меда.
Согласно спектру этих зерен, наличие типов пыльцы от различных видов растений в меде способствует его уникальным свойствам. Основные типы пыльцы видов растений, обнаруженные в образцах меда, перечислены в Таблице 2.
Таблица 2. Основные типы пыльцы видов растений, обнаруженные в образцах меда.
3.2. Значение Пфунда, Цвет, Нерастворимые в воде вещества (WIS), Влажность (M), Общее содержание растворимых сухих веществ (TSS) и Удельный вес (SG)
В Таблице 3 представлены результаты анализа монофлорных образцов меда с детализацией ключевых параметров, таких как нерастворимые в воде вещества (WIS), влажность (M), общее содержание растворимых сухих веществ (TSS) и удельный вес (SG).
Таблица 3. Результаты анализа монофлорных образцов меда, включая мм Пфунда (цвет), нерастворимые в воде вещества (WIS), влажность (M), общее содержание растворимых сухих веществ (TSS) и удельный вес (SG).
3.3. pH, Свободная кислотность (FA), Лактонная кислотность (LA), Общая кислотность (TA), Зола, Электропроводность (EC) и Гидроксиметилфурфурол (HMF)
В Таблице 4 представлены результаты важных физико-химических параметров — pH, свободной кислотности (FA), лактонной кислотности (LA), общей кислотности (TA), золы, электропроводности (EC) и гидроксиметилфурфурола (HMF) — проанализированных в пяти типах меда.
Таблица 4. Результаты анализа монофлорных образцов меда, включая pH, свободную кислотность (FA), лактонную кислотность (LA), общую кислотность (TA), золу, электропроводность (EC) и гидроксиметилфурфурол (HMF).
3.4. Минеральные элементы (Na, K, Ca, Mg, Cu, Zn, Mn и Fe)
В Таблице 5 представлено содержание восьми минеральных элементов (Na, K, Ca, Mg, Cu, Zn, Mn и Fe), определенных в пяти типах исследованных образцов меда: липовом, акациевом, рапсовом, подсолнечном и лавандовом.
Таблица 5. Результаты анализа минеральных элементов (Na, K, Ca, Mg, Cu, Zn, Mn и Fe) в монофлорных образцах меда.
3.5. Корреляционный и многомерный статистический анализ
Коэффициенты корреляции Пирсона, обычно используемые для измерения степени связи между конкретными наборами данных, были рассчитаны для определения корреляций между анализируемыми параметрами сырых образцов липового меда, полученных напрямую от пчеловодов (Таблица 6).
Таблица 6. Коэффициенты Пирсона для корреляции между параметрами сырого липового меда (значимые при p < 0,05 (), p < 0,01 (), p < 0,001 ()).
Корреляции, выявленные между изученными физическими и химическими параметрами, специфичными для коммерческих образцов липового меда, представлены в Таблице 7. В Таблице 8 представлены результаты теста ANOVA, который был проведен для оценки различий между сырыми и коммерческими образцами меда.
Таблица 7. Коэффициенты Пирсона для корреляции между параметрами коммерческого липового меда (значимые при p < 0,05 (), p < 0,01 (), p < 0,001 ()).
Таблица 8. Тест ANOVA для различий между сырым и коммерческим медом (значимые при: p < 0,05 (), p < 0,01 (); нз — не значимо).
В Таблице 9 коэффициенты корреляции Пирсона рассчитаны для определения взаимосвязей между параметрами пяти изученных типов меда.
Таблица 9. Коэффициенты Пирсона для корреляции между параметрами меда (значимые при p < 0,05 (), p < 0,01 (), p < 0,001 ()).
В Таблице 10 и Таблице 11 обобщены результаты факторного анализа (FA): в Таблице 10 представлены факторные нагрузки (Varimax-нормализованные) и объясненная дисперсия (%) для извлеченных главных компонент, где выделенные нагрузки превышают 0,700, а в Таблице 11 приведены факторные оценки (Varimax-нормализованные) для извлеченных факторов.
Таблица 10. Факторные нагрузки (Varimax-нормализованные) и объясненная дисперсия (%) для извлеченных главных компонент (выделенные нагрузки >0,700).
Таблица 11. Факторные оценки (Varimax-нормализованные) для извлеченных факторов.
4. Обсуждение
4.1. Мелиссопалинологический анализ
Мед, производимый Apis mellifera L., часто отражает ботанические источники, из которых преимущественно собирают нектар и пыльцу, что приводит к появлению различных типов монофлорного меда. Каждый тип характеризуется уникальными ароматическими и вкусовыми профилями, а также специфическими пыльцевыми сигнатурами, как описано Louveaux et al. (1978) [29]. Для определения монофлорного меда были стандартизированы международные пороги минимального содержания пыльцы, гарантируя, что эти меды сохраняют свои отличительные физические, химические и терапевтические свойства.
Мелиссопалинологический анализ классифицирует частоты пыльцы по четырем классам для точной идентификации ботанического происхождения меда: преобладающая пыльца (PP) > 45%, вторичная пыльца (SP) 16–45%, важная второстепенная пыльца (IMP) 3–15% и второстепенная пыльца (MP) < 3% [10,36].
Минимальный процент пыльцы, требуемый для классификации монофлорных медов, различается среди европейских стран: акациевый мед (Robinia pseudoacacia) (Италия — 15%, Германия, Хорватия и Сербия — 20%, Румыния — 25%); липовый (Tilia spp.) (Германия — 20%, Хорватия и Сербия — 25%, Румыния — 30%); подсолнечный (Helianthus annuus) (Румыния — 40%, Греция — 20%, Германия — 50%, Сербия — 40%); рапсовый (Brassica napus) (Хорватия — 60%, Германия — 80%); лавандовый (Lavandula spp.) (Германия — 15%, Хорватия — 10%, Сербия — 25%, Румыния — 30%) [37,38,39]. В Латвии минимальные проценты пыльцы, необходимые для классификации монофлорных медов, составляют 70% для рапсового (Brassica napus), 17% для липового (Tilia spp.) и 17% для лавандового (Lavandula spp.). Для других монофлорных медов требуется не менее 45% пыльцы от одного и того же вида растений, в соответствии с национальным законодательством [40].
Мелиссопалинологический анализ, проведенный на 27 образцах меда, подтвердил их монофлорное происхождение и выявил наличие широкого спектра видов растений. Исследование не только подтвердило основной цветочный источник, но и подчеркнуло вклад вторичной пыльцы, предлагая более глубокое понимание ботанического разнообразия в пределах кормовых территорий пчел. Кроме того, результаты соответствуют требованиям румынского законодательства и аналогичных международных нормативов, обеспечивая подлинность и точность маркировки монофлорного меда [38]. Рисунок 2 иллюстрирует распределение наиболее распространенных семейств растений, идентифицированных в проанализированных образцах меда, предоставляя обзор доминирующих ботанических источников. Различные пыльцевые семейства были идентифицированы в образцах меда: Apiaceae в 24 образцах (<1–5%), Asteraceae во всех образцах (2–75%), Boraginaceae в 10 образцах (<1–11%), Brassicaceae в 25 образцах (2–74%), Cyperaceae в 7 образцах (<1–2%), Fabaceae в 27 образцах (4–43%), Fagaceae в 14 образцах (<1–10%), Lamiaceae в 26 образцах (<1–42%), Malvaceae в 21 образце (<1–70%), Plantaginaceae в 12 образцах (<1–3%), Poaceae в 18 образцах (<1–6%), Rosaceae в 22 образцах (<1–16%) и Salicaceae в 23 образцах (<1–7%) (Таблица 2).
Преобладающая пыльца Tilia spp. была обнаружена в пределах от 49% до 70% в сырых образцах липового меда и от 45% до 66% в коммерческих образцах липового меда, жудец Яссы известен как Липовый жудец из-за липовых лесов. В коммерческих образцах акациевого меда преобладающая пыльца (Robinia pseudoacacia) составляла 35% и 37%, что ниже по сравнению с процентами, обнаруженными в сырых образцах акациевого меда, 42% и 43%. Все образцы акациевого меда имели минимальный требуемый процент пыльцы для классификации монофлорных медов. Brassica napus была доминирующей пыльцой во всех образцах рапсового меда (70–74%). Количество Asteraceae (Helianthus annuus) в подсолнечном меде находилось в диапазоне 69–75%. В двух образцах лавандового меда самый высокий процент пыльцы был из семейства Lamiaceae (Lavandula spp.) — 39% и 42% соответственно — оба ниже установленного порога в 45%. Некоторые меды все еще считаются монофлорным лавандовым медом, потому что некоторые виды растений, такие как Lavandula spp., Citrus spp., Rosmarinus officinalis и Arbutus unedo, известны тем, что недостаточно представлены в меде, даже когда они являются доминирующими источниками нектара. Лавандовый мед (Lavandula spp.) может быть классифицирован как монофлорный даже при содержании пыльцы всего 15% из-за его уникальных цветочных характеристик [21].
Лавандовый и липовый мед демонстрируют значительную вариацию в составе пыльцы в различных регионах из-за факторов окружающей среды и флористического разнообразия. В Португалии изучали лавандовый мед: Estevinho et al. (2016) сообщили об уровнях пыльцы Lavandula spp. в диапазоне от 33,17% до 36,27%, а Anjos et al. (2021) обнаружили диапазон от 15% до 59% пыльцы, отражающий изменчивость в различных регионах [41,42]. В Турции лавандовый мед из региона Испарта показал еще большую вариацию в содержании пыльцы, от 4% до 76%. Конкретные исследования обнаружили уровни от 46% до 53% [7], 41,85% [43] и от 4% до 8% в исследуемых образцах [44].
Липовый мед также демонстрирует региональные различия в составе пыльцы. В Турции уровни пыльцы обычно варьируют от 45% до 47%, хотя монофлорная классификация возможна даже при более низких уровнях. Например, Silici and Ülgen (2019) обнаружили, что липовый мед является монофлорным при уровнях пыльцы 41,43% [43]. В Польше липовый мед показывает концентрации пыльцы от 20,4% до 41,4%, находясь под влиянием регионального флористического разнообразия [12]. В Венгрии липовый мед содержит 45,89% пыльцы Tilia spp., что ближе к более высоким порогам для монофлорной классификации [45], но в Чешской Республике было значительно более низкое содержание пыльцы — 22,8% [46]. По сравнению с другими исследованиями, проценты пыльцы для липовых медов в некоторых регионах ниже, чем в наших проанализированных образцах.
Робиниевый мед, также известный как акациевый мед, демонстрирует вариабельность в уровнях пыльцы в различных регионах. В Турции уровни пыльцы находились в диапазоне от 45% до 54% [7]. В Венгрии пыльца Robinia pseudoacacia составляла 45,27% в акациевом меде [45]. Однако более низкие уровни наблюдались в Чешской Республике, со средним содержанием пыльцы всего 12,7% [46]. Другие типы меда также показывают заметные различия в составе пыльцы. В Венгрии подсолнечный мед содержал 47,44% пыльцы Helianthus annuus [45], что ниже содержания, полученного в наших образцах. Рапсовый мед из Чешской Республики имел значительно более высокое содержание пыльцы, в среднем 79,5% [46], а Brassica napus в исследованных польских рапсовых медах варьировала от 47,6% до 94,3% [47].
Точная идентификация ботанического происхождения меда ключевая для контроля качества и рыночной аутентификации. В образцах монофлорного меда перепредставленные типы пыльцы, такие как Brassica napus (>60%), контрастируют с недостаточно представленными типами, такими как Tilia spp. (1–56%), Robinia sp. (7–60%) и Lavandula spp. (1–42%) [48]. Анализ пыльцы в сочетании с сенсорной оценкой, физико-химическим анализом и количественным определением растительных соединений обеспечивает точную классификацию меда. Этот процесс также связывает цветочный состав меда с его питательной ценностью и потенциальной терапевтической пользой [30]. Мелиссопалинологический анализ необходим для классификации образцов меда в соответствии с их ботаническим происхождением, поскольку он предоставляет прямой метод идентификации видов растений, ответственных за отложение пыльцы в меде. Этот анализ особенно ценен для различения монофлорных медов, таких как липовый, рапсовый, акациевый, подсолнечный и лавандовый. Кроме того, мелиссопалинологические данные в сочетании с другими параметрами, такими как цвет, HMF и минеральный состав, также могут предоставить информацию о географическом происхождении меда. Коррелируя пыльцевые профили с региональной флорой, можно отследить происхождение меда до конкретных географических районов.
4.2. Значение Пфунда и цвет
Цвет значительно влияет на восприятие качества меда. Некоторые люди предпочитают светлый мед, другие — темный. Эти предпочтения могут иметь существенное влияние на цену продукта, иногда перевешивая важность его состава и терапевтического качества [5]. Изменчивость цвета меда находится под влиянием факторов, включая фенольные соединения, каротиноиды, сахара, минералы, пыльцу, содержание воды, цветочный источник, географическое происхождение и условия обработки [2,49].
В нашем исследовании цвет сырого липового меда варьировал от 4,25 до 39,17 мм Пфунда, в то время как коммерческий мед демонстрировал более темный диапазон от 12,94 до 55,48 мм Пфунда (Таблица 3). Это повышенное потемнение в коммерческом меде может быть связано не только с климатическими, географическими или флористическими факторами, но также может находиться под влиянием нагрева во время обработки, технологических этапов или длительных сроков хранения.
Цветочное происхождение липы и специфические условия обработки способствуют более темному цвету, наблюдаемому в некоторых регионах, в результате чего цвета липового меда охватывают почти всю шкалу Пфунда. Другие исследования в Румынии сообщали о диапазонах цвета 23,1–41,8 мм Пфунда [2,10,49]. В Республике Молдова были зафиксированы аналогичные значения 22,00–38,00 мм Пфунда [14], что согласуется с нашими выводами. Примечательно, что липовый мед из Венгрии выделяется своим более темным цветом, с широким диапазоном 38,27–139,48 мм Пфунда, приближающимся к верхнему пределу шкалы Пфунда [50].
Цвет акациевого меда широко варьирует в зависимости от региона и времени сбора, часто измеряемого в значениях шкалы Пфунда. В Румынии это исследование обнаружило сырые образцы со значениями менее 0,1 мм Пфунда (от <0,1 до 0,14 мм Пфунда) и коммерческий мед в диапазоне от −0,77 до 0,01 мм Пфунда. Другие исследования в Румынии сообщали о таких значениях, как 0,1–0,2 мм Пфунда [2], 12,84 мм Пфунда [10] и 11,00–45,00 мм Пфунда [49].
Исследования акациевого меда, проведенные в других странах, показали большую вариацию цвета, а именно: в Венгрии Bodor et al. наблюдали исключительно светлые значения −7,26 мм Пфунда, выходящие за пределы типичного диапазона Пфунда, до 20,92 мм Пфунда [50]; в Сербии Srećković et al. сообщили о средних значениях −4,30 ± 3,70 мм Пфунда [51]. В Польше исследования показали диапазон 0,1–49,8 мм Пфунда [48] и −5,7 мм Пфунда [52]. В Чешской Республике Pospiech et al. (2021) обнаружили более темный акациевый мед со значением Пфунда 47,4 мм [46], а в Хорватии Flanjak et al. (2016) сообщили о диапазоне 1,00–8,00 мм Пфунда [9]. Эти различия в цвете отражают региональные и технологические вариации акациевого меда.
В нашем исследовании цвет рапсового меда варьировал от 48,09 до 59,25 мм Пфунда. В Румынии предыдущие исследования сообщали о значениях от 45,2 до 73,7 мм Пфунда [2]. Pauliuc et al. (2022) наблюдали более низкое значение 36,14 мм Пфунда [10], а в своем исследовании Ratiu et al. (2020) отметили более высокое значение рапсового меда 94,13 мм Пфунда [17].
В различных исследованиях из европейских стран диапазон цвета рапсового меда сообщался от 2,08 мм Пфунда до 138,56 мм Пфунда. В Чешской Республике Pospiech et al. (2021) зафиксировали значение 73,3 мм Пфунда [46]. Исследование из Польши обнаружило диапазон от 33,8 мм до 114,07 мм Пфунда [17,48,52]. Рапсовый мед, собранный в Венгрии, характеризовался широким диапазоном изменения цвета от 2,08 мм до 138,56 мм Пфунда [50].
Подсолнечный мед варьирует по цвету от бело-желтого до светло-янтарного, находясь под влиянием его происхождения, сорта подсолнечника и методов обработки. В нашем исследовании румынский подсолнечный мед показал диапазон цвета 11,64–13,07 мм Пфунда, другие находки сообщали 15,5–53,9 мм Пфунда [2], 33,66 мм Пфунда [10] и 79,00–83,00 мм Пфунда [49]. В Республике Молдова Chirsanova et al. (2021) — диапазон 39,00–41,00 мм Пфунда [14]. Венгерский подсолнечный мед демонстрировал гораздо более высокие значения, от 96,3 мм Пфунда до 198,91 мм Пфунда, превышая типичную шкалу Пфунда [50]. Образцы польского подсолнечного меда варьировали от 62,07 до 114,44 мм Пфунда [17]; португальский подсолнечный мед был темнее, со значением 97,60 мм Пфунда [53]; в Испании диапазон цвета подсолнечного меда составлял 38–72 мм Пфунда [54]. Эти вариации подчеркивают влияние географического происхождения и местных факторов на цвет подсолнечного меда.
Цвет образцов лавандового меда варьировал от 16,08 до 17,39 мм Пфунда. В Румынии Pauliuc et al. (2022) сообщили о более темном значении 63,86 мм Пфунда [10]. Другие исследования выделяют значительные вариации цвета лавандового меда в различных регионах. В Турции цвет варьировал от 25 мм Пфунда до 35 мм Пфунда [55]. Португальский лавандовый мед показал значения от 39,4 мм Пфунда до 49,4 мм Пфунда [53], в то время как марокканские образцы демонстрировали гораздо более широкий диапазон, от 71 мм Пфунда до 150 мм Пфунда [56]. В Испании цвет лавандового меда, как сообщалось, варьировал от 6 мм Пфунда до 91 мм Пфунда [54] и от 24,21 мм Пфунда до 61,48 мм Пфунда [8]. Напротив, более темные образцы наблюдались в исследовании Puścion-Jakubik et al. (2022) со значениями от 92,2 мм Пфунда до 187,6 мм Пфунда [48].
Изменчивость цвета меда в первую очередь определяется такими факторами, как цветочный источник, фенольные соединения, каротиноиды, сахара, минералы, время сбора и условия обработки. Каждый тип меда демонстрирует уникальные цветовые профили, сформированные этими влияниями [1,50].
4.3. Нерастворимые в воде вещества (WIS), Влажность (M), Общее содержание растворимых сухих веществ (TSS), Удельный вес (SG)
Нерастворимые в воде вещества (WIS) в меде состоят из различных примесей, таких как части тела пчел, остатки растений, пыльцевые зерна, фрагменты воска, даже частицы пыли [57]. Все эти примеси могут влиять на прозрачность меда, параметр, ценимый потребителями. Согласно установленным стандартам качества меда, допустимое содержание WIS ограничено 0,1% для коммерческого меда и до 0,5% для прессованного меда [25,38]. В данном случае содержание нерастворимых в воде веществ (WIS) в образцах меда варьировало в зависимости от различных цветочных источников и уровней обработки. Для сырого меда содержание WIS варьировало от 0,073 до 0,193% в липовом меде, от 0,123 до 0,153% в рапсовом меде, от 0,150 до 0,233% в подсолнечном меде и от 0,143 до 0,160% в лавандовом меде. В сыром акациевом меде мы получили более низкие значения WIS, от 0,043% до 0,060%. Для коммерческого меда содержание WIS варьировало от 0,043 до 0,113% в липовом меде и 0,087–0,103% в акациевом меде. При сравнении сырого и коммерческого, образцы сырого меда обычно содержали более высокие значения WIS, чем образцы коммерческого меда. В этом исследовании коммерческие образцы акациевого меда содержали более высокие значения WIS — 0,103%, чем сырые образцы акациевого меда. Согласно установленному качественному законодательству, все сырые образцы меда оставались в пределах законного предела для необработанного меда, определенные коммерческие образцы меда, такие как липовый и акациевый, иногда приближались или незначительно превышали порог в 0,1%. Исследования, проведенные на образцах цветочного меда с рынка Чешской Республики, показали содержание нерастворимых в воде веществ ниже 0,1% (0,002–0,070%) [58].
Процессы, через которые проходит мед для соответствия коммерческим стандартам, могут влиять на его качество как положительно, так и отрицательно. Например, процесс фильтрации, используемый для осветления меда, может положительно влиять на его прозрачность и срок годности, но также может отрицательно влиять на его питательные и терапевтические свойства, удаляя полезные компоненты, такие как пыльца [59].
Содержание влаги в меде является критическим параметром, влияющим на его качество, стабильность и срок годности. Увеличение содержания воды в меде может инициировать брожение, приводя к деградации продукта. Этот процесс не только ставит под угрозу качество меда, но также приводит к нежелательным изменениям его сенсорных, питательных и физико-химических свойств [60].
В этом исследовании содержание влаги в липовом меде варьировало от 16,8% до 19,7%, со слегка более высоким значением, наблюдаемым в коммерческом меде по сравнению с сырым медом, что соответствует максимально допустимому пределу в 20%, установленному законодательством о качестве меда (Таблица 3). Сравнения с данными других исследований выявляют вариации в зависимости от географических и климатических условий; таким образом, в Румынии содержание влаги в липовом меде варьирует от 14,50% до 18,80% [23,61,62]. Более низкие значения содержания влаги 14,62% и 16,75% были зафиксированы в исследованиях, проведенных Vijan et al. (2023) и Pauliuc et al. (2022), соответственно [10,63]. В Республике Молдова значения были слегка выше, в диапазоне от 18,70% до 19,89% [14]. Исследования в Сербии сообщали об уровнях влажности от 15,9 до 17,3% [64], от 16,00 до 19,09% [18] и от 15,8 до 17,1% [11]. В Польше сообщенные значения составили 15,9–19,0% [12] и 19,05–20,50% [26]. Исследование из Турции указало на содержание влаги 19,80% [7], в то время как в Чешской Республике оно составляло 16,2% [46]; в Хорватии содержание влаги в липовом меде варьировало от 15,9 до 20,0% [9]. Важно, что все измеренные значения в нашем исследовании соответствуют законодательному порогу в 20%, обеспечивая качество и безопасность проанализированного липового меда.
Содержание влаги в акациевом меде варьировало от 18,2% до 20,0%, максимальное значение зарегистрировано у коммерческого меда, что соответствует максимальному пределу, установленному законодательством о качестве меда (Таблица 3).
В Румынии содержание влаги в акациевом меде варьирует от 15,40% до 18,60% [61,62], в то время как другие исследования сообщали о более высоких значениях, до 22,8% [23], превышающих максимальный предел, установленный законодательством. Более низкие значения содержания влаги 15,96% и 14,36% были зафиксированы в исследованиях, проведенных Vijan et al. (2023) и Pauliuc et al. (2022), соответственно [10,63].
Исследования из таких стран, как Сербия (13,63–19,01%) [11,18,64], Чешская Республика, Хорватия и Германия (14,6–19,9%) [9,46,65], показывают, что содержание влаги в акациевом меде обычно ниже предела в 20%, что указывает на стабильное соответствие стандартам качества в этих регионах. Can et al. (2015) сообщили о значении содержания влаги для турецкого меда, превышающем 20,80%, что выходит за пределы максимального предела, установленного законодательством [7].
Содержание влаги в рапсовом меде в этом исследовании варьировало от 17,5% до 19,9% (Таблица 3). Все исследования, проведенные в Румынии [10,61,63], а также в других европейских странах, сообщали о значениях содержания влаги ниже предела в 20%, в диапазоне от 14,41% до 19,89% [11,46,64].
Образцы подсолнечного меда, проанализированные в этом исследовании, демонстрировали уровни влажности, близкие к законодательному пределу в 20%, от 19,6% до 19,9%. Содержание влаги в образцах меда, проанализированных в различных европейских странах, обычно варьировало от 14,6% до 19,3%, за исключением рапсового меда из Испании, который зафиксировал максимальное значение 21,2% [11,53,54,64].
Для лавандового меда содержание влаги находилось в диапазоне от 18,2% до 19,3%, значения, обеспечивающие долгосрочное качество (Таблица 3). Исследования, проведенные на меде из Сербии, Испании, Португалии и Марокко, получили значения от 14,53% до 19,40% [8,11,53,56]; в Саудовской Аравии и Турции значения содержания влаги в лавандовом меде были обнаружены от 15,5% до 17,17% [44,55,65].
Значения, превышающие максимальный предел, установленный законодательством, которые могут привести к неблагоприятным эффектам на продукт, были зафиксированы на уровне 20,80% и 25,2%; эти значения были сообщены Can et al. для лавандового меда из Турции и Juan-Borrás et al. (2015) для лавандового меда из Испании [7,54].
Обычно общее содержание растворимых сухих веществ (большинство из них состоит из сахара) составляет 80% или выше. Согласно Nyau and Mwanza (2013), мед выше 80 °Брикс (<20% воды) является качественным и более стабильным во время хранения, поскольку влажность снижается с увеличением общего содержания растворимых сухих веществ [32]. Эта классификация особенно связана с дополнительной гарантией содержания воды (TSS обратно связано с водой и с безопасностью во время хранения в течение более длительного периода). Исследование меда в этом исследовании обнаружило TSS в диапазоне от 78,6% в подсолнечном меде до 81,7% в сыром липовом меде (Таблица 3).
Удельный вес меда обратно пропорционален его влажности: чем плотнее мед, тем меньше влаги он содержит. Он также обычно обратно связан с общим содержанием сахаров (особенно глюкозы и фруктозы) и общим содержанием сухих веществ. По мере увеличения концентрации сахара удельный вес имеет тенденцию увеличиваться. Таким же образом, удельный вес может находиться под влиянием содержания минералов и примесей, причем более высокие уровни этих компонентов обычно приводят к более высокому удельному весу.
Этот параметр важен для определения, является ли мед фальсифицированным, и имеет практическое значение для контроля запасов меда. Минимальное среднее значение удельного веса 1,418 г/см³ было найдено в образцах подсолнечного меда, а максимальное среднее значение 1,429 г/см³ — в образцах сырого липового меда (Таблица 3).
4.4. pH, Свободная кислотность (FA), Лактонная кислотность (LA) и Общая кислотность (TA)
Обычно pH меда находится между 3,5 и 5,5. Между 3,9 и 5,8 были средние значения pH проанализированных образцов меда (Таблица 4). Концентрация органических кислот снижает pH меда, придавая ему кислотный характер. Результаты в том же диапазоне были найдены другими исследователями; например, значение pH румынского меда, как сообщалось, варьирует от 3,65 до 5,36 [2,10,23,62,63,66].
Свободная кислотность меда относится к его естественным органическим кислотам, которые влияют на pH и вкус, в то время как лактонная кислотность представляет собой связанные кислоты, которые могут высвобождать больше кислоты при гидролизе. Общая кислотность представляет собой сумму обоих и отражает общую кислотность меда. Поскольку высокая кислотность может указывать на брожение или порчу, эти параметры важны для оценки свежести, качества и безопасности меда [1,62,66]. Для предотвращения процессов деградации в меде европейское законодательство имеет максимальную рекомендацию для свободной кислотности в 50 мэкв·кг⁻¹ [25].
Анализ 27 протестированных образцов меда показал, что значения свободной кислотности находятся ниже максимально рекомендованного предела в 50 мэкв·кг⁻¹: образцы сырого липового меда (5,1–19,6 мэкв·кг⁻¹) имели более низкую кислотность, чем образцы коммерческого липового меда (12,7–25,0 мэкв·кг⁻¹), вероятно, из-за обработки, в частности, нагрева (пастеризации), который может увеличить кислотность меда, разлагая сахара на органические кислоты, а также длительный нагрев или неправильное хранение дальнейшим образом ускоряют образование кислоты. Акациевый мед, с сырым (10,2–10,6 мэкв·кг⁻¹) немного выше, чем коммерческий (6,4–7,9 мэкв·кг⁻¹), является наименее кислым и наиболее стабильным. Рапсовый мед имеет умеренную кислотность (8,3–14,4 мэкв·кг⁻¹), в то время как кислотность подсолнечного меда стабильно выше (15,0–17,9 мэкв·кг⁻¹). Лавандовый мед имеет умеренный диапазон кислотности, который варьирует от 10,8 до 12,4 мэкв·кг⁻¹ (Таблица 4). Сырой мед обычно имеет более широкий и естественный диапазон кислотности, в то время как обработка имеет тенденцию делать его более однородным.
Исследования тех же типов меда показали, что акациевый мед имеет самую низкую свободную кислотность (в Румынии 3,86–25,40 мэкв·кг⁻¹ [1,2,10,61,62,63], в других странах 5,46–24,62 мэкв·кг⁻¹ [11,17,46,64]), в то время как подсолнечный мед имеет самую высокую (в Румынии 14,40–50,10 мэкв·кг⁻¹ [61,62,63,66], в других странах 21,00–45,75 мэкв·кг⁻¹) [11,17,53,64]. Более высокие значения свободной кислотности также были найдены в липовом меде (в Румынии 3,40–38,60 мэкв·кг⁻¹, в других странах 7,30–45,60 мэкв·кг⁻¹) и рапсовом меде (в Румынии 5,25–46,60 мэкв·кг⁻¹) [2,10,61,63], в других странах 12,80–36,75 мэкв·кг⁻¹) [17,46,64]. Что касается свободной кислотности, значения, полученные для лавандового меда из Сербии, Испании, Португалии, Марокко и Турции (14,40–38,90 мэкв·кг⁻¹), были выше по сравнению с теми, которые найдены в нашем исследовании [8,11,41,53,55,56].
Образцы подсолнечного меда имеют более низкие средние значения лактонной кислоты 6,5 мэкв·кг⁻¹ и общей кислотности 22,9 мэкв·кг⁻¹, сравнимые с предыдущими исследованиями, такими как Chiş and Purcărea (2015), которые сообщили о лактонах 9,98 мэкв·кг⁻¹ и общей кислотности 32,25 мэкв·кг⁻¹ в подсолнечном меде из уезда Бихор, Румыния [66]. Аналогично, Acquarone et al. наблюдали лактоны 1,80 мэкв·кг⁻¹ и общую кислотность 29,3 мэкв·кг⁻¹ в подсолнечном меде из различных географических происхождений [13]. Aazaza et al. (2013) измерили лактоны и общую кислотность в подсолнечном меде из Португалии и сообщили о значениях 13,83 мэкв·кг⁻¹ и 39,33 мэкв·кг⁻¹, соответственно [53]. Эти результаты иллюстрируют изменчивость физико-химических характеристик подсолнечного меда в различных регионах.
4.5. Зола и Электропроводность (EC)
Характеристики, используемые для отличия цветочного меда от падевого, — это зола и коррелирующая с ней положительно проводимость. Содержание золы отражает макро- и микроэлементы в меде; из-за таких факторов, как атмосферные условия, минеральный состав почвы, физиология растений и влияние состава собранного нектара, содержание золы варьирует. Электропроводность меда зависит от золы и кислотности, поскольку повышенные уровни ионов, органических кислот и белка увеличивают проводимость [5,11,60].
В этом отчете значения содержания золы в образцах меда были различными: для сырого меда содержание золы варьировало от 0,091 до 0,401% в липовом меде, от 0,054 до 0,084% в рапсовом меде, от 0,070 до 0,235% в подсолнечном меде и от 0,079 до 0,083% в лавандовом меде. В сыром акациевом меде мы получили более низкие значения содержания золы, от 0,044% до 0,053%. Для коммерческого меда содержание золы варьировало от 0,156 до 0,322% в липовом меде и от 0,034 до 0,037% в акациевом меде (Таблица 4). Методы обработки, такие как фильтрация, которые удаляют примеси, такие как пыльца и воск, являются причиной того, что коммерческий мед имеет более низкое содержание золы, чем сырой мед. Эти примеси способствуют содержанию золы, поэтому их удаление приводит к более низкому значению в коммерческом меде.
Содержание золы в меде варьирует в зависимости от региона и цветочного происхождения, поэтому исследователи опубликовали следующие данные: для липового меда содержание золы колеблется между 0,11 и 0,20% в Румынии, 0,21 и 0,50% [2,61,63] в Республике Молдова и 0,23 и 0,46% [14] в Сербии [64]. Акациевый мед показывает значения от 0,07 до 0,19% в Румынии и от 0,02 до 0,09% [2,62,63] в Сербии [64]. Рапсовый мед имеет содержание золы 0,09% в Румынии и 0,05–0,14% в Сербии [63,64]. Подсолнечный мед варьирует от 0,11 до 0,50% [62,63,67] в Румынии и 0,15 до 0,29% в Сербии [64]. Содержание золы, полученное Aazza et al., варьирует от 0,11 до 0,18% в лавандовом меде из Португалии [53].
Средние значения электропроводности (EC) сырых образцов меда, находящихся под исследованием, были: 0,667 мСм·см⁻¹ для липового, 0,187 мСм·см⁻¹ для рапсового, 0,360 мСм·см⁻¹ для подсолнечного и 0,219 мСм·см⁻¹ для лавандового. Сырой акациевый мед имел более низкую среднюю EC 0,167 мСм·см⁻¹, в то время как коммерческий мед имел EC 0,494 мСм·см⁻¹ для липового меда и 0,141 мСм·см⁻¹ для акациевого меда (Таблица 4). Электропроводность, сильно коррелирующая с содержанием золы, легко измерялась и интегрировалась в обновленные стандарты качества меда. Текущее законодательство устанавливает максимальный предел в 0,8 мСм·см⁻¹ для цветочного меда. Однако более высокие значения EC, часто превышающие этот предел, могут быть найдены в определенных типах меда, включая липовый мед (Tilia spp.) [25].
В нашем исследовании четыре образца сырого липового меда превысили максимально допустимое значение 0,8 мСм·см⁻¹, со значениями от 0,817 до 0,841 мСм·см⁻¹. Средняя EC для сырого липового меда была выше (0,667 мСм·см⁻¹) по сравнению со средней EC 0,494 мСм·см⁻¹ для коммерческих образцов липового меда.
Другие исследования, проведенные в Румынии, подчеркивают, что мед из различных регионов сообщал о более низких значениях EC по сравнению с нашими выводами, с максимумом 0,437 мСм·см⁻¹ для липового меда [2,10,23,63] и 0,268 мСм·см⁻¹ для акациевого меда [23,63,67]. Значения электропроводности, полученные из рапсового и подсолнечного медов, попадают в тот же диапазон, что и наблюдаемые в нашем исследовании [10,23,63,66].
Исследования, проведенные на меде из других стран (Сербия, Хорватия, Польша, Чешская Республика, Португалия, Испания, Турция) для определения электропроводности, показали значения, аналогичные полученным в нашем исследовании. Конкретно, для липового меда значения EC варьировали от 0,23 до 0,81 мСм·см⁻¹ [7,8,11,12], для акациевого меда от 0,08 до 0,60 мСм·см⁻¹, для рапсового меда от 0,05 мСм·см⁻¹ до 0,28 мСм·см⁻¹ [17,18,44,46] и для подсолнечного меда от 0,23 мСм·см⁻¹ до 0,46 мСм·см⁻¹ [53,55,64,67]. Для лавандового меда из Марокко Chakir et al. (2016) сообщили о более высоких значениях EC от 0,319 мСм·см⁻¹ до 0,547 мСм·см⁻¹ [56].
4.6. Гидроксиметилфурфурол (HMF)
Гидроксиметилфурфурол ( HMF ) является значительным показателем термической обработки и состояния деградации меда, отражающим его свежесть и качество. Высокие уровни HMF , вызванные нагревом или длительным хранением, могут снизить питательную ценность и безопасность меда. Европейский союз установил максимальный предел в 40 мг·кг⁻¹ для обеспечения качества меда [11,25,38]. Содержание HMF в свежем меде обычно составляет около 10 мг·кг⁻¹ [11]. Chiș and Purcărea (2011) продемонстрировали, что нагревание меда увеличивает его содержание HMF . Они обнаружили, что нагревание липового меда при 70 °C до 12 часов не превышало европейский предел в 40 мг·кг⁻¹. Однако содержание HMF значительно увеличилось с 1,041 мг·кг⁻¹ после одного часа до 1301,116 мг·кг⁻¹ после 24 часов [67]. В нашем анализе уровни HMF в изученных образцах меда были ниже законного предела со значениями от 1,3 мг·кг⁻¹ для подсолнечного меда до 14,7 мг·кг⁻¹ для коммерческого липового меда. Однако коммерческие липовый и акациевый меды имели более высокие значения 8,8 мг·кг⁻¹ и 5,1 мг·кг⁻¹ соответственно, по сравнению со значениями 3,7 мг·кг⁻¹ и 3,8 мг·кг⁻¹ в сыром меде (Таблица 4).
Анализ меда из различных стран показал широкий диапазон значений HMF. В Испании значения HMF варьировали от <0,5 до 37,4 мг·кг⁻¹ [8,54]; в Сербии от 0,77 до 28,20 мг·кг⁻¹ [11,18]; в Польше от 0,50 до 23,23 мг·кг⁻¹ [12,26]; в Чешской Республике значения HMF находились в диапазоне 1,7–2,5 мг·кг⁻¹ [46]; в Португалии от 0,60 до 12,80 мг·кг⁻¹ [53]; в Хорватии значения были найдены между 0,00 и 2,40 мг·кг⁻¹ [9]; в Турции значения были найдены в диапазоне от 2,51 до 12,56 мг·кг⁻¹ [7,55]. В образце акациевого меда из Германии было сообщено о низком значении HMF 6,08 мг·кг⁻¹ [65].
Более низкие значения HMF обычно указывают на лучшее сохранение и качество, в то время как более высокие значения предполагают возможную деградацию из-за чрезмерного воздействия тепла или неправильного хранения. Правильные методы обращения и хранения ключевые для сохранения качества меда и минимизации образования HMF.
4.7. Минеральные элементы (Na, K, Ca, Mg, Cu, Zn, Mn и Fe)
Отражая отличительные характеристики растений, из которых пчелы собирают нектар, минеральный состав меда варьирует в зависимости от его цветочного происхождения. Богатый необходимыми минералами, такими как калий с самым высоким содержанием в меде, кальций, магний, натрий, фосфор, железо, марганец, цинк, медь и другие минеральные элементы, мед предлагает как питательные преимущества, так и отличительные вкусовые и цветовые профили [19].
Некоторые минеральные элементы, найденные в меде, играют важную роль в нескольких биохимических процессах. Калий и натрий в меде действуют как электролиты, поддерживая баланс жидкости, функцию сердца и мышц, здоровье почек, регуляцию кровяного давления и нервную активность. Кальций необходим для здоровья костей, заживления переломов, предотвращения остеопороза и правильной функции опорно-двигательного аппарата, нервной и сердечной деятельности. Наряду с фосфором, он отвечает за снижение кариогенного потенциала меда. Магний необходим для мышечного сокращения, нейронной сигнализации, поддержки костей и активности антиоксидантных ферментов. Он также смягчает старение и связанные с ним расстройства [22,68].
Четыре минеральных элемента, Na, K, Ca и Mg, были обнаружены во всех проанализированных образцах меда. Среднее содержание натрия варьировало от 1,7 мг·кг⁻¹ до 38,3 мг·кг⁻¹, с самыми низкими значениями, наблюдаемыми в образцах подсолнечного меда, и самыми высокими в образцах коммерческого акациевого меда. Содержание калия варьировало от 34,1 мг·кг⁻¹ в образцах коммерческого акациевого меда до 1256,9 мг·кг⁻¹ в образцах рапсового меда. Известно, что калий присутствует в более высоких количествах по сравнению с другими элементами. В этом исследовании среднее содержание калия было ниже, чем натрия, в образцах коммерческого акациевого меда. Самое высокое содержание кальция было найдено в образцах сырого липового меда — 114,8 мг·кг⁻¹, в то время как самое низкое — 12,7 мг·кг⁻¹, было зафиксировано в образцах сырого акациевого меда. Средние значения магния варьировали от 2,0 мг·кг⁻¹ до 30,4 мг·кг⁻¹, с максимальным содержанием, наблюдаемым в лавандовом меде. В образцах, проанализированных в нашем исследовании, K был преобладающим элементом, за ним следовали Ca, Na и Mg (Таблица 5).
Содержание минеральных элементов (Na, K, Ca и Mg), о котором сообщалось в различных исследованиях, обобщено в Таблице 12.
Таблица 12. Минеральные элементы (Na, K, Ca, Mg) из нескольких источников.
Исследования четырех минеральных элементов (Na, K, Ca, Mg) в одном и том же типе меда из различных стран выявляют значительные экологические различия, отраженные в широком диапазоне концентраций. В Румынии зафиксированные диапазоны были Na (3,02–47,70 мг·кг⁻¹), K (45,35–1284,66 мг·кг⁻¹), Ca (17,69–213,28 мг·кг⁻¹) и Mg (2,17–84,45 мг·кг⁻¹) [19,23]. В Латвии интервалы были Na (5,10–7,00 мг·кг⁻¹), K (320–1100 мг·кг⁻¹), Ca (28–39 мг·кг⁻¹) и Mg (13,50–13,80 мг·кг⁻¹) [69].
В Сербии, Венгрии, Словении и Польше концентрации этих элементов попадают в следующие интервалы: Na (2,06–160,04 мг·кг⁻¹), K (46,35–2284,44 мг·кг⁻¹), Ca (4,31–245,8 мг·кг⁻¹) и Mg (3,12–72,31 мг·кг⁻¹) [18,20,45,64,70,71]. Концентрации этих четырех элементов в образцах меда из Болгарии и Португалии соответствуют тем, о которых сообщалось в Сербии (Таблица 12) [53,72].
Мед содержит множество минералов, поэтому его часто называют полноценной пищей и натуральным целебным продуктом. Четыре других минеральных элемента, количественно оцененных из пяти типов изученного меда, — это медь, цинк, марганец и железо. Эти микроэлементы необходимы для различных биологических функций и требуются организму в малых количествах [22,68].
Из-за их низких концентраций эти микроэлементы были необнаружимы в некоторых образцах меда, с уровнями концентраций ниже предела обнаружения. Конкретно, медь не была обнаружена в семи образцах липового меда, включая два коммерческих образца меда и два образца лавандового меда. Цинк был неопределяемым в четырех липовых и трех акациевых образцах меда, в то время как марганец был количественно определен в четырех липовых образцах меда, двух рапсовых образцах меда и одном образце подсолнечного меда.
Результаты количественного определения этих элементов показывают их неоднородное распределение в образцах, отражая различия в условиях окружающей среды и цветочных источниках. Подсолнечный мед имел самую высокую среднюю концентрацию меди — 0,61 мг·кг⁻¹, в то время как лавандовый мед имел самую высокую концентрацию цинка (1,14 мг·кг⁻¹). Средняя концентрация марганца варьировала между 0,74 мг·кг⁻¹ и 3,38 мг·кг⁻¹. В лавандовом меде была найдена самая высокая концентрация железа — 111,01 мг·кг⁻¹, в то время как самая низкая средняя концентрация наблюдалась в подсолнечном меде, со значением 3,91 мг·кг⁻¹.
В образцах, проанализированных в нашем исследовании, железо имело самую высокую среднюю концентрацию среди четырех микроэлементов, за ним следовали марганец, цинк и медь (Таблица 5).
Концентрация микроэлементов (Cu, Zn, Mn и Fe), зафиксированная из различных исследований, обобщена в Таблице 13.
Таблица 13. Минеральные элементы (Cu, Zn, Mn, Fe) из нескольких исследований.
Как показано широким диапазоном концентраций, исследования четырех микроэлементов в одном и том же типе меда из различных стран выявляют значительные экологические различия (Таблица 13).
В Румынии сообщенные диапазоны для микроэлементов были: Cu (LoQ–2,40 мг·кг⁻¹), Zn (LoQ–4,80 мг·кг⁻¹), Mn (LoQ–7,17 мг·кг⁻¹) и Fe (LoQ–75,91 мг·кг⁻¹) [19,23]. В Латвии интервалы были: Mn (0,29–0,37 мг·кг⁻¹), Fe (<0,075–1,40 мг·кг⁻¹) и <0,075 мг·кг⁻¹ для Cu [69].
В Сербии, Венгрии, Словении, Польше и Болгарии концентрации этих элементов находятся в пределах следующих диапазонов: Cu (LoQ–257,30 мг·кг⁻¹), Zn (LoQ–7,59 мг·кг⁻¹), Mn (0,08–4,72 мг·кг⁻¹) и Fe (<0,005–154,39 мг·кг⁻¹) [18,20,45,53,64,70,71,72] (Таблица 13).
4.8. Корреляции между исследуемыми переменными
Выполнение корреляционного анализа Пирсона по параметрам меда ключевое для оценки силы и характера взаимосвязей между переменными. Он предоставляет ценную информацию о том, как факторы окружающей среды и композиционные атрибуты взаимодействуют, чтобы влиять на физико-химические и минеральные свойства меда.
В Таблице 6 представлены коэффициенты Пирсона для корреляции между параметрами сырого липового меда. Можно наблюдать очень сильные корреляции между влажностью и общим содержанием растворимых сухих веществ (r = −1,00 ) и удельным весом (r = −1,00 ); общим содержанием растворимых сухих веществ и удельным весом (r = −1,00 ); pH и свободной кислотностью (r = 0,94 ); общей кислотностью и pH (r = −0,86 ) и свободной кислотностью (r = 0,85 ), медью (r = 0,81 ) и цинком (r = 0,77 ); содержанием золы и pH (r = 0,77 ); электропроводностью и pH (r = 0,81 ), общей кислотностью (r = −0,76 ) и золой (r = 0,99 ); кальцием и натрием (r = 0,73 ); цинком и медью (r = 0,97 ) и железом (r = 0,74 ); свободной кислотностью и марганцем (r = −0,75 ); железом и HMF (r = 0,81 ).
В сыром липовом меде были наблюдаемы сильные положительные или отрицательные корреляции между несколькими параметрами, с коэффициентами Пирсона от 0,50 до 0,70 (0,50 ≤ r ≤ 0,70). Таким образом, были замечены корреляции между мм Пфунда и золой, электропроводностью и магнием; WIS с золой, электропроводностью и кальцием; калием с влажностью, TSS и удельным весом; pH с медью и марганцем; свободной кислотностью с золой и электропроводностью; HMF с медью и цинком; лактонной кислотностью с цинком и железом, кальцием с марганцем и медью с железом.
В Таблице 7 представлены коэффициенты Пирсона для корреляций между параметрами коммерческого липового меда. Мы наблюдали сильную корреляцию между мм Пфунда и некоторыми параметрами: pH (r = −0,85 ), FA (r = 0,86 ), TA (r = 0,81 ), Cu (r = −0,66); средние корреляции для золы и влажности (r = −0,53), TSS (r = 0,54) и удельного веса (r = 0,53), а также между мм Пфунда и параметрами WIS (r = −0,55), LA (r = 0,58), HMF (r = 0,51), K (r = −0,56) и Fe (r = −0,51). Свободная, лактонная и общая кислотность имеют средние корреляции с несколькими параметрами (HMF, Na, K, Cu и Zn). Более высокие уровни HMF , часто являющиеся результатом длительного хранения или нагрева, могут способствовать повышению кислотности; минералы, такие как Na и K, могут влиять на pH и буферную способность меда, косвенно влияя на его кислотность. Более высокая кислотность в меде может усиливать растворение и биодоступность минералов, таких как медь и цинк. Кислотные условия делают ионы металлов более доступными и могут влиять на ферментативные реакции, такие как процесс окисления, приводящий к образованию HMF . Примечательны другие важные корреляции: зола с электропроводностью (r = 0,90 ); более высокое содержание золы (больше минералов) приводит к более высокой электропроводности, так как больше минералов (ионов) улучшают проводимость; кальций и магний (r = −0,81 ); медь с цинком (r = 0,85 ), сильная положительная корреляция, вероятно, из-за схожих источников и ролей в ферментативных реакциях, оба металла имеют тенденцию встречаться вместе в меде; и железо с медью (r = 0,78 ); и цинком (r = 0,92 ).
В Таблице 8 представлен тест ANOVA для различий между сырым и коммерческим медом. Различия между сырым и коммерческим медом очевидны в таких параметрах, как шкала мм Пфунда, нерастворимые в воде вещества и гидроксиметилфурфурол. Отражая свое естественное, необработанное состояние, сырой мед имеет тенденцию иметь более разнообразный цветовой профиль по шкале мм Пфунда. Нерастворимые вещества, такие как пыльца и пчелиный воск, увеличивают вязкость, создавая физические барьеры для потока жидкости. Мед становится гуще и более вязким из-за этого сопротивления течению. Напротив, коммерческий мед часто подвергается фильтрации и термической обработке, что приводит к более низким WIS и более высоким уровням HMF , поскольку HMF увеличивается с нагревом и хранением, указывая на потенциал деградации. Эти факторы иллюстрируют различия в качестве и обработке между сырым и коммерческим медом.
Таблица 9 представляет коэффициенты Пирсона для корреляций между всеми параметрами изученных образцов меда. Наблюдаются связи между шкалой мм Пфунда, влажностью, общим содержанием растворимых сухих веществ, кислотностью, содержанием золы, электропроводностью и другими. Кроме того, было найдено много корреляций между минеральными элементами и другими параметрами, а также среди минеральных элементов.
Корреляции между анализируемыми параметрами показывают, что мед имеет взаимосвязанный состав. Изменения в одном факторе связаны с изменениями в других, отражая его общее качество и характеристики.
В Таблице 10 обобщены результаты факторного анализа. В Таблице 11 даны оценки извлеченных факторов.
Факторный анализ дает обзор всего набора данных и указывает на вклады определенных параметров качества. Было выбрано семь факторов с собственными значениями выше 1,00, которые объясняют около 90% общей дисперсии. Нагрузки и соответствующие собственные значения и дисперсии представлены в Таблице 10.
Фактор 1 характеризуется влажностью, общим содержанием растворимых сухих веществ и удельным весом как параметрами со значительными нагрузками и может быть отнесен к некоторым фундаментальным характеристикам стабильности продукта. Соответствующие оценки (Таблица 11) указывают, что этот фактор не выделяет определенный тип меда, но все основные вносящие вклад меды являются сырыми. Значительные вклады даются липовым (T3, T5, T9) и рапсовым (R21), и умеренные вклады от липового (T12), рапсового (R22), акациевого (A19) и подсолнечного (SF23, SF25).
Второй фактор, Фактор 2, объясняет 18,73% дисперсии и отражает кислотность, включая свободную и общую кислотность как доминирующие параметры. Оценки для этого фактора подчеркивают липовые образцы.
Фактор 3 с высокими нагрузками WIS имеет основные вклады от акациевых и рапсовых медов.
Интересно, что K и цвет объединены в Фактор 4, объясняющий около 13% дисперсии, при этом основной вклад вносят рапсовые меды.
Фактор 5 включает в себя как доминирующие параметры pH, золу, электропроводность, Mg и Cu, определяя минеральный фактор, с доминирующими вкладами от липовых медов T3 и T4. Фактор 6 указывает на вклад Fe из образцов лавандового меда. В Факторе 7 только лактонная кислотность имеет значительную нагрузку, даваемую в основном липовыми медами.
5. Выводы
Разнообразие моно- и полифлорных медов обусловлено перекрывающимися периодами цветения различных растений. Мелиссопалинологический анализ важен для подтверждения цветочного происхождения, поддержания качества и открытия полезных для здоровья свойств конкретных растений.
Этот анализ помогает идентифицировать основные источники нектара, используемые пчелами, и проверяет ботаническое происхождение меда. Широкое разнообразие типов пыльцы показывает, как факторы окружающей среды и разнообразие растений положительно влияют на состав меда.
Все протестированные параметры находились в пределах законодательных ограничений, указывая, что как сырой, так и коммерческий мед имеют хорошее качество. Хотя существуют значительные различия между определенными параметрами качества, такими как цвет, нерастворимые в воде вещества и гидроксиметилфурфурол, качество меда доказывает, что пчеловоды и переработчики меда в регионе улучшили методы производства.
Различия в концентрациях минералов в меде отражают как разнообразие растений, так и окружающую среду, включая воду, воздух и почву. Состав окружающей среды отражается в сыром меде, доказывая, что пчелы являются надежными биоиндикаторами здоровья окружающей среды.
Исследуемые параметры качества и взаимосвязи между ними указывают на хорошее качество окружающей среды, ценные природные ресурсы и соответствующие технологии обработки меда в регионе.
Ссылки
1. Pauliuc, D.; Dranca, F.; Oroian, M. Antioxidant Activity, Total Phenolic Content, Individual Phenolics and Physicochemical Parameters Suitability for Romanian Honey Authentication. Foods 2020, 9, 306. [Google Scholar] [CrossRef] [PubMed]
2. Pop, I.M.; Simeanu, D.; Cucu-Man, S.-M.; Pui, A.; Albu, A. Quality Profile of Several Monofloral Romanian Honeys. Agriculture 2023, 13, 75. [Google Scholar] [CrossRef]
3. Dobre, I.; Alexe, P.; Escuredo, O.; Seijo, C.M. Palynological evaluation of selected honeys from Romania. Grana 2013, 52, 113–121. [Google Scholar] [CrossRef]
4. Persano Oddo, L.; Piro, R. Main European Unifloral Honeys: Descriptive Sheets. Apidologie 2004, 35, S38–S81. [Google Scholar] [CrossRef]
5. da Silva, P.M.; Gauche, C.; Gonzaga, L.V.; Costa, A.C.O.; Fett, R. Honey: Chemical composition, stability and authenticity. Food Chem. 2016, 196, 309–323. [Google Scholar] [CrossRef]
6. Tarapoulouzi, M.; Mironescu, M.; Drouza, C.; Mironescu, I.D.; Agriopoulou, S. Insight into the Recent Application of Chemometrics in Quality Analysis and Characterization of Bee Honey during Processing and Storage. Foods 2023, 12, 473. [Google Scholar] [CrossRef]
7. Can, Z.; Yildiz, O.; Sahin, H.; Akyuz Turumtay, E.; Silici, S.; Kolayli, S. An Investigation of Turkish Honeys: Their Physico-Chemical Properties, Antioxidant Capacities and Phenolic Profiles. Food Chem. 2015, 180, 133–141. [Google Scholar] [CrossRef]
8. Castro-Vázquez, L.; León-Ruiz, V.; Alañón, M.E.; Pérez-Coello, M.S.; González-Porto, A.V. Floral Origin Markers for Authenticating Lavandin Honey (Lavandula angustifolia × latifolia): Discrimination from Lavender Honey (Lavandula latifolia). Food Control 2014, 37, 362–370. [Google Scholar] [CrossRef]
9. Flanjak, I.; Kenjerić, D.; Bubalo, D.; Primorac, L. Characterisation of Selected Croatian Honey Types Based on the Combination of Antioxidant Capacity, Quality Parameters, and Chemometrics. Eur. Food Res. Technol. 2016, 242, 467–475. [Google Scholar] [CrossRef]
10. Pauliuc, D.; Dranca, F.; Ropciuc, S.; Oroian, M. Advanced Characterization of Monofloral Honeys from Romania. Agriculture 2022, 12, 526. [Google Scholar] [CrossRef]
11. Sakač, M.; Jovanov, P.; Marić, A.; Četojević-Simin, D.; Novaković, A.; Plavšić, D.; Škrobot, D.; Kovač, R. Antioxidative, Antibacterial and Antiproliferative Properties of Honey Types from the Western Balkans. Antioxidants 2022, 11, 1120. [Google Scholar] [CrossRef] [PubMed]
12. Waś, E.; Rybak-Chmielewska, H.; Szczęsna, T.; Kachaniuk, K.; Teper, D. Characteristics of Polish unifloral honeys. II. Lime honey (Tilia spp.). J. Apic. Sci. 2011, 55, 1–8. [Google Scholar]
13. Acquarone, C.; Buera, P.; Elizalde, B. Pattern of pH and Electrical Conductivity upon Honey Dilution as a Complementary Tool for Discriminating Geographical Origin of Honeys. Food Chem. 2007, 101, 695–703. [Google Scholar] [CrossRef]
14. Chirsanova, A.; Capcanari, T.; Boistean, A. Quality Assessment of Honey in Three Different Geographical Areas from Republic of Moldova. Food Nutr. Sci. 2021, 12, 962–977. [Google Scholar] [CrossRef]
15. Mărgăoan, R.; Topal, E.; Balkanska, R.; Yücel, B.; Oravecz, T.; Cornea-Cipcigan, M.; Vodnar, D.C. Monofloral Honeys as a Potential Source of Natural Antioxidants, Minerals and Medicine. Antioxidants 2021, 10, 1023. [Google Scholar] [CrossRef]
16. Milosavljević, S.; Jadranin, M.; Mladenović, M.; Tešević, V.; Menković, N.; Mutavdžić, D.; Krstić, G. Physicochemical Parameters As Indicators of the Authenticity of Monofloral Honey from the Territory of the Republic of Serbia. Maced. J. Chem. Chem. Eng. 2021, 40, 57–67. [Google Scholar] [CrossRef]
17. Ratiu, I.A.; Al-Suod, H.; Bukowska, M.; Ligor, M.; Buszewski, B. Correlation study of honey regarding their physicochemical properties and sugars and cyclitols content. Molecules 2020, 25, 34. [Google Scholar] [CrossRef]
18. Spirić, D.; Ćirić, J.; Đorđević, V.; Nikolić, D.; Janković, S.; Nikolić, A.; Petrović, Z.; Katanić, N.; Teodorović, V. Toxic and Essential Element Concentrations in Different Honey Types. Int. J. Environ. Anal. Chem. 2019, 99, 1032–1046. [Google Scholar] [CrossRef]
19. Bora, F.D.; Andrecan, A.F.; Călugăr, A.; Bunea, C.I.; Popescu, M.; Petrescu-Mag, I.V.; Bunea, A. Comprehensive Elemental Profiling of Romanian Honey: Exploring Regional Variance, Honey Types, and Analyzed Metals for Sustainable Apicultural and Environ-mental Practices. Foods 2024, 13, 1253. [Google Scholar] [CrossRef]
20. Pavlin, A.; Kočar, D.; Imperl, J.; Kolar, M.; Marolt, G.; Petrova, P. Honey Origin Authentication via Mineral Profiling Combined with Chemometric Approaches. Foods 2023, 12, 2826. [Google Scholar] [CrossRef]
21. Soares, S.; Amaral, J.S.; Oliveira, M.B.P.; Mafra, I. A comprehensive review on the main honey authentication issues: Production and origin. Compr. Rev. Food Sci. Food Saf. 2017, 16, 1072–1100. [Google Scholar] [CrossRef] [PubMed]
22. Solayman, M.; Islam, M.A.; Paul, S.; Ali, Y.; Khalil, M.I.; Alam, N.; Gan, S.H. Physicochemical properties, minerals, trace elements, and heavy metals in honey of different origins: A comprehensive review. Compr. Rev. Food Sci. Food Saf. 2016, 15, 219–233. [Google Scholar] [CrossRef] [PubMed]
23. Stihi, C.; Chelarescu, E.D.; Duliu, O.G.; Toma, L.G. Characterization of Romanian honey using physico-chemical parameters and the elemental content determined by analytical techniques. Rom. Rep. Phys. 2016, 68, 362–369. [Google Scholar]
24. Tudoreanu, L.; Codreanu, M.D.; Crivineanu, V.; Goran, G.V. The Quality of Romanian Honey Varieties—Mineral Content and Textural Properties. Bull. USAMV 2012, 69, 1–7. [Google Scholar] [CrossRef]
25. European Commission. Council Directive 2001/110/CE concerning honey. Off. J. Eur. Comm. 2002, L10, 47–52. [Google Scholar]
26. Miłek, M.; Bocian, A.; Kleczynśka, E.; Sowa, P.; Dżugan, M. The Comparison of Physicochemical Parameters, Antioxidant Activity and Proteins for the Raw Local Polish Honeys and Imported Honey Blends. Molecules 2021, 26, 2423. [Google Scholar] [CrossRef]
27. Raweh, H.S.A.; Badjah-Hadj-Ahmed, A.Y.; Iqbal, J.; Alqarni, A.S. Physicochemical Composition of Local and Imported Honeys Associated with Quality Standards. Foods 2023, 12, 2181. [Google Scholar] [CrossRef]
28. Rysha, A.; Kastrati, G.; Biber, L.; Sadiku, V.; Rysha, A.; Zogaj, F.; Kabashi-Kastrati, E. Evaluating the Physicochemical Properties of Some Kosovo’s and Imported Honey Samples. Appl. Sci. 2022, 12, 629. [Google Scholar] [CrossRef]
29. Louveaux, J.; Maurizio, A.; Vorwohl, G. Methods of Melissopalynology. Bee World 1978, 59, 139–157. [Google Scholar] [CrossRef]
30. Von Der Ohe, W.; Persano Oddo, L.; Piana, M.L.; Morlot, M.; Martin, P. Harmonized Methods of Melissopalynology. Apidol-ogie 2004, 35, S18–S25. [Google Scholar] [CrossRef]
31. SR 784-3:2009; ICS 68.180.10. Honey Bee. Part 3: Analytical Methods. Romanian Standards Association: Bucharest, Romania, 2009.
32. Nyau, V.; Mwanza, E.P.; Moonga, H.B. Physico-Chemical Qualities of Honey Harvested from Different Beehive Types in Zambia. Afr. J. Food, Agric. Nutr. Dev. 2013, 13, 7415–7427. [Google Scholar] [CrossRef]
33. Bogdanov, S. Harmonized Methods of the International Honey Commission. 2009. Available online: https://www.ihc-platform.net/ihcmethods2009.pdf (accessed on 30 May 2018).
34. White, J.W. Determination of Acidity, Nitrogen, and Ash in Honey. J. Assoc. Off. Agric. Chem. 1962, 459, 548–551. [Google Scholar] [CrossRef]
35. White, J.W., Jr. Spectrophotometric method for hydroxymethylfurfural in honey. AOAC 1979, 62, 509–514. [Google Scholar] [CrossRef]
36. Bobiș, O.; Mărghitaș, L.A.; Dezmirean, D.S.; Bărnuțiu, L.I.; Mărgăoan, R.; Bogdan Gher-man, B.; Bonta, V. The Importance of Melissopalynology in Addition to Physical-chemical Analysis on Botanical Authenticity Testing of Monofloral Honey. Bull. UASVM Anim. Sci. Biotechnol. 2013, 70, 24–30. [Google Scholar]
37. Thrasyvoulou, A.; Tananaki, C.; Goras, G.; Karazafiris, E.; Dimou, M.; Liolios, V.; Kanelis, D.; Gounari, S. Legislation of Honey Criteria and Standards. J. Apic. Res. 2018, 57, 88–96. [Google Scholar] [CrossRef]
38. SR 784-2:2009; ICS 68.180.10. Honey Bee. Part 2: Quality Requirements at Sale. Romanian Standards Association: Bucharest, Romania, 2009.
39. Tedesco, R.; Scalabrin, E.; Malagnini, V.; Strojnik, L.; Ogrinc, N.; Capodaglio, G. Character-ization of Botanical Origin of Italian Honey by Carbohydrate Composition and Volatile Organic Compounds (VOCs). Foods 2022, 11, 2441. [Google Scholar] [CrossRef]
40. Requirements for Food Quality Schemes, Procedures for the Implementation, Operation, Monitoring, and Control Thereof. Annex 7. 2014. Available online: https://likumi.lv/ta/en/en/id/268347-requirements-for-food-quality-schemes-procedures-for-theimplementation-operation-monitoring-and-control-thereof (accessed on 9 December 2024).
41. Estevinho, L.M.; Chambó, E.D.; Pereira, A.P.R.; Carvalho, C.A.L.d.; Toledo, V.d.A.A.d. Characterization of Lavandula spp. honey using multivariate techniques. PLoS ONE 2016, 11, e0162206. [Google Scholar] [CrossRef]
42. Anjos, O.; Guiné, R.P.F.; Santos, A.J.A.; Paula, V.B.; Pereira, H.; Estevinho, L.M. Evaluation of FT-Raman and FTIR-ATR Spectroscopy for the Quality Evaluation of Lavandula spp. Honey. Open Agric. 2018, 3, 47–56. [Google Scholar] [CrossRef]
43. Silici, S.; Ülgen, N. Bioactive Properties of Blossom and Honeydew Honeys. Mellifera 2019, 19, 36–47. [Google Scholar]
44. Kolaylı, S.; Can, Z.; Kara, Y.; Özkök, A.; Ozmert Ergin, S.; Kemal, M.; Demir Kanbur, E. Physicochemical Characteristics, Phenolic Components, and Antioxidant Capacities of Lavender Honey (Lavandula spp.) from Isparta Region of Türkiye. Chem. Biodivers. 2024, 21, e202400718. [Google Scholar] [CrossRef]
45. Bodó, A.; Radványi, L.; Kőszegi, T.; Csepregi, R.; Nagy, D.U.; Farkas, Á.; Kocsis, M. Quality Evaluation of Light- and Dark-Colored Hungarian Honeys, Focusing on Botanical Origin, Antioxidant Capacity and Mineral Content. Molecules 2021, 26, 2825. [Google Scholar] [CrossRef] [PubMed]
46. Pospiech, M.; Javůrková, Z.; Hrabec, P.; Cížková, H.; Titěra, D.; Štarha, P.; Ljasovská, S.; Kružík, V.; Podskalská, T.; Bednář, J.; et al. Physico-Chemical and Melissopalynological Characterization of Czech Honey. Appl. Sci. 2021, 11, 4989. [Google Scholar] [CrossRef]
47. Stawiarz, E. Pollen Spectrum of Rapeseed Honey from the Sandomierska Upland Area. J. Apic. Sci. 2008, 52, 83–91. [Google Scholar]
48. Puścion-Jakubik, A.; Bielecka, J.; Grabia, M.; Markiewicz-Żukowska, R.; Soroczyńska, J.; Teper, D.; Socha, K. Comparative Analysis of Antioxidant Properties of Honey from Poland, Italy, and Spain Based on the Declarations of Producers and Their Results of Melissopalinological Analysis. Nutrients 2022, 14, 2694. [Google Scholar] [CrossRef]
49. Al, M.L.; Daniel, D.; Moise, A.; Bobis, O.; Laslo, L.; Bogdanov, S. Physico-chemical and bioactive properties of different floral origin honeys from Romania. Food Chem. 2009, 112, 863–867. [Google Scholar] [CrossRef]
50. Bodor, Z.; Benedek, C.; Urbin, A.; Szabó, A.; Sipos, L. Color of Honey: Can We Trust the Pfund Scale?—An Alternative Graphical Tool Covering the Whole Visible Spectra. LWT-Food Sci. Technol. 2021, 149, 111872. [Google Scholar] [CrossRef]
51. Srećković, N.Z.; Mihailović, V.B.; Katanić Stanković, J.S. Physico-Chemical, Antioxidant and Antimicrobial Properties of Three Different Types of Honey from Central Serbia. Kragujevac J. Sci. 2019, 41, 53–68. [Google Scholar] [CrossRef]
52. Majewska, E.; Drużyńska, B.; Derewiaka, D.; Ciecierska, M.; Pakosz, P. Comparison of Antioxidant Properties and Color of Selected Polish Honeys and Manuka Honey. Foods 2024, 13, 2666. [Google Scholar] [CrossRef]
53. Aazza, S.; Lyoussi, B.; Antunes, D.; Miguel, M.G. Physicochemical Characterization and Antioxidant Activity of Commercial Portuguese Honeys. J. Food Sci. 2013, 78, 1159–1165. [Google Scholar] [CrossRef]
54. Juan-Borrás, M.; Domenech, E.; Conchado, A.; Escriche, I. Physicochemical Quality Parameters at the Reception of the Honey Packaging Process: Influence of Type of Honey, Year of Harvest, and Beekeeper. J. Chem. 2015, 929658, 1–6. [Google Scholar] [CrossRef]
55. Beykaya, M. Determination of Physiochemical Properties of Raw Honey Samples. Progr. Nutr. 2021, 23, e2021020. [Google Scholar]
56. Chakir, A.; Romane, A.; Marcazzan, G.L.; Ferrazzi, P. Physicochemical Properties of Some Honeys Produced from Different Plants in Morocco. Arab. J. Chem. 2016, 9 (Suppl. 1), S946–S954. [Google Scholar] [CrossRef]
57. Crane, E. Honey: A Comprehensive Survey; Heinemann: London, UK, 1979. [Google Scholar]
58. Čelechovská, O.; Vorlová, L. Groups of honey—Physicochemical properties and heavy metals. Acta Vet. Brno 2001, 70, 91–95. [Google Scholar] [CrossRef]
59. Codex Alimentarius, Alinorm 01/25, Joint FAO/WHO Food Standard Programme, Codex Alimentarius Commission Twenty-fourth Session, Geneva, 2–7 July 2001. Available online: https://www.fao.org/input/download/report/277/Al01_25e.pdf (accessed on 19 June 2019).
60. Albu, A.; Simeanu, C.; Pop, I.M.; Pui, A.; Tarcău, D.; Cucu-Man, S.-M. Selected Characteristics of Multifloral Honeys from North-Eastern Romania. Agriculture 2024, 14, 26. [Google Scholar] [CrossRef]
61. Isopescu, R.D.; Josceanu, A.M.; Minca, I.; Colta, T.; Postelnicescu, P.; Mateescu, C. Characterization of Romanian Honey Based on Physico-Chemical Properties. Rev. Chim. 2014, 65, 381–385. [Google Scholar]
62. Oroian, M.; Sănduleac, E.T.; Pădureț, S. Physicochemical and Textural Properties of Honeys from North East Part of Romania. Food Environ. Saf. 2016, 15, 234–239. [Google Scholar]
63. Vîjan, L.E.; Mazilu, I.C.; Enache, C.; Enache, S.; Topală, C.M. Botanical Origin Influence on Some Honey Physicochemical Characteristics and Antioxidant Properties. Foods 2023, 12, 2134. [Google Scholar] [CrossRef]
64. Ðogo Mračević, S.; Krstić, M.; Lolić, A.; Ražić, S. Comparative study of the chemical composition and biological potential of honey from different regions of Serbia. Microchem. J. 2020, 152, 104420. [Google Scholar] [CrossRef]
65. Alzahrani, H.A.; Alsabehi, R.; Boukraa, L.; Abdellah, F.; Bellik, Y.; Bakhotmah, B.A. Antibacterial and Antioxidant Potency of Floral Honeys from Different Botanical and Geographical Origins. Molecules 2012, 17, 10540–10549. [Google Scholar] [CrossRef]
66. Chiş, A.M.; Purcărea, C. The phisico-chemical caracterisation of sun flower honey from Bihor county. An. Univ. Din Oradea Fasc. Ecotoxicol. Zooteh. Şi Tehnol. Ind. Aliment. 2015, 14, 107–114. [Google Scholar]
67. Chiş, A.M.; Purcărea, C. The Effect of Thermal Treatment on Fresh Monofloral Honey Types from Bihor County. An. Univ. Din Oradea Fasc. Ecotoxicol. Zooteh. Şi Tehnol. Ind. Aliment. 2011, 71, 71–76. [Google Scholar]
68. Kamaruzzaman, M.A.; Chin, K.-Y.; Ramli, E.S.M. A Review of Potential Beneficial Effects of Honey on Bone Health. Evid. Based Complement. Altern. Med. 2019, 2019, 8543618. [Google Scholar] [CrossRef] [PubMed]
69. Labsvards, K.D.; Rudovica, V.; Borisova, A.; Kokina, K.; Bertins, M.; Naumenko, J.; Viksna, A. Multi-Element Profile Characterization of Monofloral and Polyfloral Honey from Latvia. Foods 2023, 12, 4091. [Google Scholar] [CrossRef] [PubMed]
70. Sajtos, Z.; Herman, P.; Harangi, S.; Baranyai, E. Elemental Analysis of Hungarian Honey Samples and Bee Products by MP-AES Method. Microchem. J. 2019, 149, 103968. [Google Scholar] [CrossRef]
71. Tarapatskyy, M.; Sowa, P.; Zaguła, G.; Dzugan, M.; Puchalski, C. Assessment of the Botanical Origin of Polish Honeys Based on Physicochemical Properties and Bioactive Components with Chemometric Analysis. Molecules 2021, 26, 4801. [Google Scholar] [CrossRef]
72. Atanassova, J.; Yurukova, L.; Lazarova, M. Pollen and Inorganic Characteristics of Bulgarian Unifloral Honeys. Czech J. Food Sci. 2012, 30, 520–526. [Google Scholar] [CrossRef]
Albu A, Bora FD, Cucu-Man S-M, Stoleru V, Nistor C-E, Brumă IS, Rusu O-R. Assessing Honey Quality: A Focus on Some Physicochemical Parameters of Honey from Iasi County (Romania). Agriculture. 2025; 15(3):333. https://doi.org/10.3390/agriculture15030333
Перевод статьи «Assessing Honey Quality: A Focus on Some Physicochemical Parameters of Honey from Iasi County (Romania)» авторов Albu A, Bora FD, Cucu-Man S-M, Stoleru V, Nistor C-E, Brumă IS, Rusu O-R., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
Фото: freepik
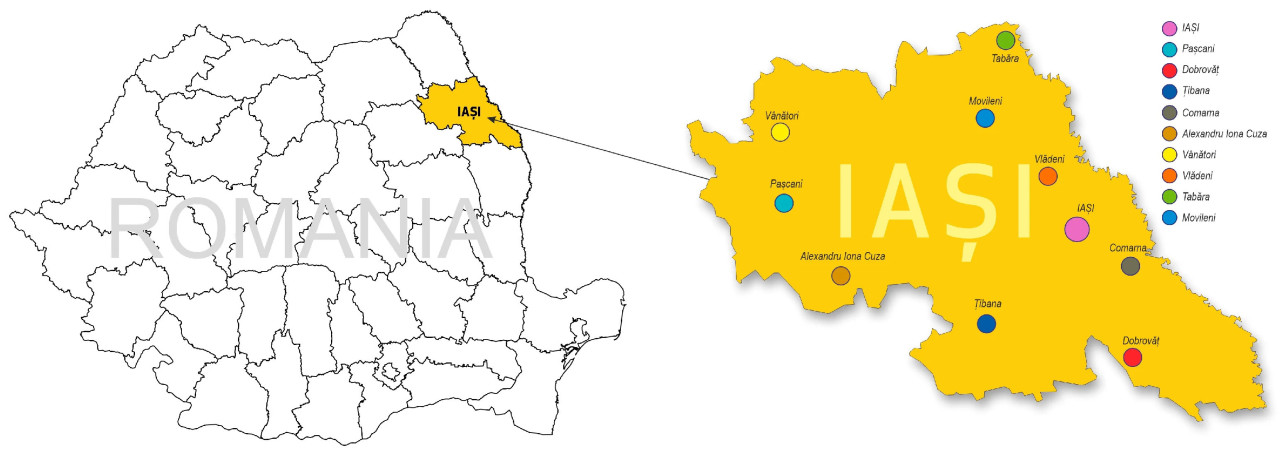
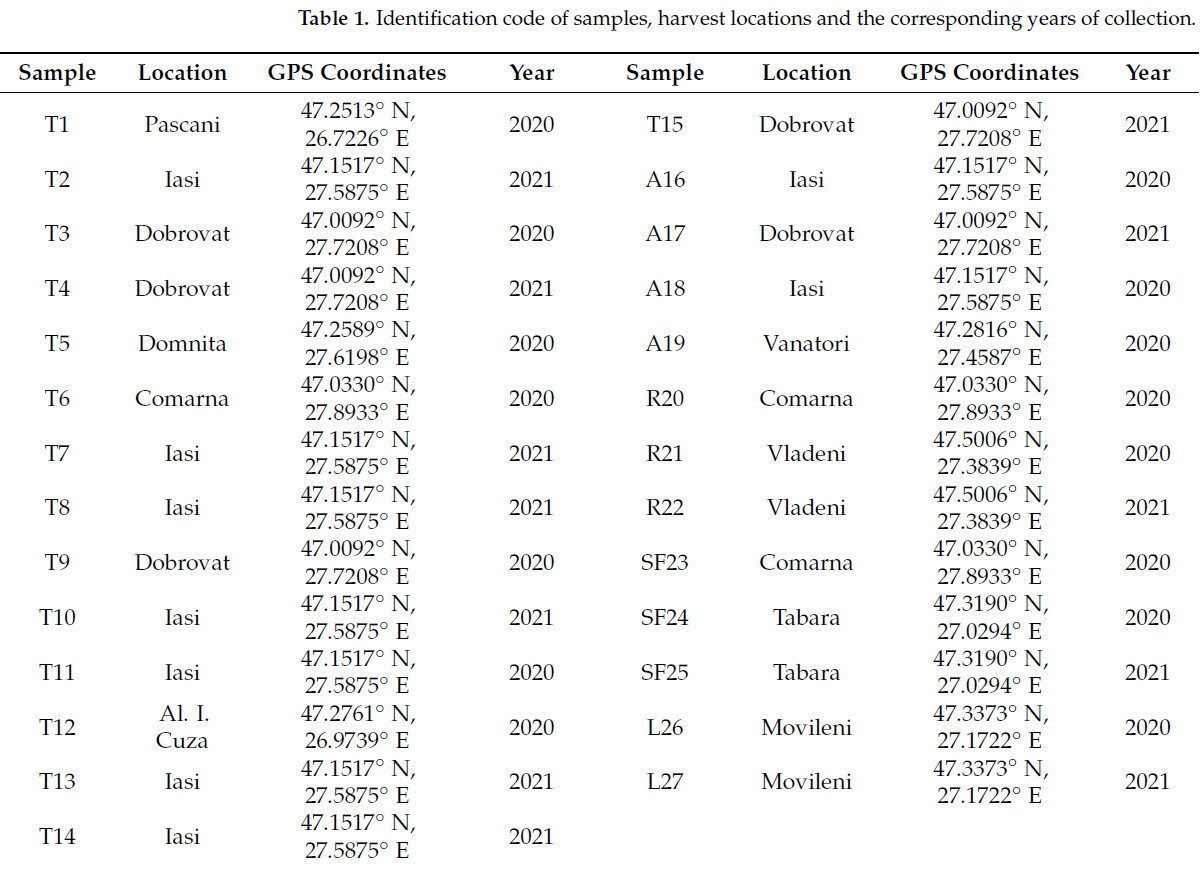
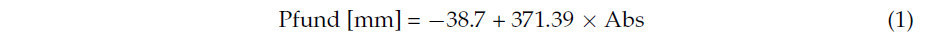
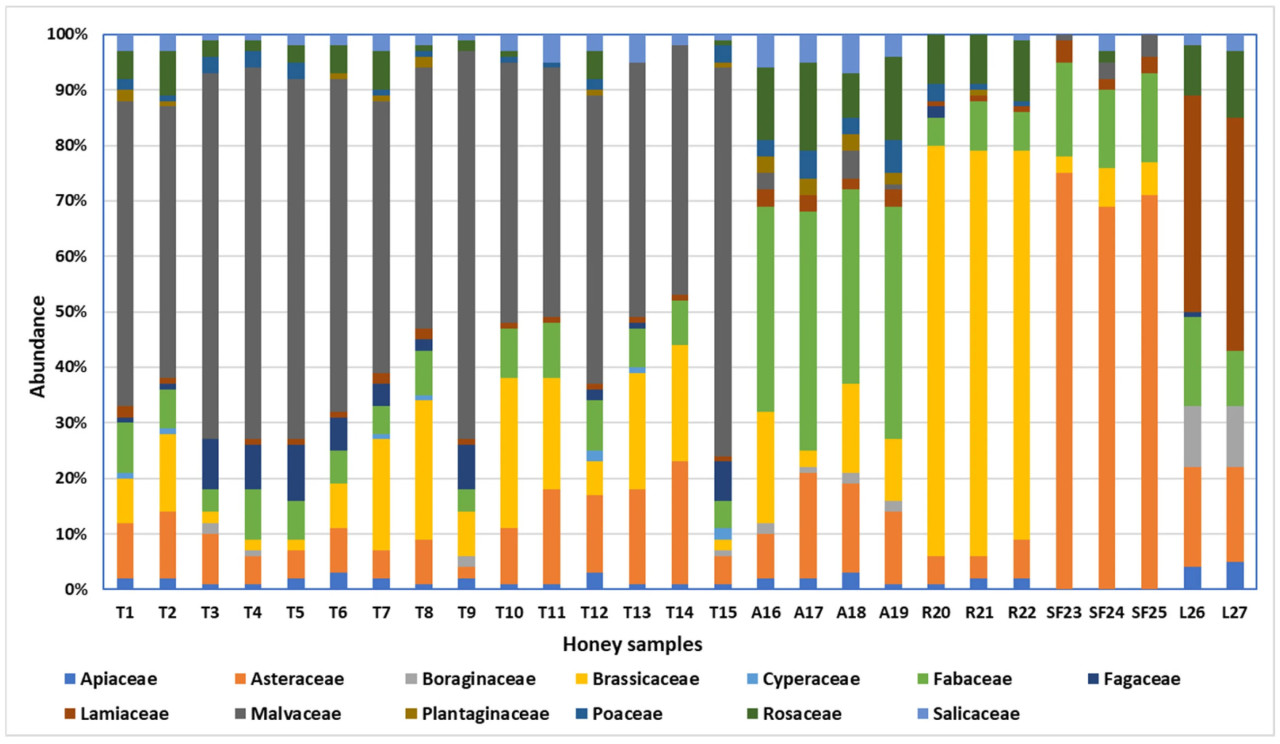
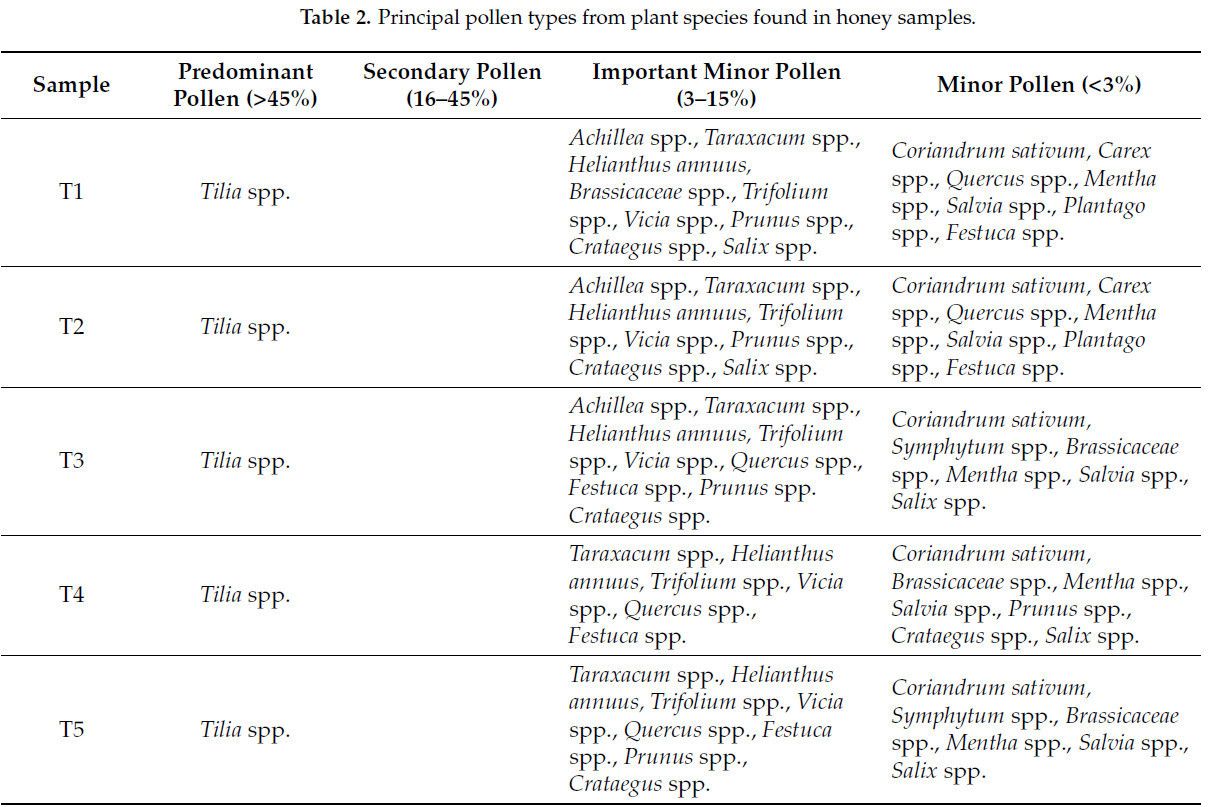
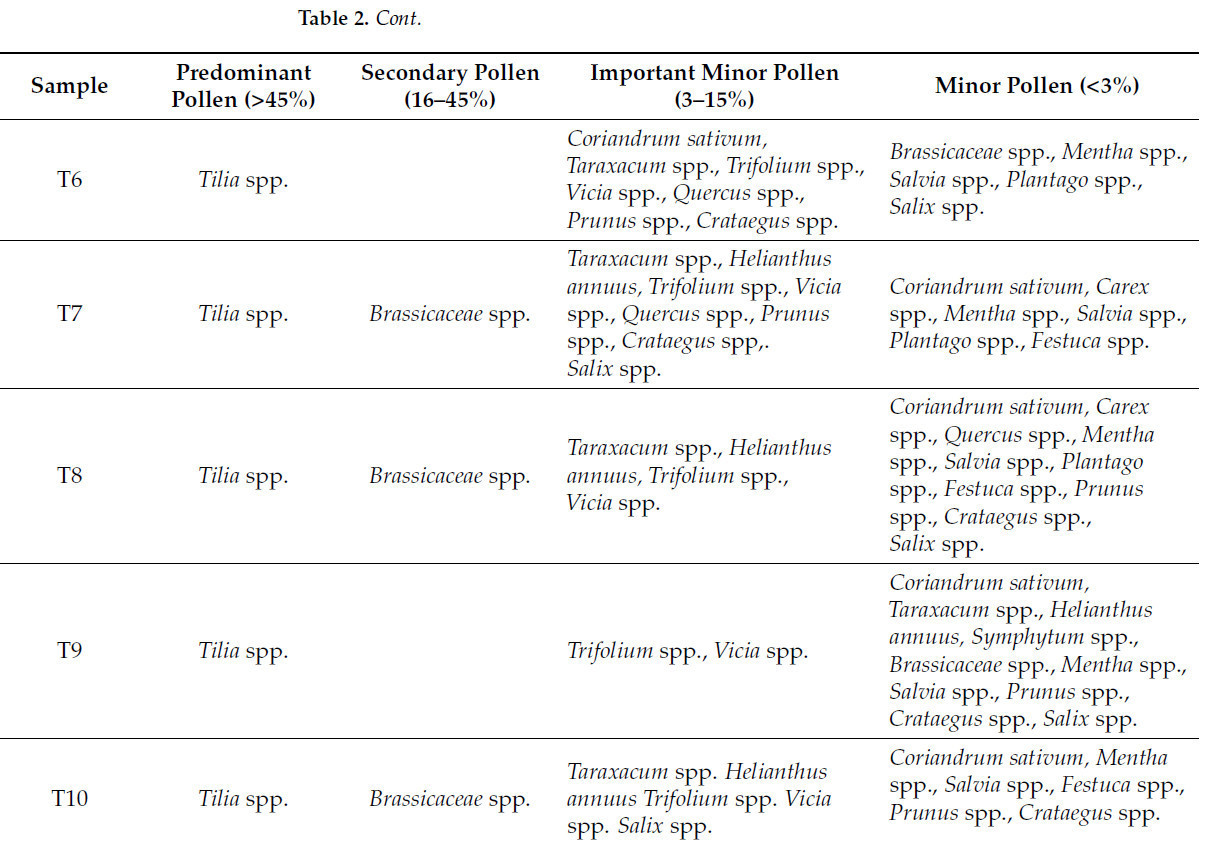
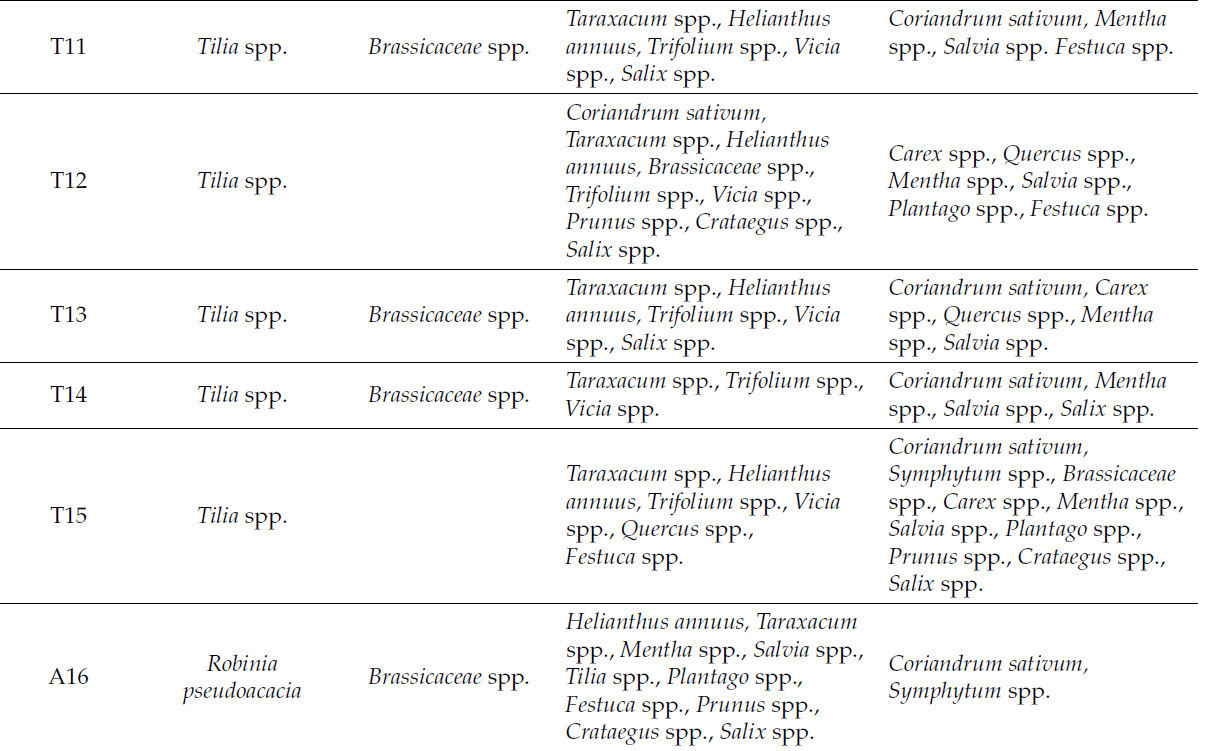
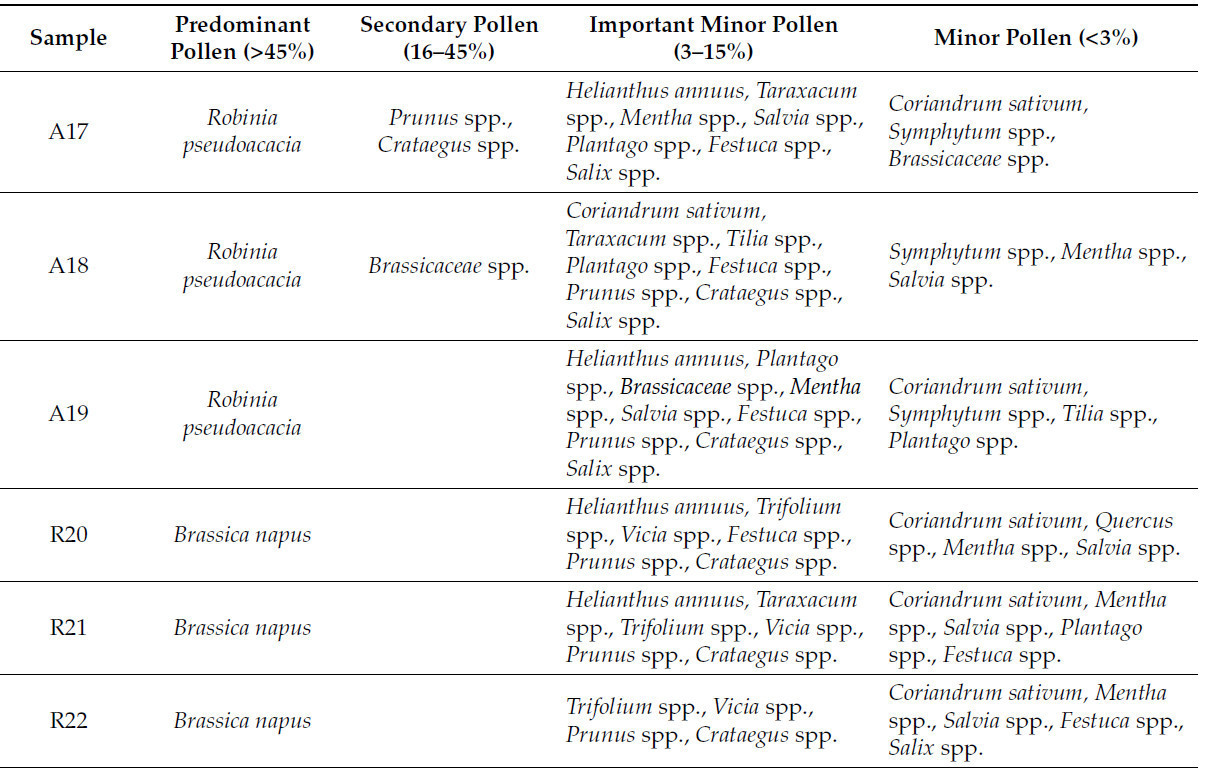
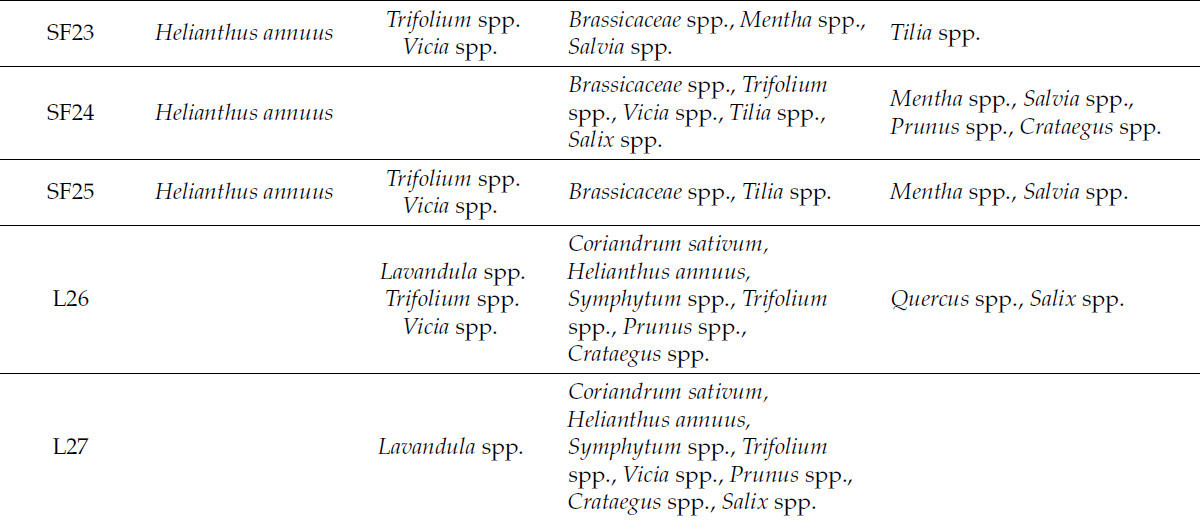
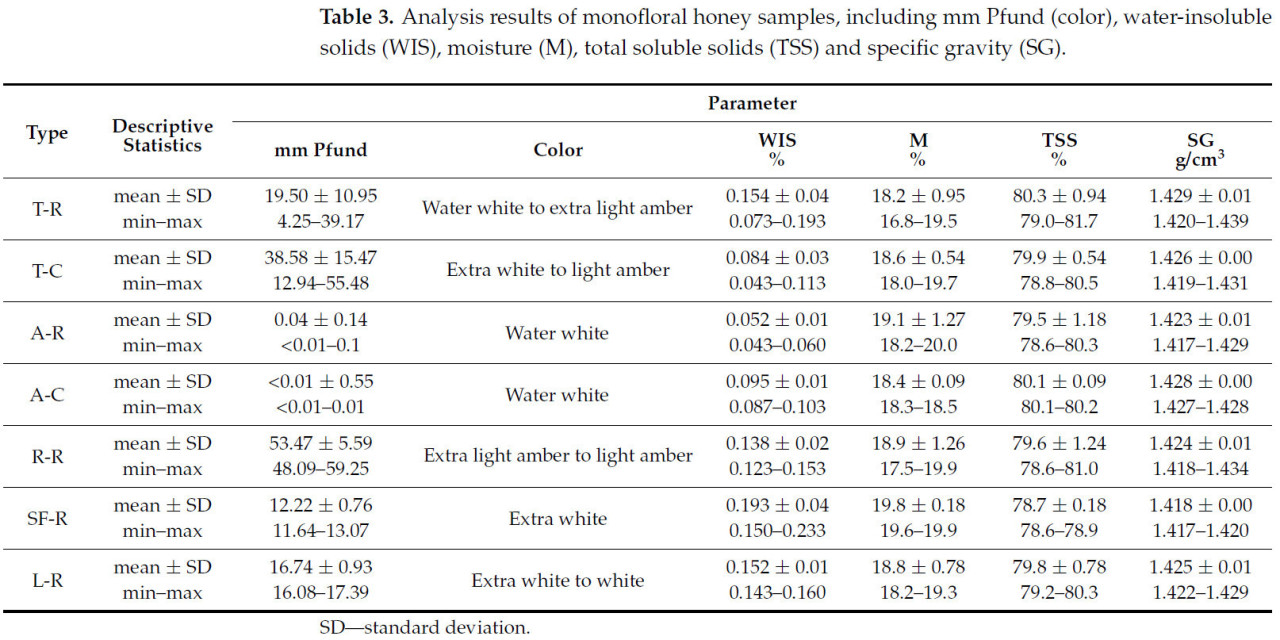
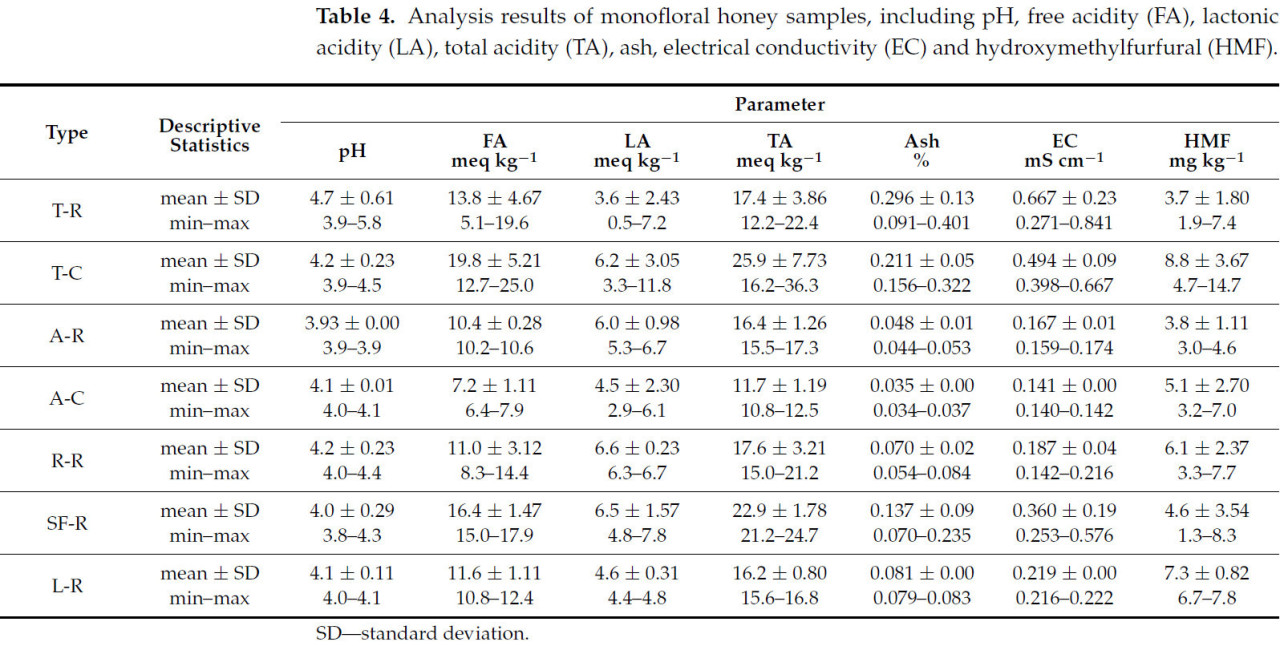
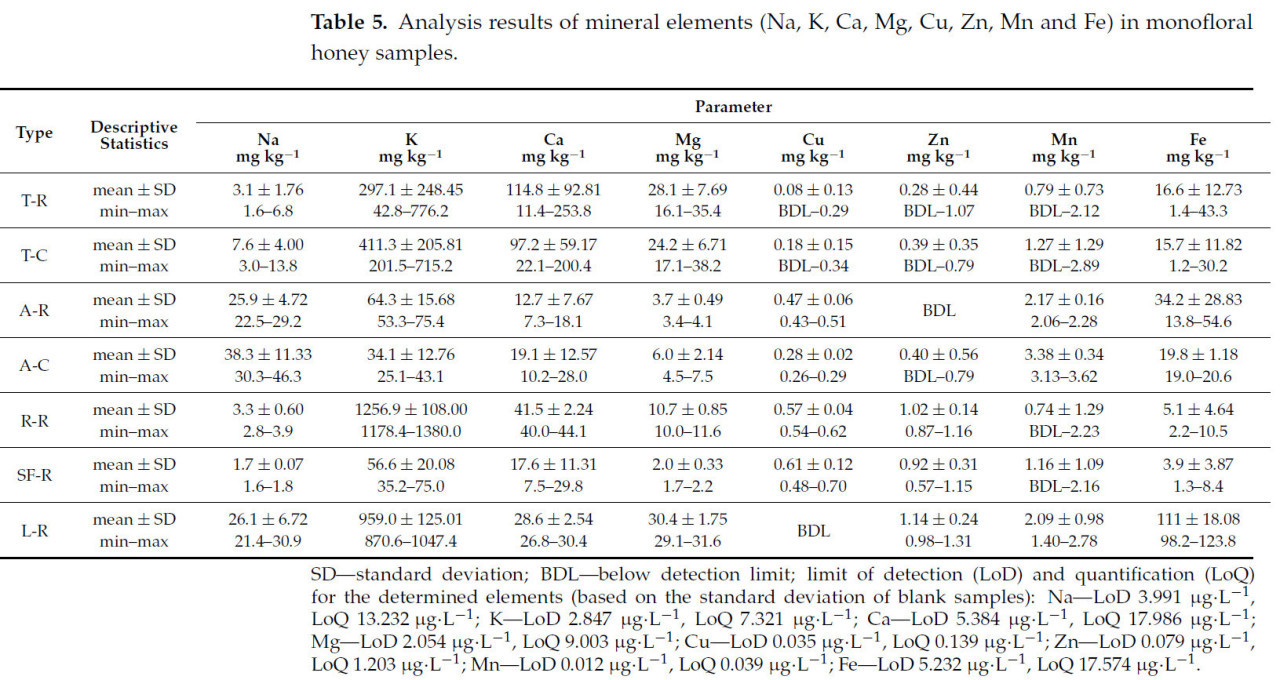
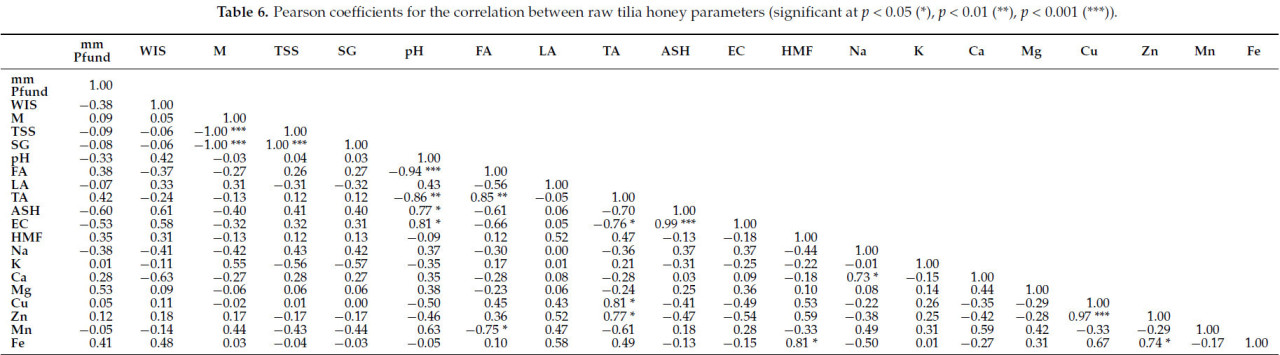
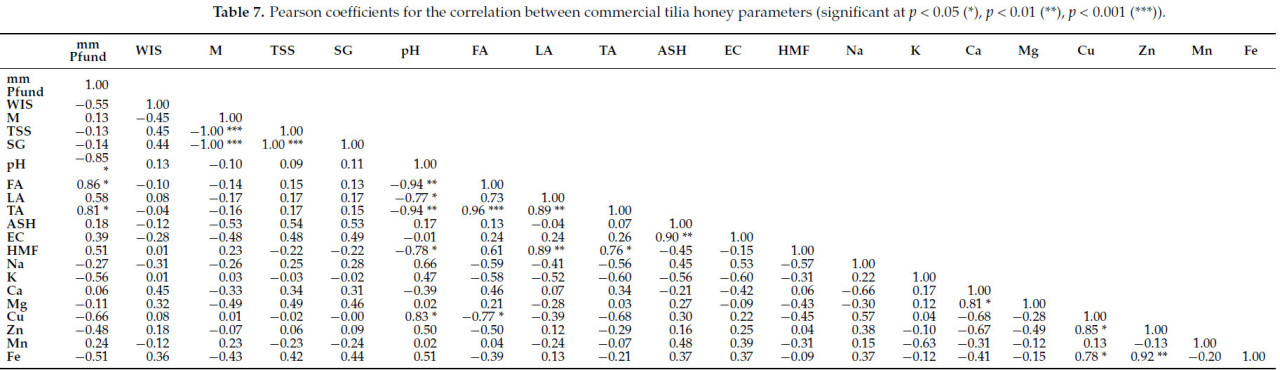
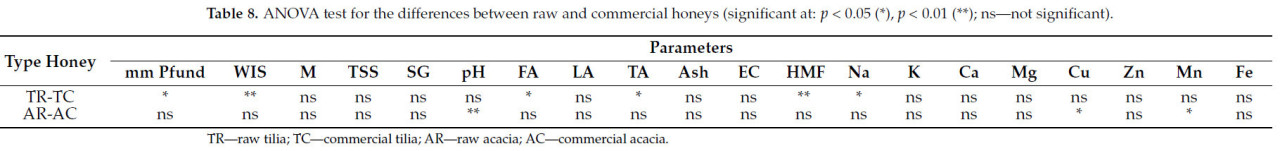
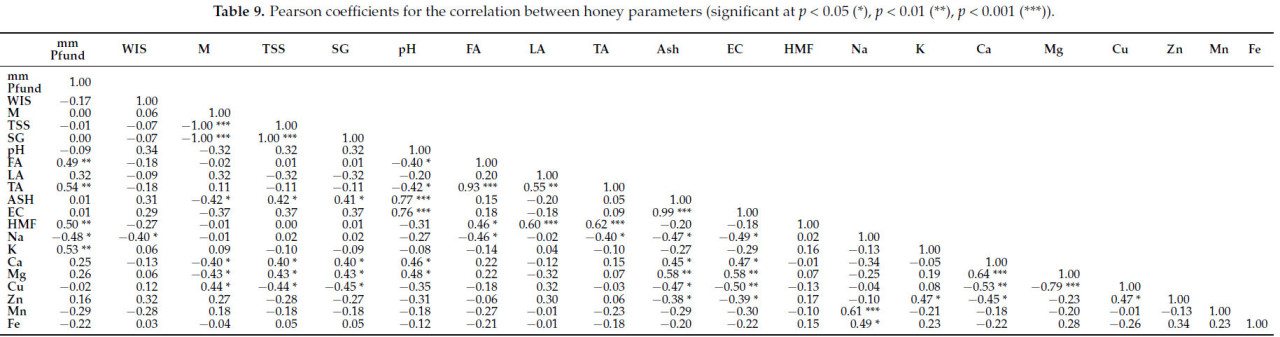
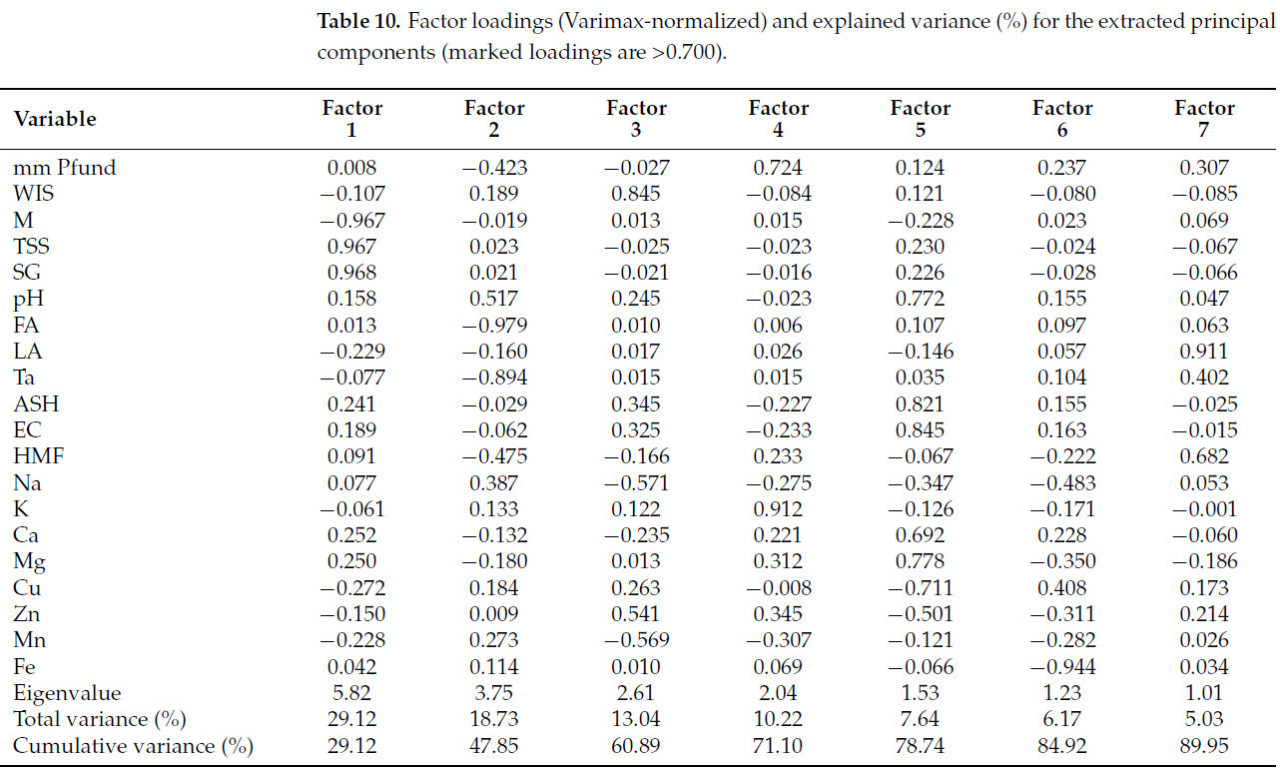
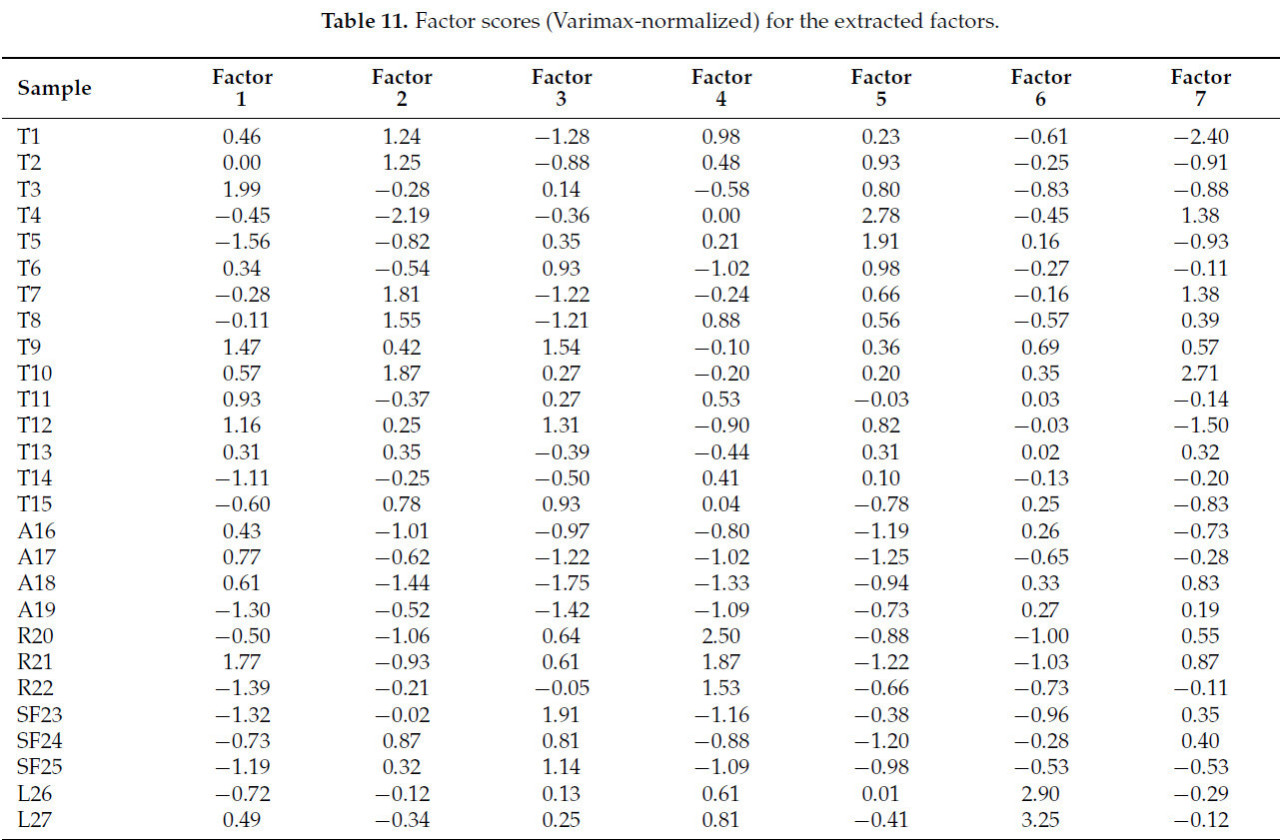
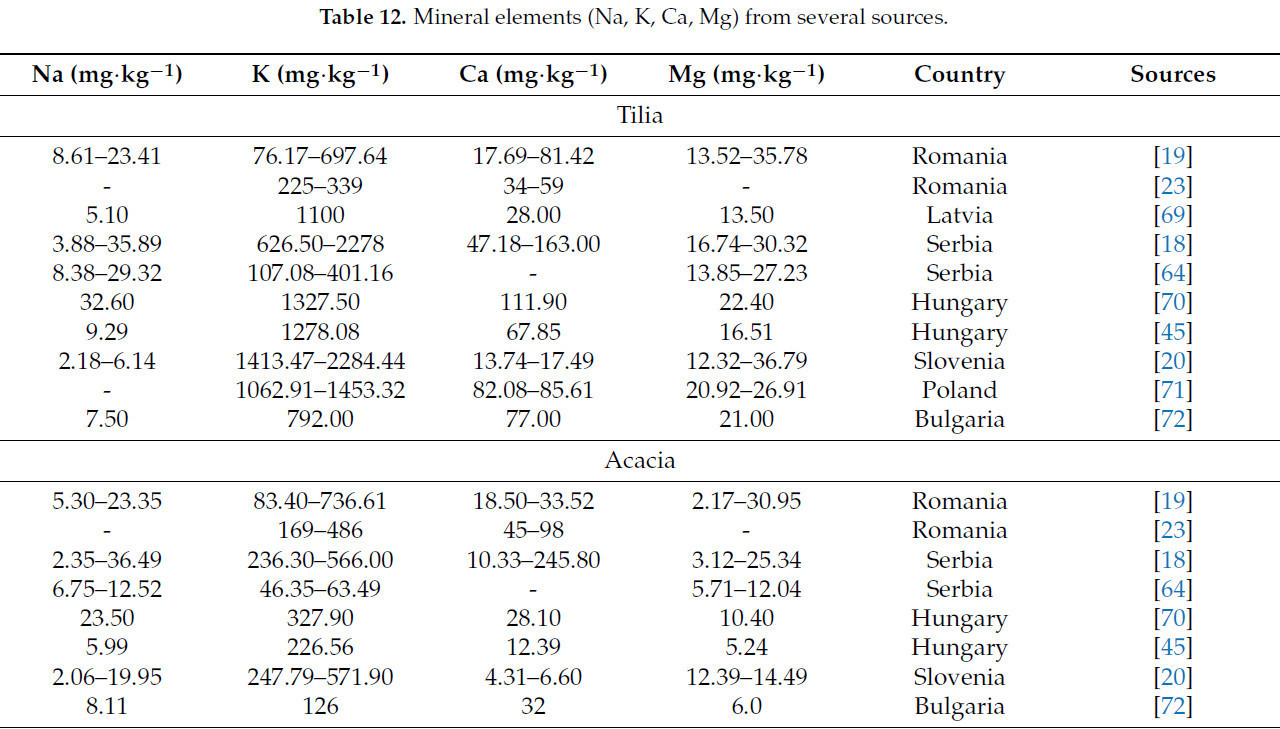
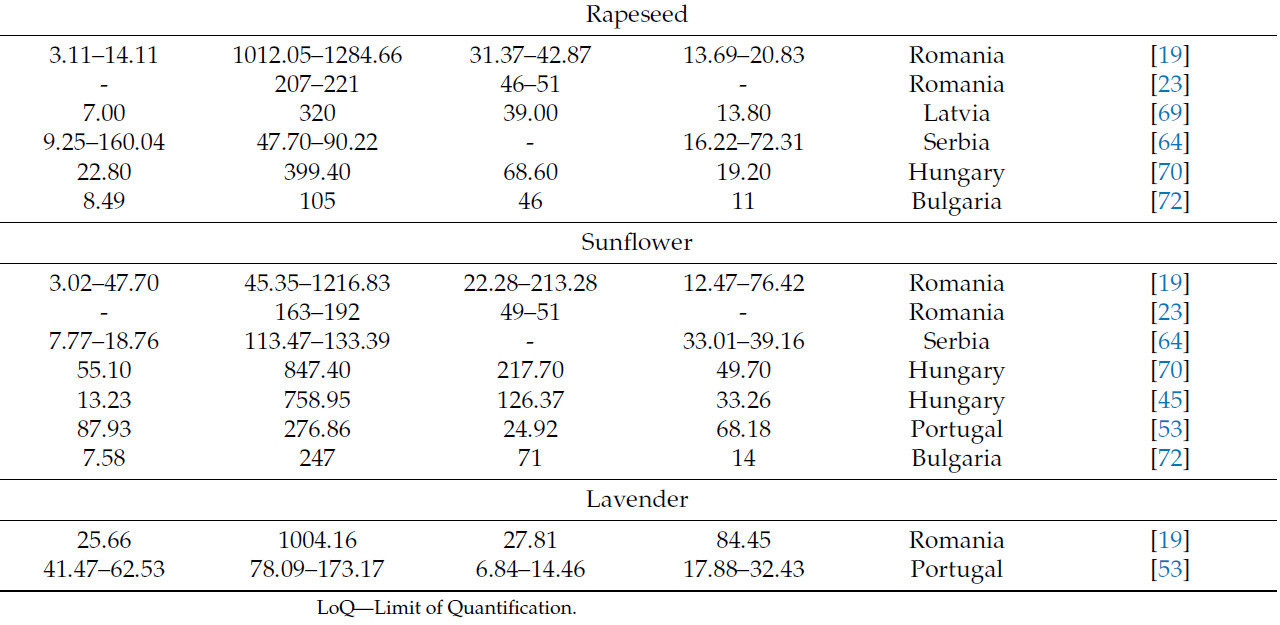
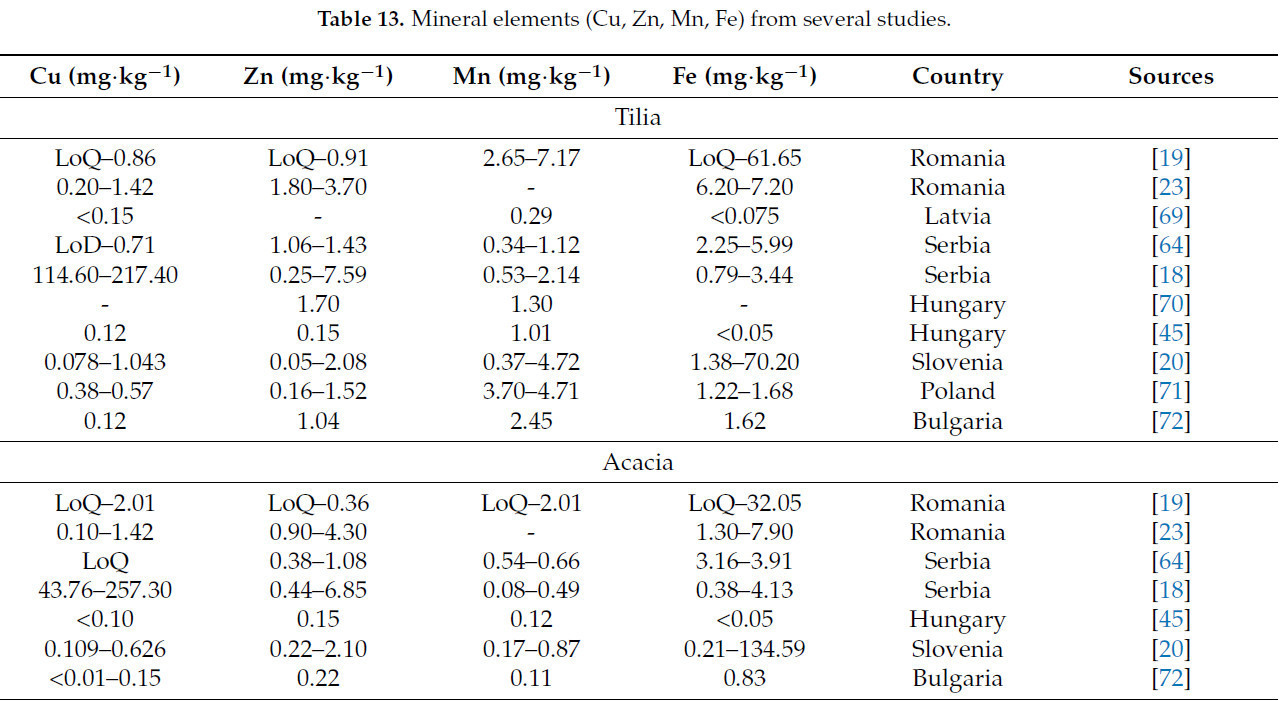
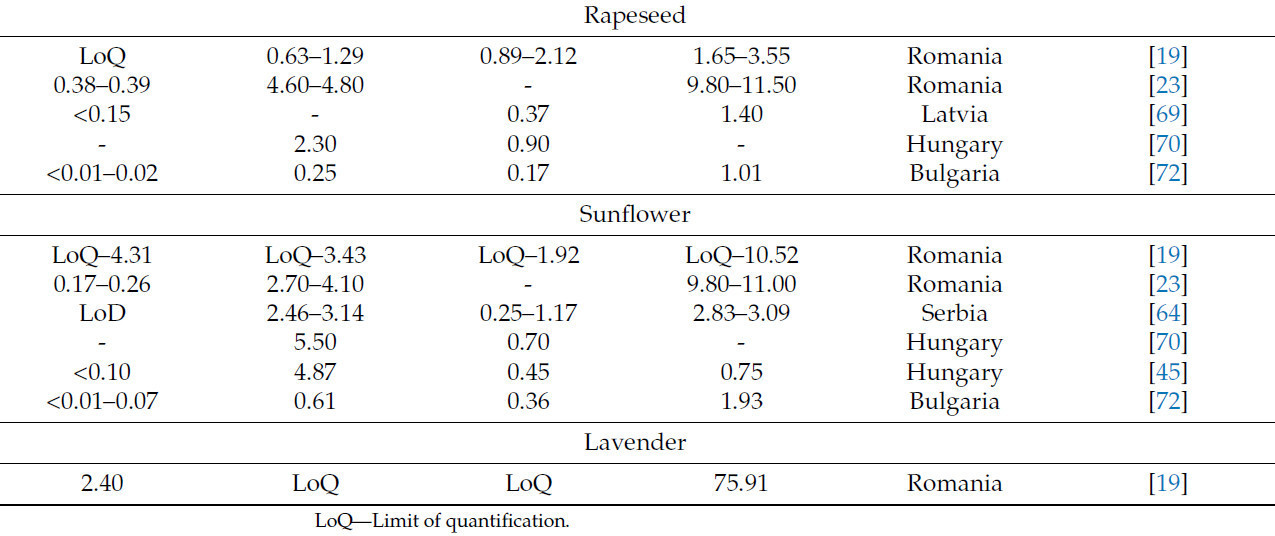





























































































Комментарии (0)