Микропластик в почве: обзор источников, путей миграции и воздействия на экосистему
Риски, которые микропластик (MPs) представляет для структуры сельскохозяйственных почв и роста культур в агросистемах, являются предметом глобальных дискуссий. MPs попадает в почву различными путями, такими как использование сельхозмульчирующей пленки и атмосферные осадки. В данном обзоре представлены результаты исследований загрязнения почв MPs за последние 30 лет.
Аннотация
Основное внимание уделяется: (i) источникам, типам и характеристикам распределения MPs в сельскохозяйственных почвах; (ii) миграции и трансформации MPs, а также их взаимодействию с микроорганизмами, органическим веществом и загрязнителями в сельскохозяйственных почвах; и (iii) влиянию факторов окружающей среды на состав и структуру MPs в сельскохозяйственных почвах. В данном обзоре также предлагаются ключевые направления для будущих исследований и управления MPs в сельскохозяйственных почвах. Мы стремимся предоставить теоретическую основу для точного управления сельскохозяйственными угодьями.
1. Введение
Микропластик (MPs) — это частицы, размер которых хотя бы в одном измерении меньше 5 мм [1,2,3], в то время как нанопластик обычно относят к пластиковым частицам размером менее 100 нм [4]. Результаты многих исследований показывают, что количество MPs, остающихся в почве, прямо пропорционально продолжительности мульчирования пластиковой пленкой [5,6]. Хотя нанопластик также широко присутствует в почве, данный обзор фокусируется на MPs [7]. Например, средняя концентрация MPs в хлопковых полях провинции Синьцзян составила 80,30 ± 49,30 и 308,00 ± 138,10 частиц/кг сухой массы (сух. м.) почвы на сельхозугодьях с 5 и 24 годами пленочного мульчирования соответственно [8]. Годовой сброс MPs в почву через очистные сооружения в Европе оценивался в диапазоне от 63 000 до 430 000 тонн, тогда как оценка для Северной Америки колебалась от 44 000 до 300 000 тонн [9,10]. Большинство предыдущих исследований MPs были сосредоточены на водных объектах, таких как океаны, озера и реки [8,11]. Было обнаружено, что количество MPs в почве более чем в четыре раза превышает таковое в океане [12,13]. Однако загрязнению почвы MPs исследователи уделяли гораздо меньше внимания [8]. Поэтому крайне важно охарактеризовать MPs в почве и предложить соответствующие технологии обработки.
Имея большое отношение площади поверхности к объему и высокую гидрофобность, MPs могут адсорбировать множество гидрофобных органических загрязнителей, тяжелых металлов и других сложных загрязняющих веществ [14]. После попадания в организмы в почве MPs могут угрожать их выживанию и развитию. MPs также могут поглощаться человеком через пищевую цепь, создавая потенциальные риски для здоровья человека [15]. Несмотря на потенциальные риски MPs на сельхозугодьях, исследования показали, что микроорганизмы в ризосфере растений могут использовать сополимер гидрокси-валерата (PHBV, тип биоразлагаемого MPs) в качестве источника углерода, тем самым способствуя своему росту и развитию [16]. Наличие PHBV также изменило структуру бактериальных колоний на разных таксономических уровнях [16]. Следовательно, биоразлагаемые пластмассы обладают потенциалом для оптимизации экологической функции почвы и биогеохимического цикла углерода и других питательных веществ за счет стимулирования активности функциональных микробных ферментов в ризосфере сельскохозяйственных культур [17]. Таким образом, воздействие MPs на агроэкосистему не является полностью отрицательным. Для оценки влияния сложных эффектов MPs с другими загрязнителями и микроорганизмами в почвенной экосистеме необходимы более комплексные исследования.
В настоящее время международное сообщество поставило цель по обработке пластиковых отходов на уровне 35% переработки к 2050 году [18]. ЕС запускает «Стратегию по пластику», направленную на сокращение использования одноразовых пластиковых пакетов и создание новой циркулярной экономики [19]. Была создана программа «Биотехнологические инновации в восстановлении окружающей среды» (CE-Biotec-05-2019) для установления биотехнологий биодеградации трудноразлагаемых и разлагаемых пластиков. Закон Китая о предотвращении и контроле загрязнения почв, обнародованный 31 августа 2018 года, предлагает усилить переработку и повторное использование отходов сельскохозяйственной пленки [20]. Дополнительно, усилия по очистке остаточной мульчирующей пленки и пластиковой упаковки пестицидов и удобрений, а также политические корректирующие меры должны продвигаться для постепенного сокращения количества пластиковых отходов на сельхозугодьях.
В этом обзоре обобщены глобальные исследования по MPs в сельскохозяйственных почвах за последние 30 лет с точки зрения анализа источников, состояния загрязнения, характеристик распределения, миграции и трансформации, а также технологий обработки. В дальнейшем предлагаются ключевые направления исследований для создания теоретической основы и руководства будущими исследованиями влияния MPs на почвенные экосистемы.
2. Экологическая характеристика микропластика в сельскохозяйственных почвах
2.1. Поиск и отбор литературы
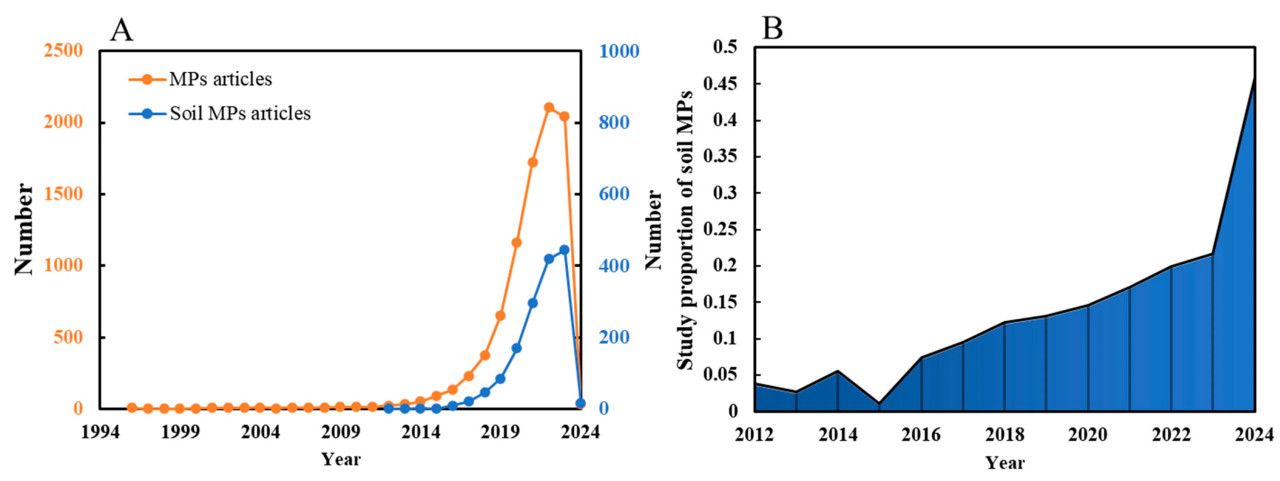
В базе данных Web of Science Core Collection мы использовали условие «TS = (microplastic)», чтобы найти исследования по микропластику, и сузили область поиска условием «(TS = ((soil) или (land) или (farmland))) И TS = (microplastic)», чтобы сосредоточиться на исследованиях MPs в почве. Было получено в общей сложности 8839 статей, связанных с микропластиком, и в общей сложности 1520 статей по микропластику в почве. Годовое количество опубликованных статей о MPs и MPs в почве представлено на Рисунке 1A. Исследования по MPs начались в 2013 году и постепенно стали исследовательским хот-спотом в последние годы. Рисунок 1B показывает долю исследований по MPs в почве по отношению к общим исследованиям по MPs, что показывает растущее внимание к MPs в почве.
Рисунок 1. Количество статей по MPs и почвенным MPs, опубликованных с 1995 по 2024 год ((A) количество статей по MPs и количество статей по почвенным MPs; и (B) доля почвенных MPs в исследованиях по MPs).
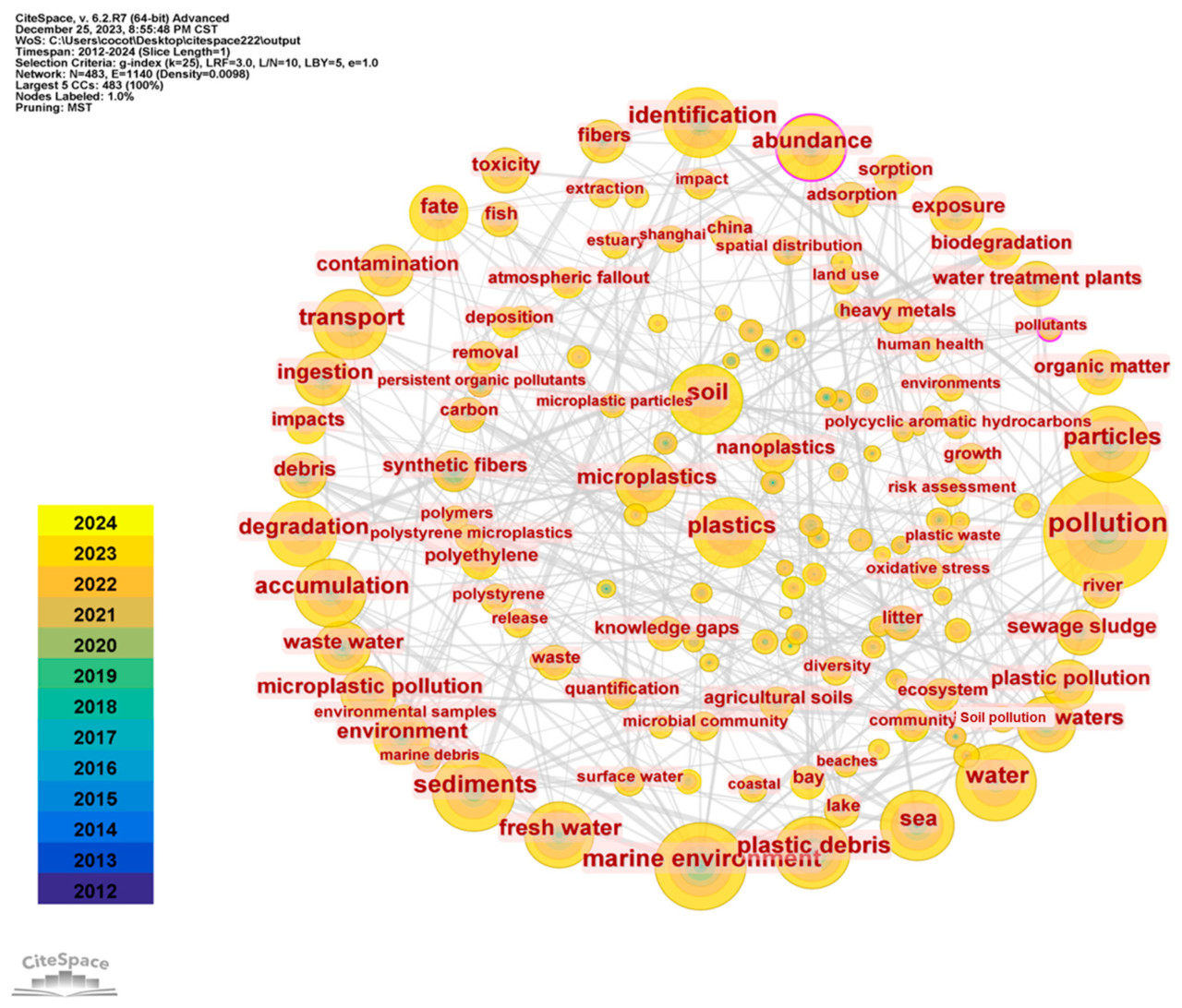
Дополнительно, отобранные публикации были подвергнуты анализу со-встречаемости ключевых слов с использованием программного обеспечения CiteSpace 6.2 R7 (Рисунок 2). Наиболее часто встречающимися ключевыми словами были определены: загрязнение, морская среда, осадки, частицы, вода, накопление, пластмассы, идентификация, почва и транспорт. Этот анализ подчеркивает сложный характер и широкое влияние MPs как на морскую, так и на наземную среду.
Рисунок 2. Анализ со-встречаемости ключевых слов в исследованиях по почвенному микропластику с 2012 по 2024 год. Размер узлов и шрифтов связан с количеством совместных вхождений.
Анализ со-встречаемости ключевых слов показывает основные направления и тенденции в исследованиях MPs в почве. Исследователи обычно сосредотачиваются на воздействии MPs на качество почвы и экосистемы, а также на источниках, поведении и методах идентификации MPs в почве. Дополнительно, внимание направлено на накопление и воздействие MPs в морской среде, а также на пути их попадания в почву, например, через осадки или водные объекты.
Важно определить влияние MPs на почвенную экосистему и внедрить соответствующие управленческие меры для здоровья окружающей среды и человека.
2.2. Источники и типы микропластика в сельскохозяйственных почвах
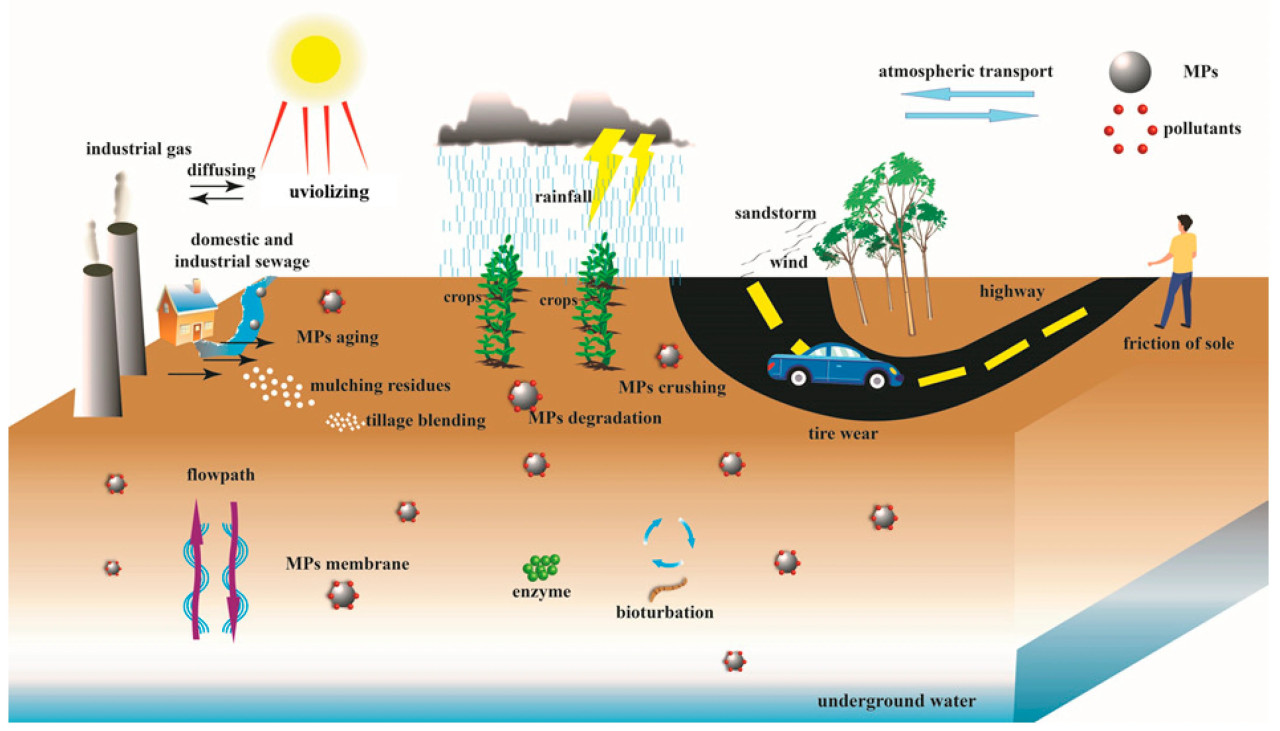
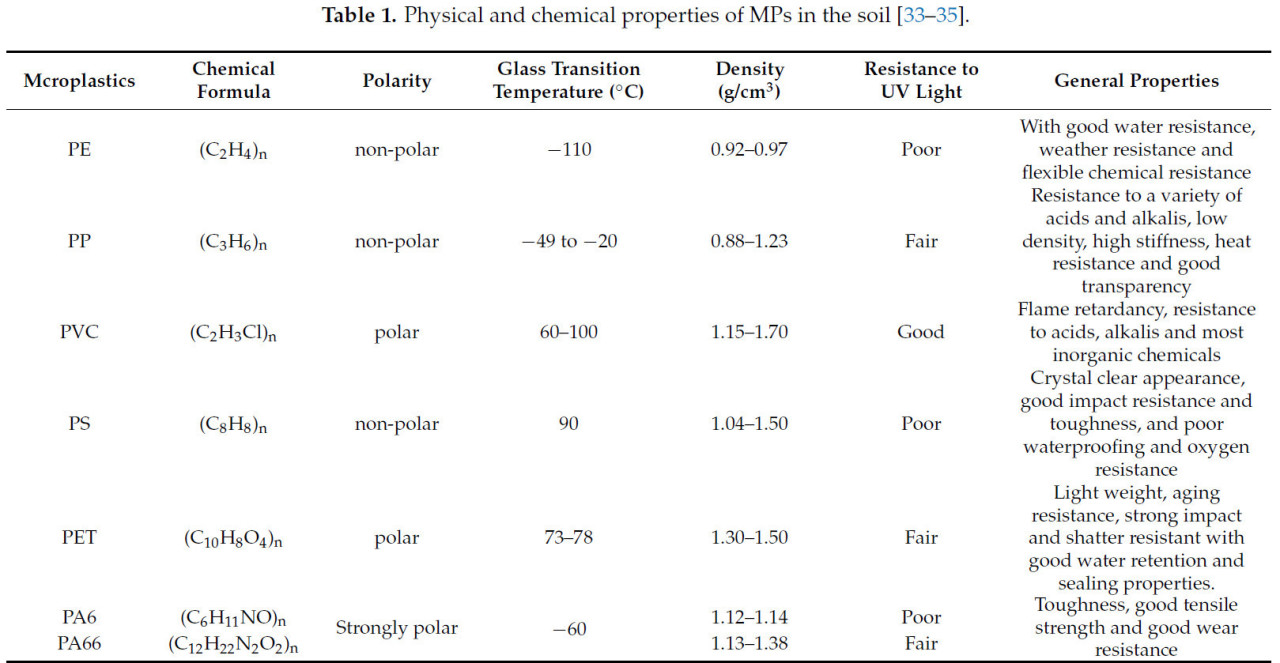
Основными источниками пластика наземного происхождения являются пластиковые теплицы, используемые в сельскохозяйственном производстве, пластиковая мульча, непосредственно применяемая на сельхозугодьях, рассеивание пластика бытового использования (включая добавки в средствах личной гигиены, стиральных машинах и износ шин, высвобождающих пластиковые частицы), осадок сточных вод, отложения выхлопных газов промышленного производства, наводнения и песчаные бури [21,22,23,24,25] (Рисунок 3). Эти пластмассы стали важными источниками MPs в почве из-за их низкой степени извлечения и подверженности старению и фрагментации при нахождении в окружающей среде. По составу MPs в основном состоят из полиэтилена (PE), полипропилена (PP), полистирола (PS), полиэтилентерефталата (PET) и поливинилхлорида (PVC). Физические и химические характеристики пластиков, часто встречающихся в почве, представлены в Таблице 1. Сельскохозяйственные пленки в основном представляют собой материалы PE и PVC [26]. Пластик PE и PVC чаще всего используется в сельскохозяйственной практике. Пленка PE способна поддерживать постоянную температуру и стабильную влажность почвы, отпугивать вредителей и подавлять возникновение болезней. В то же время пластик PVC обычно используется в системах капельного орошения в сельском хозяйстве [27,28]. По происхождению MPs можно разделить на первичные и вторичные [26,29,30]. Первичные MPs в основном происходят от такой деятельности, как стирка, использование косметики и сброс медицинских отходов. Другими словами, чистящие средства, косметика, солнцезащитный крем, шампунь и т.д., используемые в нашей повседневной жизни, являются потенциальными источниками MPs [31]. Вторичные MPs — это более мелкие пластиковые фрагменты, образующиеся в результате физических, химических и биодеградационных процессов крупных пластиковых фрагментов [31,32].
Рисунок 3. Основные источники и миграция MPs в почве.
Таблица 1. Физические и химические свойства MPs в почве [33,34,35].
Пластиковая мульча является эффективной сельскохозяйственной практикой, которая регулирует температуру почвы, поддерживает влажность почвы, предотвращает рост сорняков и эрозию почвы, а также повышает урожайность культур [36,37]. Потребление пластиковой пленки растет в геометрической прогрессии, с глобальной долей более 3,9 миллиона тонн, и оно в основном сосредоточено в Азии (около 70%) и Европе (около 16%), причем крупнейшей страной-потребителем является Китай [38,39]. В 2017 году общий объем сельскохозяйственной пластиковой пленки в Китае достиг 2 миллионов тонн, что составило 90% от общемирового объема [38,39]. Использование сельскохозяйственной пластиковой пленки в Китае увеличивалось на 30% ежегодно с 1991 по 2001 год и увеличилось с 1,85 × 10^6 тонн до 2,6 × 10^6 тонн (на 41%) с 2006 по 2015 год [40]. Диапазон содержания остаточной пленки в почве Синьцзяна составляет от 0 до 502 кг/га (в среднем 121,5 кг/га) [41]. Среднее количество остаточной мульчирующей пленки превышало 100 кг/га в большинстве регионов провинции Ганьсу, восточной Внутренней Монголии и северо-восточных районах, где преобладают песчаные почвы [42]. В этих районах мульча используется для уменьшения испарения воды из-за низкого количества осадков и высокого испарения. У фермеров невысокий уровень осведомленности о вреде загрязнения остаточной пленкой. Толщина пленки PE, производимой многими предприятиями Китая, ниже национального стандарта 0,008 мм, что приводит к низкой прочности и легкой ломкости [43]. Предполагается, что мульча будет удаляться с поля по окончании сельскохозяйственного периода. Однако собирается лишь небольшая часть мульчирующего пластика. Например, в Европейском союзе ежегодно используется 100 000 тонн пластика для мульчирования, но по окончании сельскохозяйственного периода собирается только 32% от этого количества, а остальное сжигается или закапывается в почву [44].
Сброс сточных вод и осадка также является одним из важных источников MPs в почвенной среде во всем мире. Например, Тагг и др. обнаружили концентрацию MPs 14,6 г/л в немецкой почве, что было связано с высоким содержанием MPs в осадке сточных вод [45]. Согласно обследованию в Норвегии, 500 миллиардов MPs ежегодно попадали в окружающую среду через осадок с очистных сооружений [46]. Более того, 32,4% MPs с канадских очистных сооружений предположительно попадали в почвенную экосистему [47].
2.3. Распределение микропластика в сельскохозяйственных почвах
Большие количества MPs были обнаружены в почвах по всему миру. В Швейцарии около 90% почв в пойменных районах содержали MPs с максимальной концентрацией 593 г/кг [24]. Среднее содержание MPs в почве на промышленных площадках в Австралии составляло 23 г/кг сух. м. [48]. MPs в донных отложениях реки Коси (типичной альпийской реки в Гималаях на границе Китая и Индонезии) были обратно пропорциональны высоте, с диапазоном концентраций от 31 до 85 шт./кг сухого веса [49]. Обилие MPs на берегу было в два раза выше, чем в центре реки [50]. В засушливых и полузасушливых районах относительно большие количества MPs наблюдались в почвах вблизи водосборов, а также промышленных и сельскохозяйственных объектов [51].
MPs в почве мигрируют посредством различных процессов, включая выщелачивание, биотурбацию и механическое возмущение [52]. Несколько исследований показали, что поля зерновых культур (таких как пшеница и рис) содержат большую долю крупных (1–5 мм) волокнистых MPs, в то время как лесные угодья (например, сады и леса) содержали большую долю MPs меньшего размера (0,02–0,2 мм) [30]. Биологические процессы способствовали горизонтальному и вертикальному перераспределению MPs в почве. В этих процессах MPs могут поглощаться и селективно выделяться почвенными простейшими, такими как дождевые черви и коллемболы [53,54]. Поровое строение почвы и деятельность почвенных организмов, таких как дождевые черви, помогают MPs мигрировать вглубь земли и даже достигать уровня грунтовых вод [53,55]. Исследование Чой и др. показало, что концентрация MPs в почвах сельхозугодий варьировала в зависимости от типа обработки почвы, с наибольшим количеством в садах, затем в теплицах на богарных землях и на рисовых полях. Вероятно, это связано с использованием сельскохозяйственной пленки и инструментов, поскольку сады, как правило, имеют меньше стока и эрозии почвы, но больше физических нарушений, чем другие сельскохозяйственные земли (например, обработка почвы и перемешивание) [56,57].
3. Миграция и воздействие микропластика в сельскохозяйственных почвах
3.1. Миграция микропластика в сельскохозяйственных почвах
Частицы MPs на поверхности почвы могут попадать под землю в результате деятельности человека. Методы обработки почвы влияют на распределение MPs в почвенном слое [58]. Традиционная обработка почвы способствует переносу MPs в глубокий слой почвы, в то время как мелкая обработка, ротационная обработка и боронование приводят к миграции MPs в обрабатываемый слой [58]. Миграция MPs в почве зависит от электролитов, pH, гуминовой кислоты и т.д. [59,60,61]. Катионы с меньшими ионными радиусами имеют большие гидратные радиусы, что снижает эффект экранирования заряда и стерического препятствования осадку и уменьшает удержание MPs в пористой среде; то есть эффективность миграции MPs увеличивается [50,60,62]. Взаимодействие MPs с растворенным органическим веществом (DOM) в почве также неизбежно влияет на миграцию MPs различными способами и усложняет экологические характеристики MPs [63]. В почве насыщенный гетит (GT), DOM и нанопластик (50 нм) могут образовывать нанокомпозит GT-DOM, что приводит к совместному осадку нанопластика и DOM и блокирует миграцию нанопластика [64]. Когда pH почвенного раствора близок к нейтральному, MPs взаимодействуют с фульвокислотой (FA) через H-связь и n-π EDA (донор/акцептор электронов), что способствует подвижности MPs в почве [65]. Поверхностная морфология и структурные характеристики MPs претерпевают изменения при старении. Например, после старения под ультрафиолетом MPs проявляют хрупкость, неправильную форму, увеличенную шероховатость и изменение поверхностной гидрофобности, что, следовательно, влияет на адсорбцию, миграцию и микробную колонизацию в почве [66]. Процесс старения обычно сопровождается химическими реакциями, приводящими к образованию кислородсодержащих групп, таких как –OH, –C=O, COOH и C=C, на поверхности MPs [67]. Дополнительно, молекулярная масса полимера также претерпевает изменения во время старения. Например, после обработки O3 средняя молекулярная масса PS уменьшается с 24,8 кг/моль до 18,4 кг/моль, в то время как средневесовая молекулярная масса PS уменьшается с 168,1 кг/моль до 121,2 кг/моль [68]. В настоящее время значения CI и O/C часто используются для оценки степени старения MPs. CI относится к отношению поглощения карбонильного пика к опорному пику в спектре FTIR, тогда как O/C представляет собой отношение кислорода к углероду на поверхности полимера, охарактеризованное методом рентгеновской фотоэлектронной спектроскопии (XPS). Следовательно, миграция MPs также тесно связана с этими гидрофильными тяжелыми металлами. Наличие гуминовых кислот и гетерогенность функциональных групп на поверхности ограничивают транспорт MPs [69]. MPs в почве в основном мигрируют с ветровой эрозией, поверхностным стоком, биологическими процессами и сельскохозяйственной деятельностью (Yu et al. 2019). Биологические процессы могут ускорять как горизонтальную, так и вертикальную миграцию MPs в почве. Глубина нор дождевых червей (Lumbricus terrestris) может составлять более 30 см, что является потенциальным путем проникновения MPs в глубокий слой почвы с преимущественным потоком [70,71,72].
Сильные дожди, высокая температура, интенсивное ультрафиолетовое излучение и ветреная погода делают остатки пластика более хрупкими и трудными для утилизации из почв сельхозугодий. Регионы с высокой температурой могут столкнуться с большой угрозой со стороны MPs. MPs на сельхозугодьях острова Хайнань, Китай, варьировались от 2800 до 82 500 частиц/кг и показали значительную положительную корреляцию с температурой [73]. Распределение MPs в почве сельхозугодий также зависит от многих факторов, таких как гранулометрический состав почвы, срок посадки и методы орошения. Гранулометрический состав почвы влияет на миграцию и накопление MPs в почве, что связано с распределением и непрерывностью почвенных пор. Грубая почва проявляет быструю скорость проникновения; то есть мелкозернистая почва способствует удержанию воды [74,75,76,77]. Концентрация MPs в супесчаной почве была значительно выше, чем в суглинистой или глинистой почве согласно международному классификационному стандарту [78]. Длительное применение мульчи и орошение во время сельскохозяйственной практики могут вызывать накопление MPs в почве [11]. Несколько исследований показали, что методы орошения также могут влиять на накопление MPs в почве. Поверхностное дождевание имеет самый низкий коэффициент использования воды, за ним следуют дождевание и капельное орошение [79]. В результате мы предположили, что поступление MPs в почву через орошение представлено в возрастающем порядке следующим образом: поверхностное орошение, дождевание и капельное орошение.
Различные типы пластмасс проявляют различные функциональные группы и полярности, влияя на их адсорбционное поведение в почве. Например, PS проявлял заметно сильную адсорбционную способность к толуолу из-за сильного π-π взаимодействия между ними [80]. Аналогично, PA, содержащая амидную группу (группу донора протонов), может образовывать водородные связи с карбонильной группой (группой акцептора протонов), тем самым усиливая адсорбцию PA к органическому веществу [34]. Следовательно, адсорбционная способность PA к гормонам, лекарствам, пестицидам и другим органическим веществам превосходит таковую у PE [81]. Неполярные пластмассы, такие как PE, PP и PS, демонстрируют значительную гидрофобность, проявляя, таким образом, более сильную адсорбционную способность к гидрофобным органическим веществам, таким как 17β-эстрадиол, по сравнению с полярными пластмассами [82].
3.2. Влияние микропластика на сельскохозяйственные экосистемы
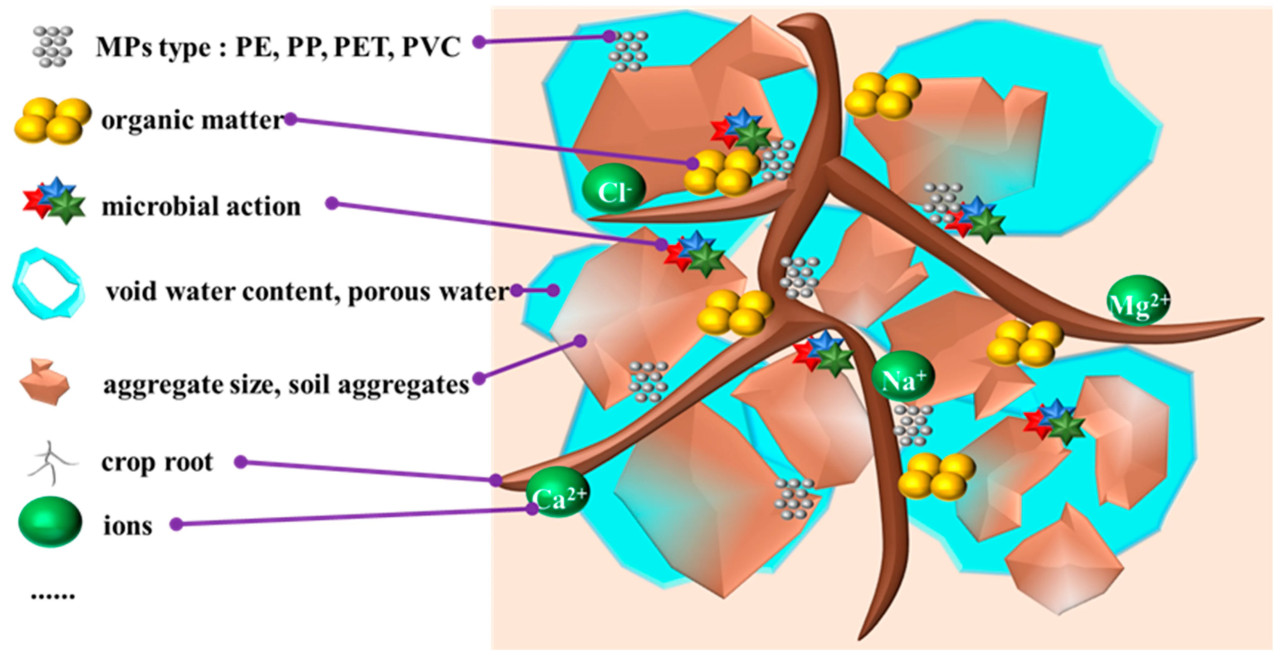
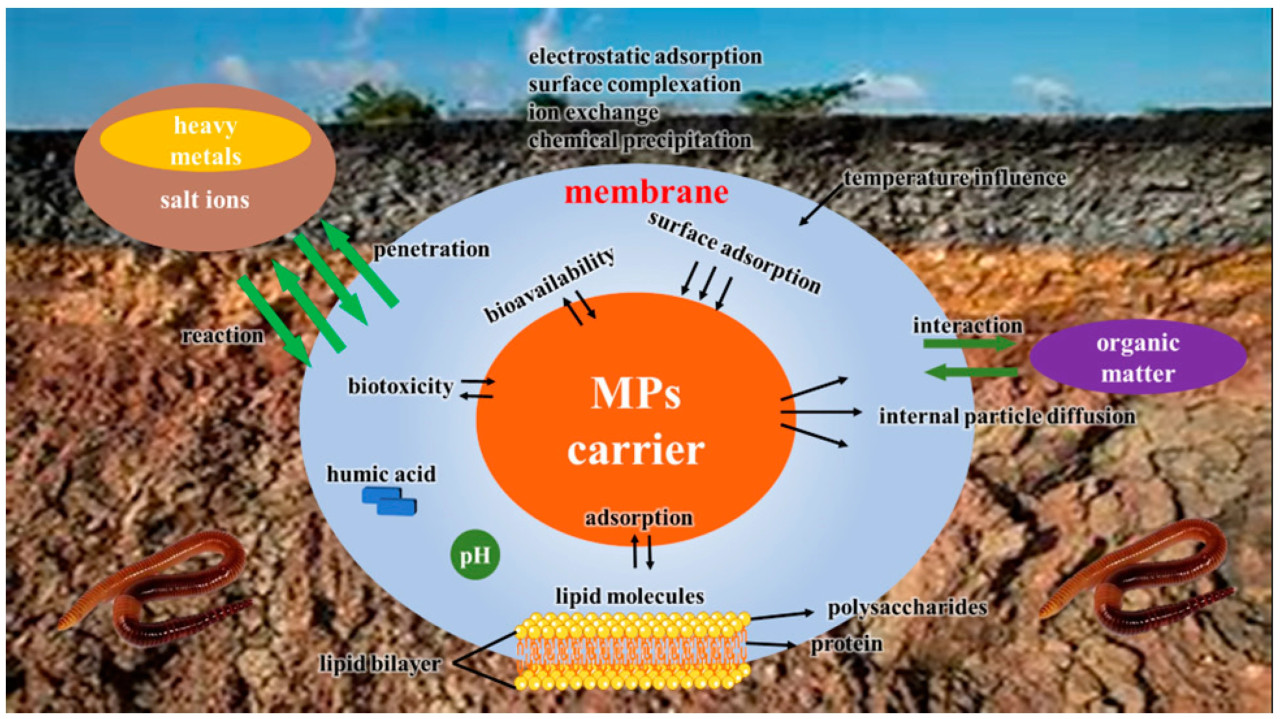
Остатки мульчи, включая MPs, снижают проницаемость почвы, ингибируют поглощение воды и питательных веществ корнями и подавляют активность почвенных микроорганизмов, таким образом негативно влияя на урожайность и качество культур и устойчивость почвы [83] (Рисунок 4). Например, годовой весовой коэффициент остатка мульчи (весовое отношение остатка мульчи к общему количеству примененной мульчи) в орошаемом районе Хэтао в бассейне реки Хуанхэ достигал 38,10% [84]. MPs могут разрушать почвенные агрегаты, что критически важно для проникновения воды, удержания влаги, аэрации и плодородия почвы [85,86,87,88,89]. Влияние MPs на растения в основном проявлялось в прямых эффектах на рост растений и корневые микробные сообщества. Корневые микроорганизмы-колонизаторы обычно включают азотфиксаторов, патогенов, микоризные грибы [90]. Симбионты корневой колонизации часто оказывают положительное влияние на разнообразие растений [91,92]. MPs изменяют структуру почвы, что влияет на микробные сообщества, далее влияя на скорость минерализации и симбионтов-колонизаторов и даже снижая разнообразие растений [93,94]. MPs в почве могут поглощаться корнями и транспортироваться в стебель и плод, причем транспирация является основной движущей силой [95]. MPs в воздухе также могут попадать в устьица листьев и затем переноситься через сосудистую систему в другие части растения [96,97]. Нанопластик с меньшим размером частиц был обнаружен в ядре, что предполагает риск для ядерной мембраны и функции хромосом [98,99]. Ухудшенное качество почвы под действием MPs также ограничивает пространство для корней и почвенной фауны, снижает аэробные процессы, важные для питания растений, и благоприятствует анаэробным микробным процессам, ведущим к образованию метана и закиси азота [100]. MPs обычно гидрофобны, инертны и устойчивы, и поэтому они относительно стабильны и сохраняются в окружающей среде в течение длительного времени [101]. Большинство MPs отрицательно заряжены, и катионы металлов в окружающей среде могут прикрепляться к MPs посредством электростатической связи [102]. В то же время MPs имеют большую площадь поверхности и сильную аффинность связывания, что позволяет им эффективно взаимодействовать с окружающими материалами. Эти окружающие вещества могут образовывать эко-короны и био-короны на поверхности пластика, и поверхностная корона может влиять на транспорт, поглощение, распределение, биотрансформацию и токсичность MPs [103]. Корона, образующаяся на поверхности MPs, может долго оставаться в почве и взаимодействовать с биологическими молекулами, такими как белки и липиды в организмах (Рисунок 5). Благодаря своему малому размеру MPs могут проникать в клетки или разрушать клеточную стенку организмов, накапливаться в организмах и приводить к цитотоксичности, влияя на выживание организмов [104,105,106].
Рисунок 4. Сложные взаимодействия корней растений и микропластика с другими веществами в почве. (Почвенные MPs взаимодействуют с корнями растений, органическим веществом и питательными веществами в почве).
Рисунок 5. Микроскопические взаимодействия микропластика с другими веществами в почве.
Вещества, высвобождаемые из MPs, такие как полиуретан, поливинилхлорид и сополимеры акрилат-бутадиен, также вызывают экологические риски для почвенной экосистемы [62]. Дополнительно, добавки (т.е. бисфенол А и фталаты), большинство из которых являются эндокринными разрушителями, обычно добавляются в процессе производства пластмасс [93]. Эти эндокринные разрушители окружающей среды, высвобождаемые из пластика, также представляют угрозу для экосистем и даже здоровья человека. MPs были обнаружены в кишечнике, легких, крови, мозге и грудном молоке человека [107,108]. MPs также могут быть способны проникать через клеточные мембраны, гемато-энцефалический барьер и плацентарный барьер млекопитающих [105,109]. Пластиковые гранулы размером 300 нм и 50 нм увеличивали накопление окситетрациклина (OTC) в печени данио-рерио на 33,8% и 44,5% соответственно [110]. Фактически, большинство соединений, добавляемых в пластмассы, таких как пластификаторы, стабилизаторы и пигменты, вредны для эндокринной системы [108,111]. Фрагментированный полиэфирный MPs в почвах, вероятно, адсорбирует органические химикаты и патогены [60,112], тогда как поликарбонатный MPs подвергается старению под воздействием УФ-излучения и истиранию, высвобождая мономерный бисфенол А и другие промежуточные продукты, такие как гидроксилированные, карбоксилированные и карбонилированные продукты [113,114,115].
MPs также могут мешать опылению местных продовольственных культур, влияя на экспрессию определенных генов опылителей, таких как пчелы [116]. Было показано, что влияние на экспрессию генов связано с окислительным повреждением, детоксикацией и иммунитетом [116]. Когда концентрация MPs высока, рост и размножение других почвенных организмов, таких как дождевые черви, сильно страдают [117]. MPs могут накапливаться в организме дождевых червей, влияя на иммунную систему и размножение червей, тем самым снижая плодородие почвы и подавляя рост растений [53,54]. MPs также могут переноситься вниз дождевыми червями и представлять большой риск для грунтовых вод [53,118,119]. MPs размером менее 0,1 мкм могут транспортироваться в листья, что может снижать содержание хлорофилла в листьях и биомассу растений [120]. MPs также могут накапливаться в корнях и приводить к снижению активности супероксиддисмутазы в корнях [120]. Фитотоксичность MPs также может задерживать прорастание семян, влиять на поглощение и миграцию MPs в стеблях и листьях, препятствовать росту растений, ингибировать фотосинтез, нарушать метаболизм питательных веществ, вызывать окислительное повреждение и производить генетическую токсичность [121].
Однако, помимо ущерба, причиняемого живым организмам, экологические эффекты MPs требуют комплексной оценки. Ян и др. изучили взаимодействие MPs с антибиотиком сульфаметазином (SMT) в сточных водах во время ультрафиолетового обеззараживания. Исследование показало, что фотосенсибилизация хинонов и ароматических структур в структуре MP-DOM ускоряла фотодеградацию SMT в определенном диапазоне концентраций [122]. Биодоступность загрязнителей может быть снижена за счет адсорбции на MPs, создавая «очищающий эффект» [123]. MPs могут уменьшать количество основных потребителей в почвенной экосистеме, благоприятствуя популяциям микроводорослей [124]. MPs также могут приносить пользу некоторым видам, таким как Halobates sericeus, выступая в качестве субстрата для микробного роста [125,126]. Ян и др. обнаружили, что MPs влияли на доступность фосфора в рисе и красной почве, дифференцируя микробные сообщества [127]. Ли и др. также обнаружили, что пластики PP, PE, PS, PES и PVC с концентрацией 1000~10 000 частиц/л способствовали денитрификации активного ила, а PVC ингибировал эмиссию N2O, производимого в процессе нитрификации [128]. Дальнейшие исследования необходимы для изучения влияния MPs на геохимический цикл азота и фосфора в почве. И необходимо участие специалистов с различным бэкграундом, таких как биологи, химики и экономисты, для полной оценки прямых и косвенных эффектов MPs в широком масштабе на экосистему и общество.
4. Биодеградация микропластика в сельскохозяйственных почвах
Как новый тип устойчивых органических загрязнителей, MPs, как правило, трудно поддаются деградации микроорганизмами в окружающей среде [129]. Однако большинство материалов мульчи, содержащих полиэтилен низкой плотности, устойчивы к деградации [3], а биоразлагаемые пластмассы не получили широкого распространения из-за их высокой стоимости [130,131]. Проводятся исследования по биоразлагаемым пластмассам с помощью микробов и микробных ферментов. PCL (поликапролактон) и PBAT (поли(бутиленадипат-ко-терефталат)) являются часто используемыми биоразлагаемыми пластиками на биологической основе. PBAT может использоваться для производства сельскохозяйственных мульчирующих пленок, а PCL — для упаковки сельскохозяйственной продукции [132]. Деполямераза Penicillium oxalicum DSYD05-1 имеет широкий диапазон субстратной специфичности, и штамм может полностью разлагать пленки PCL в течение 9 дней при 28 °C [133]. Скорость деградации PBAT штаммами Thermomonospora fusca могла достигать 99% при 55 °C в течение 22 дней [134]. Анализ FTIR старения полимолочной кислоты показал дополнительный широкий порог пика в диапазоне от 3000 до 3500 см^−1, что указывало на то, что сложноэфирная связь PLA была гидролизована и разорвана с образованием карбоксильных и гидроксильных групп. Затем она могла быть дальнейшей деградирована микроорганизмами до H2O и CO2 [48].
Биодеградация оказывает относительно небольшое влияние на природную почвенную экосистему по сравнению с другими методами обработки, поэтому она имеет большой потенциал для борьбы с загрязнением MPs в почве [135]. В 2017 году из мангровых отложений в полуостровной Малайзии были выделены два штамма, Bacillus cereus и Bacillus formans, которые показали потенциал для деградации PP MPs [136]. В настоящее время все больше и больше бактерий, которые могут разлагать PE пластик, включая Bacillus, Staphylococcus, Pseudomonas, Achromatobacteria, Chomonas, Delfteia и Stenotrophomonas, были обнаружены в наземных средах [137,138]. Когда технология доместикации и размножения микроорганизмов с потенциалом деградации MPs станет зрелой, эффективность деградации MPs будет значительно повышена. В то же время микроорганизмы с высокой эффективностью деградации MPs могут быть объединены и культивированы для формирования ферментов, способных разлагать MPs (Рисунок 6). Однако необходимы дальнейшие исследования, чтобы определить, оказывают ли эти искусственные микробные сообщества неблагоприятное воздействие на микробные сообщества в природных экосистемах. В настоящее время несколько исследований было сосредоточено на микробной деградации MPs, но с развитием технологии микробного культивирования биодеградация с помощью микроорганизмов станет основной технологией деградации MPs в будущем.
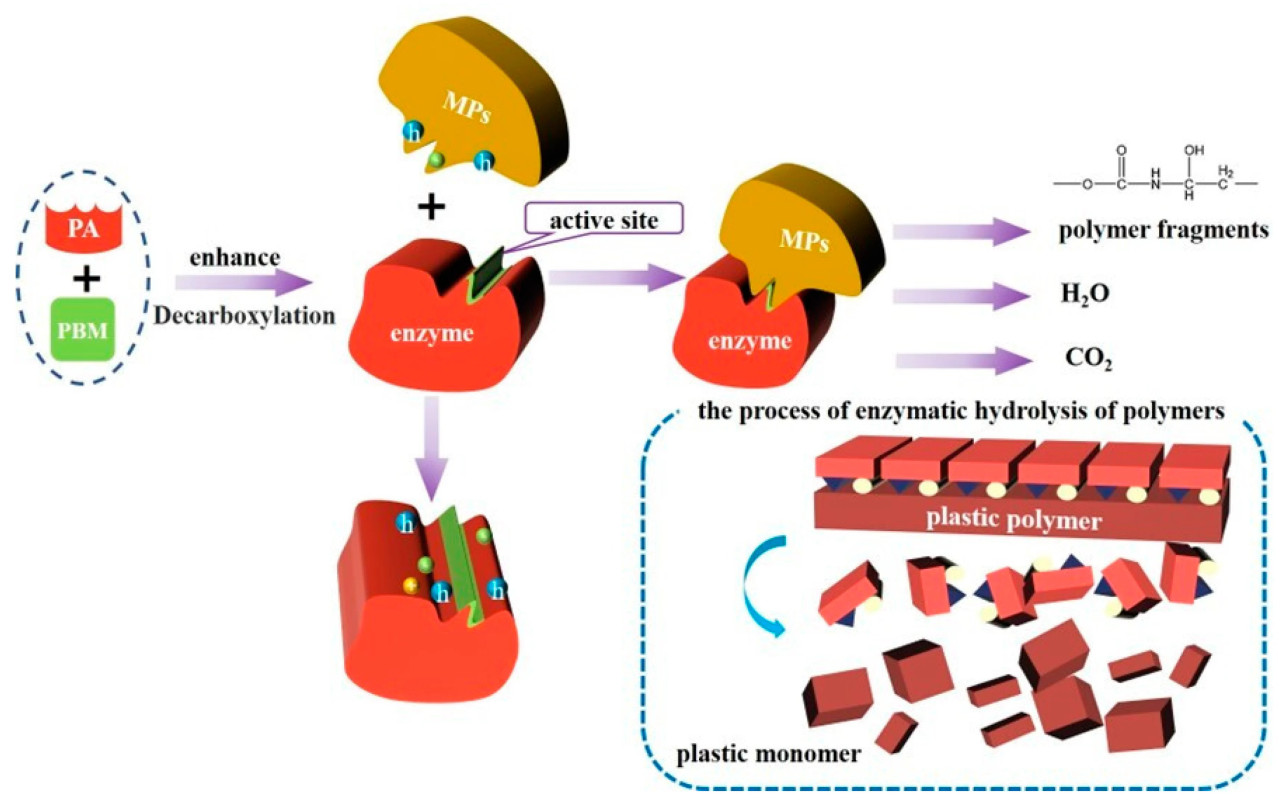
Рисунок 6. Схематическая диаграмма ферментативного механизма деградации PA MPs. (PBM: модуль связывания полимера. PA: полиамидаза. h: активный центр.).
В дополнение к микроорганизмам, выделенные микробные ферменты также могут использоваться для деградации MPs [139]. Биодеградация MPs микробными ферментами проходит в два этапа: ферменты адсорбируются на поверхности MPs через домен поверхностного связывания, который не разлагает мономеры MPs; и сложноэфирная связь MPs гидролизуется [140]. Также ферменты могут разлагать сложные пластиковые полимеры на диоксид углерода, воду и другие полимеры с малой молекулярной массой, делая MPs источником углерода для микробного метаболизма [141] (Рисунок 6).
Как отмечено в приведенном выше обсуждении, в целом, MPs представляют больше рисков, чем преимуществ в почве. Хотя внесение биоразлагаемых MPs в почвы сельхозугодий может увеличить источник углерода для биодеградации, неразлагаемые MPs нуждаются в дальнейшей обработке. В будущем целенаправленные микроорганизмы (такие как бактерии, грибы и археи) и микробные ферменты могут использоваться для обработки и удаления остаточных MPs в почве, что имеет широкие перспективы и требует углубленных исследований и непрерывных исследований.
5. Выводы
Присутствие MPs в почвах сельхозугодий приводит к пагубным последствиям, нарушая структуру почвы, снижая проницаемость почвы и препятствуя поглощению воды и питательных веществ корнями растений. Дополнительно, MPs могут нарушать микробные сообщества, вызывая дисбаланс в почвенной экосистеме и снижая биоразобразие. MPs также могут проникать в ткани растений, создавая риски для роста растений. Более того, MPs высвобождают токсичные соединения и эндокринные разрушители, представляя потенциальные угрозы не только для почвенных экосистем, но и для здоровья человека.
Чтобы смягчить воздействие загрязнения MPs и способствовать устойчивому развитию сельского хозяйства, крайне важно понять свойства и экологическое поведение MPs и внедрить необходимые стратегии. Например, можно рассмотреть следующие подходы: укрепление практик управления сельхозугодьями, сокращение чрезмерного использования пластиковых пленок, поиск альтернативных материалов, улучшение процессов обработки сточных вод и осадка, повышение экологической осведомленности и содействие научно-исследовательскому сотрудничеству. В частности, биодеградация считается перспективным подходом к решению проблемы загрязнения MPs. Определенные микробные штаммы и ферменты могут эффективно разлагать биоразлагаемые пластмассы, такие как PCL, PBAT и PLA. Более того, культивирование и использование искусственных микробных сообществ демонстрируют потенциал для повышения эффективности деградации MPs. Однако необходимы дальнейшие исследования для решения проблем, создаваемых небиоразлагаемыми MPs, и изучения альтернативных методов обработки.
Сокращения
CI Индекс карбонила
DOM Растворенное органическое вещество
EDA Донор-акцептор электронов
EU Европейский союз
FA Фульвокислота
FTIR Фурье-спектроскопия инфракрасного излучения с преобразованием Фурье
GT Гетит
NPs Нанопластик
MPs Микропластик
O/C Отношение кислорода к углероду
OTC Окситетрациклин
PAHs Полициклические ароматические углеводороды
PBAT Поли(бутиленадипат-ко-терефталат)
PCL Поликапролактон
PE Полиэтилен
PHBV Поли(-3-гидроксибутират-ко-3-гидроксивалерат)
PET Полиэтилентерефталат
PP Полипропилен
PS Полистирол
PVC Поливинилхлорид
ROS Активные формы кислорода
SOC Почвенный органический углерод
SMT Сульфаметазин
XPS Рентгеновская фотоэлектронная спектроскопия
Ссылки
1. Arthur, C.; Baker, J.; Bamford, H. Proceedings of the International Research Workshop on the Occurrence, Effects and Fate of Microplastic Marine Debris, Tacoma, WA, USA, 9–11 September 2008; National Oceanic and Atmospheric Administration Technical Memorandum NOS-OR&R-30; National Oceanic and Atmosphere Administration: Washington, DC, USA, 2009.
2. Alimi, O.S.; Farner Budarz, J.; Hernandez, L.M.; Tufenkji, N. Microplastics and Nanoplastics in Aquatic Environments: Aggregation, Deposition, and Enhanced Contaminant Transport. Environ. Sci. Technol. 2018, 52, 1704–1724. [Google Scholar] [CrossRef] [PubMed]
3. Tang, K.H.D. Microplastics in agricultural soils in China: Sources, impacts and solutions. Environ. Pollut. 2023, 322, 121235. [Google Scholar] [CrossRef] [PubMed]
4. EFSA Panel on Contaminants in the Food Chain (CONTAM). Presence of microplastics and nanoplastics in food, with particular focus on seafood. EFSA J. 2016, 14, e04501. [Google Scholar]
5. Zhou, B.; Wang, J.; Zhang, H.; Shi, H.; Fei, Y.; Huang, S.; Tong, Y.; Wen, D.; Luo, Y.; Barceló, D. Microplastics in agricultural soils on the coastal plain of Hangzhou Bay, east China: Multiple sources other than plastic mulching film. J. Hazard. Mater. 2020, 388, 121814. [Google Scholar] [CrossRef] [PubMed]
6. Zhu, Y.; Wen, H.; Li, T.; Li, H.; Wu, C.; Zhang, G.; Yan, J. Distribution and Sources of Microplastics in Farmland Soil Along the Fenhe River. Environ. Sci. 2021, 42, 3894–3903. [Google Scholar]
7. Yu, Y.; Flury, M. Current understanding of subsurface transport of micro- and nanoplastics in soil. Vadose Zone J. 2021, 20, e20108. [Google Scholar] [CrossRef]
8. Huang, Y.; Liu, Q.; Jia, W.; Yan, C.; Wang, J. Agricultural plastic mulching as a source of microplastics in the terrestrial environment. Environ. Pollut. 2020, 260, 114096. [Google Scholar] [CrossRef]
9. Nizzetto, L.; Futter, M.; Langaas, S. Are Agricultural Soils Dumps for Microplastics of Urban Origin? Environ. Sci. Technol. 2016, 50, 10777–10779. [Google Scholar] [CrossRef]
10. Okeke, E.S.; Okoye, C.O.; Atakpa, E.O.; Ita, R.E.; Nyaruaba, R.; Mgbechidinma, C.L.; Akan, O.D. Microplastics in agroecosystems-impacts on ecosystem functions and food chain. Resour. Conserv. Recycl. 2022, 177, 105961. [Google Scholar] [CrossRef]
11. Bläsing, M.; Amelung, W. Plastics in soil: Analytical methods and possible sources. Sci. Total. Environ. 2018, 612, 422–435. [Google Scholar] [CrossRef]
12. Horton, A.; Walton, A.; Spurgeon, D.; Lahive, E.; Svendsen, C. Microplastics in freshwater and terrestrial environments: Evaluating the current understanding to identify the knowledge gaps and future research priorities. Sci. Total Environ. 2017, 586, 127–141. [Google Scholar] [CrossRef] [PubMed]
13. Lim, X. Microplastics are everywhere—But are they harmful? Nature 2021, 593, 22–25. [Google Scholar] [CrossRef] [PubMed]
14. Wang, Z.; Fu, D.; Gao, L.; Qi, H.; Su, Y.; Peng, L. Aged microplastics decrease the bioavailability of coexisting heavy metals to microalga Chlorella vulgaris. Ecotoxicol. Environ. Saf. 2021, 217, 112199. [Google Scholar] [CrossRef] [PubMed]
15. Sana, S.S.; Dogiparthi, L.K.; Gangadhar, L.; Chakravorty, A.; Abhishek, N. Effects of microplastics and nanoplastics on marine environment and human health. Environ. Sci. Pollut. Res. Int. 2020, 27, 44743–44756. [Google Scholar] [CrossRef]
16. Zhou, J.; Gui, H.; Banfield, C.C.; Wen, Y.; Zang, H.; Dippold, M.A.; Charlton, A.; Jones, D.L. The microplastisphere: Biodegradable microplastics addition alters soil microbial community structure and function. Soil Biol. Biochem. 2021, 156, 108211. [Google Scholar] [CrossRef]
17. Patrício Silva, A.L.; Prata, J.C.; Mouneyrac, C.; Barcelò, D.; Duarte, A.C.; Rocha-Santos, T. Risks of COVID-19 face masks to wildlife: Present and future research needs. Sci. Total Environ. 2021, 792, 148505. [Google Scholar] [CrossRef]
18. ESCAP. A Call for Healthy “Blue Oceans” in Asia and the Pacific; ESCAP: Bangkok, Thailand, 2019. [Google Scholar]
19. European Union. Plastics Strategy; European Union: Brussels, Blegium, 2018. [Google Scholar]
20. The National People’s Congress of the People’s Republic of China. Law of the People’s Republic of China on Prevention and Control of Soil Contamination; The National People’s Congress of the People’s Republic of China: Beijing, China, 2018.
21. Dannis, M.L. Rubber Dust from the Normal Wear of Tires. Rubber Chem. Technol. 1974, 47, 1011–1037. [Google Scholar] [CrossRef]
22. Napper, I.E.; Bakir, A.; Rowland, S.J.; Thompson, R.C. Characterisation, quantity and sorptive properties of microplastics extracted from cosmetics. Mar. Pollut. Bull. 2015, 99, 178–185. [Google Scholar] [CrossRef]
23. Mahon, A.M.; O’Connell, B.; Healy, M.G.; O’Connor, I.; Officer, R.; Nash, R.; Morrison, L. Microplastics in Sewage Sludge: Effects of Treatment. Environ. Sci. Technol. 2017, 51, 810–818. [Google Scholar] [CrossRef]
24. Scheurer, M.; Bigalke, M. Microplastics in Swiss Floodplain Soils. Environ. Sci. Technol. 2018, 52, 3591–3598. [Google Scholar] [CrossRef]
25. Mahbub, M.S.; Shams, M. Acrylic fabrics as a source of microplastics from portable washer and dryer: Impact of washing and drying parameters. Sci. Total Environ. 2022, 834, 155429. [Google Scholar] [CrossRef]
26. Sang, W.; Wang, X.; Wang, X.; Xiao, L. The source, occurance characteristics and migration behavior of microplastics in soil. J. Ecol. Rural Environ. 2021, 37, 1361–1367. [Google Scholar]
27. Anthony, L.A. Plastics and the Environment; Wiley: Hoboken, NJ, USA, 2003. [Google Scholar]
28. Sa’adu, I.; Farsang, A. Plastic contamination in agricultural soils: A review. Environ. Sci. Eur. 2023, 35, 1–11. [Google Scholar] [CrossRef]
29. Wu, J.; Jiang, R.; Lin, W.; Ouyang, G. Effect of salinity and humic acid on the aggregation and toxicity of polystyrene nanoplastics with different functional groups and charges. Environ. Pollut. 2019, 245, 836–843. [Google Scholar] [CrossRef] [PubMed]
30. Wang, J.; Li, J.; Liu, S.; Li, H.; Chen, X.; Peng, C.; Zhang, P.; Liu, X. Distinct microplastic distributions in soils of different land-use types: A case study of Chinese farmlands. Environ. Pollut. 2021, 269, 116199. [Google Scholar] [CrossRef] [PubMed]
31. Sun, Q.; Ren, S.-Y.; Ni, H.-G. Incidence of microplastics in personal care products: An appreciable part of plastic pollution. Sci. Total Environ. 2020, 742, 140218. [Google Scholar] [CrossRef]
32. Patel, M.M.; Goyal, B.R.; Bhadada, S.V.; Bhatt, J.S.; Amin, A.F. Getting into the brain: Approaches to enhance brain drug delivery. CNS Drugs 2009, 23, 35–58. [Google Scholar] [CrossRef]
33. Crawford, C.B.; Quinn, B. 4—Physiochemical properties and degradation. In Microplastic Pollutants; Crawford, C.B., Quinn, B., Eds.; Elsevier: Amsterdam, The Netherlands, 2017; pp. 57–100. [Google Scholar]
34. Fu, L.; Li, J.; Wang, G.; Luan, Y.; Dai, W. Adsorption behavior of organic pollutants on microplastics. Ecotoxicol. Environ. Saf. 2021, 217, 112207. [Google Scholar] [CrossRef]
35. Guo, X.; Wang, J. The chemical behaviors of microplastics in marine environment: A review. Mar. Pollut. Bull. 2019, 142, 1–14. [Google Scholar] [CrossRef]
36. Li, H.; Li, S.; Nan, L.; Li, H.; Guo, Q. Meta-analysis of Effect of Plastic Film Mulching on Cotton Yield in China. Trans. Chin. Soc. Agric. Mach. 2017, 48, 228–235. [Google Scholar]
37. Pei, X. Current Situation of Agricultural Plastic Sheeting Pollution in Henan Province and Its Countermeasures. Master’s Thesis, Henan Agricultural University, Zhengzhou, China, 2018. [Google Scholar]
38. Mormile, P.; Stahl, N.; Malinconico, M. The World of Plasticulture. In Soil Degradable Bioplastics for a Sustainable Modern Agriculture; Green Chemistry and Sustainable Technology; Malinconico, M., Ed.; Springer: Berlin/Heidelberg, Germany, 2017; pp. 1–21. [Google Scholar]
39. Zhang, Q.-Q.; Ma, Z.-R.; Cai, Y.-Y.; Li, H.-R.; Ying, G.-G. Agricultural Plastic Pollution in China: Generation of Plastic Debris and Emission of Phthalic Acid Esters from Agricultural Films. Environ. Sci. Technol. 2021, 55, 12459–12470. [Google Scholar] [CrossRef] [PubMed]
40. Brodhagen, M.; Goldberger, J.R.; Hayes, D.G.; Inglis, D.A.; Marsh, T.L.; Miles, C. Policy considerations for limiting unintended residual plastic in agricultural soils. Environ. Sci. Policy 2017, 69, 81–84. [Google Scholar] [CrossRef]
41. Zhang, D.; Liu, H.; Hu, W.; Qin, X.; Ma, X.; Yan, C.; Wang, H. The status and distribution characteristics of residual mulching film in Xinjiang, China. J. Integr. Agric. 2016, 15, 2639–2646. [Google Scholar] [CrossRef]
42. Zhao, Y.; Chen, X.; Wen, H.; Zheng, X.; Niu, Q.; Kang, J. Research status and prospect of control technology for residual plastic film pollution in farmland. Trans. Chin. Soc. Agric. Eng. 2017, 48, 1–14. [Google Scholar]
43. Yan, C.; Mei, X.; He, W.; Zheng, S. Present situation of residue pollution of mulching plastic film and controlling measures. Trans. Chin. Soc. Agric. Eng. 2006, 22, 269–272. [Google Scholar]
44. Susanna, G. Plastic Pollution in Soil; Institute for European Environmental Policy: Brussels, Belgium, 2018. [Google Scholar]
45. Isari, E.A.; Papaioannou, D.; Kalavrouziotis, I.K.; Karapanagioti, H.K. Microplastics in Agricultural Soils: A Case Study in Cultivation of Watermelons and Canning Tomatoes. Water 2021, 13, 2168. [Google Scholar] [CrossRef]
46. Lusher, A.; Hurley, R.; Vogelsang, C.; Nizzetto, L.; Olsen, M. Mapping Microplastics in Sludge; Norsk Institutt for Vannforskning: Oslo, Norway, 2017. [Google Scholar]
47. Gies, E.A.; LeNoble, J.L.; Noël, M.; Etemadifar, A.; Bishay, F.; Hall, E.R.; Ross, P.S. Retention of microplastics in a major secondary wastewater treatment plant in Vancouver, Canada. Mar. Pollut. Bull. 2018, 133, 553–561. [Google Scholar] [CrossRef]
48. Zhao, Z.-Y.; Wang, P.-Y.; Wang, Y.-B.; Zhou, R.; Koskei, K.; Munyasya, A.N.; Liu, S.-T.; Wang, W.; Su, Y.-Z.; Xiong, Y.-C. Fate of plastic film residues in agro-ecosystem and its effects on aggregate-associated soil carbon and nitrogen stocks. J. Hazard. Mater. 2021, 416, 125954. [Google Scholar] [CrossRef]
49. Yang, L.; Luo, W.; Zhao, P.; Zhang, Y.; Kang, S.; Giesy, J.P.; Zhang, F. Microplastics in the Koshi River, a remote alpine river crossing the Himalayas from China to Nepal. Environ. Pollut. 2021, 290, 118121. [Google Scholar] [CrossRef]
50. Jiang, N.; Luo, W.; Zhao, P.; Ga, B.; Jia, J.; Giesy, J.P. Distribution of microplastics in benthic sediments of Qinghai Lake on the Tibetan Plateau, China. Sci. Total Environ. 2022, 835, 155434. [Google Scholar] [CrossRef]
51. Zhao, S.; Zhu, L.; Wang, T.; Li, D. Suspended microplastics in the surface water of the Yangtze Estuary System, China: First observations on occurrence, distribution. Mar. Pollut. Bull. 2014, 86, 562–568. [Google Scholar] [CrossRef] [PubMed]
52. Li, J.; Song, Y.; Cai, Y. Focus topics on microplastics in soil: Analytical methods, occurrence, transport, and ecological risks. Environ. Pollut. 2020, 257, 113570. [Google Scholar] [CrossRef] [PubMed]
53. Huerta Lwanga, E.; Gertsen, H.; Gooren, H.; Peters, P.; Salánki, T.; van der Ploeg, M.; Besseling, E.; Koelmans, A.A.; Geissen, V. Microplastics in the Terrestrial Ecosystem: Implications for Lumbricus terrestris (Oligochaeta, Lumbricidae). Environ. Sci. Technol. 2016, 50, 2685–2691. [Google Scholar] [CrossRef] [PubMed]
54. Rillig, M.C.; Bonkowski, M. Microplastic and soil protists: A call for research. Environ. Pollut. 2018, 241, 1128–1131. [Google Scholar] [CrossRef] [PubMed]
55. Yu, M.; van der Ploeg, M.; Lwanga, E.H.; Yang, X.; Zhang, S.; Ma, X.; Ritsema, C.J.; Geissen, V. Leaching of microplastics by preferential flow in earthworm (Lumbricus terrestris) burrows. Environ. Chem. 2019, 16, 31–40. [Google Scholar] [CrossRef]
56. Zhang, S.; Yang, X.; Gertsen, H.; Peters, P.; Salánki, T.; Geissen, V. A simple method for the extraction and identification of light density microplastics from soil. Sci. Total Environ. 2017, 616–617. [Google Scholar] [CrossRef]
57. Choi, Y.R.; Kim, Y.-N.; Yoon, J.-H.; Dickinson, N.; Kim, K.-H. Plastic contamination of forest, urban, and agricultural soils: A case study of Yeoju City in the Republic of Korea. J. Soils Sediments 2021, 21, 1962–1973. [Google Scholar] [CrossRef]
58. Bo, L.; Li, B.; Zhang, K.; Ma, R.; Li, Y.; Sun Bi Liu, Y. Distribution, Sources and Behavioral Characteristics of Microplastics in Farmland Soil. Environ. Sci. 2022, 44, 2375–2383. [Google Scholar]
59. Dong, S.; Cai, W.; Xia, J.; Sheng, L.; Wang, W.; Liu, H. Aggregation kinetics of fragmental PET nanoplastics in aqueous environment: Complex roles of electrolytes, pH and humic acid. Environ. Pollut. 2021, 268, 115828. [Google Scholar] [CrossRef]
60. Dong, S.; Xia, J.; Sheng, L.; Wang, W.; Liu, H.; Gao, B. Transport characteristics of fragmental polyethylene glycol terephthalate (PET) microplastics in porous media under various chemical conditions. Chemosphere 2021, 276, 130214. [Google Scholar] [CrossRef]
61. Qi, K.; Lu, N.; Zhang, S.; Wang, W.; Wang, Z.; Guan, J. Uptake of Pb(II) onto microplastic-associated biofilms in freshwater: Adsorption and combined toxicity in comparison to natural solid substrates. J. Hazard. Mater. 2021, 411, 125115. [Google Scholar] [CrossRef] [PubMed]
62. Zhao, P.; Luo, W.; Jiang, N.; Ga, B.; Pang, X.; Giesy, J.; Galloway, T. Distribution and Risks of Microplastics in Sediments of a Small Coastal River–Estuary System: Functional Areas, Wastewater Treatment Plants, and Dams. SSRN Electron. J. 2022, preprint. [Google Scholar] [CrossRef]
63. Abdurahman, A.; Cui, K.; Wu, J.; Li, S.; Gao, R.; Dai, J.; Liang, W.; Zeng, F. Adsorption of dissolved organic matter (DOM) on polystyrene microplastics in aquatic environments: Kinetic, isotherm and site energy distribution analysis. Ecotoxicol. Environ. Saf. 2020, 198, 110658. [Google Scholar] [CrossRef] [PubMed]
64. Ma, J.; Qiu, Y.; Zhao, J.; Ouyang, X.; Zhao, Y.; Weng, L.; MDYasir, A.; Chen, Y.; Li, Y. Effect of Agricultural Organic Inputs on Nanoplastics Transport in Saturated Goethite-Coated Porous Media: Particle Size Selectivity and Role of Dissolved Organic Matter. Environ. Sci. Technol. 2022, 56, 3524–3534. [Google Scholar] [CrossRef] [PubMed]
65. Tang, S.; Lin, L.; Wang, X.; Sun, X.; Yu, A. Adsorption of fulvic acid onto polyamide 6 microplastics: Influencing factors, kinetics modeling, site energy distribution and interaction mechanisms. Chemosphere 2021, 272, 129638. [Google Scholar] [CrossRef] [PubMed]
66. Wang, L.; Zhang, J.; Huang, W.; He, Y. Laboratory simulated aging methods, mechanisms and characteristic changes of microplastics: A review. Chemosphere 2023, 315, 137744. [Google Scholar] [CrossRef] [PubMed]
67. Mao, R.; Lang, M.; Yu, X.; Wu, R.; Yang, X.; Guo, X. Aging mechanism of microplastics with UV irradiation and its effects on the adsorption of heavy metals. J. Hazard. Mater. 2020, 393, 122515. [Google Scholar] [CrossRef]
68. Liu, J.; Zhang, T.; Tian, L.; Liu, X.; Qi, Z.; Ma, Y.; Ji, R.; Chen, W. Aging Significantly Affects Mobility and Contaminant-Mobilizing Ability of Nanoplastics in Saturated Loamy Sand. Environ. Sci. Technol. 2019, 53, 5805–5815. [Google Scholar] [CrossRef]
69. Song, Y.; Zhao, J.; Zhu, W.; Xue, X.; Zheng, L.; Yu, Y.; Wang, H. Adsorption of natural organic matter on original and aged polystyrene microplastics. Acta Sci. Circumstantiae 2023, 43, 181–191. [Google Scholar]
70. Sander, T.; Gerke, H.H. Modelling field-data of preferential flow in paddy soil induced by earthworm burrows. J. Contam. Hydrol. 2009, 104, 126–136. [Google Scholar] [CrossRef]
71. Bogner, C.; Borken, W.; Huwe, B. Impact of preferential flow on soil chemistry of a podzol. Geoderma 2012, 175–176, 37–46. [Google Scholar] [CrossRef]
72. Zhang, Y.; Zhang, M.; Niu, J.; Zheng, H. The preferential flow of soil: A widespread phenomenon in pedological perspectives. Eurasian Soil Sci. 2016, 49, 661–672. [Google Scholar] [CrossRef]
73. Khan, M.A.; Huang, Q.; Khan, S.; Wang, Q.; Huang, J.; Fahad, S.; Sajjad, M.; Liu, Y.; Mašek, O.; Li, X.; et al. Abundance, spatial distribution, and characteristics of microplastics in agricultural soils and their relationship with contributing factors. J. Environ. Manag. 2023, 328, 117006. [Google Scholar] [CrossRef] [PubMed]
74. Bradford, S.A.; Yates, S.R.; Bettahar, M.; Simunek, J. Physical factors affecting the transport and fate of colloids in saturated porous media. Water Resour. Res. 2002, 38, 63.1–63.12. [Google Scholar] [CrossRef]
75. Hallaq, A. The impact of soil texture on nitrates leaching into groundwater in the north governorate, Gaza strip. J. Soc. Sci. 2010, 38, 11–35. [Google Scholar]
76. Rahmatpour, S.; Mosaddeghi, M.R.; Shirvani, M.; Šimůnek, J. Transport of silver nanoparticles in intact columns of calcareous soils: The role of flow conditions and soil texture. Geoderma 2018, 322, 89–100. [Google Scholar] [CrossRef]
77. Silori, R.; Shrivastava, V.; Mazumder, P.; Mootapally, C.; Pandey, A.; Kumar, M. Understanding the underestimated: Occurrence, distribution, and interactions of microplastics in the sediment and soil of China, India, and Japan. Environ. Pollut. 2023, 320, 120978. [Google Scholar] [CrossRef]
78. Yu, L.; Zhang, J.; Liu, Y.; Chen, L.; Tao, S.; Liu, W. Distribution characteristics of microplastics in agricultural soils from the largest vegetable production base in China. Sci. Total Environ. 2021, 756, 143860. [Google Scholar] [CrossRef]
79. Zhang, Z. Monitoring and Evaluation of Irrigation Water Utilization Coefficient under Different Irrigation Methods in Xiliaohe Well Irrigation District. Master’s Thesis, Changchun Institute of Technology, Changchun, China, 2020. [Google Scholar] [CrossRef]
80. Hüffer, T.; Metzelder, F.; Sigmund, G.; Slawek, S.; Schmidt, T.C.; Hofmann, T. Polyethylene microplastics influence the transport of organic contaminants in soil. Sci. Total Environ. 2019, 657, 242–247. [Google Scholar] [CrossRef]
81. Endo, S.; Droge ST, J.; Goss, K.-U. Polyparameter Linear Free Energy Models for Polyacrylate Fiber−Water Partition Coefficients to Evaluate the Efficiency of Solid-Phase Microextraction. Anal. Chem. 2011, 83, 1394–1400. [Google Scholar] [CrossRef]
82. Liu, X.; Xu, J.; Zhao, Y.; Shi, H.; Huang, C.-H. Hydrophobic sorption behaviors of 17β-Estradiol on environmental microplastics. Chemosphere 2019, 226, 726–735. [Google Scholar] [CrossRef] [PubMed]
83. Rillig, M.C.; Lehmann, A. Microplastic in terrestrial ecosystems. Science 2020, 368, 1430–1431. [Google Scholar] [CrossRef] [PubMed]
84. Bao, M.; Hong, M.; Zhao, B.; Xing, A.; Ye, H.; Shen, Q.; Wang, L. Distribution characteristics and influencing factors concerning residual quantity of agricultural mulch film in Hetao irrigation area, Inner Mongolia. J. Agric. Resour. Environ. 2023, 40, 45–54. [Google Scholar]
85. Bryan, R.B. The development, use and efficiency of indices of soil erodibility. Geoderma 1968, 2, 5–26. [Google Scholar] [CrossRef]
86. Boix-Fayos, C.; Calvo-Cases, A.; Imeson, A.C.; Soriano-Soto, M.D. Influence of soil properties on the aggregation of some Mediterranean soils and the use of aggregate size and stability as land degradation indicators. Catena 2001, 44, 47–67. [Google Scholar] [CrossRef]
87. de Souza Machado, A.A.; Lau, C.W.; Till, J.; Kloas, W.; Lehmann, A.; Becker, R.; Rillig, M.C. Impacts of Microplastics on the Soil Biophysical Environment. Environ. Sci. Technol. 2018, 52, 9656–9665. [Google Scholar] [CrossRef] [PubMed]
88. Lehmann, A.; Fitschen, K.; Rillig, M.C. Abiotic and Biotic Factors Influencing the Effect of Microplastic on Soil Aggregation. Soil Syst. 2019, 3, 21. [Google Scholar] [CrossRef]
89. Liang, Y.; Lehmann, A.; Yang, G.; Leifheit, E.F.; Rillig, M.C. Effects of Microplastic Fibers on Soil Aggregation and Enzyme Activities Are Organic Matter Dependent. Front. Environ. Sci. 2021, 9, 650155. [Google Scholar] [CrossRef]
90. Powell, J.R.; Rillig, M.C. Biodiversity of arbuscular mycorrhizal fungi and ecosystem function. New Phytol. 2018, 220, 1059–1075. [Google Scholar] [CrossRef]
91. Wagg, C.; Bender, S.F.; Widmer, F.; van der Heijden, M.G.A. Soil biodiversity and soil community composition determine ecosystem multifunctionality. Proc. Natl. Acad. Sci. USA 2014, 111, 5266–5270. [Google Scholar] [CrossRef]
92. van der Heijden MG, A.; de Bruin, S.; Luckerhoff, L.; van Logtestijn RS, P.; Schlaeppi, K. A widespread plant-fungal-bacterial symbiosis promotes plant biodiversity, plant nutrition and seedling recruitment. ISME J. 2016, 10, 389–399. [Google Scholar] [CrossRef] [PubMed]
93. Rillig, M.C.; Lehmann, A.; de Souza Machado, A.A.; Yang, G. Microplastic effects on plants. New Phytol. 2019, 223, 1066–1070. [Google Scholar] [CrossRef] [PubMed]
94. Vallespir Lowery, N.; Ursell, T. Structured environments fundamentally alter dynamics and stability of ecological communities. Proc. Natl. Acad. Sci USA 2019, 116, 379–388. [Google Scholar] [CrossRef] [PubMed]
95. Zhao, S.; Zhang, Z.; Chen, L.; Cui, Q.; Cui, Y.; Song, D.; Fang, L. Review on migration, transformation and ecological impacts of microplastics in soil. Appl. Soil Ecol. 2022, 176, 104486. [Google Scholar] [CrossRef]
96. Adeel, M.; Yang, Y.S.; Wang, Y.Y.; Song, X.M.; Ahmad, M.A.; Rogers, H.J. Uptake and transformation of steroid estrogens as emerging contaminants influence plant development. Environ. Pollut. 2018, 243, 1487–1497. [Google Scholar] [CrossRef] [PubMed]
97. Sun, H.; Lei, C.; Xu, J.; Li, R. Foliar uptake and leaf-to-root translocation of nanoplastics with different coating charge in maize plants. J. Hazard. Mater. 2021, 416, 125854. [Google Scholar] [CrossRef] [PubMed]
98. Schwab, F.; Zhai, G.; Kern, M.; Turner, A.; Schnoor, J.L.; Wiesner, M.R. Barriers, pathways and processes for uptake, translocation and accumulation of nanomaterials in plants—Critical review. Nanotoxicology 2016, 10, 257–278. [Google Scholar] [CrossRef]
99. Azeem, I.; Adeel, M.; Ahmad, M.A.; Shakoor, N.; Jiangcuo, G.D.; Azeem, K.; Ishfaq, M.; Shakoor, A.; Ayaz, M.; Xu, M.; et al. Uptake and Accumulation of Nano/Microplastics in Plants: A Critical Review. Nanomaterials 2021, 11, 2935. [Google Scholar] [CrossRef]
100. Hartmann, M.; Six, J. Soil structure and microbiome functions in agroecosystems. Nat. Rev. Earth Environ. 2023, 4, 4–18. [Google Scholar] [CrossRef]
101. Fan, Y.; Zheng, K.; Zhu, Z.; Chen, G.; Peng, X. Distribution, sedimentary record, and persistence of microplastics in the Pearl River catchment, China. Environ. Pollut. 2019, 251, 862–870. [Google Scholar] [CrossRef]
102. Bandow, N.; Will, V.; Wachtendorf, V.; Simon, F. Contaminant release from aged microplastic. Environ. Chem. 2017, 14, 394. [Google Scholar] [CrossRef]
103. Cao, J.; Yang, Q.; Jiang, J.; Dalu, T.; Kadushkin, A.; Singh, J.; Fakhrullin, R.; Wang, F.; Cai, X.; Li, R. Coronas of micro/nano plastics: A key determinant in their risk assessments. Part. Fibre Toxicol. 2022, 19, 55. [Google Scholar] [CrossRef] [PubMed]
104. Rossi, G.; Barnoud, J.; Monticelli, L. Polystyrene Nanoparticles Perturb Lipid Membranes. J. Phys. Chem. Lett. 2014, 5, 241–246. [Google Scholar] [CrossRef] [PubMed]
105. Hale, R.C.; Seeley, M.E.; La Guardia, M.J.; Mai, L.; Zeng, E.Y. A global perspective on microplastics. J. Geophys. Res. Ocean 2020, 125, e2018JC014719. [Google Scholar] [CrossRef]
106. Wang, L.; Zhu, Y.; Gu, J.; Yin, X.; Guo, L.; Qian, L.; Shi, L.; Guo, M.; Ji, G. The toxic effect of bisphenol AF and nanoplastic coexposure in parental and offspring generation zebrafish. Ecotoxicol. Environ. Saf. 2023, 251, 114565. [Google Scholar] [CrossRef] [PubMed]
107. Vethaak, A.D.; Legler, J. Microplastics and human health. Science 2021, 371, 672–674. [Google Scholar] [CrossRef]
108. He, L.; Li, Z.; Jia, Q.; Xu, Z. Soil microplastics pollution in agriculture. Science 2023, 379, 547. [Google Scholar] [CrossRef]
109. Ragusa, A.; Svelato, A.; Santacroce, C.; Catalano, P.; Notarstefano, V.; Carnevali, O.; Papa, F.; Rongioletti, M.C.A.; Baiocco, F.; Draghi, S.; et al. Plasticenta: First evidence of microplastics in human placenta. Environ. Int. 2021, 146, 106274. [Google Scholar] [CrossRef]
110. Yu, Z.; Yan, C.; Qiu, D.; Zhang, X.; Wen, C.; Dong, S. Accumulation and ecotoxicological effects induced by combined exposure of different sized polyethylene microplastics and oxytetracycline in zebrafish. Environ. Pollut. 2023, 319, 120977. [Google Scholar] [CrossRef]
111. Sendra, M.; Pereiro, P.; Figueras, A.; Novoa, B. An integrative toxicogenomic analysis of plastic additives. J. Hazard. Mater. 2021, 409, 124975. [Google Scholar] [CrossRef]
112. Wang, J.; Zhao, X.; Wu, A.; Tang, Z.; Niu, L.; Wu, F.; Wang, F.; Zhao, T.; Fu, Z. Aggregation and stability of sulfate-modified polystyrene nanoplastics in synthetic and natural waters. Environ. Pollut. 2021, 268, 114240. [Google Scholar] [CrossRef] [PubMed]
113. Liu, P.; Qian, L.; Wang, H.; Zhan, X.; Lu, K.; Gu, C.; Gao, S. New Insights into the Aging Behavior of Microplastics Accelerated by Advanced Oxidation Processes. Environ. Sci. Technol. 2019, 53, 3579–3588. [Google Scholar] [CrossRef] [PubMed]
114. Wu, X.; Liu, P.; Shi, H.; Wang, H.; Huang, H.; Shi, Y.; Gao, S. Photo aging and fragmentation of polypropylene food packaging materials in artificial seawater. Water Res. 2021, 188, 116456. [Google Scholar] [CrossRef] [PubMed]
115. Shi, Y.; Liu, P.; Wu, X.; Shi, H.; Huang, H.; Wang, H.; Gao, S. Insight into chain scission and release profiles from photodegradation of polycarbonate microplastics. Water Res. 2021, 195, 116980. [Google Scholar] [CrossRef] [PubMed]
116. Al Naggar, Y.; Brinkmann, M.; Sayes, C.M.; AL-Kahtani, S.N.; Dar, S.A.; El-Seedi, H.R.; Grünewald, B.; Giesy, J.P. Are Honey Bees at Risk from Microplastics? Toxics 2021, 9, 109. [Google Scholar] [CrossRef]
117. Yu, Z.; Song, S.; Xu, X.; Ma, Q.; Lu, Y. Sources, migration, accumulation and influence of microplastics in terrestrial plant communities. Environ. Exp. Bot. 2021, 192, 104635. [Google Scholar] [CrossRef]
118. Lwanga, E.H.; Gertsen, H.; Gooren, H.; Peters, P.; Salánki, T.; van der Ploeg, M.; Besseling, E.; Koelmans, A.A.; Geissen, V. Incorporation of microplastics from litter into burrows of Lumbricus terrestris. Environ. Pollut. 2017, 220, 523–531. [Google Scholar] [CrossRef]
119. de Souza Machado, A.A.; Kloas, W.; Zarfl, C.; Hempel, S.; Rillig, M.C. Microplastics as an emerging threat to terrestrial ecosystems. Glob. Chang. Biol. 2018, 24, 1405–1416. [Google Scholar] [CrossRef]
120. Ma, J.; Chen, F.; Zhu, Y.; Li, X.; Yu, H.; Sun, Y. Joint effects of microplastics and ciprofloxacin on their toxicity and fates in wheat: A hydroponic study. Chemosphere 2022, 303, 135023. [Google Scholar] [CrossRef]
121. Zhang, Z.; Cui, Q.; Chen, L.; Zhu, X.; Zhao, S.; Duan, C.; Zhang, X.; Song, D.; Fang, L. A critical review of microplastics in the soil-plant system: Distribution, uptake, phytotoxicity and prevention. J. Hazard. Mater. 2022, 424, 127750. [Google Scholar] [CrossRef]
122. Yang, Z.; Liu, P.; Wang, J.; Ding, L.; Li, L.; Jia, H.; Wang, T.; Guo, X.; Gao, S. Microplastics-derived dissolved organic matters accelerate photodegradation of sulfamethazine in wastewater ultraviolet disinfection process. Chem. Eng. J. 2023, 454, 140301. [Google Scholar] [CrossRef]
123. Koelmans, A.A.; Besseling, E.; Wegner, A.; Foekema, E.M. Plastic as a carrier of POPs to aquatic organisms: A model analysis. Environ. Sci. Technol. 2013, 47, 7812–7820. [Google Scholar] [CrossRef] [PubMed]
124. Prata, J.C.; da Costa, J.P.; Lopes, I.; Andrady, A.L.; Duarte, A.C.; Rocha-Santos, T. A One Health perspective of the impacts of microplastics on animal, human and environmental health. Sci. Total Environ. 2021, 777, 146094. [Google Scholar] [CrossRef] [PubMed]
125. Goldstein, M.C.; Rosenberg, M.; Cheng, L. Increased oceanic microplastic debris enhances oviposition in an endemic pelagic insect. Biol. Lett. 2012, 8, 817–820. [Google Scholar] [CrossRef] [PubMed]
126. Hu, D.; Shen, M.; Zhang, Y.; Li, H.; Zeng, G. Microplastics and nanoplastics: Would they affect global biodiversity change. Environ. Sci. Pollut. Res. Int. 2019, 26, 19997–20002. [Google Scholar] [CrossRef] [PubMed]
127. Yan, Y.; Chen, Z.; Zhu, F.; Zhu, C.; Wang, C.; Gu, C. Effect of Polyvinyl Chloride Microplastics on Bacterial Community and Nutrient Status in Two Agricultural Soils. Bull. Environ. Contam. Toxicol. 2021, 107, 602–609. [Google Scholar] [CrossRef] [PubMed]
128. Li, L.; Song, K.; Yeerken, S.; Geng, S.; Liu, D.; Dai, Z.; Xie, F.; Zhou, X.; Wang, Q. Effect evaluation of microplastics on activated sludge nitrification and denitrification. Sci. Total Environ. 2020, 707, 135953. [Google Scholar] [CrossRef]
129. Krueger, M.C.; Harms, H.; Schlosser, D. Prospects for microbiological solutions to environmental pollution with plastics. Appl. Microbiol. Biotechnol. 2015, 99, 8857–8874. [Google Scholar] [CrossRef]
130. Feng, W.; Deng, Y.; Cao, Y.; Liu, J.; Han, Y.; Liu, J.; Miao, Q.; Yang, F.; Zhu, Y.; Giesy, J.P. Biotechnology Remediation and Environmental Behavior of Microplastics in Soils: A Review. Rev. Environ. Contam. 2023, 261, 13. [Google Scholar] [CrossRef]
131. Jin, Y.; Cai, F.; Wang, L.; Song, C.; Jin Sun, J.; Liu, G.; Chen, C. Advance in the degradation of biodegradable plastics in different environments. Chin. J. Biotech. 2022, 38, 1784–1808. [Google Scholar]
132. Wang, M.; Yan, N.; Jiang, X.; Chen, G.; Liang, R.; Chen, Y.; Zhang, X.; Xu, L. Degradation performance of PBAT/PLA fully biodegradable mulching film and its effect on cotton growth in Shihezi reclamation areas in Xinjiang of China. Trans. Chin. Soc. Agric. Eng. 2022, 38, 273–282. [Google Scholar]
133. Urbanek, A.K.; Rymowicz, W.; Strzelecki, M.C.; Kociuba, W.; Franczak, Ł.; Mirończuk, A.M. Isolation and characterization of Arctic microorganisms decomposing bioplastics. AMB Express 2017, 7, 148. [Google Scholar] [CrossRef] [PubMed]
134. Witt, U.; Einig, T.; Yamamoto, M.; Kleeberg, I.; Deckwer, W.-D.; Müller, R.-J. Biodegradation of aliphatic–aromatic copolyesters: Evaluation of the final biodegradability and ecotoxicological impact of degradation intermediates. Chemosphere 2001, 44, 289–299. [Google Scholar] [CrossRef] [PubMed]
135. Liu Xi Dong, X.; Xie, Z.; Ma, X.; Luo, Y. Ecological Effects and Biodegradation of Microplastics in Soils. Acta Pedol. Sin. 2022, 59, 349–363. [Google Scholar]
136. Helen, A.S.; Uche, E.C.; Hamid, F.S. Screening for Polypropylene Degradation Potential of Bacteria Isolated from Mangrove Ecosystems in Peninsular Malaysia. IJBBB 2017, 7, 245–251. [Google Scholar] [CrossRef]
137. Peixoto, J.; Silva, L.P.; Krüger, R.H. Brazilian Cerrado soil reveals an untapped microbial potential for unpretreated polyethylene biodegradation. J. Hazard. Mater. 2017, 324, 634–644. [Google Scholar] [CrossRef]
138. Park, S.Y.; Kim, C.G. Biodegradation of micro-polyethylene particles by bacterial colonization of a mixed microbial consortium isolated from a landfill site. Chemosphere 2019, 222, 527–533. [Google Scholar] [CrossRef]
139. Tang, K.H.D.; Lock, S.S.M.; Yap, P.-S.; Cheah, K.W.; Chan, Y.H.; Yiin, C.L.; Ku AZ, E.; Loy AC, M.; Chin BL, F.; Chai, Y.H. Immobilized enzyme/microorganism complexes for degradation of microplastics: A review of recent advances, feasibility and future prospects. Sci. Total. Environ. 2022, 832, 154868. [Google Scholar] [CrossRef]
140. Akutsu, Y.; Nakajima-Kambe, T.; Nomura, N.; Nakahara, T. Purification and properties of a polyester polyurethane-degrading enzyme from comamonas acidovorans tb-35. Appl. Environ. Microbiol. 1998, 64, 62–67. [Google Scholar] [CrossRef]
141. Montazer, Z.; Habibi Najafi, M.B.; Levin, D.B. Challenges with verifying microbial degradation of polyethylene. Polymers 2020, 12, 123. [Google Scholar] [CrossRef]
Deng Y, Zeng Z, Feng W, Liu J, Yang F. Characteristics and Migration Dynamics of Microplastics in Agricultural Soils. Agriculture. 2024; 14(1):157. https://doi.org/10.3390/agriculture14010157
Перевод статьи «Characteristics and Migration Dynamics of Microplastics in Agricultural Soils» авторов Deng Y, Zeng Z, Feng W, Liu J, Yang F., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
Фото: freepik





























































































Комментарии (0)