Как ферментированный бамбук улучшает рост, иммунитет и пищеварение у цыплят-бройлеров
В данном исследовании изучается влияние ферментированного бамбукового порошка (ФБП) на продуктивность роста, антиоксидантный статус, морфологию кишечника и экспрессию генов переносчиков питательных веществ у цыплят-бройлеров.
Аннотация
Из 600 здоровых суточных цыплят были сформированы две группы; каждая группа включала 30 цыплят, опыт повторялся 10 раз. Контрольная группа получала базовый рацион, а рацион экспериментальной группы был дополнен 1,0 г/кг ФБП в I фазу (1–22 дни) и 2,0 г/кг ФБП во II фазу (23–45 дни). Полученные результаты выявили значительное улучшение продуктивности роста в группе, получавшей ферментированный бамбуковый порошок, по сравнению с контрольной группой (p < 0,05). Уровень триглицеридов значительно снизился (p < 0,05), наряду с достоверным снижением уровня мочевины и креатинина (p < 0,05). Уровень малонового диальдегида (МДА), маркера окислительного стресса, в группе ФБП был значительно ниже по сравнению с контрольной группой (p < 0,01). Было установлено, что активность антиоксидантных ферментов — супероксиддисмутазы (СОД) и каталазы (КАТ) — в группе ФБП была значительно выше, чем в контрольной группе (p < 0,01). Кроме того, ферментированный бамбуковый порошок значительно увеличивал площадь поверхности кишечника (двенадцатиперстной, тощей и подвздошной кишок), доступную для всасывания питательных веществ, за счет увеличения высоты ворсинок, глубины крипт и площади ворсинок (p < 0,01). По сравнению с контролем, ФБП повышал уровень экспрессии генов, участвующих в транспорте питательных веществ в отделах кишечника (двенадцатиперстной, тощей и подвздошной кишках), включая GLUT1, GLUT2, CAT1, CAT2, PEPT1, PEPT2 и LAT1. Повышение регуляции генов переносчиков питательных веществ дополнительно способствовало абсорбции питательных веществ, что обусловило наблюдаемое улучшение роста и увеличение массы тела. Эти результаты подтверждают, что ФБП является жизнеспособной кормовой добавкой в рационы бройлеров для улучшения их здоровья и продуктивности.
1. Введение
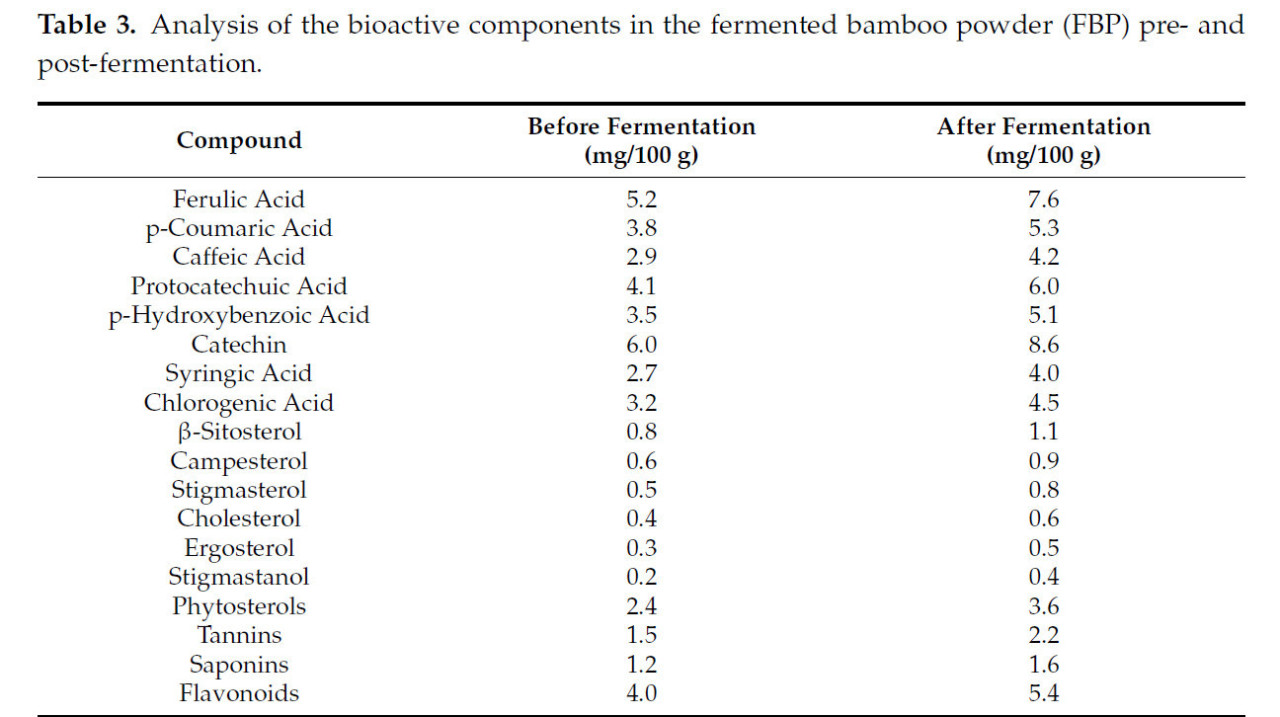
Бамбук, многолетнее растение с древесной текстурой, широко распространенное в мире, относится к подсемейству Bambuseae и семейству Gramineae. Являясь ведущим производителем, Китай вносит значительный вклад в мировое предложение бамбука, предоставляя большие объемы по низкой цене [1]. На долю бамбука приходится почти 3% площади мировых лесов [2]. Известный своим быстрым ростом и высоким производственным потенциалом, бамбук выделяется как ключевой возобновляемый ресурс с широким географическим распространением [3]. Состав бамбука обогащен различными физиологически активными соединениями, преимущественно флавоноидами, полисахаридами и фенольными кислотами, которые оказывают значительное влияние на цыплят [4,5]. Кроме того, бамбук содержит существенное количество нерастворимых пищевых волокон (НПВ), которые могут положительно влиять на здоровье кишечника, использование питательных веществ и поведение бройлеров [6,7]. Известно, что флавоноиды бамбука смягчают кишечное воспаление и модулируют иммунную активность в кишечнике [8]. Исследователи признают способность фенольных компонентов бамбука снижать риски ожирения печени, а также обеспечивать антиоксидантные и антибактериальные преимущества [9,10,11]. Благодаря процессу ферментации некоторые вещества могут быть более концентрированными и биодоступными в ферментированном бамбуковом порошке по сравнению с неферментированным бамбуковым порошком. Это может способствовать росту молочнокислых бактерий и повышать сбраживаемость субстрата [12]. Кроме того, процесс ферментации бамбука может приводить к значительному увеличению содержания сырой клетчатки и сырого протеина, достигая 10,76% сырой клетчатки и 15,20% сырого протеина, в зависимости от вида бамбука и конкретных используемых условий ферментации [13]. Кроме того, ферментированный бамбуковый порошок содержал следующие количества сухого вещества (89,80%), сырого протеина (2,28%), сырого жира (0,18%), кислотно-детергентной клетчатки (47,36%), кальция (0,12%), общего фосфора (0,02%) и валовой энергии (16,85 МДж/кг) при скармливании животным [14,15].
Эпителий тонкого кишечника образует сложную сеть переносчиков, необходимых для всасывания питательных веществ. Это включает переносчики глюкозы GLUT1 и GLUT2, переносчики катионных аминокислот CAT1 и CAT2, обменники нейтральных/катионных аминокислот y+L-переносчик аминокислот 1 и y+L-переносчик аминокислот 2, а также переносчики пептидов PepT1 и PepT2, которые являются важными частями механизмов, перемещающих аминокислоты внутри клеток [16,17].
Недавние исследования показывают, что ФБП стимулирует кишечные обонятельные рецепторы, улучшая здоровье кишечника и продуктивность роста у бройлеров [18]. Несмотря на существующие исследования по использованию ферментированного бамбукового порошка (ФБП) у кур и свиней, информация о механизмах, посредством которых ФБП воздействует на этих животных, остается недостаточной. Это исследование направлено на восполнение этого пробела путем изучения того, как различные уровни добавок ФБП влияют на рост, антиоксидантный статус, экспрессию генов переносчиков питательных веществ и морфологию кишечника у цыплят-бройлеров.
2. Материалы и методы
2.1. Рационы, животные и дизайн эксперимента
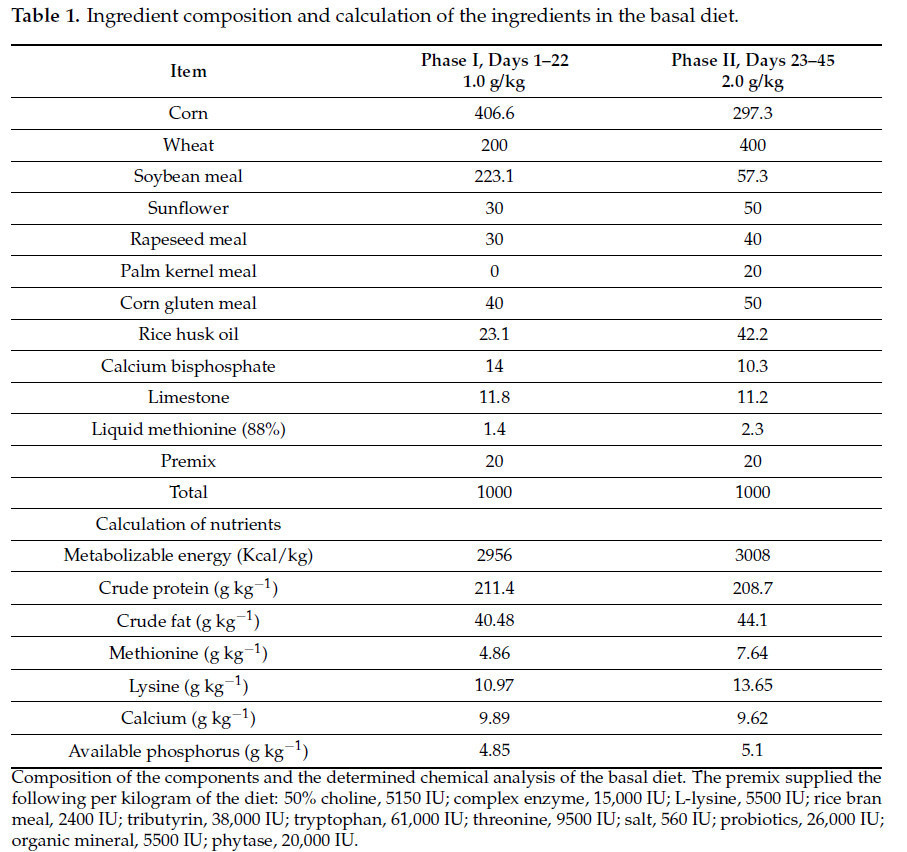
Экспериментальные протоколы получили одобрение Комитета по уходу и использованию животных Нанкинского сельскохозяйственного университета, Нанкин, Китай, под номером разрешения: SYXK (Su) 2022–0031. Базовый рацион был закуплен в Jiangsu Yancheng Xiling Agricultural Science and Technology Co., Ltd., Нанкин, Китай. Рекомендации, изложенные NRC в 1994 г. относительно потребностей в питательных веществах, описывают потребности желтых цыплят в питании, как показано в Таблице 1, и послужили основополагающим руководством для составления базового рациона. ФБП был приобретен в Zhejiang Muyi Xiangzhu Biotechnology Co., Ltd., уезд Фуян, город Ханчжоу, Китай. В Таблице 2 представлены ингредиенты ФБП. Исследовательский институт Global 3E, Киото, Япония, выполнил анализ биоактивных компонентов, присутствующих в ФБП, как до, так и после ферментации, с использованием технологии ВЭЖХ-МС/МС, как показано в Таблице 3.
Таблица 1. Состав ингредиентов и расчет питательности ингредиентов базового рациона.
Таблица 2. Анализированный состав ферментированного бамбукового порошка (ФБП).
Таблица 3. Анализ биоактивных компонентов в ферментированном бамбуковом порошке (ФБП) до и после ферментации.
Группа из 600 суточных цыплят карликовых желтоперых бройлеров (DYB) со средней живой массой 52,16 ± 0,26 г была использована для этого эксперимента, получая стандартные протоколы вакцинации и неограниченный доступ к корму и воде в течение 45 дней. Испытание включало следующие два различных этапа: Фаза I (дни 1–22) и Фаза II (дни 23–45). Мы разделили цыплят на следующие две основные группы: контрольную группу (CON) и группу, получавшую добавку ФБП. Каждая группа имела 10 повторностей, каждая повторность включала 30 цыплят, выращенных на подстиле. Контрольная группа получала базовый рацион на протяжении всего эксперимента. Группа ФБП получала различные эквиваленты ФБП (1,0–2,0 г/кг) в каждой фазе в соответствии с их потребностями в питании.
2.2. Отбор образцов и сбор данных
Мы регистрировали показатели живой массы (BW) в следующие три отдельных дня на протяжении эксперимента: день 1, день 22 и день 45. Дополнительно мы регистрировали и впоследствии рассчитывали потребление корма и среднесуточный прирост (ADG) на загон. Среднесуточное потребление корма (ADFI) на птицу рассчитывалось путем деления общего потребления корма для загона за период испытания на количество дней в периоде исследования. Коэффициент конверсии корма (FCR) определяли путем анализа данных по потреблению корма и живой массе для каждого загона. Образцы крови были получены и центрифугированы при 3000 об/мин в течение 10 мин. Мы сохранили образцы сыворотки при температуре −20 °C. Убойную продуктивность оценивали путем расчета потрошеной массы, массы грудных и бедренных мышц, а также массы других внутренних органов, таких как сердце, селезенка, почки и печень. Мы провели окрашивание гематоксилином и эозином (HE) и экстракцию РНК на тканях, взятых из отделов кишечника, включая двенадцатиперстную, тощую и подвздошную кишки.
2.3. Окрашивание ГЭ тканевых срезов
Ткани тонкого кишечника (двенадцатиперстная, тощая и подвздошная кишки) были сохранены в 75% этаноле при комнатной температуре для дальнейшего ГЭ-анализа. Ткани кишечника были нарезаны на срезы толщиной 3–4 мм и сохранены в 10% нейтральном забуференном формалине. Затем ткани обезвоживали в серии спиртов восходящей концентрации, промывали ксилолом и заливали в парафин. Парафиновые блоки нарезали толщиной 5–7 мкм с использованием микротома, а затем окрашивали ГЭ-окрашиванием (Beijing Solarbio Science & Technology Co., Ltd., Пекин, Китай) для морфологического исследования. Срезы анализировали с использованием микроскопа Nikon Eclipse E200 (Nikon Instruments, Shanghai Co., Ltd., Шанхай, Китай). С использованием программного обеспечения ImageJ версии 1.54d (США) мы провели пять измерений глубины крипт (CD), высоты ворсинок (VH) и площади ворсинок для кишечных образцов из различных ворсинок и крипт на срез от каждого бройлера со следующей указанной формулой [19]:
площадь ворсинки = 2π × (средняя ширина ворсинки/2) × высота ворсинки.
2.4. Биохимические измерения сыворотки и антиоксидантные ферменты
Мы оценили общий белок, глюкозу, холестерин, триглицериды, холестерин липопротеинов высокой плотности (HDL) и холестерин липопротеинов низкой плотности (LDL) в образцах сыворотки. В данном исследовании использовались образцы крови для оценки активности антиоксидантных ферментов. Общая активность супероксиддисмутазы (SOD) и концентрации малонового диальдегида (MDA), глутатионпероксидазы (GSH-PX), гемоксигеназы HO-1 и каталазы (CAT) оценивались с использованием коммерческих наборов, предоставленных Nanjing Angle Gene Co., Ltd. в Нанкине, Китай.
2.5. Экстракция РНК и количественная ПЦР
2.5.1. Выделение РНК и синтез кДНК
Образцы тонкого кишечника (двенадцатиперстная, тощая и подвздошная кишки) были собраны и помещены в жидкий азот при температуре −80 °C для анализа. Тотальную РНК экстрагировали с помощью набора для экстракции тотальной РНК из тканей/клеток животных (TSP413, Qingke, Пекин, Китай) в соответствии с инструкциями производителя. Мы использовали электрофорез в агарозном геле для оценки целостности и качества РНК. Концентрацию РНК количественно определяли с помощью микропланшетного спектрофотометра Epoch, произведенного Agilent Technologies, Inc., Пекин, Китай. Набор SynScript® RT SuperMix для обратной транскрипции qPCR был использован для обратной транскрипции образца РНК в кДНК, затем она хранилась при температуре −20 °C для анализа.
2.5.2. К-ПЦР (Количественная полимеразная цепная реакция в реальном времени)
Последовательности праймеров использовались для амплификации генов, которые перечислены в Таблице 4. Последовательности праймеров прошли валидацию с использованием NCBI Primer-BLAST. Обратно-транскрибированный продукт кДНК подвергли трехкратному разведению и использовали в качестве матрицы для кПЦР. Мы достигли амплификации, используя ArtiCanCEO SYBR qPCR Mix TSE401 (Qingke), следуя инструкциям производителей и используя оборудование для ПЦР в реальном времени ABI QuantStudio от Thermo Fisher Scientific, Inc. Процедура амплификации начиналась с начальной стадии денатурации при 95 °C в течение 5 мин, с последующими 40 циклами, состоящими из денатурации при 95 °C в течение 15 с, отжига при 60 °C в течение 20 с и элонгации при 72 °C в течение 20 с. Кривые диссоциации были изучены для подтверждения того, что для каждой заданной температуры плавления обнаружен один пик, что иллюстрирует, что продукты ПЦР были амплифицированы с точностью. Мы использовали дублированные образцы для тестирования. Расчет уровней относительной экспрессии генов (кратное изменение) включал нормализацию значений Ct целевого гена относительно β-актина в качестве гена домашнего хозяйства.
Таблица 4. Последовательности праймеров, использованные для эксперимента ОТ-кПЦР.
2.6. Статистический анализ
Собранные данные подверглись тщательному статистическому анализу с использованием программного обеспечения SPSS V.26 для анализа. Для определения значительных различий между средними значениями использовался t-критерий для независимых выборок (p < 0,05). Данные представлены как среднее значение, сопровождаемое стандартной ошибкой. Экспрессия генов оценивалась в трех повторах и впоследствии нормализована относительно β-актина в качестве референсного гена. Относительная экспрессия генов оценивалась с использованием метода 2−ΔΔCt.
3. Результаты
3.1. Продуктивность роста
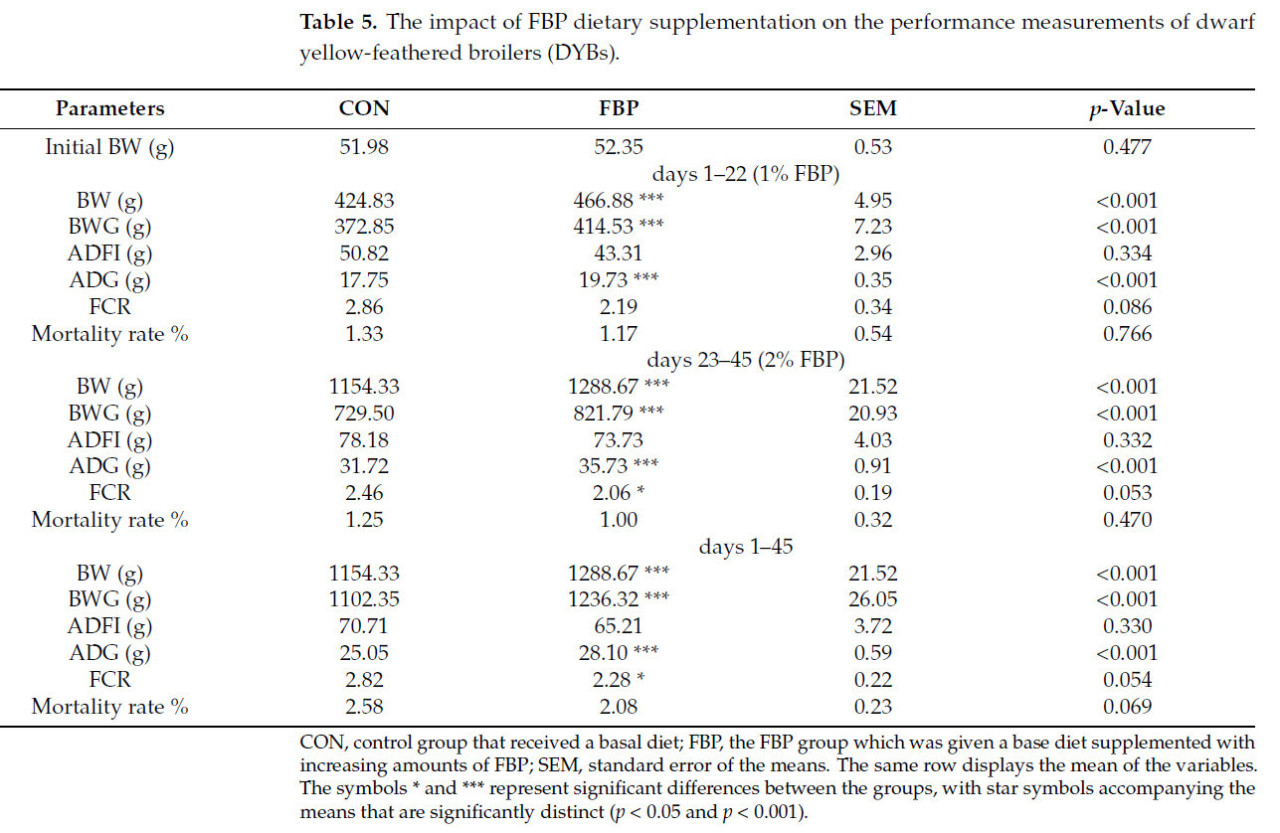
Результаты, касающиеся общей продуктивности роста, показали преимущества интеграции ФБП в рационы бройлеров. В Таблице 5 представлен подробный обзор влияния диетической добавки ФБП на живую массу цыплят-бройлеров в течение двух последовательных фаз развития, включающего следующие два дополнительных количества ФБП: 1,0 и 2,0 г/кг (p < 0,001). Начальная живая масса цыплят как в контрольной группе, так и в группе ФБП была, очевидно, сопоставима в начальной точке эксперимента.
Таблица 5. Влияние диетической добавки ФБП на показатели продуктивности карликовых желтоперых бройлеров (DYB).
3.2. Масса тушки и органов
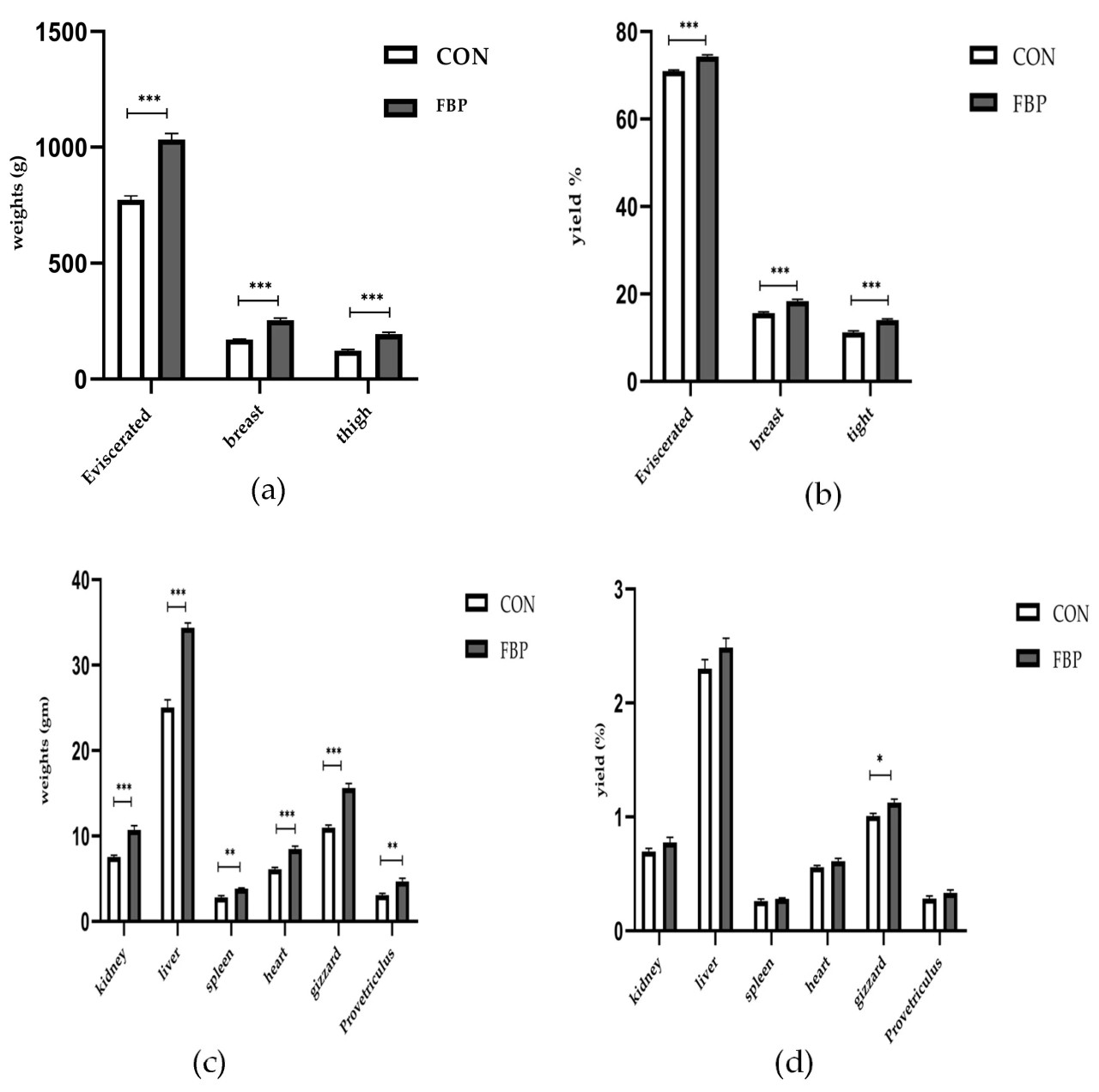
Потрошеная масса, а также масса и индексы грудных и бедренных мышц значительно увеличились у цыплят, получавших рацион с ФБП, превосходя показатели контрольной группы (p = 0,05). Однако мы наблюдали значимые различия в массе органов между контрольной группой и группой ФБП (p > 0,05). Рисунок 1 показывает, что включение ФБП в базовый рацион стабильно увеличивало массу как тушки, так и органов. Это указывает на то, что добавка к рациону оказала влияние на рост организма в целом.
Рисунок 1. Влияние ФБП на массу тушки и органов у цыплят DYB: (a) масса тушки; (b) индекс тушки; (c) масса органов; (d) индекс органов. Столбчатые диаграммы показывают средние значения переменных. Планки погрешностей представляют стандартную ошибку среднего. Символы , и указывают на значимые различия между группами. Различные символы звездочек соответствуют существенно различающимся средним значениям (p < 0,05).
3.3. Морфология кишечника
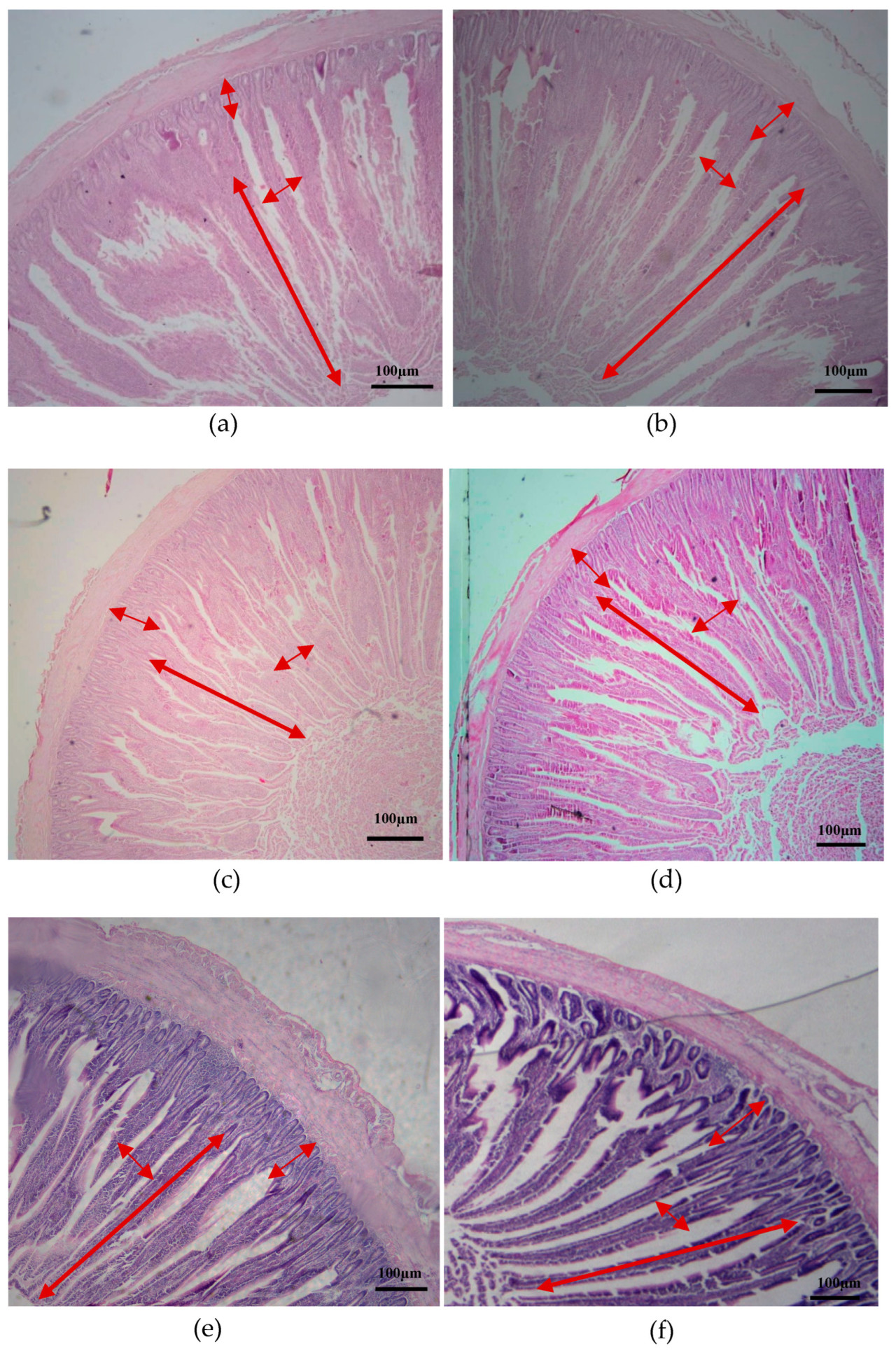
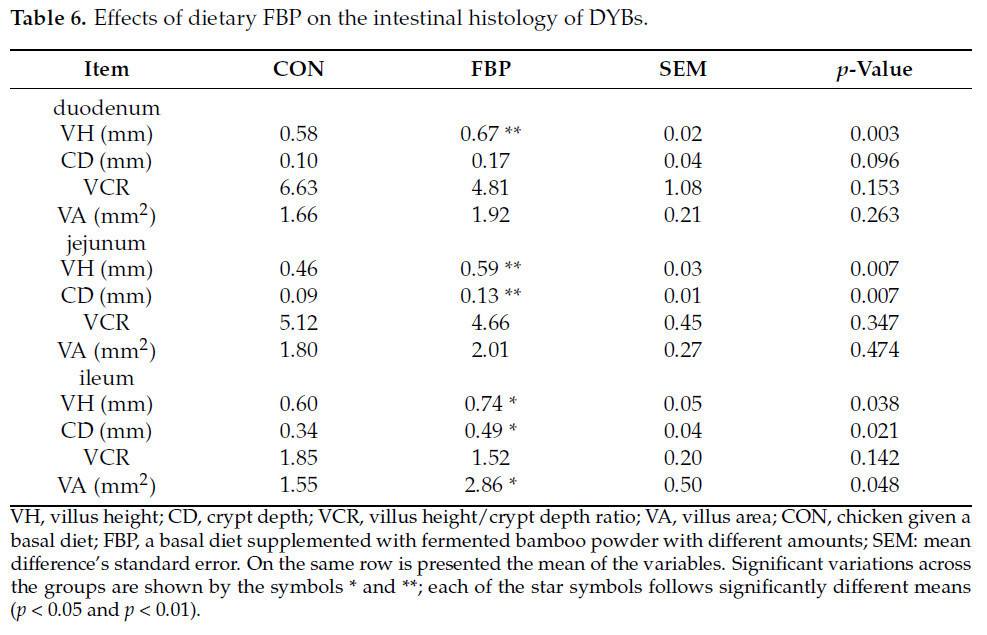
Результаты показали, что включение ФБП в рацион улучшило структурные характеристики кишечника (двенадцатиперстной, тощей и подвздошной кишок) на 45 день по сравнению с контрольной группой. Ворсинки в двенадцатиперстной кишке демонстрировали большую высоту в группе ФБП по сравнению с контрольной группой. Кроме того, группа ФБП показала более глубокие крипты по сравнению с контрольной группой. Однако при сравнении контрольной группы с группой, обработанной ФБП, анализ не выявил значимой разницы в соотношении высоты ворсинок и глубины крипт, а также в площади ворсинок. ФБП значительно увеличил как глубину крипт, так и высоту ворсинок в тощей кишке (p < 0,01). Тем не менее, обработанная группа не показала значимого эффекта на соотношение ворсинки/крипты или площадь ворсинок. Морфология подвздошной кишки показала значительные изменения благодаря обработке ФБП, в частности, в измерениях высоты ворсинок, глубины крипт и площади ворсинок. И наоборот, обработка ФБП не показала значимого эффекта на развитие крипт подвздошной кишки. Таблица 6 и Рисунок 2 иллюстрируют результаты, обсуждавшиеся ранее. Кроме того, ФБП увеличил высоту, глубину и площадь поверхности ворсинок в двенадцатиперстной, тощей и подвздошной кишках по сравнению с контрольной группой.
Рисунок 2. Морфология отделов кишечника при контрольном кормлении и кормлении с ФБП цыплят DYB. (a,b) Двенадцатиперстная кишка групп CON и ФБП; (c,d) Тощая кишка групп CON и ФБП; (e,f) Подвздошная кишка групп CON и ФБП при увеличении 40×. Масштабная шкала = 100 мкм. Красные стрелки показывают высоту ворсинки, ширину ворсинки и глубину крипты.
Таблица 6. Влияние ФБП в рационе на гистологию кишечника DYB.
3.4. Биохимические показатели сыворотки крови
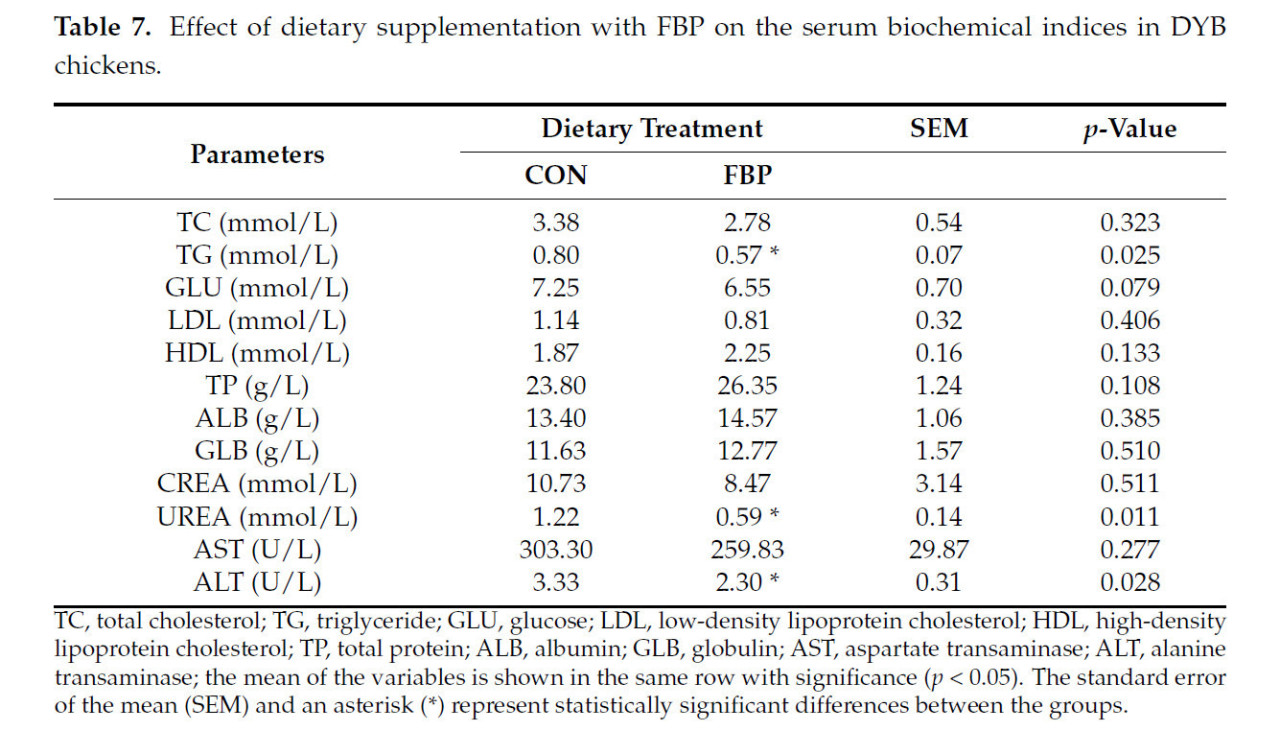
В Таблице 7 показано влияние ФБП на биохимический анализ крови цыплят-бройлеров. Результаты показали, что включение ФБП в рацион повысило уровни липопротеинов низкой плотности (LDL), холестерина (Chol) и глюкозы (GLU) в крови. Кроме того, включение ФБП привело к более высоким концентрациям общего белка (TP) и липопротеинов высокой плотности (HDL) по сравнению с контрольной группой. С другой стороны, применение ФБП значительно повлияло на концентрацию триглицеридов (TG) в сыворотке (p < 0,05). Напротив, ФБП повлиял на функцию печени, снижая уровень аспартатаминотрансферазы (AST) в сыворотке и значительно снижая уровень аланинаминотрансферазы (ALT) (p < 0,05). ФБП значительно снизил концентрацию мочевины (p < 0,05), но не оказал значимого влияния на концентрацию креатинина.
Таблица 7. Влияние диетической добавки ФБП на биохимические показатели сыворотки крови у цыплят DYB.
3.5. Антиоксидантный статус
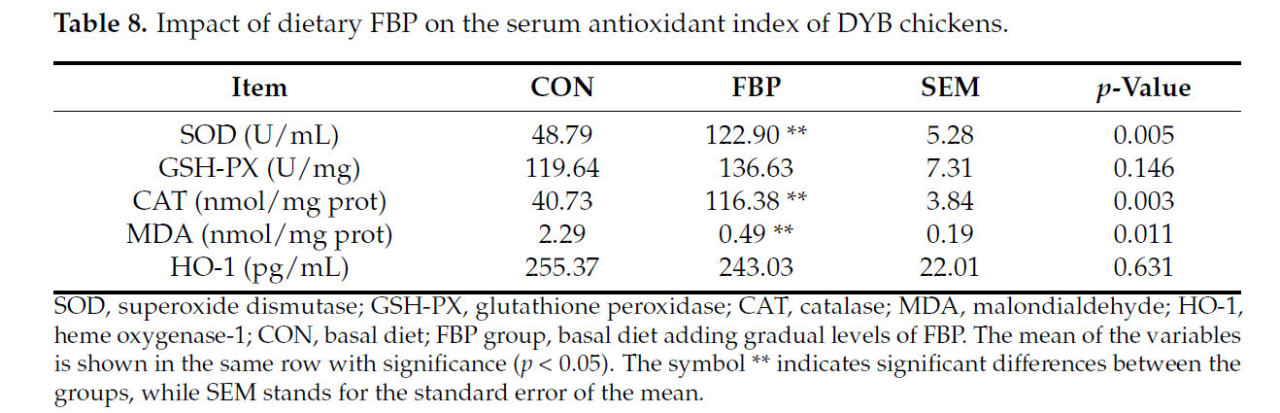
Данные, представленные в Таблице 8, показывают влияние ФБП на маркеры антиоксидантного статуса сыворотки. Активности CAT и SOD были значительно повышены по сравнению с контрольной группой (p < 0,01). Мы не наблюдали заметных различий в содержании GSH-PX между контрольной группой и группой ФБП. По сравнению с контрольной группой, группа ФБП показала значительное снижение (p = 0,01) уровней MDA.
Таблица 8. Влияние ФБП в рационе на антиоксидантные показатели сыворотки крови цыплят DYB.
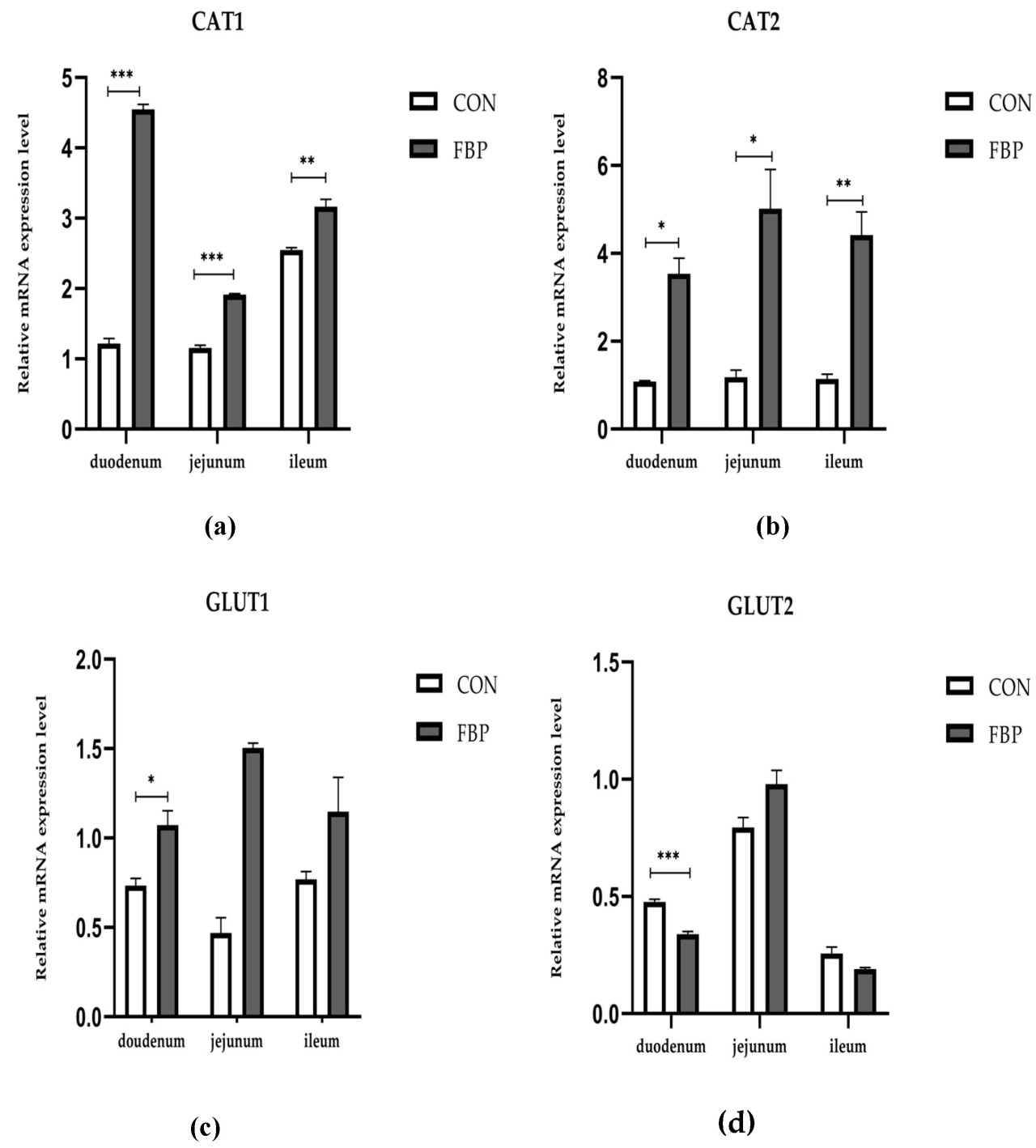
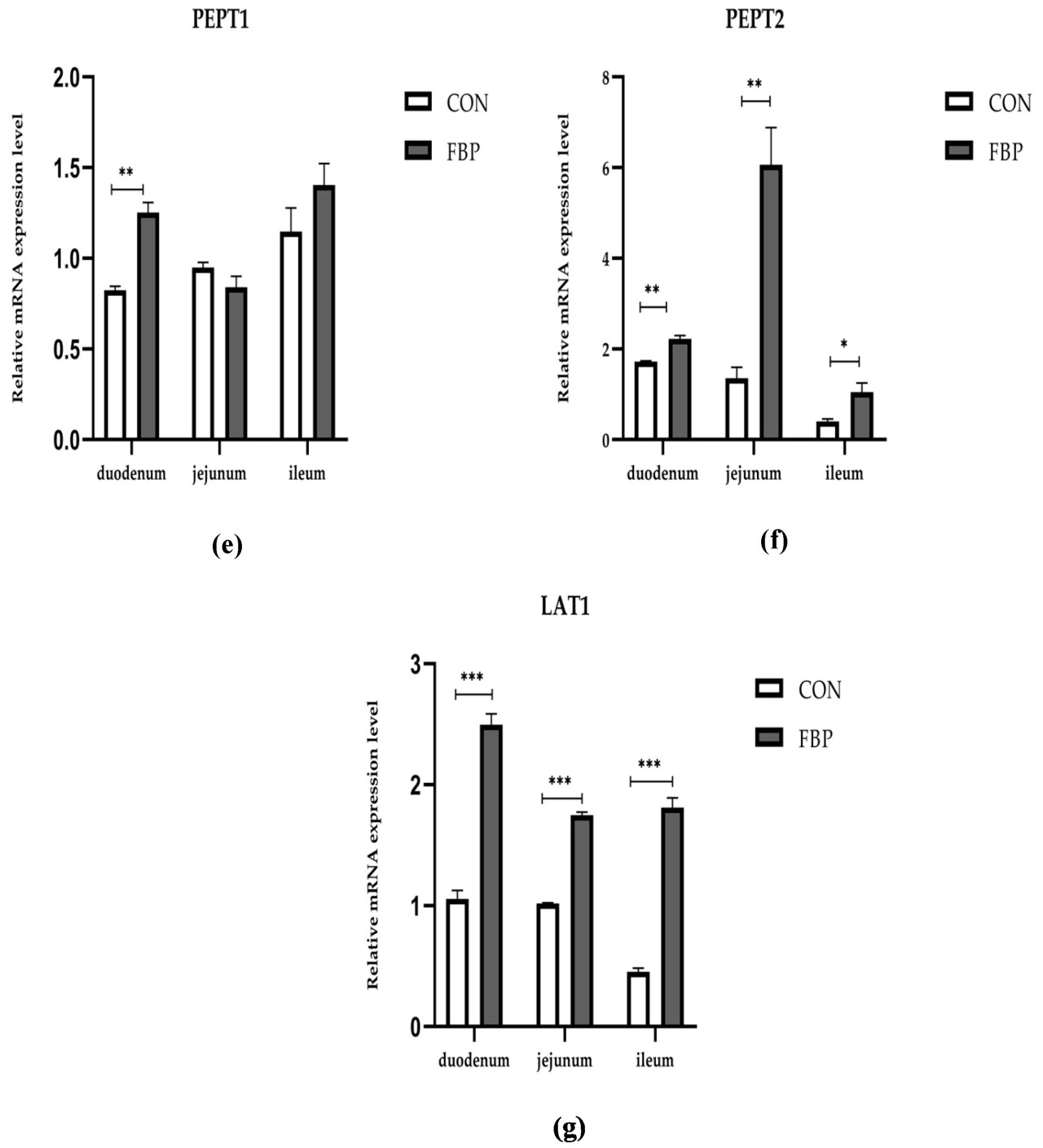
3.6. Влияние ФБП на относительный уровень экспрессии мРНК генов переносчиков питательных веществ в кишечнике
Рисунок 3 иллюстрирует исследование уровней экспрессии мРНК семи генов в трех основных отделах кишечника, в частности, в двенадцатиперстной, тощей и подвздошной кишках, после добавления в корм ФБП. Рацион с ФБП значительно повысил относительную экспрессию мРНК CAT1, CAT2, PepT2 и LAT1 в кишечном тракте птиц по сравнению с группой рациона CON (p < 0,05). Рацион с ФБП не оказал заметного влияния на другие исследованные гены, такие как GLUT1, GLUT2 и PepT1, по сравнению с контрольной группой. И наоборот, рацион с ФБП повысил относительный уровень экспрессии мРНК GLUT в тощей кишке.
Рисунок 3. Относительная экспрессия генов мРНК, кодирующих (a) CAT1, (b) CAT2, (c) GLUT1, (d) GLUT2, (e) PepT1, (f) PepT2 и (g) LAT1. Экспрессия измерена как 2−ΔΔCt относительно экспрессии на 45 день. Данные представлены как среднее ± SEM. Символы , и указывают на значимые различия между группами. Различные символы звездочек соответствуют существенно различающимся средним значениям (p < 0,05).
4. Обсуждение
Предыдущие исследования, проведенные на бройлерах, показали, что включение нерастворимой клетчатки в их рацион может значительно улучшить результаты их роста [20,21]. Множество факторов, включая тип используемых источников клетчатки [22,23], количество включенной клетчатки, размер частиц клетчатки [24,25] и конкретный этап кормления [26], влияют на продуктивность роста бройлеров. Бамбук, быстрорастущее многолетнее растение, признан за ценное содержание питательной клетчатки в бамбуковом порошке. Следовательно, он считается особенно уникальным кормовым сырьем в секторе производства животных [27]. Тем не менее, необходимы дополнительные исследования для изучения потенциальных преимуществ ФБП в области птицеводства. Текущее исследование демонстрирует, что включение рационов, дополненных ФБП, значительно повысило продуктивность роста, особенно в отношении ADFI, на различных этапах роста. Более того, включение ФБП в рацион показало значительное улучшение FCR, в дополнение к значительному увеличению ADG и BWG в периоды роста дни 1–22 и 23–45. Кроме того, ФБП значительно увеличил как массу тушки, так и индексы органов. Наблюдаемые улучшения соответствовали увеличению уровней ФБП на 1% и 2% по сравнению с базовым рационом. Это заключение согласуется с результатами недавнего исследования, которое показало, что включение 1% микронизированного бамбукового порошка в рационы бройлеров улучшило коэффициент конверсии корма и повысило прирост живой массы. Это свидетельствует о том, что ФБП оказывает благоприятное влияние на продуктивность роста [28,29]. Исследователи также провели дополнительное исследование, которое не выявило неблагоприятного воздействия на показатели продуктивности роста, такие как среднесуточное потребление корма (ADFI) и среднесуточный прирост (ADG), у растуще-откармливаемых свиней, получавших рационы с добавками ФБП [15]. Результаты этого исследования показывают, что ФБП может успешно функционировать в качестве кормового компонента в производстве цыплят.
Биохимические показатели сыворотки обычно используются в оценках питания для оценки качества тестируемых кормов или добавок и для понимания физиологической и метаболической активности животных [30]. Настоящее исследование продемонстрировало, что включение ФБП оказало благоприятные результаты на многие биохимические показатели сыворотки. Триглицериды и холестерин являются отдельными липидными молекулами, которые перемещаются внутри организма как компоненты липопротеинов. Ишемическая болезнь сердца — это состояние, возникающее из-за накопления холестерина на стенках артерий, что приводит к образованию бляшек и последующему сужению артерий. Это сужение приводит к снижению кровотока к сердцу. Чрезмерное присутствие триглицеридов и холестерина было связано с развитием ишемической болезни сердца. Моноциты интернализируют частицы липопротеинов низкой плотности (LDL) и прикрепляются к эндотелиальным клеткам, выстилающим коронарную артерию. Впоследствии эти моноциты дифференцируются в макрофаги и затем накапливаются внутри артерии, что приводит к образованию «жировой полоски», которая в конечном итоге прогрессирует в атеросклеротическое поражение [31,32]. В настоящем исследовании наблюдалось, что уровни триглицеридов в крови проявляли стабильное и статистически значимое повышение у цыплят, получавших контрольный рацион, по сравнению с теми, которым предоставлялся рацион с ФБП. И наоборот, не было замечено заметных различий в концентрациях холестерина и LDL. Снижение метаболитов сыворотки, наблюдаемое у бройлеров, получавших рационы, обогащенные ФБП, выявило дополнительные преимущества для здоровья, связанные с включением ФБП в качестве диетической добавки в рационы цыплят-бройлеров. Эти результаты согласуются с предыдущими исследованиями, которые касались благотворного влияния рациона с экстрактом листьев бамбука (BLE) на биохимические маркеры сыворотки у цыплят-бройлеров [33], а также влияния рациона, содержащего отходы переработки ферментированных побегов бамбука (FPSBW), на триглицериды и холестерин сыворотки у свиней [12].
Тем не менее, включение ФБП привело к большему повышению уровня HDL в сыворотке; однако это различие не достигло статистической значимости. Таким образом, включение ФБП может привести к повышению уровней HDL и IgA, что, в свою очередь, улучшает общее состояние здоровья цыплят-бройлеров и обеспечивает защиту от различных заболеваний. Высокое содержание флавоноидов, органических кислот, фенольных соединений и полисахаридов в продуктах из бамбука, которые, как известно, влияют на липидный обмен, способствует повышению концентраций HDL [11,34].
Предыдущие исследования показали, что включение клетчатки из оболочек побегов бамбука в рацион улучшило контроль нарушений жирового обмена у мышей [35]. Это диетическое вмешательство привело к снижению уровня холестерина, триглицеридов и холестерина липопротеинов низкой плотности в сыворотке, одновременно увеличивая уровни холестерина липопротеинов высокой плотности. И наоборот, мы часто рассматриваем уровни общего белка и азота мочевины в сыворотке как индикаторы синтеза и метаболизма белка, факторы, связанные с продуктивностью роста цыплят-бройлеров. Наблюдаемое повышение уровня общего белка в сыворотке указывает на повышенную скорость синтеза и всасывания белка. Присутствие азота мочевины в сыворотке является следствием катаболизма белка. Следовательно, снижение азота мочевины в сыворотке свидетельствует об улучшении синтеза белков из аминокислот [36]. Мы рассматриваем уровень азота мочевины в сыворотке как ключевой фактор в оценке качества диетического белка. Снижение уровня азота мочевины в сыворотке свидетельствует об улучшении качества белка ферментированного корма, отражая более эффективное использование аминокислот для синтеза белков тканей. Тем не менее, уровень глюкозы в сыворотке служит надежным индикатором доступности энергии [37]. В отличие от контрольной группы, в настоящем исследовании отмечено значительное снижение уровня мочевины и глюкозы в сыворотке у цыплят, получавших ФБП. Тем не менее, не наблюдалось заметного влияния на концентрацию общего белка. Этот вывод согласуется с результатами, представленными в более ранних исследованиях [28].
Параметры антиоксидантной защиты, обнаруженные в сыворотке, функционируют как индикаторы способности организма к антиоксидантной защите. Антиоксидантные ферменты, включая глутатионпероксидазу (GSH-Px), супероксиддисмутазу (SOD) и каталазу (CAT), функционируют синергетически для эффективного удаления свободных радикалов и поддержания клеточного гомеостаза. MDA признан побочным продуктом перекисного окисления липидов, функционируя как индикатор для оценки степени окислительного стресса. Результаты нашего исследования показывают, что включение ФБП в рацион значительно повысило активности SOD и CAT в сыворотке, наряду с увеличением активности GSH-Px, в отличие от контрольной группы. Более того, группа ФБП показала значительное снижение концентраций MDA в сыворотке по сравнению с контрольной группой. Флавоноиды, присутствующие в ФБП, вероятно, вносят значительный вклад в повышение эффективности антиоксидантных ферментов и ингибирование синтеза соединений, взаимодействующих с тиобарбитуровой кислотой. Предыдущие исследования показали, что флавоноиды обладают антиоксидантными свойствами в живых организмах благодаря их способности связывать катализаторы металлов, активировать антиоксидантные ферменты, ингибировать оксидазы и переносить электроны на свободные радикалы [38]. Более того, дополнительные исследования показали, что рационы бройлеров, дополненные растительными экстрактами, богатыми флавоноидами, полифенолами и полисахаридами, включая экстракт листьев гинкго билоба [39] и экстракт полыни однолетней, могут усиливать их способность удалять свободные радикалы [40]. И наоборот, введение BLE было связано с улучшениями окислительного статуса цыплят-бройлеров [41]. Результаты нашего текущего исследования согласуются с более ранними исследованиями, показывающими, что диетическая добавка ФБП способствует относительной экспрессии генов, связанных с антиоксидантами, обонятельными рецепторами, ростом и иммунитетом у желтоперых цыплят-бройлеров [42]. Это свидетельствует о том, что включение ФБП в рацион цыплят-бройлеров способствует повышению антиоксидантной способности. Это побуждает к дополнительным исследованиям применения бамбукового порошка в птицеводческом секторе.
Тонкий кишечник играет ключевую роль в всасывании питательных веществ. Исследователи предполагают, что удлиненные кишечные ворсинки увеличивают всасывающую поверхность кишечника, в то время как более короткие кишечные ворсинки препятствуют всасыванию питательных веществ. Увеличение высоты ворсинок напрямую связано с улучшенным перевариванием и всасыванием питательных веществ [43]. Включение рациона, обогащенного BLE, продемонстрировало благотворное влияние на биогенез митохондрий в тонком кишечнике цыплят-бройлеров [44].
Наша работа продемонстрировала, что введение ФБП улучшило рост кишечника за счет увеличения площади поверхности и высоты кишечных ворсинок. Увеличение высоты ворсинок и площади кишечника, наблюдаемое в этом исследовании, объясняется антимикробными, антиоксидантными и противовоспалительными свойствами бамбука, которые усиливают пролиферацию полезных бактерий, одновременно уменьшая количество патогенных бактерий, тем самым снижая воспалительные процессы в слизистой оболочке кишечника [15,45]. Улучшения в структуре и функции кишечника обеспечивают превосходное использование компонентов рациона, таких как белки и минералы, следовательно, повышая эффективность корма.
Процесс включает включение клетчатки посредством диетических добавок и использование кукурузы с крупным размером частиц. Экспрессия кишечного переносчика катионных аминокислот-1 (CAT1), аминопептидазы N (APN) двенадцатиперстной кишки, переносчика аланина, серина, цистеина, треонина-1 (ASCT1) тощей кишки и переносчика пептидов-2 (PepT2) подвздошной кишки, наряду с генами, ответственными за пищеварительные ферменты, заметно повышается в пищеварительной системе цыплят-бройлеров [46]. Когда ферментированная сухая пивная дробина (DBG) добавлялась в корм бройлерам, относительная экспрессия генов переносчиков питательных веществ повышалась в двенадцатиперстной кишке [47].
Текущее исследование выявило улучшение продуктивности бройлеров за счет включения в рацион ФБП, наряду с продемонстрированным повышением регуляции относительной экспрессии различных генов переносчиков питательных веществ в двенадцатиперстной, тощей и подвздошной кишках. Например, было обнаружено, что ФБП повышает регуляцию CAT1, переносчика, облегчающего двунаправленный транспорт катионных аминокислот в двенадцатиперстной, тощей и подвздошной кишках. Более того, GLUT1 тощей кишки, который облегчает транспорт глюкозы, наряду с PepT2, который играет меньшую роль в транспорте ди- и трипептидов, также повышали регуляцию под действием ФБП. Действительно, улучшенный транспорт питательных веществ будет не только способствовать лучшему всасыванию питательных веществ, но и внесет значительный вклад в сохранение иммунного ответа и целостности кишечного барьера. В течение некоторого времени мы признавали, что недостаток аминокислот, таких как аланин, цистеин, серин, треонин, аргинин и лизин, вреден для иммунной функции, тем самым повышая уязвимость животных к инфекционным заболеваниям.
5. Выводы
В целом, включение ФБП в рацион оказало значительное влияние на продуктивность роста. Кроме того, оно оказало положительное влияние на стимулирование биохимических и антиоксидантных показателей сыворотки крови. Это исследование служит важной вехой в понимании потенциала ФБП как источника пищевых волокон для улучшения производства птицы. Учитывая полезные свойства этого растения, мы настоятельно рекомендуем использовать ФБП в качестве добавки в рационы птицы.
Ссылки
1. Bian, F.; Zhong, Z.; Zhang, X.; Yang, C.; Gai, X. Bamboo—An untapped plant resource for the phytoremediation of heavy metal contaminated soils. Chemosphere 2020, 246, 125750. [Google Scholar] [CrossRef]
2. Qi, S.; Song, B.; Liu, C.; Gong, P.; Luo, J.; Zhang, M.; Xiong, T. Bamboo Forest Mapping in China Using the Dense Landsat 8 Image Archive and Google Earth Engine. Remote Sens. 2022, 14, 762. [Google Scholar] [CrossRef]
3. Chongtham, N.; Bisht, M.S. Bamboo: A Prospective Ingredient for Functional Food and Nutraceuticals. In Proceedings of the 10th World Bamboo Congress, Damyang, Republic of Korea, 17–22 September 2015. [Google Scholar]
4. Cheng, Y.; Wan, S.; Yao, L.; Lin, D.; Wu, T.; Chen, Y.; Zhang, A.; Lu, C. Bamboo leaf: A review of traditional medicinal property, phytochemistry, pharmacology, and purification technology. J. Ethnopharmacol. 2023, 306, 116166. [Google Scholar] [CrossRef]
5. Rattanawut, J.; Pimpa, O.; Yamauchi, K.E. Effects of dietary bamboo vinegar supplementation on performance, eggshell quality, ileal microflora composition, and intestinal villus morphology of laying hens in the late phase of production. Anim. Sci. J. 2018, 89, 1572–1580. [Google Scholar] [CrossRef] [PubMed]
6. Nirmala, C.; Bisht, M.S.; Bajwa, H.K.; Santosh, O. Bamboo: A Rich Source of Natural Antioxidants and its Applications in the Food and Pharmaceutical Industry. Trends Food Sci. Technol. 2018, 77, 91–99. [Google Scholar] [CrossRef]
7. Murthy, H.N.; Paek, K.Y. Bioactive Compounds in Underutilized Vegetables and Legumes; Reference Series in Phytochemistry; Springer Nature Switzerland AG: Cham, Switzerland, 2021; pp. 419–440. [Google Scholar]
8. Pei, R.; Liu, X.; Bolling, B. Flavonoids and gut health. Curr. Opin. Biotechnol. 2020, 61, 153–159. [Google Scholar] [CrossRef]
9. Kwon, J.H.; Hwang, S.Y.; Han, J.S. Bamboo (Phyllostachys bambusoides) leaf extracts inhibit adipogenesis by regulating adipogenic transcription factors and enzymes in 3T3-L1 adipocytes. Food Sci. Biotechnol. 2017, 26, 1037–1044. [Google Scholar] [CrossRef] [PubMed]
10. Van Hoyweghen, L.; De Beer, T.; Deforce, D.; Heyerick, A. Phenolic compounds and anti-oxidant capacity of twelve morphologically heterogeneous bamboo species. Phytochem. Anal. 2012, 23, 433–443. [Google Scholar] [CrossRef] [PubMed]
11. Rattanawut, J.; Pimpa, O.; Venkatachalam, K.; Yamauchi, K.E. Effects of bamboo charcoal powder, bamboo vinegar, and their combination in laying hens on performance, egg quality, relative organ weights, and intestinal bacterial populations. Trop. Anim. Health Prod. 2021, 53, 83. [Google Scholar] [CrossRef]
12. Huang, Y.; Peng, Y.; Yang, Z.; Chen, S.; Liu, J.; Wang, Z.; Wang, G.; Lan, S. Effects of Fermented Bamboo Shoot Processing Waste on Growth Performance, Serum Parameters, and Gut Microbiota of Weaned Piglets. Animals 2022, 12, 2728. [Google Scholar] [CrossRef] [PubMed]
13. Bam, Y. Effect of Fermentation on Nutrient Composition of Bamboo Shoot. Int. J. Pure Appl. Biosci. 2017, 5, 1015–1023. [Google Scholar] [CrossRef]
14. Xiao, Z.; Zhang, Q.; Dai, J.; Wang, X.; Yang, Q.; Cai, C.; Mao, J.; Ge, Q. Structural characterization, antioxidant and antimicrobial activity of water-soluble polysaccharides from bamboo (Phyllostachys pubescens Mazel) leaves. Int. J. Biol. Macromol. 2020, 142, 432–442. [Google Scholar] [CrossRef]
15. Liu, Z.; Li, N.; Zhou, X.; Zheng, Z.; Zhang, C.; Liang, S.; Li, Y.; Yan, J.; Li, Q.; Mu, S. Effects of Fermented Bamboo Powder Supplementation on Serum Biochemical Parameters, Immune Indices, and Fecal Microbial Composition in Growing-Finishing Pigs. Animals 2022, 12, 3127. [Google Scholar] [CrossRef]
16. Fotiadis, D.; Kanai, Y.; Palacin, M. The SLC3 and SLC7 families of amino acid transporters. Mol. Asp. Med. 2013, 34, 139–158. [Google Scholar] [CrossRef] [PubMed]
17. Roder, P.V.; Geillinger, K.E.; Zietek, T.S.; Thorens, B.; Koepsell, H.; Daniel, H. The role of SGLT1 and GLUT2 in intestinal glucose transport and sensing. PLoS ONE 2014, 9, e89977. [Google Scholar] [CrossRef] [PubMed]
18. Malyar, R.M.; Wei, Q.; Hou, L.; Elsaid, S.H.; Zhang, Y.; Banuree, S.A.H.; Saifullah; Zhou, W.; Shi, F. Fermented Bamboo Powder Activates Gut Odorant Receptors, and Promotes Intestinal Health and Growth Performance of Dwarf Yellow-Feathered Broiler Chickens. Poult. Sci. 2024, 103, 70. [Google Scholar] [CrossRef] [PubMed]
19. Nain, S.; Renema, R.; Zuidhof, M.; Korver, D.R. Effect of metabolic efficiency and intestinal morphology on variability in n-3 polyunsaturated fatty acid enrichment of eggs. Poult. Sci. 2012, 91, 888–898. [Google Scholar] [CrossRef]
20. Jimenez-Moreno, E.; de Coca-Sinova, A.; Gonzalez-Alvarado, J.M.; Mateos, G.G. Inclusion of insoluble fiber sources in mash or pellet diets for young broilers. 1. Effects on growth performance and water intake. Poult. Sci. 2016, 95, 41–52. [Google Scholar] [CrossRef] [PubMed]
21. Jimenez-Moreno, E.; Gonzalez-Alvarado, J.M.; de Coca-Sinova, A.; Lazaro, R.P.; Camara, L.; Mateos, G.G. Insoluble fiber sources in mash or pellets diets for young broilers. 2. Effects on gastrointestinal tract development and nutrient digestibility. Poult. Sci. 2019, 98, 2531–2547. [Google Scholar] [CrossRef]
22. Pourazadi, Z.; Salari, S.; Tabandeh, M.R.; Abdollahi, M.R. Effect of particle size of insoluble fibre on growth performance, apparent ileal digestibility and caecal microbial population in broiler chickens fed barley-containing diets. Br. Poult. Sci. 2020, 61, 734–745. [Google Scholar] [CrossRef]
23. Tejeda, O.J.; Kim, W.K. Effects of fiber type, particle size, and inclusion level on the growth performance, digestive organ growth, intestinal morphology, intestinal viscosity, and gene expression of broilers. Poult. Sci. 2021, 100, 1397. [Google Scholar] [CrossRef] [PubMed]
24. Berrocoso, J.D.; Garcia-Ruiz, A.; Page, G.; Jaworski, N.W. The effect of added oat hulls or sugar beet pulp to diets containing rapidly or slowly digestible protein sources on broiler growth performance from 0 to 36 days of age. Poult. Sci. 2020, 99, 6859–6866. [Google Scholar] [CrossRef] [PubMed]
25. Amerah, A.M.; Ravindran, V.; Lentle, R.G. Influence of insoluble fibre and whole wheat inclusion on the performance, digestive tract development and ileal microbiota profile of broiler chickens. Br. Poult. Sci. 2009, 50, 366–375. [Google Scholar] [CrossRef] [PubMed]
26. Ramakrishnan, M.; Yrjälä, K.; Vinod, K.K.; Sharma, A.; Cho, J.; Satheesh, V.; Zhou, M. Genetics and genomics of moso bamboo (Phyllostachys edulis): Current status, future challenges, and biotechnological opportunities toward a sustainable bamboo industry. Food Energy Secur. 2020, 9, e229. [Google Scholar] [CrossRef]
27. Dai, F.; Lin, T.; Cheng, L.; Wang, J.; Zuo, J.; Feng, D. Effects of micronized bamboo powder on growth performance, serum biochemical indexes, cecal chyme microflora and metabolism of broilers aged 1–22 days. Trop. Anim. Health Prod. 2022, 54, 166. [Google Scholar] [CrossRef]
28. Dai, F.; Lin, T.; Huang, X.; Yang, Y.; Nong, X.; Zuo, J.; Feng, D. Effects of micronised bamboo powder on growth performance, intestinal development, caecal chyme microflora and metabolic pathway of broilers aged 24–45 days. Anim. Prod. Sci. 2023, 63, 1196–1207. [Google Scholar] [CrossRef]
29. Ogbuewu, I.P.; Emenalom, O.O.; Okoli, I.C. Alternative feedstuffs and their effects on blood chemistry and haematology of rabbits and chickens: A review. Comp. Clin. Pathol. 2015, 26, 277–286. [Google Scholar] [CrossRef]
30. Weingartner, O.; Weingartner, N.; Scheller, B.; Lutjohann, D.; Graber, S.; Schafers, H.J.; Bohm, M.; Laufs, U. Alterations in cholesterol homeostasis are associated with coronary heart disease in patients with aortic stenosis. Coron. Artery Dis. 2009, 20, 376–382. [Google Scholar] [CrossRef]
31. Lee, E.J.; Kim, M.H.; Kim, Y.R.; Park, J.W.; Park, W.J. Proteasome inhibition protects against diet-induced gallstone formation through modulation of cholesterol and bile acid homeostasis. Int. J. Mol. Med. 2018, 41, 1715–1723. [Google Scholar] [CrossRef]
32. Oloruntola, O.D.; Agbede, J.O.; Ayodele, S.O.; Oloruntola, D.A. Neem, pawpaw and bamboo leaf meal dietary supplementation in broiler chickens: Effect on performance and health status. J. Food Biochem. 2019, 43, e12723. [Google Scholar] [CrossRef]
33. Ge, Q.; Li, H.; Wu, P.; Sha, R.; Xiao, Z.; Dai, J.; Mao, J. Investigation of physicochemical properties and antioxidant activity of ultrafine bamboo leaf powder prepared by ball milling. J. Food Process. Preserv. 2020, 44, e14506. [Google Scholar] [CrossRef]
34. Luo, X.; Wang, Q.; Zheng, B.; Lin, L.; Chen, B.; Zheng, Y.; Xiao, J. Hydration properties and binding capacities of dietary fibers from bamboo shoot shell and its hypolipidemic effects in mice. Food Chem. Toxicol. 2017, 109, 1003–1009. [Google Scholar] [CrossRef] [PubMed]
35. Kim, J.S.; Ingale, S.L.; Lee, S.H.; Kim, K.H.; Kim, J.S.; Lee, J.H.; Chae, B.J. Effects of energy levels of diet and β-mannanase supplementation on growth performance, apparent total tract digestibility and blood metabolites in growing pigs. Anim. Feed Sci. Technol. 2013, 186, 64–70. [Google Scholar] [CrossRef]
36. Wang, H.; Chen, Y.; Zhao, Y.N.; Liu, H.; Liu, J.; Makkar, H.P.S.; Becker, K. Effects of replacing soybean meal by detoxified Jatropha curcas kernel meal in the diet of growing pigs on their growth, serum biochemical parameters and visceral organs. Anim. Feed Sci. Technol. 2011, 170, 141–146. [Google Scholar] [CrossRef]
37. Heim, K.E.; Tagliaferro, A.R.; Bobilya, D.J. Flavonoid antioxidants: Chemistry, metabolism and structure-activity relationships. J. Nutr. Biochem. 2002, 13, 572–584. [Google Scholar] [CrossRef] [PubMed]
38. Niu, Y.; Wan, X.L.; Zhang, X.H.; Zhao, L.G.; He, J.T.; Zhang, J.F.; Zhang, L.L.; Wang, T. Effect of supplemental fermented Ginkgo biloba leaves at different levels on growth performance, meat quality, and antioxidant status of breast and thigh muscles in broiler chickens. Poult. Sci. 2017, 96, 869–877. [Google Scholar] [CrossRef]
39. Wan, X.L.; Song, Z.H.; Niu, Y.; Cheng, K.; Zhang, J.F.; Ahmad, H.; Zhang, L.L.; Wang, T. Evaluation of enzymatically treated Artemisia annua L. on growth performance, meat quality, and oxidative stability of breast and thigh muscles in broilers. Poult. Sci. 2017, 96, 844–850. [Google Scholar] [CrossRef] [PubMed]
40. Shen, M.; Xie, Z.; Jia, M.; Li, A.; Han, H.; Wang, T.; Zhang, L. Effect of Bamboo Leaf Extract on Antioxidant Status and Cholesterol Metabolism in Broiler Chickens. Animals 2019, 9, 699. [Google Scholar] [CrossRef]
41. Malyar, R.M.; Ding, W.; Wei, Q.; Sun, J.; Hou, L.; Elsaid, S.H.; Ali, I.; Zhou, W.; Shi, F. Effects of fermented bamboo powder supplementation on gene expressions of antioxidant, odorant receptors, growth and immunity in yellow-feather broiler chickens. Anim. Adv. 2024, 1, e005. [Google Scholar] [CrossRef]
42. Montagne, L.; Pluske, J.R.; Hampson, D.J. A review of interactions between dietary fibre and the intestinal mucosa, and their consequences on digestive health in young non-ruminant animals. Anim. Feed Sci. Technol. 2003, 108, 95–117. [Google Scholar] [CrossRef]
43. Xie, Z.; Yu, G.; Yun, Y.; Zhang, X.; Shen, M.; Jia, M.; Li, A.; Zhang, H.; Wang, T.; Zhang, J.; et al. Effects of bamboo leaf extract on energy metabolism, antioxidant capacity, and biogenesis of small intestine mitochondria in broilers. J. Anim. Sci. 2022, 101, skac391. [Google Scholar] [CrossRef]
44. Li, Q.; Fang, X.; Chen, H.; Han, Y.; Liu, R.; Wu, W.; Gao, H. Retarding effect of dietary fibers from bamboo shoot (Phyllostachys edulis) in hyperlipidemic rats induced by a high-fat diet. Food Funct. 2021, 12, 4696–4706. [Google Scholar] [CrossRef] [PubMed]
45. Kaminski, N.A.; Wong, E.A. Differential mRNA expression of nutrient transporters in male and female chickens. Poult. Sci. 2018, 97, 313–318. [Google Scholar] [CrossRef]
46. Kheravii, S.K.; Swick, R.A.; Choct, M.; Wu, S.B. Upregulation of genes encoding digestive enzymes and nutrient transporters in the digestive system of broiler chickens by dietary supplementation of fiber and inclusion of coarse particle size corn. BMC Genom. 2018, 19, 208. [Google Scholar] [CrossRef] [PubMed]
47. Al-Khalaifah, H.S.; Shahin, S.E.; Omar, A.E.; Mohammed, H.A.; Mahmoud, H.I.; Ibrahim, D. Effects of graded levels of microbial fermented or enzymatically treated dried brewer’s grains on growth, digestive and nutrient transporter genes expression and cost effectiveness in broiler chickens. BMC Vet. Res. 2020, 16, 424. [Google Scholar] [CrossRef] [PubMed]
Shoura HE, Ding W, Hou L, Malyar RM, Wei Q, Zhou W, Shi F. Fermented Bamboo Powder Affects Dwarf Yellow-Feathered Broiler Growth, Blood Biochemistry, Antioxidant Status, Intestinal Morphology, and Nutrient Transporter Gene Expression. Agriculture. 2025; 15(3):240. https://doi.org/10.3390/agriculture15030240
Перевод статьи «Fermented Bamboo Powder Affects Dwarf Yellow-Feathered Broiler Growth, Blood Biochemistry, Antioxidant Status, Intestinal Morphology, and Nutrient Transporter Gene Expression» авторов Shoura HE, Ding W, Hou L, Malyar RM, Wei Q, Zhou W, Shi F., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык































































































Комментарии (0)