Молодые или зрелые: какие листья жимолости полезнее?
Жимолость синяя (Lonicera caerulea) — это богатое питательными веществами растение, имеющее важное значение. Ее химический состав зависит от различных внутренних свойств и внешних факторов, которые меняются в зависимости от сезона. Целью данного исследования была оценка влияния различных сроков сбора на общий химический состав, содержание пигментов, макроэлементов, биологически активных соединений и антиоксидантную активность в листьях жимолости. Были проанализированы сезонные изменения содержания клетчатки, золы, белков, азота (N), калия (K), магния (Mg), фосфора (P), кальция (Ca), хлорофиллов, суммарных каротиноидов, суммы флавоноидов и суммы фенольных соединений.
Результаты показали, что время сбора и сорт растения существенно влияют на химический состав листьев жимолости. При первом сборе были отмечены самые высокие уровни содержания белка, N, P, K, хлорофилла a и b, общего хлорофилла и суммарных каротиноидов. И наоборот, при третьем сборе наблюдалось самое высокое содержание Ca и Mg. В частности, листья третьего сбора сорта 'Indigo Yum' имели самое высокое содержание Ca и Mg, в то время как листья второго сбора сорта 'Zojka' (116,67 мг на 100 г сухого вещества) и третьего сбора сорта 'Wojtek' (115 мг на 100 г сухого вещества) содержали больше всего суммы флавоноидов. В листьях первого сбора сорта 'Wojtek' зафиксированы самые высокие уровни белка, N, P и суммарных каротиноидов, тогда как при третьем сборе отмечено самое высокое содержание клетчатки и золы.
Эти результаты дают ценную информацию для фермеров, позволяя им выбирать подходящие сорта и оптимальные сроки сбора для получения высококачественных листьев жимолости, предназначенных для использования в качестве пищевых продуктов или лекарственных добавок.
1. Введение
Жимолость синяя (Lonicera caerulea L.), многолетнее древесное растение, принадлежащее к семейству Жимолостные (Caprifoliaceae), дает ягоды, богатые биологически активными соединениями. К ним относятся антоцианы, полифенолы и различные незаменимые витамины, которые играют важнейшую роль в питании человека и должны поступать из различных продуктов питания [1]. Кроме того, эти ягоды богаты аскорбиновой кислотой. Благодаря содержанию антиоксидантов, ягоды жимолости полезны в качестве потенциального средства для лечения онкологических и сердечно-сосудистых заболеваний, а также поддерживают функцию печени, стабилизируют кровяное давление и представляют ценность для людей с диабетом из-за низкого содержания сахара [2]. В некоторых странах, например в Японии, жимолость издавна культивируется и используется в народной медицине как ягода, обладающая омолаживающим действием, полезная для сердца и стимулирующая пищеварение [3]. Жимолость, называемая питательно и биологически превосходным суперфудом (superfood), как было показано, обладает в три-пять раз более высокой антиоксидантной активностью, чем клубника или смородина [4].
В последние годы интерес к съедобной жимолости возрос, и были проведены исследования для оценки пищевой ценности ягод, но информация о других частях съедобной жимолости, в данном случае о листьях, все еще недостаточна [5]. После сбора ягод листья жимолости обычно оставляют под кустами и считают сельскохозяйственными отходами [6]. Однако исследования показали, что листья жимолости являются богатым источником многих биологически активных соединений, таких как флавоноиды, хлорогеновая кислота, фенольные соединения, каротиноиды и другие соединения [7]. Полифенолы в листьях жимолости способствуют их антиоксидантным и противовоспалительным свойствам, которые полезны для общего здоровья и ассоциируются с оздоровительными свойствами [8]. Исследователи предполагают, что экстракты этих листьев могут ингибировать рост различных патогенов, таких как Streptococcus pyogenes. Они также используются в народной медицине для лечения респираторных инфекций и снижения уровня провоспалительных медиаторов [9,10]. Исследования свидетельствуют, что листья Lonicera caerulea можно использовать в виде настоев для лечения диабета 2 типа благодаря их плейотропным эффектам, которые включают ингибирование ферментов, усваивающих сахар, снижение уровня холестерина, уменьшение осложнений, связанных с диабетом, и подавление провоспалительных процессов [11]. В настоящее время наиболее широко используемым сырьем для настоев являются листья шелковицы белой; однако листья жимолости стали перспективной альтернативой, предлагающей уникальный терапевтический потенциал. Для выяснения механизмов действия и изучения клинического применения биоактивных соединений, присутствующих в этих листьях, все еще требуются всесторонние исследования. Хотя листья часто рассматриваются как побочные продукты, они содержат ценные биоактивные соединения. Использование этих листьев в качестве сырья благодаря их полезным свойствам могло бы способствовать росту экологической устойчивости [10,12].
Несмотря на растущий интерес к питательным и функциональным свойствам листьев жимолости, исследования в этой области все еще находятся на начальной стадии, и данных в настоящее время недостаточно. Листья жимолости используются только как отходы в сельском хозяйстве. В частности, отсутствуют комплексные исследования, изучающие распределение ключевых биохимических компонентов, таких как общий химический состав, пигменты, макроэлементы и фенольные соединения, в листьях в разные сроки сбора [13]. Влияние различных сроков сбора на эти компоненты особенно слабо изучено, что оставляет значительный пробел в знаниях о том, как временные изменения влияют на питательный профиль и биоактивный потенциал листьев жимолости. Также отсутствуют рекомендации по использованию листьев жимолости [14].
Данное исследование было направлено на систематическое изучение влияния времени сбора на листья жимолости и изучение их потенциала как устойчивого ресурса. Анализ включает общий химический состав, концентрацию пигментов, макроэлементы и отдельные биоактивные соединения, известные своими оздоровительными свойствами. Кроме того, в этом исследовании оценивается антиоксидантная активность листьев, что позволяет понять, как время сбора может оптимизировать их функциональные и питательные качества. Анализируя листья жимолости как новое сырье для получения питательных веществ, это исследование направлено на то, чтобы подчеркнуть их потенциальное применение в питании и медицине. Результаты подчеркивают надежду на то, что полученные результаты предоставят ценные знания производителям и переработчикам и откроют новые возможности в науке о питании и разработке растительных продуктов для здоровья.
2. Материалы и методы
2.1. Полевой эксперимент
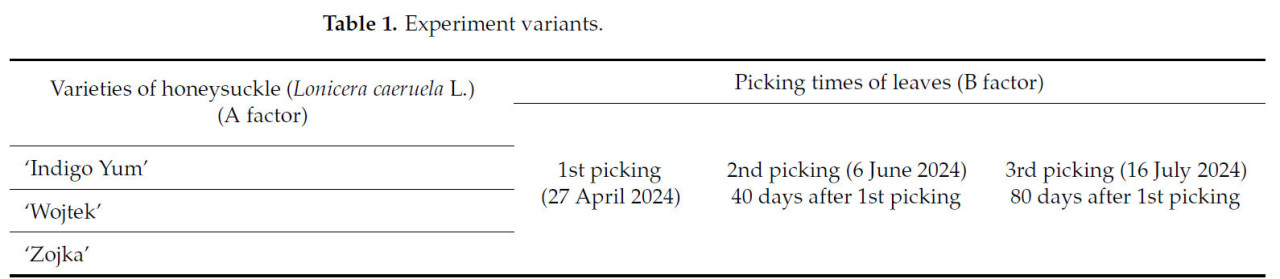
Был проведен двухфакторный полевой эксперимент с тремя сортами съедобной жимолости - 'Indigo Yum', 'Wojtek' и 'Zojka' (фактор А) - и тремя различными сроками сбора листьев (фактор В) - 1-й сбор (27 апреля), 2-й сбор (через 40 дней после 1-го сбора), 3-й сбор (через 80 дней после 1-го сбора) (Таблица 1). Делянки полевого опыта были расположены рендомизированно с четырьмя повторностями, и каждая опытная делянка содержала пять кустов. Расстояния посадки для съедобной жимолости составляли 4,0 м между рядами и 0,7 м между кустами. Полевой эксперимент был проведен в 2024 году на ферме по выращиванию съедобной жимолости в Алитусском районе, Литва (54°29′44,7″ с.ш. 24°00′14,5″ в.д.).
Таблица 1. Варианты эксперимента.
2.2. Подготовка образцов листьев жимолости
Листья каждого сорта жимолости собирали вручную со всех четырех сторон куста в одинаковых условиях, чтобы они представляли весь куст. Для анализов было собрано приблизительно 200 г листьев для каждого сорта и стадии роста. Образцы листьев замораживали при температуре -35 °C и сублимировали (ZIRBUS Technology GmbH, Бад-Грунд, Германия). После лиофилизации листья измельчали в течение 1 минуты при 8000 об/мин с использованием лабораторной мельницы (Grindomix GM 200, Retsch GmbH, Хаан, Германия) и затем хранили в морозильной камере при температуре -34 °C до проведения анализа.
2.3. Химические вещества и реактивы
Для экстракции использовали этанол аналитической чистоты от MV Group (MV Group, Каунас, Литва) сельскохозяйственного происхождения. Деминерализованную воду получали из системы Milli-Q (Millipore, Берлингтон, Массачусетс, США). Галловую кислоту (97%), реактив Фолина-Чокальтеу, 2,2-дифенил-1-пикрилгидразил гидрат (свободный радикал) (DPPH, 95%), раствор хлорида алюминия (2%) и ацетат натрия (чистота ≥99,5%) были получены от Enola (Enola, Рига, Латвия). Серную кислоту (98%) приобрели у компании Merck (Merck, Познань, Польша). Ацетон, азотную кислоту, пероксид водорода и морской песок поставила компания Sigma-Aldrich (Штайнхайм, Германия).
2.4. Анализ содержания клетчатки, золы и белка
Содержание клетчатки определяли в соответствии с официальными методами Ассоциации официальных сельскохозяйственных химиков (AOAC) [15]. Содержание золы определяли количественно путем сжигания при 550 °C [16]. Содержание белка анализировали методом Кьельдаля с использованием аппарата KJELDATHERM (Gerhardt, Кёнигсвинтер, Германия) [17].
2.5. Анализ макроэлементов
Порошкообразные образцы листьев жимолости были подготовлены и проанализированы с использованием стандартизированных методологий. Содержание азота (N) определяли количественно методом Кьельдаля с использованием аппарата KJELDATHERM (Gerhardt, Кёнигсвинтер, Германия). Калий (K), магний (Mg), фосфор (P) и кальций (Ca) измеряли фотометрически после мокрого озоления в серной кислоте. Дополнительно элементы анализировали с использованием атомно-эмиссионной спектрометрии с индуктивно связанной плазмой (ИСП-АЭС) после кислотного разложения смесью азотной кислоты и пероксида водорода (HNO3:H2O2, 5:3, об/об) в микроволновой системе. Процесс разложения проводили путем постепенного повышения температуры до 200 °C в течение 20 минут и выдерживания при этом уровне в течение 2 часов. Все процедуры выполнялись в соответствии со стандартным методом (LST EN 15510:2017) [18].
2.6. Анализ пигментов
Концентрации хлорофилла a и b, общего хлорофилла и суммарных каротиноидов определяли количественно с помощью УФ-ВИД спектроскопии [19]. Концентрации пигментов определяли по калибровочным кривым, полученным для известных концентраций стандартов. Для каждого анализа 0,1 г ткани листа гомогенизировали с небольшим количеством морского песка и 50 мл ацетона. Полученную смесь затем фильтровали для получения прозрачного раствора. Измерения абсорбции регистрировали при длинах волн 644,00 нм, 662,00 нм и 440,50 нм для оценки уровней пигментов.
2.7. Анализ общего содержания фенольных соединений (ОСФ)
Общее содержание фенольных соединений в листьях определяли методом Фолина-Чокальтеу с использованием галловой кислоты в качестве стандарта [20]. Образец готовили с использованием 0,5 г сублимированного порошка листьев жимолости и 10 мл 75% водного этанола. Образец гомогенизировали в течение 60 секунд с использованием гомогенизатора (модель VDI 25 s40, Retsch GmbH, Хаан, Германия), оставляли в темноте на 30 минут, а затем фильтровали с использованием бумаги Whatman (удержание 8–12 мкм). Реактив готовили разбавлением исходного раствора чистой дистиллированной водой (1/10, об/об). В измерительную кювету добавляли 100 мкл образца, затем 300 мкл 0,2 М реактива Фолина-Чокальтеу и 1,0 мл Na2CO3. Смесь затем инкубировали при комнатной температуре в течение 60 минут. После этого абсорбцию всех образцов измеряли при длине волны 765 нм с использованием спектрофотометра Spectro UVD-3200 (Spectro UV-VIS Double Beam PC, Labomed, Лос-Анджелес, Калифорния, США). Общую концентрацию фенольных соединений определяли по калибровочной кривой галловой кислоты и выражали в мг 100 г−1 сухого образца [21].
2.8. Анализ общего содержания флавоноидов (ОСФл)
Общее содержание флавоноидов определяли колориметрическим методом с хлоридом алюминия [22]. Образец готовили путем инкубации 0,5 г лиофилизированного порошка листьев с 10 мл 75% EtOH в течение 60 минут в автоматическом шейкере (Heidolph Vibramax 100, 31 Вт, Retsch GmbH, Хаан, Германия) при 1200 об/мин. Затем образец фильтровали через бумагу Whatman (удержание 8–12 мкм). Для приготовления смесей образцов к 1,0 мл экстракта листьев жимолости добавляли 10 мл 2% раствора хлорида алюминия, 2 мл 96% этанола и 1,0 мл 1М ацетата натрия. Смесь затем инкубировали в течение 30 минут в темноте. После этого измеряли абсорбцию при длине волны 415 нм с использованием УФ-спектрофотометра Varian Cary 50 (Labomed Inc., Лос-Анджелес, Калифорния, США) и двулучевого спектрофотометра Spectro UV-VIS (Labomed Inc., Лос-Анджелес, Калифорния, США).
2.9. Антиоксидантная активность
Антиоксидантную активность листьев оценивали с использованием DPPH-анализа [23]. В пробирку 0,5 г лиофилизированного порошка листьев жимолости смешивали с 10 мл 50% этанола и 5 мл разбавленного раствора DPPH. Смесь тщательно встряхивали и инкубировали в темноте в течение 30 минут для предотвращения светоиндуцированной деградации. После инкубации измеряли абсорбцию при длине волны 517 нм с использованием двулучевого спектрофотометра Spectro UV-VIS (Varian Co., Пало-Альто, Санта-Клара, Калифорния, США).
2.10. Статистический анализ
Данные были статистически проанализированы с использованием дисперсионного анализа (ANOVA) с помощью программного обеспечения STATISTICA 10. Рассчитывали средние арифметические экспериментальных данных, а статистическую значимость различий между групповыми средними оценивали с использованием критерия Тьюки (p < 0,05). Образцы листьев жимолости трех сортов, собранные в разное время, были классифицированы с использованием анализа главных компонент (АГК) с помощью программного обеспечения XLSTAT 2018 (Нью-Йорк, Нью-Йорк, США) на основе их общего химического состава, содержания пигментов, макроэлементов, суммы флавоноидов и суммы фенольных соединений.
3. Результаты
3.1. Общий химический состав
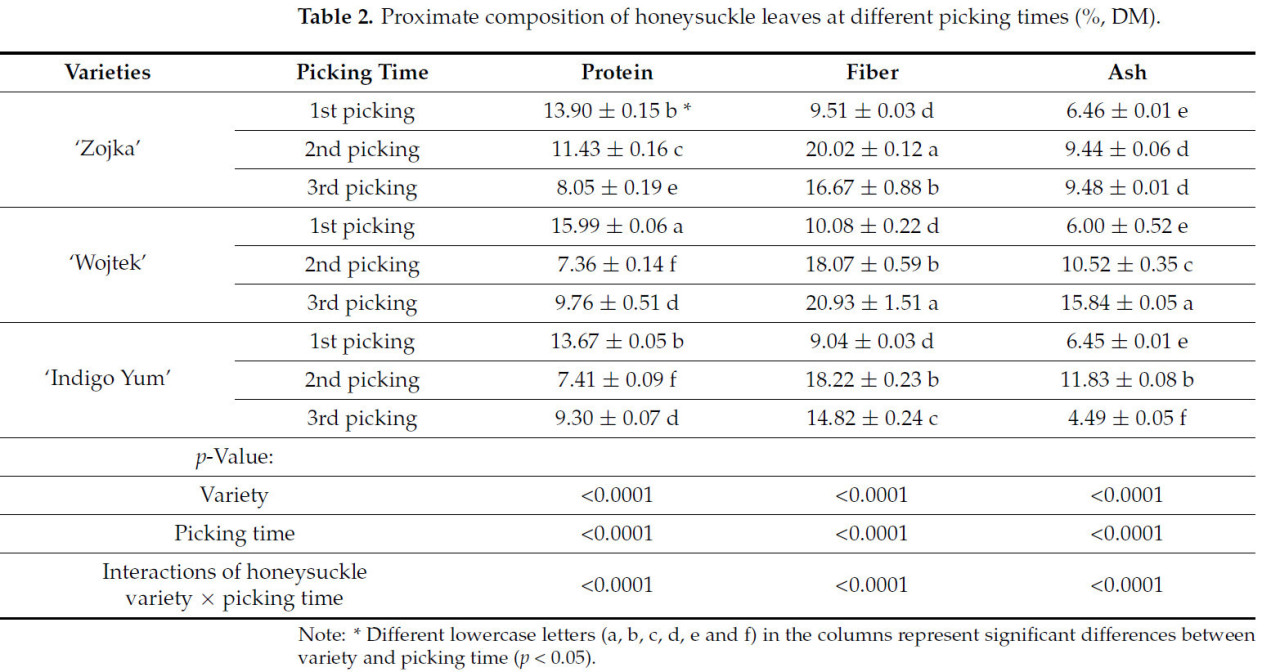
Данное исследование показало, что время сбора листьев и специфические свойства сортов жимолости существенно влияют на общий химический состав листьев жимолости (Таблица 2). Среди полученных результатов самое высокое содержание белка (15,99% СВ) наблюдалось в листьях сорта 'Wojtek' при первом сборе, в то время как самое высокое содержание золы (15,84% СВ) отмечено в листьях того же сорта при третьем сборе. Самое высокое содержание клетчатки было обнаружено в листьях 'Wojtek' при третьем сборе (20,93% СВ) и листьях 'Zojka' при втором сборе (20,02% СВ). И наоборот, самое низкое содержание белка (7,36% СВ) было обнаружено в листьях 'Wojtek' при втором сборе. Во время первого сбора у всех проанализированных сортов жимолости наблюдалось самое низкое содержание клетчатки ('Zojka': 9,51% СВ, 'Wojtek': 10,08% СВ и 'Indigo Yum': 9,04% СВ) по сравнению с последующими сборами. Кроме того, самое низкое содержание золы (4,49% СВ) было зафиксировано в листьях 'Indigo Yum' при третьем сборе. Недавние исследования Rupasinghe и др. [1] показывают, что листья жимолости содержат белки приблизительно 1,84 мг 100 г−1 (сырой массы), что свидетельствует об их потенциале как источника белка для потребления человеком. Хотя в литературе отсутствуют данные о содержании белка, клетчатки и золы в листьях жимолости в разные сроки сбора, исследования на других растениях подтвердили наши результаты. Снижение содержания белка в листьях с возрастом растения также было отмечено для листьев смородины белой [24]. Согласно литературе, по мере старения листьев белки разрушаются, а образующиеся пептиды и аминокислоты переносятся в другие органы для хранения и повторно используются для роста корней или цветов в течение следующего вегетационного периода [25,26]. Уменьшение содержания белка по мере старения листьев обычно приводит к увеличению структурных компонентов растения, таких как лигнин, гемицеллюлоза и целлюлоза [27]. Ortíz-Ocampo и др. [28] также обнаружили, что содержание клетчатки в листьях Gymnopodium floribundum Rolfe было значительно выше в сентябре по сравнению с образцами, собранными в марте и июне. Более раннее исследование, проведенное Ziobroń и др. [24], также показало, что содержание золы во всех изученных листьях смородины увеличивалось с созреванием.
Таблица 2. Общий химический состав листьев жимолости в разные сроки сбора (%, СВ).
3.2. Содержание пигментов
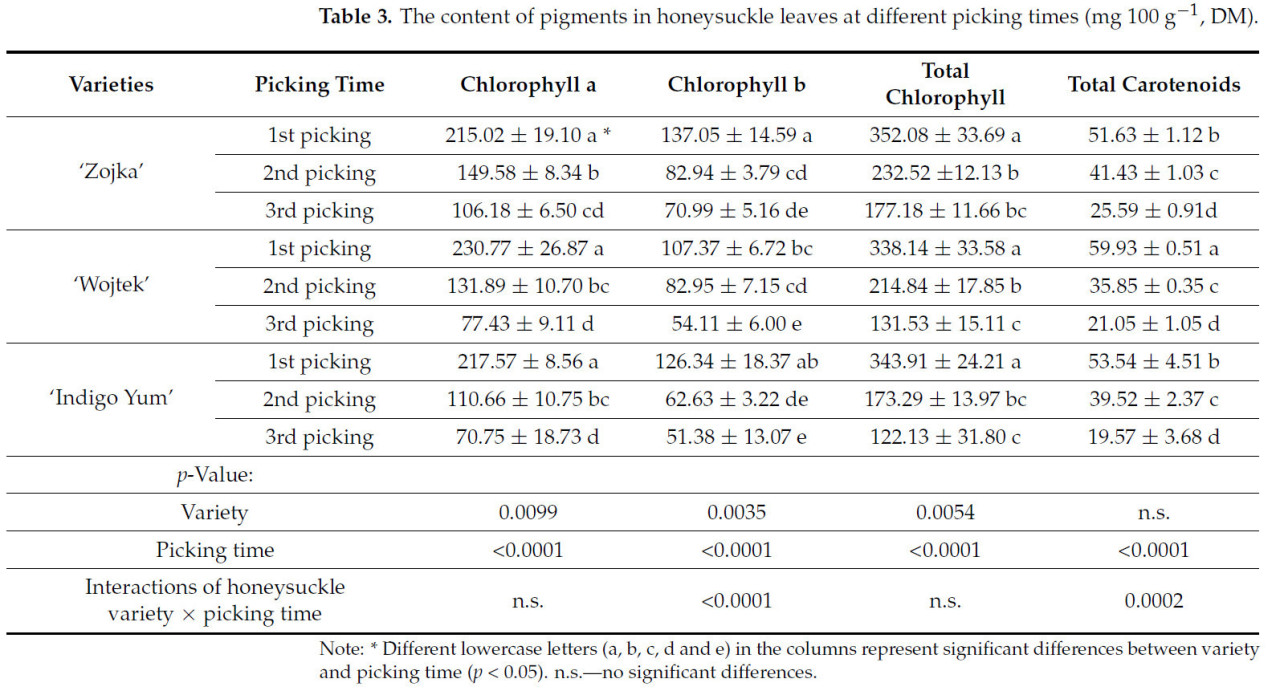
Содержание пигментов в образцах листьев жимолости обобщено в Таблице 3. Самые высокие уровни хлорофилла a наблюдались при первом сборе для сортов 'Zojka' (215,02 мг 100 г−1 СВ), 'Wojtek' (230,77 мг 100 г−1 СВ) и 'Indigo Yum' (217,57 мг 100 г−1 СВ). Напротив, самые низкие уровни хлорофилла a были зафиксированы при третьем сборе, составляя от 77,43 до 106,18 мг 100 г−1 СВ для всех протестированных сортов. Уровни хлорофилла b в листьях варьировали от 51,38 до 137,05 мг 100 г−1 СВ, причем самые высокие количества обнаружены при первом сборе у 'Zojka' (137,05 мг 100 г−1 СВ) и 'Indigo Yum' (126,34 мг 100 г−1 СВ). Общее содержание хлорофилла также было самым высоким при первом сборе, со значениями 352,08 мг 100 г−1 СВ у 'Zojka', 338,14 мг 100 г−1 СВ у 'Wojtek' и 343,91 мг 100 г−1 СВ у 'Indigo Yum'. Значительное снижение уровней пигментов наблюдалось по мере созревания листьев. Аналогично, самое высокое содержание каротиноидов было зафиксировано в листьях 'Wojtek' при первом сборе (59,93 мг 100 г−1 СВ), в то время как самые низкие уровни каротиноидов были обнаружены при третьем сборе: 'Zojka' (25,59 мг 100 г−1 СВ), 'Wojtek' (21,05 мг 100 г−1 СВ) и 'Indigo Yum' (19,57 мг 100 г−1 СВ). Эти результаты согласуются с предыдущими исследованиями. Sip и др. [11] сообщили об уровнях хлорофилла a 10,29–13,38 мг г−1 СВ, хлорофилла b 4,31–5,63 мг г−1 СВ и каротиноидов 1,81–2,22 мг г−1 СВ в листьях жимолости, подчеркивая роль интенсивности света и факторов окружающей среды в концентрации пигментов. Liu и др. [29] подчеркнули взаимосвязь между хлорофиллом, каротиноидами и другими фитохимическими веществами, отмечая их важность для биоактивных и лекарственных свойств. Yan и др. [30] также сообщили о концентрациях пигментов в листьях жимолости: хлорофилл a (0,126 мг г−1), хлорофилл b (0,062 мг г−1), общий хлорофилл (2,00 мг г−1) и каротиноиды (0,23 мг г−1), подчеркивая их ключевую роль в фотосинтезе и общей функции растений.
Таблица 3. Содержание пигментов в листьях жимолости в разные сроки сбора (мг 100 г−1, СВ).
3.3. Макроэлементы
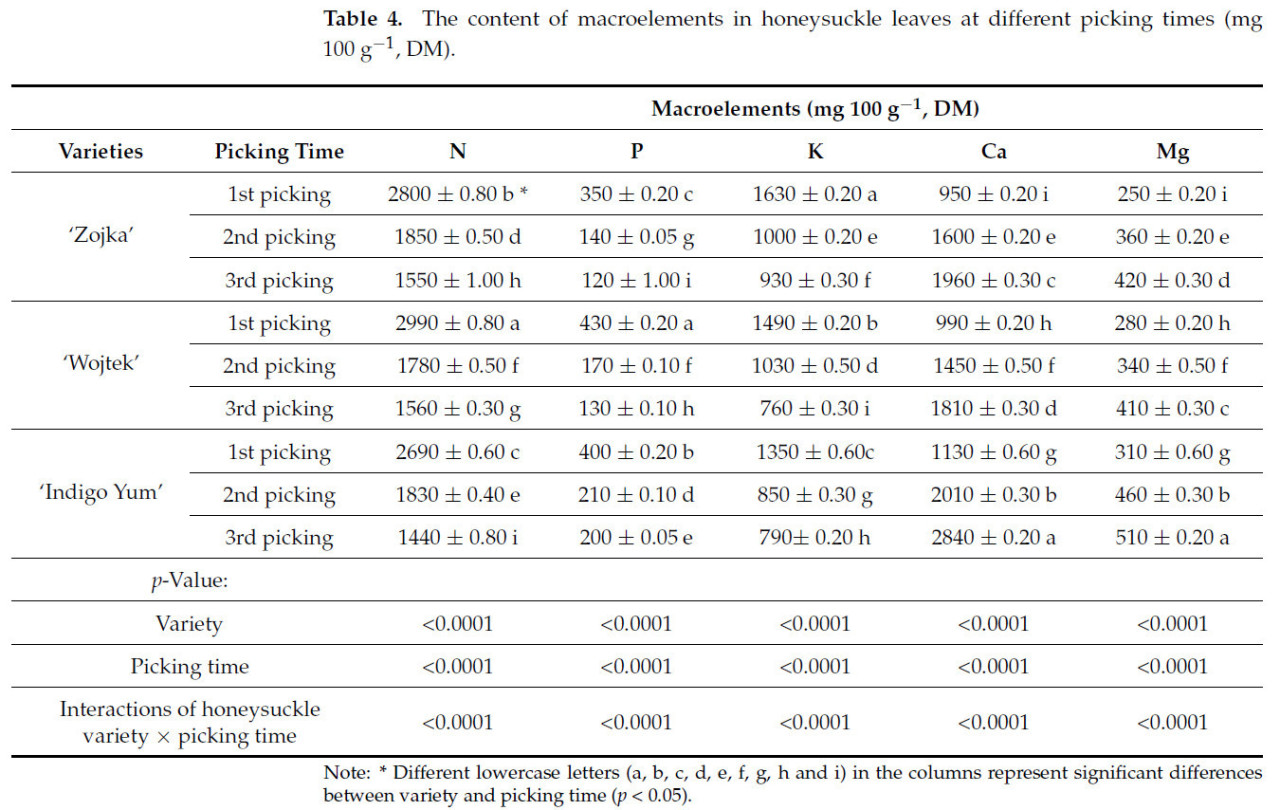
Результаты показали, что время сбора и свойства сорта жимолости оказали существенное влияние на макроэлементы в листьях жимолости (Таблица 4). Все исследованные образцы листьев имели более высокое содержание N, за которым следовали Ca, K, Mg и P. Примечательно, что самое высокое содержание N (2990 мг 100 г−1, СВ) и P (430 мг 100 г−1, СВ) было в листьях 'Wojtek' при первом сборе. Значительно самое низкое содержание N (1440 мг 100 г−1, СВ) было обнаружено в листьях 'Indigo Yum', тогда как самое низкое содержание P (120 мг 100 г−1, СВ) было у листьев 'Zojka' при третьем сборе. Результаты показали, что у всех сортов листьев жимолости самое высокое содержание N, P и K было при первом сборе, а самое низкое содержание наблюдалось при третьем сборе.
Таблица 4. Содержание макроэлементов в листьях жимолости в разные сроки сбора (мг 100 г−1, СВ).
Содержание K в листьях также существенно различалось между сортами жимолости. Листья 'Zojka' содержали самое высокое содержание K (930–1630 мг 100 г−1, СВ), а листья сорта 'Indigo Yum' имели самое низкое содержание K (790–1350 мг 100 г−1, СВ). Содержание Ca и Mg в молодых листьях жимолости было значительно ниже: в 1,83–2,51 раза и в 1,46–1,68 раза соответственно по сравнению с листьями третьего сбора. Влияние возраста было подтверждено наблюдениями, показывающими значительное увеличение концентраций Ca и Mg в листьях по мере их старения [31]. Это увеличение связано с ограниченной подвижностью Ca во флоэме [32]. О подобной низкой подвижности внутри растений сообщалось также для Mg [33]. Листья сорта 'Indigo Yum' показали значительно более высокое содержание Ca (2840 мг 100 г−1, СВ) и Mg (510 мг 100 г−1, СВ) при третьем сборе. По сообщениям некоторых авторов, вид растения; сорт; условия выращивания, такие как методы культивирования; биотический или абиотический стресс; и пищевой статус оказывают значительное влияние на минеральный состав растений [34]. В литературе, однако, недостаточно информации о минеральном составе листьев жимолости в разные сроки сбора. Levickienė и др. [35] изучали влияние времени сбора на накопление минеральных элементов в листьях шелковицы белой (Morus alba L.) и обнаружили, что содержание этих веществ варьируется в зависимости от сорта и времени сбора. Они установили, что содержание Ca, Mg, P и S в листьях увеличивалось с созреванием, в то время как содержание K уменьшалось. Nour и др. [34] установили, что листья черной смородины имели более высокое содержание K, Ca, Mg, Fe, Mn, Al, Cr и B в июне по сравнению с июлем. Согласно Fernandez-Escobar и др. [36], содержание N, P, K, Zn и B было выше в молодых листьях оливы (Olea europaea L.), тогда как содержание Ca, Mg, Mn, Cu и Fe было выше в старых листьях.
3.4. Общее содержание фенольных соединений, флавоноидов и антиоксидантная активность
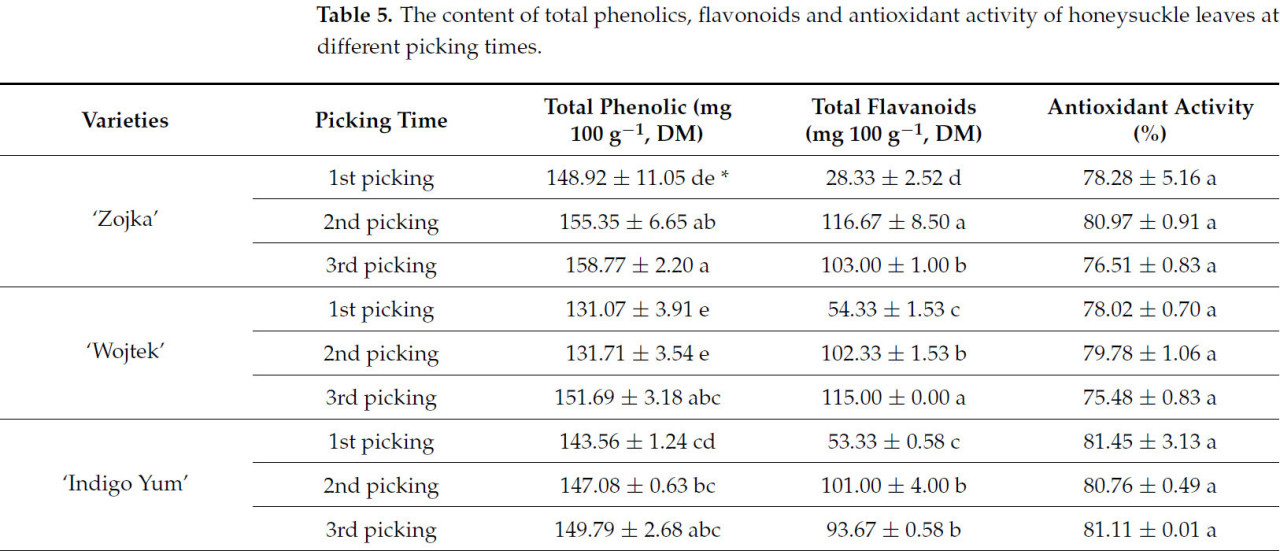
Результаты показали значительные различия в общем содержании фенольных соединений (ОСФ) среди изученных сортов жимолости и в разные сроки сбора. ОСФ варьировало от 131,07 мг 100 г−1 СВ в листьях 'Wojtek' при первом сборе до 158,77 мг 100 г−1 СВ в листьях 'Zojka' при третьем сборе (Таблица 5). Молодые листья 'Zojka' и 'Wojtek' (первый сбор) показали значительно более низкое ОСФ по сравнению с листьями третьего сбора. Kucharska и др. [37] ранее сообщали, что ОСФ в листьях жимолости может достигать уровней от 300 до 600 мг эквивалентов галловой кислоты на 100 г сырой массы. Аналогично, Česonienė и др. [38] наблюдали, что ОСФ варьируется в зависимости от сорта жимолости, предполагая, что выбор сорта может влиять на потенциальную пользу для здоровья. На общее содержание флавоноидов (ОСФл) в листьях жимолости также существенно влияли сорт и время сбора, при этом значения варьировали от 28,33 до 116,67 мг 100 г−1 СВ. Самые высокие значения ОСФл были зафиксированы в листьях 'Zojka' при втором сборе (116,67 мг 100 г−1 СВ) и листьях 'Wojtek' при третьем сборе (115,00 мг 100 г−1 СВ), в то время как самое низкое содержание ОСФл наблюдалось в листьях 'Zojka' первого сбора (28,33 мг 100 г−1 СВ). Факторы окружающей среды и различия между сортами, по-видимому, играют существенную роль во влиянии на уровни ОСФл в листьях жимолости. Антиоксидантная активность листьев была самой высокой при первом сборе у 'Indigo Yum' (81,45% СВ) и самой низкой при втором сборе у 'Wojtek' (75,48% СВ), хотя различия не были статистически значимыми. В исследовании Rop и др. [39] была задокументирована антиоксидантная активность в листьях жимолости в диапазоне от 6,59 до 10,17 г эквивалентов аскорбиновой кислоты на кг (сырой массы). В сравнительном исследовании различных видов Lonicera Feng и др. [40] изучили антиоксидантную активность листьев жимолости и сообщили, что содержание антиоксидантов в них составляло от 160 до 250 мкМ Тролокса г−1 сухой массы. Nie и др. [41] подчеркнули, что питательный состав листьев жимолости, включая фенольные соединения и флавоноиды, способствует их антиоксидантным свойствам, которые имеют значительный потенциал для профилактики хронических заболеваний. Исследования на других растениях показали сходные результаты.
Таблица 5. Содержание общих фенольных соединений, флавоноидов и антиоксидантная активность листьев жимолости в разные сроки сбора.
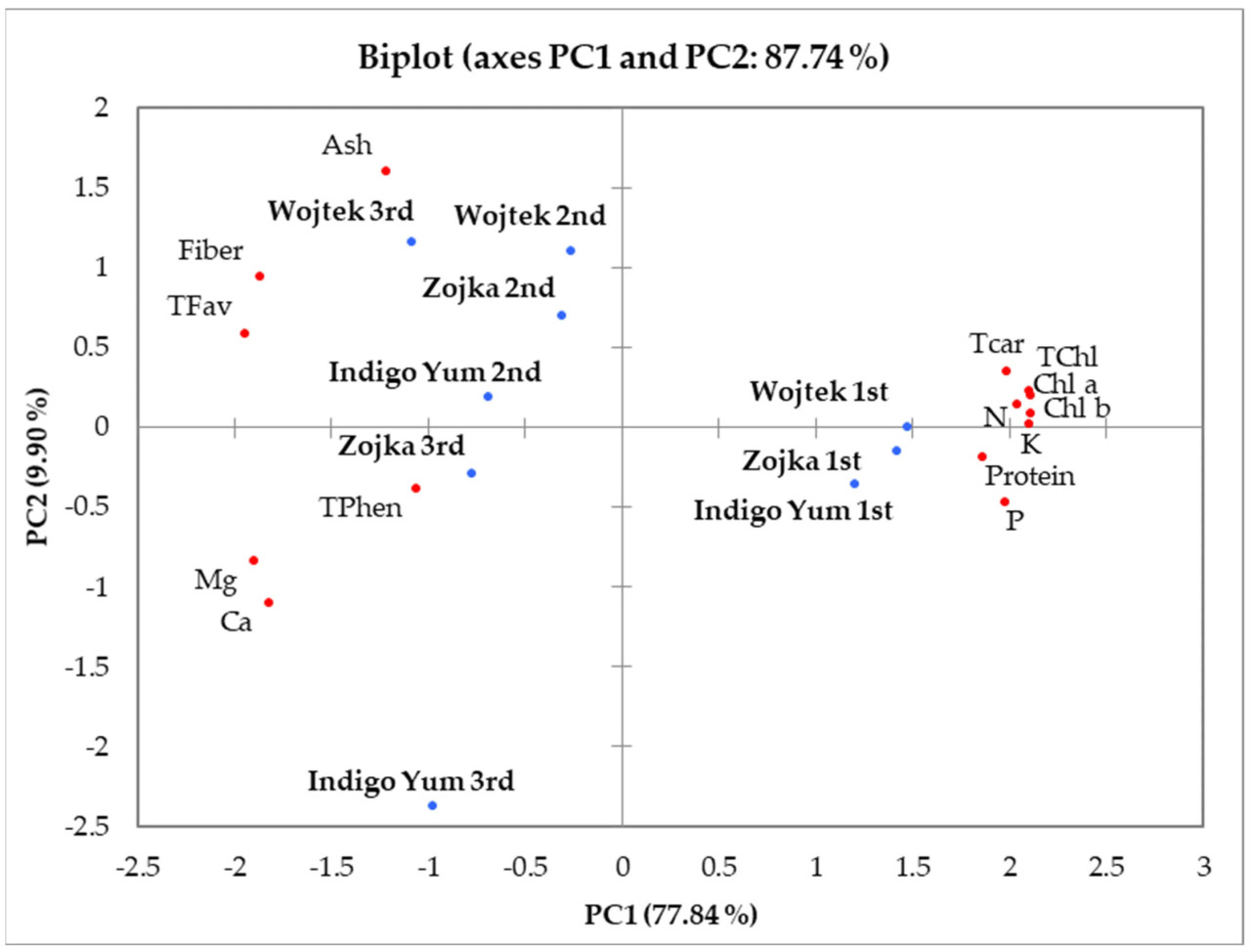
3.5. Анализ главных компонент (АГК)
АГК был использован для категоризации образцов листьев жимолости трех сортов, собранных в разное время, на основе параметров химического состава, таких как общий химический состав, пигменты, макроэлементы, сумма флавоноидов и сумма фенольных соединений (Рисунок 1). Первые две главные компоненты (ГК1 - 77,84%, ГК2 - 9,90%) объясняли 87,74% общей дисперсии. ГК1 была сильно коррелирована (r2 > 0,85) с N (+), P (+), K (+), хлорофиллом a (+), хлорофиллом b (+), общим хлорофиллом (+), суммарными каротиноидами (+), белком (+), Ca (−), Mg (−), суммой флавоноидов (−) и клетчаткой (−), тогда как ни одна из переменных не была сильно коррелирована с ГК2.
Рисунок 1. АГК, выполненная по химическим параметрам листьев, собранных в разные сроки: первый (1-й) сбор, второй (2-й) сбор и третий (3-й) сбор. Сокращения: N—азот, K—калий, Mg—магний, P—фосфор, Ca—кальций, Chl a—хлорофилл a, Chl b—хлорофилл b, TChl—общий хлорофилл, TCar—суммарные каротиноиды, Tflav—сумма флавоноидов, TPhen—сумма фенольных соединений.
При первом сборе данные для листьев жимолости всех изученных сортов располагались на противоположной стороне по сравнению с данными второго и третьего сборов. Это указывает на то, что молодые листья (первый сбор) всех протестированных сортов содержали самые высокие количества N, P, K, хлорофилла a, хлорофилла b, общего хлорофилла и суммарных каротиноидов и самые низкие количества Ca, Mg, суммы флавоноидов и клетчатки.
4. Выводы
Чтобы определить оптимальное время сбора, в этом исследовании были изучены общий химический состав, содержание пигментов, макронутриентов, общих фенольных соединений, флавоноидов и антиоксидантная активность листьев трех сортов жимолости. Результаты показали, что различные сроки сбора существенно влияют на химический состав листьев, что было подтверждено анализом главных компонент (АГК). Наблюдалась четкая кластеризация, основанная на эффектах различных сроков сбора.
Самые высокие уровни белка, азота (N), фосфора (P), калия (K), хлорофилла a, хлорофилла b, общего хлорофилла и суммарных каротиноидов были обнаружены в молодых листьях (первый сбор). Напротив, содержание кальция (Ca) и магния (Mg) было значительно выше в листьях третьего сбора по сравнению с первым и вторым сборами. Поэтому рекомендуется собирать листья жимолости в соответствующее время, чтобы максимизировать содержание этих компонентов.
Содержание протестированных соединений также значительно различалось между сортами жимолости. Листья первого сбора сорта 'Wojtek' имели самое высокое содержание белка, N, P и суммарных каротиноидов, в то время как листья третьего сбора имели самое высокое содержание клетчатки и золы. Листья третьего сбора сорта 'Indigo Yum' содержали самые высокие уровни Ca и Mg. Самое высокое содержание суммы флавоноидов было обнаружено в листьях второго сбора 'Zojka' и листьях третьего сбора 'Wojtek'.
Эти результаты подчеркивают сложное взаимодействие между временем сбора и сортом в формировании питательных и биоактивных свойств листьев жимолости. Это исследование предоставляет ценную информацию для оптимизации сроков сбора с целью улучшения питательных и функциональных качеств листьев жимолости. Например, листья первого сбора наиболее богаты белком, азотом и хлорофиллом, что делает их полезными для пищевых и функциональных целей. Напротив, листья третьего сбора, с более высоким содержанием кальция и магния, могут быть более пригодны для применений, требующих этих специфических минералов. Эти результаты предполагают, что выбор конкретных сортов жимолости может помочь адаптировать время сбора листьев для удовлетворения потребностей различных отраслей промышленности, таких как производство продуктов питания, фитотерапия и производство натуральных продуктов. Следуя этим рекомендациям, исследователи могут максимизировать коммерческий и медицинский потенциал листьев жимолости, гарантируя, что они собираются, перерабатываются и используются наиболее эффективным и полезным способом.
Ссылки
1. Rupashinge, H.V.; Yu, L.J.; Bhullar, K.S.; Bors, B. Haskaip (Lonicera caerulea): A new berry crop with high antioxidant capacity. Can. J. Plant Sci. 2012, 92, 1311–1317. [Google Scholar] [CrossRef]
2. Zhang, C.; Yang, D.; Liang, Z.; Liu, J.; Yan, K.; Zhu, Y.; Yang, S. Climatic factors control the geospatial distribution of active ingredients in Salvia miltiorrhiza Bunge in China. Sci. Rep. 2019, 9, 904. [Google Scholar] [CrossRef] [PubMed]
3. Celli, G.B.; Ghanem, A.; Brooks, M.S.L. Haskap berries (Lonicera caerulea L.)—A critical review of antioxidant capacity and health-related studies for potential valueadded products. Food Bioprocess Technol. 2014, 7, 1541–1554. [Google Scholar] [CrossRef]
4. Rupasinghe, H.; Boehm, M.; Sekhon-Loodu, S.; Parmar, I.; Bors, B.; Jamieson, A. Anti-inflammatory activity of haskap cultivars is polyphenols-dependent. Biomolecules 2015, 5, 1079–1098. [Google Scholar] [CrossRef]
5. Gerbrandt, E. Propagation, management and adaptation of the blue honeysuckle. Acta Hortic. 2015, 1085, 289–292. [Google Scholar] [CrossRef]
6. Wang, M.; Li, Y.C.; Meng, F.B.; Wang, Q.; Wang, Z.W.; Liu, D.Y. Effect of honeysuckle leaf extract on the physicochemical properties of carboxymethyl konjac glucomannan/konjac glucomannan/gelatin composite edible film. Food Chem. X 2023, 18, 100675. [Google Scholar] [CrossRef]
7. Chong, K.Y.; Yuryev, Y.; Jain, A.; Mason, B.; Brooks Su-Ling, M. Development of Pea Protein Films with Haskap (Lonicera caerulea) Leaf Extracts from Aqueous Two-phase Systems. Food Bioprocess Technol. 2021, 14, 1733–1750. [Google Scholar] [CrossRef]
8. Oprea, O.; Negreanu–Pîrjol, T.; Roncea, F.; Prelipcean, A.; Crăciunescu, O.; Iosăgeanu, A.; Artem, V.; Ranca, A.; Motelica, L.; Lepadatu, A.C.; et al. Health Benefits of Antioxidant Bioactive Compounds in the Fruits and Leaves of Lonicera caerulea L. and Aronia melanocarpa (Michx.) Elliot. Antioxidants 2023, 12, 951. [Google Scholar] [CrossRef]
9. Khattab, R.; Brooks, M.; Ghanem, A. Phenolic Analyses of Haskap Berries (Lonicera caerulea L.): Spectrophotometry Versus High Performance Liquid Chromatography. Int. J. Food Prop. 2015, 19, 1708–1725. [Google Scholar] [CrossRef]
10. Jan, B.; Parveen, R.; Zahiruddin, S.; Khan, M.U.; Mohapatra, S.; Ahmad, S. Nutritional Constituents of Mulberry and Their Potential Applications in Food and Pharmaceuticals: A Review. Saudi J. Biol. Sci. 2021, 28, 3909–3921. [Google Scholar] [CrossRef]
11. Sip, S.; Sip, A.; Szulc, P.; Cielecka-Piontek, J. Haskap Berry Leaves (Lonicera caerulea L.)—The Favorable Potential of Medical Use. Nutrients 2022, 14, 3898. [Google Scholar] [CrossRef] [PubMed]
12. Bora, L.; Lombrea, A.; Batrina, S.L.; Buda, V.O.; Esanu, O.-M.; Pasca, O.; Dehelean, C.A.; Dinu, S.; Diaconeasa, Z.; Danciu, C. A Systematic Review of Cardio-Metabolic Properties of Lonicera caerulea L. Antioxidants 2024, 13, 694. [Google Scholar] [CrossRef] [PubMed]
13. Shang, X.; Pan, H.; Li, M.; Miao, X.; Ding, H. Lonicera japonica Thunb.: Ethnopharmacology, phytochemistry and pharmacology of an important traditional Chinese medicine. J. Ethnopharmacol. 2011, 138, 1–21. [Google Scholar] [CrossRef] [PubMed]
14. Cheng, Z.; Bao, Y.; Li, Z.; Wang, J.; Wang, M.; Wang, S.; Wang, Y.; Wang, Y.; Li, B. Lonicera caerulea (Haskap berries): A review of development traceability, functional value, product development status, future opportunities, and challenges. Crit. Rev. Food Sci. Nutr. 2022, 63, 8992–9016. [Google Scholar] [CrossRef] [PubMed]
15. AOAC. Official Methods of Analysis: Official Method for Crude Fibre; Method No. 920.85; Association of Official Analytical Chemists: Washington, DC, USA, 1995; 16p. [Google Scholar]
16. European Union. First Commission Directive of 15 June 1971 Establishing Community Methods of Analysis for the Official Control of Feeding–Stuffs (71/250/EEC); European Union: Brussels, Belgium, 1971; 22p. [Google Scholar]
17. Commission Regulation (EC). No 152/2009 laying down the methods of sampling and analysis for the official control of feed. Off. J. Eur. Union 2009, 152, 1–54. [Google Scholar]
18. LST EN 15510:2017; Animal Feeding Stuffs: Methods of Sampling and Analysis-Determination of Calcium, Sodium, Phosphorus, Magnesium, Potassium, Iron, Zinc, Copper, Manganese, Cobalt, Molybdenum and Lead by ICP-AES. Lithuanian Standards Board: Vilnius, Lithuania, 2017; p. 29.
19. Lichtenthaler, H.K.; Buschmann, C. Chlorophylls and Carotenoids: Measurement and Characterization by UV-VIS Spectroscopy. Curr. Protoc. Food Anal. Chem. 2021, 1, F4.3.1–F4.3.8. [Google Scholar] [CrossRef]
20. Bobinaitė, R.; Viškelis, P.; Venskutonis, P.R. Variation of total phenolics, anthocyanins, ellagic acid and radical scavenging capacity in various Raspberry (Rubus spp.) cultivars. Food Chem. 2012, 132, 1495–1501. [Google Scholar] [CrossRef]
21. Urbonavičienė, D.; Bobinas, Č.; Bobinaitė, R.; Raudonė, L.; Trumbeckaitė, S.; Viškelis, J.; Viškelis, P. Composition and Antioxidant Activity, Supercritical Carbon Dioxide Extraction Extracts, and Residue after Extraction of Biologically Active Compounds from Freeze-Dried Tomato Matrix. Processes 2021, 9, 467. [Google Scholar] [CrossRef]
22. Marinova, D.; Ribarova, F.; Atanassova, M. Total phenolics and total flavonoids in Bulgarian fruits and vegetables. J. Univ. Chem. Technol. Met. 2005, 40, 255–260. [Google Scholar]
23. Lu, Y.; Foo, L.Y. Antioxidant and radical scavenging activities of polyphenols from apple pomace. Food Chem. 2000, 68, 81–85. [Google Scholar] [CrossRef]
24. Ziobroń, M.; Kopeć, A.; Skoczylas, J.; Dziadek, K.; Zawistowski, J. Basic Chemical Composition and Concentration of Selected Bioactive Compounds in Leaves of Black, Red and White Currant. Appl. Sci. 2021, 11, 7638. [Google Scholar] [CrossRef]
25. Lim, P.O.; Kim, H.J.; Nam, H.G. Leaf senescence. Annu Rev Plant Biol. 2007, 58, 115–136. [Google Scholar] [CrossRef] [PubMed]
26. Keskitalo, J.; Bergquist, G.; Gardestrom, P.; Jansson, S. A cellular timetable of autumn senescence. Plant Physiol. 2005, 139, 1635–1648. [Google Scholar] [CrossRef]
27. Kitajima, K.; Wright, S.J.; Westbrook, J.W. Leaf cellulose density as the key determinant of inter- and intra-specific variation in leaf fracture toughness in a species-rich tropical forest. Interface Focus 2016, 6, 20150100. [Google Scholar] [CrossRef]
28. Ortíz-Ocampo, G.I.; Sandoval-Castro, C.A.; González-Pech, P.G.; Mancilla-Montelongo, G.; Ventura-Cordero, J.; Castañeda-Ramírez, G.S.; Tun-Garrido, J.; Torres-Acosta, J.F.d.J. Month of Harvest and Leaf Age Impact the Bromatological Composition and Polyphenol Content of Gymnopodium floribundum Rolfe Leaves. Agriculture 2022, 12, 1110. [Google Scholar] [CrossRef]
29. Liu, Z.; Cheng, Y.; Chao, Z. A comprehensive quality analysis of different colors of medicinal and edible honeysuckle. Foods 2023, 12, 3126. [Google Scholar] [CrossRef]
30. Yan, W.; Lu, Y.; Guo, L.; Liu, Y.; Li, M.; Zhang, B.; Zhang, B.; Zhang, L.; Qin, D.; Huo, J. Effects of Drought Stress on Photosynthesis and Chlorophyll Fluorescence in Blue Honeysuckle. Plants 2024, 13, 2115. [Google Scholar] [CrossRef]
31. Alcázar Román, R.; Amorós, J.A.; Pérez de los Reyes, C.; Navarro, F.G.; Bravo, S. Major and trace element content of olive leaves. Olivæ 2014, 119, 1–7. [Google Scholar]
32. White, P.J. Long-Distance Transport in the Xylem and Phloem; Academic Press: San Diego, CA, USA, 2012; pp. 49–70. [Google Scholar]
33. Pongrac, P.; Kelemen, M.; Vogel-Mikuš, K.; Vavpetič, P.; Pelicon, P.; Žurga, P.; Pasković, I. Tissue-specific calcium and magnesium allocation to explain differences in bulk concentration in leaves of one-year-old seedlings of two olive (Olea europaea L.) cultivars. Plant Physiol. Biochem. 2023, 194, 619–626. [Google Scholar] [CrossRef]
34. Nour, V.; Trandafir, I.; Cosmulescu, S. Antioxidant capacity, phenolic compounds and minerals content of blackcurrant (Ribes nigrum L.) leaves as influenced by harvesting date and extraction method. Ind. Crop. Prod. 2014, 53, 133–139. [Google Scholar] [CrossRef]
35. Levickienė, D.; Vaitkevičienė, N.; Jarienė, E.; Mažeika, R. The content of macroelements in white mulberry (Morus alba L.) leaves. Žemės Ūkio Moksl. 2018, 25, 177–183. [Google Scholar] [CrossRef]
36. Fernandez-Escobar, R.; Moreno, R.; Garcıa-Creus, M. Seasonal changes of mineral nutrients in olive leaves during the alternate-bearing cycle. Sci. Hortic. 1999, 82, 25–45. [Google Scholar] [CrossRef]
37. Kucharska, A.Z.; Sokół-Łętowska, A.; Oszmiański, J.; Piórecki, N.; Fecka, I. Iridoids, Phenolic Compounds and Antioxidant Activity of Edible Honeysuckle Berries (Lonicera caerulea var. kamtschatica Sevast.). Molecules 2017, 22, 405. [Google Scholar] [CrossRef] [PubMed]
38. Česonienė, L.; Labokas, J.; Jasutienė, I.; Šarkinas, A.; Kaškonienė, V.; Kaškonas, P.; Kazernavičiūtė, R.; Pažereckaitė, A.; Daubaras, R. Bioactive Compounds, Antioxidant, and Antibacterial Properties of Lonicera caerulea Berries: Evaluation of 11 Cultivars. Plants 2021, 10, 624. [Google Scholar] [CrossRef]
39. Rop, O.; Řezníček, V.; Mlček, J.; Jurí-ková, T.; Balík, J.; Sochor, J.; Kramářová, D. Antioxidant and radical oxygen species scavenging activities of 12 cultivars of blue honeysuckle fruit. Hortic. Sci. 2011, 38, 63–70. [Google Scholar] [CrossRef]
40. Feng, Y.H.; Zhang, G.D.; Zhu, P.C.; Zhu, W.H.; Li, Y.Z.; Fan, X.W. Metabolite profiles and antibacterial and antioxidant activities of leaf extracts of five Lonicera species: A comparative study. Chem. Biol. Technol. Agric. 2023, 10, 91. [Google Scholar] [CrossRef]
41. Nie, R.; Zhang, J.; Jia, Q.; Li, Y.; Tao, W.; Qin, G.; Li, P. Structurally oriented carbon dots as ros nanomodulators for dynamic chronic inflammation and infection elimination. ACS Nano 2024, 18, 22055–22070. [Google Scholar] [CrossRef]
Jakienė E, Kaušė E, Vaitkevičienė N. Impact of Picking Time on Leaf Quality Parameters of Three Varieties of Honeysuckle (Lonicera caerulea L.). Agriculture. 2025; 15(3):257. https://doi.org/10.3390/agriculture15030257
Перевод статьи «Impact of Picking Time on Leaf Quality Parameters of Three Varieties of Honeysuckle (Lonicera caeruleaL.)» авторов Jakienė E, Kaušė E, Vaitkevičienė N., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
Фото: freepik





























































































Комментарии (0)