Без пестицидов: как салициловая кислота помогает ананасам бороться с мучнистым червецом
Ананасы очень восприимчивы к «болезни увядания», вызываемой биотрофным насекомым Dysmicoccus brevipes, который также переносит несколько ассоциированных с увяданием вирусов (PMWaVs). В традиционных хозяйствах с мучнистым червецом и болезнью увядания борются с помощью химических препаратов. Однако многие из этих средств были запрещены в Европе из-за рисков для безопасности, что создает острую необходимость в исследованиях безпестицидных методов контроля. В процессе эволюции у растений выработались естественные защитные механизмы, такие как системная приобретенная устойчивость (SAR), против патогенов и вредителей. В данном исследовании салициловая кислота (10−3 М) применялась на растениях ананаса сортов MD2 и Королева Виктория в виде опрыскивания листьев или полива почвы с последующим заражением мучнистым червецом.
Аннотация
Эта обработка усилила защитные реакции, что оценивалось по скорости размножения мучнистого червеца, а также по биохимическим и молекулярным ответам микроразмноженных растений в контролируемых условиях. Активность фенилаланин-аммиак-лиазы (PAL) измерялась как потенциальный ферментативный маркер сигнального пути SAR. Дополнительно были проанализированы уровни экспрессии четырех генов, включая AcPAL и AcICS2, связанных с синтезом салициловой кислоты; AcMYB-like, фактора транскрипции, регулирующего биосинтез салициловой кислоты; и AcCAT, участвующего в контроле уровня H2O2 в растениях. Обработка салициловой кислотой снизила скорость размножения мучнистого червеца на ананасах на 70% по сравнению с необработанными растениями. В этом исследовании биохимический маркер (PAL) и три молекулярных маркера (AcPAL, AcICS2 и AcCAT) показали значительные различия между праймированными и непраймированными растениями, что указывает на индукцию SAR и ее роль во взаимодействии ананаса и мучнистого червеца. У сортов MD2 и Королева Виктория активность PAL увеличилась в 2,3 и 1,5 раза соответственно, тогда как экспрессия AcPAL возросла в 4 и более чем в 10 раз. Экспрессия других молекулярных маркеров, AcICS2, AcCAT и AcMYB-like (фактора транскрипции), увеличилась в 3 раза, за исключением последнего у сорта Королева Виктория. Снижение популяций мучнистого червеца с помощью SAR менее эффективно по сравнению с пестицидами, но оно представляет собой ценную альтернативу на острове Реюньон, где единственный оставшийся разрешенным инсектицид скоро будет запрещен. Кроме того, праймирование SAR предлагает многообещающую, экологически безопасную стратегию для контроля популяций мучнистого червеца и снижения заболеваемости увяданием в системах возделывания ананасов без применения пестицидов.
1. Введение
Ананасы в основном выращиваются в условиях интенсивной монокультуры по всему миру. Растения ананаса восприимчивы к «Увяданию», разрушительному заболеванию. Увядание вызывается паразитическим комплексом, включающим мучнистого червеца Dysmicoccus brevipes (Cockerell), сосущего флоэму, и ассоциированные с увяданием ананаса вирусы, такие как PMWaV1, V2 и V3 [1,2], а также, потенциально, представителей других семейств вирусов. D. brevipes, биотрофный агент, является наиболее распространенным мучнистым червецом на ананасах на острове Реюньон, где развитие симптомов увядания требует, согласно недавнему обследованию [3], одновременного присутствия мучнистого червеца и PMWaV2. Увядание обычно контролируют с помощью обычных контактных или системных инсектицидов, направленных против мучнистого червеца, но под давлением потребителей использование этих химических веществ в настоящее время запрещено на европейских территориях, что требует разработки новых методов контроля без применения пестицидов. Новые методы контроля должны эффективно защищать сельскохозяйственные культуры от мучнистого червеца и болезни увядания, одновременно обеспечивая устойчивость производства ананасов, которые представляют собой вторую по величине статью сельскохозяйственного экспорта острова Реюньон. Более того, систематическое применение инсектицидов снижает биоразнообразие, особенно в хрупких островных экосистемах. Наконец, эти систематические обработки в традиционных системах производства загрязняют окружающую среду и водные ресурсы, создавая риск для здоровья населения.
Для ананаса один из подходов включает использование покровных культур, таких как виды Crotalaria, для снижения исходного общего паразитического стресса, вызываемого почвенными патогенами (например, нематодами и симфилами), перед посадкой, наряду с использованием безболезненного посадочного материала [4]. Было высказано предположение, что снижение стрессов окружающей среды на растения может благоприятствовать индукции эффективных системных резистентностей [5]. Основываясь на этой гипотезе, мы разработали систему земледелия, направленную на снижение биотических стрессов и усиление индукции естественных защитных механизмов ананаса, известных как системные резистентности [6,7].
Растения обнаруживают патогены с помощью мембранных рецепторов, которые распознают специфические связанные с патогенами молекулярные паттерны (PAMP) [8,9]. Эти паттерны называются MAMP (ассоциированные с микробами), HAMP (ассоциированные с травоядными) или DAMP (ассоциированные с повреждениями) [10,11,12]. Обнаружение этих сигналов активирует паттерн-индуцированный иммунитет (PTI) в качестве первой линии защиты [13]. Кроме того, растения развили системные сигнальные пути, которые полагаются на гормоны, такие как жасмонат (JA), этилен (ET) и салициловая кислота (SAL), наряду со специфическими факторами транскрипции и другими сигнальными молекулами [8]. Сигнальный путь жасмоната, ассоциируемый с индуцированной системной резистентностью (ISR), реагирует на некротрофные патогены, непатогенные микроорганизмы (например, бактерии или микоризные грибы) и абиотические стрессы. Напротив, сигнальный путь салициловой кислоты, ассоциируемый с системной приобретенной устойчивостью (SAR), в первую очередь нацелен на биотрофные патогены и вредителей. После первичной инфекции или внешней элиситации эти сигнальные пути дальнего действия активируют иммунные ответы в незараженных тканях растений, механизм, известный как "праймирование" [14,15], который описывается как адаптивная и низкозатратная оборонительная стратегия. Это связано с тем, что у праймированных растений защитные реакции либо не активируются, либо лишь незначительно и временно запускаются праймирующим стимулом. В условиях биотического или абиотического стресса праймированные растения активируют свои защитные реакции быстрее, интенсивнее и продолжительнее при обнаружении последующего сигнала угрозы. Этот новый вызов эффективно инициирует их полные защитные механизмы, включая активацию генов, связанных с защитой, и ферментативных активностей, связанных с окислительным взрывом и другими защитными реакциями [16,17,18,19]. Растения дополнительно усиливают свою защиту, секретируя антимикробные белки, связанные с патогенезом (PR), такие как хитиназы и β-1,3-глюкозидазы, во время взаимодействия с патогенами [14,20,21]. Другие потенциальные молекулярные маркеры SAR включают факторы транскрипции, такие как MYB, которые регулируют NPR1, ключевой элемент в балансировании путей SAR и ISR. Этот баланс отражает антагонистический перекрестный разговор между этими двумя сигнальными путями [22,23,24,25,26]. Было обнаружено, что SAR эффективна против многих патогенов растений, включая вирусы [27], бактерии [27], грибы [28] и других биотрофных патогенов и вредителей, таких как сосущие флоэму тли [29]. Сорт ананаса MD2, как и сорт Королева Виктория, уже показал способность реагировать на стимуляцию ISR и SAR для контроля нематоды R. reniformis в контролируемых условиях и на экспериментальных полевых делянках [5,30].
D. brevipes, сосущий флоэму мучнистый червец, является биотрофным насекомым [31], которое, как предполагается, более восприимчиво к SAR, чем к ISR. Салициловая кислота (SAL) и несколько ее производных считаются элиситорами SAR на различных растениях [32], а метилжасмонат (MeJA) использовался в качестве элиситора ISR в различных экспериментах на плодовых культурах, таких как ананас [33], овощах и срезанных цветах [34].
В этом исследовании мы протестировали системную приобретенную устойчивость (SAR) и индуцированную системную резистентность (ISR) на двух сортах ананаса, экспортируемых на свежий рынок: MD2, который является основным экспортируемым сортом в мире, и сорт Королева, который является единственным сортом, производимым на острове Реюньон. Сначала мы сравнили элиситацию защитных реакций против мучнистого червеца у растений ананаса сортов MD2 и Королева Виктория с использованием салициловой кислоты (SAL) и метилжасмоната (MeJA). Далее мы предположили, что праймирование SAR против мучнистого червеца ананаса может быть индуцировано и охарактеризовано через его биологические, биохимические и молекулярные эффекты [35] — соответствующие снижению размножения мучнистого червеца, усилению ферментативной защиты и повышению или понижению регуляции генов, связанных с защитой. Биологический эффект оценивали путем измерения размножения мучнистого червеца. Биохимический эффект оценивали через активность фенилаланин-аммиак-лиазы (PAL), ключевого фермента в биосинтезе SA и сигнальном пути системной приобретенной устойчивости (SAR). PAL также контролирует биосинтез фенольных соединений, в значительной степени вовлеченных в защиту растений. Наконец, молекулярный эффект был исследован с использованием четырех потенциальных молекулярных маркеров: AcPAL и AcICS2, AcMYB-like, все вовлеченные в биосинтез SAL и его контроль, и AcCAT, который играет двойную роль в защите растений. Повышенная активность каталазы (CAT) детоксифицирует H2O2 во время окислительных вспышек, вызванных взаимодействием с патогенами, тогда как сниженная активность CAT увеличивает уровень H2O2, создавая враждебную и токсичную среду для патогенов. Более того, H2O2 действует как вторичный мессенджер в SAR, проходя через мембраны и активируя гены, связанные с защитой, по всему растению [13]. В заключение, мы предполагаем, что индукция SAR может быть интегрирована в стратегии интегрированной защиты растений (IPM) для контроля мучнистого червеца и снижения воздействия болезни увядания в производстве ананасов.
2. Материалы и методы
2.1. Растительный материал и условия выращивания
Микроразмноженные растения ананаса MD2 выращивали в горшках объемом 250 мл с коммерческой смесью для горшечных культур при температуре 28 ± 1 °C и фотопериоде 12 ч под диодами Tarentula® мощностью 60 Вт, имитирующими спектр естественного дневного света. После 6-месячного периода акклиматизации микроразмноженные растения развили надземную массу приблизительно 56,5 ± 17,5 г и 40 ± 16,5 г для MD2 и Королевы Виктории соответственно. Лист D, используемый в качестве эталона для анализа роста и минерального состава, рос под углом 45° к вертикальной оси растения и только что завершил свой рост в длину. Группа листьев D также идентифицировалась по более или менее параллельным краям у основания листьев по сравнению со старыми листьями (группа C) с расширенным основанием и молодыми листьями (группа E) с суженным основанием [36].
2.2. Мучнистые червецы
Мучнистых червецов (D. brevipes) собирали с зараженных микроразмноженных растений ананаса, выращенных в самодельной системе разведения. Контролируемые условия для выращивания ананасов, которые были вручную заражены несколькими дикими мучнистыми червецами, собранными с экспериментальных полей, были такими же, как описано ранее в разделе 2.1. Чтобы удалить беременных взрослых самок, которые могли бы выпустить личинок сразу после инокуляции (так как эти личинки могли развиться в период разведения), мучнистых червецов выдерживали в пробирке для отбора проб с влажной фильтровальной бумагой в течение 24 часов. Для инокуляции в экспериментах этого исследования под бинокулярной лупой отбирали только мучнистых червецов 2-го и 3-го возрастов, которые активно питались на растениях. Нестимулированные растения без инокуляции мучнистым червецом использовались в качестве контроля внешнего загрязнения в каждом эксперименте.
2.3. Биологический эффект: сравнение эффективности ISR и SAR и методов применения
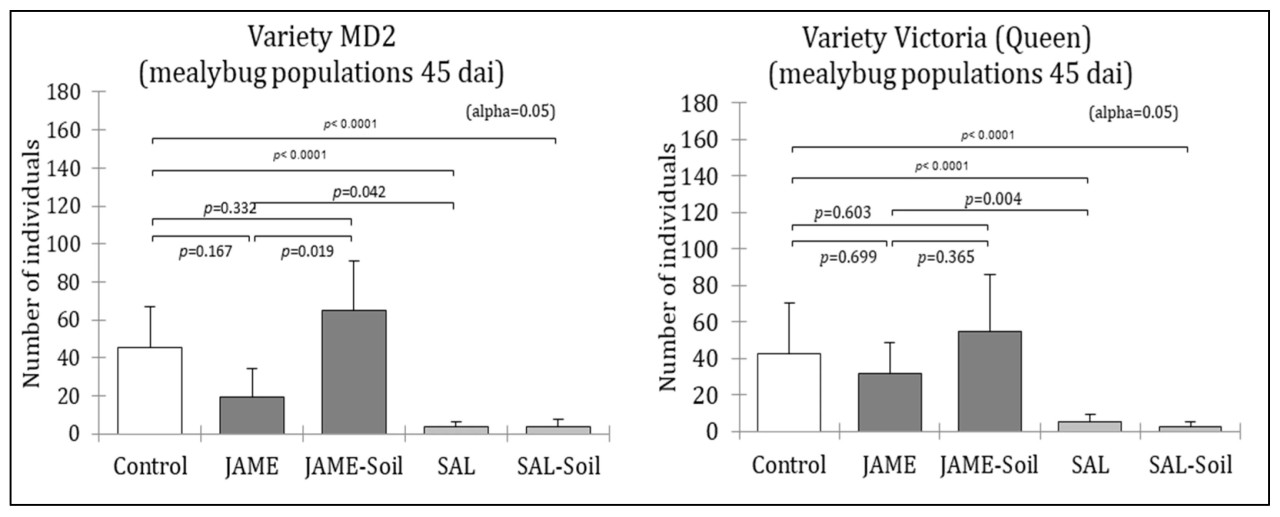
Было протестировано пять обработок, каждая с девятью повторностями (девять растений на обработку), включая контроль (вода), два элиситора — метилжасмонат (MeJA, 0,1 мМ) или салициловую кислоту (SAL, 1 мМ) — и два метода применения (15 мл наносили либо на поверхность почвы вокруг основания растений, либо в центр растения с помощью калиброванных микропипеток). Концентрации элиситоров были определены в экспериментах, опубликованных ранее [33]. Каждое растение получило три аппликации по 15 мл растворов элиситоров или воды с 4-дневными интервалами. Через три дня после финальной аппликации элиситора на каждое растение инокулировали по четыре мучнистых червеца. Популяции мучнистого червеца подсчитывали через 45 дней после инокуляции, что представляло собой один полный цикл размножения в экспериментальных условиях, установленных в предварительном эксперименте. Результаты выражали как снижение размножения под влиянием обработки по сравнению с контролем. Общее количество погибших мучнистых червецов подсчитывали для оценки смертности новых личинок в течение 45 дней этого первого эксперимента.
Первый эксперимент был частично повторен (только биологический эффект) на обоих сортах год спустя в аналогичных экспериментальных условиях, за исключением того, что в качестве элиситора защиты использовали только салициловую кислоту. Раствор салициловой кислоты (SAL, 1 мМ) был разделен между растением (5 мл) и почвой (10 мл).
2.4. Биохимический эффект: активность фенилаланин-аммиак-лиазы (PAL)
Две обработки — SAL (1 мМ) и вода (контроль) — наносились трехкратно на поверхность почвы из расчета 15 мл на растение с 4-дневными интервалами, с пятью повторностями (растениями) на обработку. Через три дня после финальной аппликации растения MD2 и Королева Виктория были инокулированы 20 и 40 мучнистыми червецами соответственно. Для оценки эффекта одной лишь стимуляции SAL дополнительные растения получали SAL, но без инокуляции мучнистым червецом. Через двадцать дней после инокуляции активность фенилаланин-аммиак-лиазы (PAL) измеряли в сыром экстракте (см. раздел 2.6. для подготовки образцов) в качестве биохимического маркера сигнального пути SAR и биосинтеза фенольных соединений.
2.5. Молекулярный эффект: гены-кандидаты в качестве молекулярных маркеров для характеристики праймирования SAR
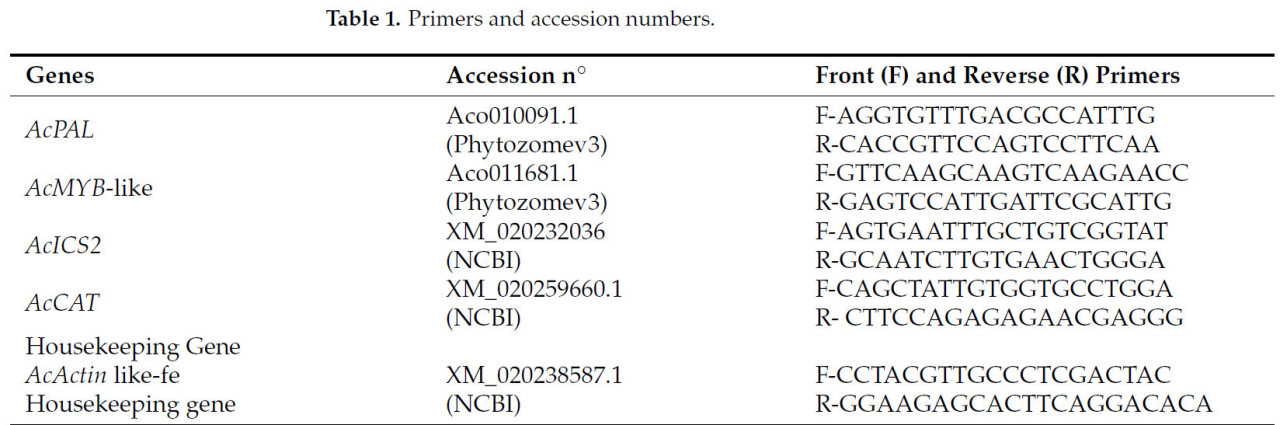
Среди генов, обычно используемых для характеристики SAR, были отобраны четыре гена для сравнения их экспрессии в праймированных и непраймированных растениях после инокуляции мучнистым червецом в наших экспериментальных условиях: AcPAL, AcMYB-like, AcICS2 и AcCAT с использованием AcActin из листьев в качестве домашних генов (Таблица 1).
Таблица 1. Праймеры и номера доступа.
2.6. Протоколы для измерений ферментативной активности и экспрессии генов
Подготовка образцов: Образцы быстро промывали под струей дистиллированной воды, удаляя корни и верхние части листьев. Оставшиеся части затем быстро ополаскивали дважды — сначала 70% этанолом, а затем дистиллированной водой. Для анализов белую часть листьев и прилегающий к ней зеленый участок аналогичного размера замораживали в сухом льду, растирали в порошок, лиофилизировали и, наконец, хранили в морозильной камере при -80 °C до экстракции белка или РНК.
Экстракция белка: Сырой экстракт (ce) получали из 50 мг лиофилизированного порошка в холодном 0,1 М фосфатном буфере (pH 6,8), содержащем 40 мМ PMSF в качестве ингибитора протеаз (Sigma, Сент-Луис, Миссури, США) и 62,5 мг/мл поливинил-полипирролидона, при мягком перемешивании на льду в течение одного часа. Затем 'ce' фильтровали сначала через стекловолоконные фильтры Pall A/E (1 мкм), затем через мини-фильтры Whatman (0,45 мкм ацетат целлюлозы, Restek Франция, Лисс, Франция) для получения прозрачного фильтрата.
Ферментативное измерение (биохимический эффект): Следующие процедуры для ферментативных измерений были адаптированы из протоколов, разработанных авторами, процитированными для микроанализа с объемами реакций 300 мкл, каждая повторялась дважды. Абсорбцию измеряли на 96-луночных кварцевых планшетах с помощью Powerwave HT (Biotek, Уинуски, Вермонт, США). PAL: Коричную кислоту, образованную из L-фенилаланина с 25 мкл ce, измеряли при 290 нм [37]. Контроль модифицировали с использованием D-фенилаланина (ε = 9000 M−1 см−1), PAL выражена в нкат на 100 мкл 'ce'.
Экспрессия защитных генов (молекулярный эффект): РНК экстрагировали из 25 мг лиофилизированного материала с использованием набора RNeasy Plant mini kit (Qiagen, Хильден, Германия), а кДНК получали с использованием набора для обратной транскрипции (Qiagen). ОТ-ПЦР в реальном времени (RTqPCR) выполняли с набором Fast SYBR Green Master Kit (Thermofisher, Уолтем, Массачусетс, США) на приборе Stepone Plus (Applied Biosystem, Уолтем, Массачусетс, США) с объемами реакций 20 мкл, и ОТ-ПЦР проводили в соответствии с рекомендациями, включенными в набор. Гены актина использовались в качестве референсных генов. Праймеры были разработаны для Ananas comosus, и различия в экспрессии генов между стимулированными и нестимулированными растениями оценивали для AcPAL, AcCAT, AcMYB-like и AcICS2. Оптимальное время задержки после инокуляции для оценки этих различий в наших условиях было определено с использованием гена AcPAL у MD2. РНК экстрагировали через 5 ч, 24 ч, 36 ч и 48 ч после инокуляции мучнистыми червецами. Результаты выражены как относительная количественная оценка путем нормализации по отрицательным контролям (Ctrl < 0), которые не были ни стимулированы, ни инокулированы, с использованием AcActin листьев в качестве домашнего гена.
Анализ данных: Данные по биологическому эффекту анализировали с использованием непараметрических тестов Крускала и Уоллиса, поскольку, несмотря на тщательный отбор хрупких возрастов, у некоторых были повреждены стилеты, а некоторые уже были беременны. Тесты Данна использовались для сравнения каждой обработки с контролем. Данные по биохимическим эффектам и данные по молекулярным эффектам анализировали с помощью разделения средних со стандартными отклонениями. Все статистические анализы выполнялись с использованием программного обеспечения XLStat (2023.1.1 (1396)).
3. Результаты
3.1. Биологический эффект: сравнение стимуляции салициловой кислотой или метилжасмонатом
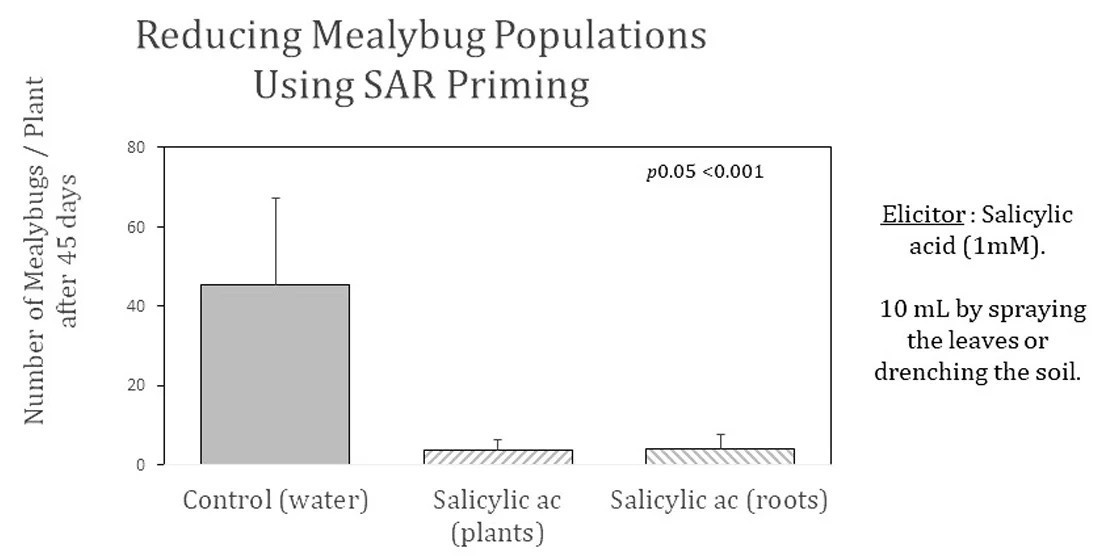
Только стимуляция SAR значительно снизила скорость размножения мучнистого червеца в ходе 45-дневного эксперимента, что соответствует одному циклу развития мучнистого червеца в этих условиях (Рисунок 1). Стимуляция SAR была эффективна на обоих сортах ананаса, MD2 и Королева Виктория. Кроме того, салициловая кислота (1 мМ) была одинаково эффективна при внесении на растение или в почву перед инокуляцией.
Рисунок 1. Сравнение воздействий ISR и SAR на размножение мучнистого червеца. Элиситор ISR = метилжасмонат (MeJA 0,1 мМ), элиситор SAR = салициловая кислота (SAL 1 мМ), 15 мл раствора либо на растение, либо на почву. На каждое растение инокулировали по четыре мучнистых червеца. Dai = дни после инокуляции мучнистыми червецами.
У MD2 популяции мучнистого червеца были значительно снижены на стимулированных растениях по сравнению с положительными контролями, с reductions −94% и −91% для аппликаций SA на растение и в почву соответственно. Аналогично, у Королевы Виктории наблюдались снижения −88% и −93% для аппликаций SA на растение и в почву соответственно. Различия между нестимулированными контролями и стимулированными растениями были высоко значимыми (p < 0,0001) для обоих сортов ананаса, независимо от того, применялась ли стимуляция на листья или в почву.
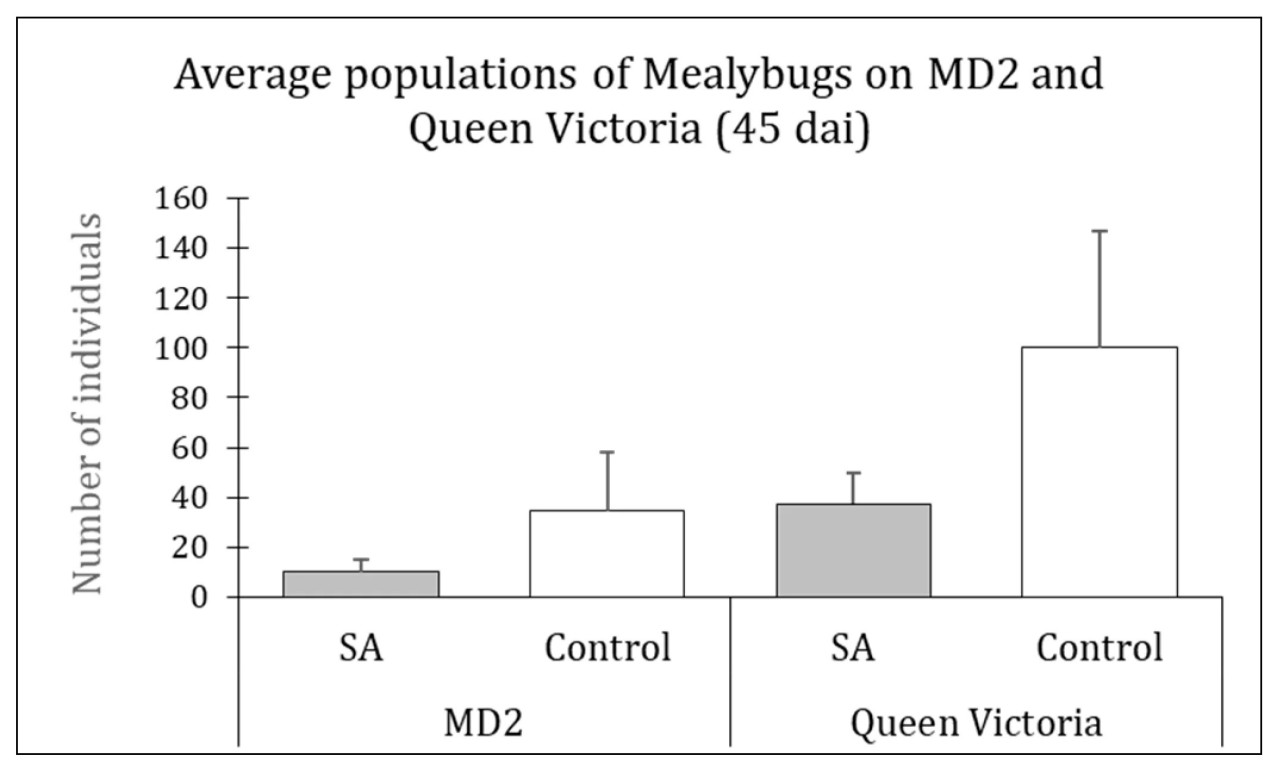
Эксперимент, повторенный год спустя, показал значительное снижение размножения мучнистого червеца на обоих сортах (Рисунок 2), хотя биологический эффект был немного ниже, но все еще значимым (значения p 0,05 составили 0,045 и 0,005 для MD2 и Королевы Виктории соответственно).
Рисунок 2. Воздействие SAR на размножение мучнистого червеца на сортах MD2 и Королева Виктория. Элиситор SAR = салициловая кислота (SAL, 1 мМ). Раствор элиситора был разделен между растением (5 мл) и почвой (10 мл). На каждое растение инокулировали по четыре отдельных мучнистых червеца; dai = дни после инокуляции мучнистыми червецами. (p 0,05 = 0,045 и 0,005 для MD2 и Королевы Виктории соответственно).
Количество молодых мучнистых червецов, родившихся в ходе эксперимента и погибших в течение 45-дневного эксперимента, было значительно выше на стимулированной Виктории (Королева) (+142,0%, p 0,05 = 0,004) и имело лишь тенденцию к увеличению на стимулированном MD2 (+48,6%, p 0,05 = 0,078), хотя и незначимо.
3.2. Биохимические эффекты: ферментативные маркеры SAR-защиты
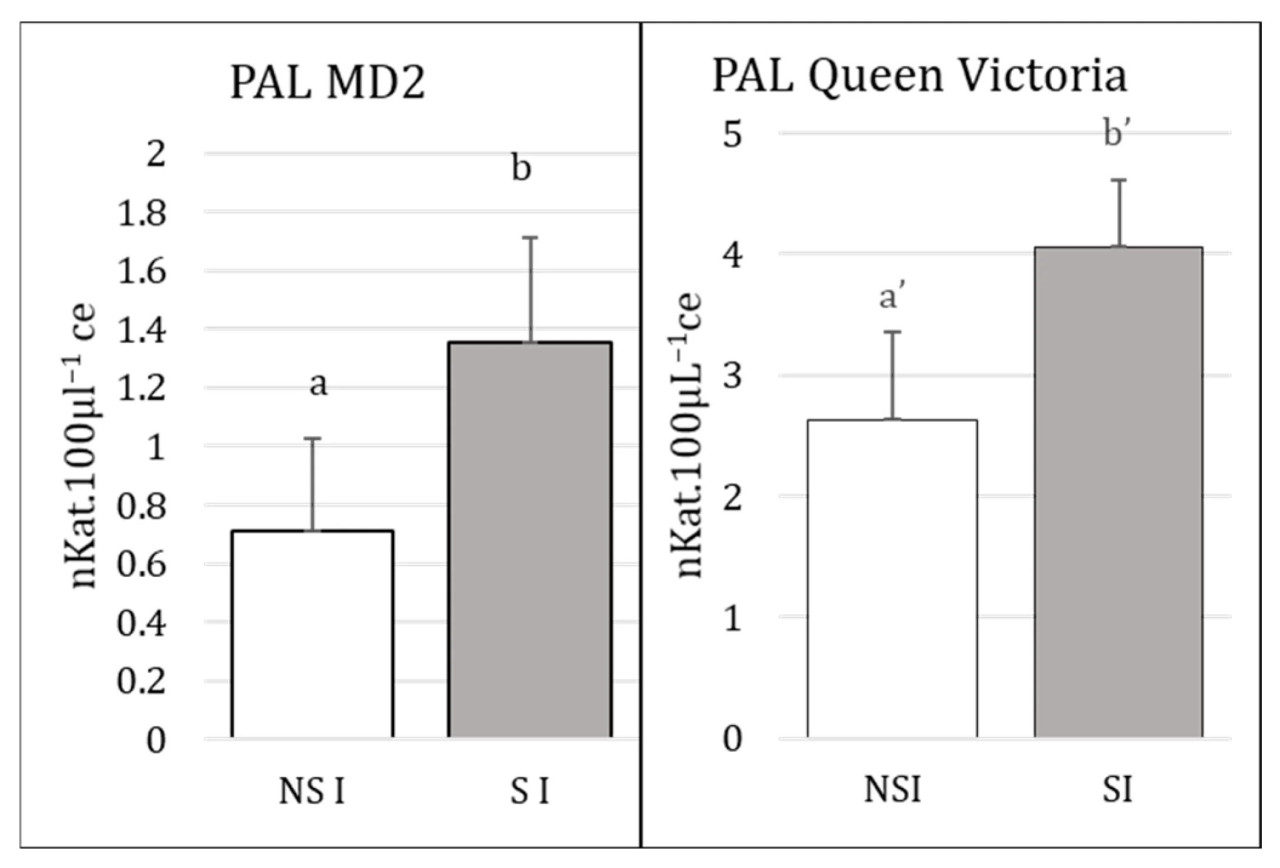
Поскольку результаты по биологическому эффекту показали, что только салициловая кислота была эффективна в качестве обработки элиситором для сильного снижения размножения мучнистого червеца на обоих сортах ананаса, мы оценили активность PAL для продукции салициловой кислоты растениями в контексте сильного стресса, вызванного инокуляцией большого количества мучнистых червецов на растения (20 и 40 отдельных мучнистых червецов на MD2 и Королеву Виктория соответственно) (Рисунок 3).
Рисунок 3. Количественная оценка активности PAL в нестимулированных–инокулированных (NSI = Ctrl > 0) и стимулированных–инокулированных (SI) растениях MD2 и Королева Виктория, инокулированных 20 и 40 мучнистыми червецами соответственно. Разные буквы (отдельные эксперименты проводились для статистической оценки 2 сортов: MD2 (a, b) и Королева Виктория (a', b')) на графиках указывают на значительно различающиеся уровни активности между NSI и SI. Использованным элиситором SAR была салициловая кислота (1 мМ), нанесенная в виде 15 мл раствора. Активность PAL измеряли через 20 дней после инокуляции (dai).
3.3. Молекулярные эффекты
3.3.1. Время между инокуляцией мучнистого червеца и экспрессией гена AcPAL у стимулированных растений MD2 по сравнению с нестимулированными
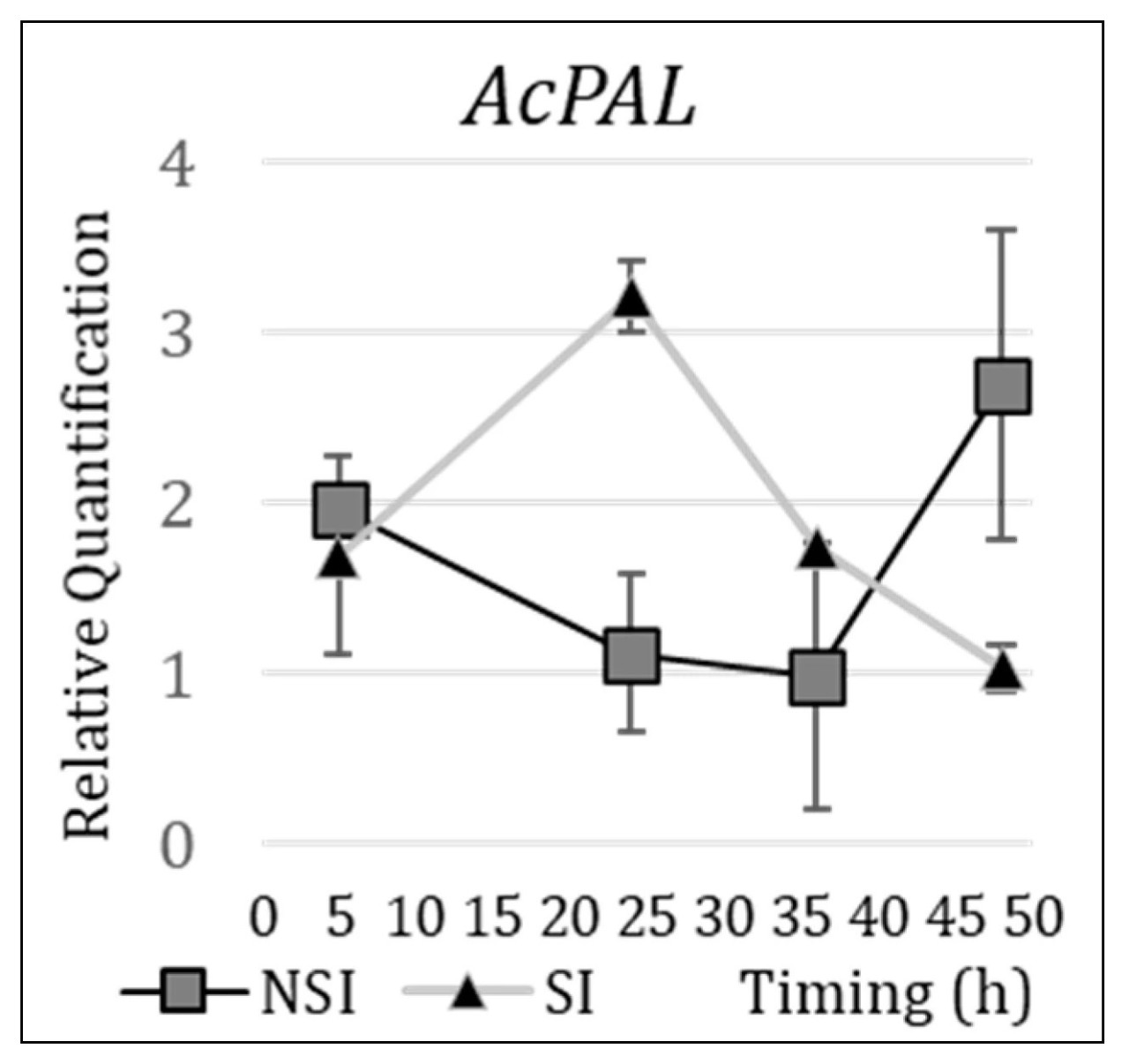
Оптимальное время задержки для экстракции РНК после инокуляции мучнистым червецом было выбрано произвольно для максимизации экспрессии AcPAL в стимулированных растениях, одновременно обеспечивая максимальную задержку в ответе между стимулированными и нестимулированными растениями (Ctrl > 0). Для сравнения уровней экспрессии генов между стимулированными и нестимулированными растениями экстракцию РНК следует проводить через 24 часа после инокуляции мучнистым червецом, так как этот момент времени более точно отражает реакции растений, показывая максимальную экспрессию в стимулированных растениях, а также отсроченный ответ в Ctrl > 0 (Рисунок 4).
Рисунок 4. Относительная количественная оценка экспрессии гена AcPAL в нестимулированных (NSI) и стимулированных растениях MD2 (SI), инокулированных 20 мучнистыми червецами. Элиситор SAR = салициловая кислота (1 мМ), 15 мл раствора. РНК экстрагировали через 5 ч, 24 ч, 36 ч и 48 ч после инокуляции.
3.3.2. Молекулярные маркеры SAR-защиты у MD2 и Королевы Виктории
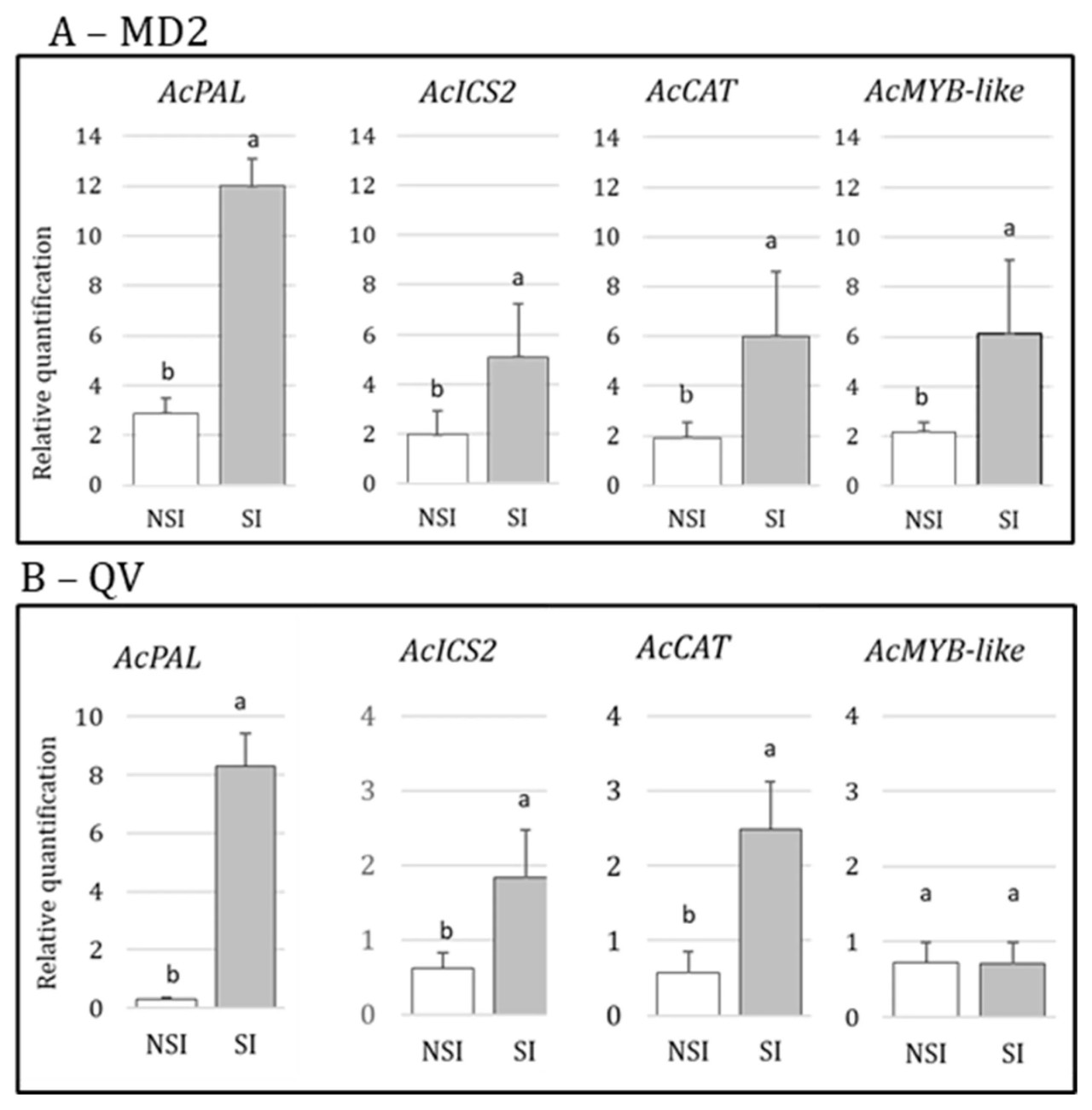
У MD2 уровни экспрессии четырех молекулярных маркеров (AcPAL, AcICS2, AcCAT и AcMYB-like) значительно увеличились после инокуляции мучнистым червецом у стимулированных растений по сравнению с нестимулированными положительными контролями (Рисунок 5A — MD2). У Королевы Виктория три молекулярных маркера (AcPAL, AcICS и AcCAT) показали повышенную экспрессию, в то время как AcMYB-like не показал, выявляя значительные различия в поведении экспрессии генов между сортами ананаса (Рисунок 5B — QV). Наибольшие увеличения уровней экспрессии генов, 6-кратное и 8-кратное увеличение, наблюдались для PAL у MD2 и Королевы Виктория соответственно. В этом эксперименте Королева Виктория показала более низкие уровни экспрессии генов, чем MD2, особенно для AcICS2, AcCAT и AcMYB-like.
Рисунок 5. Относительная количественная оценка 4 потенциальных молекулярных маркеров SAR через 1 час после применения биотического стресса на MD2 (A—MD2) и Королеве Виктория (B—QV). Разные буквы (a и b) означают, что экспрессия генов значимо различалась между NSI и SI; элиситором SAR была салициловая кислота (SA, 1 мМ), 15 мл раствора на растение. Референсным геном был AcActin. Экспрессия генов была нормализована по NS-NI (Ctrl < 0).
4. Обсуждение
Наши результаты, касающиеся биологических, биохимических и молекулярных эффектов, поддерживают гипотезу о том, что салициловая кислота (SA, 1 мМ) индуцирует системную приобретенную устойчивость (SAR) против мучнистого червеца, ассоциированного с болезнью увядания, у обоих сортов ананаса, MD2 и Королева Виктория. Однако наши предыдущие результаты выявили сильный дифференциальный ответ в пользу сорта MD2 по сравнению с Smooth Cayenne при индукции SAR и ISR с помощью SA или MeJA соответственно против нематоды R. reniformis [33]. В той публикации авторы подчеркнули существование сортовых различий в способности входить в праймированное состояние. Кроме того, мы также установили эти различия у бананов, сравнивая их способности развивать праймированное состояние и системную приобретенную устойчивость (SAR) против нематод [38].
4.1. Биологический эффект: снижение размножения мучнистого червеца
В отличие от стимуляции метилжасмонатом (MeJA), обработка салициловой кислотой (SA) оказалась более эффективной для индукции действенной защиты против размножения мучнистого червеца. В первом эксперименте она снизила количество новорожденных личинок на −90% на обоих сортах. В повторном эксперименте, проведенном год спустя, это снижение составило −70% для сорта MD2 и −65% для сорта Королева Виктория. Наши результаты подтвердили, что биотрофное насекомое Dysmicoccus brevipes (Cockerell) более восприимчиво к системной приобретенной устойчивости (SAR), чем к индуцированной системной резистентности (ISR), подобно другим биотрофным патогенам и вредителям [39]. Ранее было обнаружено, что SAR, индуцированная элиситацией SA у MD2, эффективна против другого патогена, нематоды R. reniformis [33].
Аппликации салициловой кислоты (SA) на поверхность почвы для достижения корней и аппликации на листья были одинаково эффективны против размножения мучнистого червеца, что поддерживает гипотезу о системном характере индуцированной SA защиты. Кроме того, снижение размножения мучнистого червеца, вероятно, не было связано с прямой токсичностью SA, а вместо этого свидетельствует об активации защитных механизмов SAR против мучнистого червеца. Фактически, отсутствие токсичности SA в низкой концентрации (1 мМ) для мучнистого червеца было ранее продемонстрировано в экспериментах с прямым контактом с использованием пробирок для образцов [6].
Количество молодых мучнистых червецов, которые родились в течение 45-дневного эксперимента и впоследствии погибли, было значительно выше на стимулированных растениях Королевы Виктория (+142,0%, p 0,05 = 0,004) и имело тенденцию к увеличению на стимулированных растениях MD2 (+48,6%, p 0,05 = 0,078), хотя и незначимо и при очень низком количестве живых мучнистых червецов. Это свидетельствует о потенциальном механизме, который ингибировал развитие этих молодых возрастов. Праймированные растения с элиситорами SAR продуцировали более высокие уровни токсичных фенольных соединений и цистатина, которые нарушали пищеварительные процессы патогенов [40,41]. Было показано, что цистатин, природный ингибитор протеазы бромелайна в ананасе [42], изменяет питание нематод и снижает их популяции, нарушая активность пищеварительных ферментов у томатов [43]. В предыдущем эксперименте ген AcCystatin показал повышенную экспрессию в плодах ананаса MD2 при абиотическом стрессе (низкая температура), как и в других культурах, толерантных к холоду или стрессу засухи [44]. Генетически модифицированные ананасы с усиленной продукцией цистатина изучались на предмет их потенциала для контроля нематод путем введения генов цистатина из дикого сорта риса, показав многообещающие первоначальные результаты. Однако на полевом уровне результаты были недостаточными для достижения эффективного контроля нематод [45]. Предполагается, что цистатины блокируют пищеварительные протеазы нематод у томатов и ананасов. Подобный механизм мог бы также воздействовать на мучнистых червецов после индукции SAR у ананасов, особенно на молодые возрасты, которые активно питаются. Кроме того, Королева Виктория и MD2 также естественным образом продуцируют высокий уровень фенольных соединений, таких как p-кумароил-изолимонная кислота и несколько гидроксибензойных кислот, среди других фенольных соединений, которые играют роль в устойчивости к грибным заболеваниям у ананаса [46].
Наши результаты по биологическим эффектам поддерживают гипотезу о том, что праймирование SAR эффективно в снижении популяций мучнистого червеца. Чтобы дополнительно подтвердить это, были оценены ферментативные и молекулярные эффекты путем измерения маркеров SAR-защиты.
4.2. Биохимические и молекулярные эффекты обработки салициловой кислотой (SA)
Экспрессия гена AcPAL, а также ферментативная активность PAL, два маркера сигнального пути SA, значительно увеличились у растений, обработанных SA, по сравнению с необработанными растениями в ответ на стресс, вызванный инокуляцией мучнистого червеца. Это увеличение, вероятно, привело к биосинтезу эндогенной SA, первоначально для сигнального пути SAR, а позднее для дополнительного синтеза токсичных соединений. Увеличение активности PAL и биосинтеза SA представляет собой одно из ранних биохимических событий в продукции фенольных соединений, включая токсичные соединения, необходимые не только для защиты, но и для структурных компонентов, таких как лигнин и каллоза, которые укрепляют клеточные стенки как часть защитного ответа SAR. Ген AcICS2, хотя и вносит вклад в синтез SA в меньшей степени, показал значительное увеличение экспрессии у обоих сортов, что свидетельствует о его потенциале в качестве надежного маркера SAR. Фактор транскрипции AcMYB-like, участвующий в регуляции синтеза SA, показал повышенную экспрессию у сорта MD2, но не у Королевы Виктория, будучи в данном случае менее надежным в качестве общего молекулярного маркера ананаса.
Хорошо известно, что АФК (ROS) запускают окислительно-восстановительный сигналинг, но при избытке вызывают окислительный стресс, приводящий к повреждению клеточных компонентов [47]. Эти авторы также подчеркнули окислительно-восстановительную регуляцию нескольких компонентов сигналинга SAR. Вспышка активных форм кислорода (АФК) в месте инфекции является одним из самых ранних клеточных ответов после заражения патогеном. Экспрессия AcCAT показала интересное увеличение между растениями, обработанными SA, и необработанными растениями у обоих сортов, что позволяет предположить, что это также потенциально надежный маркер SAR. Как упоминалось ранее, CAT имеет двойную роль в этом контексте защиты. Когда активность CAT снижена, токсичность H2O2 создает враждебную среду для патогенов. H2O2 также действует как вторичный мессенджер в SAR, проходя через мембраны и активируя гены защиты по всему растению [13,47]. Напротив, повышенная активность CAT способствует детоксикации среды растительной клетки из-за стрессовой окислительной вспышки и продукции АФК.
Наши результаты по ферментативным и молекулярным эффектам подтверждают индукцию SAR обработкой салициловой кислотой и установление SAR-защиты.
4.3. Интеграция праймирования SAR в экологически интегрированную стратегию защиты растений
Стратегия, разработанная для включения праймирования в экологически интегрированный подход к защите растений, была успешно протестирована на нематодах ананаса, Rotylenchulus reniformis [30], и будет применена для праймирования SAR против мучнистого червеца. Стратегия включает снижение паразитизма с помощью покровных культур, таких как Crotalaria spp., в севообороте с ананасами и использование безболезненного посадочного материала, особенно свободного от мучнистого червеца. Этот подход направлен на минимизацию исходного инокулюма до элиситации на молодых растениях и на использование защитных механизмов растений для поддержания приемлемого уровня паразитизма для устойчивого производства плодов.
5. Выводы
Это исследование продемонстрировало, что обработка 1 мМ салициловой кислоты эффективно индуцирует системную приобретенную устойчивость (SAR) против мучнистого червеца Dysmicoccus brevipes у двух сортов ананаса, MD2 и Королева Виктория, в контролируемых условиях. Индукция SAR характеризовалась тремя ключевыми эффектами: (1) биологическим эффектом, значительно снижающим размножение мучнистого червеца; (2) биохимическим эффектом, отмеченным повышенной активностью PAL, связанной с биосинтезом салициловой кислоты и путями фенольных соединений; и (3) молекулярным эффектом, вовлекающим повышение регуляции генов, ассоциированных с сигналингом SAR и окислительным взрывом. Этот протокол предлагает потенциальную основу для идентификации сортов ананаса с индуцируемыми природными защитными механизмами. Разработка новых элиситоров, индуцирующих SAR или ISR, против патогенов ананаса может способствовать разработке более экологически интегрированных стратегий защиты растений для контроля болезни увядания, а также других патогенов и вредителей в производстве ананасов.
Ссылки
1. Hu, J.S.; Sether, D.M.; Metzer, M.J.; Pérez, E.; Gonsalves, A.; Karasev, A.V.; Nagai, C. Pineapple mealybug wilt associated virus and mealybug wilt of pineapple. Acta Hort. (ISHS) 2005, 666, 209–212. [Google Scholar] [CrossRef]
2. Hernandez-Rodriguez, L.; Ramos-Gonzalez, P.L.; Garcia-Garcia, G.; Zamora, V.; Peralta-Martin, A.M.; Pena, I.; Perez, J.M.; Ferriol, X. Geographic distribution of mealybug wilt disease of pineapple and genetic diversity of viruses infecting pineapple in Cuba. Crop Prot. 2014, 65, 43–50. [Google Scholar] [CrossRef]
3. Massé, D.; Cassam, N.; Darnaudéry, M.; Dorey, E.; Hostachy, B.; Tullus, G.; Soler, A. Reunion Island: General survey of pineapple parasites with a focus on wilt disease and associated viruses. In X Pineapple Symposium, Uvero Alto, Dominican Republic; International Society for Horticultural Science (ISHS): Leuven, Belgium, 2024; pp. 67–74. [Google Scholar]
4. Nurbel, T.; Soler, A.; Thuries, L.; Dorey, E.; Chabanne, A.; Tisserand, G.; Hoarau, I.; Darnaudery, M. Concevoir des systèmes de production d’ananas en agriculture biologique. Innov. Agron. 2021, 82, 1–24. [Google Scholar]
5. Soler, A.; Marie-Alphonsine, P.A.; Corbion, C.; Fernandes, P.; Portal Gonzalez, N.; Gonzalez, R.; Repellin, A.; Declerck, S.; Quénéhervé, P. A strategy towards bioprotection of tropical crops: Experiences and perspectives with ISR on pineapple and banana in Martinique. In Congrès: 6th Meeting of IOBC-WPRS Working Group “Induced Resistance in Plants Against Insects and Diseases”: Induced Resistance in Plants Against Insects and diseases: Leaping from Success in the Lab to Success in the Field; IOBC, Ed.; IOBC: Avignon, France, 2013. [Google Scholar]
6. N’Guessan, L.; Chillet, M.; Chiroleu, F.; Soler, A. Ecologically Based Management of Pineapple Mealybug Wilt: Controlling Dysmicoccus brevipes Mealybug Populations with Salicylic Acid Analogs and Plant Extracts. Horticulturae 2024, 10, 227. [Google Scholar] [CrossRef]
7. Marie-Alphonsine, P.-A.; Soler, A.; Gaude, J.-M.; Bérimée, M.; Qénéhervé, P. Effects of cover crops on Rotylenchulus reniformis and Hanseniella sp. Populations. In Proceedings of the IX International Pineapple Symposium, Havana, Cuba, 15–19 October 2017; Bartholomew, D.P., Reinhardt, D.H., Duarte Souza, F.V., Eds.; ISHS: Leuven, Belgium, 2019; pp. 185–193. [Google Scholar]
8. Pai, L.; Lu, Y.-J.; Chen, H.; Day, B. The Lifecycle of the Plant Immune System. Crit. Rev. Plant Sci. 2020, 39, 72–100. [Google Scholar]
9. Boller, T.; Felix, G. A Renaissance of Elicitors: Perception of Microbe-Associated Molecular Patterns and Danger Signals by Pattern-Recognition Receptors. Annu. Rev. Plant Biol. 2009, 60, 379–406. [Google Scholar] [CrossRef]
10. Freeman, B.C.; Beattie, G.A. An overview of plant defenses against pathogens and herbivores. Plant Health Instr. 2008. [Google Scholar] [CrossRef]
11. Mithöfer, A.; Boland, W. Recognition of herbivory-associated molecular patterns. Plant Physiol. 2008, 146, 825–831. [Google Scholar] [CrossRef]
12. Zipfel, C. Plant pattern-recognition receptors. Trends Immunol. 2014, 35, 345–351. [Google Scholar] [CrossRef]
13. Klessig, D.F.; Choi, H.W.; Dempsey, D.M.A. Systemic acquired resistance and salicylic acid: Past, present, and future. Mol. Plant-Microbe Interact. 2018, 31, 871–888. [Google Scholar] [CrossRef]
14. Holmes, E.; Chen, Y.C.; Sattely, E.; Mudgett, M.B. Conservation of N-hydroxy-pipecolic acid-mediated systemic acquired resistance in crop plants. bioRxiv 2019. [Google Scholar] [CrossRef]
15. Villena, J.; Kitazawa, H.; Van Wees, S.C.M.; Pieterse, C.M.J.; Takahashi, H. Receptors and Signaling Pathways for Recognition of Bacteria in Livestock and Crops: Prospects for Beneficial Microbes in Healthy Growth Strategies. Front. Immunol. 2018, 9, 2223. [Google Scholar] [CrossRef] [PubMed]
16. Martinez-Medina, A.; Flors, V.; Heil, M.; Mauch-Mani, B.; Pieterse, C.M.J.; Pozo, M.J.; Ton, J.; van Dam, N.M.; Conrath, U. Recognizing Plant Defense Priming. Trends Plant Sci. 2016, 21, 818–822. [Google Scholar] [CrossRef] [PubMed]
17. Conrath, U. Molecular aspects of defense priming. Trends Plant Sci. 2011, 16, 524–531. [Google Scholar] [CrossRef]
18. Conrath, U.; Beckers, G.J.; Langenbach, C.J.; Jaskiewicz, M.R. Priming for enhanced defense. Annu. Rev. Phytopathol. 2015, 53, 97–119. [Google Scholar] [CrossRef]
19. Mehari, Z.H.; Elad, Y.; Rav-David, D.; Graber, E.R.; Harel, Y.M. Induced systemic resistance in tomato (Solanum lycopersicum) against Botrytis cinerea by biochar amendment involves jasmonic acid signaling. Plant Soil. 2015, 395, 31–44. [Google Scholar] [CrossRef]
20. Ganguly, P.; Ganguly, N.; Chakraborty, B.; Adhya, T.K. Pathogenesis related proteins: Milestones in five decades of research. Indian. Phytopathol. 2024, 77, 899–923. [Google Scholar] [CrossRef]
21. Breen, S.; Williams, S.J.; Outram, M.; Kobe, B.; Solomon, P.S. Emerging Insights into the Functions of Pathogenesis-Related Protein 1. Trends Plant Sci. 2017, 22, 871–879. [Google Scholar] [CrossRef]
22. Durrant, W.; Dong, X. Systemic acquired resistance. Annu. Rev. Phytopathol. 2004, 42, 185–209. [Google Scholar] [CrossRef]
23. Mou, Z.; Fan, W.; Dong, X. Inducers of plant systemic acquired resistance regulate NPR1 function through redox changes. Cell 2003, 113, 935–944. [Google Scholar] [CrossRef]
24. Spoel, S.H.; Koornneef, A.; Claessens, S.M.C.; Korzelius, J.P.; Van Pelt, J.A.; Mueller, M.J.; Buchala, A.J.; Métraux, J.-P.; Brown, R.; Kazan, K.; et al. NPR1 Modulates Cross-Talk between Salicylate- and Jasmonate-Dependent Defense Pathways through a Novel Function in the Cytosol. Plant Cell Online 2003, 15, 760–770. [Google Scholar] [CrossRef] [PubMed]
25. Withers, J.; Dong, X. Posttranslational modifications of NPR1: A single protein playing multiple roles in plant immunity and physiology. PLoS Path. 2016, 12, e1005707. [Google Scholar] [CrossRef] [PubMed]
26. Younus Wani, M.; Mehraj, S.; Rathe, R.A.; Rani, S.; Hajam, O.A.; Ganie, N.A.; Mir, M.R.; Baqual, M.F.; Kamili, A.S. SAR:A novel strategy for plant protection with reference to mulberry. Int. J. Chem. Stud. 2018, 6, 1184–1192. [Google Scholar]
27. Monci, F.; García-Andrés, S.; Sánchez-Campos, S.; Fernández-Muñoz, R.; Díaz-Pendón, J.A.; Moriones, E. Use of Systemic Acquired Resistance and Whitefly Optical Barriers to Reduce Tomato Yellow Leaf Curl Disease Damage to Tomato Crops. Plant Dis. 2019, 103, 1181–1188. [Google Scholar] [CrossRef]
28. Saravanakumar, K.; Dou, K.; Lu, Z.; Wang, X.; Li, Y.; Chen, J. Enhanced biocontrol activity of cellulase from Trichoderma harzianum against Fusarium graminearum through activation of defense-related genes in maize. Physiol. Mol. Plant Pathol. 2018, 103, 130–136. [Google Scholar] [CrossRef]
29. Hodge, S.; Thompson, G.A.; Powell, G. Application of DL-[beta]-aminobutyric acid (BABA) as a root drench to legumes inhibits the growth and reproduction of the pea aphid Acyrthosiphon pisum (Hemiptera: Aphididae). Bull. Entomol. Res. 2005, 95, 449. [Google Scholar] [CrossRef]
30. Soler, A.; Marie-Alphonsine, P.A.; Quénéhervé, P.; Prin, Y.; Sanguin, H.; Tisseyre, P.; Daumur, R.; Pochat, C.; Dorey, E.; Gonzalez Rodriguez, R.; et al. Field management of Rotylenchulus reniformis on pineapple combining crop rotation, chemical-mediated induced resistance and endophytic bacterial inoculation. Crop Prot. 2021, 141, 105446. [Google Scholar] [CrossRef]
31. Joy, P.; Anjana, R.; Soumya, K. Insect Pests of pineapple and management. In Insect Pests Management of FRUIT CROPS; Ajay Kumar Pandey, P.M., Ed.; Biotech Books: New Delhi, India, 2016; pp. 471–492. [Google Scholar]
32. Tripathi, D.; Raikhy, G.; Kumar, D. Chemical elicitors of systemic acquired resistance—Salicylic acid and its functional analogs. Curr. Plant Biol. 2019, 17, 48–59. [Google Scholar] [CrossRef]
33. Soler, A.; Marie-Alphonsine, P.-A.; Corbion, C.; Quénéhervé, P. Differential response of two pineapple cultivars (Ananas comosus (L.) Merr.) to SAR and ISR inducers against the nematode Rotylenchulus Reniformis. Crop Prot. 2013, 54, 48–54. [Google Scholar]
34. Terry, L.A.; Joyce, D.C. Elicitors of induced disease resistance in postharvest horticultural crops: A brief review. Postharvest Biol. Technol. 2004, 32, 1–13. [Google Scholar] [CrossRef]
35. Elicitra. Guide Méthodologique D’évaluation de L’efficacité des Stimulateurs des Defenses des Plantes; Elicitra: Avignon, France, 2013; p. 35. [Google Scholar]
36. Py, C.; Lacoeuilhe, J.J.; Teisson, C. The Pineapple: Cultivation and Uses; Editions G.-P. Maisonneuve: Paris, France, 1987; p. 568. [Google Scholar]
37. Zhou, Y.; Dahler, J.; Underhill, S.; Wills, R. Enzymes associated with blackheart development in pineapple fruit. Food Chem. 2003, 80, 565–572. [Google Scholar] [CrossRef]
38. Soler, A.; Portal, N.; Marie-Alphonsine, P.-A.; Santos Bermúdez, R. Induced systemic resistance (ISR) and native tolerance to pathogens in banana: Preliminary results. In X International Symposium on Banana: ISHS-ProMusa Symposium on Agroecological Approaches to Promote Innovative Banana Production Systems, Montpellier, France; ProMusa: Montpellier, France, 2016. [Google Scholar]
39. Rodriguez, P.A.; Rothballer, M.; Chowdhury, S.P.; Nussbaumer, T.; Gutjahr, C.; Falter-Braun, P. Systems biology of plant microbiome interactions. Mol. Plant 2019, 12, 804–821. [Google Scholar] [CrossRef] [PubMed]
40. Wang, M.-L.; Paull, R.E. Genetic Transformation of Pineapple. In Genetics and Genomics of Pineapple; Springer: Berlin/Heidelberg, Germany, 2018; pp. 69–86. [Google Scholar]
41. Tanpure, R.S.; Kondhare, K.R.; Venkatesh, V.; Gupta, V.S.; Joshi, R.S.; Giri, A.P. Non-host Armor Against Insect: Characterization and Application of Capsicum annuum Protease Inhibitors in Developing Insect Tolerant Plants. In Genetically Modified Crops: Current Status, Prospects and Challenges Volume 2; Kavi Kishor, P.B., Rajam, M.V., Pullaiah, T., Eds.; Springer: Singapore, 2021; pp. 85–110. [Google Scholar]
42. Raimbault, A.-K.; Zuily-Fodil, Y.; Soler, A.; Mora, P.; Cruz de Carvalho, M.H. The expression patterns of bromelain and AcCYS1 correlate with blackheart resistance in pineapple fruits submitted to postharvest chilling stress. J. Plant Physiol. 2013, 170, 1442–1446. [Google Scholar] [CrossRef] [PubMed]
43. Atkinson, J.N.; Urwin, P.E.; Clarke, M.C.; McPherson, M.J. Image Analysis of the Growth of Globodera pallida and Meloidogyne incognita on Transgenic Tomato Roots Expressing Cystatins. J. Nematol. 1996, 28, 209–215. [Google Scholar]
44. Raimbault, A.K.; Zuily-Fodil, Y.; Soler, A.; Mora, P.; Cruz de Carvalho, M.H. Postharvest Chilling Treatment Induces Distinct Expression in Fruit Bromelain and Cystatin in Two Pineapple (Ananas comosus (L.) Merr.) Varieties Differing in Their Susceptibility to Blackheart Physiopathy. Ph.D. Thesis, Paris Créteil’, Paris, France, 2012. [Google Scholar]
45. Soneji, J.R.; Nageswara Rao, M. Genetic engineering of pineapple. Transgenic Plant J. 2009, 3, 47–56. [Google Scholar]
46. Barral, B.; Chillet, M.; Léchaudel, M.; Lugan, R.; Schorr-Galindo, S. Coumaroyl-isocitric and caffeoyl-isocitric acids as markers of pineapple fruitlet core rot disease. Fruits 2019, 74, 11–17. [Google Scholar] [CrossRef]
47. Liu, C.; Liu, Q.; Mou, Z. Redox signaling and oxidative stress in systemic acquired resistance. J. Exp. Bot. 2024, 75, 4535–4548. [Google Scholar] [CrossRef]
Soler A, Pochat C, Perrin M, Mendoza J, Latchimy F. Systemic Acquired Resistance: Plant Priming for Ecological Management of Mealybug-Induced Wilt in MD2 and Queen Victoria Pineapples. Agriculture. 2025; 15(3):264. https://doi.org/10.3390/agriculture15030264
Перевод статьи «Systemic Acquired Resistance: Plant Priming for Ecological Management of Mealybug-Induced Wilt in MD2 and Queen Victoria Pineapples» авторов Soler A, Pochat C, Perrin M, Mendoza J, Latchimy F., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
Фото: freepik





























































































Комментарии (0)