Красная свекла: от суперфуда до безотходного производства. Подробный обзор пользы для здоровья и инновационных способов переработки
Свекла столовая (Beta vulgaris), корнеплод, известный своим ярким природным цветом и питательным профилем, является источником широкого спектра биоактивных соединений, включая беталаины, фенольные соединения, витамины и антиоксиданты. Эти биологически активные вещества связаны со многими полезными для здоровья свойствами, включая антигипертензивное, антиоксидантное, противовоспалительное и противораковое действие. Промышленность по переработке свеклы производит значительное количество побочных продуктов, богатых фитохимическими веществами и беталаинами, что открывает ценные возможности для их использования. Таким образом, они могут заменить синтетические добавки и повысить пищевую ценность продуктов.
Аннотация
Сокращая количество отходов и поддерживая циркулярную экономику, побочные продукты переработки свеклы повышают эффективность использования ресурсов, снижают производственные затраты и уменьшают воздействие пищевой промышленности на окружающую среду. Свекла и ее побочные продукты богаты фитохимическими веществами, которые обеспечивают различные преимущества для здоровья. Они поддерживают здоровье сердечно-сосудистой системы, подавляют микробную порчу продуктов, способствуют функции печени, а также уменьшают воспаление и окислительный стресс. В данной статье представлен подробный обзор современных знаний о свекле и ее побочных продуктах с акцентом на их биохимические компоненты, методы экстракции и стабилизации, пользу для здоровья и потенциальное применение в пищевой промышленности. В работе подчеркивается универсальность и важность красной столовой свеклы и ее производных, а также обосновывается необходимость дальнейших исследований оптимизированных методов переработки и инновационных способов использования для повышения их промышленной и пищевой ценности. Предоставляя ценную информацию, данный обзор призван вдохновить ученых-пищевиков, диетологов и сельскохозяйственный сектор на интеграцию свеклы и ее побочных продуктов в более устойчивые и ориентированные на здоровье пищевые системы.
1. Введение
Программа развития Организации Объединенных Наций [1] сообщает, что ежегодно в мире образуется 1,3 миллиарда тонн пищевых отходов, что составляет одну треть от общего объема производства продуктов питания в продовольственном секторе. Согласно Ganesh et al. [2], отходы фруктов и овощей составляют большую часть пищевых отходов (42%), и необходимо эффективное управление этими отходами по экологическим и экономическим причинам.
Свекла столовая (Beta vulgaris L.) — травянистое цветущее двулетнее растение, принадлежащее к семейству Chenopodiaceae, родом из Азии и Европы. Она имеет богатое историческое и культурное значение, ее происхождение восходит к Средиземноморью, и она культивируется с древних времен. Начиная с 1000 года до н.э., листья морской свеклы использовались древними цивилизациями, а в Римской империи листья употребляли в пищу, а корни использовали как лекарственное средство. Позже морская свекла приобрела популярность в Индии, где ее питательные свойства использовались наряду с частым применением в лечебных целях. Она также была известна и употреблялась в пищу греками и римлянами, которые называли ее сицилийской свеклой [3]. Этот питательный продукт представляет собой корнеплод, который существует в различных формах, при этом окраска клубня варьируется от желтой до красной [4].
На рынке представлены три коммерчески доступных подвида Beta vulgaris: B. maritima, B. vulgaris и B. adanensis. Эти подвиды также известны как красная свекла, сахарная свекла, свекла столовая, листовая свекла, золотистая свекла или просто свекла [5]. Их широко употребляют в мире в виде салатов, солений и соков, и производят круглый год [6]. Последние достижения в методах культивирования свеклы (орошение, селекционные программы и внесение питательных веществ) были направлены на повышение урожайности и качества. Внедрение методов органического земледелия и интегрированной защиты растений позволило снизить использование химикатов, сохраняя при этом здоровье посевов свеклы [7,8].
Главный корень свеклы длинный, сужающийся и крепкий, а его боковые корни образуют плотную структуру. Корень представляет собой потребляемую часть растения, часто достигающую 1–2 дюймов в высоту [5]. Корни свеклы различаются по форме (шаровидные или цилиндрические) и цвету (красновато-фиолетовый, золотисто-желтый или красновато-белый) в зависимости от сорта. Листья, появляющиеся из верхушки, различаются по размеру, морфологии и цвету. Семена свеклы многоростковые, так как одно семя может дать несколько проростков и имеет пробковидную оболочку, содержащую фенольные соединения, ингибирующие прорастание. Цветки мелкие, с пятью лепестками [9]. Свекла доступна круглый год, хорошо растет в прохладные сезоны при идеальном диапазоне температур 15–19 °C. Более низкие температуры усиливают ее темно-красный цвет, хотя она также может переносить и более сильную жару [10]. Ее можно собирать через 75–90 дней летом и через 100–120 дней зимой. Азот вносится на начальных фазах роста, и его доступность существенно влияет на уровень сахара в свекле [8].
Свекла является важной товарной культурой, возделываемой по всему миру (Рисунок 1), при этом выращивание сахарной свеклы в 2021 году охватывало 4,5 миллиона гектаров, а урожай составил 269,19 миллиона тонн. Россия лидировала по производству с 45 миллионами тонн, за ней следовали Франция (33 миллиона), США (31 миллион) и Германия (30 миллионов). На долю Европы пришлось 67,3% мирового производства, за ней следуют Азия (14%), Америка (12,6%) и Африка (6,1%) [11]. Научная классификация свеклы относит ее к царству Plantae, отделу Tracheophyta, классу Magnoliopsida, порядку Caryophyllales, семейству Amaranthaceae и роду Beta L., который включает в себя в общей сложности 78 классифицированных видов. Наиболее известные румынские съедобные сорта Beta vulgaris: «Rubiniu» (с 2005 г.), «Reta» (с 2005 г.), «Regat» (с 2005 г.), «De Arad» (1991 г.) и др. [12].
Рисунок 1. Beta vulgaris L. по всему миру [12]. Различные цвета отражают перекрывающиеся классические гексагоны (56 848 геопривязанных записей) и означают встречаемость подвидов, видов и сортов свеклы в каждой области земного шара.
Свекла богата биоактивными соединениями, включая беталаины, флавоноиды (рутин, астрагалин, кемпферол, кверцетин), терпеноиды, сапонины, витамины, фенольные кислоты (галловая, n-кумаровая, кофейная), стероиды, алкалоиды, дубильные вещества и сахара. Она содержит 9,56 г/100 г углеводов и 2,8 г/100 г клетчатки и особенно богата калием (356 мг/100 г в органической свекле). Органическая свекла богаче минералами, такими как калий, фосфор, магний, железо и кальций, чем обычная свекла [13]. Беталаины, включая бетацианины (бетанидин, изобетанин, бетанин) и бетаксантины (вульгаксантин I, допамин-бетаксантин), являются ключевыми соединениями в свекле, причем их содержание выше в кожуре, чем в мякоти. Эти пигменты, известные своими противовоспалительными и антиоксидантными свойствами, придают свекле яркий цвет и служат натуральными пищевыми красителями [14]. Свекла содержит высокие уровни нитратов и нитритов, в среднем 1379 мг/кг, что является самым высоким показателем среди корнеплодов. Эти соединения полезны для здоровья дыхательной и сердечно-сосудистой систем, делая свеклу и ее добавки полезными для поддержки этих систем [15].
Яркий цвет, характерный вкус и питательные свойства свеклы, благодаря которым она получила статус суперфуда, сделали ее объектом исследований как для академических кругов, так и для пищевой промышленности [8,16]. Темно-красная свекла является основным продуктом питания во всем мире, ее употребляют в свежем виде в салатах, вареной в тушеных блюдах, а также широко используют в таких блюдах, как восточноевропейский свекольный суп и южноамериканская маринованная свекла. Свеклу также промышленно перерабатывают для маринования, а свекольный сок используется в меньших количествах. В Австралии свеклу часто добавляют в бутерброды, а ее листья и стебли готовят на пару или жарят для употребления в пищу [8]. Согласно Slavov et al. [17], свекла может служить заменителем синтетических красителей и использоваться в качестве маркетинговой стратегии в пищевом секторе.
Согласно Yadav et al. [18], среди потребителей растет предпочтение зеленому консьюмеризму, который подразумевает использование меньшего количества синтетических ингредиентов. Безопасность натуральных красителей для употребления в пищу широко признана. Натуральные красители предпочтительнее синтетических в коммерческих пищевых продуктах из-за проблем со здоровьем, так как синтетические красители могут вызывать аллергию и обладать канцерогенными свойствами при длительном употреблении [19].
Красная свекла широко используется в пищевой промышленности и производстве напитков в виде свекольного сока или обезвоженного свекольного порошка, причем соки часто распылительной сушки преобразуют в порошок [20]. Свежую свеклу, свекольный порошок или экстрагированные пигменты добавляют для усиления красного цвета в томатные пасты, соусы, десерты, супы, джемы, конфеты, мороженое, желе и зерновые продукты. Растворимость натуральных красителей в воде позволяет интегрировать их в жидкие пищевые системы (напитки, молочные продукты, соусы и заправки). Натуральные пищевые красители усиливают визуальную привлекательность, улучшают различимость и приносят пользу для здоровья благодаря своим мощным антиоксидантным свойствам [21]. Свекольный сок окрашивает различные продукты, такие как молочные продукты, йогурт, плавленый сыр и сладости. Однако термическая обработка изменяет его цвет, что делает его подходящим для мороженого, кондитерских изделий и продуктов с высоким содержанием сахара. Он также служит потенциальной заменой синтетических антиоксидантов в рецептурах майонеза, как свежего, так и сублимированного [22,23].
Производство свекольного сока в Великобритании приводит к образованию отходов, составляющих 35–40% от исходной биомассы, в то время как ЕС является преобладающим мировым производителем, на долю которого приходится около 70% общего объема производства. Свекла, богатая водорастворимыми азотистыми пигментами, такими как беталаины, обладает значительными функциональными свойствами, что приводит к увеличению использования этих красных и желтых пигментов в пищевой и других отраслях промышленности. Пигменты, производные от беталамовой кислоты, подразделяются на два основных типа: красно-фиолетовые бетацианины и желтые бетаксантины, широко используемые в качестве натуральных красителей. Бетацианины имеют цвет от пурпурного до фиолетового, в то время как бетаксантины демонстрируют желтые и оранжевые оттенки. Свекла содержит около 1000 мг беталаинов на 100 г общего сухого остатка и 120 мг на 100 г сырой массы. Эти соединения могут использоваться в фармацевтической промышленности и в качестве пищевых добавок благодаря своим красящим свойствам и биоактивности как антиоксиданты [24,25].
Уровень пигментов в корнях свеклы зависит от спелости, сорта и местных погодных условий. Бетанин составляет 75–78% пигментов бетацианинов, при этом изобетанин составляет 95% красных пигментов в свекольном соке. Промышленные отходы свеклы, включая жом и кожуру от производства сока, джема и напитков, содержат высокие уровни пигментов и ценные соединения. Использование этих отходов для извлечения натуральных красителей позволяет сократить количество отходов и добавить стоимость. Кроме того, побочные продукты, такие как кожура, стебли и листья, признаны за их питательные и функциональные свойства, что поддерживает их применение в устойчивых пищевых системах [5,26].
Данный обзор представляет всесторонний анализ красной столовой свеклы и ее побочных продуктов, фокусируясь на ключевых областях: (1) фитохимический состав и биоактивность; (2) передовые методы экстракции для оптимального извлечения и стабилизации; (3) польза для здоровья, связанная со свеклой и ее биоактивными соединениями; и (4) разнообразные области применения в пищевой промышленности, включая натуральные красители и функциональные ингредиенты. В нем подчеркивается растущее использование побочных продуктов свеклы в устойчивых пищевых системах, с акцентом на сокращение отходов и эффективность использования ресурсов. Исследование выделяет потенциал свеклы для улучшения здоровья человека и стимулирования развития технологий функциональных продуктов питания, а также исследует будущие возможности для исследований.
2. Характеристика отходов и побочных продуктов свеклы
По оценкам ФАО, отходы и побочные продукты переработки свеклы, такие как кожура, семена, стебли и жом, составляют до 1,3 миллиарда тонн в год, что представляет собой четверть объема производства пищевой промышленности. Долгое время производители либо утилизировали эти побочные продукты, либо использовали их повторно в качестве удобрения или корма для животных. Однако недавние исследования показали, что эти побочные продукты богаты биоактивными соединениями, что открывает потенциал для их использования в разработке функциональных продуктов питания или в качестве пищевых добавок [2,27].
Побочный продукт переработки свеклы играет значительную роль в промышленных процессах. Повышение ценности побочных продуктов красной свеклы, в частности листьев и стеблей [28], кожуры и жома [29] и корней [30], стало предметом недавних исследований. Эти исследования фокусируются главным образом на извлечении фенольных соединений и беталаинов. В процессе производства жидкой свеклы для распылительной сушки, по оценкам, более 40% свеклы классифицируется как побочные продукты. Процесс получения натуральных красителей часто включает распылительную сушку жидкой свеклы. Волокнистое вещество, образующееся в результате экстракции сока, обладает характерным пурпурным оттенком, напоминающим свеклу, как показано на Рисунке 2. Обычно эти побочные продукты используются либо для производства кормов для животных, либо для производства биотоплива [31]. Рисунок 2 иллюстрирует типы побочных продуктов свеклы и их биохимические компоненты.
Рисунок 2. Биохимические компоненты побочных продуктов свеклы и их воздействие на здоровье.
Несмотря на свою внутреннюю ценность, листья и стебли свеклы часто остаются незамеченными на овощных распределительных центрах или промышленных предприятиях, в конечном итоге становясь органическим удобрением, кормом для животных или отходами [32]. Недавний интерес к повышению ценности побочных продуктов направлен на сокращение отходов и повышение эффективности использования ресурсов, снижение воздействия на окружающую среду и создание новых экономических возможностей [33].
Кроме того, эти остатки агропромышленного комплекса имеют потенциал служить ценным источником компонентов. Их извлечение добавляет стоимость технологической цепочке, тем самым улучшая управление сельскохозяйственными отходами [34]. Как правило, надземные части свеклы, включая листья и стебли, содержат значительное количество железа, соли, калия, витамина А и витаминов группы В. Эти количества существенно выше, чем в корнях [35].
Каротиноиды, минералы, флавоноиды, тритерпеновые сапонины, беталаины, бетацианины, бетаксантины и антиоксидантные вещества, такие как фенольные кислоты, особенно полиненасыщенные жирные кислоты, присутствуют в этих отходах [32].
2.1. Свекольный жом
Из-за чрезмерного содержания сахара потребление соков значительно снизилось в США и Европе за последнее десятилетие. В результате сектор безалкогольных напитков был вынужден адаптироваться, внедряя низкокалорийные продукты с нулевой калорийностью. Для достижения этой цели они начали включать овощи, такие как свекла, чтобы снизить общее содержание сахара. После извлечения сока из свеклы остаточный твердый остаток, известный как жом, обычно считается побочным продуктом. Свекольный жом богат клетчаткой и включает значительные количества фенольных соединений и беталаинов, которые являются азотистыми пигментами. Обычно свекольный жом утилизируется на свалках или редко используется в качестве корма для скота [36].
Свекольный жом измельчается в порошок как экономичная и бескалорийная пищевая добавка, служащая заменителем муки. Это связано с его обильным содержанием клетчатки и способностью эффективно поглощать масло или воду [37]. После экстракции сока около 15–30% жома, обладающего значительным потенциалом, обычно теряется или редко используется в качестве корма для животных [38].
Costa et al. [39] сообщили, что свекольный жом имеет содержание влаги 10,1%, золы 5,62%, белка 12,64%, общее содержание углеводов 20,83%, содержание нерастворимой клетчатки 45,08%, содержание растворимой клетчатки 20,14% и содержание жира 1,31%.
Отличной альтернативой является использование жома в кулинарном бизнесе в качестве компонента различных товаров, включая печенье, конфеты и хрустящие хлебцы. Использование свекольного жома привело к значительному повышению как содержания клетчатки, так и антиоксидантной активности [40].
Сок содержит больше всего натуральных красителей, в то время как фракция жома богата углеводами (пектином). Тем не менее, только небольшое количество исследовательских работ было направлено на то, чтобы сделать эти углеводы более ценными [41,42].
Существует настоятельная необходимость изучить различные методы повторного использования этих отходов или экономически эффективного извлечения беталаинов и фитохимических веществ. Жом красной свеклы обладает многочисленными функциональными свойствами благодаря обилию биоактивных веществ и повышенному содержанию клетчатки, что может придать интересные технологические свойства пищевой промышленности, такие как улучшение качества печенья, макаронных изделий и тортов [39].
2.2. Кожура свеклы
В промышленном процессе свеклу очищают от кожуры, и удаляют отбракованную кожицу. При промышленной переработке 11–50% корнеплодов отбраковывается в виде кожуры [43]. Кожура корнеплодов содержит крахмал, некрахмальные полисахариды, белки, пищевые волокна, лигнин, липиды и богата каротиноидами и полифенолами. Кожура свеклы имеет следующий химический состав: влага (86,3%), зола (1,48%), белок (1,02%), сырая клетчатка (2,6%), общие сахара (8,4%) и общие липиды (0,2%) [44]. Кожура обычно содержит большую часть беталаинов, составляя до 54% от общего количества, за ней следуют коронка с 32% и мякоть с 14%. Фенольный состав кожуры включает l-триптофан, бетацианин, бетаксантины и производные циклодопа-глюкозидов [36].
Кожура свеклы проявляет широкий спектр биологических действий, включая антибактериальные, антиоксидантные, противовоспалительные, противотревожные, антигипертензивные, противораковые и противодиабетические свойства. Потенциальная эффективность кожуры свеклы как ценного источника натуральных красителей была продемонстрирована в различных секторах, особенно в пищевой промышленности [45].
2.3. Листья и стебли свеклы
Клубень является основным съедобным продуктом, в то время как листья и стебли превращаются в отходы и остаются неиспользованными. Листья и стебли свеклы обычно считаются компостом, кормом для скота или пищевыми отходами. Листья составляют от 20% до 34% от общего объема корнеплодов [46]. Листья сахарной свеклы и столовой свеклы обычно содержат углеводы (46–71% сухой массы), белки (18–25% сухой массы), пищевые волокна (7–36% сухой массы), липиды (2–5% сухой массы) и биоактивные компоненты, включая флавоноиды, фенольные кислоты, каротиноиды, беталаины, хлорофилл, витамины и различные микроэлементы. Листья сахарной свеклы богаты белками и содержат все незаменимые аминокислоты, что свидетельствует о значительных перспективах как источник растительного белка [47]. Непосредственное употребление этих листьев в пищу может представлять угрозу для безопасности из-за наличия химических загрязнителей (тяжелые металлы и нитраты), остатков пестицидов (фосфорорганические соединения и карбаматы) или возможных инфекций (грибковые токсины и патогены), которые могут поставить под угрозу здоровье потребителя. Следовательно, обеспечение безопасности листьев имеет решающее значение для их использования в пищу человеком [48].
Хотя листья свеклы считаются обладающими значительным терапевтическим потенциалом для лечения стресс-ассоциированных психических расстройств [49], не рекомендуется непосредственно добавлять их в блюда после сушки и измельчения в порошок. Необработанные листья могут содержать антинутриенты, такие как фитиновая кислота, которые могут влиять на биодоступность витаминов и макронутриентов при употреблении в значительных количествах [50]. На Рисунке 3 представлены структуры различных биоактивных соединений побочных продуктов свеклы.
Рисунок 3. Примеры структур различных важных биоактивных соединений в побочных продуктах свеклы. (a) β-каротин, (b) Бетанин, (c) Вульгаксантин-I, (d) Феруловая кислота, (e) Кемпферол, (f) Рутин [51].
3. Биохимические компоненты побочных продуктов свеклы
3.1. Фенольные соединения
Категория вторичных метаболитов, обнаруженных в растениях, — фенольные соединения, которые имеют решающее значение для качества продуктов растительного происхождения. Свекла, богатая фенолами и флавоноидами, способствует здоровому функционированию печени, почек и иммунной системы [52].
Более того, кожура свеклы содержит второе по величине количество общих фенолов в пересчете на сухую массу. 5,5',6,6'-Тетрагидрокси-3,3'-бииндолил, димер 5,6-дигидроксииндолкарбоновой кислоты, и беталаины, включая вульгаксантин I, вульгаксантин II, индикаксантин, пребетанин, изобетанин, бетанин и необетанин, были высоко нестабильными фенольными соединениями, экстрагированными из кожуры красной свеклы. Эти специфические фенольные соединобладают значительными преимуществами для здоровья, включая антиоксидантные, противовоспалительные свойства и поддержку сердечно-сосудистой системы. Ключевые соединения, такие как вульгаксантин I и II, бетанин и индикаксантин, защищают от окислительного стресса, уменьшают воспаление и могут снижать риск хронических заболеваний, таких как рак и нейродегенеративные расстройства. Например, бетанин поддерживает здоровье сердца, снижая кровяное давление, в то время как индикаксантин помогает защитить ДНК от окислительного повреждения [30,53]. Из оболочек семян свеклы были выделены два фенольных амида: N-транс-ферулоилтирамин и N-транс-феруоилгомованилиламин [54]. Свекла (25,7 мг/100 г) и черная морковь (24,2 мг/100 г) имели более высокую концентрацию галловой кислоты по сравнению с другими овощами (горькая тыква, мята). Общее содержание фенолов было выше в свекле (909,5 мг/100 г) по сравнению с баклажаном (292,3 мг/100 г), оранжевой морковью (179,3 мг/100 г) и шпинатом (233,5 мг/100 г) [55].
Было обнаружено, что свекла содержит в общей сложности 50–60 мкмоль фенольных кислот на грамм сухой массы [56]. В Beta vulgaris var. cicla было обнаружено значительное количество производных от двух основных групп фенольных кислот: гидроксибензойных кислот и гидроксикоричных кислот. Согласно Maraie et al. [57], эти фенольные кислоты включают пролин, эпикатехин, катехингидрат, рутин, ванилиновую, n-кумаровую, протокатеховую, кофейную кислоты, сиринговые кислоты и мономер дегидровомифолиол.
Содержание фенолов в экстракте жома свеклы сорта Детройт было измерено с помощью ВЭЖХ, и результаты показали, что на 100 г сухой массы свекольного жома приходится 132,52 мг феруловой кислоты, 5,12 мг ванилиновой кислоты, 1,13 мг n-гидроксибензойной кислоты, 7,11 мг кофейной кислоты, 5,42 мг протокатеховой кислоты, 37,96 мг катехина, 0,39 мг эпикатехина и 0,25 мг рутина [58].
Ванилин, рамнетин, астрагалин, катехин, эпикатехин гидрат, рамноцитрин, рутин, бетагарин, бетавульгарин, кверцетин, тилирозид, кохилофолин А, дигидроизорамнетин и апигенин входят в число флавоноидов, обнаруженных в свекле [58,59,60].
Согласно Mikołajczyk-Bator et al. [61] и Mroczek et al. [62], в свекле обнаружено в общей сложности 26 тритерпеновых сапонинов, включая бетавульгарозиды I, II, III, IV, V, VI, VII, VIII, IX и X. И наоборот, листья свеклы содержали бетавульгарозиды IX и X, в отличие от корней, которые их не содержали. Первоначально считалось, что бетавульгарозиды I–IX, которые представляют собой тритерпеновые олигогликозиды с уникальными ацетальными и диоксолановыми типами заместителей, биосинтезируются путем окислительного расщепления концевой моносахаридной единицы.
Фитохимический состав побочных продуктов свеклы может значительно варьироваться из-за таких факторов, как качество почвы, орошение, внесение удобрений и время сбора урожая, что делает стандартизацию проблемой в коммерческих приложениях. Свекла, выращенная биодинамическим способом, имела более высокое содержание полифенолов по сравнению с обычными и интегрированными категориями [7].
3.2. Беталаины
Свекла содержит большое количество водорастворимых беталаинов, которые являются азотистыми растительными пигментами. Согласно Haltestad et al. [63], гидроксилирование тирозина до дигидроксифенилаланина является первым этапом в синтезе беталаина. Затем ароматическое кольцо дигидроксифенилаланина расщепляется с образованием беталамовой кислоты. Кожура свеклы имеет самую высокую концентрацию беталаина, тогда как количество колеблется по всему корню. Согласно Marmion [24], свекла имеет среднюю концентрацию беталаина 120 мг/100 г сырой массы и указанное соотношение содержания бетацианина к бетаксантину 1:3. Кожура свеклы содержит значительно более высокое общее содержание беталаина (12,48 мг/г) по сравнению с кожурой питахайи (3,2 мг/г), что подчеркивает ее превосходный потенциал в качестве источника натуральных красителей и антиоксидантов [64].
Бетацианины, которые состоят из беталамовой кислоты и цикло-3,4-дигидроксифенилаланина (ДОФА) и имеют красновато-фиолетовый оттенок, проявляют максимальную длину волны поглощения 538 нм [65]. Бетацианины являются результатом конденсации цикло-ДОФА с беталамовой кислотой и определяются как негликозилированные хромофоры бетанидина или изобетанидина [66]. Свекла содержит наибольшие количества бетацианинов, а именно бетанин, изобетанин и необетанин, в указанном порядке. Бетаксантины, желтые пигменты с оптимальным поглощением при 480 нм, образуются в результате реакции аминокислот или биогенных аминов с беталамовой кислотой. В свекле преобладающими бетаксантинами в порядке убывания являются вульгаксантин I, вульгаксантин II, индикаксантин и мираксантин. Цвет корня определяется изменением соотношений бетацианинов и бетаксантинов; более высокая концентрация бетацианинов придает корню его характерный красновато-пурпурный оттенок. Согласно Domínguez et al. [65], в природе обнаружено около 90 различных беталаинов — 60 бетацианинов и 33 бетаксантина. Кроме того, характерные красители могут варьироваться от желтых до пурпурно-синих оттенков путем комбинирования бетацианинов и бетаксантинов. Кожура свеклы содержала ряд бетацианинов, включая необетанин, изобетанин, пребетанин и бетанин [54].
3.3. Пищевые волокна
Содержание пищевых волокон является важнейшим элементом рациона, который предлагает многочисленные преимущества для здоровья и помогает в профилактике различных заболеваний. Пищевые волокна полезны для здоровья человека, так как они устойчивы к гидролизу пищеварительными ферментами; они подвергаются полной или частичной ферментации в толстом кишечнике; они в основном состоят из целлюлозы, олигосахаридов, лигнина, пектина, восков и камедей [67].
Преобладающим соединением, связанным с побочными продуктами, являются пищевые волокна, в основном состоящие из структурных полисахаридов. Свекольный жом может служить хорошим источником фитохимических веществ и пищевых волокон. Согласно Elleuch et al. [68], свекольный порошок содержит 55% пищевых волокон. Следовательно, его можно включать в крупы и хлебобулочные изделия, такие как хлеб, торты и печенье, чтобы обеспечить значительное количество пищевых волокон.
Содержание пищевых волокон в свекольном жоме составляет около 62,75%. Свекольный жом является уникальным подходом для обогащения пищевых продуктов клетчаткой благодаря своей улучшенной функциональности, обусловленной оптимальным балансом растворимой и нерастворимой клетчатки, превосходными гидратационными свойствами, повышенной ферментируемостью и наличием фитохимических веществ [69].
3.4. Каротиноиды
Каротиноид — это пигмент, полученный из свеклы, конкретно экстрагированный как β-каротин, с концентрацией 1,9 мг на 100 г свеклы [70]. Каротиноиды, которыми богата свекла, являются мощными антиоксидантами, играющими решающую роль в предотвращении заболеваний. Каротиноиды представляют собой класс фотосинтетических вспомогательных пигментов, обнаруженных в растениях. Они выполняют двойную роль, действуя как поглотители кислородных радикалов, вырабатываемых хлоропластами в процессе фотосинтеза. Это позволяет им защищать клеточные компоненты, такие как ДНК, от потенциального вреда, вызванного свободными радикалами. Согласно Salah et al. [71], сообщалось, что содержание каротина в свекле составляет 1,9 мг/100 г. Листья свеклы содержат ксантофилл, который состоит из β-каротина и кислородсодержащих соединений, таких как лютеин [72].
3.5. Минералы
Свекла содержит природные минералы, которые поддерживают здоровье костей, зубов и тканей, включая натрий (Na), железо (Fe), калий (K), кальций (Ca), цинк (Zn), фосфор (P), медь (Cu) и магний (Mg) [19,73,74]. Свеклу используют для лечения лихорадки и запоров из-за высокого содержания меди, которая способствует усвоению организмом железа [8]. Минералы, обнаруженные в свекле, включают кальций (16 мг), железо (0,79 мг), фосфор (38 мг), калий (305 мг), магний (23 мг), цинк (0,35 мг) и натрий (77 мг) на 100 г съедобной части [8].
Листья свеклы имеют более высокую концентрацию железа (256 мг/кг), чем многие другие овощи, такие как Senna occidentalis (110 мг/кг), Chenopodium album (130 мг/кг) и Justicia flava (160 мг/кг) [32,75]. Кроме того, согласно Ekholm et al. [76], было обнаружено, что листья свеклы имеют высокое содержание Cu (13,42 мг/кг), сравнимое с содержанием в кресс-салате и рукколе. Аналогично, Biondo et al. [32] обнаружили, что листья свеклы имеют высокую концентрацию K (20 784 мг/кг), что способствует метаболизму белков и углеводов.
3.6. Витамины
Свекла богата жирорастворимыми витаминами (A-ретинол, E-токоферол, K-филлохинон) и водорастворимыми витаминами (B1-тиамин, B2-рибофлавин, B3-ниацин, B5-пантотеновая кислота, B6-пиридоксин, B9-фолаты, B12-цианокобаламин и C-аскорбиновая кислота) [77]. Согласно ранним исследованиям, свекла включает различные витамины, включая витамин B6 (0,067 мг), аскорбиновую кислоту (3,6 мг), ниацин (0,331 мг), пантотеновую кислоту (0,145 мг), тиамин (0,31 мг), рибофлавин (0,27 мг), витамин A (2 мкг) и фолат (80 мкг) [8]. Поскольку свекла усиливает приток крови к мозгу, содержащиеся в ней витамины группы В помогают уменьшить симптомы деменции и потери памяти [64]. Листья свеклы богаты витамином A (3,93 мг) и K (280 мг), которые важны для здоровья сердечно-сосудистой системы и профилактики рака, а также могут снижать кровяное давление [8]. Кроме того, свекла имеет высокую концентрацию фолиевой кислоты, которая поддерживает здоровую функцию нервной системы и профилактику рака [22].
3.7. Сапонины
Сапонины, классифицируемые как тритерпеновые или стероидные гликозиды, преимущественно встречаются в бобовых и корнеплодах, таких как свекла, сахарная свекла и овес. Они обладают острым вкусом и поверхностно-активными свойствами [78]. Сапонины, биологически активные химические вещества, экстрагируются из растений для борьбы с инфекциями и травоядными животными. Ранние исследования показывают, что B. vulgaris содержит примерно 11 тритерпеновых сапонинов. Почти все сапонины состоят из производных олеаноловой кислоты [5]. В исследовании было идентифицировано 26 тритерпеновых сапонинов в свекле, 17 из которых ранее не были охарактеризованы, а 7 были уникальными. Концентрация сапонинов составляла 8,22 мг на 100 мл свекольного сока.
Сапонины снижают риски развития рака, уменьшают количество жиров в крови и повышают чувствительность к глюкозе в крови. Диета, богатая сапонинами, может предотвратить кариес и агрегацию тромбоцитов, лечить гиперкальциурию у взрослых и служить противоядием при острой токсичности тяжелыми металлами [79,80].
4. Инновационные применения побочных продуктов свеклы
В настоящее время произошел сдвиг в моделях питания населения в сторону принятия более здоровых пищевых привычек [81]. Кожура красной свеклы использовалась для экстракции беталаина и других нутрицевтических соединений для кулинарных целей [43].
4.1. Натуральные пищевые добавки
Побочные продукты свеклы все чаще используются в пищевой промышленности благодаря их значительной пищевой ценности и потенциальной пользе для здоровья. Свекольный порошок является отличным источником клетчатки, минералов и антиоксидантов (беталаинов), в то время как хлебные смеси и хлебобулочные изделия представляют собой альтернативные варианты использования свеклы, которые включают значительно больше калорий и обогащены антиоксидантами [26]. Кожура и жом свеклы, как ценные побочные продукты, богатые полезными для здоровья соединениями, могут использоваться в нутрицевтиках, фармацевтических препаратах и функциональных пищевых продуктах. Рисунок 4 иллюстрирует использование порошков из побочных продуктов свеклы в различных пищевых приложениях.
Рисунок 4. Повышение ценности побочных продуктов свеклы и потенциальные продукты.
Промышленники и технологи пищевых продуктов в настоящее время занимаются разработкой функциональных продуктов питания. Таблица 1 иллюстрирует промышленное пищевое применение побочных продуктов свеклы.
Таблица 1. Потенциальное использование различных форм побочных продуктов свеклы в продуктах питания.
Жом свеклы, благодаря своим натуральным, нетоксичным пигментам и красящим свойствам, широко используется в кулинарном секторе в качестве добавки. Свекольный порошок широко используется в разнообразных кулинарных продуктах, включая печенье, торты, закуски и сладости, благодаря своим функциональным свойствам, таким как влагоудерживающая способность, водоудерживающая способность, набухаемость и маслопоглощающая способность. Использование свекольного жома экономически выгодно и может функционировать как ценный компонент. Экстракт и порошок свеклы, полученные из отходов, проявляют значительные антиоксидантные свойства, которые предотвращают окисление жиров в колбасных изделиях, что объясняется высокими концентрациями беталаинов и фенольных соединений [37].
В настоящее время из кожуры свеклы, содержащей значительное количество фитохимических веществ, производят желе, джемы и мармелады. Они доступны как с сахаром, так и без него. Кожура и экстракты свеклы используются в заправках для салатов, десертах и соусах, придавая визуально привлекательный вид продуктам с натуральным качеством. Свекольные чипсы производятся с использованием нескольких злаков, специй и других семян, полученных из отходов свеклы [26]. В настоящее время нитраты и нитриты производятся естественным путем из свекольного жома. Свекольный жом не только богат нитратами/нитритами, но также содержит другие полезные компоненты, которые улучшают качество пищи и обеспечивают функциональные свойства [108].
Добавление порошка кожуры свеклы в безе положительно влияет на физико-химические и фитохимические характеристики, повышая пищевую ценность, эстетику продукта и его стабильность. Эта технология поддерживает принципы циркулярной экономики и способствует устойчивому использованию агропродовольственных побочных продуктов [109].
Sahni & Shere [40] оценили приемлемость печенья, обработанного свекольным жомом. Использование свекольного жома изменило как питательные, так и сенсорные характеристики обогащенного печенья. Уровни влажности, сырой клетчатки и белков повысились, в отличие от углеводов, которые уменьшились с увеличением интеграции порошка свекольного жома. Печенье с 10% порошка свекольного жома получило наивысшее сенсорное одобрение благодаря улучшенному вкусу и аромату, при этом снижая нежелательную темноту, часто связанную с печеньем. Процентное содержание сырой клетчатки в лузге пшеничной муки и порошке из отходов свеклы составляло 51,77% и 62,75% соответственно. Лузга пшеничной муки и порошок из отходов свеклы использовались для приготовления печенья. Согласно Chauhan and Rajput [87], эта комбинация оказалась приемлемой на основе сенсорной оценки, а также благодаря высокому содержанию минералов и сырой клетчатки.
Экстракты свеклы и ее побочных продуктов содержат множество биоактивных компонентов, имеющих значительную экономическую ценность, благодаря их антиоксидантным свойствам (беталаины, фенольные кислоты и флавоноиды), красящим способностям (беталаины) и стабилизирующим эффектам (нитраты/нитриты) [65]. Использование пигментов свеклы растет в промышленности из-за их полезной для здоровья биоактивности и красящих свойств, которые могут заменить синтетические красители [5]. Alshehry [98] изучала изменения в качестве кексов, включающих свекольный порошок (2,5–10%). Результаты продемонстрировали, что включение свекольного порошка улучшило сохранение качества и подавило микробиологическое загрязнение. Кроме того, включение свекольных порошков до 10% улучшило сенсорные характеристики с точки зрения физических свойств и цвета [98].
Пигменты, полученные из свеклы, широко используются в качестве натуральных пищевых красителей в пищевой промышленности США и Европейского Союза [21]. Порошкообразный экстракт пигмента свеклы в концентрациях 0,2% в сорбетах и 0,3% в джеме был успешно включен, демонстрируя сенсорные качества, сравнимые с продуктами, содержащими 0,1% кармина (синтетический красный краситель) [21]. Пигменты свеклы признаны за их антиоксидантные характеристики [21,98], которые играют решающую роль в регулировании качества пищевых систем во время хранения.
Печенье [99] и крекеры [104], обогащенные свекольным порошком, содержащие 5 г и 10 г соответственно, демонстрируют улучшенные питательные и сенсорные характеристики. Мультизлаковая закуска, обогащенная 30% свекольного жома, была разработана и оценена на предмет сенсорных и химических характеристик [100]. Было обнаружено, что произведенные мультизлаковые закуски имеют высокие уровни белков, клетчатки и минералов, а также благоприятные сенсорные характеристики. Некоторые авторы использовали свекольный порошок в качестве функционального пищевого компонента для производства питательных макаронных изделий [103,110] и лапши [5]. Авторы утверждали, что включение свекольного порошка улучшило питательные, физико-химические, кулинарные и сенсорные характеристики конечных товаров.
Учитывая значительное количество фитохимических веществ, минералов, витаминов и белка в свекле, свекольная паста использовалась для приготовления функционального свекольного желе и конфет [101]. Свекольное пюре [111] и свекольный жом [105] использовались в качестве функциональных ингредиентов в рецептуре сливочного сырного спреда и сырных крекеров соответственно.
В последующем исследовании был произведен и проанализирован йогурт, обогащенный свекольным порошком, на предмет его качественных характеристик [88]. Добавление 8% свекольного порошка значительно увеличило количество полезных бактерий в йогурте в течение срока хранения. Кроме того, было показано, что физико-химические и сенсорные качества йогурта, дополненного свекольным порошком, превосходят таковые у контроля [88].
Имбирная конфета, богатая антиоксидантами, была разработана с использованием 9% экстракта бланшированного свекольного жома [102]. Формула показала самые высокие концентрации бетацианина (18,8 мг/кг сухой массы) и бетаксантина (12,8 мг/кг сухой массы), а также удовлетворительные сенсорные характеристики.
4.2. Другие способы использования побочных продуктов свеклы
Кожура свеклы является широко используемым натуральным красителем, служащим в качестве красителя и индикатора свежести в упаковке пищевых продуктов. Вещество состоит из пигментов, которые реагируют на изменения pH, показывая степень свежести продукта через различные оттенки [112]. Zin et al. [113] и Silva et al. [114] сообщили, что беталаин, выделенный из кожуры свеклы, имеет более высокую концентрацию бетацианина по сравнению с бетаксантином. Это объясняет основную функцию бетацианина в контексте интеллектуальных решений для упаковки пищевых продуктов.
Включение бетацианина из отходов кожуры свеклы в биоразлагаемые пленки из сагового крахмала улучшает их использование в качестве интеллектуальной упаковки. Это нововведение улучшает товары на основе саго и использует недостаточно применяемую кожуру свеклы, а также способствует экологической устойчивости, минимизируя зависимость от синтетических пластиковых отходов [115].
Кожура свеклы может быть недорогим или бесплатным источником углерода в качестве субстрата для роста бактерий, продуцирующих бактериальную наноцеллюлозу. Используя такие субстраты для синтеза бактериальной наноцеллюлозы, можно снизить производственные затраты, тем самым обеспечивая ее доступность в значительных количествах для различных промышленных применений [116].
Кожура свеклы может служить экономически эффективными и устойчивыми источниками для извлечения красителей, используемых в окрашивании текстиля. Чтобы растительные отходы считались источником натуральных красителей, они должны быть обильными, поддающимися селективному сбору и способными давать значительное количество красителей или пигментов. Интеграция зеленой химии в разработку устойчивых методов экстракции и окрашивания имеет важное значение, поскольку она улучшает текущие методы для смягчения воздействия их товаров и процессов на окружающую среду. При определенных условиях экстрагированные красители и пигменты могут придавать яркие цвета и отличные свойства устойчивости текстильным материалам из натуральных или синтетических волокон [117]. Шелковые ткани окрашивали пигментами свеклы, экстрагированными из ее кожуры с помощью ультразвуковой технологии, как с использованием протрав, так и без них. Экологически безопасные протравы, такие как лимонная кислота, винная кислота, уксусная кислота и дубильная кислота, использовались в процессе крашения [26].
Кислая среда вызывает депротонирование беталаина и активацию шерсти, но сильные неорганические кислоты не усиливают красную окраску. Функционализация аминогруппами посредством аминирования приводит к более светлым красным оттенкам, указывая на то, что группы NH₂ оказывают минимальное влияние на процесс крашения шерсти. Функционализация уксусной кислотой — единственный подход, который значительно усиливает красную окраску шерсти. Уровень pH влияет как на содержание беталаина, так и на цветовые свойства окрашенной шерсти [118].
Беталаины были экстрагированы из свекольного жома путем оптимизации нескольких параметров, и полученный пигмент использовался для окрашивания хлопковых, шерстяных и шелковых тканей. Максимальные значения интенсивности окраски (K/S) окрашенной ткани составили 7,5 для обработанного хлопка, 11,03 для шерсти и 15,6 для шелкового волокна. Все образцы прошли оценку устойчивости окраски к стирке, поту и свету [119].
Натуральные красители в последнее время привлекли внимание в косметическом секторе (составление цветной косметики, включая губную помаду) из-за растущей осведомленности современных потребителей об опасности синтетических химикатов в косметике. Натуральные красители могут использоваться в средствах личной гигиены благодаря их терапевтическим свойствам, включая антиоксидантную, солнцезащитную, нецитотоксическую, антивозрастную активность и активность против тирозиназы. Были разработаны составы для окрашивания волос на основе натуральных экстрактов для окрашивания седых волос. Натуральные красители были включены в косметику для очищения кожи из-за их антибактериальных и противовоспалительных свойств. Благодаря своим мощным антиоксидантным и антивозрастным свойствам, а также способности поглощать УФ-излучение, натуральные красители эффективны в уменьшении пигментации и старения кожи. Косметика для осветления кожи может быть разработана с использованием антитирозиназных эффектов натуральных красителей [120].
В исследовании Šoštarić et al. [38] изучалась сорбционная эффективность свекольного жома по отношению к ионам свинца в водных растворах. Свекольный жом продемонстрировал исключительные сорбционные способности, и экспериментальные данные, полученные в процессе адсорбции, хорошо согласовывались с изотермическими моделями Редлиха-Петерсона, Сипса и Лэнгмюра, что свидетельствует о монослойной сорбции. Наибольшая сорбционная способность по модели Сипса составляет 79,8 мг/г для свекольного жома. Емкость катионного обмена свекольного жома составляет 95,85 мэкв/100 г, что объясняется преобладанием ионов калия в обменных участках. Исследование механизмов сорбции показало, что механизм ионного обмена вносит значительный вклад в процесс сорбции.
Кроме того, пигмент свеклы (капсулы, богатые беталаином) привлек интерес исследователей спортивного питания, тренеров и спортсменов из-за его значительных антиоксидантных свойств и его потенциала улучшать физическую работоспособность [121,122]. Следовательно, исследователи оценили влияние добавок, богатых беталаином, на бегунов-соревнователей [123], триатлонистов [121] и велосипедистов [122]. Все исследователи сообщили об улучшении физической работоспособности, более быстром восстановлении после тренировки и снижении маркеров окислительного стресса и воспаления. Эти результаты подчеркивают потенциал пигментов свеклы в качестве натуральной диетической добавки для улучшения спортивных результатов. Забегая вперед, можно сказать, что существуют многообещающие исследовательские возможности для изучения беталаинов, полученных из свеклы, в спортивном питании.
Khan и Giridhar [123] утверждали, что беталаины полностью безопасны для потребления и могут служить пищевыми добавками. Rahimi et al. [53] и da Silva et al. [124] указали, что бетанин является единственным одобренным FDA молекулой для использования в качестве натуральной добавки в пищевых продуктах, косметике и фармацевтических продуктах. Для оптимальной биологической эффективности и пигментного потенциала рекомендуемая максимальная суточная доза беталаина не должна превышать 100 мг бетанина и 50 мг индикаксантина в их изолированных формах [125]. Следовательно, беталаины, полученные из свеклы, демонстрируют значительный потенциал для применения в качестве натуральных красителей и функциональных компонентов при разработке инновационных пищевых продуктов.
В исследовании del Amo-Mateos et al. [126] стремились повысить ценность отбракованной красной свеклы путем извлечения пектина из жома и получения сока, богатого биоактивными веществами, включая натуральные красители, антиоксиданты и фенолы. Пектин экстрагировали с использованием экологически чистой микроволновой экстракции с полиэтиленгликолем (ПЭГ4000) в качестве растворителя. В условиях высокой температуры (160 °C, 5,3 мин, 8,4 г ПЭГ4000/л) процесс позволил получить 271,2 г пектоолигосахаридов на килограмм сухого жома. Экстракция галактуроновой кислоты была оптимизирована в умеренных условиях (137 °C, 5 мин, 2,5 г ПЭГ4000/л), что дало 120,1 г GalA/кг сухого жома. Извлеченный пектин классифицируется как высокометоксилированный пектин со степенью этерификации, превышающей 50%. Это демонстрирует, что отбракованная красная свекла может быть преобразована в высокоценные биопродукты в рамках биорефинерии. Целлюлаза использовалась для извлечения пектина из побочных продуктов свеклы [127].
5. Различные методы экстракции биоактивных веществ из побочных продуктов свеклы
Процесс экстракции и достижение максимально возможного выхода биоактивных веществ обычно включают сложные и многоступенчатые процессы. Выбор растворителя имеет решающее значение для извлечения органических молекул из растительных тканей, включая беталаины, полифенолы и другие биоактивные соединения. Необходимо учитывать несколько факторов, таких как растворимость целевых соединений, полярность растворителя, взаимодействие между растворителем, целевыми соединениями и матрицей отходов, а также токсичность, стоимость и доступность растворителей [128].
Обзор процедур экстракции для повышения ценности побочных продуктов свеклы представлен в Таблице 2.
5.1. Традиционные методы
Традиционные технологии относятся к давно установленным методам, используемым в промышленности на протяжении десятилетий и широко считающимся безопасными и надежными. На растворение и стабильность соединений значительно влияют такие факторы, как выбор растворителя, уровень pH, температура и наличие дополнительных химических компонентов. Экстракция растворителем с использованием мацерации, кипячения или высокого гидростатического давления представляет собой преобладающие традиционные методы, используемые при экстракции пигмента свеклы. Они предоставляют преимущество гибкости в выборе растворителя для воздействия на конкретные вещества. Это экономически выгодно и масштабируемо для промышленного применения. Тем не менее, его недостатки включают значительное использование растворителя, что может повысить экологические проблемы и проблемы безопасности, часто требует длительного времени экстракции и может привести к ухудшению качества термочувствительных веществ [129].
Цвета свеклы можно экстрагировать с использованием воды; однако использование этанола или метанола (20–50%), пропан-2-ола [130] или включение лимонной кислоты/аскорбиновой кислоты [131] обычно использовалось для улучшения экстракции пигмента. Пигменты могут быть получены из цельной свеклы [132], очищенной свеклы [130] или побочных продуктов свеклы, таких как кожура [113] и жом [133]. Концентрация беталаина 68–81 мг/г сухого вещества была достигнута с помощью экстракции с соотношением твердого вещества к жидкости 1 г:5 мл с использованием 70% этанола [39]. Оптимальная экстракция беталаинов, составляющая 55 мг/л, была достигнута из свекольного жома с использованием воды в соотношении 0,5 г/10 мл, при температуре 50 °C в течение 3 минут и при pH 5,0 [119].
В своем исследовании Kushwaha et al. [133] провели оптимизацию экологически устойчивого подхода для экстракции беталаинов из свекольного жома. Для достижения этого оптимума необходимо изменить множество экспериментальных факторов, включая соотношение твердого вещества к жидкости, время, температуру и pH. Результаты показали, что выход бетацианина колебался от 1,75 до 62 мг/л, в то время как выход бетаксантина колебался от 1,79 до 61,62 мг/л.
Центральный композиционный план (CCD) использовался для улучшения экстракции беталаинов и общих полифенолов из свеклы, и было исследовано влияние параметров экстракции на этапы экстракции. Для каждого из исследованных и использованных параметров была рекомендована квадратичная модель. Содержание беталаина варьировалось от 0,29 до 1,44 мг/г сухого вещества в соответствии с планом эксперимента, в то время как выход полифенолов колебался от 1,64 до 2,74 мг/г сухого вещества. Оптимальными условиями для максимального извлечения беталаинов и фенолов были концентрация лимонной кислоты 1,5%, этанола 50%, температура 52,5 °C и время экстракции 49,9 мин [134].
Seremet et al. [135] оценили три различных традиционных метода экстракции (настаивание, отваривание и мацерацию) для экстракции пигментов беталаина из порошка кожуры свеклы. Процесс настаивания проводился при 80 °C в течение 30 мин, отваривание при 100 °C в течение 20 мин, а мацерация при комнатной температуре в течение 48 ч. Среди этих методов настаивание дало самую высокую концентрацию беталаина (18,21 мг/г сухого вещества), за ним следовали отваривание (12,65 мг/г сухого вещества) и мацерация (4,84 мг/г сухого вещества). Путем максимизации ряда переменных, таких как масса свеклы, pH, температура и время, был использован экологически чистый метод для извлечения беталаинов и фитохимических веществ из отходов свеклы (свекольного жома) [119].
Sturzoiu et al. [131] указали, что вода с 0,2% лимонной кислоты и 0,1% аскорбиновой кислоты, или 20% этанол и 0,5% аскорбиновой кислоты, экстрагировали большее количество бетанина из сушеной свеклы при 25 °C в течение 3 мин, используя соотношение образца к растворителю 1:5. Слабые кислоты облегчали экстракцию пигментов, одновременно стабилизируя их как в процессе экстракции, так и при хранении. Беталаины экстрагировали из порошка свекольного жома с использованием методологии поверхности отклика [133].
Оптимальными условиями для экстракции пигментов беталаина были определены pH 2,5, соотношение образца к растворителю 1:15, температура 50 °C и время экстракции 10 мин. Halwani et al. [132] сообщили, что концентрации беталаина были выше в водных экстрактах по сравнению с 2% раствором лимонной кислоты, при экстракции проводимой при соотношении образца к растворителю 1:3 и смешивании в течение 1 мин. Таким образом, различные параметры экстракции, включая природу сырья, значительно влияют на конечный выход экстракции и концентрацию пигмента. Основные недостатки традиционных методов включают длительное время экстракции, повышенные требования к объему растворителя, термическое разложение пигментов и низкую эффективность экстракции [129]. Следовательно, эти проблемы побудили ученых и инженеров разрабатывать новые методологии, называемые перспективными подходами, направленными на повышение эффективности экстракции при сохранении стабильной концентрации пигмента.
Таблица 2. Обзор процессов экстракции для побочных продуктов свеклы.
5.2. Современные методы экстракции
Новые методы были внедрены в результате ограничений традиционных процедур. Процесс экстракции является ключевым этапом в повышении ценности растительных источников; различные методы экстракции, параметры процесса и растворители могут влиять на конечное фитохимическое содержание и биоактивный потенциал полученных экстрактов. В настоящее время существует множество новых и развивающихся методов, используемых в процессе экстракции. Основные цели зеленой экстракции, основанные на экологически устойчивых принципах, заключаются в выявлении и разработке методов экстракции, которые минимизируют потребление энергии, способствуют использованию альтернативных растворителей и возобновляемых природных ресурсов и гарантируют безопасный, высококачественный экстракт или продукт [145].
Наиболее эффективные и перспективные новые технологии для экстракции пигмента свеклы включают ультразвуковую экстракцию [139], микроволновую экстракцию [146], экстракцию с помощью импульсных электрических полей [6], экстракцию сверхкритическим флюидом [28] и обработку высоким давлением [147]. Эти методы считаются безопасными и экологически устойчивыми технологиями из-за их сниженной зависимости от опасных химикатов, более короткого времени обработки, изначально безопасной конструкции, высокой энергоэффективности, минимального использования катализаторов и производных, а также более низких скоростей деградации активных соединений [129].
5.3. Ультразвуковая экстракция (UAE)
Процедура UAE включает две основные концепции: (1) диффузию растворителя в клеточную стенку и (2) выщелачивание клеточного содержимого [129]. Когда ультразвуковые волны проходят через жидкую среду, они генерируют микропузырьки, которые впоследствии расширяются и violently схлопываются; это явление называется кавитацией. Кавитация вблизи твердой поверхности материала генерирует микроструи и ударные волны. Это усиливает тепло- и массоперенос, ускоряя проникновение растворителя в клеточные компоненты свеклы. Это дает несколько преимуществ, включая сокращение времени экстракции, энергоэффективность, меньшее использование растворителя и повышенный выход биоактивных веществ. Однако его недостатки включают потенциальное разрушение чувствительных соединений из-за локальных высоких температур и давлений, возникающих во время кавитации [139].
Беталаины и полифенолы хранятся в вакуолях растительных клеток. Применение ультразвука вызывает акустическую кавитацию, которая способствует разрушению клеточных стенок. Это приводит к более высокому выходу экстракции, чем традиционные методы мацерации, позволяя высвобождать фенольные соединения и беталаины в экстракционный растворитель. Более того, UAE использует умеренную температуру, что выгодно для извлечения термочувствительных веществ [148].
В своем исследовании Vulic et al. [60] использовали раствор воды и этанола (1:1), подкисленный уксусной кислотой (0,5%), для экстракции беталаинов из кожуры и жома свеклы. Процесс экстракции был дополнительно оптимизирован с использованием UAE (50–60 Гц, 22 °C, 125 Вт, в течение 30 мин). Три основных беталаина были идентифицированы в отходах кожуры свеклы: бетанин (3,8–7,5 мг/г), изобетанин (1,2–3,1 мг/г) и вульгаксантин (1,4–4,3 мг/г). Кроме того, экстракт из свекольного жома продемонстрировал значительную концентрацию бетанина, количественно определенную как 37,22 мг на 100 г в пересчете на сухую массу. Maran & Priya [139] исследовали UAE для максимизации выхода из стеблей отходов свеклы, оптимизируя параметры процесса для повышения эффективности экстракции с дистиллированной водой в качестве растворителя. Наибольший выход был достигнут 1,28 ± 0,02 и 5,31 ± 0,09 мг/г для бетацианина, а для бетаксантина наблюдались при соотношении образца к растворителю 1:19 г/мл, мощности ультразвука 89 Вт, температуре 53 °C и продолжительности 35 мин.
UAE с использованием комбинаций этанол/вода показала себя более эффективной для извлечения как беталаинов, так и полифенолов из сушеной свекольной мякоти, полученной от соковой промышленности [137]. Эффективность метода ультразвуковой обработки для экстракции пигментов из стеблей отходов свеклы была изучена с использованием множественного регрессионного анализа для исследования индивидуальных и интерактивных эффектов ключевых параметров, включая интенсивность мощности, соотношение твердого вещества к растворителю и продолжительность озвучивания. Оптимальные настройки дали максимальные концентрации бетацианина и бетаксантина 3 мг/г и 4,36 мг/г соответственно, при интенсивности мощности 79,801 Вт/см², соотношении твердого вещества к растворителю 22,4 г/мл и продолжительности озвучивания 26,7 мин. Все использованные переменные процесса продемонстрировали существенное влияние (p < 0,05) на выход беталаинов из стеблей отходов свеклы [141].
5.4. Микроволновая экстракция (MAE)
MAE — это технология, которая использует микроволны, генерируемые электромагнитным полем, для экстракции растворимых веществ из пищевых продуктов или растительных материалов. Частота электромагнитного излучения в микроволновом диапазоне охватывает от 0,3 до 300 ГГц, при этом электрическое и магнитное поля ориентированы перпендикулярно друг другу [129]. Микроволновый нагрев включает преобразование электромагнитной энергии в тепловую посредством механизмов ионной проводимости и дипольного вращения [148]. Микроволновая энергия проникает в водную составляющую растительной матрицы, вызывая внутренний нагрев, который разрушает растительную клетку и высвобождает ее содержимое в растворитель [149]. Кроме того, микроволновое излучение усиливает проникновение растворителя в пищевую матрицу, тем самым увеличивая выщелачивание биоактивных веществ. Основные преимущества MAE — сокращение времени экстракции, минимизация температурного градиента, повышенная безопасность и увеличенный выход экстракции. Тем не менее, ее недостатки включают возможное ухудшение качества термочувствительных компонентов, если температура не тщательно контролируется. Метод требует специализированного оборудования и может не подходить для всех типов материалов, особенно для тех, которые имеют низкую микроволновую поглощающую способность [150].
Больше всего бетацианинов было экстрагировано при мощности 400 Вт со 100% рабочим циклом в течение 90–120 с, в то время как экстракция бетаксантина была улучшена за 150 с, согласно исследованию. Добавление аскорбиновой кислоты увеличило эффективность экстракции. Двухэтапный микроволновый метод между фазами охлаждения использует аскорбиновую кислоту в качестве второго растворителя. MAE дала в два раза больше беталаина, чем экстракция при 80 °C. Этот двухэтапный микроволновый метод восстанавливает на 50% больше пигментов свеклы. Наивысший выход бетанина (52%), тогда как выход бетаксантина (140–150 с) составляет 400 Вт и 100% рабочий цикл в течение 1,5–2,0 мин. Аскорбиновая кислота предотвращает деградацию пигмента [146]. Экстракция беталаинов из кожуры свеклы проводилась с помощью MAE при уровнях мощности 100–800 Вт в течение 30–150 с с использованием четырех различных растворителей. Наивысшая концентрация общих беталаинов, измеренная как 202,08 ± 2,23 мг/100 г, была получена с использованием чистой воды в качестве растворителя после 150 с микроволновой экстракции при 800 Вт [143].
Singh et al. [142] оптимизировали экстракцию бетанина из кожуры свеклы, используя условия микроволновой экстракции. Сообщалось, что тип растворителя влияет на конечный выход экстракции бетанина, при этом добавление этанола продемонстрировало большую экстракцию бетанина. Оптимальными условиями для максимального выхода экстракции являются pH 4,74, мощность микроволн 384,25 МВт и продолжительность 57,06 с, что приводит к выходу 472,11 мг/л бетанина.
На эффективность микроволновой экстракции влияют размеры сырья, природа растворителя (полярный или летучий), а также мощность и продолжительность процесса MAE.
5.5. Экстракция сверхкритическим флюидом (SFE)
SFE — это метод экстракции веществ из натуральных продуктов, при котором CO2 является преобладающим растворителем, признанным GRAS (общепризнанно безопасным) US-FDA [151]. Низкая вязкость и относительно высокая диффузионная способность сверхкритических растворителей обеспечивают отличные транспортные свойства, способствуя быстрому извлечению по сравнению с традиционными подходами. SFE предоставляет многочисленные преимущества, включая экстракцию высокочистых биоактивных веществ без использования вредных растворителей, что делает ее экологически устойчивым и безопасным методом. Она функционирует при относительно низких температурах, сохраняя целостность термолабильных веществ, и облегчает селективную экстракцию путем модуляции давления и температуры. Тем не менее, SFE имеет существенные недостатки, включая значительные первоначальные затраты на установку и текущие расходы, требование специализированного оборудования и трудности с масштабированием для промышленного производства [129]. При сверхкритической экстракции растворитель подвергается воздействию повышенных температуры и давления, превышающих его критическую точку. Это приводит к повышению сольватирующей способности растворителя и увеличению его диффузионной способности. Высокое давление прикладывается к растворителю во время экстракции под давлением, что сокращает время экстракции и использует меньше растворителя. Для экстракции и стабилизации красных и фиолетовых беталаинов из отходов свеклы (кожуры и мякоти), образующихся в соковой промышленности, использовались глубокие эвтектические растворители (DES), состоящие из гексагидрата хлорида магния и мочевины, в разных соотношениях [29].
5.6. Импульсные электрические поля (PEF)
Метод экстракции с помощью импульсного электрического поля (PEF) использует нетепловой механизм для пермеабилизации клеток. Этот метод прикладывает кратковременные импульсы электрического поля высокой интенсивности (0,1–50 кВ/см) к растительному материалу, помещенному между двумя электродами, обычно в условиях окружающей температуры [6]. Когда трансмембранный потенциал превышает свой порог, электростатическое отталкивание между заряженными молекулами усиливается, что приводит к повышенной проницаемости клеточной мембраны. Следовательно, PEF улучшает эффективность экстракции пигмента за счет модификации структуры клеточной мембраны посредством массопереноса, одновременно уменьшая продолжительность экстракции [129].
Воздействие продолжительности импульсного электрического поля (PEF), измеряемой в миллисекундах (10–60) и микросекундах (30–150), на экстракцию бетанина из свеклы было исследовано [152]. Результаты показали, что более высокие выходы экстракции были достигнуты при продолжительности PEF 40 мс и 150 мкс с напряженностью поля 0,6 кВ/см и 6 кВ/см соответственно. Обработка PEF в микросекундном диапазоне показала значительно более низкую удельную потребность в энергии 28,8 кДж/кг по сравнению с обработкой в миллисекундном диапазоне, которая имела удельную потребность в энергии 43,2 кДж/кг.
Недавно Nowacka et al. [6] изучили влияние различных параметров на эффективность PEF-ассистированной экстракции беталаина из свеклы. Исследование продемонстрировало, что приложение напряженности электрического поля 4,38 кВ/см с 20 импульсами (10 мкс вкл. и 2 с выкл.) значительно усилило экстракцию беталаина. Различия в оптимизированных условиях в разных исследованиях могут быть связаны с различиями в критериях выбора напряженности электрического поля, продолжительности импульса и времени воздействия.
Эффективность обработки PEF определяется параметрами экстракции, такими как интенсивность электрического поля, подводимая энергия, количество импульсов и специфические свойства растительного материала [128]. Напряжение 1 кВ/см повышает эффективность просачивания беталаинов из красной свеклы, требуя энергопотребления 7 кДж/кг. Этот подход эффективно сохраняет сенсорные и питательные качества экстрагируемого вещества. Различные характеристики влияют на эффективность экстракции, такие как форма образца, количество импульсов, интенсивность электрического поля и электрическая проводимость образца. Он энергоэффективен и позволяет быстро обрабатывать, что делает его подходящим для чувствительных продуктов, таких как функциональные продукты питания. Основным недостатком этой процедуры являются коррозионные свойства электрода, который может выщелачиваться в экстрагированные пигменты и приводить к загрязнению, высокие первоначальные затраты на оборудование и ограниченная масштабируемость для крупномасштабных промышленных применений [26].
5.7. Экстракция сжиженным растворителем под давлением (PLE)
PLE использует растворители под высоким давлением и температурой, оставаясь ниже критической точки, чтобы удерживать растворитель в жидком состоянии, с целью эффективного и экономичного извлечения соединений из твердых или полутвердых матриц с минимальным использованием растворителя [153]. Это дает такие преимущества, как высокая эффективность экстракции биоактивных веществ, достаточно быстрый и экологичный процесс, а также снижение зависимости от опасных химикатов. Недостатки включают возможное ухудшение термолабильных веществ из-за повышенных температур, необходимость в специализированном и дорогом оборудовании, а также требование тщательного контроля рабочих параметров для предотвращения непостоянных результатов. Минимальное количество растворителей, вовлеченных в быстрые процессы, позволяет классифицировать PLE как «зеленый метод». Применение PLE со смесями вода-этанол в качестве растворителей предоставляет возможность сократить или искоренить использование опасных растворителей и повысить пропускную способность образцов за счет уменьшения времени экстракции. PLE служит альтернативой традиционным методам, таким как экстракция Сокслетом и мацерация, поскольку она производит значительные количества и превосходное качество экстракта [154].
Arias et al. [155] разработали комплексное моделирование, получив десять различных сценариев, используя как листья, так и остатки стеблей в качестве исходных данных процесса, наряду с пятью различными методами экстракции, которые включают традиционные методы, Сокслет и мацерацию, а также новые технологии, включая ультразвуковую экстракцию (UAE), экстракцию сверхкритическим флюидом (SFE) и экстракцию сжиженным растворителем под давлением (PLE). Оценки воздействия на окружающую среду показывают, что технологии SFE и PLE оказывают наименьшее воздействие на окружающую среду, тогда как UAE имеет наиболее неблагоприятный профиль из-за повышенного энергопотребления. Электроэнергия может рассматриваться как основной фокус с наибольшим влиянием, за которым следуют потребности в паре и использование экстракционного растворителя. Оценки чувствительности были проведены для улучшения экологического профиля, с фокусом на использование возобновляемых ресурсов для производства энергии и выбор экстракционных растворителей. Несмотря на заметные достижения в производстве энергии и пара за счет гидроэнергетики и сжигания отходов, экологический профиль остался неизменным при оценке использования смесей этанол-вода или гексана для экстракции. Последующие исследования должны сосредоточиться на минимизации использования энергии и уточнении дозы растворителя для экстракции [155].
5.8. Ферментативная экстракция (EAE)
EAE привлекает повышенный интерес из-за своей эффективности при экстракции в относительно мягких условиях (низкая температура и короткая продолжительность), являясь экологически чистым методом, достигая при этом высокого выхода биоактивных веществ, поскольку она способствует извлечению связанных веществ [156]. Ферменты, включая целлюлазу, гемицеллюлазу, пектиназу и лигниназу, используются для разложения компонентов клеточной стенки. Эти ферменты используются в сочетании для оптимизации извлечения пигмента. Ферментативную экстракцию можно проводить посредством ферментативного гидролиза и экстракции или путем включения растворителя перед ферментативным гидролизом. Основные факторы, критические для экстракции, включают концентрацию фермента, оптимальный pH, температуру для оптимальной активности фермента и продолжительность гидролиза. Ферментативная экстракция имеет недостатки, включая ее нерентабельность, необходимость точной оптимизации условий экстракции и трудности, связанные с промышленным масштабированием. Для пищевого сектора беталаины можно экстрагировать из мякоти красной свеклы с использованием воды, кислой/спиртовой среды (такой как лимонная кислота, аскорбиновая кислота или смесь этилового спирта и лимонной кислоты, или HCl) или процедур, облегчаемых ферментами или микроорганизмами [5,157].
5.9. Другие методы
Был разработан инновационный интегрированный метод для одновременной экстракции и разделения беталаинов и хлорофиллов из отходов красной свеклы (стеблей и листьев) с использованием термообратимых водных двухфазных систем (ABS), состоящих из ионных жидкостей (IL) на основе четвертичного аммония и полипропиленгликоля. Для оптимизации параметров экстракции (температура, время и соотношение твердого вещества к жидкости) для выхода пигментов был реализован центральный композиционный план. Соотношение твердого вещества к жидкости составляло 0,12, а максимальные выходы экстракции составили 6,67% (мас./мас.) для беталаинов и 1,82% (мас./мас.) для хлорофиллов при 20 °C. Процесс экстракции продолжался 70 мин [144]. Другой метод улучшает пигмент путем применения гамма-облучения к процессу экстракции. Обработка гамма-облучением повышает эффективность экстракции главным образом за счет пермеабилизации клеточной стенки посредством модификаций внутренней структуры ткани и снижения тургорного давления [158]. Каждый метод экстракции демонстрирует различные уровни стабильности в зависимости от условий обработки, включая температуру, продолжительность и воздействие кислорода. Современные методы, такие как SFE, PEF и UAE, обеспечивают улучшенную стабильность биоактивных веществ свеклы, что делает их подходящими для сохранения чувствительных компонентов, включая беталаины и полифенолы. Оптимизация процесса необходима для каждого подхода для повышения производительности при сохранении целостности биоактивных веществ [129].
5.10. Возможности стабилизации беталаинов
Беталаины легко разрушаются в растворе; следовательно, для их производства рекомендуется сушка. Методы сушки для получения порошка беталаина включают сушку в печи, вальцовую сушку, микроволновую сушку, распылительную сушку, сублимационную сушку и вакуумную сушку. Производство порошка беталаина путем сушки имеет множество проблем, в основном из-за его термочувствительной природы, что приводит к ограниченному выходу беталаина. Кроме того, сушка может влиять на цвет, форму, структуру, пищевую ценность и состав других компонентов в беталаине. Оптимальные условия сушки и микрокапсулирование с использованием вещества-носителя необходимы для достижения превосходной стабильности беталаина и максимального выхода [159].
Инкапсуляция является наиболее перспективным методом стабилизации беталаинов, повышающим их устойчивость к факторам окружающей среды, таким как тепло, pH, свет и кислород. Инкапсуляция значительно уменьшает деградацию беталаина, позволяя продуктам сохранять свои функциональные и эстетические свойства в течение длительного времени. Такие матрицы, как мальтодекстрин, гуммиарабик, инулин и смеси белок-полисахарид, обеспечивают различные степени защиты, причем комбинации часто дают наилучшие результаты. Инкапсуляция не только защищает беталаины, но и увеличивает их распределение и всасывание в биологических системах, улучшая их воздействие на здоровье. Инкапсулированные беталаины демонстрируют повышенную стабильность и применение в функциональных продуктах питания, косметике, лекарствах и упаковке пищевых продуктов [160].
В исследовании Mkhari et al. [161] экстракты из отходов свеклы, которые были инкапсулированы либо с гуммиарабиком, либо с мальтодекстрином, продемонстрировали превосходный цвет, растворимость, эффективность инкапсуляции и содержание беталаина [161]. Смеси гуммиарабика и мальтодекстрина дали порошки с более высоким общим содержанием фенолов и маслоудерживающей способностью. И наоборот, порошки не показали каких-либо существенных различий (p > 0,05) с точки зрения выхода порошка, общего содержания растворимых веществ, титруемой кислотности, насыпной плотности и активности по удалению радикалов DPPH. Сублимационная сушка с одним только гуммиарабиком или мальтодекстрином давала стабильные, более мелкие и более однородные частицы, в то время как смеси демонстрировали повышенную агрегацию частиц. Измеренные метаболиты, такие как галловая кислота, (+)-катехин и мирицетин, были заметно повышены в экстрактах отходов свеклы, полученных из гуммиарабика или мальтодекстрина по отдельности, что указывает на то, что порошки могут быть использованы для обогащения других продуктов питания и разработки функциональных продуктов питания с определенными преимуществами для здоровья или в качестве натуральных пищевых красителей.
В другом исследовании Tekin et al. [162] было определено, что процесс ионного гелеобразования, используемый для инкапсуляции беталаинов красной свеклы, подходит для этой цели. Оптимальные параметры инкапсуляции были определены как содержание сока красной свеклы 14,81%, концентрация альгината натрия 1,7% и время погружения 5 мин, определенные с использованием методов поверхности отклика. По истечении 6-недельного срока хранения в капсулах наблюдалась потеря 19,59% бетацианина и 21,40% бетаксантина [162].
Saponjac et al. [163] продемонстрировали, что сублимационная сушка и инкапсуляция с соевым белком, примененные к свекольному жому (Beta vulgaris L., сорт 'Bicor'), достигли эффективности инкапсуляции 86,14%, хотя стабильность снизилась на 24% после трех месяцев хранения при 25 °C, что предполагает потенциальное применение в фармацевтической промышленности и в качестве пищевых добавок. Гуаровая камедь (GG), акациевая камедь (AG) и трагакантовая камедь (TG) были оценены как инкапсулирующие агенты в исследовании Kaur & Ghoshal [164], при этом GG показала лучшие результаты в стабилизации беталаина и эффективности инкапсуляции (в диапазоне от 84,79% до 94,56%, в зависимости от использованного гидроколлоида). Инкапсуляция обеспечила значительную защиту беталаинов, экстрагированных из жома Beta vulgaris L. Порошки показали благоприятные физико-химические свойства, включая растворимость в воде, низкую гигроскопичность и подходящую насыпную плотность, что делает их идеальными для промышленного применения.
Мальтодекстрин является наиболее часто используемым веществом-носителем. Дополнительные вещества, которые могут быть использованы, включают гуммиарабик, инулин, белок, крахмал и другие. Каждое вещество-носитель обладает определенными преимуществами и недостатками, значительно влияя на свойства порошка. Комбинации веществ-носителей в определенных количествах могут быть использованы для достижения желаемых свойств порошка. Оптимальный порошок беталаина был получен с использованием метода сублимационной сушки. Этот процесс дорог и требует длительного периода сушки [165]. Инкапсуляция с такими агентами, как мальтодекстрин и гуммиарабик, повышает стабильность беталаинов во время сушки и хранения, защищая пигменты от разрушения под воздействием окружающей среды. Обработанные порошки беталаина подходят для использования в качестве натуральных красителей в пищевых продуктах, а также в нутрицевтиках и упаковке для пищевых продуктов, обеспечивая увеличенный срок годности и функциональную универсальность [166].
6. Потенциальная польза для здоровья от побочных продуктов свеклы
Лекарственный потенциал свеклы и ее побочных продуктов против различных заболеваний приписывается биоактивным веществам, которые вызывают определенные физиологические эффекты в организме человека. Биоактивные соединения имеют значительное значение для здоровья человека, о чем свидетельствует оценка химических, биологических и фармакологических свойств свеклы и ее побочных продуктов, таких как кожура и жом [77].
6.1. Антиоксидантная активность
Антиоксиданты — это вещества или процессы, которые замедляют естественный процесс окисления, предотвращают генерацию или ограничивают распространение вредных молекул, называемых свободными радикалами, различными способами и нейтрализуют свободные радикалы до того, как они смогут повредить клетки. Сильная донорная способность электронов бетанина отвечает за его антиоксидантный потенциал. Кроме беталаинов, красная свекла содержит другие мощные антиоксидантные компоненты, такие как рутин, эпикатехин и кофейная кислота. Однако беталаины являются основными вкладчиками в ее антиоксидантные свойства [58]. Vasconcellos et al. [80] сообщили об общем антиоксидантном потенциале свекольного сока (80,5%), свекольного порошка (95,3%), свекольных чипсов (95,7%) и вареной свеклы (85,8%).
Экстракты свеклы, по-видимому, сохраняли эндогенную антиоксидантную активность (восстановленный глутатион, ферменты глутатионпероксидаза и каталаза) на нормальных клеточных уровнях после окислительного стресса у крыс, предварительно обработанных свекольным жомом. Это побудило ученых выдвинуть гипотезу, что в ответ на клеточную атаку in vivo свекла может демонстрировать непрямые антиоксидантные свойства, которые усиливают механизмы антиоксидантной защиты [60]. В исследовании Coimbra et al. [167] мука из кожуры свеклы продемонстрировала значительную антиоксидантную активность in vitro с убедительным доказательством ее воздействия на активные формы кислорода.
6.2. Антигипертензивная и кардиопротекторная активность
Роль оксида азота (NO) в поддержании эндотелиальной функции подчеркивается Hobbs et al. [168]. Напротив, использование красной свеклы в качестве источника нитратов для лечения высокого кровяного давления хорошо документировано. Красная свекла при преобразовании в нитрит может улучшить эндотелиальную функцию за счет повышения уровня NO, циклического гуанозинмонофосфата (cGMP) и расширения кровеносных сосудов [168].
Исследование, проведенное Mumford et al. [122], показало, что у 28 велосипедистов-мужчин, использовавших добавку, содержащую 100 мг/сут беталаинов в течение семи дней, наблюдалось улучшение кровотока в плечевой артерии. Однако изменений в их показателях крови, а именно уровнях NO, не наблюдалось. Кроме того, исследование, проведенное на 24 мужчинах с ишемической болезнью сердца, показало, что прием капсул красной свеклы, содержащих 25 мг беталаинов, привел к увеличению уровня сиртуина-1 и снижению уровня окисленных липопротеинов низкой плотности и высокочувствительного С-реактивного белка [169].
Кроме того, экстракт красной свеклы эффективно защищает от повреждений, вызванных ишемией-реперфузией в ткани сердца, за счет увеличения концентрации эндогенного сероводорода (H2S) [170]. Тем не менее, требуются дополнительные тесты для определения конкретных клеточных и молекулярных путей.
6.3. Противораковая активность
Значительные антиоксидантные и противораковые способности беталаинов, полученных из свекольного жома, были продемонстрированы, что привело к заметным пролиферативным эффектам в клеточных линиях человека — MCF7 и MRC-5 [171]. Когда капсулы с экстрактом красной свеклы давали людям с остеоартритом в течение десяти дней, уровни воспалительных цитокинов, таких как фактор некроза опухоли-альфа (TNF-α), интерлейкин-6 (IL-6) и продуктов окисления белков (AOPP), снизились [172]. Введение бетанина приводило к апоптозу и усиливало расщепление каспазы 3 и рибозополимеразы в клеточных линиях рака легкого человека [173]. Кроме того, концентрация бетанина 200 мкг/мл, как сообщается, подавляет рост клеток гепатомы G2 (HepG2), согласно Lee et al. [174] в 2014 году. Добавление экстракта красной свеклы к доксорубицину (0,29–290 мкг/мл) привело к синергетическому цитотоксическому воздействию на клетки рака поджелудочной железы (PaCa), молочной железы (MCF-7) и предстательной железы (PC-3) [175]. В исследовании Coimbra et al. [167] клеточные анализы показали, что водный экстракт муки из кожуры свеклы значительно повлиял на тройной негативные клетки рака молочной железы (MDA-MB-231), снижая их жизнеспособность дозо- и времязависимым образом.
Кроме того, было показано, что присутствие бетанина в красной свекле ингибирует повреждение ДНК в лимфоцитах и гепатоцитах [176]. Кроме того, когда энтероциты человека обрабатывали концентрацией 15 мкмоль/л бетанина, это значительно уменьшало повреждение ДНК, вызванное H2O2 [177].
Беталаины, полученные из кожуры свеклы, были тщательно изучены на предмет их противораковых свойств [178]. Синергетические взаимодействия между беталаинами и определенными противораковыми агентами, приводящие к повышенной цитотоксической эффективности, требуют дальнейшего изучения в комплексных исследованиях in vitro и in vivo.
6.4. Противоожирение
Беннин, полученный из отходов свеклы, был идентифицирован как перспективный альтернативный подход для профилактики рака и различных других заболеваний, включая болезнь Альцгеймера, диабет и ожирение [179]. В своем исследовании Gao et al. [180] изучили влияние потребления бетанина на широкую популяцию и выявили четкую связь между потреблением бетаина и улучшением состава тела. Кроме того, беталаины защищали липопротеины низкой плотности (LDL) от окислительного повреждения путем взаимодействия с полярным компонентом LDL [181].
Исследование, проведенное Rabeh & Ibrahim [182], показало, что кормление крыс с гиперхолестеринемией экстрактом, содержащим отходы мякоти красной свеклы (в дозах 200, 400 и 600 мг/кг), в течение 30 дней привело к снижению уровня холестерина и триглицеридов.
Кроме того, исследование, проведенное на крысах с высоким уровнем холестерина, показало, что введение экстракта красной свеклы (в дозах 250–500 мг/кг) привело к снижению накопления липидов. Этот эффект сопровождался значительным увеличением уровня липопротеинов высокой плотности (HDL) и усилением антиоксидантной активности [183]. Данные свидетельствуют, что введение этанолового экстракта свеклы, полученного из стеблей и листьев, мышам на диете с высоким содержанием жиров в течение 8 недель эффективно снижает окислительный стресс, уровень глюкозы в крови и холестерин в печени. Результаты были приписаны наличию флавоноидов в экстракте, согласно Lorizola et al. [184].
Кроме того, исследования показали, что наличие клетчатки в красной свекле может снизить уровень холестерина у крыс с высоким содержанием холестерина, которых кормили диетой, содержащей 0,3% холестерина. Кроме того, исследование, проведенное на крысах, показало, что потребление клетчатки и целлюлозы, обнаруженных в красной свекле, привело к снижению частоты возникновения опухолей рака толстой кишки, индуцированных диметилгидразином [185].
6.5. Противодиабетический эффект
Гипергликемия вызывает фиброз сердца, запуская выработку сшитых коллагеновых связей во внеклеточном матриксе. Это вызвано цитокинами, включая профибротический фактор трансформирующий фактор роста (TGF)-β1 и фактор роста соединительной ткани (CTGF). Было задокументировано, что бетанин борется с кардиогенным фиброзом, вызванным гипергликемией. Введение бетанина диабетическим крысам в дозах 25 и 100 мг/кг/сут в течение 60 дней привело к снижению гликирования белков, гликированных продуктов и уровней NF-κB [186,187].
В этом исследовании оценивалась ингибирующая активность in vitro экстракта кожуры свеклы в отношении четырех протестированных ферментов, а именно α-глюкозидазы, α-амилазы, липазы и липоксигеназы. Протестированный экстракт оказал ингибирующее действие на α-амилазу со значением IC50 4,22 ± 0,40 мкг/мл экстракта. Оптимизированный экстракт кожуры свеклы показал ингибирующие эффекты в отношении активности анализируемых ферментов с процентом ингибирования 53,93 ± 0,27% для α-амилазы, 66,79 ± 0,14% для α-глюкозидазы, 93,10 ± 0,52% для панкреатической липазы и 45,17 ± 0,33% для активности липоксигеназы в зависимости от концентрации. Результаты предполагают, что экстракт, полученный из кожуры свеклы, имеет потенциал для эффективного содействия контролю постпрандиальной гликемии, а также клеточного окислительного стресса, связанного с диабетом, а также заболеваний, связанных с гиперлипидемией [109].
Исследование, проведенное Kabir et al. [188], показало, что введение водного экстракта B. vulgaris в дозах 50 и 200 мг/кг в течение 8 недель привело к антигипергликемическим эффектам у мышей с диабетом 2 типа. Эти эффекты наблюдались через увеличение уровня инсулина, усиленную утилизацию глюкозы в скелетных миоцитах и улучшенное поглощение глюкозы, облегчаемое транспортерами глюкозы 4 типа (GLUT4). Водно-метанольный экстракт листьев B. vulgaris (в дозах 50, 100 или 200 мг/кг массы тела), вводимый в течение 28 дней, продемонстрировал антидиабетические эффекты. Он эффективно снижал уровень глюкозы в сыворотке, липидный профиль, аланинаминотрансферазу, аспартатаминотрансферазу, TNF-α, IL-1β, IL-6 и малоновый диальдегид в печени у диабетических крыс. Кроме того, он увеличивал уровень триацетилолеандомицина и глутатиона в печени [189].
6.6. Противовоспалительный эффект
Беталаины и экстракты свеклы были идентифицированы как мощные противовоспалительные агенты. По-видимому, они взаимодействуют с провоспалительными сигнальными путями, чтобы частично опосредовать свои противовоспалительные эффекты [190]. Противовоспалительные и антиоксидантные характеристики свеклы вызвали интерес к ее потенциальному использованию при заболеваниях, характеризующихся дисфункциональной активностью иммунных клеток. Экстракты бетацианина продемонстрировали химиопрофилактические преимущества в исследованиях на животных, включая клетки рака кожи, легких и печени, а в последнее время — на клетках рака кожи, молочной железы, поджелудочной железы и предстательной железы человека [176,191]. Хроническое воспаление связано с возникновением злокачественных опухолей, и исследования показывают, что экстракты беталаина, полученные из свеклы, могут смягчать эти эффекты [192].
Крысы, получавшие в течение 28 дней этаноловый экстракт красной свеклы, защищали от нефротоксичности гентамицина и показали снижение активности TNF-α, IL-6 и NF-κB [190]. Согласно Pietrzkowski et al. [172], капсулы с беталаином использовались в течение десяти дней для снижения провоспалительных факторов, воспаления, TNF-α, цитокинов и IL-6 у людей с остеоартритом. Это привело к уменьшению боли. Было обнаружено, что беталаины функционируют как специфические ингибиторы циклооксигеназы-2 (COX-2), согласно Vidal et al. [193]. В частности, было обнаружено, что бетанин демонстрирует ингибирующие эффекты в отношении COX1 и COX2 в лабораторных исследованиях и взаимодействует с остатками серина и тирозина, расположенными в активной области фермента COX. Беталаины продемонстрировали способность препятствовать ферменту липоксигеназе и молекуле межклеточной адгезии-1 (ICAM-1) в лабораторных условиях. ICAM-1 вырабатывается в ответ на стимуляцию цитокинами [194]. Бетанин является основным компонентом беталаинов, в значительной степени ответственным за противовоспалительные свойства красной свеклы. Требуется больше исследований для дальнейшего понимания терапевтического потенциала беталаинов в лечении воспаления, особенно в долгосрочных клинических исследованиях.
6.7. Антимикробный эффект
Антибактериальные свойства свекольного жома привели к его использованию в различных функциональных добавках и пищевых продуктах [133]. Kumar & Brooks [195] задокументировали антибактериальную эффективность экстракта свеклы и использовали эти особенности для разработки инновационных продуктов из красной свеклы с добавленной стоимостью.
В антибактериальных анализах экстракты свеклы продемонстрировали большую эффективность против Staphylococcus aureus и Bacillus cereus по сравнению с Escherichia coli и Pseudomonas aeruginosa [196]. Khosasi et al. [197] указывают, что экстракт кожуры красной свеклы проявляет антибактериальную активность в отношении S. mutans.
6.8. Другие преимущества для здоровья
Побочные продукты свеклы богаты биоактивными веществами, такими как кемпферолы, кверцетины, кофейная кислота, хлорогеновая кислота и каротиноиды, и проявляют значительную способность поглощать радикалы, подавляют микробную порчу продуктов и улучшают здоровье глаз, желудка и печени.
Добавки свеклы могут эффективно усиливать собственную антиоксидантную защиту, тем самым защищая биомолекулы от окислительного стресса. Tesoriere et al. [181] указывают, что многочисленные исследования in vitro показали, что пигменты беталаины, в частности, защищают биологические компоненты от окислительного повреждения. Свекла содержит множество биологически активных фенольных соединений, таких как кофейная кислота, эпикатехин и рутин, все из которых служат эффективными антиоксидантами. Аналогично, было показано, что нитрит и другие источники NO, включая красную свеклу, могут эффективно поглощать потенциально вредные активные формы кислорода и азота, включая перекись водорода, и предотвращать генерацию радикалов, что свидетельствует о том, что нитрат может обладать антиоксидантными эффектами [198,199]. Исследователи обнаружили, что бетанин, самый распространенный беталаин в свекле (300–600 мг·кг⁻¹), был наиболее эффективным ингибитором перекисного окисления липидов. Мощное антиоксидантное действие бетанина объясняется его замечательной способностью отдавать электроны и его способностью нейтрализовать высокореактивные радикалы, угрожающие клеточным мембранам [200].
Abdo et al. [201] исследовали влияние печенья, обогащенного свекольным жомом, на анемию у крыс, продемонстрировав потенциальную эффективность экстракта свекольного жома в лечении анемии и управлении окислительным стрессом. Увеличение количества свекольного жома привело к увеличению содержания белков, клетчатки, кальция, фосфора и железа. Потребление печенья, содержащего 15% свекольного жома, которое получило наивысшую сенсорную оценку, продемонстрировало антианемический эффект у крыс через 14 дней, при этом минимальное повреждение почек и печени у анемичных групп восстанавливалось через 28 дней.
Нитрат из свеклы преобразуется в нитрит, который затем может быть восстановлен с образованием NO. NO регулирует несколько эндотелиальных функций, и снижение биодоступности NO с возрастом было признано основным фактором, способствующим эндотелиальной дисфункции [202]. Эндотелиальная дисфункция признана значительным потенциальным фактором, способствующим нескольким сердечно-сосудистым заболеваниям, и, следовательно, связана с прогрессированием атеросклероза и гипертонии. Аналогично, свекла, богатая нитратами, также содержит биоактивные компоненты (т.е. кофейную кислоту, беталаины), которые способствуют профилактике и лечению сердечно-сосудистых заболеваний [203,204]. Источник NO, такой как свекла, может улучшить мозговой кровоток и устранить нарушения когнитивных функций [205]. Gilchrist et al. [206] сообщают, что пожилые люди (67 лет) с диабетом 2 типа, которые потребляли 250 мл свекольного сока (нитрат: 7,5 ммоль) в течение 2 недель, продемонстрировали значительное улучшение времени простой реакции по сравнению с контрольной группой людей.
7. Проблемы и будущие перспективы
Включение побочных продуктов свеклы (листьев, кожуры и жома) в пищу человека сталкивается с несколькими проблемами.
Ожидается, что будущие исследования будут сосредоточены на исправлении недостаточных знаний о сырье (химический состав), внедрении эффективных и действенных методов предварительной обработки (экстракция и применение) и достижении всестороннего понимания биодоступности (механизм действия) изолированных ингредиентов в пищевых и фармацевтических продуктах. Более того, требуется дополнительная работа для балансировки сенсорного качества продуктов с целью повышения потребительской приемлемости продуктов, модифицированных побочными продуктами (Рисунок 5). Производители, внедряющие натуральные свекольные пигменты, должны инвестировать в исследования и разработки, обеспечивать соответствие глобальным стандартам и решать проблемы стабильности, чтобы сделать эти продукты жизнеспособными и привлекательными для потребителей.
Рисунок 5. Проблемы и будущие перспективы повышения ценности побочных продуктов свеклы.
Для повышения стабильности этих побочных продуктов при хранении рекомендуется механическое прессование в качестве метода обезвоживания, а свежеотжатый жом следует использовать в течение нескольких дней для предотвращения деградации. Повышенная влажность побочных продуктов может быть использована в сочетании с другими сухими сельскохозяйственными побочными продуктами, такими как шелуха и солома, для выравнивания содержания воды, одновременно смягчая высокие затраты, связанные с обезвоживанием [207].
Технологии зеленой экстракции привлекают повышенное внимание из-за экологического давления и цели устойчивого использования природных ресурсов. Кинетика экстракции может быть улучшена с помощью передовых методов, включая экстракцию сверхкритическим CO2 и субкритическую водную экстракцию, в сочетании с ультразвуковой и микроволновой поддержкой. Необходимы дополнительные усилия научных исследователей для разработки эффективных и экономичных технологий экстракции [178].
Проведено минимальное количество исследований для изучения биодоступности полезных компонентов в экстракте/порошке. Это приводит к значительному пробелу в исследованиях, касающихся основных механизмов и синергетических эффектов полезных компонентов, полученных из побочных продуктов свеклы, в практических применениях. Моделируемые модели, эксперименты на животных и исследования in vivo могут дать всестороннее представление о взаимосвязи между перевариваемостью и биодоступностью белков, полифенолов и других биоактивных соединений, а также об их влиянии на здоровье человека.
Биологические активности, включая антиоксидантную способность, и физические особенности, такие как желирующий эффект, экстрактов могут быть одновременно улучшены с помощью совместной экстракции [208].
Последующие исследования должны уделять первоочередное внимание сенсорной оценке. Дополнительная дозировка экстрактов или порошков, полученных из побочных продуктов, напрямую влияет на одобрение потребителями конечных продуктов. Оценка безопасности съедобных продуктов, полученных из побочных продуктов, является дополнительной трудностью, требующей внимания. Существование вредных бактерий представляет риск для здоровья потребителей. Поэтому необходима идентификация для конкретного случая [48].
Требуются дальнейшие исследования для разработки всестороннего понимания состава, биодоступности и срока годности компонентов, полученных из побочных продуктов свеклы, и связанных с ними нутрицевтических и фармацевтических продуктов.
8. Выводы
Это исследование предлагает всесторонний обзор различных данных для демонстрации нутрицевтического потенциала побочных продуктов свеклы и их использования в пищевых продуктах.
Свекла и ее метаболиты являются исключительным источником биологически активных соединений, которые предлагают существенные технологические, оздоровительные и питательные преимущества. К ним относятся беталаины, фенольные соединения (флавоноиды и фенольные кислоты) и неорганический нитрат, которые очень важны для пищевого бизнеса из-за их промышленных и функциональных свойств, таких как красители, консерванты и антиоксиданты. Свекольный жом служит натуральным и экономичным источником красителей, ароматизаторов, пищевых волокон, белка, антиоксидантов и антимикробных средств, которые могут использоваться в качестве натуральных пищевых добавок в пищевой промышленности. Этот метод помогает перерабатывающим предприятиям снизить расходы на обработку и потенциально получить дополнительную прибыль от материалов, ранее считавшихся отходами, одновременно повышая их производительность.
Экстракт свеклы использовался в качестве пищевого красителя и полезного пищевого компонента в нескольких кулинарных продуктах. Проблемы, связанные с развивающимися технологиями экстракции пигмента свеклы, должны быть решены. Будущие тенденции могут сделать акцент на гибридизации традиционных и новых технологий для упрощенной и эффективной экстракции беталаинов.
Включение побочных продуктов свеклы в рецептуру продуктов питания приводит к включению остатков пищевого производства, тем самым повышая их ценность, дополняя конечные товары и смягчая проблему пищевых отходов. Содействие циркулярной экономике согласуется с рекомендациями Продовольственной и сельскохозяйственной организации (FAO) в Цели устойчивого развития 12, которая относится к Целям устойчивого развития. Этот подход также играет роль в достижении цели 2030 года по смягчению потерь продовольствия в производственных цепочках.
Несмотря на многообещающий характер новых методов экстракции, которые превосходят традиционные методы, ожидается, что эти инновации столкнутся с несколькими проблемами в достижении промышленной масштабируемости, включая (i) конфигурацию процесса масштабирования, (ii) технические препятствия, (iii) дизайн процесса и (iv) влияние электрических полей или радиации на активные соединения.
Необходимо учитывать факторы, влияющие на стабильность пигмента свеклы и эффективность его экстракции при использовании любой из этих методологий. Кроме того, будущие достижения в экстракции пигмента свеклы должны быть сосредоточены на интеграции традиционных методов с инновационными подходами для оптимизации концентрации и стабильности пигмента. Потенциальное применение растворителей для зеленой экстракции, таких как ионные жидкости и глубокие эвтектические растворители, может быть исследовано для эффективной экстракции беталаинов из свеклы и ее побочных продуктов. Это предполагает, что побочные продукты свеклы могут быть использованы в качестве потенциального источника функциональных пищевых компонентов, натуральных антиоксидантов и антибактериальных агентов и далее переработаны в терапевтические функциональные пищевые продукты, вместо того чтобы быть выброшенными как отходы.
Ссылки
1. United Nations Development Programme Sustainable Development Goals. 2022. Available online: https://www.undp.org/sustainable-development-goals (accessed on 29 November 2024).
2. Ganesh, K.S.; Sridhar, A.; Vishali, S. Utilization of Fruit and Vegetable Waste to Produce Value-Added Products: Conventional Utilization and Emerging Opportunities—A Review. Chemosphere 2022, 287, 132221. [Google Scholar] [CrossRef] [PubMed]
3. Ninfali, P.; Angelino, D. Nutritional and functional potential of Beta vulgaris cicla and rubra. Fitoterapia 2013, 89, 88–199. [Google Scholar] [CrossRef] [PubMed]
4. Gokhale, S.V.; Lele, S.S. Betalain Content and Antioxidant Activity of Beta vulgaris: Effect of Hot Air Convective Drying and Storage: Drying Effect on Betalain and Antioxidants in Beet. J. Food Process. Preserv. 2014, 38, 585–590. [Google Scholar] [CrossRef]
5. Chhikara, N.; Kushwaha, K.; Sharma, P.; Gat, Y.; Panghal, A. Bioactive Compounds of Beetroot and Utilization in Food Processing Industry: A Critical Review. Food Chem. 2019, 272, 192–200. [Google Scholar] [CrossRef]
6. Nowacka, M.; Tappi, S.; Wiktor, A.; Rybak, K.; Miszczykowska, A.; Czyzewski, J.; Tylewicz, U. The Impact of Pulsed Electric Field on the Extraction of Bioactive Compounds from Beetroot. Foods 2019, 8, 244. [Google Scholar] [CrossRef]
7. Abu-Ellail, F.F.B.; Salem, K.F.M.; Saleh, M.M.; Alnaddaf, L.M.; Al-Khayri, J.M. Molecular Breeding Strategies of Beetroot (Beta vulgaris ssp. vulgaris var. conditiva Alefeld). In Advances in Plant Breeding Strategies: Vegetable Crops; Al-Khayri, J.M., Jain, S.M., Johnson, D.V., Eds.; Springer: Cham, Switzerland, 2021. [Google Scholar] [CrossRef]
8. Yashwant, K. Beetroot: A Super Food. Int. J. Eng. Stud. Tech. Approach 2015, 1, 20–26. [Google Scholar]
9. Kezi, J.; Sumathy, J.H. Betalain a Boon to the Food Industry. Discovery 2014, 20, 51–58. [Google Scholar]
10. Carreón-Hidalgo, J.P.; Franco-Vásquez, D.C.; Gómez-Linton, D.R.; Pérez-Flores, L.J. Betalain plant sources, biosynthesis, extraction, stability enhancement methods, bioactivity, and applications. Food Res. Int. 2022, 151, 110821. [Google Scholar] [CrossRef]
11. FAOSTAT. 2022. Available online: https://www.fao.org/faostat/en/#data/qcl (accessed on 2 February 2024).
12. Global Biodiversity Information Facility (GBIF). Available online: https://www.gbif.org/species/2874515 (accessed on 10 August 2024).
13. Knez, E.; Kadac-Czapska, K.; Dmochowska-Ślęzak, K.; Grembecka, M. Root Vegetables-Composition, Health Effects, and Contaminants. Int. J. Environ. Res. Public Health 2022, 19, 15531. [Google Scholar] [CrossRef]
14. Thiruvengadam, M.; Chung, I.-M.; Samynathan, R.; Chandar, S.R.H.; Venkidasamy, B.; Sarkar, T.; Rebezov, M.; Gorelik, O.; Shariati, M.A.; Simal-Gandara, J. A Comprehensive Review of Beetroot (Beta vulgaris L.) Bioactive Components in the Food and Pharmaceutical Industries. Crit. Rev. Food Sci. Nutr. 2024, 64, 708–739. [Google Scholar] [CrossRef]
15. dos S. Baião, D.; da Silva, D.V.T.; Paschoalin, V.M.F. Beetroot, A Remarkable Vegetable: Its Nitrate and Phytochemical Contents Can be Adjusted in Novel Formulations to Benefit Health and Support Cardiovascular Disease Therapies. Antioxidants 2020, 9, 960. [Google Scholar] [CrossRef]
16. Sentkowska, A.; Pyrzyńska, K. Old-Fashioned, but Still a Superfood—Red Beets as a Rich Source of Bioactive Compounds. Appl. Sci. 2023, 13, 7445. [Google Scholar] [CrossRef]
17. Slavov, A.; Karagyozov, V.; Denev, P.; Kratchanova, M.; Kratchanov, C. Antioxidant Activity of Red Beet Juices Obtained after Microwave and Thermal Pretreatments. Czech J. Food Sci. 2013, 31, 139–147. [Google Scholar] [CrossRef]
18. Yadav, D.N.; Sharma, M.; Chikara, N.; Anand, T.; Bansal, S. Quality Characteristics of Vegetable-Blended Wheat—Pearl Millet Composite Pasta. Agric. Res. 2014, 3, 263–270. [Google Scholar] [CrossRef]
19. Panghal, A.; Yadav, D.N.; Khatkar, B.S.; Sharma, H.; Kumar, V.; Chhikara, N. Post-Harvest Malpractices in Fresh Fruits and Vegetables: Food Safety and Health Issues in India. Nutr. Food Sci. 2018, 48, 561–578. [Google Scholar] [CrossRef]
20. Kazimierczak, R.; Hallmann, E.; Lipowski, J.; Drela, N.; Kowalik, A.; Pussa, T.; Rembialkowska, E. Beetroot (Beta vulgaris L.) and Naturally Fermented Beetroot Juice from Organic and Conventional Production: Metabolomics, Anti-Oxidant Levels and Anti-Cancer Activity. J. Sci. Food Agric. 2014, 94, 2618–2629. [Google Scholar] [CrossRef] [PubMed]
21. Sruthi, P.D.; Anoohya, P.N.; Vasu, A.T.; Latha, B.S.; Chavali, M. Portrayal of Red Pigments Extracted from Red Beet (Beta vulgaris, L.) and Its Potential Uses as Antioxidant and Natural Food Colourants. VFSTR J. STEM 2014, 2, 24–32. [Google Scholar]
22. Szekely, D.; Illes, B.; Steger-Mate, M.; Monspart-Senyi, J. Effect of Drying Methods for Inner Parameters of Red Beetroot (Beta vulgaris L). Alimentaria 2016, 9, 60–68. [Google Scholar] [CrossRef]
23. Raikos, V.; McDonagh, A.; Ranawana, V.; Duthie, G. Processed Beetroot (Beta vulgaris L.) as a Natural Antioxidant in Mayonnaise: Effects on Physical Stability, Texture and Sensory Attributes. Food Sci. Hum. Wellness 2016, 5, 191–198. [Google Scholar] [CrossRef]
24. Marmion, D.M. (Ed.) Handbook of US Colorants: Foods, Drugs, Cosmetics, and Medicinal Devices; Wiley-Interscience: New York, NY, USA, 1991. [Google Scholar]
25. Cai, Y.Z.; Corke, H. Production and Properties of Spray Dried Amaranthus Betacyanin Pigments. J. Food Sci. 2000, 65, 1248–1252. [Google Scholar] [CrossRef]
26. Sooch, B.S.; Sandhu, N.; Mann, M.K.; Ray, R.C. Valorization of Beetroot Waste for Extraction of Natural Dye for Textile and Food Applications. In Roots, Tubers, and Bulb Crop Wastes: Management by Biorefinery Approaches; Springer Nature: Singapore, 2024; pp. 237–260. [Google Scholar]
27. Ferreira, M.S.; Santos, M.C.; Moro, T.M.; Basto, G.J.; Andrade, R.M.; Gonçalves, É.C. Formulation and characterization of Functional Foods Based on Fruit and Vegetable Residue Flour. J. Food Sci. Technol. 2015, 52, 822–830. [Google Scholar] [CrossRef] [PubMed]
28. Battistella Lasta, H.F.; Lentz, L.; Gonçalves Rodrigues, L.G.; Mezzomo, N.; Vitali, L.; Salvador Ferreira, S.R. Pressurized Liquid Extraction Applied for the Recovery of Phenolic Compounds from Beetroot Waste. Biocatal. Agric. Biotechnol. 2019, 21, 101353. [Google Scholar] [CrossRef]
29. Hernández-Aguirre, O.A.; Muro, C.; Hernández-Acosta, E.; Alvarado, Y.; Díaz-Nava, M.D.C. Extraction and Stabilization of Betalains from Beetroot (Beta vulgaris) Wastes Using Deep Eutectic Solvents. Molecules 2021, 26, 6342. [Google Scholar] [CrossRef] [PubMed]
30. Ben Haj Koubaier, H.; Snoussi, A.; Essaidi, I.; Chaabouni, M.M.; Thonart, P.; Bouzouita, N. Betalain and Phenolic Compositions, Antioxidant Activity of Tunisian Red Beet (Beta vulgaris L. Conditiva) Roots and Stems Extracts. Int. J. Food Prop. 2014, 17, 1934–1945. [Google Scholar] [CrossRef]
31. Igual, M.; Moreau, F.; García-Segovia, P.; Martínez-Monzó, J. Valorization of Beetroot By-Products for Producing Value-Added Third Generation Snacks. Foods 2023, 12, 176. [Google Scholar] [CrossRef]
32. Biondo, P.B.F.; Boeing, J.S.; Barizão, É.O.; de Souza, N.E.; Matsushita, M.; de Oliveira, C.C.; Boroski, M.; Visentainer, J.V. Evaluation of Beetroot (Beta vulgaris L.) Leaves during Its Developmental Stages: A Chemical Composition Study. Food Sci. Technol. 2014, 34, 94–101. [Google Scholar] [CrossRef]
33. Vilas-Franquesa, A.; Montemurro, M.; Casertano, M.; Fogliano, V. The food by-products bioprocess wheel: A guidance tool for the food industry. Trends Food Sci. Technol. 2024, 152, 104652. [Google Scholar] [CrossRef]
34. Narnoliya, L.K.; Jadaun, J.S.; Singh, S.P. Management of Agro-Industrial Wastes with the Aid of Synthetic Biology. In Biosynthetic Technology and Environmental Challenges; Springer: Singapore, 2018; pp. 11–28. [Google Scholar]
35. Tivelli, S.W.; Factor, T.L.; Teramoto, J.R.S.; Fabri, E.G.; De Moraes, A.R.A.; Trani, P.E.; Beterraba, A.M. May. Beterraba: Do Plantio À Comercialização; (Série Tecnologia APTA. Boletim Técnico IAC, 210); Instituto Agronômico: Campinas, Brasil, 2011; 45p, ISSN 1809-7936. [Google Scholar]
36. Afzaal, M.; Saeed, F.; Ahmed, A.; Khalid, M.A.; Islam, F.; Ikram, A.; Hussain, M.; Fareed, F.; Anjum, W. Red Beet Pomace as a Source of Nutraceuticals. In Food and Agricultural Byproducts as Important Source of Valuable Nutraceuticals; Springer International Publishing: Cham, Switzerland, 2022; pp. 39–55. [Google Scholar]
37. Theba, T.; Ravani, A.; Bhatt, H. Utilization of Beetroot Pomace for Food Fortification. Int. J. Chem. Stud. 2021, 9, 2653–2657. [Google Scholar] [CrossRef]
38. Šoštarić, T.; Simić, M.; Lopičić, Z.; Zlatanovic, S.; Pastor, F.; Antanaskovic, A.; Gorjanovic, S. Food Waste (Beetroot and Apple Pomace) as Sorbent for Lead from Aqueous Solutions—Alternative to Landfill Disposal. Processes 2023, 11, 1343. [Google Scholar] [CrossRef]
39. Costa, A.P.D.; Hermes, V.S.; de Rios, A.O.; Flôres, S.H. Minimally Processed Beetroot Waste as an Alternative Source to Obtain Functional Ingredients. J. Food Sci. Technol. 2017, 54, 2050–2058. [Google Scholar] [CrossRef]
40. Sahni, P.; Shere, D.M. Physico-Chemical and Sensory Characteristics of Beet Root Pomace Powder Incorporated Fibre Rich Cookies. Int. J. Food Ferment. Technol. 2016, 6, 309–315. [Google Scholar] [CrossRef]
41. Fissore, E.N.; Ponce, N.M.A.; Matkovic, L.; Stortz, C.A.; Rojas, A.M.; Gerschenson, L.N. Isolation of Pectin-Enriched Products from Red Beet (Beta vulgaris L. Var. Conditiva) Wastes: Composition and Functional Properties. Food Sci. Technol. Int. 2011, 17, 517–527. [Google Scholar] [CrossRef] [PubMed]
42. Hotchkiss, A.T., Jr.; Chau, H.K.; Strahan, G.D.; Nuñez, A.; Simon, S.; White, A.K.; Dieng, S.; Heuberger, E.R.; Yadav, M.P.; Hirsch, J. Structural Characterization of Red Beet Fiber and Pectin. Food Hydrocoll. 2022, 129, 107549. [Google Scholar] [CrossRef]
43. El-Beltagi, H.S.; El-Mogy, M.M.; Parmar, A.; Mansour, A.T.; Shalaby, T.A.; Ali, M.R. Phytochemical Characterization and Utilization of Dried Red Beetroot (Beta vulgaris) Peel Extract in Maintaining the Quality of Nile Tilapia Fish Fillet. Antioxidants 2022, 11, 906. [Google Scholar] [CrossRef] [PubMed]
44. Shuaibu, B.S.; Aremu, M.O.; Kalifa, U.J. Chemical Composition and Antioxidant Activities of Beetroot Peel. Afr. J. Eng. Environ. Res. 2021, 2, 62–73. [Google Scholar]
45. Shakir, B.K.; Simone, V. Estimation of Betalain Content in Beetroot Peel Powder. Ital. J. Food Sci. 2024, 36, 53–57. [Google Scholar] [CrossRef]
46. Tamayo Tenorio, A. Sugar Beet Leaves for Functional Ingredients. In Food Process Engineering; Wageningen University: Wageningen, The Netherlands, 2017. [Google Scholar]
47. Akyüz, A.; Ersus, S. Optimization of Enzyme Assisted Extraction of Protein from the Sugar Beet (Beta vulgaris L.) Leaves for Alternative Plant Protein Concentrate Production. Food Chem. 2021, 335, 127673. [Google Scholar] [CrossRef] [PubMed]
48. Socas-Rodríguez, B.; Álvarez-Rivera, G.; Valdés, A.; Ibáñez, E.; Cifuentes, A. Food By-Products and Food Wastes: Are They Safe Enough for Their Valorization? Trends Food Sci. Technol. 2021, 114, 133–147. [Google Scholar] [CrossRef]
49. Sulakhiya, K.; Patel, V.K.; Saxena, R.; Dashore, J.; Srivastava, A.K.; Rathore, M. Effect of Beta vulgaris Linn. Leaves Extract on Anxiety- and Depressive-like Behavior and Oxidative Stress in Mice after Acute Restraint Stress. Pharmacogn. Res. 2016, 8, 1–7. [Google Scholar] [CrossRef]
50. Bloot, A.P.M.; Kalschne, D.L.; Amaral, J.A.S.; Baraldi, I.J.; Canan, C. A Review of Phytic Acid Sources, Obtention, and Applications. Food Rev. Int. 2023, 39, 73–92. [Google Scholar] [CrossRef]
51. PubChem. Available online: https://pubchem.ncbi.nlm.nih.gov/ (accessed on 20 September 2024).
52. Miraj, S. Chemistry and Pharmacological Effect of Beta vulgaris: A Systematic Review. Der Pharm. Lett. 2016, 8, 404–409. [Google Scholar]
53. Rahimi, P.; Abedimanesh, S.; Mesbah-Namin, S.A.; Ostadrahimi, A. Betalains, the Nature-Inspired Pigments, in Health and Diseases. Crit. Rev. Food Sci. Nutr. 2019, 59, 2949–2978. [Google Scholar] [CrossRef] [PubMed]
54. Nemzer, B.; Pietrzkowski, Z.; Spórna, A.; Stalica, P.; Thresher, W.; Michałowski, T.; Wybraniec, S. Betalainic and Nutritional Profiles of Pigment-Enriched Red Beet Root (Beta vulgaris L.) Dried Extracts. Food Chem. 2011, 127, 42–53. [Google Scholar] [CrossRef]
55. Singh, J.P.; Kaur, A.; Shevkani, K.; Singh, N. Composition, bioactive compounds and antioxidant activity of common Indian fruits and vegetables. J. Food Sci. Technol. 2016, 53, 4056–4066. [Google Scholar] [CrossRef]
56. Kathiravan, T.; Nadanasabapathi, S.; Kumar, R. Standardization of Process Condition in Batch Thermal Pasteurization and Its Effect on Antioxidant, Pigment and Microbial Inactivation of Ready to Drink (RTD) Beetroot (Beta vulgaris L.) Juice. Int. Food Res. J. 2014, 21, 1305–1312. [Google Scholar]
57. Maraie, N.K.; Abdul-Jalil, T.Z.; Alhamdany, A.T.; Janabi, H.A. Phytochemical Study of the Iraqi Beta vulgaris Leaves and Its Clinical Application for the Treatment of Different Dermatological Diseases. World J. Pharm. Pharm. Sci. 2014, 3, 5–19. [Google Scholar]
58. Georgiev, V.G.; Weber, J.; Kneschke, E.-M.; Denev, P.N.; Bley, T.; Pavlov, A.I. Antioxidant Activity and Phenolic Content of Betalain Extracts from Intact Plants and Hairy Root Cultures of the Red Beetroot Beta vulgaris Cv. Detroit Dark Red. Plant Foods Hum. Nutr. 2010, 65, 105–111. [Google Scholar] [CrossRef]
59. Płatosz, N.; Sawicki, T.; Wiczkowski, W. Profile of Phenolic Acids and Flavonoids of Red Beet and Its Fermentation Products. Does Long-Term Consumption of Fermented Beetroot Juice Affect Phenolics Profile in Human Blood Plasma and Urine? Pol. J. Food Nutr. Sci. 2020, 70, 55–65. [Google Scholar] [CrossRef]
60. Vulic, J.J.; Ćebović, T.N.; Čanadanović-Brunet, J.M.; Ćetković, G.S.; Čanadanović, V.M.; Djilas, S.M.; Tumbas Šaponjac, V.T. In Vivo and in Vitro Antioxidant Effects of Beetroot Pomace Extracts. J. Funct. Foods 2014, 6, 168–175. [Google Scholar] [CrossRef]
61. Mikołajczyk-Bator, K.; Błaszczyk, A.; Czyżniejewski, M.; Kachlicki, P. Identification of Saponins from Sugar Beet (Beta vulgaris) by Low and High-Resolution HPLC-MS/MS. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 2016, 1029–1030, 36–47. [Google Scholar] [CrossRef]
62. Mroczek, A.; Kapusta, I.; Janda, B.; Janiszowska, W. Triterpene Saponin Content in the Roots of Red Beet (Beta vulgaris L.) Cultivars. J. Agric. Food Chem. 2012, 60, 12397–12402. [Google Scholar] [CrossRef] [PubMed]
63. Hatlestad, G.J.; Sunnadeniya, R.M.; Akhavan, N.A.; Gonzalez, A.; Goldman, I.L.; McGrath, J.M.; Lloyd, A.M. The Beet R Locus Encodes a New Cytochrome P450 Required for Red Betalain Production. Nat. Genet. 2012, 44, 816–820. [Google Scholar] [CrossRef] [PubMed]
64. Martins, I.R.; da Silva Martins, L.H.; Chisté, R.C.; Picone, C.S.F.; Joele, M.R.S.P. Betalains from vegetable peels: Extraction methods, stability, and applications as natural food colorants. Food Res. Int. 2024, 195, 114956. [Google Scholar] [CrossRef] [PubMed]
65. Domínguez, R.; Munekata, P.E.S.; Pateiro, M.; Maggiolino, A.; Bohrer, B.; Lorenzo, J.M. Red Beetroot. A Potential Source of Natural Additives for the Meat Industry. Appl. Sci. 2020, 10, 8340. [Google Scholar] [CrossRef]
66. Aykln-Dinçer, E.; Güngor, K.K.; Cąǧlar, E.; Erbas, M. The Use of Beetroot Extract and Extract Powder in Sausages as Natural Food Colorant. Int. J. Food Eng. 2021, 17, 75–82. [Google Scholar] [CrossRef]
67. Sahni, P.; Shere, D.M. Utilization of Fruit and Vegetable Pomace as Functional Ingredient in Bakery Products: A Review. Asian J. Dairy Food Res. 2018, 37, 202–211. [Google Scholar]
68. Elleuch, M.; Bedigian, D.; Roiseux, O.; Besbes, S.; Blecker, C.; Attia, H. Dietary Fibre and Fibre-Rich by-Products of Food Processing: Characterisation, Technological Functionality and Commercial Applications: A Review. Food Chem. 2011, 124, 411–421. [Google Scholar] [CrossRef]
69. Parveen, H.; Bajpai, A.; Bhatia, S.; Singh, S. Analysis of Biscuits Enriched with Fbre by Incorporating Carrot and Beetroot Pomace Powder. Indian J. Nutr. Diet. 2017, 54, 403–413. [Google Scholar] [CrossRef]
70. Nirmal, N.P.; Mereddy, R.; Maqsood, S. Recent Developments in Emerging Technologies for Beetroot Pigment Extraction and Its Food Applications. Food Chem. 2021, 356, 129611. [Google Scholar] [CrossRef]
71. Salah, H.; Rebecca, L.J.; Sharmila, S.; Das, P.; Seshiah, C. Extraction and Purification of Carotenoids from Vegetables. J. Chem. Pharm. Res. 2014, 6, 594–598. [Google Scholar]
72. Zein, H.; El-Moneim, A.; Hashish, S.; Ismaiel, G.H.H. The Antioxidant and Anticancer Activities of Swiss Chard and Red Beetroot Leaves. Curr. Sci. Int. 2015, 4, 491–498. [Google Scholar]
73. Adhikari, A.; Saha, A.; Indu, R.; Sur, T.K.; Das, A.K. Evaluation of Antiinflammatory Effect of Beetroot Extract in Animal Models. Int J Basic Clin Pharmacol 2017, 6, 2853–2858. [Google Scholar] [CrossRef]
74. Olumese, F.E.; Oboh, H.A. Aqueous Beetroot Juice Extract Improves Renal Function and Some Biochemical Parameters in Carbon Tetrachloride-Induced Toxicity in Sprague Dawley Rats. Ann. Trop. Pathol. 2020, 11, 171–175. [Google Scholar]
75. Odhav, B.; Beekrum, S.; Akula, U.; Baijnath, H. Preliminary Assessment of Nutritional Value of Traditional Leafy Vegetables in KwaZulu-Natal, South Africa. J. Food Compost. Anal. 2007, 20, 430–435. [Google Scholar] [CrossRef]
76. Ekholm, P.; Reinivuo, H.; Mattila, P.; Pakkala, H.; Koponen, J.; Happonen, A.; Hellström, J.; Ovaskainen, M.-L. Changes in the Mineral and Trace Element Contents of Cereals, Fruits and Vegetables in Finland. J. Food Compost. Anal. 2007, 20, 487–495. [Google Scholar] [CrossRef]
77. Clifford, T.; Howatson, G.; West, D.J.; Stevenson, E.J. The Potential Benefits of Red Beetroot Supplementation in Health and Disease. Nutrients 2015, 7, 2801–2822. [Google Scholar] [CrossRef]
78. Egbuna, C.; Mishra, A.P.; Goyal, M.R. Preparation of Phytopharmaceuticals for the Management of Disorders; Elsevier: Amsterdam, The Netherlands, 2021. [Google Scholar] [CrossRef]
79. Güçlü-Ustündağ, O.; Mazza, G. Saponins: Properties, Applications and Processing. Crit. Rev. Food Sci. Nutr. 2007, 47, 231–258. [Google Scholar] [CrossRef]
80. Vasconcellos, J.; Conte-Junior, C.; Silva, D.; Pierucci, A.P.; Paschoalin, V.; Alvares, T.S. Comparison of Total Antioxidant Potential, and Total Phenolic, Nitrate, Sugar, and Organic Acid Contents in Beetroot Juice, Chips, Powder, and Cooked Beetroot. Food Sci. Biotechnol. 2016, 25, 79–84. [Google Scholar] [CrossRef]
81. Rodríguez-Pérez, C.; Molina-Montes, E.; Verardo, V.; Artacho, R.; García-Villanova, B.; Guerra-Hernández, E.J.; Ruíz-López, M.D. Changes in Dietary Behaviours during the COVID-19 Outbreak Confinement in the Spanish COVIDiet Study. Nutrients 2020, 12, 1730. [Google Scholar] [CrossRef]
82. Lazăr (Mistrianu), S.; Constantin, O.E.; Horincar, G.; Andronoiu, D.G.; Stănciuc, N.; Muresan, C.; Râpeanu, G. Beetroot By-Product as a Functional Ingredient for Obtaining Value-Added Mayonnaise. Processes 2022, 10, 227. [Google Scholar] [CrossRef]
83. dos Baião, D.S.; d’El-Rei, J.; Alves, G.; Fritsch Neves, M.; Perrone, D.; Del Aguila, E.M.; Flosi Paschoalin, V.M. Chronic Effects of Nitrate Supplementation with a Newly Designed Beetroot Formulation on Biochemical and Hemodynamic Parameters of Individuals Presenting Risk Factors for Cardiovascular Diseases: A Pilot Study. J. Funct. Foods 2019, 58, 85–94. [Google Scholar] [CrossRef]
84. Hobbs, D.A.; George, T.W.; Lovegrove, J.A. Differential Effect of Beetroot Bread on Postprandial DBP According to Glu298Asp Polymorphism in the eNOS Gene: A Pilot Study. J. Hum. Hypertens. 2014, 28, 726–730. [Google Scholar] [CrossRef] [PubMed]
85. Ranawana, V.; Raikos, V.; Campbell, F.; Bestwick, C.; Nicol, P.; Milne, L.; Duthie, G. Breads Fortified with Freeze-Dried Vegetables: Quality and Nutritional Attributes. Part 1: Breads Containing Oil as an Ingredient. Foods 2016, 5, 19. [Google Scholar] [CrossRef] [PubMed]
86. Kohajdová, Z.; Karovičová, J.; Kuchtová, V.; Lauková, M. Utilisation of Beetroot Powder for Bakery Applications. Chem. Pap. 2018, 72, 1507–1515. [Google Scholar] [CrossRef]
87. Chauhan, S.; Rajput, H. Production of Gluten Free and High Fiber Cookies Using Beet Root Waste Powder and Wheat Flour Husk. J. Pharm. Innov. 2018, 7, 556. [Google Scholar]
88. Yadav, M.; Masih, D.; Sonkar, C. Development and Quality Evaluation of Beetroot Powder Incorporated Yogurt. Int. J. Sci. Eng. Technol. 2016, 4, 582–586. [Google Scholar]
89. Chaudhari, S.N.; Nikam, M.P. Development and Sensory Analysis of Beetroot Jelly. Int. J. Sci. Res. 2015, 4, 827–830. [Google Scholar]
90. Jovanović, M.; Zlatanović, S.; Micić, D.; Bacić, D.; Mitić-Ćulafić, D.; Đuriš, M.; Gorjanović, S. Functionality and Palatability of Yogurt Produced Using Beetroot Pomace Flour Granulated with Lactic Acid Bacteria. Foods 2021, 10, 1696. [Google Scholar] [CrossRef]
91. Petrović, M.S.; Veljović, N.; Tomić, S.; Zlatanović, T.; Tosti, P.; Vukosavljević, S. Formulation of Novel Liqueurs from Juice Industry Waste: Consumer Acceptance, Phenolic Profile and Preliminary Monitoring of Antioxidant Activity and Colour Changes During Storage. Food Technol. Biotechnol. 2021, 59, 282–294. [Google Scholar] [CrossRef]
92. Abdo, E.; El-Sohaimy, S.; Shaltout, O.; Abdalla, A.; Zeitoun, A. Nutritional Evaluation of Beetroots (Beta vulgaris L.) and Its Potential Application in a Functional Beverage. Plants 2020, 9, 1752. [Google Scholar] [CrossRef]
93. Evanuarini, H.; Susilo, A.; Amertaningtyas, D. Physico-Chemical Properties, Amino Acid and Fatty Acid Profile of Chicken Patties Added with Beetroot Peel Flour as Natural Colourant. J. Food Nutr. Res. 2023, 62, 170–176. [Google Scholar]
94. Duthie, G.; Campbell, F.; Bestwick, C.; Stephen, S.; Russell, W. Antioxidant Effectiveness of VegetablePowders on the Lipid and Protein Oxidative Stability of Cooked Turkey Meat Patties. Implic. Health 2013, 5, 1241–1252. [Google Scholar]
95. Jeong, H.J.; Lee, H.C.; Chin, K.B. Effect of Red Beet on Quality and Color Stability of Low-Fat Sausages Duringrefrigerated Storage. Korean J. Food Sci. Anim. Resour. 2010, 30, 1014–1023. [Google Scholar] [CrossRef]
96. Swastike, W.; Suryanto, E.; Rusman, R.; Hanim, C.; Jamhari, J.; Erwanto, Y.; Jumari, J. The Substitution Effects of Tapioca Starch and Beetroot Powder as Filler On The Physical and Sensory Characteristics Of Chicken Sausage. J. Ilmu Dan Teknol. Has. Ternak 2020, 15, 97–107. [Google Scholar] [CrossRef]
97. Yavuzer, E.; Özogul, F.; Özogul, Y. Impact of Icing with Potato, Sweet Potato, Sugar Beet, and Red Beet Peel Extract on the Sensory, Chemical, and Microbiological Changes of Rainbow Trout (Oncorhynchus mykiss) Fillets Stored at (3 ± 1 °C). Aquac. Int. 2020, 28, 187–197. [Google Scholar] [CrossRef]
98. Alshehry, G.A.; Taif University, Saudi Arabia. Utilization of Beetroot as A Natural Antioxidant, Pigment and Antimicrobial in Cupcake during the Storage Period. Int. J. Eng. Res. Technol. 2019, V8, 652–659. [Google Scholar] [CrossRef]
99. Amnah, M.A.A. Nutritional, Sensory and Biological Study of Biscuits Fortified with Red Beetroots. Life Sci. J. 2013, 10, 1579–1584. [Google Scholar]
100. Dhadage, K.B.; Shinde, G.S.; Gadhave, R.K. Developemnt of the Functional Food i.e. Beetroot Fortified Multigrain Snacks. Int. J. Sci. Res. 2015, 4, 469–473. [Google Scholar]
101. Fatma, S.; Sharma, N.; Singh, S.P.; Jha, A.; Kumar, A. Fuzzy Analysis of Sensory Data for Ranking of Beetroot Candy. ETP Int. J. Food Eng. 2016, 2, 26–30. [Google Scholar] [CrossRef][Green Version]
102. Kumar, V.; Kushwaha, R.; Goyal, A.; Tanwar, B.; Kaur, J. Process Optimization for the Preparation of Antioxidant Rich Ginger Candy Using Beetroot Pomace Extract. Food Chem. 2018, 245, 168–177. [Google Scholar] [CrossRef]
103. Mohamed, Z.E.M.; Ismaiel, G.H.H.; Rizk, A.E. Quality Characterizations of Pasta Fortified with Red Beetroot and Red Radish. Int. J. Food Sci. Biotechnol. 2016, 1, 1–7. [Google Scholar]
104. Ingle, M.; Ingle, M.P.; Thorat, S.S.; Nimbalkar, C.A.; Nawkar, R.R. Nutritional Evaluation of Cookies Enriched with Beetroot (Beta vulgaris L.) Powder. Int. J. Curr. Microbiol. Appl. Sci. 2017, 6, 1888–1896. [Google Scholar] [CrossRef]
105. Shere, P.D.; Chaudhari, D.N.; Mali, P.T. Preparation and Characterization of Beetroot Fortified Cheese Crackers to Enhance Nutritional Benefits. Int. J. Food Sci. Nutr. 2018, 3, 52–55. [Google Scholar]
106. Pereira De Oliveira, L.C.A.K.N.; Farias, T.; Baldus, M.H. Scabora Beetroot Pulp and Residue Improve the Shelf Life of Greek Yogurt When Added as Syrup. Contrib. a Las Cienc. Soc. 2024, 17, e8233. [Google Scholar] [CrossRef]
107. Niemira, J.; Galus, S. Valorization of Red Beetroot (Beta vulgaris L.) Pomace Combined with Golden Linseed (Lini Semen) for the Development of Vegetable Crispbreads as Gluten-Free Snacks Rich in Bioactive Compounds. Molecules 2024, 29, 2105. [Google Scholar] [CrossRef]
108. Ozaki, M.M.; Munekata, P.E.S.; de Lopes, A.S.; do Nascimento, M.D.S.; Pateiro, M.; Lorenzo, J.M.; Pollonio, M.A.R. Using Chitosan and Radish Powder to Improve Stability of Fermented Cooked Sausages. Meat Sci. 2020, 167, 108165. [Google Scholar] [CrossRef]
109. Lazăr, S.M. Valorization of by-Products Resulting from Red Beet Processing. Ph.D. Thesis, “Dunărea de Jos” University of Galați, Galați, Romania, 2023. [Google Scholar]
110. Mridula, D.; Gupta, R.K.; Bhadwal, S.; Khaira, H.; Tyagi, S.K. Optimization of Food Materials for Development of Nutritious Pasta Utilizing Groundnut Meal and Beetroot. J. Food Sci. Technol. 2016, 53, 1834–1844. [Google Scholar] [CrossRef]
111. Sandhya, P.S.; Lakshmy, P.S. Formulation of Beetroot Cream Cheese Spread. Int. J. Inform. Res. Rev. 2017, 4, 3710–3712. [Google Scholar]
112. Guo, Z.; Ge, X.; Li, W.; Yang, L.; Han, L.; Yu, Q.-L. Active-Intelligent Film Based on Pectin from Watermelon Peel Containing Beetroot Extract to Monitor the Freshness of Packaged Chilled Beef. Food Hydrocoll. 2021, 119, 106751. [Google Scholar] [CrossRef]
113. Zin, M.M.; Marki, E.; Banvolgyi, S. Conventional Extraction of Betalain Compounds from Beetroot Peels with Aqueous Ethanol Solvent. Acta Aliment. 2020, 49, 163–169. [Google Scholar] [CrossRef]
114. Silva, J.; Bolanho, B.C.; Stevanato, N. Ultrasound-Assisted Extraction of Red Beet Pigments (Beta vulgaris L.): Influence of Operational Parameters and Kinetic Modeling. J. Food Process. Preserv. 2020, 44, e14762. [Google Scholar] [CrossRef]
115. Fadhallah, E.G.; Rinjani, S.E.R.; Anantasya, A.K.S.; Pranata, A.; Triharto, R.; Dameswary, A.H. Potency of Betacyanin from Beetroot (Beta vulgaris) Peel Waste as Chicken Meat Freshness Indicator in Sago Starch-Based Biodegradable Smart Packaging. MOJ Ecol. Environ. Sci. 2023, 8, 186–190. [Google Scholar] [CrossRef]
116. Beluhan, S.; Herceg, F.; Leboš Pavunc, A.; Djaković, S. Preparation and Structural Properties of Bacterial Nanocellulose Obtained from Beetroot Peel Medium. Energies 2022, 15, 9374. [Google Scholar] [CrossRef]
117. Popescu, V. Chapter 7—New Trends in the Application of Natural Dyes. In Textile Dyeing, Renewable Dyes and Pigments; Elsevier: Amsterdam, The Netherlands, 2024; pp. 111–137. [Google Scholar] [CrossRef]
118. Popescu, V.; Blaga, A.C.; Pruneanu, M.; Cristian, I.N.; Pîslaru, M.; Popescu, A.; Rotaru, V.; Crețescu, I.; Cașcaval, D. Green Chemistry in the Extraction of Natural Dyes from Colored Food Waste, for Dyeing Protein Textile Materials. Polymers 2021, 13, 3867. [Google Scholar] [CrossRef]
119. Ahmed Moussa, A.; Gomaa, A.; El-Azabawy, R.; El-Bayaa, R.E. Valorization Beetroot Waste for Eco-Friendly Extraction of Natural Dye for Textile and Food Applications. Egypt. J. Chem. 2022, 65, 725–736. [Google Scholar] [CrossRef]
120. Adeel, S.S.; Abrar, M.; Fazal-Ur-Rehman, M.; Hussaan, F. Batool Chapter 15—Evolving Role of Plant Pigments in the Cosmetic Industry Renewable Dyes and Pigments; Elsevier: Amsterdam, The Netherlands, 2024; pp. 307–319. [Google Scholar]
121. Montenegro, C.F.; Kwong, D.A.; Minow, Z.A.; Davis, B.A.; Lozada, C.F.; Casazza, G.A. Betalain-Rich Concentrate Supplementation Improves Exercise Performance and Recovery in Competitive Triathletes. Appl. Physiol. Nutr. Metab. 2017, 42, 166–172. [Google Scholar] [CrossRef]
122. Mumford, P.W.; Kephart, W.C.; Romero, M.A.; Haun, C.T.; Mobley, C.B.; Osburn, S.C.; Healy, J.C.; Moore, A.N.; Pascoe, D.D.; Ruffin, W.C.; et al. Effect of 1-Week Betalain-Rich Beetroot Concentrate Supplementation on Cycling Performance and Select Physiological Parameters. Eur. J. Appl. Physiol. 2018, 118, 2465–2476. [Google Scholar] [CrossRef]
123. Khan, M.I.; Giridhar, P. Plant Betalains: Chemistry and Biochemistry. Phytochemistry 2015, 117, 267–295. [Google Scholar] [CrossRef]
124. da Silva, D.V.T.; dos Santos Baião, D.; de Oliveira Silva, F.; Alves, G.; Perrone, D.; Del Aguila, E.M.; Paschoalin, V.M.F. Betanin, a natural food additive: Stability, bioavailability, antioxidant and preservative ability assessments. Molecule 2019, 24, 458. [Google Scholar] [CrossRef]
125. Khan, M.I. Plant Betalains: Safety, Antioxidant Activity, Clinical Efficacy, and Bioavailability. Compr. Rev. Food Sci. Food Saf. 2016, 15, 316–330. [Google Scholar] [CrossRef]
126. Del Amo-Mateos, E.M.; Fernández-Delgado, S.; Lucas, J.C.; López-Linares, M.T.; García-Cubero, M. Coca Valorization of Discarded Red Beetroot through the Recovery of Bioactive Compounds and the Production of Pectin by Surfactant-Assisted Microwave Extraction. J. Clean. Prod. 2023, 389, 135995. [Google Scholar] [CrossRef]
127. Fissore, E.N.; Rojas, A.M.; Gerschenson, L.N.; Williams, P.A. Butternut and Beetroot Pectins: Characterization and Functional Properties. Food Hydrocoll. 2013, 31, 172–182. [Google Scholar] [CrossRef]
128. Medina-Torres, N.; Ayora-Talavera, T.; Espinosa-Andrews, H.; Sánchez-Contreras, A.; Pacheco, N. Ultrasound Assisted Extraction for the Recovery of Phenolic Compounds from Vegetable Sources. Agronomy 2017, 7, 47. [Google Scholar] [CrossRef]
129. Azmir, J.; Zaidul, I.S.M.; Rahman, M.M.; Sharif, K.M.; Mohamed, A.; Sahena, F.; Jahurul, M.H.A.; Ghafoor, K.; Norulaini, N.A.N.; Omar, A.K.M. Techniques for Extraction of Bioactive Compounds from Plant Materials: A Review. J. Food Eng. 2013, 117, 426–436. [Google Scholar] [CrossRef]
130. Guine, R.P.F.; Mendes, M.; Gonçalves, F. Optimization of Bioactive Compound’s Extraction Conditions from Beetroot by Means of Artificial Neural Networks (ANN). Agric. Eng. Int. CIGR J. 2019, 21, 216–223. [Google Scholar]
131. Sturzoiu, A.; Stroescu, M.; Stoica, A.; Dobre, T. Betanine Extraction from Beta vulgaris-Experimental Research and Statistical Modeling. J. Biochem. Technol. 2011, 73, 10–14. [Google Scholar]
132. Halwani, A.F.; Sindi, H.A.; Jambi, H.A. Characterization of Physical Properties of Red Beet Pigments. J. Biochem. Technol. 2018, 9, 10–14. [Google Scholar]
133. Kushwaha, R.; Kumar, V.; Vyas, G.; Kaur, J. Optimization of Different Variable for Eco-Friendly Extraction of Betalains and Phytochemicals from Beetroot Pomace. Waste Biomass Valorization 2018, 9, 1485–1494. [Google Scholar] [CrossRef]
134. Lazar, S.; Constantin, O.E.; Stanciuc, N.; Aprodu, I.; Croitoru, C.; Râpeanu, G. Optimization of Betalain Pigments Extraction Using Beetroot By-Products as a Valuable Source. Inventions 2021, 6, 50. [Google Scholar] [CrossRef]
135. Šeremet, D.; Durgo, K.; Jokić, S.; Huđek, A.; Vojvodić Cebin, A.; Mandura, A.; Jurasović, J.; Komes, D. Valorization of Banana and Red Beetroot Peels: Determination of Basic Macrocomponent Composition, Application of Novel Extraction Methodology and Assessment of Biological Activity in Vitro. Sustainability 2020, 12, 4539. [Google Scholar] [CrossRef]
136. Paramita, O.; Ansori, M.; Kusumastuti, A.; Fatimah, N. Natural Food Colourant of Beetroot Skin (Beta vulgaris L): Characterisation Study. IOP Conf. Ser. Earth Environ. Sci. 2022, 969, 012047. [Google Scholar] [CrossRef]
137. Fernando, G.S.N.; Wood, K.; Papaioannou, E.H.; Marshall, L.J.; Sergeeva, N.N.; Boesch, C. Application of an Ultrasound-Assisted Extraction Method to Recover Betalains and Polyphenols from Red Beetroot Waste. ACS Sustain. Chem. Eng. 2021, 9, 8736–8747. [Google Scholar] [CrossRef]
138. Lasta, H.F.B.; Lentz, L.; Mezzomo, N.; Ferreira, S.R.S. Supercritical CO2 to Recover Extracts Enriched in Antioxidant Compounds from Beetroot Aerial Parts. Biocatal. Agric. Biotechnol. 2019, 19, 101169. [Google Scholar] [CrossRef]
139. Maran, J.P.; Priya, B. Multivariate Statistical Analysis and Optimization of Ultrasound-Assisted Extraction of Natural Pigments from Waste Red Beet Stalks. J. Food Sci. Technol. 2016, 53, 792–799. [Google Scholar] [CrossRef]
140. Singhee, D. Review on Natural Dyes for Textiles from Wastes. In Chemistry and Technology of Natural and Synthetic Dyes and Pigments; IntechOpen: London, UK, 2020. [Google Scholar]
141. Singh, S.; Tripathi, A.D.; Chauhan, A.K.; Gupta, A.K. Production of Beetroot (Beta vulgaris L.) Wine Using Different Saccharomyces Strains and Study of Physicochemical and Sensorial Characteristics. J. Food Sci. Technol. 2021, 58, 4442–4449. [Google Scholar] [CrossRef]
142. Singh, A.; Ganesapillai, M.; Gnanasundaram, N. Optimization of Extraction of Betalain Pigments from Beta vulgaris Peel by Microwave Pretreatment. IOP Conf. Ser. Mater. Sci. Eng. 2017, 263, 032004. [Google Scholar] [CrossRef]
143. Zin, M.M.; Bánvölgyi, S. Emerging Technology Approach for Extractability and Stability of Betalains from the Peel of Beetroot (Beta vulgaris L.). Biomass Convers. Biorefinery 2023, 13, 10759–10769. [Google Scholar] [CrossRef]
144. Rosa, M.E.; Ferreira, A.M.; Neves, C.M.; Almeida, M.R.; Barros, R.; Cristovão, A.C.; Sousa, A.C.; Reis, P.M.; Rebelo, L.P.N.; Esperança, J.M.; et al. Coutinho and Mara G. Freire Valorisation of Red Beet Waste: One-Step Extraction and Separation of Betalains and Chlorophylls Using Thermoreversible Aqueous Biphasic systems. Green Chem. 2023, 25, 1852–1864. [Google Scholar] [CrossRef]
145. Borjan, D.; Šeregelj, V.; Andrejč, D.C.; Pezo, L.; Šaponjac, V.T.; Knez, Ž.; Vulić, J.; Marevci, M.K. Green Techniques for Preparation of Red Beetroot Extracts with Enhanced Biological Potential. Antioxidants 2022, 11, 805. [Google Scholar] [CrossRef]
146. Cardoso-Ugarte, G.A.; Sosa-Morales, M.E.; Ballard, T.; Liceaga, A.; San Martín-González, M.F. Microwave-Assisted Extraction of Betalains from Red Beet (Beta vulgaris). LWT 2014, 59, 276–282. [Google Scholar] [CrossRef]
147. Paciulli, M.; Medina-Meza, I.G.; Chiavaro, E.; Barbosa-Cánovas, G.V. Impact of Thermal and High Pressure Processing on Quality Parameters of Beetroot (Beta vulgaris L.). LWT 2016, 68, 98–104. [Google Scholar] [CrossRef]
148. Martins, N.; Roriz, C.L.; Morales, P.; Barros, L.; Ferreira, I.C.F.R. Coloring Attributes of Betalains: A Key Emphasis on Stability and Future Applications. Food Funct. 2017, 8, 1357–1372. [Google Scholar] [CrossRef] [PubMed]
149. Li, Y.; Fabiano-Tixier, A.-S.; Abert-Vian, M.; Chemat, F. Microwave-Assisted Extraction of Antioxidants and Food Colors. In Food Engineering Series; Springer: Boston, MA, USA, 2012; pp. 103–125. [Google Scholar]
150. Soquetta, M.B.; de Terra, L.M.; Bastos, C.P. Green Technologies for the Extraction of Bioactive Compounds in Fruits and Vegetables. CyTA-J. Food 2018, 16, 400–412. [Google Scholar] [CrossRef]
151. US-FDA, United States—Food and Drug Administration. 2016. Available online: https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/cfrsearch.cfm?fr=184.1240 (accessed on 13 April 2024).
152. Luengo, E.; Martinez, J.M.; Álvarez, I.; Raso, J. Comparison of the Efficacy of Pulsed Electric Fields Treatments in the Millisecond and Microsecond Range for the Extraction of Betanine from Red Beetroot. In 1st World Congress on Electroporation and Pulsed Electric Fields in Biology, Medicine and Food & Environmental Technologies; Springer: Singapore, 2016; pp. 375–378. [Google Scholar]
153. Viganó, J.; Martinez, J. Trends for the Application of Passion Fruit Industrial By-Products: A Review on the Chemical Composition and Extraction Techniques of Phytochemicals. Food Public Health 2015, 5, 164–173. [Google Scholar] [CrossRef]
154. Armenta, S.; Esteve-Turrillas, F.A.; Garrigues, S.; de la Guardia, M. Green Analytical Chemistry. In Comprehensive Analytical Chemistry; Elsevier: Amsterdam, The Netherlands, 2017; pp. 1–25. [Google Scholar]
155. Arias, A.; Feijoo, G.; Moreira, M.T. Assessing of the Most Appropriate Biotechnological Strategy on the Recovery of Antioxidants from Beet Wastes by Applying the Life Cycle Assessment (LCA) Methodology. Food Bioprod. Process. 2022, 135, 178–189. [Google Scholar] [CrossRef]
156. Nadar, S.S.; Rao, P.; Rathod, V.K. Enzyme Assisted Extraction of Biomolecules as an Approach to Novel Extraction Technology: A Review. Food Res. Int. 2018, 108, 309–330. [Google Scholar] [CrossRef]
157. Yusuf, M.; Shabbir, M.; Mohammad, F. Natural Colorants: Historical, Processing and Sustainable Prospects. Nat. Prod. Bioprospect. 2017, 7, 123–145. [Google Scholar] [CrossRef]
158. Rastogi, N.K.; Raghavarao, K.S.M.S. Mass Transfer during Osmotic Dehydration of Pineapple: Considering Fickian Diffusion in Cubical Configuration. LWT 2004, 37, 43–47. [Google Scholar] [CrossRef]
159. Calva-Estrada, S.J.; Jiménez-Fernández, M.; Lugo-Cervantes, E. Betalains and Their Applications in Food: The Current State of Processing, Stability and Future Opportunities in the Industry. Food Chem. 2022, 4, 100089. [Google Scholar] [CrossRef]
160. Castro-Enríquez, D.D.; Montaño-Leyva, B.; Del Toro-Sánchez, C.L.; Juaréz-Onofre, J.E.; Carvajal-Millan, E.; Burruel-Ibarra, S.E.; Tapia-Hernández, J.A.; Barreras-Urbina, C.G.; Rodríguez-Félix, F. Stabilization of Betalains by Encapsulation—A Review. J. Food Sci. Technol. 2020, 57, 1587–1600. [Google Scholar] [CrossRef]
161. Mkhari, T.; Kaseke, T.; Fawole, O.A. Encapsulation of Betalain-Rich Extract from Beetroot Postharvest Waste Using a Binary Blend of Gum Arabic and Maltodextrin to Promote a Food Circular Bioeconomy. Front. Nutr. 2023, 10, 1235372. [Google Scholar] [CrossRef] [PubMed]
162. Tekin, İ.K.; Özcan, S. Ersus Optimization of Ionic Gelling Encapsulation of Red Beet (Beta vulgaris L.) Juice Concentrate and Stability of Betalains. Biocatal. Agric. Biotechnol. 2023, 51, 102774. [Google Scholar] [CrossRef]
163. Tumbas Šaponjac, V.; Čanadanović-Brunet, J.; Ćetković, G.; Jakišić, M.; Djilas, S.; Vulić, J. Encapsulation of Beetroot Pomace Extract: RSM Optimization, Storage and Gastrointestinal Stability. Molecules 2016, 21, 584. [Google Scholar] [CrossRef] [PubMed]
164. Kaur, A.; Ghoshal, G. Encapsulation of Betalains Extracted from Beta vulgaris L. Pomace Powder Using Different Hydrocolloids and Its Characterization. Food Bioprocess Technol. 2024, 18, 1968–1982. [Google Scholar] [CrossRef]
165. Ravichandran, K.; Palaniraj, R.; Saw, N.M.M.T.; Gabr, A.M.M.; Ahmed, A.R.; Knorr, D.; Smetanska, I. Effects of Different Encapsulation Agents and Drying Process on Stability of Betalains Extract. J. Food Sci. Technol. 2014, 51, 2216–2221. [Google Scholar] [CrossRef]
166. Shofinita, D.M.; Fawwaz, A.B. Achmadi Betalain Extracts: Drying Techniques, Encapsulation, and Application in Food Industry. Food Front. 2023, 4, 576–623. [Google Scholar] [CrossRef]
167. Coimbra, P.P.S.; Silva-e-Silva, A.C.A.G.D.; Antonio, A.D.S.; Pereira, H.M.G.; Veiga-Junior, V.F.D.; Felzenszwalb, I.; Araujo-Lima, C.F.; Teodoro, A.J. Antioxidant Capacity, Antitumor Activity and Metabolomic Profile of a Beetroot Peel Flour. Metabolites 2023, 13, 277. [Google Scholar] [CrossRef]
168. Hobbs, D.A.; Kaffa, N.; George, T.W.; Methven, L.; Lovegrove, J.A. Blood Pressure-Lowering Effects of Beetroot Juice and Novel Beetroot-Enriched Bread Products in Normotensive Male Subjects. Br. J. Nutr. 2012, 108, 2066–2074. [Google Scholar] [CrossRef]
169. Rahimi, P.; Mesbah-Namin, S.A.; Ostadrahimi, A.; Separham, A.; Jafarabadi, M.A. Betalain-and Betacyanin-Rich Supplements’impacts on the PBMC SIRT1 and LOX1 Genes Expression and Sirtuin-1 Protein Levels in Coronary Artery Disease Patients: A Pilot Crossover Clinical Trial. J. Funct. Foods 2019, 60, 103401. [Google Scholar] [CrossRef]
170. Salloum, F.N.; Sturz, G.R.; Yin, C.; Rehman, S.; Hoke, N.N.; Kukreja, R.C.; Xi, L. Beetroot Juice Reduces Infarct Size and Improves Cardiac Function Following Ischemia-Reperfusion Injury: Possible Involvement of Endogenous H2S. Exp. Biol. Med. 2015, 240, 669–681. [Google Scholar] [CrossRef]
171. Vulic, J.; Canadanovic-Brunet, J.; Cetkovic, G. Antioxidant and Cell Growth Activities of Beet Rootpomace Extracts. J. Func. Foods 2012, 4, 670–678. [Google Scholar] [CrossRef]
172. Pietrzkowski, Z.; Nemzer, B.; Spórna, A.; Stalica, P.; Tresher, W.; Keller, R.; Wybraniec, S. Influence of Betalain-Rich Extract on Reduction of Discomfort Associated with Osteoarthritis. New Med. 2010, 1, 12–17. [Google Scholar]
173. Zhang, Q.; Pan, J.; Wang, Y.; Lubet, R.; You, M. Beetroot Red (Betanin) Inhibits Vinyl Carbamate-and Benzo (a) Pyrene-Induced Lung Tumorigenesis through Apoptosis. Mol. Carcinog. 2013, 52, 686–691. [Google Scholar] [CrossRef] [PubMed]
174. Lee, E.J.; An, D.; Nguyen, C.T.; Patil, B.S.; Kim, J.; Yoo, K.S. Betalain and betaine composition of greenhouse-or field-produced beetroot (Beta vulgaris L.) and inhibition of HepG2 cell proliferation. J. Agric. Food Chem. 2014, 62, 1324–1331. [Google Scholar] [CrossRef]
175. Kapadia, G.J.; Rao, G.S.; Ramachandran, C.; Iida, A.; Suzuki, N.; Tokuda, H. Synergistic Cytotoxicity of Red Beetroot (Beta vulgaris L.) Extract with Doxorubicin in Human Pancreatic, Breast and Prostate Cancer Cell Lines. J. Complement. Integr. Med. 2013, 10, 113–122. [Google Scholar] [CrossRef]
176. Lee, J.H.; Son, C.W.; Kim, M.Y.; Kim, M.H.; Kim, H.R.; Kwak, E.S.; Kim, M.R. Red Beet (Beta vulgaris L.) Leaf Supplementation Improves Antioxidant Status in C57BL/6J Mice Fed High-Fat High Cholesterol Diet. Nutr. Res. Pract. 2009, 3, 114–121. [Google Scholar] [CrossRef]
177. Esatbeyoglu, T.; Wagner, A.E.; Motafakkerazad, R.; Nakajima, Y.; Matsugo, S.; Rimbach, G. Free Radical Scavenging and Antioxidant Activity of Betanin: Electron Spin Resonance Spectroscopy Studies and Studies in Cultured Cells. Food Chem. Toxicol. 2014, 73, 119–126. [Google Scholar] [CrossRef]
178. Fu, Y.; Shi, J.; Xie, S.-Y.; Zhang, T.-Y.; Soladoye, O.P.; Aluko, R.E. Red Beetroot Betalains: Perspectives on Extraction, Processing, and Potential Health Benefits. J. Agric. Food Chem. 2020, 68, 11595–11611. [Google Scholar] [CrossRef]
179. Zhao, G.; He, F.; Wu, C. Betaine in Inflammation: Mechanistic Aspects and Applications. Front. Immunol. 2018, 9, 1070. [Google Scholar] [CrossRef]
180. Gao, X.; Wang, Y.; Randell, E. Higher Dietary Cho-Line and Betaine Intakes Are Associated with Betterbody Composition in the Adult Population of New found land. PLoS ONE 2016, 11, e0155403. [Google Scholar]
181. Tesoriere, L.; Fazzari, M.; Angileri, F.; Gentile, C.; Livrea, M.A. In Vitro Digestion of Betalainic Foods. Stability and Bioaccessibility of Betaxanthins and Betacyanins and Antioxidative Potential of Food Digesta. J. Agric. Food Chem. 2008, 56, 10487–10492. [Google Scholar] [CrossRef] [PubMed]
182. Rabeh, M.N.; Ibrahim, E.M. Antihypercholesterolemic Effects of Beet (Beta vulgaris L.) Root Waste Extract on Hypercholesterolemic Rats and Its Antioxidant Potential Properties. Pak. J. Nutr. 2014, 13, 500–505. [Google Scholar] [CrossRef][Green Version]
183. Al-Dosari, M.; Alqasoumi, S.A.; Ahmed, M.; Al-Yahya, M.; Ansari, M.N.; Rafatullah, S. Effect of Beta vulgaris L. on Cholesterol Rich Dietinduced Hypercholesterolemia in Rats. Farmácia 2011, 59, 669–678. [Google Scholar]
184. Lorizola, I.M.; Furlan, C.P.B.; Portovedo, M.; Milanski, M.; Botelho, P.B.; Bezerra, R.M.N.; Sumere, B.R.; Rostagno, M.A.; Capitani, C.D. Beet Stalks and Leaves (Beta vulgaris L.) Protect against High-Fat Diet-Induced Oxidative Damage in the Liver in Mice. Nutrients 2018, 10, 872. [Google Scholar] [CrossRef] [PubMed]
185. Bobek, P.; Galbavý, S.; Mariássyová, M. The Effect of Red Beet (Beta vulgaris Var. Rubra) Fiber on Alimentary Hypercholesterolemia and Chemically Induced Colon Carcinogenesis in Rats. Nahrung 2000, 44, 184–187. [Google Scholar] [CrossRef]
186. Han, J.; Ma, D.; Zhang, M.; Yang, X.; Tan, D. Natural Antioxidant Betanin Protects Rats from Paraquat-Induced Acute Lung Injury Interstitial Pneumonia. Biomed. Res. Int. 2015, 2015, 608174. [Google Scholar] [CrossRef]
187. Han, J.; Tan, C.; Wang, Y.; Yang, S.; Tan, D. Betanin Reduces the Accumulation and Cross-Links of Collagen in High-Fructose-Fed Rat Heart through Inhibiting Non-Enzymatic Glycation. Chem. Biol. Interact. 2015, 227, 37–44. [Google Scholar] [CrossRef]
188. Kabir, A.U.; Samad, M.B.; Ahmed, A.; Jahan, M.R.; Akhter, F.; Tasnim, J.; Hasan, S.M.N.; Sayfe, S.S.; Hannan, J.M.A. Aqueous Fraction of Beta vulgaris Ameliorates Hyperglycemia in Diabetic Mice Due to Enhanced Glucose Stimulated Insulin Secretion, Mediated by Acetylcholine and GLP-1, and Elevated Glucose Uptake via Increased Membrane Bound GLUT4 Transporters. PLoS ONE 2015, 10, e0116546. [Google Scholar] [CrossRef]
189. El-Ghffar, E.A.; Hegazi, N.M.; Saad, H.H.; Soliman, M.M.; El-Raey, M.A.; Shehata, S.M.; Sobeh, M. HPLC-ESI-MS/MS Analysis of Beet (Beta vulgaris) Leaves and Its Beneficial Properties in Type 1 Diabetic Rats. Biomed. Pharmacother. 2019, 120, 109541. [Google Scholar] [CrossRef]
190. El Gamal, A.A.; AlSaid, M.S.; Raish, M.; Al-Sohaibani, M.; Al-Massarani, S.M.; Ahmad, A.; Hefnawy, M.; Al-Yahya, M.; Basoudan, O.A.; Rafatullah, S. Beetroot (Beta vulgaris L.) Extract Ameliorates Gentamicin-Induced Nephrotoxicity Associated Oxidative Stress, Inflammation, and Apoptosis in Rodent Model. Mediators Inflamm. 2014, 2014, 983952. [Google Scholar] [CrossRef]
191. Kundu, J.K.; Surh, Y.-J. Emerging Avenues Linking Inflammation and Cancer. Free Radic. Biol. Med. 2012, 52, 2013–2037. [Google Scholar] [CrossRef] [PubMed]
192. Das, S.; Williams, D.S.; Das, A.; Kukreja, R.C. Beet Root Juice Promotes Apoptosis in Oncogenic MDA-MB-231 Cells While Protecting Cardiomyocytes under Doxorubicin Treatment. J. Exp. Second. Sci. 2013, 2, 1–6. [Google Scholar]
193. Vidal, P.J.; López-Nicolás, J.M.; Gandía-Herrero, F.; García-Carmona, F. Inactivation of Lipoxygenase and Cyclooxygenase by Natural Betalains and Semi-Synthetic Analogues. Food Chem. 2014, 154, 246–254. [Google Scholar] [CrossRef]
194. Ricciotti, E.; FitzGerald, G.A. Prostaglandins and Inflammation. Arterioscler. Thromb. Vasc. Biol. 2011, 31, 986–1000. [Google Scholar] [CrossRef]
195. Kumar, S.; Brooks, M.S.-L. Use of Red Beet (Beta vulgaris L.) for Antimicrobial Applications—A Critical Review. Food Bioproc. Technol. 2018, 11, 17–42. [Google Scholar] [CrossRef]
196. Čanadanović-Brunet, J.M.; Savatović, S.S.; Ćetković, G.S.; Vulić, J.J.; Djilas, S.M.; Markov, S.L.; Cvetković, D.D. Antioxidant and Antimicrobial Activities of Beet Root Pomace Extracts. Czech J. Food Sci. 2011, 29, 575–585. [Google Scholar] [CrossRef]
197. Khosasi, W.; Felim, J.; Lukita, S.; Sim, M.; Wijaya, S.; Florenly. Stronger Antibacterial Efficacy of Red Beetroots Compared to Red Dragon Fruit Peels Extract on Streptococcus Mutans. In Proceedings of the 2021 IEEE International Conference on Health, Instrumentation & Measurement, and Natural Sciences (InHeNce), Medan, Indonesia, 14–16 July 2021. [Google Scholar]
198. Lundberg, J.O.; Carlström, M.; Larsen, F.J.; Weitzberg, E. Roles of Dietary Inorganic Nitrate in Cardiovascular Health and Disease. Cardiovasc. Res. 2011, 89, 525–532. [Google Scholar] [CrossRef]
199. Wink, D.A.; Hines, H.B.; Cheng, R.Y.S.; Switzer, C.H.; Flores-Santana, W.; Vitek, M.P.; Ridnour, L.A.; Colton, C.A. Nitric Oxide and Redox Mechanisms in the Immune Response. J. Leukoc. Biol. 2011, 89, 873–891. [Google Scholar] [CrossRef]
200. Kanner, J.; Harel, S.; Granit, R. Betalains—A New Class of Dietary Cationized Antioxidants. J. Agric. Food Chem. 2001, 49, 5178–5185. [Google Scholar] [CrossRef]
201. Abdo, E.M.; Shaltout, O.E.-S.; El-Sohaimy, S.; Abdalla, A.E.M.; Zeitoun, A.M. Effect of Functional Beetroot Pomace Biscuit on Phenylhydrazine Induced Anemia in Albino Rats: Hematological and Blood Biochemical Analysis. J. Funct. Foods 2021, 78, 104385. [Google Scholar] [CrossRef]
202. Lidder, S.; Webb, A.J. Vascular Effects of Dietary Nitrate (as Found in Green Leafy Vegetables and Beetroot) via the Nitrate-Nitrite-Nitric Oxide Pathway: Vascular Effects of Dietary Nitrate. Br. J. Clin. Pharmacol. 2013, 75, 677–696. [Google Scholar] [CrossRef] [PubMed]
203. Joris, P.J.; Mensink, R.P. Beetroot Juice Improves in Overweight and Slightly Obese Men Postprandial Endothelial Function after Consumption of a Mixed Meal. Atherosclerosis 2013, 231, 78–83. [Google Scholar] [CrossRef] [PubMed]
204. Machha, A.; Schechter, A.N. Dietary Nitrite and Nitrate: A Review of Potential Mechanisms of Cardiovascular Benefits. Eur. J. Nutr. 2011, 50, 293–303. [Google Scholar] [CrossRef] [PubMed]
205. Presley, T.D.; Morgan, A.R.; Bechtold, E.; Clodfelter, W.; Dove, R.W.; Jennings, J.M.; Kraft, R.A.; King, S.B.; Laurienti, P.J.; Rejeski, W.J.; et al. Acute Effect of a High Nitrate Diet on Brain Perfusion in Older Adults. Nitric Oxide 2011, 24, 34–42. [Google Scholar] [CrossRef]
206. Gilchrist, M.; Winyard, P.G.; Fulford, J.; Anning, C.; Shore, A.C.; Benjamin, N. Dietary Nitrate Supplementation Improves Reaction Time in Type 2 Diabetes: Development and Application of a Novel Nitrate-Depleted Beetroot Juice Placebo. Nitric Oxide 2014, 40, 67–74. [Google Scholar] [CrossRef]
207. Ptak, M.; Skowrońska, A.; Pińkowska, H.; Krzywonos, M. Sugar Beet Pulp in the Context of Developing the Concept of Circular Bioeconomy. Energies 2021, 15, 175. [Google Scholar] [CrossRef]
208. Simić, S.; Petrović, J.; Rakić, D.; Pajin, B.; Lončarević, I.; Jozinović, A.; Fišteš, A.; Nikolić, S.; Blažić, M.; Miličević, B. The Influence of Extruded Sugar Beet Pulp on Cookies’ Nutritional, Physical and Sensory Characteristics. Sustainability 2021, 13, 5317. [Google Scholar] [CrossRef]
Stoica F, Râpeanu G, Rațu RN, Stănciuc N, Croitoru C, Țopa D, Jităreanu G. Red Beetroot and Its By-Products: A Comprehensive Review of Phytochemicals, Extraction Methods, Health Benefits, and Applications. Agriculture. 2025; 15(3):270. https://doi.org/10.3390/agriculture15030270
Перевод статьи «Red Beetroot and Its By-Products: A Comprehensive Review of Phytochemicals, Extraction Methods, Health Benefits, and Applications» авторов Stoica F, Râpeanu G, Rațu RN, Stănciuc N, Croitoru C, Țopa D, Jităreanu G., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
Фото: freepik
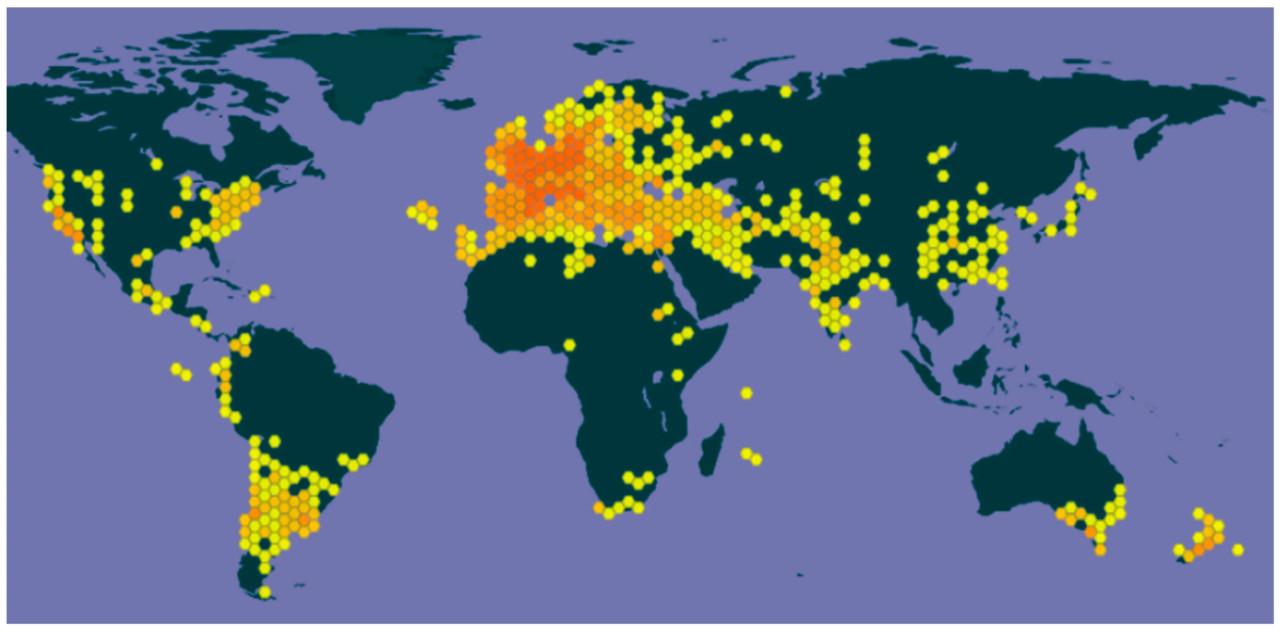
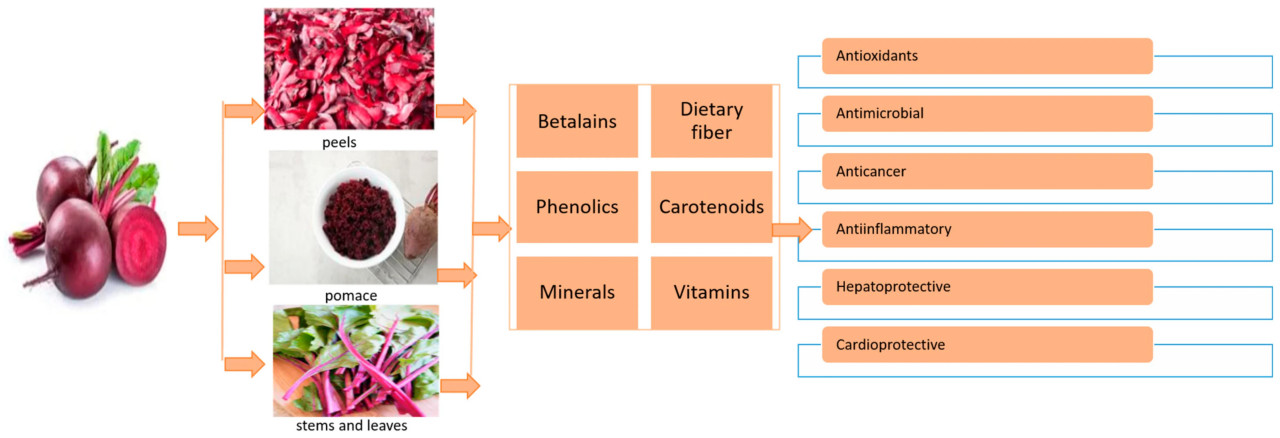
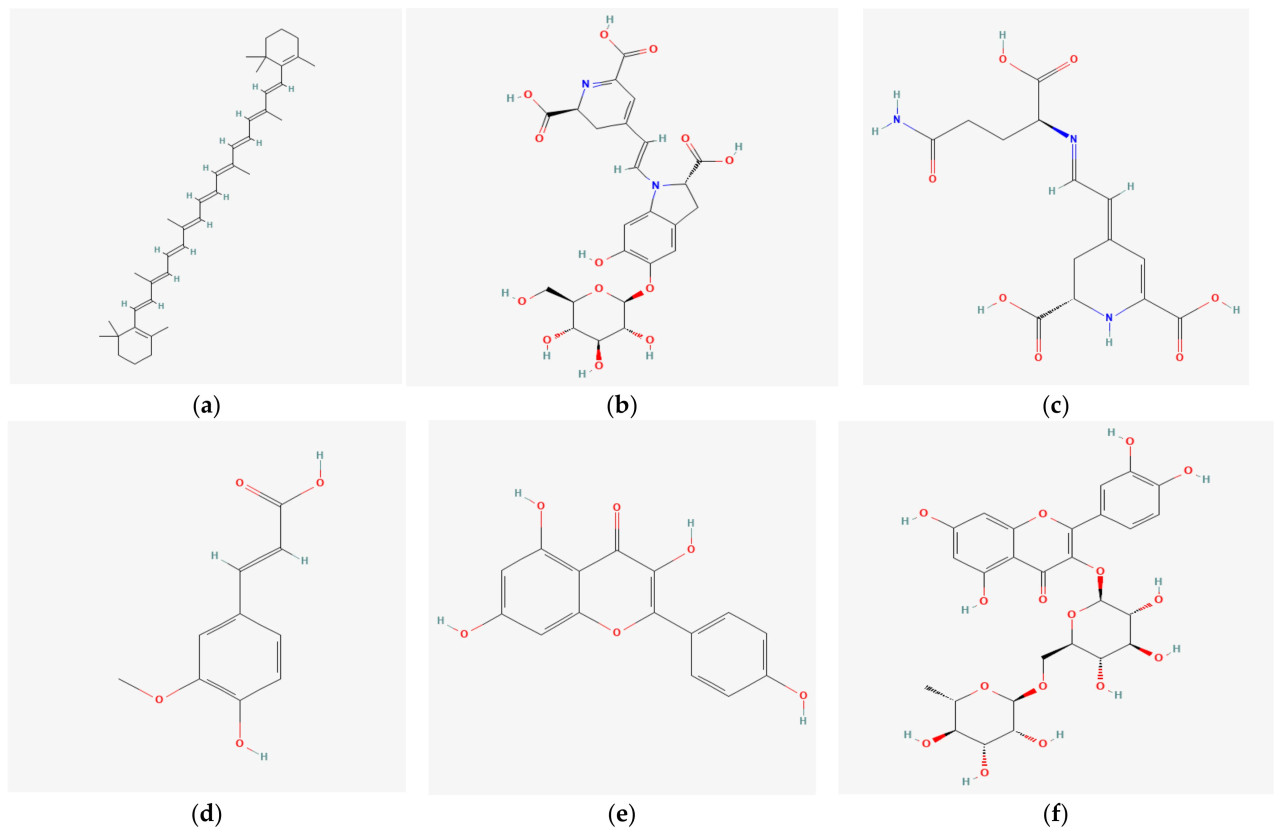
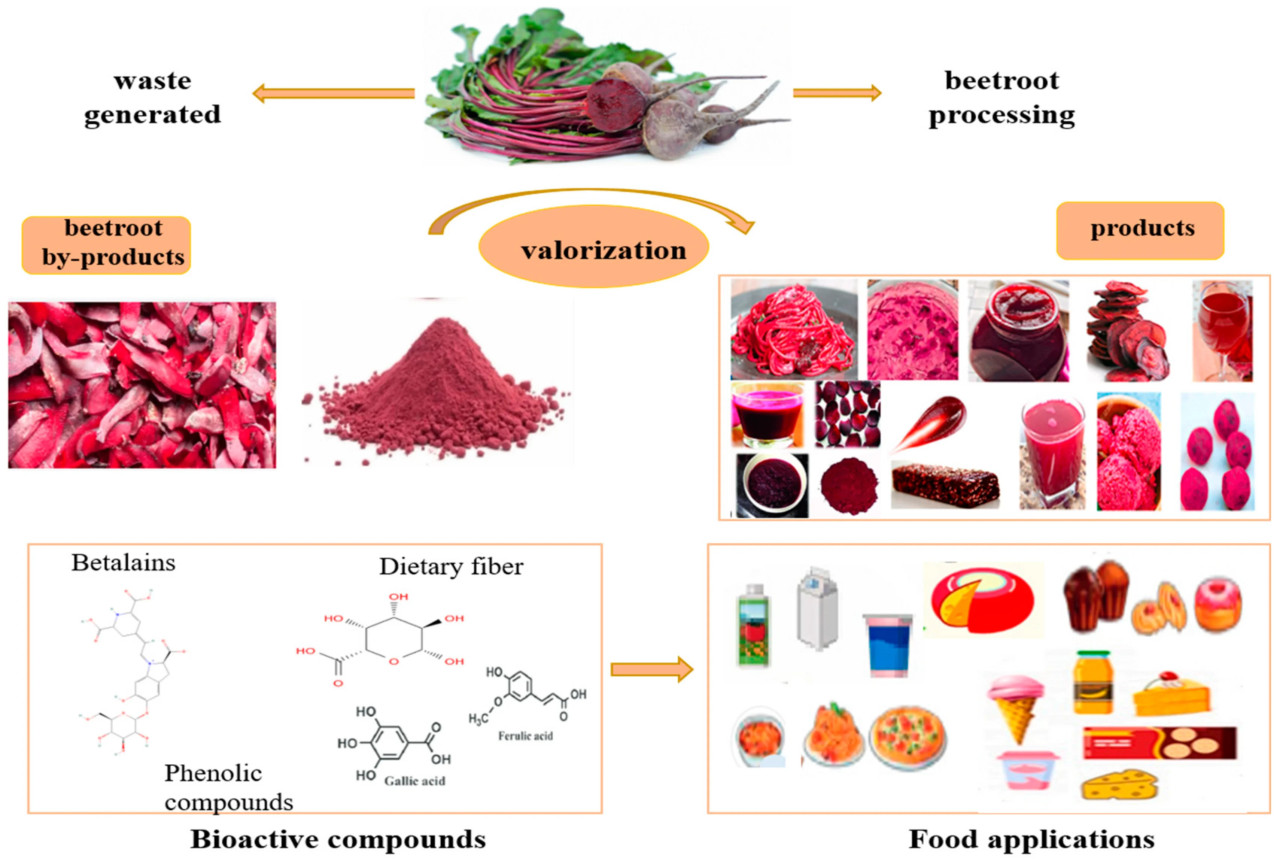

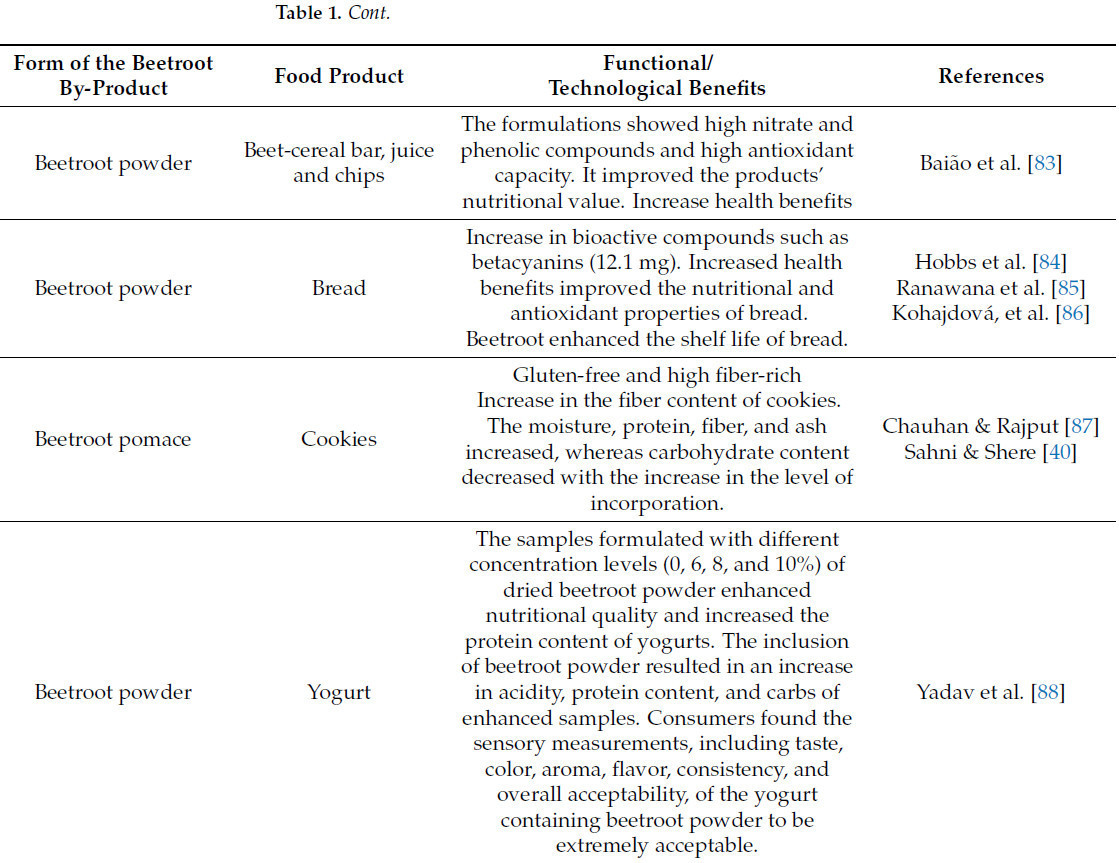
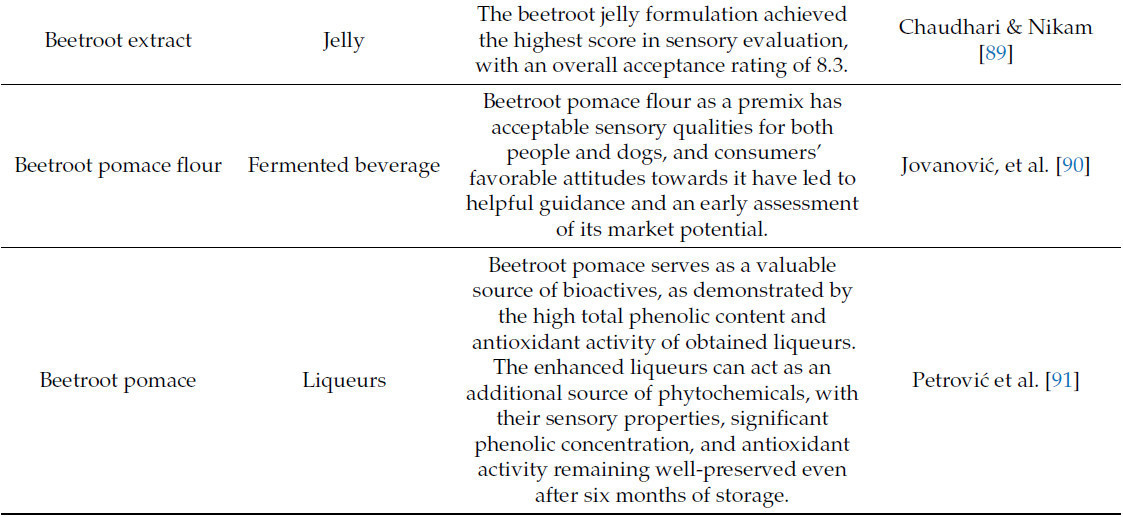
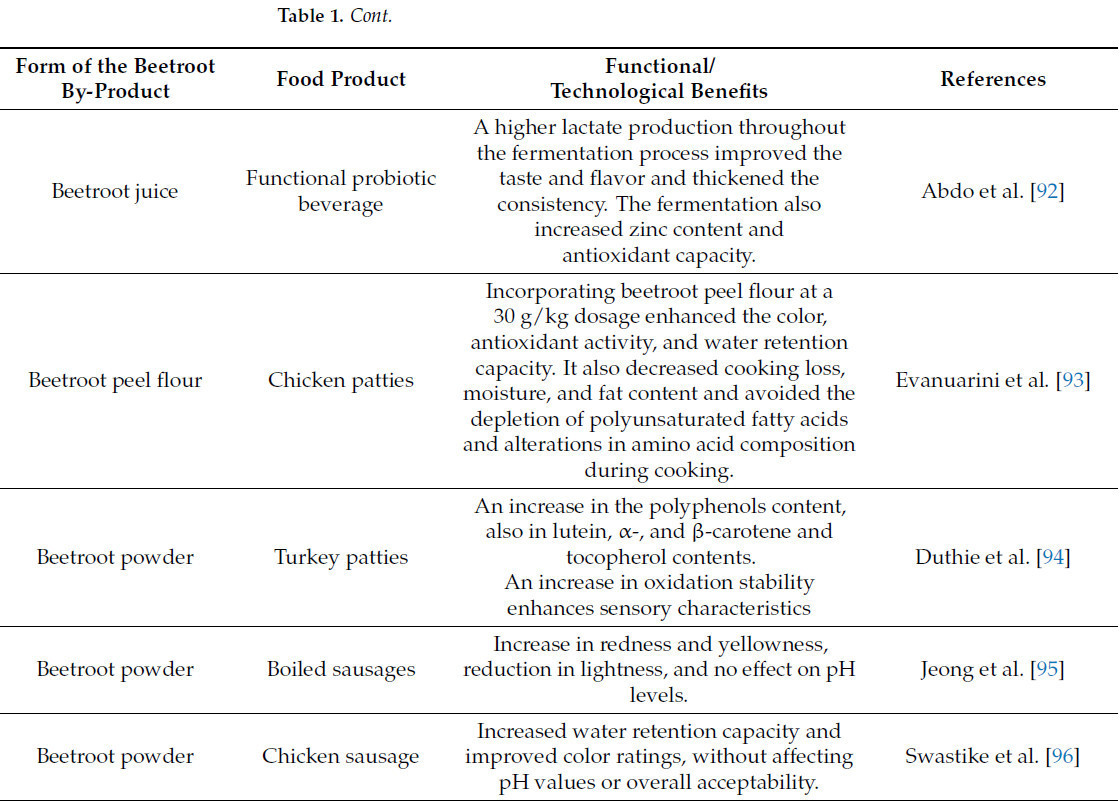
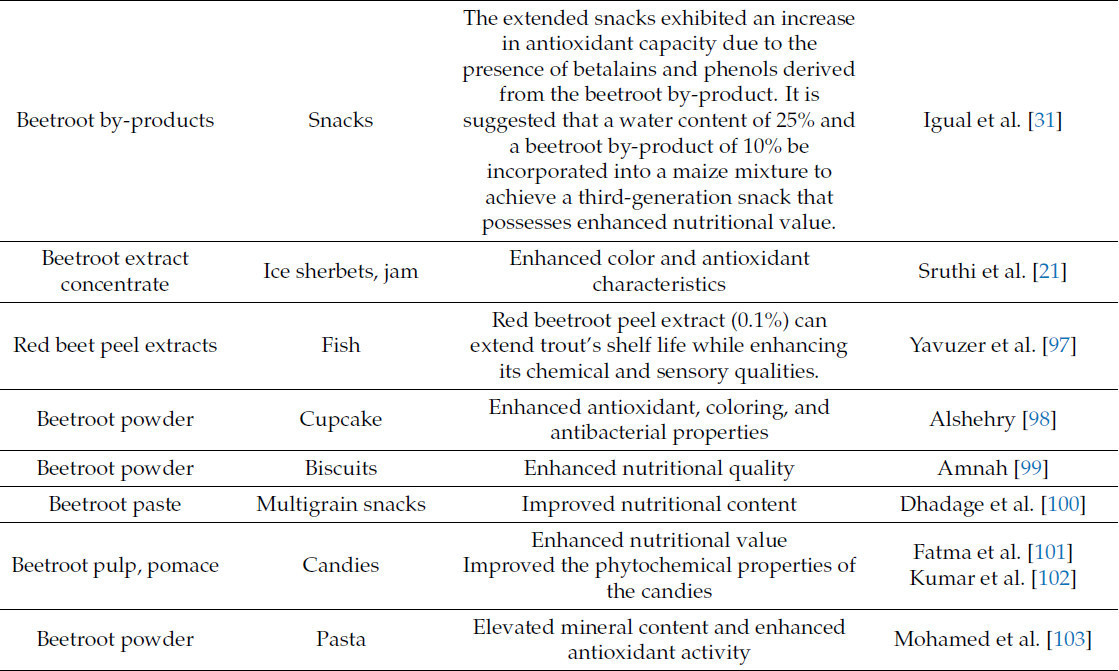
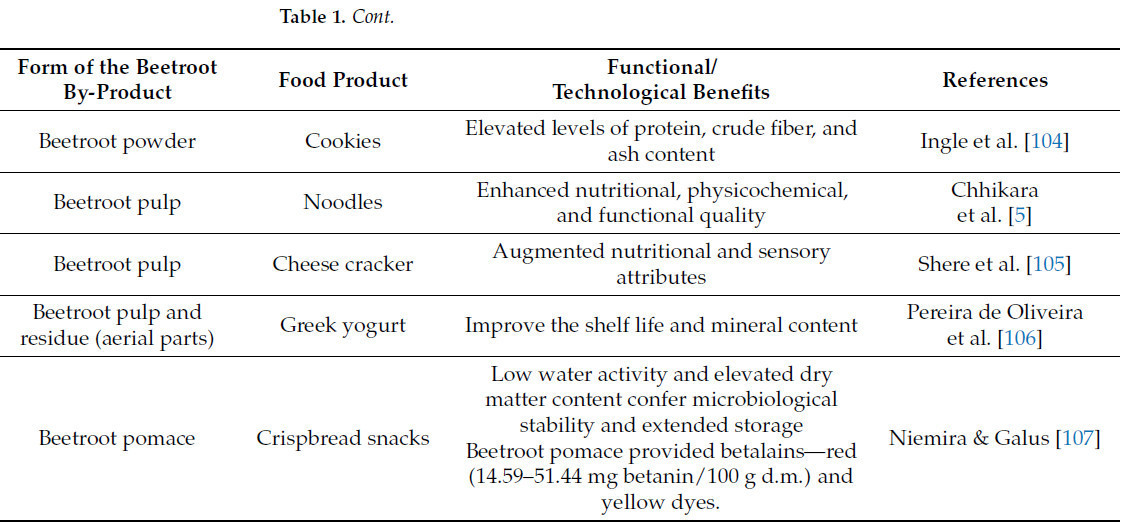
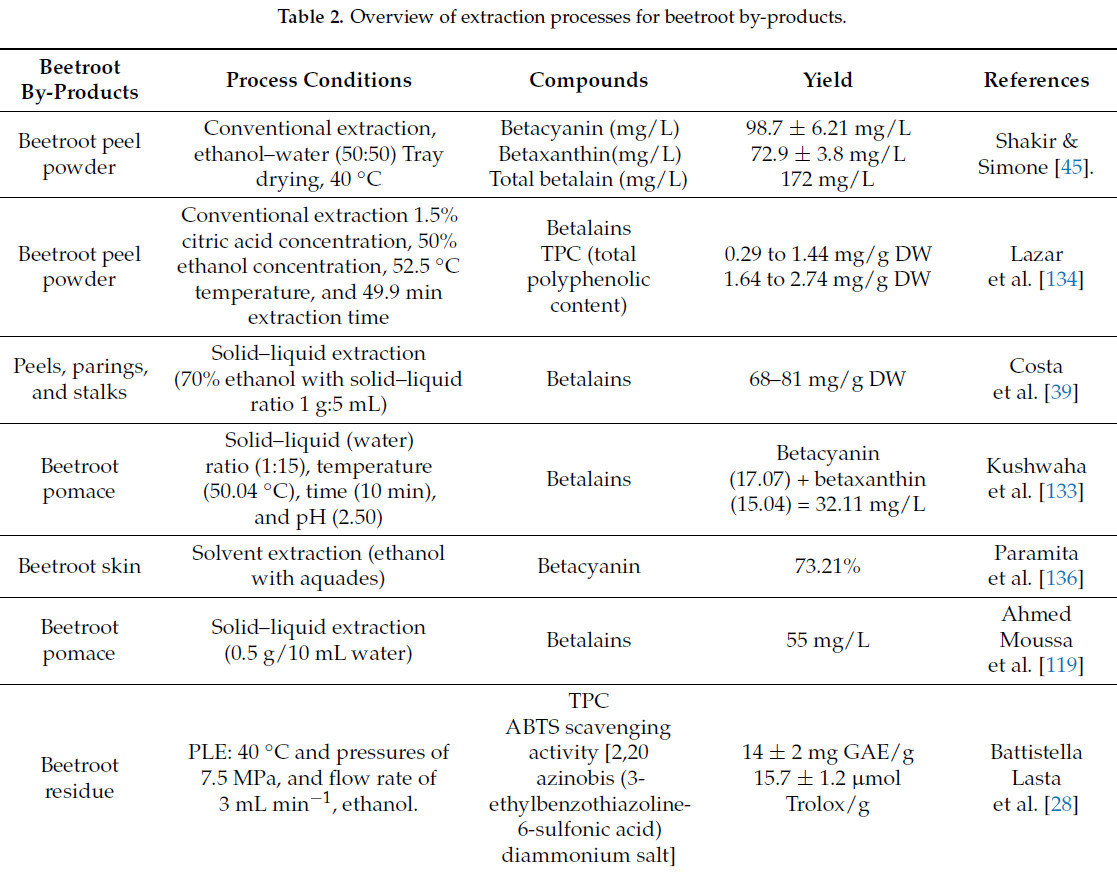
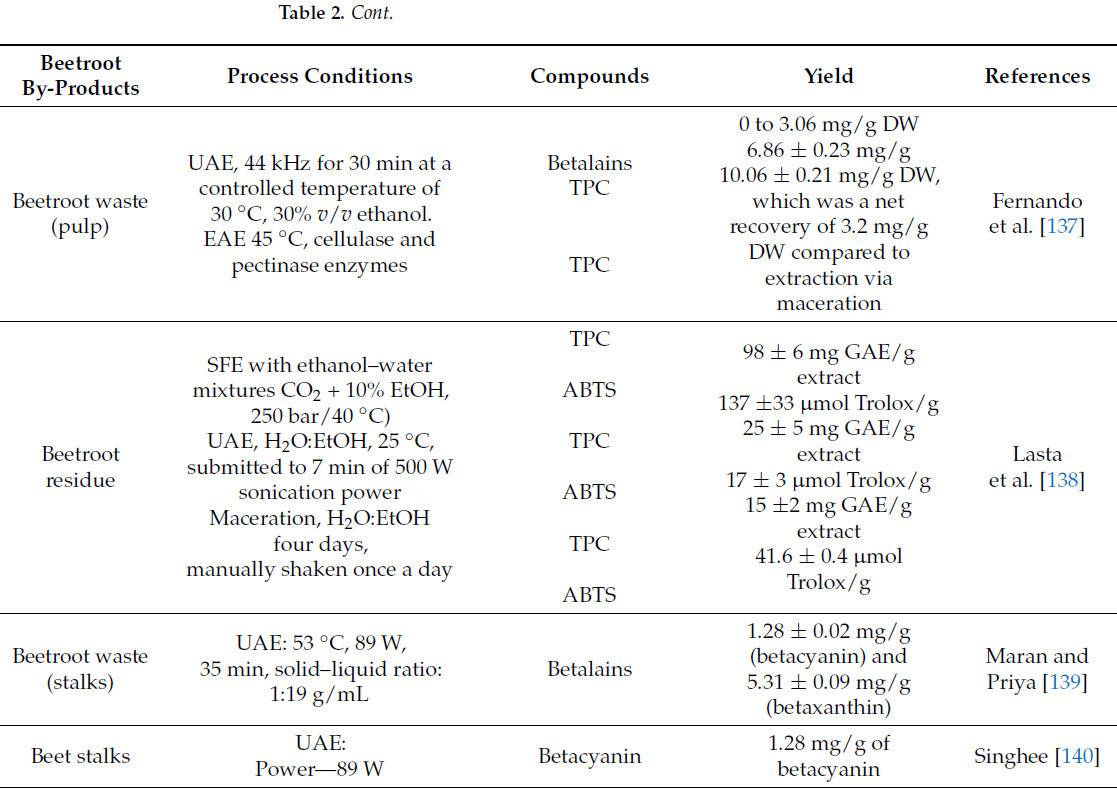
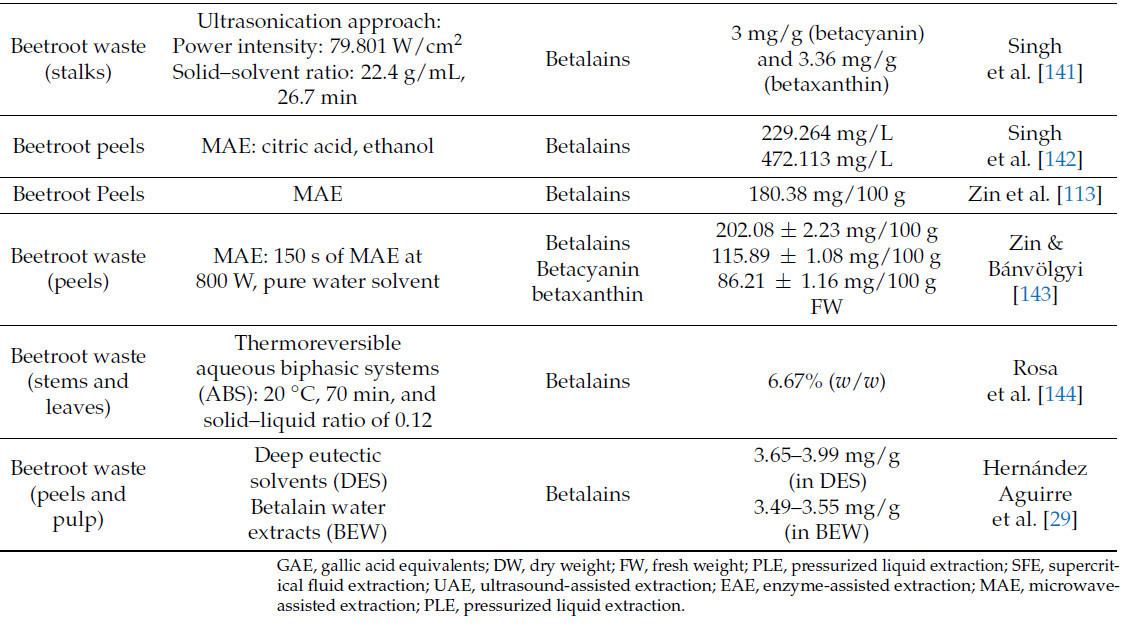
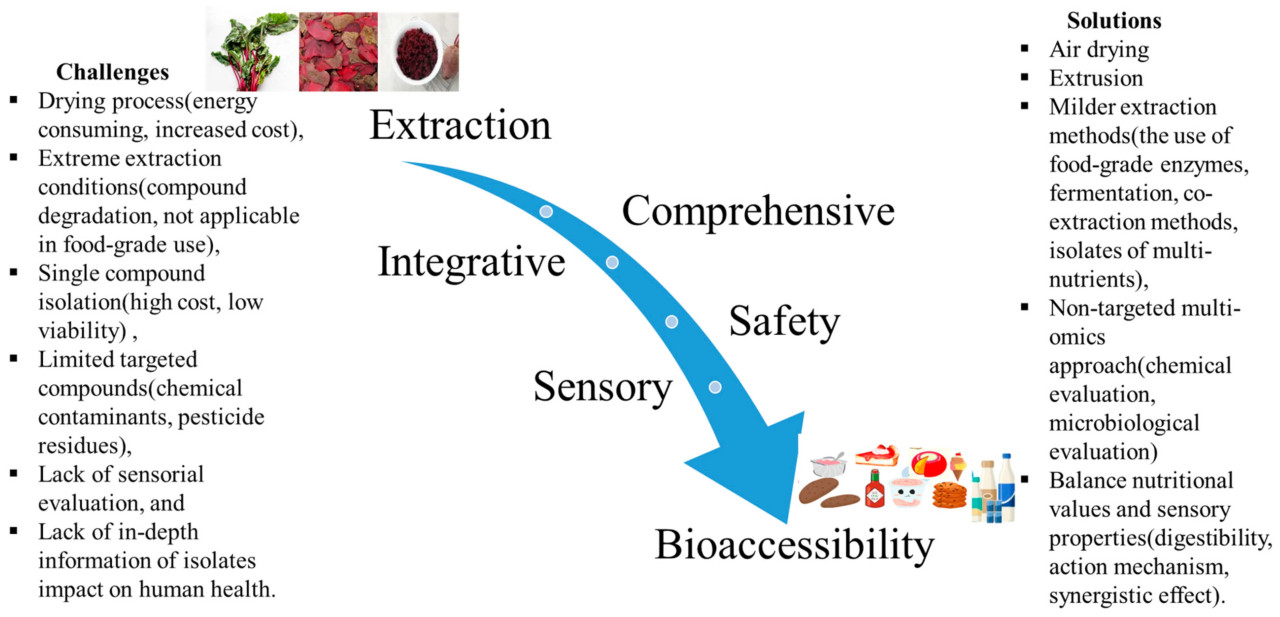






























































































Комментарии (0)