Пчелиная диета: найден липид, управляющий сменой профессий у пчел
Разделение труда среди рабочих пчёл способствует эффективности их опылительной деятельности. Липиды играют ключевую роль в регуляции поведения, при этом пыльца служит основным источником этих липидов. Однако регуляторное влияние липидов пыльцы на разделение труда у рабочих пчёл остаётся малоизученным. В данном исследовании был применён углублённый липидомический анализ на основе HPLC-QTOF-MS (высокоэффективная жидкостная хроматография с квадруполь-времяпролётной масс-спектрометрией) и UPLC-IM-QTOF-MS (сверхэффективная жидкостная хроматография с ионной мобильностью и квадруполь-времяпролётной масс-спектрометрией).
Аннотация
Впервые выполнен комплексный липидомический анализ брюшка, мозга и кишечника только что вылупившихся пчёл, пчёл-кормилиц и пчёл-фуражиров, а также пыльцы. В результате создана библиотека липидов, включающая 646 видов липидов. Установлено, что липидный состав пыльцы имеет характеристики, сходные с таковыми у рабочих пчёл, а альфа-линоленовая кислота (alpha linolenic acid, ALA) подтверждена как ключевой липид, связанный с разделением труда. Умеренное добавление ALA в корм изменило уровень липидов и способствовало метаболизму, связанному с разделением труда. Эти результаты продвигают область липидомического анализа у рабочих пчёл, раскрывая новый поведенческий регулятор и расширяя понимание механизмов нутриционной регуляции ALA в разделении труда у рабочих пчёл.
1. Введение
Рабочие пчелы регулярно посещают цветы для сбора необходимых ресурсов, таких как нектар и пыльца, что приводит к перекрестному опылению и делает их высокоэффективными опылителями [1,2]. Этот эффективный процесс опыления во многом объясняется их сложной социальной структурой и высокой степенью организации колоний [3,4]. Внутри пчелиных колоний рабочие особи демонстрируют типичное возрастное разделение труда [5,6]: молодые взрослые пчелы, известные как только что вылупившиеся пчелы (emerging bees, EBs), в основном занимаются чисткой ячеек; пчелы-кормилицы (nursing bees, NBs) ответственны за кормление личинок; а ближе к концу своего жизненного цикла пчелы-фуражиры (foraging bees, FBs) покидают улей для сбора пыльцы и других ресурсов. Эта сложная трансформация была extensively изучена на различных биологических уровнях, включая экспрессию генов [7,8,9], белки [10,11,12], гормоны и феромоны [13,14,15].
Липиды представляют собой разнообразную группу биомолекул, которая, как широко reported, включает триацилглицерины для хранения энергии [16] и фосфолипиды для структуры мембран [17]. Примечательно, что липиды играют ключевую роль в регуляции разделения труда у рабочих пчел. У этих рабочих особей наблюдается стабильная потеря липидов в разные периоды труда, при этом общее содержание липидов в брюшке наиболее низкое в период EB, достигает пика в период NB и снижается примерно на 50% в период FB [18]. Было показано, что вмешательство в накопление липидов удваивает скорость фуражировки [19], что указывает на то, что уровни липидов являются ключевыми детерминантами разделения труда. Однако конкретные липидные молекулы, ответственные за это накопление липидов, еще предстоит идентифицировать. Липидомика обеспечивает более глубокое понимание молекулярных изменений и была применена для изучения развития [20,21] и здоровья [22] медоносных пчел. На сегодняшний день липидомика использовалась в анализах ткани мозга для объяснения разделения труда у рабочих пчел [23]. Учитывая, что липидные молекулы могут регулировать поведение в различных биологических тканях, необходим более полный липидомический анализ для выяснения лежащих в основе механизмов.
Нутриционная регуляция влияет на липидные профили медоносных пчел [12,24]. Пыльца является основным источником питательных веществ, в частности липидов, для улья [25,26]. Хотя исследования индивидуального потребления питательных веществ ограничены, существуют заметные различия в потреблении пыльцы среди рабочих пчел с разными ролями. В частности, в периоды EB и FB потребление пыльцы ниже, тогда как в период NB оно существенно возрастает [27]. Эта вариабельность потребления пыльцы свидетельствует о потенциальном влиянии на накопление липидов, возможно, обусловленном добавлением пищевых липидов. После потребления липидов пыльцы они перевариваются и всасываются в кишечнике [28,29], при этом питательные вещества впоследствии переносятся в брюшко и мозг для хранения и использования [30,31,32]. Этот процесс приводит к дальнейшим физиологическим и поведенческим изменениям у пчел [33]. Показательным примером является альфа-линоленовая кислота (ALA), незаменимая омега-3 жирная кислота, которую медоносные пчелы должны получать с пищей [34]. Доля ALA в пыльце может изменять липидный состав медоносных пчел и влиять на их поведенческую специализацию [24,34]. Более того, дефицит ALA в пыльце приводит к снижению уровней ALA в брюшке и мозге пчел, ухудшая их способность к обучению [35]. Однако нутриционная регуляция липидов пыльцы на разделение труда у рабочих пчел еще предстоит изучить.
В этом исследовании мы изучили влияние липидов пыльцы на разделение труда у рабочих пчел. Мы впервые представляем комплексное липидное профилирование брюшка, мозга и кишечника рабочих пчел (EBs, NBs, FBs), а также пыльцы, что привело к созданию соответствующей библиотеки липидов, включающей 646 видов липидов. Основываясь на этой работе, мы исследовали характерные для труда липиды рабочих пчел, определив, что эти липиды могут происходить из пыльцы. Было обнаружено, что ALA в пыльце является ключевым эффектором, и соответствующее количество пищевой ALA может способствовать повышению уровней липидов и метаболизма, связанного с трудовыми характеристиками рабочих пчел.
2. Материалы и методы
2.1. Химикаты и реагенты
Химикаты и реагенты перечислены в таблице S1. Сверхчистая вода (18,2 МΩ/см, 25 °C) была подготовлена с использованием системы Milli-Q Academic от Merck (Дармштадт, Германия).
2.2. Сбор образцов
Рабочие пчелы (Apis mellifera L.), использованные в этом исследовании, содержались в Научно-исследовательском институте шелководства и пчеловодства Юньнаньской академии сельскохозяйственных наук, автономный префектура Хунхэ, 661400, Китай. Дифференциация и сбор EBs, NBs и FBs проводились в соответствии с методом Fang и др. [10]. Кратко, EBs собирали в течение 24 часов после выхода взрослых особей из ячеек. NBs идентифицировали как взрослых особей, проявляющих кормовое поведение, определяемое как погружение головы в ячейки с молодыми личинками не менее чем на 10 секунд. FBs собирали у входа в улей, когда они возвращались с грузом пыльцы на ногах. В июне 2023 года было получено по 300 особей EBs, NBs и FBs из шести разных колоний. Была собрана пыльца, переносимая FBs. Эти образцы были использованы для липидного профилирования. В июне 2024 года из сильной колонии была извлечена одна запечатанная расплодная ячейка для проведения эксперимента по добавлению ALA в корм.
Образцы пчел были гуманно подвергнуты эвтаназии охлаждением при -20 °C в течение 15 минут с последующим немедленным препарированием для минимизации стресса и дискомфорта. Брюшко [36], мозг [10] и кишечник [37] рабочих пчел препарировали, следуя установленным методам. Более точно, мы сначала извлекали кишечник из жала рабочей пчелы. Затем мы собирали оставшуюся часть брюшка. Для сбора мозга мы удаляли усики и головную капсулу, чтобы обнажить весь мозг, затем осторожно отделяли железистые ткани, простые глазки и сложные глаза, прикрепленные к мозгу. Собранный образец пыльцы тщательно перемешивали, а затем подвергали лиофильной сушке. Все образцы хранили при -80 °C до дальнейшего использования.
2.3. Экстракция липидов
Подготовка образцов следовала установленному методу экстракции липидов [38] с модификациями объемов образцов и реагентов. Ткани рабочих пчел объединяли из расчета 10 особей на образец: около 10 мг мозга и около 100 мг брюшка и кишечника. Каждый образец пыльцы точно взвешивали по 20 мг. Для образцов мозга использовали исходный объем реагента в соответствии с методом, для образцов пыльцы требовалось двукратное увеличение, а для образцов брюшка и кишечника потребовалось десятикратное увеличение объема реагента. Общее содержание липидов в каждом образце было взвешено. Все липидные образцы были объединены по 10 мкл каждый для создания пула контроля качества (QC).
2.4. Липидное профилирование
Липидное профилирование проводили с использованием 1290 Infinity II ВЭЖХ в сочетании с 6545 LC-ESI-QTOF масс-спектрометром (Agilent, Санта-Клара, Калифорния, США). Липидные экстракты (объем инъекции 2 мкл) разделяли на колонке Waters Xbridge C18 (2,1 × 100 мм, 3,5 мкм) при 50 °C. Использовали бинарную систему растворителей: подвижная фаза А (ACN: вода (6:4, об/об)) и подвижная фаза В (IPA: ACN (9:1, об/об)), обе содержали 10 мМ формиата аммония и 0,1% муравьиной кислоты. Разделение проводили со скоростью потока 0,3 мл/мин в течение 30 мин со следующим градиентом: 0 мин, 60% А; 4 мин, 50% А; 25 мин, 100% А; 27 мин, 100% А; 27,1 мин, 60% А; 30 мин, 60% А. Данные собирали в режиме DDA (зависимый от данных сбор), включая режим положительных ионов и режим отрицательных ионов, диапазон сбора составлял 100–2000 m/z. Все образцы анализировали в одной партии, с QC как минимум каждые 6 образцов. Сырые данные, полученные в результате масс-спектрометрического анализа, обрабатывали с использованием программного обеспечения MS-DIAL ver.4.9.221218, как подробно описано в предыдущем исследовании [39].
2.5. Библиотека липидов
Информация об ионах для липидного профилирования вручную отбиралась путем сравнения времени удерживания (RT) стандартов липидов. Химические названия и SMILES идентифицированных липидов были импортированы в программное обеспечение Progenesis SDF Studio v1.0 (Waters, Милфорд, Массачусетс, США) для получения молярных структур соединений. Затем в программном обеспечении Progenesis QI v2.0 (Waters, Милфорд, Массачусетс, США) значения сечения столкновения (CCS) для соединений были получены из их молярных структур, и было введено RT каждого соединения для создания библиотеки липидов.
2.6. Эксперимент по добавлению ALA в корм
Запечатанная рамка с расплодом была разрезана на три сегмента (5 см × 10 см) и помещена в прозрачные изолированные ящики (10 см × 15 см) при 34 °C и влажности 40%, обозначенные как контрольная группа, группа средней концентрации и группа высокой концентрации. После выхода взрослых рабочих пчел из ячеек рамки были удалены, и количество рабочих пчел было зарегистрировано как 55, 52 и 57 соответственно. Корм состоит из пыльцы, обогащенной дополнительной пищевой ALA, смешанной с сахарным сиропом (1:1, об/об). Контрольная группа, группа средней концентрации и группа высокой концентрации были созданы [40,41] с содержанием ALA в корме 0%, 5% и 10% от веса пыльцы соответственно. Корм обновляли каждые два дня, и уровень смертности контролировали ежедневно (Таблица S1). Все выжившие рабочие пчелы были гуманно подвергнуты эвтаназии и собраны через 7 дней. В каждой группе 10 рабочих пчел были случайным образом выбраны как один образец, и было взято 3 параллельных образца. Брюшко и мозг пчел были препарированы для липидного анализа. Были проанализированы общее содержание липидов, уровни ALA и липидомика.
2.7. Липидомический анализ для эксперимента по добавлению ALA в корм
Была проведена работа на системе ACQUITY UPLC, сопряженной с SYNAPT G2-XS IM-QTOF масс-спектрометром (Waters, Милфорд, Массачусетс, США). Объем инъекции, бинарная система растворителей, тип колонки, температура колонки и условия разделения соответствовали использованным при липидном профилировании. Данные собирали в режиме DIA (независимый от данных сбор), охватывающем как режим положительных, так и отрицательных ионов, с диапазоном масс 50–1200 m/z. Лейцин-энкефалин использовали в качестве блокирующей массы для точного определения массы, и прибор калибровали с формиатом натрия. Ионно-мобилизационную спектроскопию проводили с использованием дрейфующего газа азота и калибровали с помощью инфузии Major Mix. Все образцы анализировали в одной партии, с QC как минимум каждые 9 образцов. Сырые данные были импортированы в программное обеспечение Progenesis QI v2.0 (Waters, Милфорд, Массачусетс, США), и настройки параметров основывались на нашей библиотеке липидов.
2.8. Определение ALA
Определение ALA проводили по методу, установленному для липидомики в эксперименте по добавлению ALA. Для улучшенного обнаружения использовали бинарную систему растворителей с подвижной фазой А (ACN: вода, 6:4 об/об) и подвижной фазой В (IPA: ACN, 1:1 об/об). На основе RT и m/z стандарта ALA площади пиков были интегрированы с использованием программного обеспечения MassLynx V4.2 (Waters Corporation, Милфорд, Массачусетс, США). Был записан график масс-спектрометрии для определения ALA (Рисунок S1). Впоследствии концентрации ALA в тканях брюшка и мозга были количественно определены с использованием калибровочных кривых, установленных с различными концентрациями стандарта ALA (Рисунок S2).
2.9. Статистический анализ
Липиды, идентифицированные в образцах QC с относительными стандартными отклонениями (RSDs) > 30%, были сначала отсеяны. Оставшиеся данные были импортированы в программное обеспечение SIMCA 14.0 (Umetrics, Швеция) для дискриминантного анализа проекций на латентные структуры (OPLS-DA) и проверочных тестов с 200 перестановками (Рисунки S3 и S4). Значительно изменившиеся липиды определялись по важности переменной в проекции (VIP) > 1, p-значениям < 0,05 и абсолютному значению логарифма кратного изменения > 0. Анализ главных компонент (PCA) и анализ путей на основе базы данных RaMP-DB были построены с использованием MetaboAnalyst (https://www.metaboanalyst.ca/, доступ получен 22 сентября 2024). Конверсия подклассов липидов была предсказана с использованием BioPAN (https://lipidmaps.org/biopan/, доступ получен 23 октября 2024). Статистическая значимость определялась с использованием однофакторного дисперсионного анализа (ANOVA) с последующим множественным сравнением Тьюки с помощью программного обеспечения SPSS Statistics 21 (IBM, Армонк, Нью-Йорк, США). Среднее значение было отмечено буквами a, b и c от максимального до минимального с тестом значимости (p < 0,05). Графики были выполнены с использованием R версии 4.2.0, Origin 2021 (OriginLab, Уэлесли, Массачусетс, США) и Metware cloud (https://cloud.metware.cn/, доступ получен 16 сентября 2024).
3. Результаты
3.1. Липидное профилирование и библиотека липидов
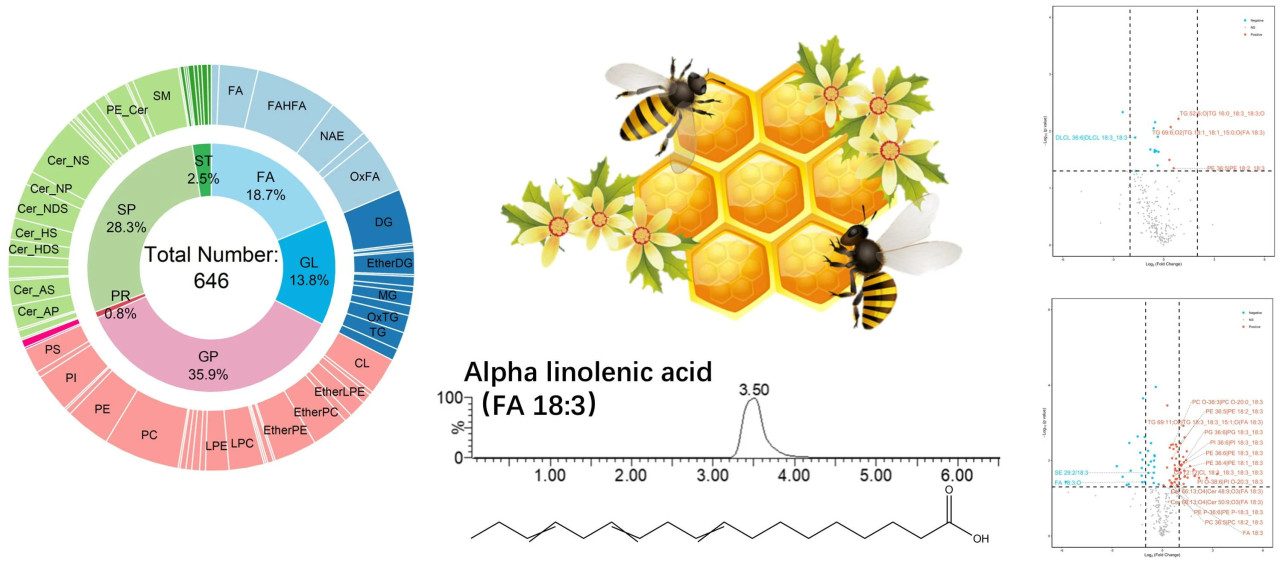
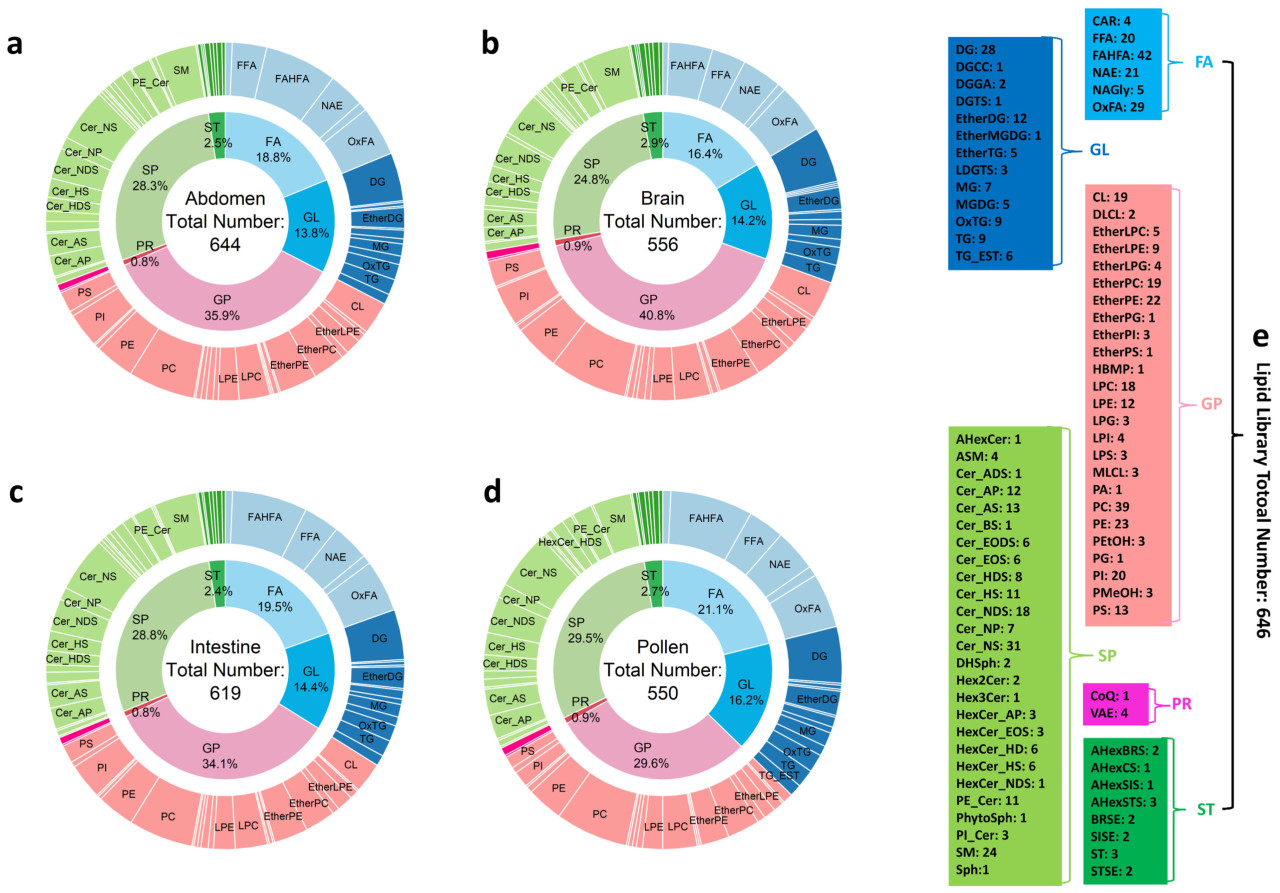
Липидные профили брюшка (Рисунок 1a), мозга (Рисунок 1b), кишечника (Рисунок 1c) рабочих пчел и пыльцы (Рисунок 1d) выявили присутствие 644, 556, 619 и 550 видов липидов соответственно. Была создана комплексная библиотека липидов, включающая в общей сложности 646 видов липидов (Рисунок 1e). Эти липиды были классифицированы по шести классам следующим образом [42]: глицерофосфолипиды (GPs), сфинголипиды (SPs), жирные кислоты (FAs), глицеролипиды (GLs), стероловые липиды (STs) и пренольные липиды (PRs). Среди них GPs были наиболее распространенными (29,6–40,8%), за ними следовали SPs (24,8–29,5%), FAs (16,4–21,1%), GLs (13,8–16,2%), STs (2,4–2,9%) и PRs (0,8–0,9%), которые были наименее представлены (Рисунок 1a–d). Эти результаты указывают на сходство между липидными профилями пыльцы и брюшка, мозга и кишечника рабочих пчел.
Рисунок 1. Липидное профилирование и библиотека липидов. Липидное профилирование брюшка (a), мозга (b) и кишечника (c) рабочих пчел, а также пыльцы (d) и комплексная библиотека липидов (e).
3.2. PCA на основе нетаргетной липидомики
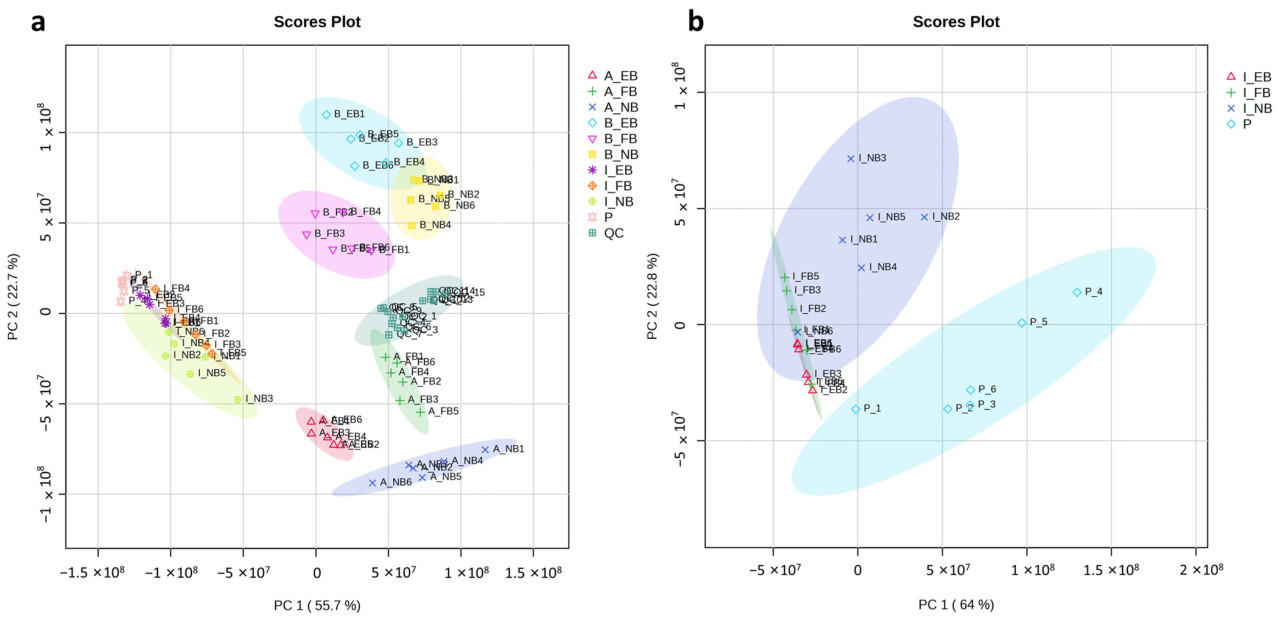
Как показано на Рисунке 2a, сгруппированные QC указывают на надежность данных. Первая главная компонента (PC1) объяснила 55,7% общей дисперсии, разделяя образцы брюшка и мозга, в то время как вторая главная компонента (PC2) добавила еще 22,7% разделения. Рисунок 2b дополнительно демонстрирует четкое различие между образцами кишечника и пыльцы, при этом PC1 объясняет 64% общей дисперсии, а PC2 обеспечивает еще 22,8% разделения. Образцы брюшка, мозга и кишечника рабочих пчел, а также пыльца четко разделены. Примечательно, что образцы брюшка и мозга разделяются в соответствии с периодами EB, NB и FB, что указывает на специфичные для труда липидные профили. И наоборот, образцы кишечника не демонстрируют такой специфичной для труда кластеризации.
Рисунок 2. Графики PCA. (a) График PCA только что вылупившихся пчел (EBs), пчел-кормилиц (NBs) и пчел-фуражиров (FBs) в брюшке (A), мозге (B), кишечнике (I) и пыльце (P). (b) График PCA EBs, NBs и FBs в кишечнике и пыльце.
3.3. Изменения липидов у рабочих пчел в зависимости от разделения труда
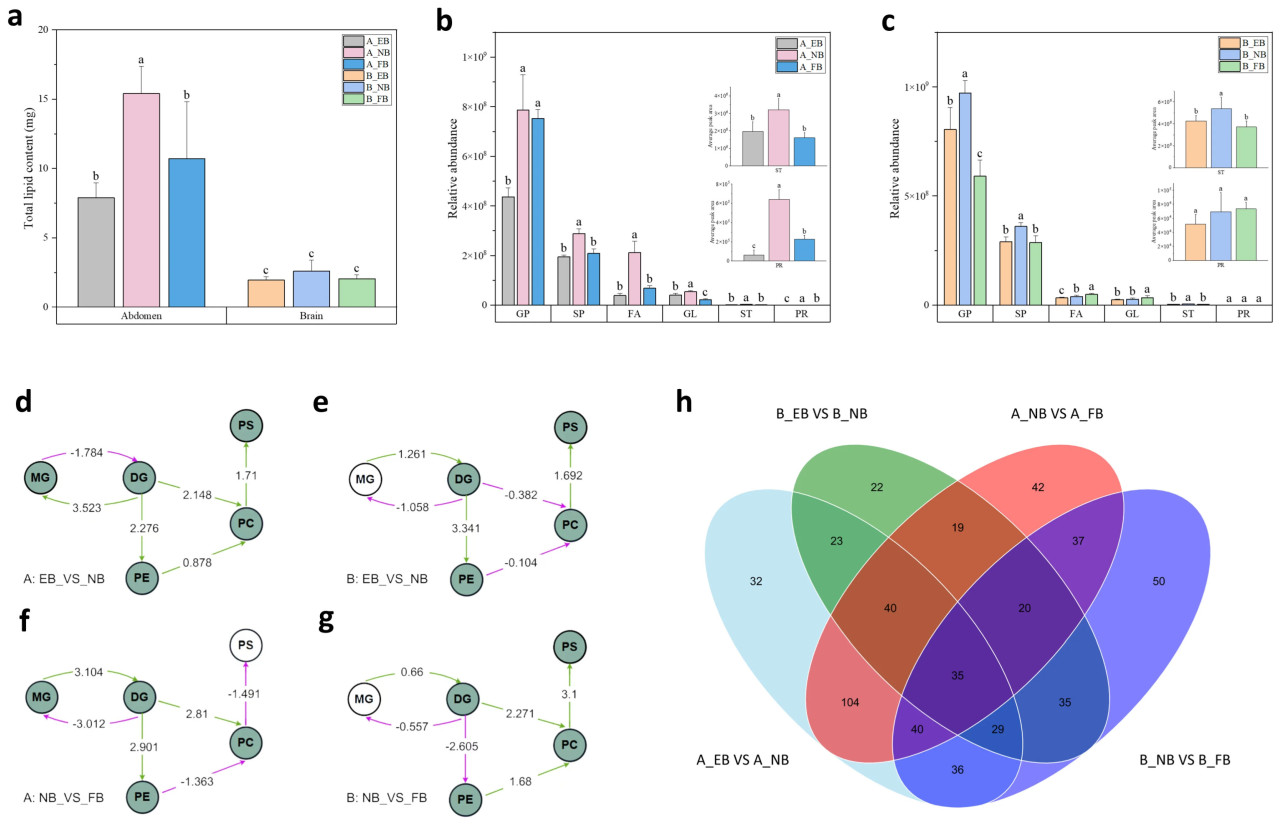
Как показано на Рисунке 3a, брюшко содержит более высокое общее содержание липидов по сравнению с мозгом. Брюшко NB продемонстрировало заметное увеличение общего содержания липидов, что подчеркивает важность накопления липидов в этот период [18,19]. Эта тенденция также очевидна на уровне классов липидов. Все классы липидов, включая GPs, SPs, FAs, GLs, STs и PRs, заметно повышены в брюшке NB (Рисунок 3b), в то время как GPs, SPs и STs достигли пика в мозге NB (Рисунок 3c).
Рисунок 3. Изменения липидов у рабочих пчел в зависимости от разделения труда. Общее содержание липидов (a), относительное обилие классов липидов (b,c), анализ BioPAN подклассов липидов (d–g) и значительно изменившиеся липиды (h) в брюшке (A) и мозге (B) только что вылупившихся пчел (EBs), пчел-кормилиц (NBs) и пчел-фуражиров (FBs). Для (a–c) планки погрешностей представляют стандартные отклонения (n = 6). Среднее значение было отмечено буквами a, b и c от максимального до минимального с тестом значимости (p < 0,05). Для (d–g) заливка означает присутствие, пустой узор означает отсутствие. Зеленая стрелка означает положительную реакцию, фиолетовая стрелка означает отрицательную реакцию. Если абсолютный балл > 1,64, p < 0,05.
Анализ BioPAN выявил значительные трансформации в моноацилглицерине (MG), диацилглицерине (DG), фосфатидилэтаноламине (PE), фосфатидилхолине (PC) и фосфатидилсерине (PS) как в брюшке, так и в мозге на протяжении всего разделения труда (Рисунок 3d–g). Этот результат указывает на то, что эти подклассы липидов характерны для конкретных трудовых ролей. Примечательно, что наблюдалась значительная конверсия между MG и DG в брюшке по сравнению с мозгом. В отличие от тенденций, наблюдаемых в других группах, конверсия PC в PS отсутствовала в группе NB_VS_FB в брюшке. Кроме того, конверсия DG в PC отсутствовала в группе EB_VS_NB в мозге. Между тем, конверсия PE в PC была активной, в то время как конверсия DG в PE была подавлена в группе NB_VS_FB в мозге. Эти результаты иллюстрируют функциональные различия между брюшком и мозгом, что также подтверждается значительно изменившимися липидами (Рисунок 3h). Важно, что 35 идентичных характерных для труда липидов было обнаружено как в брюшке, так и в мозге (Рисунок 3h), что предполагает, что эти липиды могут регулироваться одним и тем же лежащим в основе механизмом.
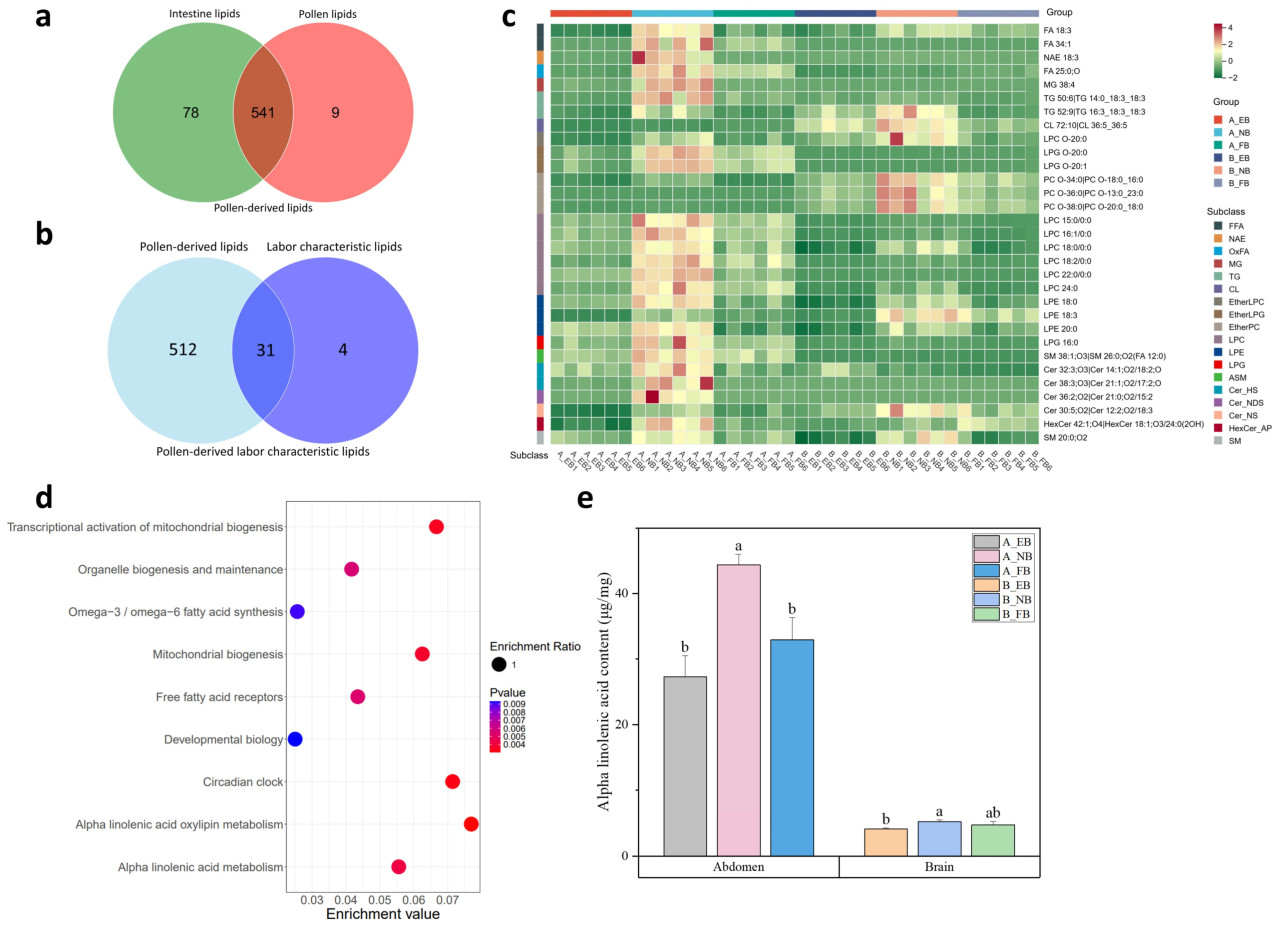
3.4. Происходящие из пыльцы характерные для труда липиды
В пыльце и кишечнике рабочих пчел было идентифицировано в общей сложности 541 идентичных липида (Рисунок 4a). Среди них 31 липид был идентифицирован как происходящий из пыльцы характерный для труда липид (Рисунок 4b,c). Хотя в брюшке и мозге наблюдались различия, эти липиды демонстрировали повышенные уровни в период NB. Это наблюдение объясняет феномен накопления липидов в период NB на молекулярном уровне. Примечательно, что FA 18:3 (альфа-линоленовая кислота, ALA) и ее производные, включая NAE 18:3, TG 50:6|TG 14:0_18:3_18:3, TG 52:9|TG 16:3_18:3_18:3, LPE 18:3 и Cer 30:5; O2|Cer 12:2; O2/18:3, были значительно повышены в период NB (Рисунок 4c). Эти происходящие из пыльцы характерные для труда липиды были обогащены в путях, связанных с развитием и поведением, включая циркадный ритм и биологию развития. Также были обогащены пути, отражающие митохондриальную функцию, включая биогенез митохондрий, биогенез и поддержание органелл, а также транскрипционную активацию биогенеза митохондрий. Метаболизм альфа-линоленовой кислоты, метаболизм оксилипинов альфа-линоленовой кислоты и синтез омега-3/омега-6 жирных кислот показали высокие значения обогащения (Рисунок 4d, Таблица S2). Последующий эксперимент показал, что содержание ALA как в брюшке, так и в мозге достигло наивысшего уровня в период NB (Рисунок 4e).
Рисунок 4. Происходящие из пыльцы характерные для труда липиды. (a) Диаграмма Венна липидов пыльцы и липидов кишечника. (b) Диаграмма Венна липидов, происходящих из пыльцы, и характерных для труда липидов. (c) Тепловая карта, изображающая относительное обилие происходящих из пыльцы характерных липидов в брюшке (A) и мозге (B) только что вылупившихся пчел (EBs), пчел-кормилиц (NBs) и пчел-фуражиров (FBs) (n = 6). (d) Анализ обогащения путей на основе происходящих из пыльцы характерных липидов. (e) Содержание альфа-линоленовой кислоты в брюшке и мозге EBs, NBs и FBs, планки погрешностей представляют стандартные отклонения (n = 3). Среднее значение было отмечено буквами a, ab и b от максимального до минимального с тестом значимости (p < 0,05).
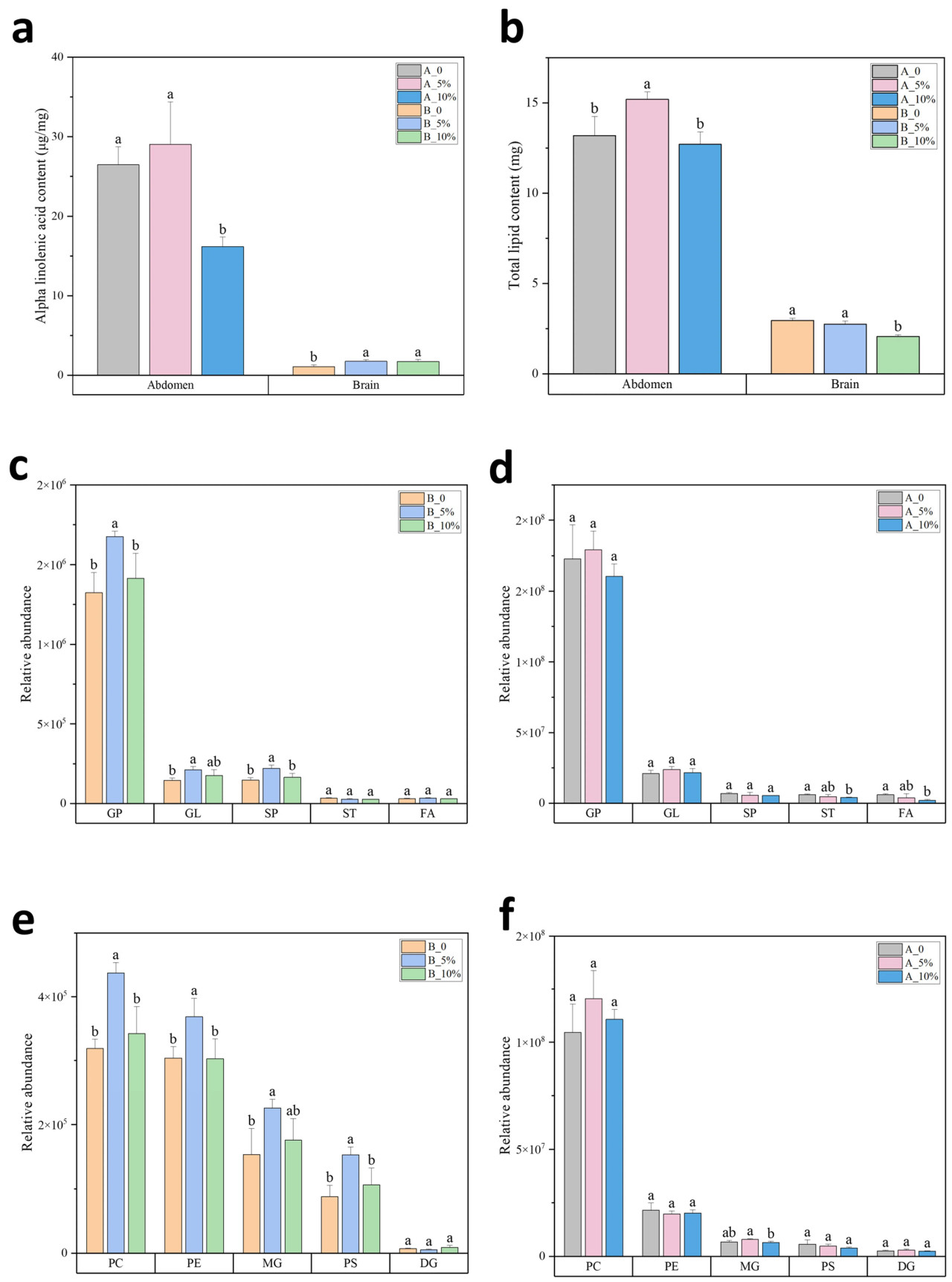
3.5. Добавление ALA в корм изменяет уровни липидов
Не было значительных различий в смертности или потреблении корма между группами с добавлением ALA и контрольной группой (Таблица S1). Содержание ALA у рабочих пчел можно регулировать с помощью пищевых добавок. По сравнению с контрольной группой, обе группы с 5% ALA показали значительное увеличение содержания ALA в мозге; однако группа с 10% ALA показала значительное снижение содержания ALA в брюшке (Рисунок 5a). Кроме того, что касается общего содержания липидов, группа с 5% ALA продемонстрировала значительное увеличение в брюшке, в то время как группа с 10% ALA значительно снизила содержание липидов в мозге (Рисунок 5b). Основываясь на созданной библиотеке липидов, в эксперименте по добавлению ALA в корм с помощью липидомического анализа было идентифицировано в общей сложности 279 видов липидов (Рисунок S5). На уровне классов липидов группа с 5% значительно увеличила GPs, GLs и SPs в мозге (Рисунок 5c), тогда как группа с 10% ALA значительно снизила STs и FAs в брюшке (Рисунок 5d). Что касается уровней характерных для труда подклассов, группа с 5% значительно увеличила PC, PE, MG и PS в мозге (Рисунок 5e). Хотя уровни подклассов липидов брюшка в группе с 5% ALA и группе с 10% ALA не показали значительных изменений по сравнению с контрольной группой, группа с 10% ALA показала значительное снижение уровня MG по сравнению с группой с 5% ALA (Рисунок 5f). Эти результаты предполагают, что добавление ALA изменяет уровни липидов рабочих пчел, причем умеренное добавление ALA (5%) положительно влияет на обилие липидов, тогда как избыточное добавление (10%) отрицательно влияет на обилие липидов.
Рисунок 5. Добавление ALA в корм изменяет уровни липидов. Общее содержание липидов (a), содержание альфа-линоленовой кислоты (b), относительное обилие классов липидов (c,d), относительное обилие подклассов липидов (e,f) в брюшке (A) и мозге (B) только что вылупившихся пчел (EBs), пчел-кормилиц (NBs) и пчел-фуражиров (FBs). Планки погрешностей представляют стандартные отклонения (n = 3). Среднее значение было отмечено буквами a, ab и b от максимального до минимального с тестом значимости (p < 0,05).
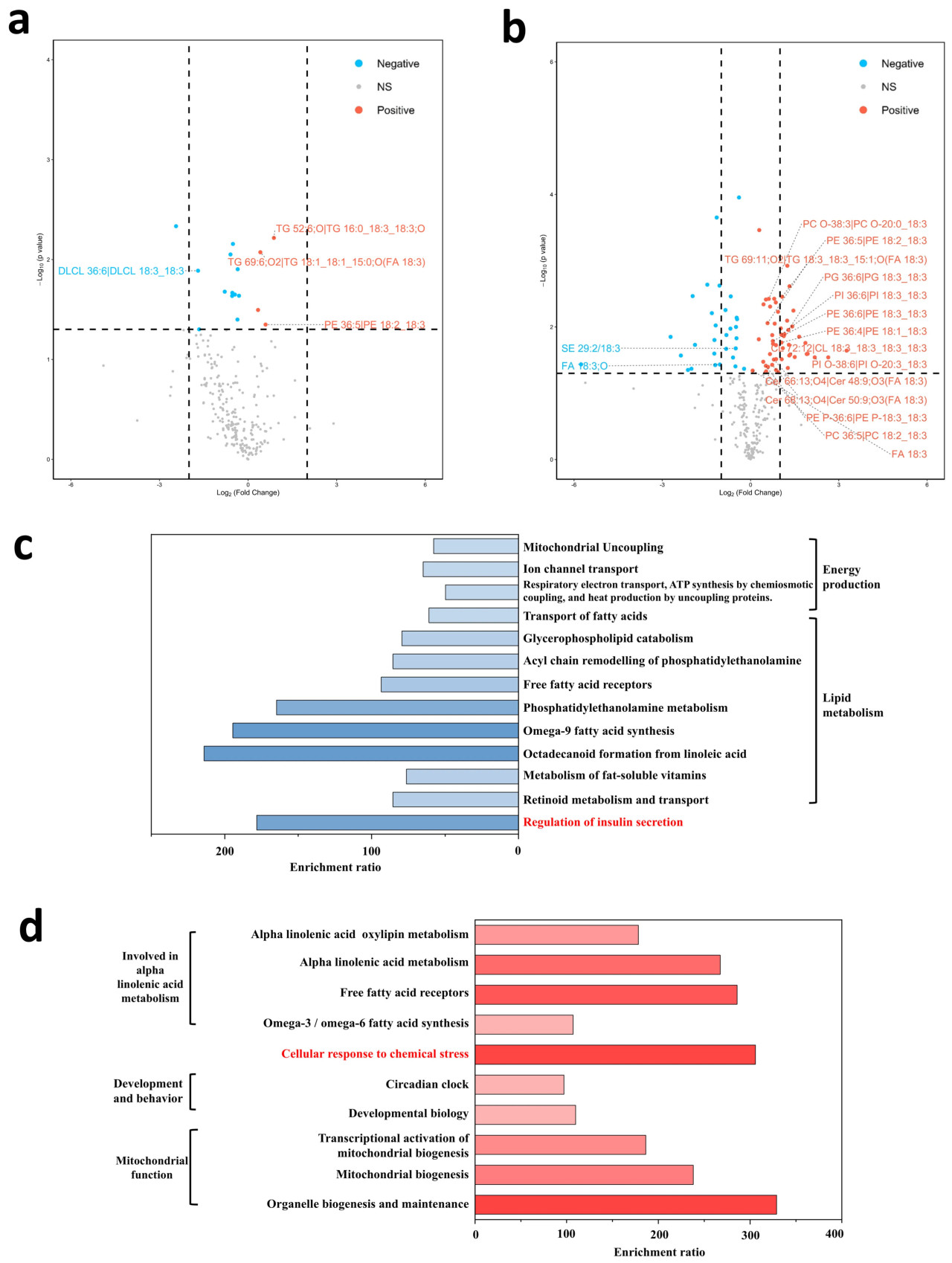
3.6. Умеренное добавление ALA в корм способствует метаболизму, связанному с трудом
Дополнительное 5% добавление ALA привело к значительному снижению 42 липидов и значительному повышению 58 липидов в брюшке (Рисунок 6a) и мозге (Рисунок 6b) рабочих пчел, включая значительные изменения в 20 производных ALA. Сниженные липиды были обогащены в путях, связанных с производством энергии и метаболизмом липидов, а также регуляцией секреции инсулина (Рисунок 6c, Таблица S3). Повышенные липиды были обогащены в путях клеточного ответа на химический стресс (Рисунок 6d, Таблица S4) и были преимущественно связаны с метаболической активностью происходящих из пыльцы характерных для труда липидов, включая метаболизм альфа-линоленовой кислоты, развитие и поведение, а также митохондриальную функцию (Рисунок 4d, Таблица S2). Эти результаты предполагают, что умеренное добавление ALA изменяет липидный метаболизм и способствует метаболизму, связанному с трудом.
Рисунок 6. Умеренное добавление ALA в корм способствует метаболизму, связанному с трудом. Графики вулкано, изображающие значительно изменившиеся липиды в брюшке (a) и мозге (b) группы с 5% ALA. Синие точки данных = виды липидов с p < 0,05 и log2 кратного изменения < 0. Красные точки данных = виды липидов с p < 0,05 и log2 кратного изменения > 0. Анализ обогащения путей на основе значительно сниженных липидов (c) и значительно повышенных липидов (d) группы с 5% ALA.
4. Обсуждение
Разделение труда у рабочих пчел было extensively изучено в транскриптомике [7,8,9] и протеомике [10,11,12]; однако липидомика остается малоисследованной областью в этом отношении. Учитывая значительный объем данных, генерируемых в омиксных исследованиях, включение ложноположительных результатов является распространенной проблемой. Интеграция анализа DDA с анализом DIA повышает точность, разрешение и воспроизводимость масс-спектрометрической идентификации [43]. Поэтому мы впервые применили этот метод для проведения комплексного липидомического анализа рабочих пчел. Ранее Zhang и др. [23] reported 337 видов липидов, обнаруженных в мозге рабочих пчел. В этом исследовании было идентифицировано в общей сложности 556 видов липидов в этих мозгах. Кроме того, были исследованы липидные профили в брюшке и кишечнике рабочих пчел, идентифицировано 644 и 619 видов липидов соответственно. Чтобы изучить влияние пищевых липидов на разделение труда у рабочих пчел, мы также установили липидный профиль пыльцы, который содержит 550 видов липидов. Насколько нам известно, это первое комплексное липидное профилирование, охватывающее брюшко, мозг и кишечник рабочих пчел, а также пыльцу. Соответствующая библиотека липидов состоит в общей сложности из 646 видов липидов. Успех последующего эксперимента по валидации дифференциальных липидов дополнительно подчеркивает надежность и практичность нашей библиотеки липидов и используемых аналитических методов.
Липиды играют ключевую роль в разделении труда у рабочих пчел, особенно в брюшке и мозге. Основным местом хранения липидов является брюшко [41,42], которое демонстрирует стабильный механизм потери липидов [18,19]. Это исследование подтверждает эти более ранние работы и указывает на то, что этот механизм наблюдается во всех идентифицированных классах липидов, включая GPs, SPs, FAs, GLs, STs и PRs. Более того, на уровнях подклассов липидов, MG и DG необходимы для синтеза триглицеридов [16] и продемонстрировали значительную положительную трансформацию в брюшке, подчеркивая тенденцию к накоплению липидов в этой области. Мозг, который регулирует поведение рабочих пчел как центральная нервная система, также демонстрирует липидную пластичность, связанную с разделением труда [23]. Это отражается в активном метаболизме важных фосфолипидов, таких как PC и PS, которые облегчают трансдукцию сигнала [17].
Липиды, присутствующие в брюшке и мозге медоносных пчел, преимущественно происходят из липидов пыльцы после переваривания и всасывания в кишечнике [28,29,30,31,32]. В настоящем исследовании пропорции липидов, наблюдаемые в брюшке, мозге и кишечнике рабочих пчел, сходны с пропорциями, обнаруженными в потребляемой ими пыльце. Более того, мы идентифицировали 541 идентичный вид липидов между липидами кишечника (619 видов) и липидами пыльцы (550 видов). Примечательно, что это перекрытие включает 31 липид, который соответствует характерным для труда липидам (35 видов). Эти результаты указывают на то, что пыльца является основным источником пищевых липидов и, вероятно, обеспечивает рабочих пчел характерными для труда липидами.
ALA является незаменимой омега-3 жирной кислотой, которую медоносные пчелы должны получать с пищей [34]. Arien и др. [35] продемонстрировали, что на уровни ALA в брюшке и мозге рабочих пчел влияет содержание ALA в пыльце. Это исследование подтвердило, что дополнительное добавление ALA также может изменить уровни ALA у рабочих пчел. Сообщалось, что умеренные уровни ALA в корме улучшают способность к обучению [35], репродуктивную функцию и продуктивные признаки [17,40] у медоносных пчел. Это исследование показывает, что умеренное добавление повысило уровни общих липидов, классов липидов и подклассов липидов, что согласуется со свойствами накопления липидов у NB. Кроме того, метаболизм, связанный с производством энергии, катаболизмом глицерофосфолипидов, ремоделированием ацильных цепей фосфатидилэтаноламина и метаболизмом фосфатидилэтаноламина, был значительно снижен после умеренного добавления ALA. Это снижение объясняет наблюдаемое накопление липидов.
Zhang и др. [23] ранее обнаружили, что ALA и ее производные в мозге рабочих пчел демонстрируют трудовые особенности. В этом исследовании ALA и ее производные также были идентифицированы как происходящие из пыльцы характерные для труда липиды. Однако конкретные типы производных ALA различались в двух исследованиях, что предполагает, что трудовые характеристики, связанные с этими производными, вероятно, проявляются через метаболизм ALA. Это было подтверждено умеренным добавлением ALA, которое значительно изменило уровни множества производных ALA как в брюшке, так и в мозге рабочих пчел. Важно, что после умеренного добавления ALA метаболические пути происходящих из пыльцы характерных для труда липидов, в частности метаболизм альфа-линоленовой кислоты, метаболизм оксилипинов альфа-линоленовой кислоты и синтез омега-3/омега-6 жирных кислот, были значительно активированы. Пчелиные колонии сталкиваются с многочисленными стрессорами, влияющими на поведение [44]. Умеренное добавление ALA значительно усилило клеточный ответ на химический стресс, тем самым благоприятствуя способности колонии поддерживать гомеостаз в условиях стресса, что выгодно для разделения труда. Примечательно, что умеренное добавление ALA также привело к снижению регуляции секреции инсулина. Инсулин участвует в сигнальном пути инсулина/инсулиноподобного фактора роста (IIS), на который влияет пищевая среда [45]. Согласно Ament и др. [46], IIS может регулировать разделение труда у рабочих пчел, причем NBs демонстрируют более высокие уровни пищевых запасов, но сниженную продукцию инсулина и восприимчивость к нему по сравнению с FBs. Это указывает на то, что умеренное добавление ALA может действовать через пищевую добавку, тем самым модулируя путь IIS и в конечном итоге достигая характерных высоких уровней липидов, наблюдаемых у NBs.
5. Вывод
Это исследование представляет первое комплексное липидное профилирование EBs, NBs и FBs, включая их брюшко, мозг, кишечник и пыльцу, идентифицирующее 646 видов липидов. Поразительное сходство между липидными профилями пыльцы и рабочих пчел подчеркивает потенциальное регулирующее влияние пищевых липидов на распределение задач. ALA была идентифицирована как ключевой происходящий из пыльцы характерный для труда липид, и этот вывод был подтвержден экспериментально. Умеренное добавление ALA изменило липидный метаболизм у рабочих пчел и способствовало их переходу к характерным уровням липидов NBs. Это открытие расширяет понимание молекулярной основы разделения труда у рабочих пчел и предоставляет новый взгляд на нутриционные добавки в пчеловодстве.
Дополнительные материалы
Следующую вспомогательную информацию можно загрузить по адресу: https://www.mdpi.com/article/10.3390/agriculture15030272/s1, Рисунок S1: График масс-спектрометрии определения ALA; Рисунок S2: Стандартная кривая концентрации ALA; Рисунок S3: OPLS-DA и проверочный тест для изменений липидов рабочих пчел; Рисунок S4: OPLS-DA и проверочный тест для эксперимента по добавлению ALA в корм; Рисунок S5: Липиды, идентифицированные в эксперименте по добавлению ALA в корм; Таблица S1: Смертность и потребление корма в эксперименте по добавлению ALA в корм; Таблица S2: Пути происходящих из пыльцы характерных для труда липидов на основе базы данных RaMP-DB; Таблица S3: Пути обогащения значительно сниженных липидов на основе базы данных RaMP-DB в группе с 5% ALA; Таблица S4: Пути обогащения значительно повышенных липидов на основе базы данных RaMP-DB в группе с 5% ALA.
Список сокращений
В этой рукописи используются следующие сокращения:
ALA Альфа-линоленовая кислота
EBs Только что вылупившиеся пчелы
NBs Пчелы-кормилицы
FBs Пчелы-фуражиры
GPs Глицерофосфолипиды
SPs Сфинголипиды
FAs Жирные кислоты
GLs Глицеролипиды
STs Стероловые липиды
PRs Пренольные липиды
MG Моноацилглицерин
DG Диацилглицерин
PE Фосфатидилэтаноламин
PC Фосфатидилхолин
PS Фосфатидилсерин
Ссылки
1. Layek, U.; Bhandari, T.; Das, A.; Karmakar, P. Floral visitors of sesame (Sesamum indicum L.): Elucidating their nectar-robbing behaviour and impacts on the plant reproduction. PLoS ONE 2024, 19, e0300398. [Google Scholar] [CrossRef] [PubMed]
2. Varma, S.; Sinu, P.A. Nectar robbing in bellflower (Sesamum radiatum) benefited pollinators but unaffected maternal function of plant reproduction. Sci. Rep. 2019, 9, 8357. [Google Scholar] [CrossRef]
3. Beshers, S.N.; Fewell, J.H. Models of Division of Labor in Social Insects. Annu. Rev. Entomol. 2001, 46, 413–440. [Google Scholar] [CrossRef] [PubMed]
4. Omholt, S.W.; Amdam, G.V. Epigenetic Regulation of Aging in Honeybee Workers. Sci. Aging Knowl. Environ. 2004, 2004, e28. [Google Scholar] [CrossRef] [PubMed]
5. Page, R.E.; Peng, C.Y. Aging and Development in Social Insects with Emphasis on the Honey Bee, Apis mellifera L. Exp. Gerontol. 2001, 36, 695–711. [Google Scholar] [CrossRef]
6. Rueppell, O.; Bachelier, C.; Fondrk, M.K.; Page, R.E. Regulation of Life History Determines Lifespan of Worker Honey Bees (Apis mellifera L.). Exp. Gerontol. 2007, 42, 1020–1032. [Google Scholar] [CrossRef] [PubMed]
7. Hamilton, A.R.; Traniello, I.M.; Ray, A.M.; Caldwell, A.S.; Wickline, S.A.; Robinson, G.E. Division of Labor in Honey Bees Is Associated with Transcriptional Regulatory Plasticity in the Brain. J. Exp. Biol. 2019, 222, jeb200196. [Google Scholar] [CrossRef]
8. Stuart, S.H.; Ahmed, A.C.C.; Kilikevicius, L.; Robinson, G.E. Effects of microRNA-305 Knockdown on Brain Gene Expression Associated with Division of Labor in Honey Bee Colonies (Apis mellifera). J. Exp. Biol. 2024, 227, jeb246785. [Google Scholar] [CrossRef] [PubMed]
9. Whitfield, C.W.; Ben-Shahar, Y.; Brillet, C.; Leoncini, I.; Crauser, D.; Leconte, Y.; Rodriguez-Zas, S.; Robinson, G.E. Genomic Dissection of Behavioral Maturation in the Honey Bee. Proc. Natl. Acad. Sci. USA 2006, 103, 16068–16075. [Google Scholar] [CrossRef]
10. Fang, Y.; Feng, M.; Ma, C.; Rueppell, O.; Li, J. Major Royal Jelly Proteins Influence the Neurobiological Regulation of the Division of Labor among Honey Bee Workers. Int. J. Biol. Macromol. 2023, 225, 848–860. [Google Scholar] [CrossRef] [PubMed]
11. Hora, Z.A.; Altaye, S.Z.; Wubie, A.J.; Li, J. Proteomics Improves the New Understanding of Honeybee Biology. J. Agric. Food Chem. 2018, 66, 3605–3615. [Google Scholar] [CrossRef]
12. Stabler, D.; Al-Esawy, M.; Chennells, J.A.; Perri, G.; Robinson, A.; Wright, G.A. Regulation of Dietary Intake of Protein and Lipid by Nurse-Age Adult Worker Honeybees. J. Exp. Biol. 2021, 224, jeb230615. [Google Scholar] [CrossRef]
13. Huang, Z.Y.; Robinson, G.E.; Borst, D.W. Physiological Correlates of Division of Labor among Similarly Aged Honey Bees. J. Comp. Physiol. A 1994, 174, 731–739. [Google Scholar] [CrossRef] [PubMed]
14. Pandey, A.; Bloch, G. Juvenile Hormone and Ecdysteroids as Major Regulators of Brain and Behavior in Bees. Curr. Opin. Insect Sci. 2015, 12, 26–37. [Google Scholar] [CrossRef]
15. Sullivan, J.P.; Fahrbach, S.E.; Robinson, G.E. Juvenile Hormone Paces Behavioral Development in the Adult Worker Honey Bee. Horm. Behav. 2000, 37, 1–14. [Google Scholar] [CrossRef] [PubMed]
16. Soulages, J.L.; Wu, Z.; Firdaus, S.J.; Mahalingam, R.; Arrese, E.L. Monoacylglycerol and Diacylglycerol Acyltransferases and the Synthesis of Neutral Glycerides in Manduca sexta. Insect Biochem. Mol. Biol. 2015, 62, 194–210. [Google Scholar] [CrossRef]
17. Choudhary, R.C.; Kuschner, C.E.; Kazmi, J.; Mcdevitt, L.; Espin, B.B.; Essaihi, M.; Nishikimi, M.; Becker, L.B.; Kim, J. The Role of Phospholipid Alterations in Mitochondrial and Brain Dysfunction after Cardiac Arrest. Int. J. Mol. Sci. 2024, 25, 4645. [Google Scholar] [CrossRef]
18. Toth, A.L.; Robinson, G.E. Worker Nutrition and Division of Labour in Honeybees. Anim. Behav. 2005, 69, 427–435. [Google Scholar] [CrossRef]
19. Toth, A.L.; Kantarovich, S.; Meisel, A.F.; Robinson, G.E. Nutritional Status Influences Socially Regulated Foraging Ontogeny in Honey Bees. J. Exp. Biol. 2005, 208, 4641–4649. [Google Scholar] [CrossRef] [PubMed]
20. Furse, S.; Martel, C.; Willer, D.F.; Stabler, D.; Fernandez-Twinn, D.S.; Scott, J.; Patterson-Cross, R.; Watkins, A.J.; Virtue, S.; Prescott, T.A.K.; et al. Systemic Analysis of Lipid Metabolism from Individuals to Multi-Organism Systems. Mol. Omics 2024, 20, 570–583. [Google Scholar] [CrossRef] [PubMed]
21. Hu, X.; Zhang, W.; Chi, X.; Wang, H.; Liu, Z.; Wang, Y.; Ma, L.; Xu, B. Non-Targeted Lipidomics and Transcriptomics Analysis Reveal the Molecular Underpinnings of Mandibular Gland Development in Apis mellifera Ligustica. Dev. Biol. 2021, 479, 23–36. [Google Scholar] [CrossRef]
22. Morfin, N.; Fillier, T.A.; Pham, T.H.; Goodwin, P.H.; Thomas, R.H.; Guzman-Novoa, E. First Insights into the Honey Bee (Apis mellifera) Brain Lipidome and Its Neonicotinoid-Induced Alterations Associated with Reduced Self-Grooming Behavior. J. Adv. Res. 2022, 37, 75–89. [Google Scholar] [CrossRef] [PubMed]
23. Zhang, X.; Hao, Y.; Niu, Q.; Chen, Y.; Xia, Z.; Xie, Z.; Zhao, Y.; Kong, L.; Peng, W. Division of Labor among Worker Bees Is Associated with the Lipidomic Plasticity in Their Brains. Agriculture 2022, 12, 952. [Google Scholar] [CrossRef]
24. Arien, Y.; Dag, A.; Yona, S.; Tietel, Z.; Lapidot Cohen, T.; Shafir, S. Effect of Diet Lipids and Omega-6:3 Ratio on Honey Bee Brood Development, Adult Survival and Body Composition. J. Insect Physiol. 2020, 124, 104074. [Google Scholar] [CrossRef] [PubMed]
25. Al-Kahtani, S.N.; Taha, E.-K.A.; Farag, S.A.; Taha, R.A.; Abdou, E.A.; Mahfouz, H.M. Harvest Season Significantly Influences the Fatty Acid Composition of Bee Pollen. Biology 2021, 10, 495. [Google Scholar] [CrossRef] [PubMed]
26. Giampieri, F.; Quiles, J.L.; Cianciosi, D.; Forbes-Hernández, T.Y.; Orantes-Bermejo, F.J.; Alvarez-Suarez, J.M.; Battino, M. Bee Products: An Emblematic Example of Underutilized Sources of Bioactive Compounds. J. Agric. Food Chem. 2022, 70, 6833–6848. [Google Scholar] [CrossRef] [PubMed]
27. Bennett, M.M.; Welchert, A.C.; Carroll, M.; Shafir, S.; Smith, B.H.; Corby-Harris, V. Unbalanced Fatty Acid Diets Impair Discrimination Ability of Honey Bee Workers to Damaged and Healthy Brood Odors. J. Exp. Biol. 2022, 225, jeb244103. [Google Scholar] [CrossRef]
28. Bryś, M.S.; Skowronek, P.; Strachecka, A. Pollen Diet—Properties and Impact on a Bee Colony. Insects 2021, 12, 798. [Google Scholar] [CrossRef]
29. Turunen, S. Digestion and Absorption of Lipids in Insects. Comp. Biochem. Physiol. A Physiol. 1979, 63, 455–460. [Google Scholar] [CrossRef]
30. Downer, R.G.H.; Matthews, J.R. Patterns of Lipid Distribution and Utilisation in Insects. Am. Zool. 1976, 16, 733–745. [Google Scholar] [CrossRef]
31. Roma, G.C.; Bueno, O.C.; Camargo-Mathias, M.I. Morpho-Physiological Analysis of the Insect Fat Body: A Review. Micron 2010, 41, 395–401. [Google Scholar] [CrossRef] [PubMed]
32. Skowronek, P.; Wójcik, Ł.; Strachecka, A. Fat Body-Multifunctional Insect Tissue. Insects 2021, 12, 547. [Google Scholar] [CrossRef]
33. Wegener, J.; Krause, S.; Parafianczuk, V.; Chaniotakis, I.; Schiller, J.; Dannenberger, D.; Engel, K.M. Lipidomic Specializations of Honeybee (Apis mellifera) Castes and Ethotypes. J. Insect Physiol. 2022, 142, 104439. [Google Scholar] [CrossRef] [PubMed]
34. Hulbert, A.J.; Abbott, S.K. Nutritional Ecology of Essential Fatty Acids: An Evolutionary Perspective. Aust. J. Zool. 2011, 59, 369. [Google Scholar] [CrossRef]
35. Arien, Y.; Dag, A.; Zarchin, S.; Masci, T.; Shafir, S. Omega-3 Deficiency Impairs Honey Bee Learning. Proc. Natl. Acad. Sci. USA 2015, 112, 15761–15766. [Google Scholar] [CrossRef] [PubMed]
36. Elizabeth Deeter, M.; Snyder, L.A.; Meador, C.; Corby-Harris, V. Accelerated Abdominal Lipid Depletion from Pesticide Treatment Alters Honey Bee Pollen Foraging Strategy, but Not Onset, in Worker Honey Bees. J. Exp. Biol. 2023, 226, jeb245404. [Google Scholar] [CrossRef]
37. Tilocca, B.; Greco, V.; Piras, C.; Ceniti, C.; Paonessa, M.; Musella, V.; Bava, R.; Palma, E.; Morittu, V.M.; Spina, A.A.; et al. The Bee Gut Microbiota: Bridging Infective Agents Potential in the One Health Context. Int. J. Mol. Sci. 2024, 25, 3739. [Google Scholar] [CrossRef]
38. Wang, Z.; Li, X.; Wang, T.; Liao, G.; Gu, J.; Hou, R.; Qiu, J. Lipidomic Profiling Study on Neurobehavior Toxicity in Zebrafish Treated with Aflatoxin B1. Sci. Total Environ. 2023, 898, 165553. [Google Scholar] [CrossRef]
39. Gowda, S.G.B.; Minami, Y.; Gowda, D.; Chiba, H.; Hui, S.-P. Detection and Characterization of Lipids in Eleven Species of Fish by Non-Targeted Liquid Chromatography/Mass Spectrometry. Food Chem. 2022, 393, 133402. [Google Scholar] [CrossRef] [PubMed]
40. Jorjani, R.; Ghaffari, M.; Pirsa, S.; Babaei, S. Effect of Alpha-Linolenic Acid on Some Productive and Reproductive Traits of the Iranian Bee (Apis mellifara Meda). J. Apic. Res. 2023, 62, 287–293. [Google Scholar] [CrossRef]
41. Ma, L.; Wang, Y.; Hang, X.; Wang, H.; Yang, W.; Xu, B. Nutritional Effect of Alpha-Linolenic Acid on Honey Bee Colony Development (Apis mellifera L.). J. Apic. Sci. 2015, 59, 63–72. [Google Scholar] [CrossRef]
42. Liebisch, G.; Fahy, E.; Aoki, J.; Dennis, E.A.; Durand, T.; Ejsing, C.S.; Fedorova, M.; Feussner, I.; Griffiths, W.J.; Köfeler, H.; et al. Update on LIPID MAPS Classification, Nomenclature, and Shorthand Notation for MS-Derived Lipid Structures. J. Lipid Res. 2020, 61, 1539–1555. [Google Scholar] [CrossRef] [PubMed]
43. Xin, L.; Qiao, R.; Chen, X.; Tran, H.; Pan, S.; Rabinoviz, S.; Bian, H.; He, X.; Morse, B.; Shan, B.; et al. A Streamlined Platform for Analyzing Tera-Scale DDA and DIA Mass Spectrometry Data Enables Highly Sensitive Immunopeptidomics. Nat. Commun. 2022, 13, 3108. [Google Scholar] [CrossRef]
44. Perry, C.J.; Søvik, E.; Myerscough, M.R.; Barron, A.B. Rapid Behavioral Maturation Accelerates Failure of Stressed Honey Bee Colonies. Proc. Natl. Acad. Sci. USA 2015, 112, 3427–3432. [Google Scholar] [CrossRef]
45. Gumeni, S.; Lamprou, M.; Evangelakou, Z.; Manola, M.S.; Trougakos, I.P. Sustained Nrf2 Overexpression-Induced Metabolic Deregulation Can Be Attenuated by Modulating Insulin/Insulin-like Growth Factor Signaling. Cells 2023, 12, 2650. [Google Scholar] [CrossRef] [PubMed]
46. Ament, S.A.; Corona, M.; Pollock, H.S.; Robinson, G.E. Insulin Signaling Is Involved in the Regulation of Worker Division of Labor in Honey Bee Colonies. Proc. Natl. Acad. Sci. USA 2008, 105, 4226–4231. [Google Scholar] [CrossRef] [PubMed]
Zeng Q, Zong D, Li X, Zhang Z, Qiu J. Lipidomics Reveals Dietary Alpha Linolenic Acid Facilitates Metabolism Related to Division of Labor in Honeybee Workers. Agriculture. 2025; 15(3):272. https://doi.org/10.3390/agriculture15030272
Перевод статьи «Lipidomics Reveals Dietary Alpha Linolenic Acid Facilitates Metabolism Related to Division of Labor in Honeybee Workers» авторов Zeng Q, Zong D, Li X, Zhang Z, Qiu J., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
Фото: freepik






























































































Комментарии (0)