Мелатонин: обзор процессов синтеза и его многочисленных биоактивных ролей в организме животных и человека
Мелатонин — это естественный гормон, синтезируемый главным образом шишковидной железой (эпифизом) позвоночных и, во вторую очередь, другими тканями и органами. Он считается биоактивной молекулой благодаря множеству ролей и функций, которые выполняет в организме животных и человека. Исследования, проведенные к 2024 году, также подтвердили наличие мелатонина у широкого круга растений и бактерий. Цель данного обзора — собрать некоторые научные данные для выявления и описания основных источников мелатонина, а также задокументировать функции и роли, которые он выполняет в организмах животных.
Аннотация
В обзоре также приводится описание основных технологических и пищевых факторов, которые могут положительно или отрицательно влиять на процесс синтеза и секреции мелатонина, который впоследствии транспортируется из организма животных в некоторые пищевые продукты, такие как молоко. Данная статья также включает информацию о взаимодействии между мелатонином и другими биоактивными соединениями, присутствующими в организме животных и человека, с целью выяснить, какие еще функции и роли выполняет этот гормон и взаимодействует ли он с другими веществами, присутствующими в организме позвоночных.
1. Введение
Мелатонин, также известный под своим химическим названием N-ацетил-5-метокситриптамин [1], представляет собой естественный гормон, синтезируемый и секретируемый в основном шишковидной железой (эпифизом) млекопитающих [2], образующийся из лимитирующей незаменимой аминокислоты триптофана [3,4], который выполняет множество ролей и функций как в организме животных, так и человека. Мелатонин является эндогенным индоламином [5], впервые обнаруженным в 1958 году в шишковидной железе крупного рогатого скота [6]; впервые он был выделен в 1960 году [7] и известен как гормон темноты или гормон сна благодаря тому, что секреция мелатонина происходит как автоматическая реакция организмов на отсутствие света [8,9].
Шишковидная железа — это эндокринная железа, расположенная на третьем желудочке головного мозга всех позвоночных, и ее основная функция заключается в выработке и секреции мелатонина [10,11,12].
Определение циркадных ритмов у позвоночных осуществляется внутренними биологическими часами, которые состоят из сетчатки, гипоталамуса и шишковидной железы. Благодаря фоторецепторам сетчатки, головного мозга и шишковидной железы, эти три компонента (сетчатка, гипоталамус и шишковидная железа) синхронизируются со световыми циклами [13]. Шишковидная железа является органом, характерным для позвоночных, присутствуя в организме всех млекопитающих, включая организм человека [14], а также у птиц [15] и рыб [16]. Благодаря специализированным исследованиям, мелатонин был обнаружен и в других формах жизни, не имеющих шишковидной железы, а также сообщалось о его присутствии у некоторых видов микроорганизмов [17].
Мелатонин — это биоактивная молекула, которая участвует в регуляции сна [18] и циркадного ритма [19], а также выполняет антиоксидантные [20], противовоспалительные [21,22], иммуномодулирующие [23], антивозрастные, антиканцерогенные [24,25] и антиапоптотические функции, будучи способным регулировать апоптоз [26,27,28], и улучшает иммунную активность в организмах [29].
Термин «биоактивная молекула» (биоактивное соединение) — это понятие, определение которого в 2024 году все еще обсуждается и дискутируется, поскольку мнения различных авторов разделились на две сферы классификации этих веществ [30]. Некоторые исследователи определяют биоактивные молекулы как вещества с положительной или отрицательной биологически активной ролью, на которую влияют природа биоактивного соединения и количество молекул, доступных в источниках поступления этих биологически активных веществ (потребление пищевых биоактивных молекул). Другие авторы строго подчеркивают, что вещество можно считать биоактивной молекулой, только если оно выполняет исключительно положительную роль в организме, на который оказывает свое действие [31,32].
Основываясь на обзоре литературы, мы определили биоактивные молекулы как вещества пищевого происхождения, обладающие биологически активной ролью, выполняющие множество ролей и функций в организме животных и человека, такие как регуляция циркадного ритма, нормальное и гармоничное развитие физиологических процессов роста и развития организма, поддержание здоровья позвоночных и т.д. Эти вещества с биоактивной ролью широко распространены в природе и встречаются во множестве источников, включая сырье и готовые пищевые продукты. С химической точки зрения они классифицируются как соединения, отличные от питательных веществ, содержащихся в пище. С биологической точки зрения эти вещества выполняют исключительно положительную роль в организме животных и/или человека, действуя либо индивидуально, либо в синергетической связи с другими молекулами, присутствующими в организме позвоночного [30,31,32].
2. Синтез и секреция мелатонина
Мелатонин с химической формулой C13H16N2O2 может синтезироваться и секретироваться у позвоночных в процессе гидроксилирования, декарбоксилирования, ацетилирования и метоксилирования [4,5]. Физически мелатонин в чистом виде представляет собой бесцветный порошок с беловатым оттенком. Плотность мелатонина составляет 1,175 г/см³, молярная масса — 232,28 г/моль, а температура кипения достигается при +512,8 °C. Температура плавления мелатонина находится в пределах теплового диапазона +116,5–+118 °C [7].
С физиологической точки зрения, мелатонин может секретироваться в организме животных и человека двумя путями: эпифизарным (через шишковидную железу) и внеэпифизарным — в других органах и тканях организма. В организме позвоночных на внеэпифизарном уровне секретируется гораздо большее количество мелатонина по сравнению с уровнем мелатонина, секретируемого исключительно шишковидной железой. Однако было отмечено, что количественный уровень мелатонина, секретируемого внеэпифизарно, не может компенсировать или заменить роль, выполняемую мелатонином, секретируемым шишковидной железой, с точки зрения регуляции циркадного ритма и улучшения качества сна. По сравнению с эпифизарным мелатонином, который имеет четко установленный циркадный ритм, мелатонин, секретируемый на внеэпифизарном уровне, не выделяется в кровь, действуя только локально, на уровне тканей и органов, которые его производят, и не имеет циркадного паттерна секреции [1]. Помимо внутриэпифизарных и внеэпифизарных источников секреции мелатонина, у позвоночных существуют еще два источника этого гормона, а именно: кишечная микробиота и поступление с пищей [4]. Таким образом, потребляя пищевые продукты, богатые мелатонином, полученным в результате синтеза и естественной секреции, можно повысить уровень циркулирующего мелатонина в организме, что приведет к улучшению здоровья людей благодаря проявлению многочисленных ролей и функций, которые мелатонин может выполнять в организме человека.
Эпифизарный и внеэпифизарный мелатонин имеют одинаковую химическую структуру и выполняют схожие роли в организме животных и человека, но имеют разные источники происхождения (Рисунок 1). В организме животных и человека как эпифизарный, так и внеэпифизарный мелатонин играют антиоксидантную роль, устраняя свободные радикалы [33], а также выполняют функции в модуляции воспалительных реакций на кишечном уровне [34].
Рисунок 1. Органы и ткани, в которых может синтезироваться мелатонин в организме животных и человека. мелатонин эпифизарного происхождения; мелатонин внеэпифизарного происхождения.
Acuña-Castroviejo и др. (2014) [33] предположили, что отсутствие индуцированных фотопериодом вариаций в процессе синтеза и секреции внеэпифизарного мелатонина обусловлено существованием различных путей синтеза этого гормона на внеэпифизарном уровне по сравнению с мелатонином, синтезируемым и секретируемым исключительно шишковидной железой. Эти различия, наблюдаемые в процессе синтеза внеэпифизарного мелатонина, могут быть связаны с состояниями адаптивности в организме, участвующими в выживании клеток. Примером, предложенным Acuña-Castroviejo и др. (2014) [33], является антиоксидантный эффект мелатонина, достигаемый за счет нейтрализации активных форм кислорода (АФК) и активных форм азота (АФА). Продукция АФК и АФА происходит в основном во время фаз метаболической, двигательной и нервной активности, когда потребление кислорода максимально как в организме животных, так и человека [33]. Таким образом, в случае дневных видов животных, которые потребляют наибольшее количество кислорода в течение дня, синхронизация организма с условиями окружающей среды и с физиологическими процессами, которые более интенсивны в дневное время, приводящая к выработке больших количеств АФК и АФА, могла бы представлять собой эволюционный фактор, обусловивший адаптацию организма через установление процесса синтеза внеэпифизарного мелатонина, не зависящего от суточных вариаций и обеспечивающего мощный защитный механизм для выживания клеток.
Мелатонин обладает очень низкой токсичностью и в относительно высоких дозах, благодаря своим оптимальным размерам, способен легко преодолевать физиологические барьеры. N-ацетил-5-метокситриптамин (мелатонин) обладает амфифильным характером, частично растворим в воде и хорошо растворим в липидах [35].
2.1. Мелатонин эпифизарного происхождения
Эпифизарный синтез и секреция мелатонина начинается с помощью норадреналина, который является основным нейромедиатором, участвующим в активации группы эпифизарных ферментов, особенно N-ацетилтрансферазы. Эта активация группы эпифизарных ферментов обусловлена путями цАМФ (циклический аденозинмонофосфат) и цГМФ (циклический гуанозинмонофосфат), которые способствуют активации рецепторов альфа1 (α1), альфа2 (α2) и бета1 (β1), расположенных на мембране пинеалоцитов [36].
Синтез мелатонина (Рисунок 2) представляет собой последовательный процесс, состоящий из четырех фаз/этапов [37], и начинается с первой фазы с превращения триптофана в 5-гидрокситриптофан — превращение, которое происходит благодаря действию фермента триптофангидроксилазы (ТГ). Впоследствии 5-гидрокситриптофан превращается в серотонин (5-НТ), и после превращения серотонин подвергается процессу N-ацетилирования в результате действия арилалкиламин-N-ацетилтрансферазы (AANAT), образуя NAS (N-ацетилсеротонин). На последнем этапе N-ацетилсеротонин превращается в мелатонин, и этот процесс превращения N-ацетилсеротонина в мелатонин облегчается ферментом гидроксииндол-О-метилтрансферазой (HIOMT) [38].
Рисунок 2. Синтез мелатонина из лимитирующей незаменимой аминокислоты триптофана. Оригинальная обработка контента. 3D-модели молекул триптофана, 5-гидрокситриптофана, серотонина, N-ацетилсеротонина и мелатонина взяты из интернета и защищены авторским правом с разрешением на их использование. Графика: Триптофан, 5-Гидрокситриптофан, Серотонин и N-Ацетилсеротонин — Copyright © "Creative Commons CC0 1.0 Universal Public Domain Dedication". Графика: Мелатонин — Все права защищены Free Software Foundation в соответствии с "GNU Free Documentation License".
Из-за того, что фермент арилалкиламин-N-ацетилтрансфераза (AANAT), который играет роль катализатора превращения серотонина в N-ацетилсеротонин, обладает минимальной активностью в организме в течение дня, процесс выработки мелатонина ограничен, что способствует накоплению серотонина в пинеалоцитах, в то время как синтез мелатонина ночью обусловлен повышенной активностью AANAT в результате наступления темноты [39].
Синтез мелатонина в шишковидной железе ритмически регулируется «главными биологическими часами» организма, расположенными в супрахиазматическом ядре (СХЯ) гипоталамуса. Синтез мелатонина начинается с превращения незаменимой аминокислоты триптофана (которая поступает с пищей) в серотонин [40]. Кроме того, некоторые исследования сообщили, что митохондрии содержат высокие уровни мелатонина [41].
Процесс улавливания и передачи световой информации от сетчатки к шишковидной железе начинается с фоторецепторных клеток сетчатки, которые получают световые сигналы (сетчатка отвечает за преобразование оптических сигналов в биологические) и передают информацию в супрахиазматическое ядро гипоталамуса (СХЯ) по ретиногипоталамическому тракту. Основными клетками на поверхности сетчатки, которые получают световую информацию, являются фоточувствительные ганглиозные клетки (ipRGC), которые очень чувствительны к синему свету. Супрахиазматическое ядро гипоталамуса (СХЯ) является главными биологическими часами организма и, благодаря информации, получаемой от сетчатки, определяет, день или ночь на улице, в зависимости от интенсивности света, проникшего на поверхность сетчатки. В свою очередь, супрахиазматическое ядро гипоталамуса отправляет полученную информацию через симпатические преганглионарные нейроны, расположенные в стволе головного мозга (особенно в медуллярной области или в нижней части ствола мозга), в верхние шейные ганглии (ВШГ) [42].
У людей синтез мелатонина инициируется сразу после захода солнца, достигая пика секреции в середине ночи и постепенно снижаясь во второй половине ночи. Около 80% мелатонина, присутствующего в организме человека в течение 24-часового периода, синтезируется в ночное время. Уровень мелатонина в сыворотке крови у людей в ночное время достигает значений от 80 пг/мл до 120 пг/мл, соответственно, а в дневное время количество мелатонина резко падает до значений около 10–20 пг/мл [42,43].
2.2. Мелатонин внеэпифизарного происхождения
Мелатонин также может синтезироваться и секретироваться в организме животных и человека и в других тканях и органах, таких как кожа [44,45,46], сетчатка глаза [47,48], определенные области мозга [49], печень, почки и женские репродуктивные органы [33], щитовидная железа, хрусталик и костный мозг [50], цилиарные тела [51], тимус [52] и улитка внутреннего уха [53], а также присутствует в желудочно-кишечном тракте [54,55].
Было установлено, что мелатонин, синтезируемый и секретируемый в других тканях и органах, выполняет иные роли в живых организмах по сравнению с теми, которые выполняет эпифизарный мелатонин, в зависимости от ткани или органа, в котором он синтезируется и секретируется. Другой характеристикой внеэпифизарного мелатонина является то, что он не транспортируется в организме через кровь и действует только локально, в области, где был секретирован. Например, было обнаружено, что внеэпифизарный мелатонин, синтезируемый в коже, защищает ткань от активных форм кислорода (АФК) и активных форм азота (АФА), которые индуцируются в результате воздействия на кожу химических токсинов или ультрафиолетового излучения [4,56,57].
Внеэпифизарный мелатонин, секретируемый в коже, не способен напрямую нейтрализовать АФК и АФА без посторонней помощи [1]. Таким образом, было продемонстрировано, что когда мелатонин отдает электрон, чтобы инактивировать радикальный вид, он превращается в другой акцептор свободных радикалов, называемый 3-гидроксимелатонином. Это явление превращения мелатонина в другие производные с ролью в улавливании реактивных видов обычно называется антиоксидантным каскадом мелатонина или каскадом элиминации свободных радикалов [4,55]. Это превращение мелатонина в различные акцепторы свободных радикалов включает следующие формы: N-ацетилсеротонин (NAS), 5-метокситриптамин (5-MT), циклический 3-гидроксилированный мелатонин (c3OHM), N1-ацетил-N2-формил-5-метоксикинурамин (AFMK), N1-ацетил-5-метоксикинурамин (AMK), 6-гидроксимелатонин (6-OHM), 4-гидроксимелатонин (4-OHM) и 2-гидроксимелатонин (2-OHM) [58].
3. Роль мелатонина
Многочисленные исследования, проведенные в области изучения механизма действия мелатонина на организмы позвоночных, показали ряд ролей и функций, которые этот гормон выполняет в организме животных и человека. Таким образом, в зависимости от природы мелатонина (эпифизарный или внеэпифизарный) и в зависимости от ткани или органа, в котором он синтезируется и секретируется, этот гормон выполняет различные роли и функции на уровне каждого отдельного организма.
3.1. Роль мелатонина в организме животных
В организме животных мелатонин играет роль в регуляции циркадного ритма [19], улучшает качество сна, регулируя ритм сон–бодрствование [59], повышает качество молока у млекопитающих, опосредует сезонные репродуктивные изменения [60,61], модулирует энергетический обмен [62], регулирует клеточный окислительно-восстановительный гомеостаз [63] и играет роль в размножении домашних видов [19].
Мелатонин ритмично секретируется в организме животных в результате фотостимулирующего действия, вызванного темнотой, или путем подавления синтеза под воздействием естественного и/или искусственного света на глазное яблоко [7]. После синтеза эпифизарный мелатонин высвобождается в спинномозговую жидкость третьего желудочка, после чего распределяется по различным областям мозга для передачи сигналов о фотопериодических изменениях в окружающей среде [64,65].
Исследование, проведенное на крысах, показало, что мелатонин обладает способностью ингибировать рост и развитие некоторых раковых опухолей. Были проанализированы две группы крыс с опухолями, которым вводили кровь от доноров-людей. Крысам в первой группе вводили кровь с концентрацией мелатонина, характерной для ночного периода, а крысам во второй группе — кровь с уровнем мелатонина, характерным для дневного периода. Результаты показали, что в случае крыс, которым вводили кровь, богатую мелатонином, рост опухоли подавлялся, в то время как перфузия кровью с дефицитом мелатонина приводила к росту опухоли у исследованных крыс [66].
Участие мелатонина в репродуктивном процессе животных является хорошо известной и задокументированной функцией этого гормона. Мелатонин действует в первую очередь через рецепторы MT1 и MT2, присутствие которых было отмечено в нескольких специализированных исследованиях во многих тканях головного мозга и периферических тканях, включая семенники и яичники. Специализированные исследования сообщили, что рецептор мелатонина MT1 более широко распространен в областях мозга и эндокринных тканях по сравнению с рецептором MT2, который, по-видимому, в целом отсутствует в гипофизе и гипоталамусе. Области мозга и эндокринные ткани являются основными зонами реакции на циркадные и физиологические эффекты, индуцируемые N-ацетил-5-метокситриптамином (мелатонином), и присутствие рецептора MT1 в этих органах свидетельствует о том, что этот рецептор (MT1) играет важную роль в физиологических репродуктивных процессах млекопитающих, модулируемых мелатонином [67]. Мелатонин — это гормон, участвующий в модуляции гипоталамо-гипофизарно-гонадной оси (ГГГ-оси), которая служит регуляторным центром репродуктивного процесса как у животных с сезонным размножением, так и у животных с несезонным размножением (включая человека) [68].
Влияние рационов, богатых мелатонином, на репродуктивные показатели у баранов было изучено Peña-Delgado и др. (2023) [69], которые провели исследование в Испании на группе из 16 баранов арагонесской породы. В этом исследовании животные были разделены на две группы по 8 баранов в каждой: контрольная группа получала 500 г коммерческого рациона, а экспериментальная группа получала модифицированный рацион, также вводимый из расчета 500 г в день, но состоящий на 20% из агропромышленных побочных продуктов, богатых фитомелатонином (растительным мелатонином), при этом остальные 80% составлял тот же коммерческий рацион, что и в контрольной группе. Исследование проводилось в течение 5 месяцев, с февраля по июль, что представляет собой нерепродуктивный сезон для баранов, и животные получали сено вволю на протяжении всего исследования. Побочные продукты, богатые фитомелатонином, введенные в рацион экспериментальной группы, включали гранатовый жмых с содержанием мелатонина 35,81 ± 0,4 нг/г, томатный жмых с содержанием мелатонина 23,76 ± 1,37 нг/г и виноградную мезгу с содержанием мелатонина 45,94 ± 4,19 нг/г. Растительные компоненты, составлявшие модифицированный рацион для экспериментальной группы, смешивали в равных пропорциях, а уровни мелатонина в растительных побочных продуктах определяли авторами с помощью метода ВЭЖХ-ЭРИ-МС/МС (высокоэффективная жидкостная хроматография с ионизацией электрораспылением и тандемной масс-спектрометрией). Авторы этого исследования сообщили в своих выводах, что диета, богатая фитомелатонином, повышала уровни мелатонина в семенной плазме и улучшала жизнеспособность и морфологию сперматозоидов. В контексте того же исследования авторы выделили, что введение растительных побочных продуктов, богатых фитомелатонином, в рационы сельскохозяйственных животных дает экономические выгоды как для агропромышленного сектора, так и для животноводства, поскольку повторное использование растительных материалов, полученных в результате определенных производственных процессов, снижает уровень отходов, образующихся в процессах переработки пищевых продуктов и напитков, в то время как присутствие большего количества мелатонина в организме животного проявляет защитные эффекты против окислительного повреждения сперматозоидов за счет снижения внутриклеточных уровней активных форм кислорода [69].
3.2. Роль мелатонина в организме человека
Мелатонин — гормон, обычно синтезируемый шишковидной железой под влиянием интенсивности света, синтез и секреция которого в наибольших количествах осуществляются во временном интервале с 01:00 до 04:00 ночи, как указывают некоторые авторы [70], выполняет множество ролей в организме человека, некоторые из которых сходны с ролями, выполняемыми в организме животных. Наиболее изученными ролями и функциями, которые мелатонин выполняет в организме человека, являются регуляция циркадного ритма и улучшение качества сна [18], снижение окислительного стресса на уровне всего организма [71,72], вмешательство в регуляцию иммунной системы [73], регуляция функций сердечно-сосудистой системы [74] и нервной системы [75], участие в регуляции биологического ритма [76], стимуляция иммунных клеток и регуляция выработки цитокинов [77].
В оптимальных условиях деятельности человека, осуществляемой в течение 24 часов, доля, отводимая на отдых посредством качественного сна, должна составлять одну треть продолжительности циркадного цикла [78]. Нарушения, связанные со сном, — это ситуации, встречающиеся во всех возрастных группах человеческой популяции, и различные исследования продемонстрировали, что низкое качество сна, достигаемое в течение 24-часового дня активности, имеет множество негативных последствий для общего здоровья организма человека, таких как усталость, низкая производительность при выполнении повседневных дел и другие [79,80].
Согласно некоторым клиническим исследованиям, было установлено, что в первые месяцы жизни новорожденного шишковидная железа не способна инициировать естественный и индивидуальный синтез и секрецию мелатонина, поэтому младенцы должны получать мелатонин исключительно из внешних источников, таких как грудное молоко [81,82]. Секреция и синтез мелатонина, а также развитие циркадных ритмов сон–бодрствование начинают проявляться у младенцев только после второго-шестого месяца жизни новорожденных или даже после шестого месяца в определенных ситуациях [81]. Благодаря этим наблюдениям, обосновывается необходимость более целенаправленного изучения способа секреции мелатонина в коровьем молоке, чтобы позволить производить молоко и молочные продукты, полученные из него, которые могли бы поддерживать население, страдающее нарушениями сна из-за дефицита мелатонина.
Согласно другим исследованиям, секреция мелатонина в грудном молоке также проявляет циркадный ритм [83] с максимальным содержанием гормона мелатонина 46,9 ± 4,2 пг/мл, определенным в молоке, собранном в полночь, и очень низкими уровнями (необнаружимо низкими) в молоке, собранном в течение дня, когда сетчатка подвергалась воздействию естественного и/или искусственного света [84].
Преимущественным аспектом мелатонина является то, что этот гормон не проявляет токсичности в организме человека при введении в высоких дозах. Так, с помощью различных клинических исследований было продемонстрировано, что ежедневное пероральное введение мелатонина даже в высоких дозах (от 1 до 300 г или от 4,3 до 1291,5 мкмоль) не вызывало негативных последствий для здоровья пациентов, получавших лечение мелатонином [35], — аспект, который может стимулировать потребление продуктов с высоким содержанием мелатонина, особенно в силу того простого факта, что в молоке и других пищевых продуктах мелатонин содержится в малых количествах (выраженных в пг) по сравнению с уровнями мелатонина, вводимыми пациентам в клинических исследованиях.
Некоторые исследователи сообщили в своих работах, что мелатонин оказывает ингибирующее действие на внутренние апоптотические пути при нейродегенеративных заболеваниях, особенно при болезни Альцгеймера, болезни Хантингтона, болезни Паркинсона, сосудистых катастрофах и боковом амиотрофическом склерозе [85].
Мелатонин синтезируется и секретируется в организме человека в зависимости от возраста каждого индивида. Циркадный ритм — это колебание между светлым и темным периодами, осуществляемое в течение примерно 24 часов. В организме позвоночных супрахиазматическое ядро (СХЯ) определяет синхронизацию циркадных ритмов путем регуляции температуры тела, с помощью различных гормональных сигналов и путем регуляции нейрональной активности. Согласно исследованиям, проведенным к 2024 году, старение людей приводит к различным изменениям в паттернах сна, таким как ежедневная синхронизация часов отдыха, продолжительность сна, высокая латентность наступления сна, большая восприимчивость к пробуждениям, фрагментация сна, проявляющаяся периодическими пробуждениями в течение цикла отдыха, снижение качества более глубокого сна, усиление периодов, проводимых в более легких стадиях сна, и т.д. Таким образом, было установлено, что начиная с 50-летнего возраста количество мелатонина, секретируемого в организме человека, начинает снижаться, а после 70 лет процесс синтеза и секреции мелатонина, по-видимому, естественным образом почти полностью отсутствует [86,87,88].
Milagres и др. (2013) [89] сообщили, что введение коровьего молока, собранного в 2 часа ночи, которое было богато мелатонином, полученным как в результате синтетической продукции, так и естественной секреции, повышало уровень мелатонина в плазме на 26,5% у взрослых крыс линии Вистар по сравнению с уровнями мелатонина в плазме, обнаруженными у взрослых крыс линии Вистар, потреблявших дневное молоко (коровье молоко, собранное в 15:00). В том же исследовании было определено, что добавление триптофана в ночное молоко повышало уровень мелатонина в плазме на 35,6% у взрослых крыс линии Вистар, потреблявших этот тип молока, обогащенного естественным мелатонином и с добавленным триптофаном [89]. Сходным образом, благотворное влияние потребления молока, богатого мелатонином, было отмечено и у людей благодаря улучшению качества сна, что проявлялось в большей удовлетворенности периодом отдыха, достигнутым во сне, и в улучшении выполнения повседневных дел [59].
4. Мелатонин в молоке
Молоко представляет собой жидкую смесь, состоящую из воды и сухого вещества (пропорции двух компонентов составляют приблизительно 87,5% воды и 12,5% сухого вещества соответственно). Молоко определяется как однородная и опалесцирующая жидкость белого цвета, свободная от посторонних тел, взвешенных в объеме жидкости, секретируемая молочной железой самок млекопитающих [90].
Сухое вещество молока, в свою очередь, представлено несколькими питательными компонентами (белки, жиры, липиды и т.д.), играющими роль в обеспечении организма энергией, необходимой для поддержания здорового и гармоничного роста и развития [91], и рядом молекул с биоактивной ролью в организме животных и человека (витамины, гормоны, минералы). Благодаря химическому составу коровьего молока, который считается сложным и полным, а также высокой пищевой ценности этой жидкости, молоко считается одним из важнейших продуктов животного происхождения [92]. Естественно, сырое молоко имеет в своем химическом составе несколько биоактивных молекул (включая свободные олигосахаридные структуры, различные гормоны, пептиды, липиды и т.д.), которые выполняют множество активных биологических ролей в организме животных и человека с различным метаболическим воздействием по сравнению с пищевой ценностью молока [93,94].
Естественная секреция мелатонина — это процесс, происходящий в организме животных и человека в ночное время, поэтому мелатонин также называют гормоном сна. Мелатонин естественным образом секретируется сначала в кровь и в спинномозговую жидкость третьего желудочка головного мозга позвоночных [1], а в случае самок млекопитающих впоследствии выделяется в молоко. По этой причине любое изменение содержания питательных веществ и биоактивных молекул в крови (включая мелатонин) будет напрямую влиять на химический состав молока с точки зрения его содержания питательных веществ и биоактивных молекул. Из-за ночного характера секреции мелатонина многие исследователи инициировали идею сбора молока животных ночью, чтобы получить молоко с более высоким содержанием мелатонина, что привело к появлению концепции дневного молока (молоко, собранное в течение дня) и ночного молока (молоко, собранное ночью).
Исследования, проведенные в зоотехнической области, касающиеся факторов, которые могут влиять на секрецию мелатонина в коровьем молоке (а также у других видов животных, представляющих зоотехнический интерес), продемонстрировали, что процесс выделения мелатонина в молоко — это явление, на которое влияет ряд технологических факторов (порода и вид животных, здоровье животных, условия содержания, фотопериоды, время сбора молока, частота доения, условия окружающей среды, в которых содержатся животные, и т.д.) и питательных факторов (питание и кормление животных).
Согласно специальной литературе и опыту зоотехнических исследований, было выделено, что состояние здоровья животных (крупного рогатого скота, овец, коз, птиц и т.д.), а также условия содержания и ухода (в целом воздействие стресс-факторов) напрямую влияют на качество и количество произведенной продукции [95].
Некоторые авторы сообщили в исследовании, проведенном в Швейцарии, на стаде из 125 коров с восьми ферм с автоматическими системами доения, о корреляции между увеличением числа доек, проведенных за ночь, и низким содержанием мелатонина, обнаруженного в слюне [96]. В этом обзоре мы проанализируем и опишем влияние основных технологических и питательных факторов, которые могут значительно влиять (положительно или отрицательно) на естественную секрецию мелатонина в коровьем молоке, согласно информации, доступной в специальной литературе.
4.1. Технологические факторы содержания
Наиболее изученными технологическими факторами, которые могут влиять на содержание мелатонина в коровьем молоке, являются вид и порода животных, условия окружающей среды, суточная молочная продуктивность животных, частота доения, условия освещения и интенсивность искусственного света в помещениях для животных [5,97,98].
4.1.1. Вид и порода
Вид животных и порода — это два фактора, которые могут напрямую влиять на содержание мелатонина в молоке коров и других животных, разводимых для производства молока. Исследования крупного рогатого скота и овец показали, что существуют большие различия между содержанием мелатонина, выделяемого в молоко, собранное в течение дня, и содержанием мелатонина, выделяемого в молоко, собранное ночью, а также между молоком, собранным индивидуально у двух изученных видов животных, согласно данным, представленным в Таблице 1 [99,100]. Эти различия обусловлены главным образом циркадным ритмом синтеза мелатонина, а также генетическими различиями между двумя видами животных.
Таблица 1. Содержание мелатонина, определенное в дневном и ночном молоке, собранном у крупного рогатого скота и овец.
У овец [100] было продемонстрировано, что содержание животных в течение 16 часов в темноте и 8 часов на свету не повлияло на химический состав молока по содержанию белка, жира, лактозы и солей, но привело к получению молока с более высоким содержанием мелатонина в случае проанализированных образцов молока, собранного ночью (11,06 ± 7,24 пг/мл), по сравнению с образцами молока, собранными в течение дня (6,12 ± 4,55 пг/мл). Результаты, представленные в Таблице 1, подчеркивают ночной характер секреции мелатонина в молоке крупного рогатого скота и овец из-за получения более высоких значений мелатонина в ночном молоке по сравнению с результатами, полученными для дневного молока, собранного у обоих видов.
4.1.2. Условия окружающей среды
Условия окружающей среды являются еще одним важным фактором в получении молока с высоким содержанием мелатонина. Значительные различия в содержании мелатонина в коровьем молоке также были зафиксированы в молоке одной и той же породы (голштинской), но находящейся в разных географических регионах, согласно данным, представленным в Таблице 2.
Таблица 2. Содержание мелатонина, зафиксированное в дневном и ночном молоке, собранном у голштинского скота, находящегося в разных географических регионах мира.
Значительные различия между значениями уровней мелатонина в молоке голштинских коров обусловлены главным образом условиями, в которых проводились эксперименты. Boztepe и др. [99] проводили свое исследование в январе (с фотопериодом 11 часов естественного света и 13 часов темноты) и с интенсивностью искусственного света, измеренной на уровне глаз в ночное время, составлявшей 150 лк. В этом исследовании молоко собирали в два разных временных интервала (между 15:00 и 17:00 для дневного молока и между 03:00 и 05:00 утра для ночного молока). В другом исследовании Şahin и др. [101] собирали молоко у коров три раза в день: в 07:00 утра, 16:00 дня и 01:00 ночи. Milagres и др. [89] провели исследование различий в мелатонине, обнаруженном в молоке голштинских коров в летний сезон (со 2 по 16 июня) в течение 15 дней, собирая молоко в 02:00 ночи для ночного молока и в 15:00 дня для дневного молока.
В контексте исследования, проведенного Romanini и др. [102], ночное молоко собирали между 05:00 и 06:00 утра, а дневное молоко собирали в течение дня, когда животных доили в соответствии с графиком сбора молока, применяемым на ферме, где проводилось исследование.
Исследование, проведенное Asher и др. [103], выполнялось в период с 1 по 15 ноября года с продолжительностью фотопериода 10,4 часа естественного света и 13,6 часа темноты. Исследование включало формирование двух экспериментальных групп, которые подвергались воздействию различных условий искусственного освещения в ночное время. В случае коров в группе «Темная ночь» условия освещения в помещениях для животных в ночное время составляли 648 ± 5,12 нм и 5,08 ± 0,04 лк, а для коров в группе «Ночное освещение» применялись условия освещения 462 ± 5,12 нм и 105 ± 3,91 лк.
Teng и др. [104] провели исследование содержания мелатонина в коровьем молоке в конце августа, и молоко собирали в 15:00, что представляло дневное молоко, и в 05:00 утра, что представляло ночное молоко.
Корреляция данных, представленных в Таблице 2, со всеми экспериментальными условиями, которые применялись в исследованиях, представленных в этой статье, показывает высокую степень вариабельности содержания мелатонина, обнаруженного в коровьем молоке. Экспериментальные данные, представленные в Таблице 2, указывают на различные значения диапазона содержания мелатонина, определенного как в дневном, так и в ночном молоке коров. Присутствие более высокого уровня мелатонина в ночном молоке демонстрирует ночной характер биосинтеза и секреции этого эпифизарного гормона в организме коровы. Существование более высокой концентрации мелатонина в ночном молоке по сравнению с дневным молоком указывает на то, что более высокий синтез и секреция мелатонина, достигаемые в организме коровы, приведут к последующему выделению этого гормона в большем количестве в молоко из-за природы мелатонина как циркулирующей молекулы.
Большие колебания минимальных и максимальных пределов мелатонина, обнаруженного как в дневном молоке (2,912–103,7 пг/мл), так и в ночном молоке крупного рогатого скота (11,314–163,13 пг/мл), а также значительные различия в содержании мелатонина, определенные разными исследователями (данные представлены в Таблице 2), скорее всего, обусловлены различными экспериментальными условиями (продолжительность фотопериодов, интенсивность искусственного света в помещениях для животных и время, в которое собирали образцы молока), в которых проводились исследования [89,99,101,102,103,104]. Среди условий окружающей среды, которые представляют собой технологические факторы, способные влиять на синтез и секрецию мелатонина и последующее выделение этого гормона в коровье молоко, можно назвать фотопериоды (в южных частях земного шара дни длиннее по сравнению с северными частями, что увеличивает период воздействия естественного света на глазное яблоко, тем самым подавляя синтез и секрецию мелатонина) и температуру окружающей среды (тепловой стресс животных — фактор, который может влиять на продуктивность крупного рогатого скота).
Тепловой стресс у молочных коров — это явление, которое может привести к снижению удоя и снижению качества получаемой продукции. Хорошо задокументировано, что организм позвоночного должен получать определенные специфические и отчетливые сигналы (отсутствие света и относительно низкая температура окружающей среды) для инициации процесса вхождения в состояние покоя. Крупный рогатый скот — животные, толерантные к низким температурам (коровы могут выдерживать также температуры в тепловом диапазоне 0 ÷ +5 °C), и начинают проявлять поведенческие и физиологические изменения при более длительном воздействии слишком высоких или даже слишком низких температур. Возникновение теплового стресса у крупного рогатого скота — это явление, которое можно в определенной степени регулировать с помощью питания животных. В ситуациях теплового стресса крупный рогатый скот будет использовать больше энергии для терморегуляции — аспект, который снизит молочную продуктивность с качественной и количественной точек зрения в результате проявления энергетической недоступности на уровне организма животного. Эта ситуация также может усугубляться низким потреблением сухого вещества корма в результате недоступности питательных веществ, которые должны усваиваться организмом животного [105].
Было продемонстрировано (согласно данным, представленным в Таблице 2), что молоко имеет в своем составе различные количества мелатонина в зависимости от условий окружающей среды, которым подвергаются животные. Так, для голштинских коров в Конье, Турция, были зафиксированы количества мелатонина, которые варьировали в дневном молоке в пределах от 2,912 пг/мл [99] до 103,7 пг/мл [101], а в ночном молоке — в пределах от 11,314 пг/мл [99] до 163,13 пг/мл [101]. В других исследованиях, проведенных в различных географических регионах Бразилии (Висоза и Кастро), была выделена степень вариабельности содержания мелатонина, секретируемого в молоке голштинского скота [89,102], при этом скот из района Висоза показал содержание мелатонина 4,03 пг/мл в дневном молоке и 39,43 пг/мл в ночном молоке [89], в то время как в исследовании, проведенном в районе Кастро, уровень содержания мелатонина составил 6,98 ± 3,05 пг/мл в дневном молоке и 14,87 ± 7,69 пг/мл в ночном молоке [102].
В других исследованиях, проведенных в Израиле [103] и Китае [104], также сообщалось о вариациях содержания мелатонина как между дневным и ночным молоком крупного рогатого скота (еще раз подчеркивая ночной характер синтеза и секреции мелатонина), так и между молоком, собранным от экспериментальных групп, проанализированных в двух работах (подчеркивая воздействие условий окружающей среды, которым подвергаются животные, на содержание мелатонина в молоке).
В исследовании, проведенном в Израиле [103], образцы молока были собраны от двух групп животных, содержавшихся в различных условиях освещения в течение всего периода отдыха (ночного периода). Одна группа коров содержалась в темных условиях в течение всего периода отдыха, а другая группа — в условиях освещения в течение всей ночи. Различия были зафиксированы как с точки зрения индивидуального сравнения (сравнение, проведенное на уровне группы/партии), так и с точки зрения общего сравнения, проведенного между молоком, собранным от двух изученных групп крупного рогатого скота. Согласно результатам, полученным Ашером и его сотрудниками, более высокое содержание мелатонина было зафиксировано для обеих изученных экспериментальных групп в случае ночного молока (30,7 ± 1,79 пг/мл для группы, содержавшейся в темных условиях, и 17,81 ± 0,33 пг/мл для группы, содержавшейся в условиях освещения) по сравнению со значениями мелатонина, обнаруженными в дневном молоке (5,36 ± 0,33 пг/мл для группы, содержавшейся в темных условиях, и 3,3 ± 0,18 пг/мл для группы, содержавшейся в условиях освещения).
Общее сравнение, проведенное по исследованию Asher и др. [103], было установлено между результатами содержания мелатонина, определенного в дневном молоке и в ночном молоке, которые были собраны от двух групп/партий изученных животных. Таким образом, благодаря данным, представленным в Таблице 2, видно, что уровень мелатонина, определенный в молоке коров, был выше в случае животных, содержавшихся в темноте в период отдыха, в случае обоих типов молока (дневного и ночного). В случае молока, собранного от крупного рогатого скота в группе темноты, уровень мелатонина составил 5,36 ± 0,33 пг/мл в дневном молоке и 30,7 ± 1,79 пг/мл в ночном молоке по сравнению с уровнем мелатонина, определенным в молоке, собранном от животных, содержавшихся в условиях освещения (3,3 ± 0,18 пг/мл мелатонина, определенного в дневном молоке, и 17,81 ± 0,33 пг/мл мелатонина, определенного в ночном молоке). Эти результаты демонстрируют ночной характер синтеза и секреции мелатонина, а также влияние искусственного света как ингибирующего фактора в процессе действия шишковидной железы. Из-за того, что различия были также зафиксированы между содержанием мелатонина в дневном молоке, собранном от двух изученных групп животных (5,36 ± 0,33 пг/мл мелатонина, определенного в дневном молоке животных в группе, содержавшейся в темных условиях, и 3,3 ± 0,18 пг/мл мелатонина, определенного в дневном молоке животных в группе, содержавшейся в условиях освещения), можно сделать вывод, что воздействие на крупный рогатый скот условий освещения в течение ночи (которая должна предназначаться для отдыха через сон) может подавлять синтез и секрецию мелатонина в течение дня, что приведет к нарушениям циркадного ритма, снижению качества сна и возможному возникновению проблем со здоровьем в организме животного.
Данные, обнаруженные в специальной литературе, указывают на то, что уровни мелатонина, которые могут быть обнаружены в молоке, показывают очень высокую степень вариации, что может быть объяснено управлением фермами, на которых содержались и выращивались изученные животные.
4.1.3. Продуктивность животных
Многие авторы сообщали в своих исследованиях, что они зафиксировали гораздо более высокое содержание мелатонина в молоке, собранном ночью и в зимние периоды. Это явление может быть объяснено большей продолжительностью зимних ночей по сравнению с другими сезонами — фактором, который сокращает продолжительность воздействия на животных условий естественного освещения. В то же время меньшая продолжительность зимних дней также коррелирует с более низкой молочной продуктивностью, которую животные имеют в холодное время года. Таким образом, увеличивая продолжительность воздействия темноты на животных, получают большее количество мелатонина в молоке, а получая малое количество молока, увеличивается соотношение мелатонина, растворенного в общем объеме жидкости. По этим причинам количество молока, которое животное производит за день, является еще одним фактором, который необходимо учитывать, когда речь идет о получении молока, богатого мелатонином, потому что в случае высокой молочной продуктивности количество секретированного мелатонина будет разбавляться в большем объеме жидкости по сравнению с ситуацией, когда получают меньшее количество молока, и в этом случае содержание мелатонина будет разбавляться в меньшем объеме жидкости [102].
4.1.4. Частота доения
Частота доения является еще одним важным фактором, влияющим на гормональный уровень мелатонина, секретируемого в коровьем молоке. Некоторые исследования показали, что молоко, выдоенное утром (рекомендуется в 04:30), содержит наибольшее количество мелатонина, а другие авторы сообщили, что наибольшая секреция мелатонина в организме животного достигает своих максимальных значений в 00:00 [103]. Таким образом, проводя процесс доения утром, можно получить молоко, богатое мелатонином, в результате гормонального накопления N-ацетил-5-метокситриптамина (мелатонина) в жидкости молочной железы в течение всей ночи.
С точки зрения продуктивности необходимо также учитывать количество доек, проводимых за день. В оптимальных условиях управления молочной фермой обычно применяют два доения в день, хотя бывают и ситуации, когда это число может варьироваться в сторону увеличения или уменьшения. Так, некоторые авторы сообщили, что проведение одного доения в день может сократить часть эксплуатационных расходов фермы, но также снижает производство молока с точки зрения количества [106], а увеличивая количество доек с двух до четырех в день, можно увеличить производство молока, изменяя экспрессию генов в молочной железе [107], но все еще остается спорным, теряет ли молоко свое качество или нет, если проводится большее количество доек в день.
Сбор молока два раза в день (один раз днем до захода солнца и один раз рано утром) и хранение собранного молока в разных резервуарах-накопителях — это практика, которая может облегчить получение и реализацию молока с высоким содержанием мелатонина, который был выделен в молоко естественным путем.
4.1.5. Условия освещения
Организация программы ночного сбора молока — это процесс, который облегчил бы получение молока с высоким содержанием мелатонина, но также необходимо учитывать вовлечение фактора стресса у животных, подвергающихся многочисленным процессам прерывания сна в результате необходимости сбора молока.
Ингибирующим фактором процесса синтеза и секреции мелатонина является интенсивность света в помещении для доения. Для проведения этапа доения необходимо наличие света в доильном зале, чтобы облегчить процесс доения в хороших условиях. Этот аспект мог бы снизить качество следующего объема собранного молока в результате подавления секреции мелатонина, подавления, возникающего из-за проникновения света в сетчатку животных. По этой причине необходимо учитывать как тип используемого света, так и интенсивность искусственного света в зонах отдыха коров и в помещениях для сбора молока.
Многочисленные исследования продемонстрировали, что наибольшее количество мелатонина в молоке коров и овец секретируется ночью, в темных условиях, когда интенсивность естественного света очень низкая [5,108].
4.1.6. Тип и интенсивность искусственного освещения
Интенсивность искусственного света, попадающего на сетчатку, является очень важным фактором для стимуляции или подавления синтеза и секреции мелатонина в организме животного. Высокая интенсивность естественного света в течение дня подавляет секрецию мелатонина и стимулирует секрецию серотонина, а отсутствие света ночью стимулирует секрецию мелатонина и выделение этого гормона в кровь, а впоследствии и в молоко. Некоторые исследования показали, что наибольшее количество мелатонина можно получить из коровьего молока в ночное время, если влияние интенсивности света в помещениях для животных сведено к минимуму. В то же время продолжительность фотопериодов напрямую влияет на естественную секрецию мелатонина в молоке, так что наиболее качественное молоко с точки зрения содержания мелатонина можно получить от коров в зимний период в результате более длительного воздействия темноты на животных. Это более длительное воздействие темноты на животных обусловлено более длинными зимними ночами по сравнению с остальными сезонами, а также в результате получения меньшего количества молока, что приводит к разбавлению содержания мелатонина в меньшем объеме жидкости [5,102].
Исследования, проведенные для определения воздействия искусственного света в коровниках на качество сырого молока, показали, что воздействие на животных искусственного света в течение более длительного периода может увеличить производство молока, но снижает содержание мелатонина в организме и в молоке. Таким образом, эффективным методом стимуляции синтеза и секреции мелатонина в организме коров, который впоследствии приведет к выделению этого гормона в молоко крупного рогатого скота, является увеличение фотопериода темноты и использование источников света низкой интенсивности в помещениях для животных [5,108,109].
С качественной точки зрения было продемонстрировано, что использование искусственного света в помещениях для содержания крупного рогатого скота не влияет на химический состав молока с точки зрения сухого вещества, белка, жира и лактозы [104,108], но чрезмерное использование искусственного света в помещениях для содержания животных подавляет секрецию мелатонина и, соответственно, выделение этого гормона в молоко [5]. В связи с тем, что внедрение программы ночного сбора молока также требует использования источников искусственного света, рекомендуется использовать определенный тип искусственного света и с определенной интенсивностью света, который не сильно подавляет синтез и секрецию мелатонина. Были проведены исследования, сосредоточенные на изучении влияния интенсивности и цвета светодиодного света на содержание мелатонина, обнаруженного в молоке коров, которые подвергались воздействию условий искусственного освещения в периоды отдыха с применением различных типов света различной интенсивности и цвета. По-видимому, светодиодный свет является наиболее полезным искусственным источником распространения света, когда речь идет о его воздействии на организм животного, поскольку светодиоды способны равномерно рассеивать свет по всей площади действия и имитировать естественный свет. Тип и интенсивность искусственного света, используемого в зонах отдыха животных, являются двумя ключевыми факторами стимуляции или подавления секреции мелатонина, при этом было обнаружено, что использование синего искусственного света приводит к получению молока с более низким содержанием мелатонина, чем красный или желтый свет [110,111]. Другие исследования также показали, что содержание животных в естественной темноте в течение всего периода отдыха стимулирует секрецию мелатонина и снижает количество соматических клеток в молоке, а за счет снижения количества соматических клеток получают качественное молоко, снижается риск мастита, улучшается здоровье животных и снижается стресс у коров путем индукции состояния благополучия [5].
Некоторые исследования показали, что светодиодные лампы с различными цветовыми оттенками и длинами волн могут в большей или меньшей степени подавлять синтез и секрецию мелатонина в организме животного. Использование синего света с короткой длиной волны (465–485 нм), применяемого в течение длительного периода времени, может количественно увеличить производство молока, но подавляет синтез и секрецию мелатонина [110,111].
Согласно исследованиям, проведенным к 2024 году, было продемонстрировано, что для подавления секреции мелатонина из коровьего молока до базовых значений мелатонина, зафиксированных в дневном молоке, необходимо, чтобы крупный рогатый скот содержался в помещениях с искусственным белым светом и интенсивностью света не менее 400 лк, воздействующего на оба глаза животных, а в случае использования синего света, но воздействующего только на один глаз, для подавления секреции мелатонина необходимо применять интенсивность света всего 225 лк [109,110]. Однако необходимы более конкретные исследования, в которых синий свет воздействует на оба глаза животных, чтобы определить, как различные оттенки искусственного света, применяемые в одинаковых условиях, влияют на уровень мелатонина, секретируемого в организме животного и впоследствии выделяемого в молоко.
4.2. Питательные факторы
Питательные факторы напрямую влияют на химический состав молока, секретируемого молочной железой коров, за счет поступления питательных веществ корма, усваиваемых организмом животного. Любой недостаток питательных веществ в рационах кормления, вводимых животным, имеет прямые негативные последствия для здоровья организма животного и качества получаемой продукции в результате неусвоения некоторых химических компонентов с энергетической и биоактивной ролью, необходимых для правильного функционирования физиологических и продукционных процессов [112].
К питательным факторам, которые могут влиять на содержание мелатонина в коровьем молоке, относятся питание и кормление животных. Некоторые исследования выделили тот факт, что одним из источников получения мелатонина организмом является собственный рацион питания индивидуума [4], так что, также применительно к процессу синтеза и естественной секреции мелатонина в организме позвоночного, уровень циркулирующего мелатонина может быть повышен, который впоследствии может выводиться с коровьим молоком путем введения в рационы животных кормов, богатых мелатонином и/или триптофаном, а также путем введения защищенного от расщепления в рубце триптофана.
4.2.1. Скармливание кормов, богатых мелатонином
Некоторые исследования сообщили о существовании мелатонина в растительных организмах [113], таким образом, существует возможность, что, вводя в рацион корма, содержащие растения с высоким уровнем мелатонина, можно получить молоко более высокого качества с точки зрения содержания некоторых биоактивных молекул, поступающих в организм животного через диету. Мелатонин из растений был идентифицирован в наибольших количествах в корнях, стеблях, цветах и листьях [114,115].
Важным аспектом, который необходимо учитывать в процессе разработки рецептов кормов, является тот факт, что рационы животных должны быть рассчитаны таким образом, чтобы они могли покрывать суточные потребности в питательных веществах, обеспечивающих рост и развитие организма в оптимальных условиях [112].
У млекопитающих сообщалось, что желудочно-кишечный тракт содержит более высокие уровни мелатонина, чем шишковидная железа, при этом мелатонин в рубце происходит из корма, потребляемого животными, из рубцовых микроорганизмов и из стенки рубца [116].
Согласно исследованию, проведенному в зоотехнической области, касающемуся влияния рационов кормления, вводимых коровам, на гормональную секрецию мелатонина в молоке, было установлено, что дополнение рациона защищенными от расщепления в рубце витаминами группы В (D-пантотеновая кислота, пиридоксин, биотин, фолиевая кислота, цианокобаламин) и незащищенными от расщепления в рубце витаминами А, D3, Е и В3 не оказывает значительного влияния на содержание мелатонина в дневном молоке, но отрицательно влияет на секрецию мелатонина в ночном молоке, с содержанием мелатонина приблизительно на 40,55% ниже в ночном молоке, собранном от коров, потреблявших корм с добавками витаминов, по сравнению с оптимальными значениями мелатонина, определенными в молоке коров, не потреблявших витаминную добавку [117].
В Таблице 3 представлено содержание мелатонина, определенное в различном сырье растительного происхождения, материалах, которые могут представлять кормовую базу при разработке рационов для молочных коров.
Таблица 3. Содержание мелатонина в различных зерновых культурах.
4.2.2. Скармливание L-триптофана, защищенного от расщепления в рубце
Триптофан с химической формулой C11H12N2O2 и молярной массой 204,22 г/моль является незаменимой аминокислотой, поступающей в организм животных и человека с пищей. Триптофан, наряду с фенилаланином и тирозином, являются аминокислотами, которые содержат по крайней мере одно шестичленное бензольное кольцо в своей боковой цепи [119].
Триптофан — это аминокислота, которая должна восполняться в организме с пищей, являясь первым предшественником в процессе синтеза и секреции мелатонина. С биохимической точки зрения синтез и секреция мелатонина начинается с превращения незаменимой аминокислоты триптофана в 5-гидрокситриптофан [38].
Дополнение рационов молочных коров различными кормами, содержащими высокие уровни триптофана, может быть полезным методом стимуляции секреции и синтеза мелатонина. Дополнение рационов кормления более высоким потреблением триптофана в организме животного, который всасывается и транспортируется в мозг, может привести к синтезу и секреции большего количества серотонина, который впоследствии, при обеспечении оптимальных темновых условий, превращается в мелатонин, тем самым обеспечивая организм гораздо более высокими циркулирующими гормональными количествами мелатонина по сравнению с ситуацией, когда животные не получали бы добавки триптофана в рационах.
Различные продукты растительного происхождения, богатые триптофаном (Таблица 4), которые можно вводить в рационы коров, предназначенных для производства молока, представлены соевыми бобами, соевым жмыхом, люцерновым сеном, овсяным сеном и пшеничными отрубями.
Таблица 4. Содержание белка и триптофана в различных кормах.
Некоторые исследования, основной целью которых была стимуляция гормональной секреции мелатонина в коровьем молоке или увеличение содержания белка в молоке путем введения L-триптофана, выделили, что дополнение рационов кормления аминокислотой L-триптофаном может влиять на содержание мелатонина в организме только при определенных условиях [105,122,123].
Исследования, проведенные к 2024 году, выделили, что введение защищенного от расщепления в рубце L-триптофана в различных количествах (20, 30, 50, 100 и 125 г) оказало различное положительное влияние на продуктивность животных. Введение 20 г защищенного от расщепления в рубце L-триптофана привело к снижению количества корма, потребляемого каждым животным, увеличению производства молока, снижению концентрации кортизола в плазме за счет уменьшения теплового стресса, которому подвергаются животные, и увеличению количества мелатонина в молоке [122].
Дополнение рациона голштинских коров 30 г защищенного от расщепления в рубце L-триптофана увеличило производство молока, изменило соотношение основного химического состава молока (увеличило содержание сухого вещества и снизило содержание воды) и повысило содержание белка в молоке [105]. Liu и др. [123] обнаружили, что дополнение рационов 50 г и 100 г защищенного от расщепления в рубце L-триптофана, соответственно, по-видимому, не влияло на содержание мелатонина и триптофана в молоке или на содержание триптофана в крови голштинских коров, но, по-видимому, увеличивало уровень циркулирующего мелатонина в крови животных. В исследовании, проведенном Liu и др. (2024) [123], сообщалось, что дополнение рациона защищенным от расщепления в рубце L-триптофаном у голштинских коров в период подготовки к отелу оказало положительное влияние на репродуктивные показатели и послеродовую лактацию в результате повышения концентрации ФСГ в сыворотке при добавлении 100 г защищенного от расщепления в рубце L-триптофана и повышения содержания ЛГ в сыворотке при добавлении 50 г защищенного от расщепления в рубце L-триптофана по сравнению с контрольной группой. ФСГ (фолликулостимулирующий гормон) и ЛГ (лютеинизирующий гормон) — это два гормона, участвующих в регуляции репродуктивных функций как у самцов, так и у самок [123].
Сравнительное исследование, проведенное в Германии на стаде из 12 нетельных нетелей (первотелок) швицкой породы весом 536 ± 13 кг и возрастом 22 ± 3 месяца и на стаде из 12 взрослых коров (также швицкой породы), было направлено на определение эффектов добавления защищенного от расщепления в рубце триптофана в дозе 125 г/сутки на содержание триптофана в плазме и гормональные уровни у нетелей. Исследование показало, что уровни триптофана в плазме (у нетелей и коров) и мелатонина (только у нетелей) повысились в ответ на добавление триптофана в рацион [124]. Увеличение содержания мелатонина в крови коров также наблюдалось в исследовании, проведенном в Висозе, Бразилия, на экспериментальной партии голштинских коров, чей рацион был дополнен триптофаном [89].
Корреляция технологических и питательных факторов, которые могут влиять на содержание мелатонина в молоке, секретируемом молочной железой коров, скорее всего, является основной причиной, по которой разные авторы зафиксировали различные уровни мелатонина в молоке коров, находящихся в различных географических регионах, как в дневном молоке (от 2,912 до 103,7 пг/мл), так и в ночном молоке (от 11,314 до 163,13 пг/мл), согласно результатам, представленным в Таблице 2 [99,101].
Управление животноводческими фермами является основной отправной точкой, определяющей качество полученной продукции, так что плохое управление животноводческими единицами окажет негативное влияние на благополучие животных, а также на количество и качество получаемой продукции. Мелатонин — это молекула, которая была обнаружена в коровьем молоке в очень широком диапазоне вариаций, главным образом из-за отсутствия корреляции факторов, которые могут влиять на синтез и секрецию этого гормона. Исследования, доступные в специальной литературе к 2024 году, которые были сосредоточены как на определении содержания мелатонина в коровьем молоке, так и на факторах, которые могут влиять на количественные вариации этого гормона, присутствующего в жидкости молочной железы, проводились в особых и различных условиях, так что мы идентифицировали следующие две ситуации: (1) разные исследователи собирали образцы молока на фермах только для определения содержания мелатонина в этом молоке, не вмешиваясь в систему управления животноводческими единицами, из которых они брали образцы молока, и (2) другие авторы применяли определенные условия содержания и поддержания животных, чтобы определить степень подавления синтеза и секреции мелатонина, применительно к оценке одного или нескольких факторов, — ситуация, в которой не учитывалось, может ли гормональная секреция мелатонина стимулироваться или подавляться путем корреляции технологических и питательных факторов. Таким образом, проведение большего количества исследований, сосредоточенных на взаимосвязях, которые могут возникнуть между применением различных технологических и питательных факторов на процессы синтеза и секреции мелатонина в организме коровы, является необходимостью для более глубокого понимания этой темы.
5. Источники мелатонина в питании человека
Получение молока с высоким содержанием естественно секретируемого мелатонина — это сложный процесс, на который влияет ряд технологических и питательных факторов, правильное управление которыми может привести к желаемому результату. Однако в процессе переработки молока для получения производных пищевых продуктов с высоким содержанием мелатонина вмешиваются два важных фактора, которые необходимо учитывать и по которым необходимо провести больше исследований. Этими двумя факторами являются технологические параметры, применяемые в процессе переработки сырого молока, и условия производства и получения определенных категорий молочных пищевых продуктов.
С технологической точки зрения следует изучить возможные влияния, которые могут оказывать выполняемые рабочие процессы и технологические параметры, используемые для получения готовых молочных продуктов. Среди этих процессов большее внимание следует уделить этапам тепловой обработки молока (пастеризация и стерилизация), гомогенизации, нормализации, обезжиривания и сгущения.
Тепловая обработка является критической точкой в технологическом потоке переработки молока, потому что любое изменение технологических параметров пастеризации/стерилизации может иметь необратимые последствия для готового продукта (например, появление эффекта перепастеризации молока). Следует изучить влияние, которое соотношение температура–время–тепловой удар может оказать на концентрацию мелатонина в готовом продукте. В то же время следует также изучить влияния, которые могут оказывать давления, используемые в процессе гомогенизации, процессы центрифугирования молока с целью отделения определенного количества жира от жидкости, и процессы фильтрационного сгущения молока на содержание мелатонина, обнаруженное в полученных молочных продуктах.
Тип молочного продукта является еще одним фактором, который следует принимать во внимание, когда желательно переработать молоко, богатое мелатонином, для получения готовых молочных продуктов с аналогичным содержанием мелатонина по сравнению с содержанием мелатонина, обнаруженным в сырье. Таким образом, большее внимание следует уделить влиянию, которое кислая среда кисломолочных продуктов (йогурт, кефир, простокваша, ацидофильное молоко, пахта) может оказывать на содержание мелатонина, обнаруженное в готовых продуктах.
Исследований, проведенных к 2024 году о количестве мелатонина, определенного в различных готовых молочных продуктах, мало, поэтому было бы полезно уделить большее внимание этой области. В Таблице 5 представлены данные, доступные из специальной литературы, касающиеся содержания мелатонина, обнаруженного в некоторых готовых молочных продуктах.
Таблица 5. Содержание мелатонина в различных молочных продуктах.
Отсутствие содержания мелатонина в кефире [126] может быть связано с одной из следующих двух причин (или даже с обеими этими связанными ситуациями):
1. Использование в процессе производства кефира сырого молока с очень низким, почти отсутствующим, гормональным содержанием мелатонина, что объяснило бы отсутствие мелатонина в готовом продукте;
2. Тип двойного брожения (молочнокислого + спиртового), характерный для кефира, мог бы быть фактором снижения содержания мелатонина в готовом продукте.
Исследование, проведенное по определению разницы между содержанием мелатонина в молоке, собранном из резервуаров временного хранения, молоке, собранном индивидуально от коров, и молоке, подвергнутом тепловой обработке методом УВТ-пастеризации, выделило тот факт, что не было зафиксировано больших различий между содержанием мелатонина, определенным в молоке, собранном из резервуаров-накопителей разных ферм, и молоке, подвергнутом тепловой обработке методом УВТ. Исследование было проведено в Бразилии (Кастро), и образцы молока были собраны из одного и того же географического района, следующим образом: образцы молока, собранные из резервуаров, были собраны из 16 резервуаров временного хранения сырья, индивидуальные образцы молока были собраны от 30 голштинских коров, а образцы УВТ-молока были приобретены в торговой сети у 12 брендов от разных производителей. Согласно результатам, представленным авторами, не было существенной разницы между молоком, собранным из резервуаров, и молоком, обработанным по технологии УВТ-тепловой обработки. Таким образом, для молока, собранного индивидуально от голштинских коров, было определено содержание мелатонина 5,24 пг/мл, для молока, собранного из резервуаров хранения сырья, зафиксированное содержание мелатонина составило 4,08 пг/мл, а для УВТ-молока было зафиксировано содержание мелатонина 4,16 пг/мл [102].
Эти результаты могут свидетельствовать о том, что тепловая обработка по методу УВТ-пастеризации не оказывает отрицательного влияния на содержание мелатонина в молоке. Romanini и его сотрудники [102] собирали молоко из резервуаров временного хранения и от 30 голштинских коров в два разных сезона, летом и зимой. Этот аспект предполагает, что сбор молока в течение более длительного периода времени и из одного и того же географического района, в сочетании с образцами молока, подвергнутыми тепловой обработке методом УВТ и приобретенными на рынке, мог бы укрепить идею о том, что высокие температуры УВТ-пастеризации и тепловой удар, которому подвергалось молоко во время резкого охлаждения, не будут значительно влиять на содержание мелатонина в готовом продукте. Однако также следует учитывать, что проанализированные образцы не прослеживали товаропроводящий поток, поскольку образцы УВТ-молока, собранные на рынке, не были частью той же партии молока, что и образцы, собранные из резервуаров, или образцы, собранные индивидуально от каждого животного. Таким образом, существует вероятность того, что для получения УВТ-молока, проанализированного в этом исследовании, было использовано сырое молоко с более высоким содержанием мелатонина, и процесс тепловой обработки отрицательно повлиял на гормональное содержание мелатонина в готовом продукте. Это утверждение также подтверждается более высоким содержанием мелатонина, обнаруженным авторами в молоке, собранном индивидуально от голштинских коров (5,24 пг/мл), по сравнению с уровнем мелатонина, обнаруженным в молоке, собранном из резервуаров (4,08 пг/мл). Чтобы объяснить это явление, авторы выдвинули идею, что в случае индивидуально собранного молока имело место гораздо лучшее и более эффективное управление фермой в отношении условий секреции мелатонина в коровьем молоке по сравнению с фермами, с которых были собраны образцы из резервуаров.
В связи с тем, что соответствующее исследование не было сосредоточено на изучении содержания мелатонина в объеме молока, который прослеживал бы оптимальную транзитивность производственного потока (от фермы до завода и от завода до торговой сети), мы предлагаем провести более точные исследования, в которых уровень мелатонина, обнаруженный в сыром молоке, полностью полученном на животноводческих фермах, будет сравниваться с готовым молоком/молочными продуктами, полученными из молока, поступившего с животноводческих ферм и подвергнутого различным технологическим процессам (гомогенизация, центробежное сепарирование, сгущение, тепловая обработка, заквашивание с использованием производственных культур и т.д.). Таким образом, можно получить более точные результаты, предоставляющие более конкретную и реалистичную информацию.
Получение натурального молока с высоким содержанием мелатонина путем управления технологическими и питательными факторами, которые могут влиять на процесс синтеза и секреции мелатонина в организме животного, — это тема исследования, результаты которой принесли бы множество выгод фермерам (за счет повышения благополучия сельскохозяйственных животных и получения молока более высокого качества с теми же производственными затратами, но с более высокой ценой продажи по сравнению с сырым цельным молоком, не содержащим избытка биоактивных молекул, естественно существующих в объеме жидкости), переработчикам (за счет реализации продукции более высокого качества по лучшей цене) и конечным потребителям (за счет существования пищевых продуктов с благотворным воздействием на организм).
Молоко и молочные продукты являются важными источниками мелатонина для организма человека; однако присутствие N-ацетил-5-метокситриптамина было зарегистрировано в различных количествах в другом сырье и готовых пищевых продуктах как растительного, так и животного происхождения [29]. В зерновых культурах большие количества мелатонина были зарегистрированы в черном рисе (182,04 ± 1,62 нг/г сухого веса) и в красном рисе (212,01 ± 1,37 нг/г сухого веса); во фруктах большие количества мелатонина были определены в клубнике Fragaria ananassa L. cv. Festival (11,26 ± 0,13 нг/г свежего веса) [29]; а в овощах мелатонин был обнаружен в больших количествах в томатах Lycopersicon esculentum cv. Gordala (17,1 ± 1,21 нг/г свежего веса) и Lycopersicon esculentum cv. Marbonea (18,13 ± 2,24 нг/г свежего веса) [127]. Мелатонин присутствует в различных количествах в продуктах животного происхождения, таких как баранина (1,6 ± 0,14 нг/г), говядина (2,1 ± 0,13 нг/г), свинина (2,5 ± 0,18 нг/г), мясо цыпленка с кожей (2,3 ± 0,23 нг/г), мясо рыбы лососевых пород (3,7 ± 0,21 нг/г) и в цельных яйцах, где мелатонин содержится в концентрации 1,54 нг/г [29].
Трудности, связанные с бессонницей и снижением количеств мелатонина, естественным образом синтезируемого в организме человека из-за старения, делают присутствие мелатонина в сырье растительного и животного происхождения полезной техникой, с помощью которой организм человека может получать экзогенный мелатонин из природных источников. Многочисленные роли и биоактивные функции, которые мелатонин выполняет в организме человека, доказательства, представленные в клинических исследованиях, демонстрирующие, что присутствие более высоких уровней мелатонина в организме человека, по-видимому, не оказывает негативного воздействия на здоровье человека, и тот факт, что до 2024 года не было зарегистрировано случаев, когда потребление продуктов, богатых мелатонином, подвергало бы опасности здоровье потребителей, делают N-ацетил-5-метокситриптамин идеальным кандидатом для поддержания здоровья человека и улучшения выполнения физиологических процессов в организме человека.
6. Роль мелатонина во взаимосвязи с другими биоактивными молекулами в организме животных и человека
Многочисленные исследования продемонстрировали, что мелатонин как гормон, секретируемый эпифизарным и внеэпифизарным путями, а также мелатонин, происходящий из микрофлоры организма или поступающий с пищей каждого индивидуума, взаимодействует с рядом других молекул с биологически активной ролью, чтобы обеспечить выполнение различных функций и ролей в организме животных и человека. Исследования, проведенные в этой области, сообщили, что мелатонин может взаимодействовать в организме животных и человека с серотонином [128], с рецепторами мелатонина MT1, MT2 и MT3 [42,129,130], с лактоферрином [131,132,133,134,135,136,137], с витаминами В3, В6 и В12 [138,139], с гормоном стресса кортизолом [5,140] и с инсулином [141,142,143,144,145], как показано на Рисунке 3.
Рисунок 3. Биоактивные молекулы, с которыми мелатонин может взаимодействовать в организме животных и человека. Оригинальная обработка контента. 3D-модели молекул мелатонина, триптофана, серотонина, лактоферрина, кортизола и инсулина взяты из интернета и защищены авторским правом с разрешением на их использование. Графика: Триптофан, Серотонин, Лактоферрин и Кортизол — Copyright © "Creative Commons CC0 1.0 Universal Public Domain Dedication". Графика: Мелатонин — Все права защищены Free Software Foundation в соответствии с "GNU Free Documentation License". Графика: Инсулин — Copyright © "Creative Commons (CC) Attribution 2.5 Generic".
Серотонин, также известный как 5-гидрокситриптамин или 5-НТ, действует как нейромедиатор и периферический гормон. Синтез серотонина осуществляется в два этапа из незаменимой аминокислоты триптофана. На первом этапе триптофангидроксилаза (ТГ) гидролизует триптофан с образованием 5-гидрокситриптофана, а на втором этапе синтеза серотонина осуществляется декарбоксилирование L-ароматических аминокислот и превращение в 5-гидрокситриптамин [128]. Любое изменение содержания триптофана и/или серотонина в организме будет напрямую влиять на содержание мелатонина в организме и в молоке млекопитающих.
Рецепторы MT1 (MTNR1A) и MT2 (MTNR1B) представляют собой два мембранных рецептора мелатонина. Эти два рецептора принадлежат к суперсемейству рецепторов, связанных с G-белком [119]. Активация рецепторов MT1 или MT2 мелатонином приводит к ингибированию активности PKA (протеинкиназы А), поскольку активация мелатонином этих двух рецепторов снижает количество циклического аденозинмонофосфата (цАМФ) [42]. С точки зрения взаимодействия с мелатонином, рецептор MT3 проявляет более низкое сродство к этому гормону [130].
Лактоферрин (Lf) — это мультифункциональный гликопротеин, принадлежащий к семейству трансферринов и играющий роль в связывании железа в организме животных и человека [131].
Белки молока бывают двух типов: казеин (основной белок молока, составляющий около 80% от общего количества белков молока) и сывороточные белки (составляющие около 20%), которые представляют собой белки, переходящие в сыворотку и пахту после переработки молока для получения определенных категорий молочных продуктов [132].
Лактоферрин, наряду с альфа-лактальбумином, бета-лактоглобулином, иммуноглобулинами, бычьим сывороточным альбумином, гликомакропептидами, лактопероксидазой и лизоцимом, входят в категорию сывороточных белков [133].
Многочисленные исследования выделили роль лактоферрина как антиоксидантного, антибактериального и противовирусного фактора [134], противомикробного и противоракового [135], а также противопаразитарного и противогрибкового [133], а также его роль в поддержании здоровья кишечника [136].
Лактоферрин выполняет антибактериальную роль в организме (являясь также первой открытой функцией этого белка) с помощью двух различных механизмов. Первый механизм осуществления антибактериальной функции лактоферрина включает секвестрацию свободного железа, тем самым лишая бактерии необходимого субстрата для роста и развития этих микроорганизмов. Второй механизм выполнения антибактериальной роли включает связывание лактоферрина с липополисахаридом, входящим в структуру клеточных стенок бактерий, таким образом разрушая бактерии путем образования пероксидов, катализируемых ионами железа (III), связанными с лактоферрином. Таким образом, проницаемость бактериальной мембраны нарушается, что приводит к лизису бактериальной клетки [137].
Бычий лактоферрин (bLF) обладает способностью контролировать выработку активных форм кислорода (АФК) и скорость их элиминации путем секвестрации железа [131].
Пиридоксин (витамин В6) действует как кофермент в синтезе мелатонина, и любой дефицит этого витамина неизбежно приведет к нарушениям сна [138,139], а следовательно, к различным состояниям с негативным воздействием, вызванным недостатком мелатонина в организме.
Некоторые исследования сообщили, что витамин В3 (ниацин) может оказывать триптофан-сберегающий эффект, а витамин В12 (кобаламин) напрямую способствует процессу секреции мелатонина [139].
Кортизол — это глюкокортикоидный гормон, который вырабатывается надпочечниками, и выделение этого гормона в организме следует циркадному ритму, регулируемому внутренними часами, расположенными в супрахиазматическом ядре [140]. Мелатонин может регулировать секрецию определенных гормонов, в частности, подавляя высвобождение кортикотропина (КТР) из гипоталамуса. Подавляя секрецию КТР, мелатонин приводит к снижению уровней адренокортикотропного гормона (АКТГ) и кортизола в ночное время [5].
Инсулин — это полипептидный гормон, состоящий из 51 аминокислоты и секретируемый главным образом β-клетками, расположенными в островках Лангерганса поджелудочной железы. Основная роль этого гормона в организме заключается в модуляции уровня глюкозы в крови, а также он играет роль в гомеостазе глюкозы, метаболизме и росте клеток [141]. Некоторые клинические исследования выделили роль, которую рецепторы мелатонина MT1 и MT2 играют в процессе секреции инсулина [142].
Исследования, проведенные в области изучения взаимодействий, которые могут возникать между мелатонином и инсулином, продемонстрировали, что существует прямая и обратно пропорциональная связь между количеством мелатонина, синтезируемого в организме, и процессами подавления или стимуляции (в зависимости от обстоятельств) синтеза и секреции инсулина. Так, было продемонстрировано, что большое количество мелатонина, секретируемого в организме, может подавлять секрецию инсулина через рецепторы мелатонина, расположенные на β-клетках поджелудочной железы. Рецепторы мелатонина связаны с тремя различными сигнальными путями (цАМФ, цГМФ и IP3) и оказывают свое собственное уникальное и различное влияние на секрецию инсулина [143,144,145]. Связывание мелатонина с рецептором MT1 может привести к подавлению секреции инсулина путем снижения цАМФ. Это явление происходит из-за связывания рецепторов MT1 с Gi (ингибиторными) белками, что, в свою очередь, приводит к снижению цАМФ (циклического аденозинмонофосфата) и ингибированию активности PKA [145].
Мелатонин может также влиять на сигнальный путь цГМФ (циклический гуанозинмонофосфат), стимулируя сосудорасширяющие сигналы через оксид азота (NO). Сигнальный путь цГМФ может способствовать секреции инсулина, так как может увеличивать панкреатический кровоток путем активации протеинкиназы (которая зависит от сигнального пути цГМФ). Таким образом, NO может активировать гуанилатциклазу, тем самым повышая уровни цГМФ и стимулируя секрецию инсулина. Путь IP3 (инозитолтрифосфат) играет роль в регуляции внутриклеточной концентрации кальция и может подвергаться влиянию присутствия мелатонина, который связывается с рецепторами MT1 и MT2 — рецепторами, которые могут активировать G-белки Gq-типа. Таким образом, когда два рецептора мелатонина (MT1 и MT2) активируются, они позволяют Gq-белку, с которым они связаны, активировать PLC (фосфолипазу C). Впоследствии PLC катализирует разложение PIP2 (фосфатидилинозитол-4,5-бисфосфата) на два других вторичных мессенджера (IP3 и диацилглицерол). Наконец, путь IP3 стимулирует высвобождение ионов Ca2+ из эндоплазматического ретикулума в цитоплазму, таким образом способствуя секреции инсулина из-за увеличения внутриклеточного уровня кальция [145].
Следовательно, мелатонин может играть роль в модуляции синтеза и секреции инсулина через рецепторы MT1 и MT2, с которыми связывается мелатонин. Присутствие мелатонина в организме позвоночного и его взаимодействие (мелатонина) с рецепторами MT1 и MT2 может модулировать синтез и секрецию инсулина путем стимуляции или подавления благодаря трем сигнальным путям (цАМФ, цГМФ и IP3), через которые работает мелатонин.
7. Выводы
Многочисленные роли и функции, которые мелатонин выполняет в организме животных и человека, как индивидуально, так и во взаимосвязи с другими биоактивными молекулами, делают этот гормон ценным соединением, активно участвующим в улучшении условий жизни путем поддержания оптимального здоровья организма.
Правильное управление технологическими и питательными факторами, которые могут положительно влиять на содержание мелатонина в коровьем молоке, имеет важные последствия для внедрения высококачественных сельскохозяйственных и зоотехнических практик благодаря более высокому уровню благополучия сельскохозяйственных животных. Этот уровень достигается путем регуляции циркадного ритма, улучшения качества сна и регуляции основных физиологических процессов, таких как размножение.
Эта статья содержит ценную информацию относительно процессов синтеза и секреции мелатонина в организмах позвоночных, его многочисленных ролей и функций как в организмах животных, так и человека, а также основных факторов, которые могут напрямую влиять на синтез мелатонина в организме крупного рогатого скота, а также на последующее выделение этого гормона в молоко коров. Специализированные исследования, проведенные в этой области к 2024 году, предоставили ценную информацию, позволившую глубже понять мелатонин как биоактивную молекулу. Однако необходимо провести больше экспериментов, сосредоточенных на изучении влияния условий содержания коров на содержание мелатонина в молоке, и некоторые будущие исследования также должны быть направлены на изучение влияния технологических процессов переработки молока на содержание мелатонина, обнаруженное в готовых молочных продуктах.
Ссылки
1. Reiter, R.J.; Sharma, R.; Tan, D.-X.; Chuffa, L.G.d.A.; da Silva, D.G.H.; Slominski, A.T.; Steinbrink, K.; Kleszczynski, K. Dual sources of melatonin and evidence for different primary functions. Front. Endocrinol. 2024, 15, 1414463. [Google Scholar] [CrossRef]
2. Chlubek, D.; Sikora, M. Fluoride and Pineal Gland. Appl. Sci. 2020, 10, 2885. [Google Scholar] [CrossRef]
3. Tan, D.-X.; Zheng, X.; Kong, J.; Manchester, L.C.; Hardeland, R.; Kim, S.J.; Xu, X.; Reiter, R.J. Fundamental issues related to the origin of melatonin and melatonin isomers during evolution: Relation to their biological functions. Int. J. Mol. Sci. 2014, 15, 15858–15890. [Google Scholar] [CrossRef] [PubMed]
4. Tan, D.-X.; Reiter, R.J.; Zimmerman, S.; Hardeland, R. Melatonin: Both a Messenger of Darkness and a Participant in the Cellular Actions of Non-Visible Solar Radiation of Near Infrared Light. Biology 2023, 12, 89. [Google Scholar] [CrossRef]
5. Andrani, M.; Dall’Olio, E.; De Rensis, F.; Tummaruk, P.; Saleri, R. Bioactive Peptides in Dairy Milk: Highlighting the Role of Melatonin. Biomolecules 2024, 14, 934. [Google Scholar] [CrossRef]
6. Lerner, A.B.; Case, J.D.; Takahashi, Y.; Lee, T.H.; Mori, W. Isolation of melatonin, the pineal gland factor that lightens melanocytes. J. Am. Chem. Soc. 1958, 80, 2587. [Google Scholar] [CrossRef]
7. Mannino, G.; Pernici, C.; Serio, G.; Gentile, C.; Bertea, C.M. Melatonin and Phytomelatonin: Chemistry, Biosynthesis, Metabolism, Distribution and Bioactivity in Plants and Animals—An Overview. Int. J. Mol. Sci. 2021, 22, 9996. [Google Scholar] [CrossRef]
8. Masters, A.; Pandi-Perumal, S.R.; Seixas, A.; Girardin, J.L.; McFarlane, S.I. Melatonin, the Hormone of Darkness: From Sleep Promotion to Ebola Treatment. Brain Disord. Ther. 2014, 4, 1000151. [Google Scholar] [CrossRef]
9. Srinivasan, V.; Spence, W.D.; Pandi-Perumal, S.R.; Zakharia, R.; Bhatnagar, K.P.; Brzezinski, A. Melatonin and human reproduction: Shedding light on the darkness hormone. Gynecol. Endocrinol. 2009, 25, 779–785. [Google Scholar] [CrossRef]
10. Patel, S.; Rahmani, B.; Gandhi, J.; Seyam, O.; Joshi, G.; Reid, I.; Smith, N.L.; Waltzer, W.C.; Khan, S.A. Revisiting the pineal gland: A review of calcification, masses, precocious puberty, and melatonin functions. Int. J. Neurosci. 2020, 130, 464–475. [Google Scholar] [CrossRef] [PubMed]
11. Tan, D.-X.; Manchester, L.C.; Esteban-Zubero, E.; Zhou, Z.; Reiter, R.J. Melatonin as a Potent and Inducible Endogenous Antioxidant: Synthesis and Metabolism. Molecules 2015, 20, 18886–18906. [Google Scholar] [CrossRef]
12. Manchester, L.C.; Coto-Montes, A.; Boga, J.A.; Andersen, L.P.H.; Zhou, Z.; Galano, A.; Vriend, J.; Tan, D.-X.; Reiter, R.J. Melatonin: An ancient molecule that makes oxygen metabolically tolerable. J. Pineal Res. 2015, 59, 403–419. [Google Scholar] [CrossRef] [PubMed]
13. Horodincu, L.; Solcan, C. Influence of Different Light Spectra on Melatonin Synthesis by the Pineal Gland and Influence on the Immune System in Chickens. Animals 2023, 13, 2095. [Google Scholar] [CrossRef] [PubMed]
14. Polakovičová, S.; Líška, J.; Varga, I.; Gálfiová, P. Morphology of the Human Pineal Gland Studied by Freeze-Fracturing in Scanning Electron Microscopy. Life 2024, 14, 1617. [Google Scholar] [CrossRef] [PubMed]
15. Cassone, V.M. Avian circadian organization: A chorus of clocks. Front. Neuroendocrinol. 2014, 35, 76–88. [Google Scholar] [CrossRef] [PubMed]
16. Esteban, M.Á.; Cuesta, A.; Chaves-Pozo, E.; Meseguer, J. Influence of Melatonin on the Immune System of Fish: A Review. Int. J. Mol. Sci. 2013, 14, 7979–7999. [Google Scholar] [CrossRef]
17. Bisquert, R.; Planells-Cárcel, A.; Alonso-del-Real, J.; Muñiz-Calvo, S.; Guillamón, J.M. The Role of the PAA1 Gene on Melatonin Biosynthesis in Saccharomyces cerevisiae: A Search of New Arylalkylamine N-Acetyltransferases. Microorganisms 2023, 11, 1115. [Google Scholar] [CrossRef] [PubMed]
18. Zisapel, N. New perspectives on the role of melatonin in human sleep, circadian rhythms and their regulation. Br. J. Pharmacol. 2018, 175, 3190–3199. [Google Scholar] [CrossRef] [PubMed]
19. Li, Z.; Zhang, K.; Zhou, Y.; Zhao, J.; Wang, J.; Lu, W. Role of Melatonin in Bovine Reproductive Biotechnology (Review). Molecules 2023, 28, 4940. [Google Scholar] [CrossRef]
20. Kopustinskiene, D.M.; Bernatoniene, J. Molecular Mechanisms of Melatonin-Mediated Cell Protection and Signaling in Health and Disease. Pharmaceutics 2021, 13, 129. [Google Scholar] [CrossRef] [PubMed]
21. Mauriz, J.L.; Collado, P.S.; Veneroso, C.; Reiter, R.J.; Gonzalez-Gallego, J. A review of the molecular aspects of melatonin’s anti-inflammatory actions: Recent insights and new perspectives. J. Pineal Res. 2013, 54, 1–14. [Google Scholar] [CrossRef] [PubMed]
22. Hardeland, R. Aging, Melatonin, and the Pro- and Anti-Inflammatory Networks. Int. J. Mol. Sci. 2019, 20, 1223. [Google Scholar] [CrossRef]
23. Mendes, L.; Queiroz, M.; Sena, C.M. Melatonin and Vascular Function. Antioxidants 2024, 13, 747. [Google Scholar] [CrossRef] [PubMed]
24. Asghari, M.H.; Moloudizargari, M.; Ghobadi, E.; Fallah, M.; Abdollahi, M. Melatonin as a Multifunctional Anti-Cancer Molecule: Implications in Gastric Cancer. Life Sci. 2017, 185, 38–45. [Google Scholar] [CrossRef]
25. Di Bella, G.; Mascia, F.; Gualano, L.; Di Bella, L. Melatonin Anticancer Effects: Review. Int. J. Mol. Sci. 2013, 14, 2410–2430. [Google Scholar] [CrossRef]
26. Fernández, A.; Ordóñez, R.; Reiter, R.J.; González-Gallego, J.; Mauriz, J.L. Melatonin and endoplasmic reticulum stress: Relation to autophagy and apoptosis. J. Pineal Res. 2015, 59, 292–307. [Google Scholar] [CrossRef]
27. Zhi, S.M.; Fang, G.X.; Xie, X.M.; Liu, L.H.; Yan, J.; Liu, D.B.; Yu, H.Y. Melatonin reduces OGD/R-induced neuron injury by regulating redox/inflammation/apoptosis signaling. Eur. Rev. Med. Pharmacol. Sci. 2020, 24, 1524–1536. [Google Scholar] [CrossRef] [PubMed]
28. Lee, J.H.; Yoon, Y.M.; Song, K.-H.; Noh, H.; Lee, S.H. Melatonin suppresses senescence-derived mitochondrial dysfunction in mesenchymal stem cells via the HSPA1L-mitophagy pathway. Aging Cell 2020, 19, e13111. [Google Scholar] [CrossRef]
29. Meng, X.; Li, Y.; Li, S.; Zhou, Y.; Gan, R.-Y.; Xu, D.-P.; Li, H.-B. Dietary Sources and Bioactivities of Melatonin. Nutrients 2017, 9, 367. [Google Scholar] [CrossRef]
30. Guaadaoui, A.; Bellaoui, M.; Elmajdoub, N.; Bellaoui, M.; Hamal, A. What is a bioactive compound? A combined definition for a preliminary consensus. Int. J. Nutr. Food Sci. 2014, 3, 174–179. [Google Scholar] [CrossRef]
31. Vilas-Boas, A.A.; Pintado, M.; Oliveira, A.L.S. Natural Bioactive Compounds from Food Waste: Toxicity and Safety Concerns. Foods 2021, 10, 1564. [Google Scholar] [CrossRef]
32. Sorrenti, V.; Burò, I.; Consoli, V.; Vanella, L. Recent Advances in Health Benefits of Bioactive Compounds from Food Wastes and By-Products: Biochemical Aspects. Int. J. Mol. Sci. 2023, 24, 2019. [Google Scholar] [CrossRef] [PubMed]
33. Acuña-Castroviejo, D.; Escames, G.; Venegas, C.; Díaz-Casado, M.E.; Lima-Cabello, E.; López, L.C.; Rosales-Corral, S.; Tan, D.X.; Reiter, R.J. Extrapineal melatonin: Sources, regulation, and potential functions. Cell Mol. Life Sci. 2014, 71, 2997–3025. [Google Scholar] [CrossRef]
34. Markus, R.P.; Sousa, K.S.; da Silveira Cruz-Machado, S.; Fernandes, P.A.; Ferreira, Z.S. Possible Role of Pineal and Extra-Pineal Melatonin in Surveillance, Immunity, and First-Line Defense. Int. J. Mol. Sci. 2021, 22, 12143. [Google Scholar] [CrossRef] [PubMed]
35. Bonnefont-Rousselot, D.; Collin, F. Melatonin: Action as antioxidant and potential applications in human disease and aging. Toxicology 2010, 278, 55–67. [Google Scholar] [CrossRef] [PubMed]
36. Lumsden, S.C.; Clarkson, A.N.; Cakmak, Y.O. Neuromodulation of the Pineal Gland via Electrical Stimulation of Its Sympathetic Innervation Pathway. Front. Neurosci. 2020, 14, 264. [Google Scholar] [CrossRef]
37. Lee, K.; Back, K. Functional Characterization of the Ciliate Stylonychia lemnae Serotonin N-Acetyltransferase, a Pivotal Enzyme in Melatonin Biosynthesis and Its Overexpression Leads to Peroxidizing Herbicide Tolerance in Rice. Antioxidants 2024, 13, 1177. [Google Scholar] [CrossRef] [PubMed]
38. Xie, X.; Ding, D.; Bai, D.; Zhu, Y.; Sun, W.; Sun, Y.; Zhang, D. Melatonin biosynthesis pathways in nature and its production in engineered microorganisms. Synth. Syst. Biotechnol. 2022, 7, 544–553. [Google Scholar] [CrossRef] [PubMed]
39. Hwang, O.J.; Back, K. Functional Characterization of Arylalkylamine N-Acetyltransferase, a Pivotal Gene in Antioxidant Melatonin Biosynthesis from Chlamydomonas reinhardtii. Antioxidants 2022, 11, 1531. [Google Scholar] [CrossRef] [PubMed]
40. Zhao, D.; Yu, Y.; Shen, Y.; Liu, Q.; Zhao, Z.; Sharma, R.; Reiter, R.J. Melatonin Synthesis and Function: Evolutionary History in Animals and Plants. Front. Endocrinol. 2019, 10, 249. [Google Scholar] [CrossRef] [PubMed]
41. Suofu, Y.; Li, W.; Jean-Alphonse, F.G.; Jia, J.; Khattar, N.K.; Li, J.; Baranov, S.V.; Leronni, D.; Mihalik, A.C.; He, Y.; et al. Dual role of mitochondria in producing melatonin and driving GPCR signaling to block cytochrome c release. Proc. Natl. Acad. Sci. USA 2017, 114, E7997–E8006. [Google Scholar] [CrossRef] [PubMed]
42. Wang, L.; Wang, C.; Choi, W.S. Use of Melatonin in Cancer Treatment: Where Are We? Int. J. Mol. Sci. 2022, 23, 3779. [Google Scholar] [CrossRef] [PubMed]
43. Tordjman, S.; Chokron, S.; Delorme, R.; Charrier, A.; Bellissant, E.; Jaafari, N.; Fougerou, C. Melatonin: Pharmacology, Functions and Therapeutic Benefits. Curr. Neuropharmacol. 2017, 15, 434–443. [Google Scholar] [CrossRef] [PubMed]
44. Miranda-Riestra, A.; Estrada-Reyes, R.; Torres-Sanchez, E.D.; Carreño-García, S.; Ortiz, G.G.; Benítez-King, G. Melatonin: A Neurotrophic Factor? Molecules 2022, 27, 7742. [Google Scholar] [CrossRef]
45. Slominski, A.T.; Zmijewski, M.A.; Semak, I.; Kim, T.K.; Janjetovic, Z.; Slominski, R.M.; Zmijewski, J.W. Melatonin, mitochondria, and the skin. Cell. Mol. Life Sci. 2017, 74, 3913–3925. [Google Scholar] [CrossRef] [PubMed]
46. Slominski, A.; Tobin, D.J.; Zmijewski, M.A.; Wortsman, J.; Paus, R. Melatonin in the skin: Synthesis, metabolism and functions. Trends Endocrinol. Metab. TEM 2008, 19, 17–24. [Google Scholar] [CrossRef]
47. Felder-Schmittbuhl, M.P.; Hicks, D.; Ribelayga, C.P.; Tosini, G. Melatonin in the mammalian retina: Synthesis, mechanisms of action and neuroprotection. J. Pineal Res. 2024, 76, e12951. [Google Scholar] [CrossRef] [PubMed]
48. Iuvone, P.M.; Tosini, G.; Pozdeyev, N.; Haque, R.; Klein, D.C.; Chaurasia, S.S. Circadian clocks, clock networks, arylalkylamine N-acetyltransferase, and melatonin in the retina. Prog. Retin. Eye Res. 2005, 24, 433–456. [Google Scholar] [CrossRef] [PubMed]
49. Sanchez-Hidalgo, M.; de la Lastra, C.A.; Carrascosa-Salmoral, M.P.; Naranjo, M.C.; Gomez-Corvera, A.; Caballero, B.; Guerrero, J.M. Age-related changes in melatonin synthesis in rat extrapineal tissues. Exp. Gerontol. 2009, 44, 328–334. [Google Scholar] [CrossRef] [PubMed]
50. Bocheva, G.; Bakalov, D.; Iliev, P.; Tafradjiiska-Hadjiolova, R. The Vital Role of Melatonin and Its Metabolites in the Neuroprotection and Retardation of Brain Aging. Int. J. Mol. Sci. 2024, 25, 5122. [Google Scholar] [CrossRef] [PubMed]
51. Alkozi, H.A.; Pintor, J. TRPV4 activation triggers the release of melatonin from human non-pigmented ciliary epithelial cells. Exp. Eye Res. 2015, 136, 34–37. [Google Scholar] [CrossRef] [PubMed]
52. Naranjo, M.C.; Guerrero, J.M.; Rubio, A.; Lardone, P.J.; Carrillo-Vico, A.; Carrascosa-Salmoral, M.P.; Jiménez-Jorge, S.; Arellano, M.V.; Leal-Noval, S.R.; Leal, M.; et al. Melatonin biosynthesis in the thymus of humans and rats. Cell Mol. Life Sci. 2007, 64, 781–790. [Google Scholar] [CrossRef] [PubMed]
53. Bonmatí-Carrión, M.-Á.; Tomas-Loba, A. Melatonin and Cancer: A Polyhedral Network Where the Source Matters. Antioxidants 2021, 10, 210. [Google Scholar] [CrossRef] [PubMed]
54. Reiter, R.J.; Rosales-Corral, S.; Boga, J.A.; Tan, D.-X.; Davis, J.M.; Konturek, P.C.; Konturek, S.J.; Brzozowski, T. The photoperiod, circadian regulation and chronodisruption: The requisite interplay between the suprachiasmatic nuclei and the pineal and gut melatonin. J. Physiol. Pharmacol. 2011, 62, 269–274. [Google Scholar]
55. Bonmatí-Carrión, M.-Á.; Rol, M.-A. Melatonin as a Mediator of the Gut Microbiota–Host Interaction: Implications for Health and Disease. Antioxidants 2024, 13, 34. [Google Scholar] [CrossRef] [PubMed]
56. Holtkamp, C.E.; Warmus, D.; Bonowicz, K.; Gagat, M.; Linowiecka, K.; Wolnicka-Glubisz, A.; Reiter, R.J.; Böhm, M.; Slominski, A.T.; Steinbrink, K.; et al. Ultraviolet Radiation-Induced Mitochondrial Disturbances Are Attenuated by Metabolites of Melatonin in Human Epidermal Keratinocytes. Metabolites 2023, 13, 861. [Google Scholar] [CrossRef]
57. Bocheva, G.; Slominski, R.M.; Janjetovic, Z.; Kim, T.-K.; Böhm, M.; Steinbrink, K.; Reiter, R.J.; Kleszczyński, K.; Slominski, A.T. Protective Role of Melatonin and Its Metabolites in Skin Aging. Int. J. Mol. Sci. 2022, 23, 1238. [Google Scholar] [CrossRef] [PubMed]
58. Galano, A.; Reiter, R.J. Melatonin and Its Metabolites vs Oxidative Stress: From Individual Actions to Collective Protection. J. Pineal Res. 2018, 65, e12514. [Google Scholar] [CrossRef]
59. Bae, S.M.; Jeong, J.; Jeon, H.J.; Bang, Y.R.; Yoon, I.Y. Effects of melatonin-rich milk on mild insomnia symptoms. Sleep. Med. Res. 2016, 7, 60–67. [Google Scholar] [CrossRef]
60. Brzezinski, A.; Rai, S.; Purohit, A.; Pandi-Perumal, S.R. Melatonin, Clock Genes, and Mammalian Reproduction: What Is the Link? Int. J. Mol. Sci. 2021, 22, 13240. [Google Scholar] [CrossRef] [PubMed]
61. Li, Q.; Tang, Y.; Chen, Y.; Li, B.; Wang, H.; Liu, S.; Adeniran, S.O.; Zheng, P. Melatonin Regulates the Expression of VEGF and HOXA10 in Bovine Endometrial Epithelial Cells through the SIRT1/PI3K/AKT Pathway. Animals 2024, 14, 2771. [Google Scholar] [CrossRef] [PubMed]
62. Cipolla-Neto, J.; Amaral, F.G.; Afeche, S.C.; Tan, D.X.; Reiter, R.J. Melatonin, energy metabolism, and obesity: A review. J. Pineal Res. 2014, 56, 371–381. [Google Scholar] [CrossRef] [PubMed]
63. Suzen, S.; Atayik, M.C.; Sirinzade, H.; Entezari, B.; Gurer-Orhan, H.; Cakatay, U. Melatonin and redox homeostasis. Melatonin Res. 2022, 5, 304–324. [Google Scholar] [CrossRef]
64. Rzepka-Migut, B.; Paprocka, J. Melatonin-Measurement Methods and the Factors Modifying the Results. A Systematic Review of the Literature. Int. J. Environ. Res. Public Health 2020, 17, 1916. [Google Scholar] [CrossRef] [PubMed]
65. Reiter, R.J.; Tan, D.X.; Kim, S.J.; Cruz, M.H.C. Delivery of pineal melatonin to the brain and SCN: Role of canaliculi, cerebrospinal fluid, tanycytes and Virchow–Robin perivascular spaces. Brain Struct. Funct. 2014, 219, 1873–1887. [Google Scholar] [CrossRef] [PubMed]
66. Mao, L.; Dauchy, R.T.; Blask, D.E.; Slakey, L.M.; Xiang, S.; Yuan, L.; Dauchy, E.M.; Shan, B.; Brainard, G.C.; Hanifin, J.P.; et al. Circadian gating of epithelial-to-mesenchymal transition in breast cancer cells via melatonin-regulation of GSK3β. Mol. Endocrinol. 2012, 26, 1808–1820. [Google Scholar] [CrossRef] [PubMed]
67. Gao, Y.; Zhao, S.; Zhang, Y.; Zhang, Q. Melatonin Receptors: A Key Mediator in Animal Reproduction. Vet. Sci. 2022, 9, 309. [Google Scholar] [CrossRef] [PubMed]
68. Li, D.Y.; Smith, D.G.; Hardeland, R.; Yang, M.Y.; Xu, H.L.; Zhang, L.; Yin, H.D.; Zhu, Q. Melatonin Receptor Genes in Vertebrates. Int. J. Mol. Sci. 2013, 14, 11208–11223. [Google Scholar] [CrossRef]
69. Peña-Delgado, V.; Carvajal-Serna, M.; Fondevila, M.; Martín-Cabrejas, M.A.; Aguilera, Y.; Álvarez-Rivera, G.; Abecia, J.A.; Casao, A.; Pérez-Pe, R. Improvement of the Seminal Characteristics in Rams Using Agri-Food By-Products Rich in Phytomelatonin. Animals 2023, 13, 905. [Google Scholar] [CrossRef] [PubMed]
70. Pereira, N.; Naufel, M.F.; Ribeiro, E.B.; Tufik, S.; Hachul, H. Influence of Dietary Sources of Melatonin on Sleep Quality: A Review. J. Food Sci. 2020, 85, 5–13. [Google Scholar] [CrossRef]
71. Karolczak, K.; Watala, C. Melatonin as a Reducer of Neuro- and Vasculotoxic Oxidative Stress Induced by Homocysteine. Antioxidants 2021, 10, 1178. [Google Scholar] [CrossRef] [PubMed]
72. Reiter, R.J.; Tan, D.X.; Korkmaz, A.; Rosales-Corral, S.A. Melatonin and stable circadian rhythms optimize maternal, placental and fetal physiology. Hum. Reprod. Update 2014, 20, 293–307. [Google Scholar] [CrossRef]
73. Ma, N.; Zhang, J.; Reiter, R.J.; Ma, X. Melatonin mediates mucosal immune cells, microbial metabolism, and rhythm crosstalk: A therapeutic target to reduce intestinal inflammation. Med. Res. Rev. 2020, 40, 606–632. [Google Scholar] [CrossRef] [PubMed]
74. Gombert, M.; Codoñer-Franch, P. Melatonin in Early Nutrition: Long-Term Effects on Cardiovascular System. Int. J. Mol. Sci. 2021, 22, 6809. [Google Scholar] [CrossRef] [PubMed]
75. Tamtaji, O.R.; Mirhosseini, N.; Reiter, R.J.; Azami, A.; Asemi, Z. Melatonin, a calpain inhibitor in the central nervous system: Current status and future perspectives. J. Cell Physiol. 2018, 234, 1001–1007. [Google Scholar] [CrossRef] [PubMed]
76. Tan, D.-X.; Xu, B.; Zhou, X.; Reiter, R.J. Pineal Calcification, Melatonin Production, Aging, Associated Health Consequences and Rejuvenation of the Pineal Gland. Molecules 2018, 23, 301. [Google Scholar] [CrossRef]
77. Carrillo-Vico, A.; Lardone, P.J.; Alvarez-Sánchez, N.; Rodríguez-Rodríguez, A.; Guerrero, J.M. Melatonin: Buffering the immune system. Int. J. Mol. Sci. 2013, 14, 8638–8683. [Google Scholar] [CrossRef] [PubMed]
78. Vorster, A.P.A.; van Someren, E.J.W.; Pack, A.I.; Huber, R.; Schmidt, M.H.; Bassetti, C.L.A. Sleep Health. Clin. Transl. Neurosci. 2024, 8, 8. [Google Scholar] [CrossRef]
79. Chattu, V.K.; Manzar, M.D.; Kumary, S.; Burman, D.; Spence, D.W.; Pandi-Perumal, S.R. The Global Problem of Insufficient Sleep and Its Serious Public Health Implications. Healthcare 2019, 7, E1. [Google Scholar] [CrossRef] [PubMed]
80. Sejbuk, M.; Mirończuk-Chodakowska, I.; Witkowska, A.M. Sleep Quality: A Narrative Review on Nutrition, Stimulants, and Physical Activity as Important Factors. Nutrients 2022, 14, 1912. [Google Scholar] [CrossRef] [PubMed]
81. Paditz, E. Postnatal Development of the Circadian Rhythmicity of Human Pineal Melatonin Synthesis and Secretion (Systematic Review). Children 2024, 11, 1197. [Google Scholar] [CrossRef]
82. Paditz, E. Melatonin in infants-Physiology, pathophysiology and intervention options. Somnologie 2024, 28, 103–109. [Google Scholar] [CrossRef]
83. Honorio-França, A.C.; Hara, C.C.P.; Ormonde, J.V.S.; Nunes, G.T.; França, E.L. Human colostrum melatonin exhibits a day-night variation and modulates the activity of colostral phagocytes. J. Appl. Biomed. 2013, 11, 153–162. [Google Scholar] [CrossRef]
84. Italianer, M.F.; Naninck, E.F.G.; Roelants, J.A.; van der Horst, G.T.J.; Reiss, I.K.M.; Goudoever, J.B.v.; Joosten, K.F.M.; Chaves, I.; Vermeulen, M.J. Circadian Variation in Human Milk Composition, a Systematic Review. Nutrients 2020, 12, 2328. [Google Scholar] [CrossRef]
85. Wang, X. The antiapoptotic activity of melatonin in neurodegenerative diseases. CNS Neurosci. Ther. 2009, 15, 345–357. [Google Scholar] [CrossRef] [PubMed]
86. Biggio, G.; Biggio, F.; Talani, G.; Mostallino, M.C.; Aguglia, A.; Aguglia, E.; Palagini, L. Melatonin: From Neurobiology to Treatment. Brain Sci. 2021, 11, 1121. [Google Scholar] [CrossRef]
87. Logan, R.W.; McClung, C.A. Rhythms of life: Circadian disruption and brain disorders across the lifespan. Nat. Rev. Neurosci. 2019, 20, 49–65. [Google Scholar] [CrossRef] [PubMed]
88. Mander, B.A.; Winer, J.R.; Walker, M.P. Sleep and Human Aging. Neuron 2017, 94, 19–36. [Google Scholar] [CrossRef]
89. Milagres, M.P.; Minim, V.P.R.; A Minim, L.; A Simiqueli, A.; Moraes, L.E.S.; Martino, H.S.D. Night milking adds value to cow’s milk. J. Sci. Food Agric. 2013, 94, 1688–1692. [Google Scholar] [CrossRef] [PubMed]
90. Usturoi, M.G. The Technology of Milk and Dairy Products; Alfa Publishing House: Iasi, Romania, 2007. [Google Scholar]
91. Rațu, R.N.; Cârlescu, P.M.; Usturoi, M.G.; Lipșa, F.D.; Veleșcu, I.D.; Arsenoaia, V.N.; Florea, A.M.; Ciobanu, M.M.; Radu-Rusu, R.-M.; Postolache, A.N.; et al. Effects of Dairy Cows Management Systems on the Physicochemical and Nutritional Quality of Milk and Yogurt, in a North-Eastern Romanian Farm. Agriculture 2023, 13, 1295. [Google Scholar] [CrossRef]
92. Matei, M.; Zaharia, R.; Petrescu, S.-I.; Radu-Rusu, C.G.; Simeanu, D.; Mierliță, D.; Pop, I.M. Persistent Organic Pollutants (POPs): A Review Focused on Occurrence and Incidence in Animal Feed and Cow Milk. Agriculture 2023, 13, 873. [Google Scholar] [CrossRef]
93. Robinson, R.C. Structures and metabolic properties of bovine milk oligosaccharides and their potential in the development of novel therapeutics. Front. Nutr. 2019, 6, 50. [Google Scholar] [CrossRef]
94. Yuzbashian, E.; Berg, E.; de Campos Zani, S.C.; Chan, C.B. Cow’s Milk Bioactive Molecules in the Regulation of Glucose Homeostasis in Human and Animal Studies. Foods 2024, 13, 2837. [Google Scholar] [CrossRef]
95. Usturoi, A.; Usturoi, M.-G.; Avarvarei, B.-V.; Pânzaru, C.; Simeanu, C.; Usturoi, M.-I.; Spătaru, M.; Radu-Rusu, R.-M.; Doliş, M.-G.; Simeanu, D. Research Regarding Correlation between the Assured Health State for Laying Hens and Their Productivity. Agriculture 2023, 13, 86. [Google Scholar] [CrossRef]
96. Helmreich, S.; Wechsler, B.; Hauser, R.; Gygax, L. Effects of milking frequency in automatic milking systems on salivary cortisol, immunoglobulin A, somatic cell count and melatonin. Schweiz Arch Tierheilkd 2016, 158, 179–186. [Google Scholar] [CrossRef] [PubMed]
97. Muthuramalingam, P.; Kennedy, A.D.; Berry, R.J. Plasma melatonin and insulin-like growth factor-1 responses to dim light at night in dairy heifers. J. Pineal Res. 2006, 40, 225–229. [Google Scholar] [CrossRef] [PubMed]
98. Bal, M.A.; Penner, G.B.; Oba, M.; Kennedy, A.D. Effects of dim light at night on milk yield, milk composition and endocrine profile of lactating dairy cows. Can. J. Anim. Sci. 2008, 88, 609–612. [Google Scholar] [CrossRef]
99. Boztepe, S.; Keskin, I.; Semacan, A.; Akyürek, F.; Aytekin, I.; Sahin, Ö. Melatonin Differences Between Day and Night Milk in Primiparous Holstein Friesian and Jersey Dairy Cattle. Selcuk. J. Agric. Food Sci. 2022, 36, 27–30. [Google Scholar] [CrossRef]
100. Keskin, M.; Gül, S.; Karaaslan, İ.; Yakan, A. Controlling the photoperiod to raise the melatonin content of sheep milk. Photoperiod control and milk melatonin content. J. Hell. Vet. Med. Soc. 2023, 74, 6641–6648. [Google Scholar] [CrossRef]
101. Şahin, Ö.; Akyürek, F.; Boztepe, S.; Aytekin, İ.; Keskin, İ. Determination of Melatonin Differences between Day and Night Milk in Dairy Cattle. J. Agric. Sci. Bilim. Derg. 2021, 27, 449–453. [Google Scholar] [CrossRef]
102. Romanini, E.B.; Marchi Volpato, A.; Dos Santos, J.S.; De Santana, E.H.W.; De Souza, C.H.B.; Ludovico, A. Melatonin concentration in cow’s milk and sources of its variation. J. Appl. Anim. Res. 2019, 47, 140–145. [Google Scholar] [CrossRef]
103. Asher, A.; Shabtay, A.; Brosh, A.; Eitam, H.; Agmon, R.; Cohen-Zinder, M.; Zubidat, A.E.; Haim, A. “Chrono-functional milk”: The difference between melatonin concentrations in night-milk versus day-milk under different night illumination conditions. Chronobiol. Int. 2015, 32, 1409–1416. [Google Scholar] [CrossRef] [PubMed]
104. Teng, Z.W.; Yang, G.Q.; Wang, I.F.; Fu, T.; Lian, H.X.; Sun, Y.; Han, L.Q.; Zhang, L.Y.; Gao, T.Y. Effects of the Circadian Rhythm on Milk Composition in Dairy Cows: Does Day Milk Differ from Night Milk? J. Dairy Sci. 2021, 104, 8301–8313. [Google Scholar] [CrossRef]
105. Jo, J.-H.; Jalil, G.N.; Kim, W.-S.; Moon, J.-O.; Lee, S.-D.; Kwon, C.-H.; Lee, H.-G. Effects of Rumen-Protected L-Tryptophan Supplementation on Productivity, Physiological Indicators, Blood Profiles, and Heat Shock Protein Gene Expression in Lactating Holstein Cows under Heat Stress Conditions. Int. J. Mol. Sci. 2024, 25, 1217. [Google Scholar] [CrossRef]
106. Stelwagen, K.; Phyn, C.V.; Davis, S.R.; Guinard-Flament, J.; Pomiès, D.; Roche, J.R.; Kay, J.K. Invited review: Reduced milking frequency: Milk production and management implications. J. Dairy. Sci. 2013, 96, 3401–3413. [Google Scholar] [CrossRef] [PubMed]
107. Wall, E.H.; Bond, J.P.; McFadden, T.B. Milk yield responses to changes in milking frequency during early lactation are associated with coordinated and persistent changes in mammary gene expression. BMC Genom. 2013, 14, 296. [Google Scholar] [CrossRef]
108. Asher, A.; Fialko, M.; Fares, F.; Moallem, U.; Yaacoby, S.; Gutman, R. The Effect of Short-Wavelength White LED Illumination throughout the Night on the Milk Fatty Acid Profile of High-Yielding Dairy Cows. Biology 2022, 11, 1799. [Google Scholar] [CrossRef] [PubMed]
109. Murphy, B.A.; Herlihy, M.M.; Nolan, M.B.; O’Brien, C.; Furlong, J.G.; Butler, S.T. Identification of the blue light intensity administered to one eye required to suppress bovine plasma melatonin and investigation into effects on milk production in grazing dairy cows. J. Dairy. Sci. 2021, 104, 12127–12138. [Google Scholar] [CrossRef]
110. Adamczyk, K.; Herbut, P.; Godyń, D.; Angrecka, S.; Kupczyński, R.; Corrêa Vieira, F.M. Effect of light on dairy cattle in farm conditions—A review. Ann. Anim. Sci. 2024, 24, 1139–1151. [Google Scholar] [CrossRef]
111. Elsabagh, M.; Mon, M.; Takao, Y.; Shinoda, A.; Watanabe, T.; Kushibiki, S.; Obitsu, T.; Sugino, T. Exposure to blue LED light before the onset of darkness under a long-day photoperiod alters melatonin secretion, feeding behaviour and growth in female dairy calves. Jpn. Soc. Anim. Sci. 2020, 91, e13353. [Google Scholar] [CrossRef] [PubMed]
112. Simeanu, D. Nutrition and Feeding of Animals; “Ion Ionescu de la Brad” Publishing House: Iasi, Romania, 2018. [Google Scholar]
113. Back, K.; Tan, D.X.; Reiter, R.J. Melatonin biosynthesis in plants: Multiple pathways catalyzetryptophan to melatonin in the cytoplasm or chloroplasts (Review article). J. Pineal Res. 2016, 61, 426–437. [Google Scholar] [CrossRef] [PubMed]
114. Fan, J.; Xie, Y.; Zhang, Z.; Chen, L. Melatonin: A Multifunctional Factor in Plants. Int. J. Mol. Sci. 2018, 19, 1528. [Google Scholar] [CrossRef]
115. Arnao, M.B.; Cano, A.; Hernández-Ruiz, J. Phytomelatonin: An unexpected molecule with amazing performances in plants. J. Exp. Bot. 2022, 73, 5779–5800. [Google Scholar] [CrossRef] [PubMed]
116. Niu, T.; Ding, Z.; Zeng, J.; Yan, Z.; Duan, H.; Lv, J.; Zhang, Y.; Zhang, L.; Hu, J. Melatonin Sources in Sheep Rumen and Its Role in Reproductive Physiology. Animals 2024, 14, 3451. [Google Scholar] [CrossRef]
117. Holzmann, V.M.M.; Trentin, M.; De Almeida Rego, F.C.; Coelho Cunha Filho, L.F.; Ludovico, A. Melatonin concentration in the milk of cows supplemented with vitamins and milked twice daily. Semin. Agrar. 2019, 40, 2017–2026. [Google Scholar] [CrossRef]
118. Hernandez-Ruiz, J.; Cano, A.; Arnao, M.B. Melatonin acts as a growth-stimulating compound in some monocot species. J. Pineal Res. 2005, 39, 137–142. [Google Scholar] [CrossRef] [PubMed]
119. Barik, S. The Uniqueness of Tryptophan in Biology: Properties, Metabolism, Interactions and Localization in Proteins. Int. J. Mol. Sci. 2020, 21, 8776. [Google Scholar] [CrossRef] [PubMed]
120. Kim, I.-S.; Kim, C.-H.; Yang, W.-S. Physiologically Active Molecules and Functional Properties of Soybeans in Human Health-A Current Perspective. Int. J. Mol. Sci. 2021, 22, 4054. [Google Scholar] [CrossRef] [PubMed]
121. Luo, C.; Wang, D.; Lu, N.; Li, H.; Liu, G.; Cao, Z.; Yang, H.; Li, S.; Yu, X.; Shao, W.; et al. Analysis of Chemical Composition, Amino Acid Content, and Rumen Degradation Characteristics of Six Organic Feeds. Animals 2022, 12, 682. [Google Scholar] [CrossRef] [PubMed]
122. Kim, Y.-L.; Lee, S.-H.; Son, G.-H.; Shin, J.-S.; Kim, M.-J.; Park, B.-K. Effect of Rumen-Protected L-Tryptophan or L-Ascorbic Acid on Plasma Metabolites and Milk Production Characteristics of Lactating Holstein Cows during Summer Conditions. Animals 2024, 14, 1820. [Google Scholar] [CrossRef] [PubMed]
123. Liu, X.; Yao, S.; Liu, Y.; Han, H.; Wang, W.; Yi, Q.; Yan, L.; Ji, P.; Zhang, L.; Liu, G. Effects of Prepartum L-Tryptophan Supplementation on the Postpartum Performance of Holstein Cows. Animals 2024, 14, 1278. [Google Scholar] [CrossRef]
124. Kollmann, M.T.; Locher, M.; Hirche, F.; Eder, K.; Meyer, H.H.; Bruckmaier, R.M. Effects of tryptophan supplementation on plasma tryptophan and related hormone levels in heifers and dairy cows. Domest. Anim. Endocrinol. 2008, 34, 14–24. [Google Scholar] [CrossRef] [PubMed]
125. Karunanithi, D.; Radhakrishna, A.; Sivaraman, K.P.; Biju, V.M. Quantitative determination of melatonin in milk by LC-MS/MS. J. Food Sci. Technol. 2014, 51, 805–812. [Google Scholar] [CrossRef] [PubMed]
126. Kocadağı, T.; Yılmaz, C.; Gökmen, V. Determination of melatonin and its isomer in foods by liquid chromatography tandem mass spectrometry. Food Chem. 2014, 153, 151–156. [Google Scholar] [CrossRef] [PubMed]
127. Sturtz, M.; Cerezo, A.B.; Cantos-Villar, E.; Garcia-Parrilla, M.C. Determination of the melatonin content of different varieties of tomatoes (Lycopersicon esculentum) and strawberries (Fragaria ananassa). Food Chem. 2011, 127, 1329–1334. [Google Scholar] [CrossRef] [PubMed]
128. Kanova, M.; Kohout, P. Serotonin—Its Synthesis and Roles in the Healthy and the Critically Ill. Int. J. Mol. Sci. 2021, 22, 4837. [Google Scholar] [CrossRef]
129. Dubocovich, M.L. Melatonin receptors: Role on sleep and circadian rhythm regulation. Sleep. Med. 2007, 8 (Suppl. S3), 34–42. [Google Scholar] [CrossRef] [PubMed]
130. Tan, D.-X.; Manchester, L.C.; Terron, M.P.; Flores, L.J.; Tamura, H.; Reiter, R.J. Melatonin as a naturally occurring co-substrate of quinone reductase-2, the putative MT3melatonin membrane receptor: Hypothesis and significance. J. Pineal Res. 2007, 43, 317–320. [Google Scholar] [CrossRef]
131. Superti, F. Lactoferrin from Bovine Milk: A Protective Companion for Life. Nutrients 2020, 12, 2562. [Google Scholar] [CrossRef]
132. Flis, Z.; Molik, E. Importance of Bioactive Substances in Sheep’s Milk in Human Health. Int. J. Mol. Sci. 2021, 22, 4364. [Google Scholar] [CrossRef] [PubMed]
133. Niaz, B.; Saeed, F.; Ahmad, A.; Imran, M.; Maan, A.; Khan, M.; Tufail, T.; Anjum, F.; Hussain, S.; Suleria, H. Lactoferrin (LF): A Natural Antimicrobial Protein. Int. J. Food Prop. 2019, 22, 1626–1641. [Google Scholar] [CrossRef]
134. Redwan, E.; Uversky, V.; El-Fakharany, E.; Al-Mehdar, H. Potential lactoferrin activity against pathogenic viruses. Comptes Rendus Biol. 2015, 337, 581–595. [Google Scholar] [CrossRef] [PubMed]
135. Cui, S.; Lv, X.; Sun, G.; Wu, W.; Xu, H.; Li, Y.; Liu, Y.; Li, J.; Du, G.; Wang, M.; et al. Recent advances and prospects in purification and heterologous expression of lactoferrin. Food Bioeng. 2022, 1, 58–67. [Google Scholar] [CrossRef]
136. Conesa, C.; Bellés, A.; Grasa, L.; Sánchez, L. The Role of Lactoferrin in Intestinal Health. Pharmaceutics 2023, 15, 1569. [Google Scholar] [CrossRef] [PubMed]
137. Giansanti, F.; Panella, G.; Leboffe, L.; Antonini, G. Lactoferrin from Milk: Nutraceutical and Pharmacological Properties. Pharmaceuticals 2016, 9, 61. [Google Scholar] [CrossRef] [PubMed]
138. Lemoine, P.; Bablon, J.C.; Da Silva, C. A combination of melatonin, vitamin B6 and medicinal plants in the treatment of mild-to-moderate insomnia: A prospective pilot study. Complement. Ther. Med. 2019, 45, 104–108. [Google Scholar] [CrossRef] [PubMed]
139. Peukhuri, K.; Sihvola, N.; Korpela, R. Diet promotes sleep duration and quality. Nutr. Res. 2012, 32, 309–319. [Google Scholar] [CrossRef]
140. Knezevic, E.; Nenic, K.; Milanovic, V.; Knezevic, N.N. The Role of Cortisol in Chronic Stress, Neurodegenerative Diseases, and Psychological Disorders. Cells 2023, 12, 2726. [Google Scholar] [CrossRef]
141. Rahman, M.S.; Hossain, K.S.; Das, S.; Kundu, S.; Adegoke, E.O.; Rahman, M.A.; Hannan, M.A.; Uddin, M.J.; Pang, M.-G. Role of Insulin in Health and Disease: An Update. Int. J. Mol. Sci. 2021, 22, 6403. [Google Scholar] [CrossRef]
142. Xia, A.-Y.; Zhu, H.; Zhao, Z.-J.; Liu, H.-Y.; Wang, P.-H.; Ji, L.-D.; Xu, J. Molecular Mechanisms of the Melatonin Receptor Pathway Linking Circadian Rhythm to Type 2 Diabetes Mellitus. Nutrients 2023, 15, 1406. [Google Scholar] [CrossRef]
143. Peschke, E.; Bähr, I.; Mühlbauer, E. Melatonin and Pancreatic Islets: Interrelationships between Melatonin, Insulin and Glucagon. Int. J. Mol. Sci. 2013, 14, 6981–7015. [Google Scholar] [CrossRef] [PubMed]
144. Peschke, E. Melatonin, endocrine pancreas and diabetes. J. Pineal Res. 2008, 44, 26–40. [Google Scholar] [CrossRef]
145. Mulder, H.; Nagorny, C.L.; Lyssenko, V.; Groop, L. Melatonin receptors in pancreatic islets: Good morning to a novel type 2 diabetes gene. Diabetologia 2009, 52, 1240–1249. [Google Scholar] [CrossRef] [PubMed]
Andronachi V-C, Simeanu C, Matei M, Radu-Rusu R-M, Simeanu D. Melatonin: An Overview on the Synthesis Processes and on Its Multiple Bioactive Roles Played in Animals and Humans. Agriculture. 2025; 15(3):273. https://doi.org/10.3390/agriculture15030273
Перевод статьи «Melatonin: An Overview on the Synthesis Processes and on Its Multiple Bioactive Roles Played in Animals and Humans» авторов Andronachi V-C, Simeanu C, Matei M, Radu-Rusu R-M, Simeanu D., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
фото: freepik
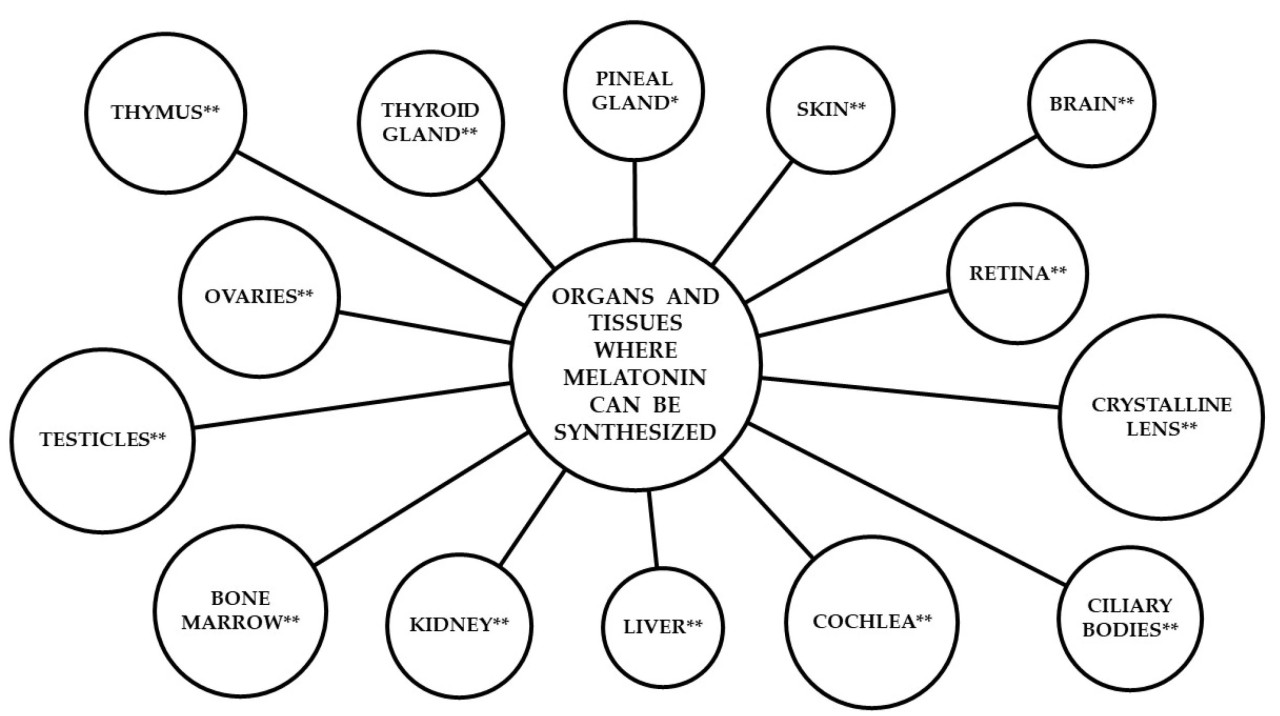
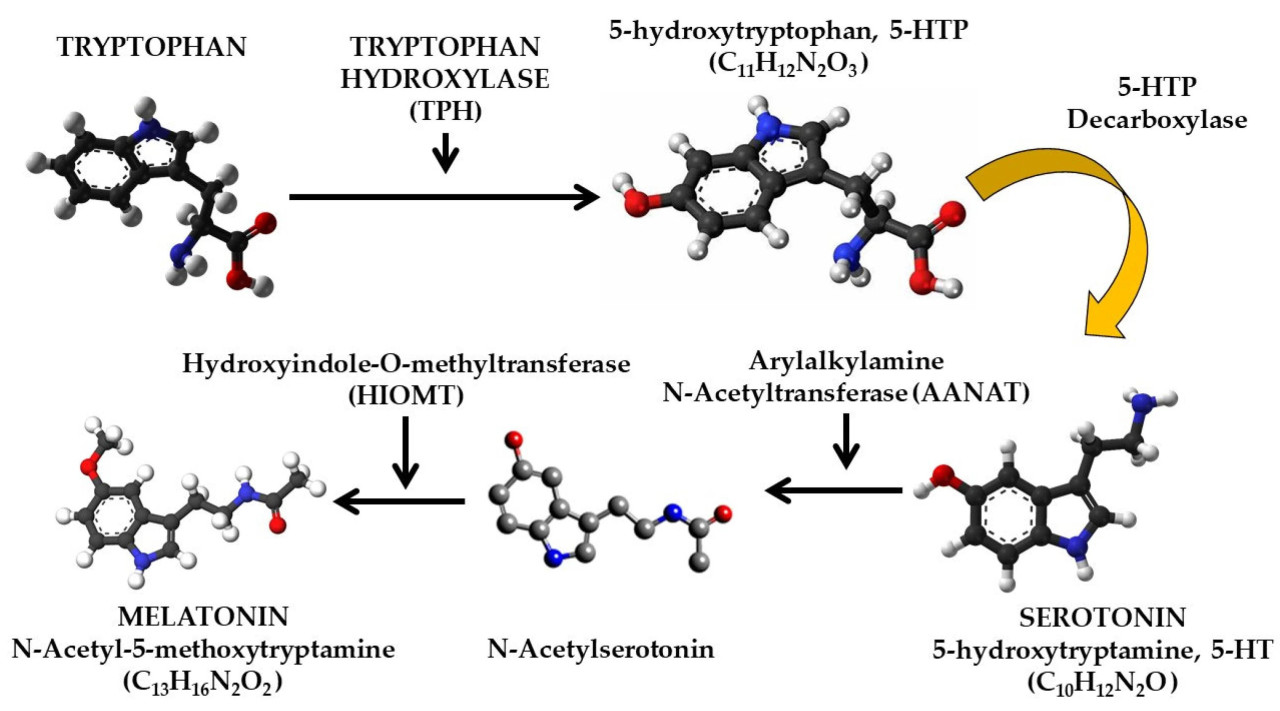
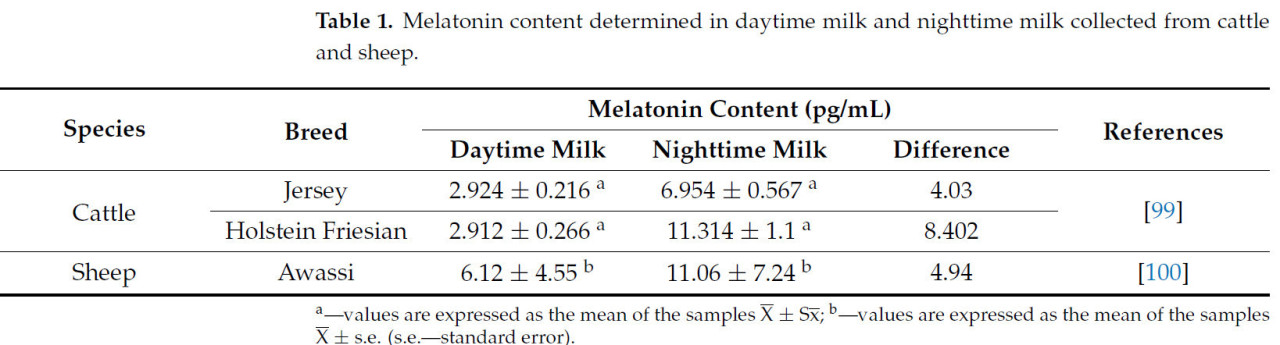
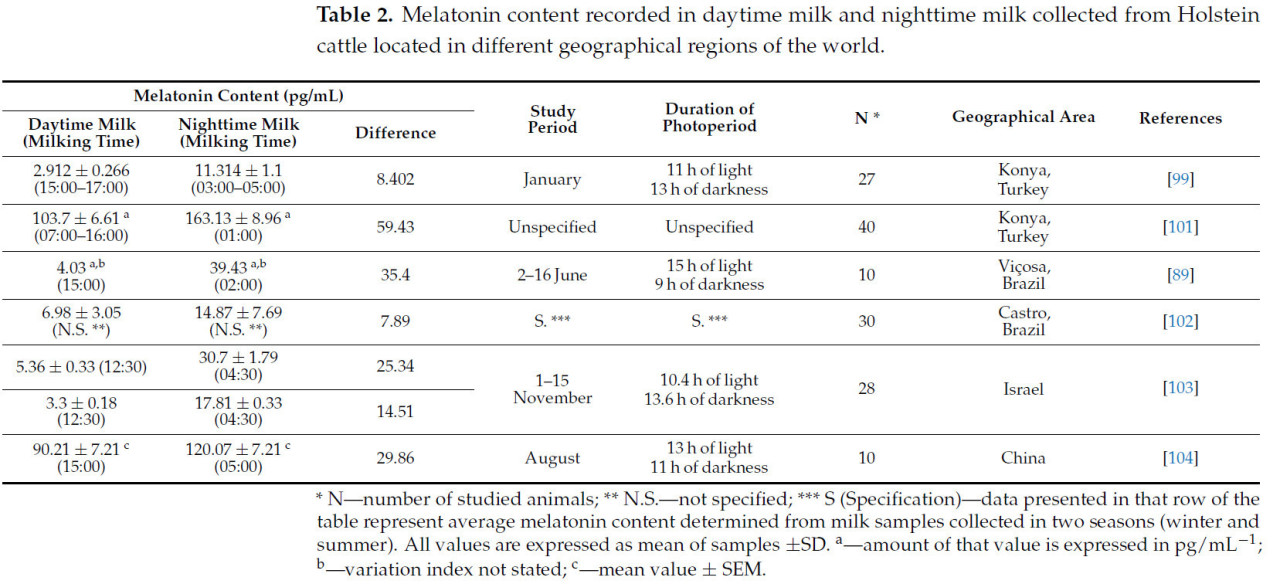
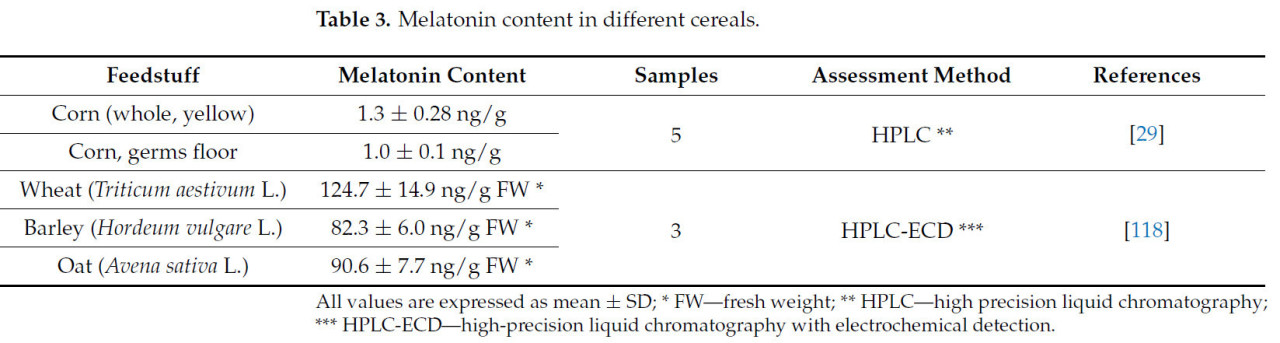
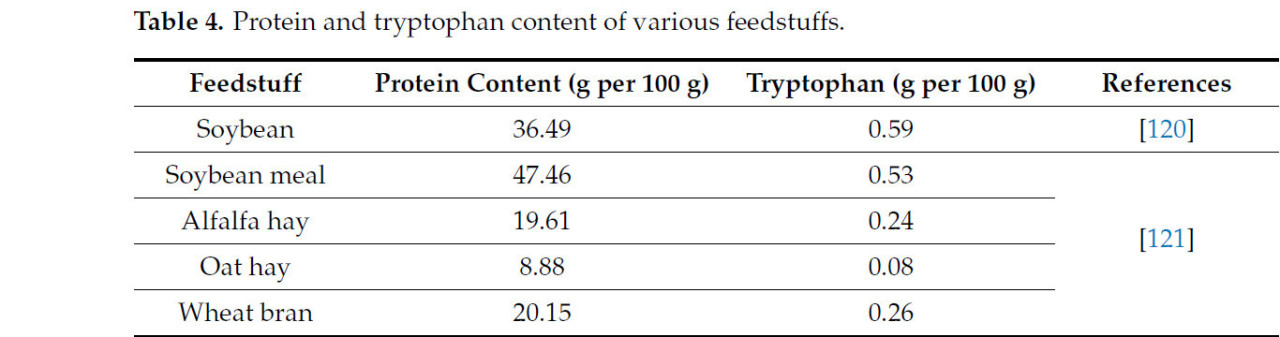
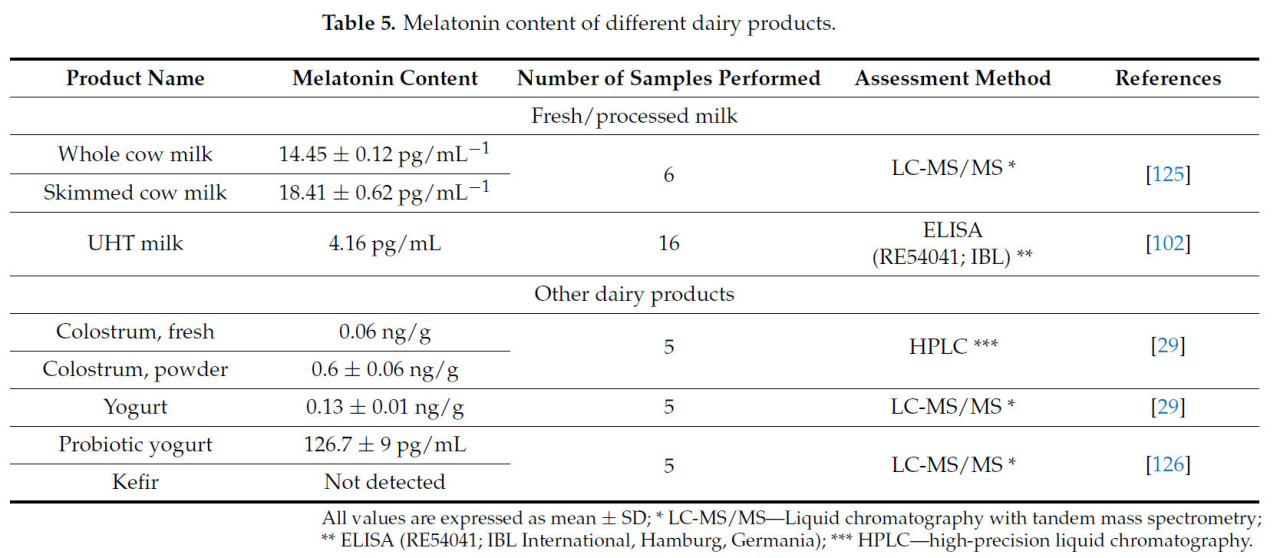
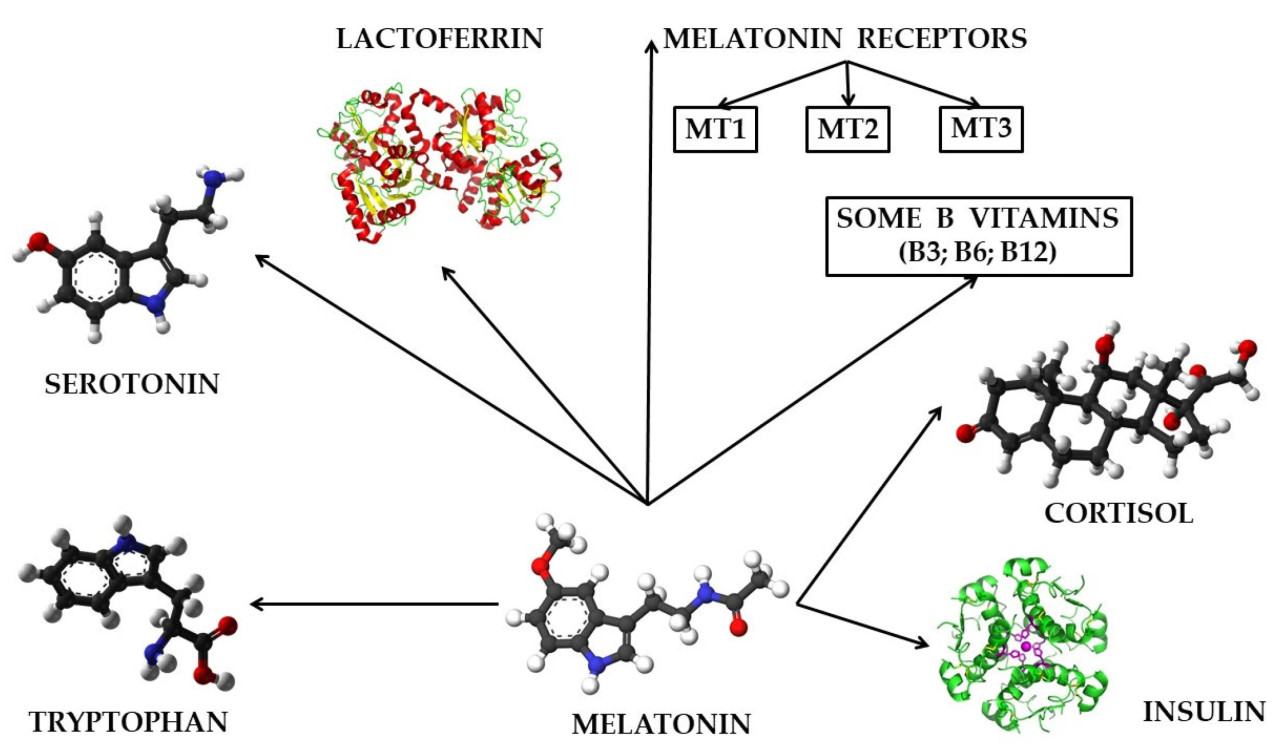






























































































Комментарии (0)