Помощь природных стимуляторов: защищаем саженцы камелии от губительной щелочи
Экзогенные биостимуляторы (ЭБ) имеют решающее значение для снижения абиотического стресса у растений. В настоящее время неясно, как такие ЭБ, как мелатонин (МТ), бетаин (БА) и салициловая кислота (СК), регулируют стресс у саженцев Camellia oleifera в условиях щелочного стресса (XP). В данном исследовании демонстрируется регулирующее действие СК (0,5, 1 и 2 ммоль/л), БА (0,2, 0,4 и 0,8 г/л) и МТ (200, 400 и 800 мкмоль/л) на относительное содержание хлорофилла, фотосинтетические параметры, параметры флуоресценции хлорофилла, осморегулирующие вещества и антиоксидантные ферменты в саженцах C. oleifera в условиях XP.
Аннотация
Результаты показали, что опрыскивание различными типами и разными концентрациями ЭБ в условиях щелочного стресса оказывает определенное смягчающее воздействие на фенотип саженцев C. oleifera. Как через 7, так и через 15 дней после применения ЭБ относительное содержание хлорофилла (SPAD) и степень желто-зеленой окраски в контрольной группе отличались от таковых в остальных 10 группах обработки, однако разница в яркости окраски была незначительной. Что касается содержания малонового диальдегида (МДА), то группы обработки SA2, BA3, MT2 и MT3 смогли значительно снизить содержание МДА на 7-й день применения ЭБ. Электролитная утечка (ЭУ) также была значительно снижена под действием MT2 и MT3. Было обнаружено, что группы обработки SA3 и MT2 смогли улучшить фотосинтетические параметры саженцев C. oleifera в разной степени на 7-й день применения ЭБ. На 15-й день применения ЭБ группы обработки SA1, SA3, BA1 и BA2 увеличили скорость фотосинтеза C. oleifera по сравнению с группой обработки XP, но другие виды обработки не привели к увеличению. В то же время результаты показали, что параметры флуоресценции саженцев улучшились в разной степени при различных условиях опрыскивания ЭБ. В условиях щелочного стресса содержание растворимых белков (РБ) и растворимых сахаров (РС) увеличилось в группе XP, но было обнаружено, что группы обработки SA3, BA3 и MT2 смогли снизить содержание осморегулирующих веществ как на 7-й, так и на 15-й день применения ЭБ. Что касается содержания пролина (Pro), группы обработки BA1, BA2 и MT2 смогли снизить содержание пролина на 7-й и 15-й день опрыскивания ЭБ соответственно. Что касается антиоксидантных ферментов, группы обработки SA2, BA3, MT2 и MT3 смогли в основном повысить активность антиоксидантных ферментов и дополнительно уменьшить окислительное повреждение на 7-й день применения ЭБ. Согласно комплексным результатам функции принадлежности, как на 7-й, так и на 15-й день опрыскивания ЭБ, группа обработки MT2 обладает наилучшим общим смягчающим эффектом среди трех применявшихся ЭБ, войдя в тройку лучших. Данное исследование поможет углубить научное понимание щелочеустойчивости C. oleifera и ее взаимодействия с ЭБ, одновременно восполняя пробел в знаниях о физиологической реакции на олеофиллиновый стресс.
1. Введение
Засоление почв является сложной глобальной проблемой, которая оказывает значительное/существенное влияние на продовольственную и экологическую безопасность во всех странах [1]. В связи с быстрым развитием индустриализации и нерациональными методами ведения сельского хозяйства проблема засоления почв в некоторых районах стала еще более острой, что в значительной степени/существенно ограничило нормальный рост сельскохозяйственных культур и объемы сельскохозяйственного производства [2,3]. Согласно соответствующей статистике, неблагоприятные факторы окружающей среды (биотический стресс и биологическое загрязнение) приводят к потере около 60–90% от общего объема производства основных культур (кукурузы, пшеницы, картофеля и др.) [4]. Засоление почв в основном вызвано длительным чрезмерным орошением, неправильным управлением почвенными ресурсами, чрезмерным использованием химических удобрений и другими факторами. Стоит отметить, что засоление почв приводит к накоплению ионов солей, что серьезно влияет на проницаемость почвы, вызывает ее уплотнение, затвердевание и другие явления, приводящие к физиологической нехватке воды у растений, а также вызывает повышение pH, что снижает эффективность усвоения минеральных элементов, подавляет поглощение неорганических анионов и влияет на межклеточный ионный баланс [5,6].
Накопление активных форм кислорода (АФК) в организме после щелочного стресса приводит к нарушению метаболического баланса в виде супероксидного аниона, пероксида водорода и гидроксильных радикалов. С одной стороны, эти вещества повреждают структуру клеточной мембраны и приводят к инактивации ферментов [7]; с другой стороны, они препятствуют фотосинтезу и дыханию растений [8]. Кроме того/дальше/в дальнейшем, высокий pH ускоряет выработку АФК, что приводит к большему/более значительному окислительному повреждению, которое, в свою очередь, ухудшает способность корней растений поглощать воду и питательные вещества, что в конечном итоге приводит к нарушению роста и развития растений или даже к их гибели [9,10]. В нормальных условиях растения могут регулировать уровень АФК с помощью антиоксидантных ферментов, но длительное накопление превысит толерантность растения и в конечном итоге нанесет ущерб [11].
C. oleifera — уникальное для Китая растение — масличная древесная культура, богатая высокоолеиновой кислотой и другими питательными веществами [12,13]. Масло C. oleifera очень популярно на внутреннем и внешнем рынках благодаря своему превосходному питательному составу, а также легкой усвояемости и всасываемости. В контексте глобальных изменений и засоления почв важно/ключевое значение имеет изучение использования экзогенных биостимуляторов (ЭБ) для ослабления щелочного стресса. В целом, экзогенные регуляторы роста растений могут включать некоторые органические вещества, микробные агенты или химические вещества, и их применение может оказывать определенное стимулирующее действие на повышение устойчивости растений. Как природный регулятор растений, мелатонин (МТ) имеет широкий спектр потенциальных применений. Сообщалось, что обработка МТ огурцов в условиях водного стресса может способствовать образованию корней и повышению их жизнеспособности, значительно/существенно/заметно улучшать эффективность фотосинтеза и, таким образом, снижать стрессовое повреждение [14]. Кроме того, предыдущие исследования показали, что экзогенный бетаин (БА) может ослаблять стресс от недостатка воды у Centella asiatica, причем эффект экзогенного БА в концентрации 25 мМ был относительно хорошим [15]. Салициловая кислота (СК) — это фенольное вещество растений, которое играет важную/ключевую роль в стрессоустойчивости. Сообщалось, что СК может минимизировать влияние солевого стресса на замедление роста Dianthus superbus [16]. Однако до настоящего времени исследования устойчивости C. oleifera в основном были сосредоточены на стрессе, вызванном низкими температурами и засухой [17,18], в то время как физиологическая реакция C. oleifera на щелочной стресс и смягчающий эффект опрыскивания ЭБ саженцев C. oleifera в условиях щелочного стресса не были широко изучены и описаны.
В этом контексте повышение соле- и щелочеустойчивости сельскохозяйственных культур имеет решающее значение/является ключевым для устойчивого сельского хозяйства. Как древесная масличная культура, потенциал соле- и щелочеустойчивости и адаптивность C. oleifera заслуживают дальнейшего изучения. Таким образом, в данном исследовании изучалось влияние трех различных ЭБ (СК, БА и МТ) на относительное содержание хлорофилла, цветовые различия, параметры газообмена, характеристики флуоресценции хлорофилла, антиоксидантные ферменты и осморегулирующие вещества саженцев C. oleifera в условиях щелочного стресса. Данное исследование поможет углубить научное понимание щелочеустойчивости C. oleifera и ее взаимодействия с ЭБ, одновременно восполняя пробел в знаниях о физиологической реакции на олеофиллиновый стресс.
2. Материалы и методы
2.1. Растительный материал
В марте 2023 года двухлетние привитые саженцы C. oleifera Чанлинь 53 были предоставлены китайской компанией Jiangxi Province Yichen Agricultural Development Co. Были отобраны саженцы с одинаковой скоростью роста и высажены на грядку в теплице на ферме Сельскохозяйственного университета Сычуани (102°59′22,88″ в.д., 29°59′19,76″ с.ш.) для укоренения. Среда для укоренения представляет собой смесь питательного грунта и перлита в соотношении 2:1. Температура культивирования/выращивания составляет 25~28 °C, относительная влажность — 60~80%; вышеуказанные данные автоматически регистрируются термогигрометром в теплице.
2.2. Обработка щелочным стрессом
В этом эксперименте для всего 11 групп обработки в каждой группе обработки было отобрано 30 здоровых саженцев с одинаковым ростом и развитием и без вредителей и болезней, которые подвергались корневому поливу для создания щелочного стресса. Значение pH стресса составляло 9,5. pH измеряли с помощью электронного pH-метра (PHS-3C). Щелочной раствор (контрольный полив дистиллированной водой) готовили из бикарбоната натрия и карбоната натрия в молярном соотношении 2:1. pH стрессового раствора калибровали 1 моль/л раствором гидроксида натрия. После 7 дней воздействия стресса на три сорта C. oleifera начиная с 8-го дня в течение 3 дней проводили непрерывное опрыскивание ЭБ. 11 групп обработки были следующими: (1) CK: нормальная вода без опрыскивания; (2) XP: щелочной стресс; (3) XP + 0,5 ммоль/л СК (СК1); (4) XP + 1 ммоль/л СК (СК2); (5) XP + 2 ммоль/л СК (СК3); (6) XP + 0,2 г/л БА (БА1); (7) XP + 0,4 г/л БА (БА2); (8) XP + 0,8 г/л БА (БА3); (9) XP + 200 мкмоль/л МТ (МТ1); (10) XP + 400 мкмоль/л МТ (МТ2); и (11) XP + 800 мкмоль/л МТ (МТ3) (подробности см. на рисунке 1). Отбор проб был разделен на два периода: 7 дней равномерного щелочного стресса, и образцы отбирали на 7-й и 15-й дни после 3 дней непрерывного опрыскивания ЭБ в разных концентрациях. При опрыскивании ЭБ желательно покрывать каплями переднюю и заднюю стороны листьев C. oleifera, но не допускать стекания вниз.
Рисунок 1. Дизайн эксперимента.
2.3. Цветовые параметры
Цвет листьев C. oleifera определяли с помощью портативного спектрофотометра TS7000 (Guangdong Three Enshi Technology Co., Ltd., Гуанчжоу, Китай). Необходимо сначала провести коррекцию черного и белого, а затем выбрать для обнаружения средние и верхние листья. L и a представляют значения яркости и красно-зеленого цвета соответственно [19].
2.4. Измерение показателей
2.4.1. Относительное содержание хлорофилла (SPAD)
SPAD в листьях C. oleifera определяли с помощью SPAD-502 Plus (Konica Minolta, Токио, Япония). Проще говоря, сначала калибруют прибор и выбирают центральное положение листа для измерения. В каждой группе обработки тестировали/проверяли по 5 листьев с 3-кратным повторением.
2.4.2. Содержание малонового диальдегида (МДА) и электролитная утечка (ЭУ)
Для измерения количества МДА использовали тиобарбитуровую кислоту (ТБК) в колориметрическом методе [20]. Листья из разных групп обработки измельчали пробойником на однородные мелкие кусочки, замачивали в дистиллированной воде на 12 ч и регистрировали исходную электропроводность (E1). Затем раствор, в котором замачивали образцы из разных групп обработки, нагревали и кипятили в течение 30 мин, и снова регистрировали электропроводность (E2): ЭУ = E1/E2 [21].
2.4.3. Фотосинтетические параметры
Чистый фотосинтез (Pn (мкмоль CO2/м2/с)), устьичную проводимость (Gs (моль/м2/с)), транспирацию (Tr (ммоль H2O/м2/с)) и межклеточную концентрацию CO2 (Ci (мкмоль/моль)) нормальных листьев саженцев C. oleifera при различных обработках измеряли с 8:00 до 11:00 утра в солнечную погоду с помощью портативного фотосинтометра GFS-3000 (Walz AG, Эффельтрих, Германия), и рассчитывали эффективность использования воды (WUE): WUE = Pn/Tr.
2.4.4. Параметры флуоресценции хлорофилла
Нормально функционирующие листья растений C. oleifera в разных группах обработки выдерживали в темноте в течение 30 мин, и параметры флуоресценции хлорофилла определяли с помощью IMAGING-PAM (Walz AG, Эффельтрих, Германия) в темной комнате.
2.5. Содержание растворимых сахаров (РС) и растворимых белков (РБ)
Содержание РС определяли антрон-сернокислотным методом с некоторыми модификациями [22]. Содержание РБ определяли методом Кумасси бриллиантового голубого с небольшими модификациями [23].
2.6. Содержание пролина
Для определения содержания пролина (Pro) использовали ранее описанный метод с небольшими модификациями [24]. Брали 0,1 г листьев, добавляли 2 мл 3% сульфосалициловой кислоты и тщательно измельчали. Затем, после кипячения на водяной бане в течение 10 мин, центрифугировали супернатант, добавляли 1 мл супернатанта в пробирку, содержащую 1 мл ледяной уксусной кислоты и 1 мл кислого нингидрина, кипятили на водяной бане 30 мин, после охлаждения добавляли 2 мл толуола и после встряхивания отбирали супернатант для анализа.
2.7. Активность антиоксидантных ферментов
Для определения активности супероксиддисмутазы (СОД), пероксидазы (ПО) и каталазы (КАТ) использовали ранее применявшийся метод с небольшими изменениями [25]. Кратко: 0,1 г листьев из разных групп обработки гомогенизировали в 2 мл фосфатного буфера (50 мМ, pH = 7,8) с кварцевым песком. Образцы центрифугировали при 4 °C в течение 20 мин при 10 000 об/мин, и супернатант использовали для определения антиоксидантной активности.
2.8. Статистический анализ
Для дисперсионного анализа данных и анализа главных компонент использовали программное обеспечение SPSS версии 26, для корреляционного анализа, кластерного анализа и построения графиков использовали программное обеспечение Origin 2024b и Graphpad Prism 8.0. Метод функции принадлежности основан на принципах нечеткой математики; основной показатель получают на основе результатов анализа главных компонент, и метод функции принадлежности используется для комплексной оценки 11 групп обработки. Со ссылкой на предыдущие исследования рассчитывают значение функции принадлежности (μ), вес и комплексную оценку [26].
3. Результаты
3.1. Влияние ЭБ на фенотип и SPAD в условиях щелочного стресса
В условиях щелочного стресса применение различных типов и концентраций ЭБ на саженцах C. oleifera привело к различным фенотипическим изменениям. Как показано на рисунке 2A, на 7-й день применения ЭБ в условиях щелочного стресса фенотип группы CK отличался от фенотипа 10 групп обработки, что в основном проявлялось опадением листьев и пожелтением краев листьев. По сравнению с группой CK, пожелтение и опадение листьев были более очевидны в группах обработки XP, СК3, БА1, БА3 и МТ1. На 7-й день опрыскивания ЭБ в условиях щелочного стресса пожелтение и скручивание листьев были более заметны в остальных 10 группах обработки, особенно в группах XP, СК1, СК3, БА1, БА3, МТ1 и МТ3 (Рисунок 2B). По фенотипу C. oleifera можно сделать вывод, что с увеличением времени применения ЭБ в рамках одного периода щелочного стресса смягчающий эффект на C. oleifera постепенно снижается.
Рисунок 2. Влияние ЭБ на фенотипическую реакцию на щелочной стресс ((A) Фенотипы на 7-й день опрыскивания ЭБ; (B) Фенотипы на 15-й день опрыскивания ЭБ).
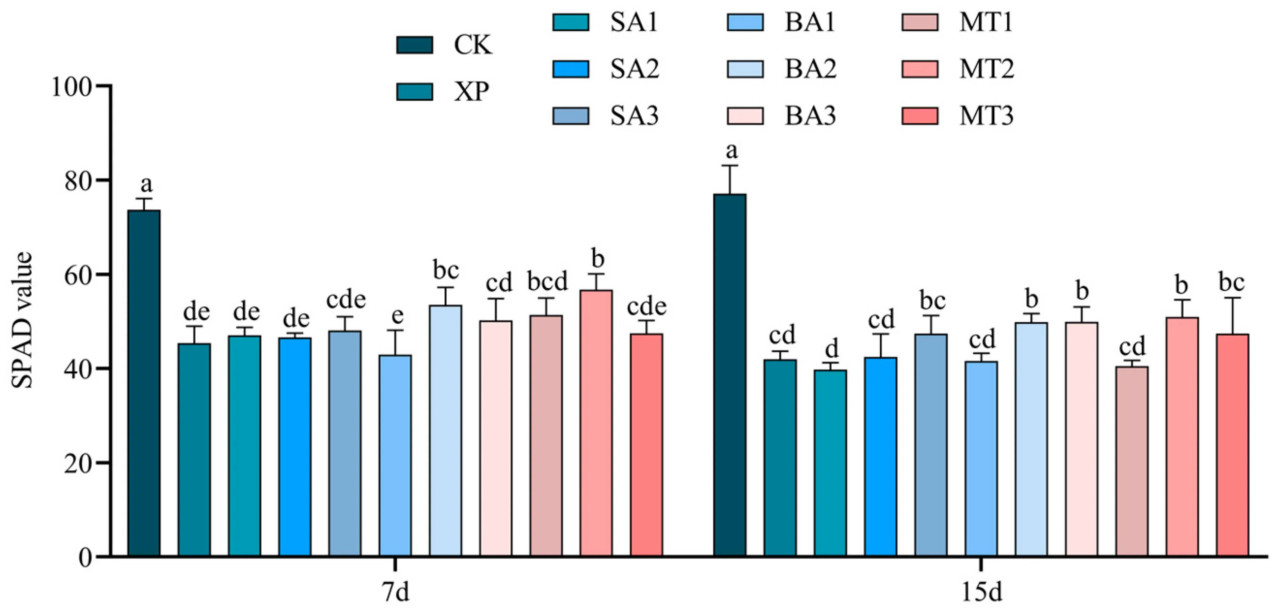
SPAD показывает/указывает на степень зелености растений и относительное значение содержания хлорофилла в листьях. Как показано на рисунке 3, наблюдались различия в SPAD саженцев C. oleifera на 7-й и 15-й дни применения ЭБ в условиях щелочного стресса. Было обнаружено, что SPAD в группе CK на 7-й день значительно/существенно/заметно отличался от такового в 10 группах обработки. Самый низкий SPAD был в группе БА1, но SPAD в группе МТ2 уступал только группе CK. На 15-й день наблюдались значительные/существенные/заметные различия в SPAD между контрольной группой и остальными 10 группами обработки, среди которых SPAD в группе обработки МТ1 был самым низким из 11 групп обработки, но значение SPAD в группах обработки БА2, БА3 и МТ2 также уступало только группе CK.
Рисунок 3. Влияние ЭБ на значение SPAD в условиях щелочного стресса (разные буквы указывают на значительную разницу (p < 0,05)).
3.2. Влияние ЭБ на параметры цвета листьев в условиях щелочного стресса
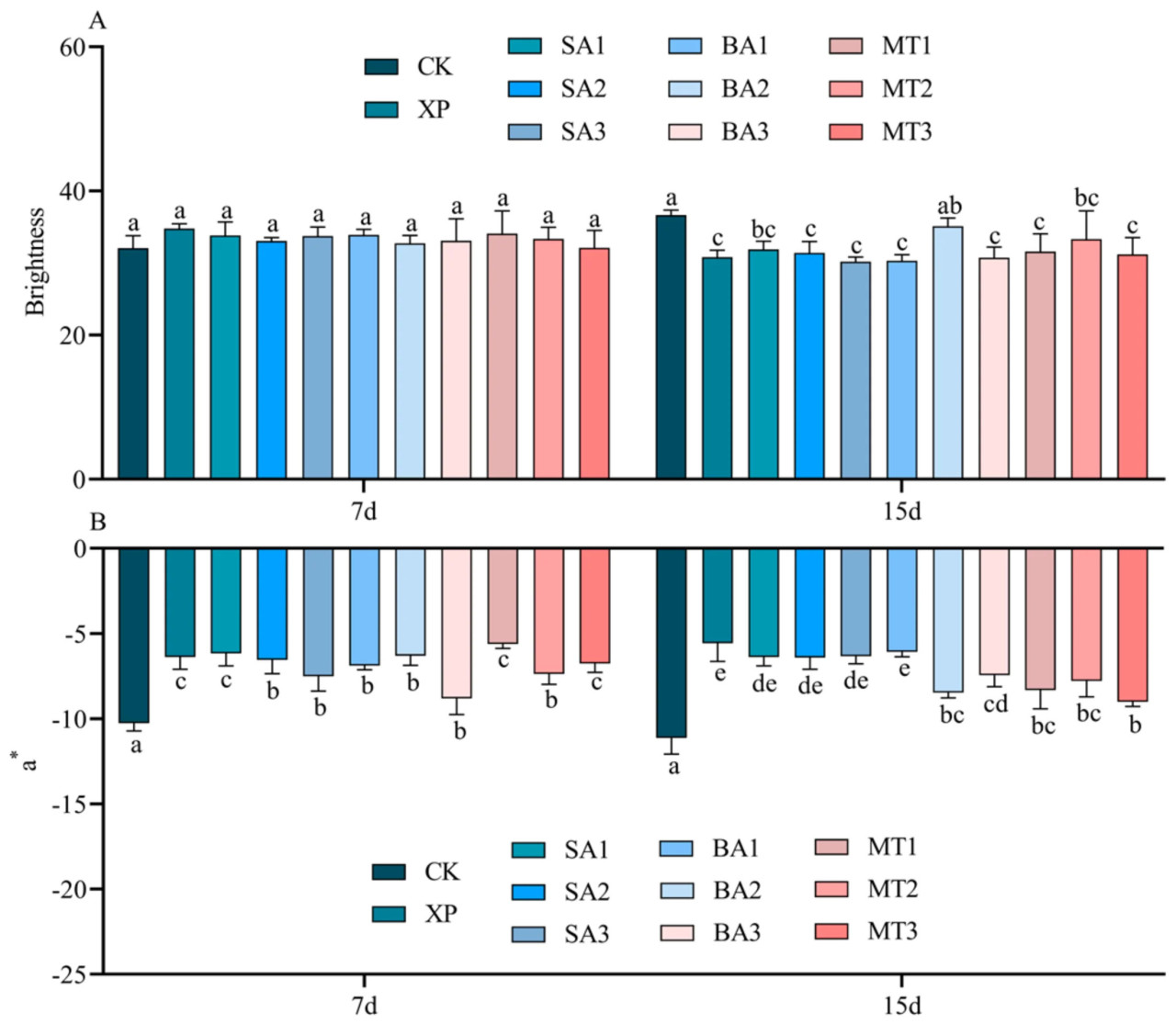
Как видно из рисунка 4A, не было различий в яркости листьев C. oleifera во всех группах обработки на 7-й день после применения ЭБ, значения варьировались от 32,06 до 34,79. За исключением группы обработки БА2, на 15-й день после применения ЭБ наблюдались различия между остальными 9 группами обработки и группой CK. Однако между девятью группами обработки различий не было, значения варьировались от 30,31 до 36,65. a отражает степень желтизны-зелености листьев C. oleifera. Чем выше абсолютное значение, тем зеленее листья; чем ниже абсолютное значение данных, тем желтее листья. Как показано на рисунке 4B, на 7-й день опрыскивания ЭБ в условиях щелочного стресса 10 групп обработки показали значительные/существенные/заметные различия по сравнению с группой CK. На 15-й день опрыскивания ЭБ в условиях щелочного стресса группа обработки XP и группа обработки БА1 имели наихудшую степень зелености листьев.
Рисунок 4. Влияние ЭБ на параметры цвета листьев в условиях щелочного стресса ((A) яркость; (B) a (желто-зеленая степень); разные буквы указывают на значительную разницу (p < 0,05)).
3.3. Влияние ЭБ на содержание МДА и ЭУ в условиях щелочного стресса
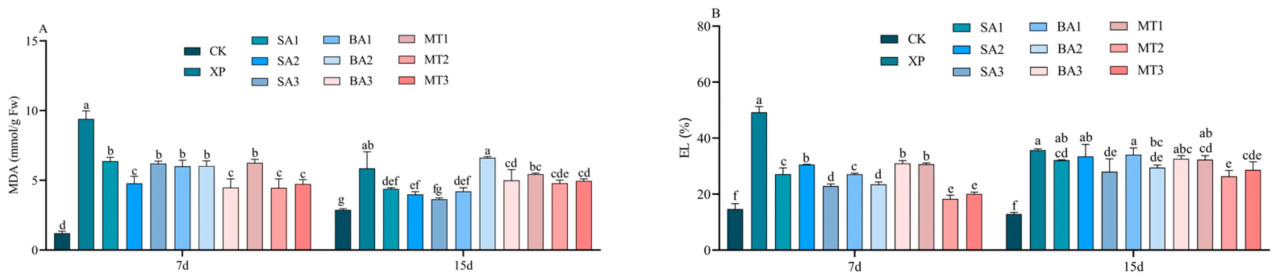
Чрезмерное накопление АФК будет атаковать клеточную мембрану растений, и эта атака на мембрану вызовет чрезмерное накопление МДА, что увеличит проницаемость мембраны и приведет к экзосмосу электролитов. На 7-й день опрыскивания ЭБ в условиях щелочного стресса содержание МДА было значительно/существенно/заметно повышено во всех группах обработки, кроме группы CK, особенно в группе обработки XP, но группы обработки СК2, БА3, МТ2 и МТ3 снизили содержание МДА. На 15-й день опрыскивания ЭБ в условиях щелочного стресса содержание МДА было значительно/существенно/заметно выше в группах обработки XP и БА2, чем в других группах обработки, и различий между этими двумя группами не было (Рисунок 5A). Как показано на рисунке 5B, на 7-й день опрыскивания ЭБ в условиях щелочного стресса ЭУ в группе обработки XP самая высокая среди всех групп обработки, что указывает/свидетельствует о том, что повреждение клеточной мембраны здесь наибольшее среди всех. Кроме того/дальше, было обнаружено, что группы обработки СК3, БА3, МТ2 и МТ3 имели значительные/существенные/заметные различия по сравнению с группой обработки XP, и эти четыре группы обработки могли эффективно/действенно/успешно снизить электропроводность. На 15-й день опрыскивания ЭБ в условиях щелочного стресса не было различий между группой XP и группами обработки ЭБ СК1, СК2, БА1, БА3 и МТ1, а ЭУ в группе обработки ЭС МТ2 была самой низкой, уступая только группе CK. Согласно вышеприведенным результатам, можно предварительно заключить, что с увеличением времени применения ЭБ смягчающий эффект ЭБ в отношении щелочного стресса также ослабевает. Поэтому необходимо обращать внимание на эффективность времени опрыскивания при условии, что различные типы ЭБ могут ослаблять стресс.
Рисунок 5. Влияние ЭБ на содержание МДА и ЭУ в условиях щелочного стресса ((A) МДА; (B) ЭУ; разные буквы указывают на значительную разницу (p < 0,05)).
3.4. Влияние ЭБ на фотосинтетические параметры в условиях щелочного стресса
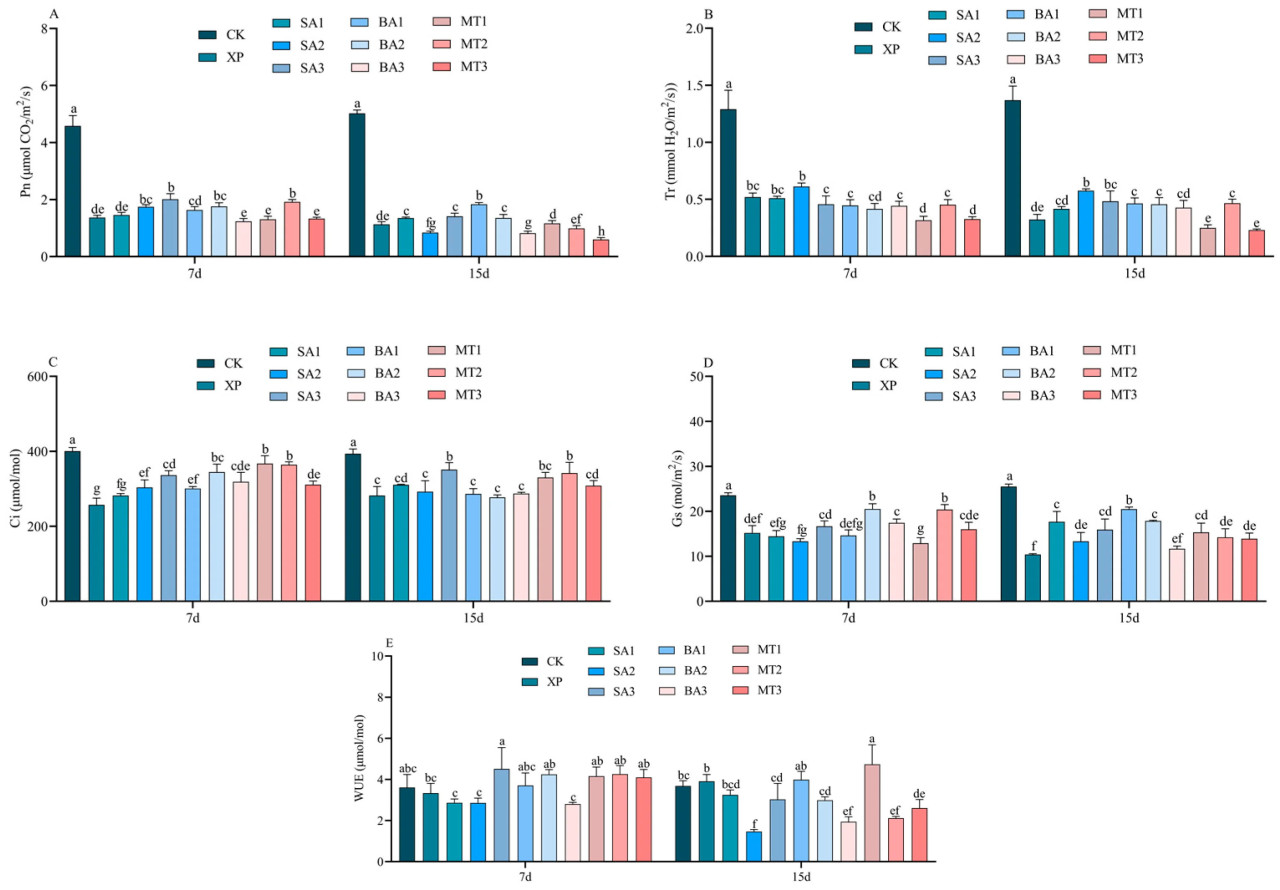
Как показано на рисунке 6A, самый высокий Pn в группе CK составил 4,59 мкмоль/м2/с1 и 5,03 мкмоль/м2/с1 на 7-й и 15-й дни после применения ЭБ соответственно. На 7-й день опрыскивания ЭБ в условиях щелочного стресса Pn в группах обработки СК3 и МТ2, опрысканных ЭБ, значительно/существенно/заметно увеличился по сравнению с CK, в то время как Pn в группах обработки БА3, МТ1 и МТ3 не увеличился, а был ниже, чем в группе обработки XP. На 15-й день опрыскивания ЭБ в условиях щелочного стресса группы обработки СК1, СК3, БА1 и БА2 увеличили Pn C. oleifera по сравнению с XP, но другие обработки не увеличили Pn. В целом, Pn C. oleifera постепенно снижался с увеличением времени применения ЭБ.
Рисунок 6. Влияние ЭБ на фотосинтетические характеристики в условиях щелочного стресса ((A) Pn; (B) Tr; (C) Ci; (D) Gs; (E) WUE; разные буквы указывают на значительную разницу (p < 0,05)).
На 7-й и 15-й день после одинакового щелочного стресса Tr сортов C. oleifera уменьшалась с течением времени. За исключением группы CK, Tr 10 групп обработки на 7-й и 15-й дни не имела значительных/существенных/заметных различий, в то время как группы обработки МТ1 и МТ3 были самыми низкими среди 11 групп обработки, и в одинаковых условиях щелочного стресса их Tr постепенно снижалась с увеличением времени после применения ЭБ (Рисунок 6B). Кроме того, из рисунка 6B видно, что Tr группы обработки СК2 уступала только группе CK как через 7, так и через 15 дней. Как показано на рисунке 6C, не было различий между CK и остальными 10 группами на 7-й и 15-й дни после обработки щелочным стрессом с применением одинаковых ЭБ. На 7-й день опрыскивания ЭБ в условиях щелочного стресса было обнаружено, что группы обработки БА2, МТ1 и МТ2 увеличили Ci, в то время как группа обработки XP имела самую низкую Ci. На 15-й день опрыскивания ЭБ в условиях щелочного стресса было обнаружено, что Ci увеличилась в группах обработки СК3 и МТ2, в то время как не было значительной/существенной/заметной разницы между группами СК1, СК2, БА1, БА2, БА3, МТ1 и МТ3 в группе обработки XP.
Как показано на рисунке 6D, на 7-й день опрыскивания ЭБ в условиях щелочного стресса группы обработки БА2 и МТ2 значительно/существенно/заметно улучшили Gs листьев C. oleifera, что указывает/свидетельствует о том, что опрыскивание ЭБ в условиях щелочного стресса может помочь ослабить серьезное повреждение C. oleifera. Кроме того, Gs в группе обработки МТ1 была самой низкой среди 10 групп обработки. На 15-й день опрыскивания ЭБ в условиях щелочного стресса Gs в группе обработки БА1 значительно/существенно/заметно улучшилась, в то время как в группе обработки XP она была самой низкой. Эти изменения могут отражать сложное взаимодействие между Gs и адаптивной реакцией растений C. oleifera на щелочной стресс. Хотя опрыскивание ЭБ могло улучшить WUE C. oleifera, было обнаружено, что не было значительной/существенной/заметной разницы в WUE среди 11 групп обработки на 7-й и 15-й дни опрыскивания ЭБ в условиях щелочного стресса (Рисунок 6E).
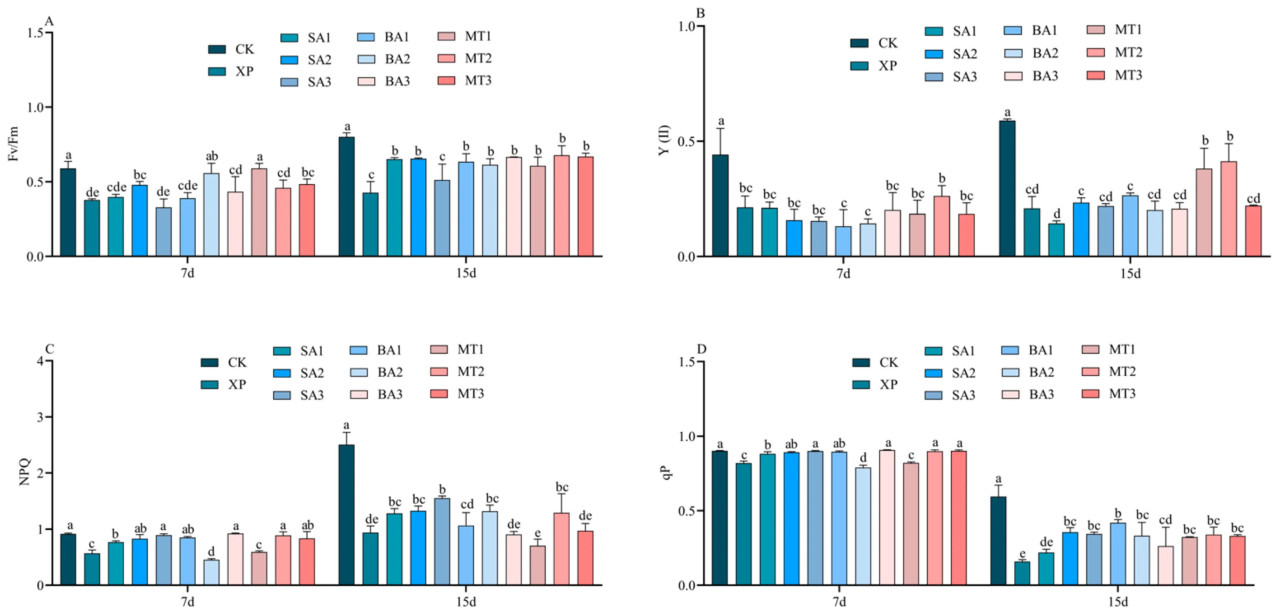
3.5. Влияние ЭБ на параметры флуоресценции хлорофилла в условиях щелочного стресса
Реакции Fv/Fm, Y(II), NPQ и qP саженцев C. oleifera в условиях щелочного стресса на различные типы и концентрации ЭБ (СК, БА и МТ) показаны на рисунке 7. По сравнению с группой CK, Y (II), qP, Fv/Fm и NPQ в целом снижались на 7 и 15 дни при опрыскивании ЭБ в условиях щелочного стресса. На 7-й день применения ЭБ Fv/Fm в группе CK не имела значительной/существенной/заметной разницы с группами БА2 и МТ1. Однако Fv/Fm в группах обработки CK и МТ1 значительно/существенно/заметно отличались от таковых в остальных восьми группах обработки, за исключением группы обработки БА2 (Рисунок 7A). На 15-й день опрыскивания ЭБ в условиях щелочного стресса Fv/Fm группы XP была значительно/существенно/заметно ниже, чем в группе CK, на 46,69%. Как показано на рисунке 7B, наблюдались значительные/существенные/заметные различия между группой CK и остальными 10 группами обработки на 7-й день применения ЭБ. На 15-й день опрыскивания ЭБ в условиях щелочного стресса наблюдались различия между группами обработки МТ1 и МТ2 и остальными восемью группами обработки, а Y(II) значительно/существенно/заметно увеличилась. Как показано на рисунке 7C, NPQ группы CK отличался от других 10 групп обработки на 15-й день применения ЭБ. Как видно на рисунке 7D, не было значительной/существенной/заметной разницы в qP между группой обработки XP и остальными 10 группами обработки на 7-й и 15-й дни опрыскивания ЭБ в условиях щелочного стресса, за исключением группы CK (p < 0,05).
Рисунок 7. Влияние опрыскивания ЭБ на параметры флуоресценции в условиях щелочного стресса ((A) Fv/Fm; (B) Y (II); (C) NPQ; (D) qP; разные буквы указывают на значительную разницу (p < 0,05)).
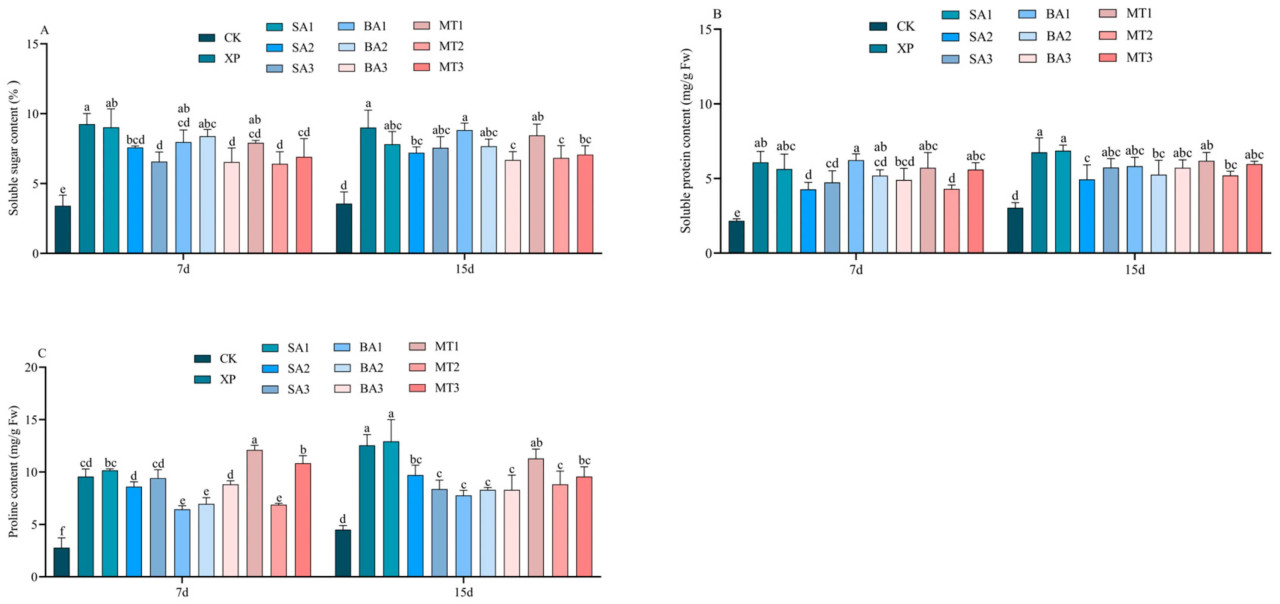
3.6. Влияние ЭБ на осморегулирующие вещества в условиях щелочного стресса
На адаптацию растений к стрессу значительно/существенно/заметно влияют РС, которые являются важными осморегуляторами. На 7-й день опрыскивания ЭБ в условиях щелочного стресса группы обработки СК3, БА3 и МТ2 отличались от XP и других групп обработки, и во всех трех группах обработки наблюдалось снижение содержания РС в листьях C. oleifera. Однако через 15 дней после применения ЭБ содержание РС в листьях C. oleifera было значительно/существенно/заметно снижено в группах обработки БА3 и МТ2. Не было значительной/существенной/заметной разницы между группой обработки XP и группами обработки СК1, СК3, БА1, БА2 и МТ1 (Рисунок 8A).
Рисунок 8. Влияние ЭБ на осморегулирующие вещества в условиях щелочного стресса ((A) содержание растворимых сахаров; (B) содержание растворимых белков; (C) содержание пролина; разные буквы указывают на значительную разницу (p < 0,05)).
Как показано на рисунке 8B, содержание РБ в листьях группы CK на 7 и 15 дней показало, что применение чужеродных веществ значительно/существенно/заметно отличалось от других 10 групп обработки. В результатах теста для 7 дней опрыскивания ЭБ было обнаружено, что за исключением группы CK, группа обработки СК2 и группа обработки МТ2 снизили содержание РБ в листьях C. oleifera, и наблюдалась разница между ними и остальными восемью группами обработки, но не было значительной/существенной/заметной разницы в остальных восьми группах обработки. На 15-й день опрыскивания ЭБ в условиях щелочного стресса РБ в листьях группы CK все еще был самым низким, и наблюдалась разница между группой CK и остальными 10 группами обработки. Среди них РБ листьев C. oleifera в группах обработки XP, СК1, СК3, БА1, БА3, МТ1 и МТ3 был относительно высоким, и между ними не было различий.
Накопление Pro в растениях, особенно в листьях, является физиологическим индикатором устойчивости растений; следовательно, измерение содержания Pro может служить физиологическим индикатором для селекции на щелочеустойчивость. Как показано на рисунке 8C, за исключением группы CK, содержание Pro в остальных 10 группах обработки увеличилось на 7-й и 15-й дни опрыскивания ЭБ в условиях щелочного стресса, особенно в группе обработки XP. На 7-й день опрыскивания ЭБ в условиях щелочного стресса содержание Pro в группах обработки БА1, БА2 и МТ2 снизилось в условиях щелочного стресса, но не было значительной/существенной/заметной разницы между тремя группами обработки. На 15-й день опрыскивания ЭБ в условиях щелочного стресса группы обработки СК3, БА1, БА2, БА3 и МТ2 показали различия и снижение содержания Pro по сравнению с XP. Кроме того, не было разницы между группами обработки XP, СК1 и МТ1 (Рисунок 7C). В целом, растения, опрысканные ЭБ в условиях щелочного стресса, могут координировать осмос, регулировать баланс веществ и в некоторой степени ослаблять повреждения, вызванные этим стрессом.
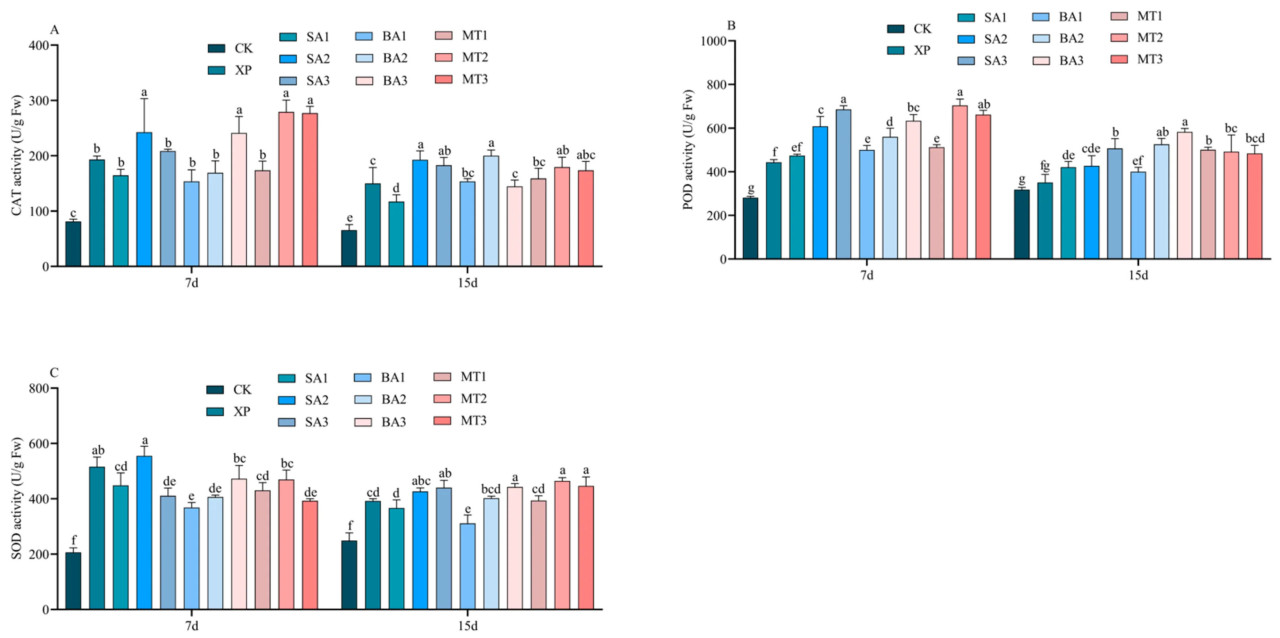
3.7. Влияние ЭБ на активность антиоксидантных ферментов в условиях щелочного стресса
Антиоксидантные ферменты являются важными компонентами в поддержании окислительно-восстановительного баланса в клетках, которые могут удалять АФК, образующиеся при стрессе, и снижать повреждение клеток, вызванное кислородной токсичностью. Как показано на рисунке 9A, активность КАТ была значительно/существенно/заметно улучшена в группах обработки СК2, БА3, МТ2 и МТ3 на 7-й день опрыскивания ЭБ в условиях щелочного стресса, в то время как не было значительной/существенной/заметной разницы между группами обработки XP и СК1, СК3, БА1, БА2 и МТ1. На 15-й день опрыскивания ЭБ в условиях щелочного стресса активность КАТ повысилась в группах обработки СК2, СК3, БА2, МТ2 и МТ3. Как показано на рисунке 9B, активность ПО была значительно/существенно/заметно повышена в группах обработки СК3, МТ2 и МТ3 на 7-й день опрыскивания ЭБ. Кроме того, БА2 и БА3 также значительно/существенно/заметно повысили активность ПО на 15-й день опрыскивания ЭБ. Как показано на рисунке 9C, активность СОД была самой низкой в группе CK при опрыскивании различными ЭБ в условиях одинакового щелочного стресса в течение 7 дней, в то время как не было значительной/существенной/заметной разницы между группами обработки СК2, БА3, МТ2 и XP. СОД в группах обработки СК2, СК3, БА3, МТ2 и МТ3 отличалась от обработки XP на 15-й день опрыскивания ЭБ в условиях щелочного стресса, что указывает/свидетельствует о том, что опрыскивание различными типами и концентрациями ЭБ повлияло на повышение антиоксидантной активности, тем самым уменьшая окислительное повреждение клеток и поддерживая нормальное превращение веществ в клетках.
Рисунок 9. Влияние ЭБ на активность антиоксидантных ферментов в условиях щелочного стресса ((A) активность КАТ; (B) активность ПО; (C) активность СОД; разные буквы обозначают значительную разницу (p < 0,05)).
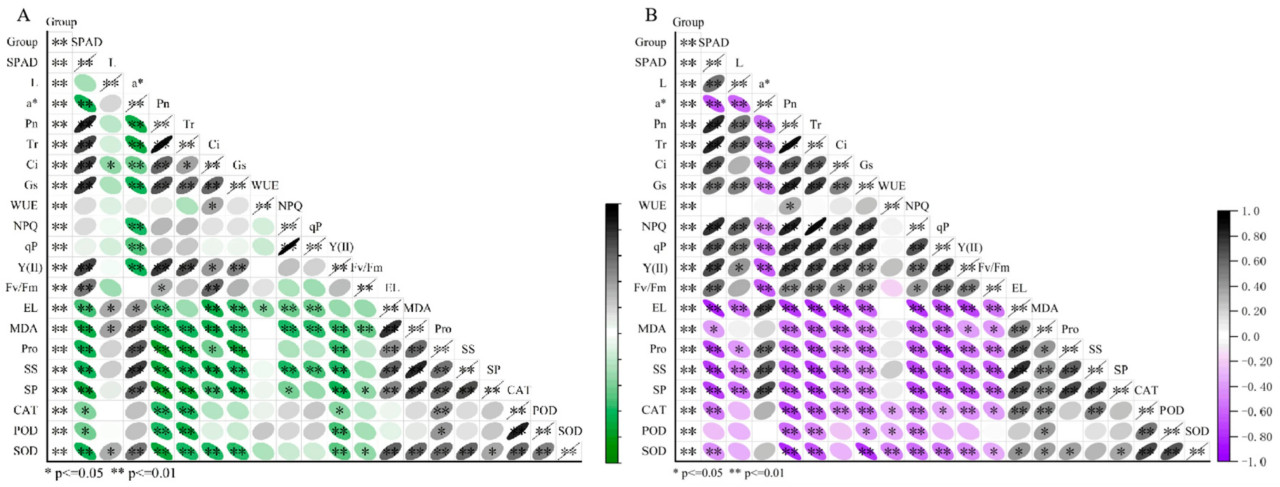
3.8. Корреляционный анализ
Чтобы лучше понять взаимосвязи между группами обработки, SPAD, параметрами цвета, фотосинтетическими параметрами, электропроводностью, содержанием МДА, осморегулирующими веществами, параметрами флуоресценции хлорофилла и антиоксидантными ферментами на 7-й и 15-й дни опрыскивания ЭБ в условиях щелочного стресса, был проведен корреляционный анализ (Рисунок 10A, B). Корреляционный анализ на 7-й день опрыскивания ЭБ в условиях одинакового щелочного стресса показал, что SPAD положительно коррелировал с Pn, Gs, Y(II), Tr, Fv/Fm и Ci, а Pn был значительно/существенно/заметно положительно коррелирован с Tr, Ci, Gs и Y(II) (p < 0,01). Однако Pn отрицательно коррелировал с ЭУ, МДА, Pro, РС, РБ, КАТ, ПО и СОД (p < 0,01). ЭУ положительно коррелировала с МДА, Pro, РС и РБ (p < 0,01). Аналогично, на 15-й день опрыскивания ЭБ в условиях щелочного стресса корреляционный анализ показал, что SPAD положительно коррелировал с Gs, Tr, Ci, Pn, NPQ, qP, Y(II), Fv/Fm и NPQ (p < 0,01). Pn положительно коррелировал с Gs, Tr, Ci, WUE, NPQ, qP, Y(II) и Fv/Fm (p < 0,01). Кроме того, ЭУ положительно коррелировала с МДА, Pro, РС, РБ и КАТ.
Рисунок 10. Корреляционный анализ для 20 показателей ((A) корреляционный анализ на 7-й день применения ЭБ; (B) корреляционный анализ на 15-й день применения ЭБ; L: яркость листа, a: желто-зеленая степень листа).
3.9. Комплексная оценка
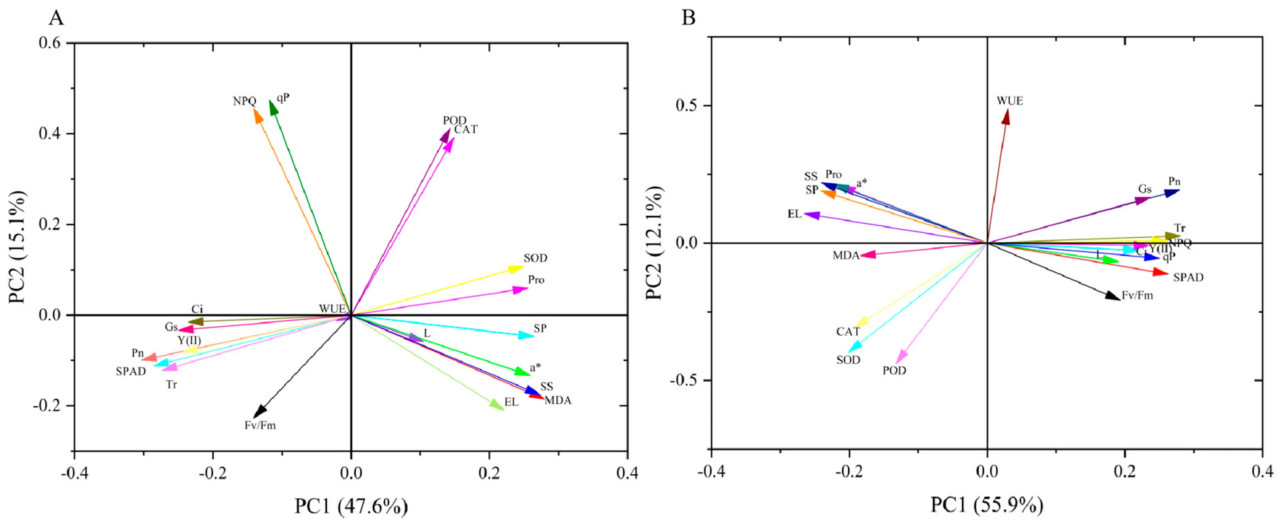
Анализ главных компонент (PCA) был проведен для 20 показателей из 11 различных групп обработки. Результаты показали, что Pn, SPAD, Tr, Gs, Y(II), NPQ, МДА, РС, a и РБ были отобраны в качестве основных показателей на 7-й день опрыскивания ЭБ по результатам PCA (Рисунок 11A). На 15-й день опрыскивания ЭБ два показателя с малыми коэффициентами — ПО и WUE — были исключены из результатов PCA, а остальные показатели использовались в качестве основных (Рисунок 11B).
Рисунок 11. PCA для анализа 20 показателей ((A) PCA на 7-й день применения ЭБ; (B) PCA на 15-й день применения ЭБ; значения в скобках представляют собой проценты, объясненные первыми двумя компонентами).
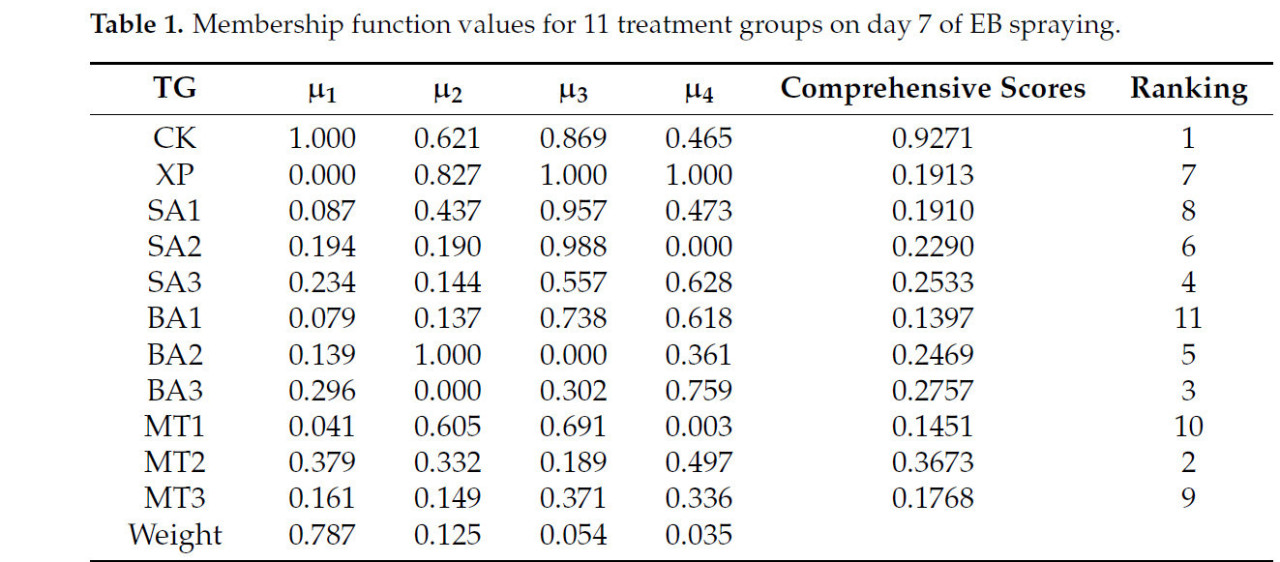
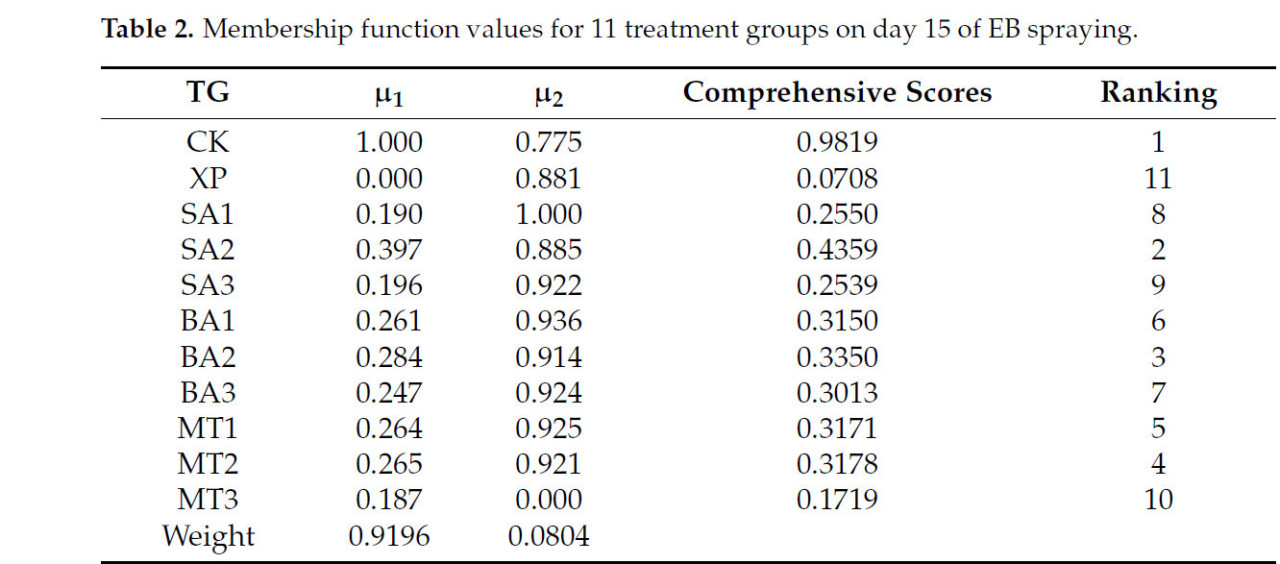
На основе результатов PCA была дальнейше оценена функция принадлежности различных групп обработки на 7-й и 15-й дни опрыскивания ЭБ. Как видно из таблицы 1, помимо группы CK, группа обработки МТ2 имела самую высокую комплексную оценку 0,3673, за ней следовала группа обработки БА3 с 0,2757 и группа обработки СК3, а группа обработки БА1 имела самую низкую комплексную оценку. Можно видеть, что на 7-й день опрыскивания ЭБ группа обработки МТ2 оказала наилучшее смягчающее воздействие на саженцы, подвергшиеся щелочному стрессу, в то время как группа обработки БА1 оказала наихудшее воздействие. Как показано в таблице 2, помимо группы CK, группы обработки СК2, БА2 и МТ2 вошли в тройку лидеров по комплексным оценкам. Согласно комплексным оценкам на 7-й и 15-й дни после опрыскивания ЭБ, группа обработки МТ2 оказала наилучшее смягчающее воздействие на саженцы C. oleifera в условиях щелочного стресса на 7-й и 15-й дни после опрыскивания ЭБ. Однако смягчающий эффект постепенно снижался по мере увеличения времени опрыскивания ЭБ.
Таблица 1. Значения функции принадлежности для 11 групп обработки на 7-й день опрыскивания ЭБ.
Таблица 2. Значения функции принадлежности для 11 групп обработки на 15-й день опрыскивания ЭБ.
4. Обсуждение
Хлорофилл является не только основным пигментом фотосинтеза растений, но и напрямую влияет на синтез питательных веществ и процесс роста растений, обеспечивая/предоставляя основную энергию и питательные вещества, необходимые растениям и другим зависящим от растений организмам. Предыдущие исследования показали, что солевой стресс снижает содержание хлорофилла, что приводит к усилению деградации пигментов и блокированию биосинтеза [27]. Луо обнаружил, что МТ может увеличить содержание хлорофилла у хризантемы в условиях засухи [28]. Аналогично, Альтаф обнаружил, что применение МТ увеличило содержание хлорофилла у томатов в условиях засухи [29]. В этом исследовании ЭБ смогли улучшить относительное содержание хлорофилла у C. oleifera в разной степени на 7-й и 15-й день применения ЭБ, но SPAD в группе обработки XP был значительно/существенно/заметно ниже, чем в группе CK, и эти результаты аналогичны результатам предыдущих исследований. Однако в одинаковых условиях щелочного стресса различные типы и концентрации ЭБ оказали различное/меняющееся/разное влияние на SPAD саженцев C. oleifera. В частности, три концентрации в группе обработки мелатонином превосходили таковые в двух других группах обработки с точки зрения ослабляющего эффекта. Возможные объяснения этого явления связаны с типом ЭБ, концентрацией применения, временем применения и объектом применения. Хотя ЭБ могут улучшить значение SPAD растений, и ЭБ можно использовать для ослабления повреждения других растений в условиях стресса, их конкретные эффекты необходимо проверить с помощью соответствующих экспериментальных данных.
АФК чрезмерно накапливаются в растениях из-за дисбаланса между выработкой и устранением АФК, вызванного тем, что клетки производят чрезмерное количество свободных радикалов и АФК в условиях стресса [30]. Чрезмерное накопление АФК запускает перекисное окисление липидов, приводя к чрезмерному накоплению МДА, что увеличивает проницаемость мембраны и вызывает экзосмос электролитов, и его содержание отражает степень повреждения растений в условиях стресса [31,32]. В этом исследовании содержание МДА в группе обработки XP было выше, чем в остальных 10 группах обработки, но в одинаковых условиях стресса опрыскивание различными типами и концентрациями ЭБ могло снизить содержание МДА саженцев C. oleifera в разной степени. На 7-й день опрыскивания ЭБ эффективными/действенными/успешными группами обработки были СК2, БА3, МТ2 и МТ3, что позволяет нам предварительно заключить, что добавление ЭБ может эффективно/действенно/успешно уменьшить повреждение саженцев C. oleifera щелочным стрессом. Между тем, ЭУ в группах обработки МТ2 и МТ3 была ниже во всех группах обработки, кроме группы CK, как на 7-й, так и на 15-й день опрыскивания ЭБ. Согласно предыдущим исследованиям, МТ может снижать степень перекисного окисления липидов в растениях и поддерживать стабильность мембран [33]. Исследование Ли и др. по засушливому стрессу на яблонях показало, что относительная электропроводность листьев, обработанных МТ, была значительно/существенно/заметно снижена по сравнению с контролем [34]. Из этого исследования можно сделать вывод, что содержание МДА и электропроводность были эффективно/действенно/успешно снижены в группах обработки МТ2 и МТ3, что заставляет нас предположить, что МТ играет полезную роль в ослаблении окислительного повреждения и улучшении стабильности клеточных мембран растений. Это открытие предоставляет/обеспечивает доказательства потенциала МТ в качестве средства для обработки растений, повышающего щелочеустойчивость, но конкретный механизм того, как он оказывает свое защитное действие в условиях щелочного стресса, все еще нуждается в дальнейшем изучении.
В этом исследовании было обнаружено, что Pn, Tr и Gs C. oleifera в группе XP были значительно/существенно/заметно снижены в условиях щелочного стресса, и снижение Pn также указывало на снижение содержания хлорофилла. С другой стороны, снижение фотосинтеза можно объяснить снижением Gs, что было аналогично предыдущим исследованиям [35]. Напротив/в отличие от этого, Pn, Tr и Gs C. oleifera в условиях щелочного стресса увеличились в разной степени при опрыскивании различными типами ЭБ. В частности/особенно, на 7-й день опрыскивания ЭБ Pn в группах обработки СК3 и МТ2 была значительно/существенно/заметно выше, чем в группе XP, а Gs в группах БА2 и МТ2 была самой высокой. Ранее сообщалось, что СК может увеличивать содержание хлорофилла для уменьшения ингибирования фотосинтеза при засухе [36]. Аналогичные результаты были обнаружены у яблонь, подвергшихся засушливому стрессу, где применение МТ снижало деградацию хлорофилла и ослабляло вызванное засухой ингибирование фотосинтеза [37]. Ван и др. обнаружили, что применение СК не только увеличило Pn, Tr и Gs у саженцев, но и улучшило параметры флуоресценции, такие как Fv/Fm, PSII и NPQ, тем самым усиливая фотосинтез и выживаемость кукурузы в условиях стресса от переувлажнения [38]. Результаты настоящего исследования были в основном аналогичны результатам, описанным выше. Кроме того, саженцы C. oleifera в условиях щелочного стресса повышали свою щелочеустойчивость за счет увеличения WUE. Поэтому WUE в группе обработки СК3 была самой высокой на 7-й день применения ЭБ, а в группе обработки МТ1 — на 15-й день применения ЭБ. Результаты фотосинтетических параметров показали, что группа обработки МТ2 могла минимизировать повреждение фотосинтетической системы саженцев C. oleifera в условиях щелочного стресса по сравнению с другими группами обработки и показала относительно хороший смягчающий потенциал. Хотя было обнаружено, что МТ2 проявил определенный потенциал для ослабления щелочного стресса в экспериментальных условиях, проблемы сложности, метода применения, оптимизации дозировки и экономичности в полевых условиях необходимо решить перед его применением в полевых условиях. Поэтому в наших последующих исследованиях нам необходимо не только проверить эффект МТ2 в полевых условиях, но и изучить, как оптимизировать режим и дозу его применения, а также провести долгосрочную оценку его эффективности.
Флуоресценция хлорофилла тесно связана с эффективностью фотосинтеза. Флуоресценция хлорофилла позволяет быстро и без повреждений обнаружить чувствительность листьев сельскохозяйственных культур к стрессовым факторам окружающей среды [39]. В этом исследовании было обнаружено, что Y(II) и Fv/Fm были значительно/существенно/заметно снижены щелочным стрессом по сравнению с группой CK, но параметры флуоресценции саженцев C. oleifera были повышены в разной степени под действием различных типов ЭБ. Исследование Лю показало, что применение МТ в условиях засушливого стресса может значительно/существенно/заметно улучшить Fv/Fm саженцев томата и ослабить стрессовое повреждение реакционного центра Y(II) [40]. К такому же выводу пришли Чжан и др. в своем исследовании на семенах хурмы, где способность к флуоресценции хлорофилла (Fv/Fm) снижалась в условиях засухи, но могла быть частично ослаблена применением экзогенного мелатонина [41]. Кроме того, при применении ЭБ NPQ увеличивался в разной степени, и увеличение NPQ означало, что саженцы C. oleifera способны удалять избыточную энергию путем рассеивания тепла, тем самым уменьшая повреждение в условиях щелочного стресса. Результаты параметров флуоресценции предоставили/обеспечили предварительные доказательства влияния применения ЭБ на фотосинтетическую способность саженцев C. oleifera в щелочной среде. Это может не только обеспечить/предоставить поддержку данными для последующих исследований, но и направить/показать направление для изучения регуляторного механизма ЭБ в условиях стресса.
Осморегулирующие вещества в растениях находятся на низком уровне в нормальных условиях роста. Когда растения подвергаются внешнему стрессу, осморегулирующие вещества, такие как РС, РБ и Pro, быстро синтезируются, и изменение их уровней отражает степень повреждения растения. Аналогично, предыдущие исследования показали, что Pro в избытке/большом количестве накапливается в листьях перца, тем самым повышая устойчивость к переувлажнению и устраняя повреждения, вызванные стрессом от переувлажнения [42]. Кроме того, увеличение накопления Pro под действием СК в условиях стресса также сообщалось для других растений, таких как картофель [43], и эти результаты аналогичны результатам настоящего исследования. В этом исследовании содержание РС, РБ и Pro у саженцев C. oleifera увеличилось в разной степени после щелочного стресса. Однако содержание РС, РБ и Pro у саженцев C. oleifera в условиях щелочного стресса снизилось на 7-й и 15-й дни применения ЭБ, что было более заметно на 7-й день применения ЭБ. Помимо содержания Pro, не было значительной/существенной/заметной разницы в содержании РС и РБ на 15-й день применения ЭБ, что может быть связано со временем действия ЭБ или с тем, что само растение начинает восстанавливаться. Кроме того, ЭБ индуцировали накопление Pro в условиях щелочного стресса, ослабляя негативные последствия щелочного стресса. Учитывая потенциал ЭБ в регуляции абиотического стресса, будущие исследования могли бы также изучить их синергетические эффекты с другими растительными гормонами или стрессоустойчивыми веществами для дальнейшего повышения стрессоустойчивости C. oleifera и других культур в неблагоприятных условиях.
Чтобы адаптироваться к избыточному производству свободных радикалов и АФК и противостоять ему, растительный организм запускает полноценную антиоксидантную защитную систему. СОД, КАТ, ПО и АРХ входят в число антиоксидантных ферментов, составляющих эту защитную систему, и каждый из них имеет определенное защитное назначение [44]. СОД и ПО являются наиболее важными антиоксидантными ферментами в растениях, которые могут эффективно/действенно/успешно удалять АФК, образующиеся при перекисном окислении клеток, и уменьшать повреждение, вызванное перекисным окислением липидов мембран [45]. Алам и др. обнаружили, что опрыскивание 24-эпибрассинолидом может повышать активность антиоксидантных оксидаз у сои, тем самым увеличивая устойчивость сои к солевому стрессу [46]. Исследование Муштак и др. показало, что использование МТ может активировать защитную систему за счет повышения активности антиоксидантных ферментов и уменьшения окислительного повреждения в условиях стресса [47]. Сардар обнаружил, что использование МТ уменьшало антиоксидантное повреждение при засолении за счет повышения активности антиоксидантных ферментов [48]. Предыдущие исследования показали, что МТ может помочь растениям восстановиться после различных стрессов окружающей среды, индуцируя активность антиоксидантных ферментов и контролируя экспрессию генов, кодирующих эти ферменты [49,50]. Кроме того/дальше, Мутлу и др. показали, что обработка СК может увеличить активность ПО и СОД в условиях солевого стресса [51]. Результаты этого исследования показали, что, за исключением отдельных групп обработки, саженцы C. oleifera смогли в определенной степени повысить активность антиоксидантных ферментов (СОД, КАТ и ПО) в условиях щелочного стресса после обработки различными типами и концентрациями ЭБ, тем самым эффективно/действенно/успешно удаляя избыточные АФК и уменьшая повреждение саженцев C. oleifera щелочным стрессом. Результаты этого исследования согласуются с предыдущими исследованиями и предоставляют/обеспечивают предварительные доказательства потенциала обработки ЭБ в повышении щелочеустойчивости растений. В будущем лабораторные и полевые эксперименты будут объединены для дальнейшего изучения эффекта применения ЭБ в реальной сельскохозяйственной среде, чтобы обеспечить/предоставить более надежные рекомендации для сельскохозяйственной практики.
5. Выводы
Настоящее исследование представляет собой попытку изучить смягчающее воздействие различных ЭБ, применяемых в идентичных условиях щелочного стресса, на саженцы C. oleifera. По сравнению с группой CK, a, SPAD, фотосинтетические параметры и параметры флуоресценции хлорофилла саженцев C. oleifera были значительно/существенно/заметно снижены в условиях щелочного стресса, что привело к ингибированию роста саженцев C. oleifera. Однако применение СК, БА и МТ в разных концентрациях снизило содержание МДА и ЭУ и улучшило показатели осморегулирующих веществ и антиоксидантных ферментов в разной степени, тем самым ослабляя вредное воздействие щелочного стресса. Pn был значительно/существенно/заметно положительно коррелирован с Tr, Ci, Gs, Y(II) и Fv/Fm как на 7-й, так и на 15-й дни применения ЭБ, что указывает/свидетельствует о том, что фотосинтез саженцев C. oleifera может быть усилен за счет регулирования состояния устьиц и повышения эффективности использования света Y(II) при применении ЭБ, особенно в группе обработки МТ2. Согласно комплексным результатам функции принадлежности, как на 7-й, так и на 15-й день опрыскивания ЭБ, группа обработки МТ2 показала наилучший общий смягчающий эффект среди трех применявшихся ЭБ, войдя в тройку лучших. Таким образом, можно предварительно продемонстрировать, что экзогенный МТ2 может улучшить адаптивность саженцев C. oleifera к щелочному стрессу. Однако все еще необходимы более обширные и долгосрочные полевые испытания. Будущие исследования будут уделять внимание различным факторам, таким как разные сорта C. oleifera, возраст саженцев, устойчивость ЭБ и стабильность опрыскивания ЭБ, а также дальнейше анализировать, как МТ2 ослабляет молекулярный регуляторный механизм у саженцев C. oleifera в условиях щелочного стресса, комбинируя данные мультиомиксных исследований. Хотя в этом исследовании есть некоторые ограничения, опрыскивание ЭБ может показать определенный потенциал в адаптации C. oleifera к щелочному стрессу и может обеспечить/предоставить более научную схему культивирования/выращивания и управления C. oleifera.
Ссылки
1. Caon, L.; Forlano, N.; Keene, C.; Sala, M.; Sorokin, A.; Verbeke, I.; Ward, C. Status of the World’s Soil Resources. Master’s Thesis, Food and Agriculture Organization of the United Nations, Rome, Italy, 2015; pp. 124–126. [Google Scholar]
2. Radanielson, A.M.; Angeles, O.; Li, T.; Ismail, A.M.; Gaydon, D.S. Describing the physiological responses of different rice genotypes to salt stress using sigmoid and piecewise linear functions. Field Crops Res. 2018, 220, 46–56. [Google Scholar] [CrossRef] [PubMed]
3. Wang, H.; Takano, T.; Liu, S.K. Screening and evaluation of saline–alkaline tolerant germplasm of rice (Oryza sativa L.) in soda saline–alkali soil. Agronomy 2018, 8, 205. [Google Scholar] [CrossRef]
4. Zurbriggen, M.D.; Hajirezaei, M.R.; Carrillo, N. Engineering the future. Development of transgenic plants with enhanced tolerance to adverse environments. Biotechnol. Genet. 2010, 27, 33–56. [Google Scholar] [CrossRef] [PubMed]
5. Bravo, S.; Amorós, J.A.; Pérez-de-los-Reyes, C.; García-Navarro, F.J.; Moreno, M.M.; Sánchez-Ormeño, M.; Higueras, P.L. Influence of the soil pH in the uptake and bioaccumulation of heavy metals and other elements in vine leaves, Castilla-La Mancha (Spain). J. Geochem. Explor. 2017, 174, 79–83. [Google Scholar] [CrossRef]
6. Li, N.; Zhang, Z.H.; Gao, S.; Lv, Y.; Chen, Z.J.; Cao, B.L.; Xu, K. Different responses of two Chinese cabbage (Brassica rapa L. ssp. pekinensis) cultivars in photosynthetic characteristics and chloroplast ultrastructure to salt and alkali stress. Planta 2021, 254, 102. [Google Scholar]
7. Huang, J.H.; Cai, Z.J.; Wen, S.X.; Guo, P.; Ye, X.; Lin, G.Z.; Chen, L.S. Effects of boron toxicity on root and leafanatomy in two Citrus species differing in boron tolerancel. Trees 2014, 28, 1653–1666. [Google Scholar] [CrossRef]
8. Singh, N.; Bhatla, S.C. Nitric oxide and iron modulate heme oxygenase activity as a long distance signaling response to salt stress in sunflower seedling cotyledons. Nitric Oxide 2016, 53, 54–64. [Google Scholar] [CrossRef]
9. Choudhury, F.K.; Rivero, R.M.; Blumwald, E.; Mittler, R. Reactive oxygen species, abiotic stress and stress combination. Plant J. 2017, 90, 856–867. [Google Scholar] [CrossRef]
10. Lv, B.S.; Ma, H.Y.; Li, X.W.; Wei, L.X.; Lv, H.Y.; Yang, H.Y.; Jiang, C.J.; Liang, Z.W. Proline accumulation is not correlated with saline-alkaline stress tolerance in rice seedlings. Agron. J. 2015, 107, 51–60. [Google Scholar] [CrossRef]
11. Zhang, H.; Liu, X.L.; Zhang, R.X.; Yuan, H.Y.; Wang, M.M.; Yang, H.Y.; Ma, H.Y.; Liu, D.; Jiang, C.J.; Liang, Z.W. Root damage under alkaline stress is associated with reactive oxygen species accumulation in rice (Oryza sativa L.). Front. Plant Sci. 2017, 8, 1580. [Google Scholar] [CrossRef]
12. Lee, C.P.; Yen, G.C. Antioxidant activity and bioactive compounds of tea seed (Camellia oleifera Abel.) oil. J. Agric. Food Chem. 2006, 54, 779–784. [Google Scholar] [CrossRef] [PubMed]
13. Wang, X.Q.; Zeng, Q.M.; Del Mar Contreras, M.; Wang, L.J. Profiling and quantification of phenolic compounds in Camellia seed oils: Natural tea polyphenols in vegetable oil. Food Res. Int. 2017, 102, 184–194. [Google Scholar] [CrossRef] [PubMed]
14. Zhang, N.; Zhao, B.; Zhang, H.J.; Weeda, S.; Yang, C.; Yang, Z.C.; Ren, S.; Guo, Y.D. Melatonin promotes water stress tolerance, lateral root formation and seed germination in cucumber (Cucumis sativus L.). J. Pineal Res. 2013, 54, 15–23. [Google Scholar] [CrossRef] [PubMed]
15. Chungloo, D.; Tisarum, R.; Samphumphuang, T.; Pipatsitee, P.; Sotesaritkul, T.; Cha-Um, S. Exogenous glycine betaine alleviates water-deficit stress in Indian pennywort (Centella asiatica) under greenhouse conditions. Protoplasma 2024, 261, 625–639. [Google Scholar] [CrossRef]
16. Ma, X.H.; Zheng, J.; Zhang, X.; Hu, Q.D.; Qian, R.J. Salicylic acid alleviates the adverse effects of salt stress on Dianthus superbus (Caryophyllaceae) by activating photosynthesis, protecting morphological structure, and enhancing the antioxidant system. Front. Plant Sci. 2017, 8, 600. [Google Scholar] [CrossRef]
17. He, X.S.; Xu, L.C.; Pan, C.; Gong, C.; Wang, Y.J.; Liu, X.L.; Yu, Y.C. Drought resistance of Camellia oleifera under drought stress: Changes in physiology and growth characteristics. PLoS ONE 2020, 15, e0235795. [Google Scholar] [CrossRef]
18. Yang, H.; Zhou, H.Y.; Yang, X.N.; Zhan, J.J.; Zhou, H.; Wang, C.; Yu, Y.; Lu, X.Y.; Chen, Y.Z.; Tian, Y. Transcriptomic analysis of Camellia oleifera in response to drought stress using high throughput RNA-seq. Russ. J. Plant Physiol. 2017, 64, 728–737. [Google Scholar] [CrossRef]
19. Denavi, G.; Tapia-Bl’acido, D.R.; An’on, M.C.; Sobral, P.J.A.; Mauri, A.N.; Menegalli, F.C. Effects of drying conditions on some physical properties of soy protein films. J. Food Eng. 2009, 90, 341–349. [Google Scholar] [CrossRef]
20. Wang, J.Y.; Qiao, Q.; Tao, J.H. The physiological response of three narcissus pseudonarcissus under NaCl stress. Am. J. Plant Sci. 2019, 10, 447–461. [Google Scholar] [CrossRef]
21. Feng, N.J.; Yu, M.L.; Li, Y.; Jin, D.; Zheng, D.F. Prohexadione-calcium alleviates saline-alkali stress in soybean seedlings by improving the photosynthesis and up-regulating antioxidant defense. Ecotoxicol. Environ. Saf. 2021, 220, 112369. [Google Scholar] [CrossRef]
22. Graham, D.; Smydzuc, J. Use of anthrone in the quantitative determination of hexose phosphates. Anal. Biochem. 1965, 11, 246–255. [Google Scholar] [CrossRef] [PubMed]
23. Bradford, M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 1976, 72, 248–254. [Google Scholar] [CrossRef] [PubMed]
24. Bates, L.S.; Waldren, R.P.; Tear, I.D. Rapid determination of free proline for water stressed studies. Plant Soil 1973, 39, 205–207. [Google Scholar] [CrossRef]
25. Zhang, X.Z. The measurement and mechanism of lipid peroxidation and SOD, POD and CAT activities in biological system. In Research Methodology of Crop Physiology; Agriculture Press: Beijing, China, 1992; pp. 197–212. [Google Scholar]
26. Long, J.T.; Dong, M.J.; Wang, C.Q.; Miao, Y.J. Effects of drought and salt stress on seed germination and seedling growth of Elymus nutans. PeerJ 2023, 11, e15968. [Google Scholar] [CrossRef]
27. Neelam, S.; Subramanyam, R. Alteration of photochemistry and protein degradation of photosystem II from Chlamydomonas reinhardtii under high salt grown cells. J. Photochem. Photobiol. B Biol. 2013, 124, 63–70. [Google Scholar] [CrossRef]
28. Luo, Y.; Hu, T.T.; Huo, Y.Y.; Wang, L.L.; Zhang, L.; Yan, R. Effects of exogenous melatonin on Chrysanthemum physiological characteristics and photosynthesis under drought stress. Horticulturae 2023, 9, 106. [Google Scholar] [CrossRef]
29. Altaf, M.A.; Shahid, R.; Ren, M.X.; Naz, S.; Altaf, M.M.; Khan, L.U.; Tiwari, R.K.; Lal, M.K.; Shahid, M.A.; Kumar, R.; et al. Melatonin improves drought stress tolerance of tomato by modulating plant growth, root architecture, photosynthesis, and antioxidant defense system. Antioxidants 2022, 11, 309. [Google Scholar] [CrossRef]
30. Bose, S.K.; Howlader, P. Melatonin plays multifunctional role in horticultural crops against environmental stresses: A review. Environ. Exp. Bot. 2020, 176, 104063. [Google Scholar] [CrossRef]
31. Li, J.T.; Qiu, Z.B.; Zhang, X.W.; Wang, L.S. Exogenous hydrogen peroxide can enhance tolerance of wheat seedlings to salt stress. Acta Physiol. Plant 2011, 33, 835–842. [Google Scholar]
32. Wang, J.; Zhang, Y.X.; Yan, X.R.; Guo, J.P. Physiological and transcriptomic analyses of yellow horn (Xanthoceras sorbifolia) provide important insights into salt and saline-alkali stress tolerance. PLoS ONE 2020, 15, e0244365. [Google Scholar] [CrossRef]
33. Arnao, M.B.; Hernández-Ruiz, J. Functions of melatonin in plants: A review. J. Pineal Res. 2015, 59, 133–150. [Google Scholar] [CrossRef] [PubMed]
34. Li, C.; Tan, D.X.; Liang, D.; Chang, C.; Jia, D.F.; Ma, F.W. Melatonin mediates the regulation of ABA metabolism, free-radical scavenging, and stomatal behaviour in two Malus species under drought stress. J. Exp. Bot. 2015, 66, 669–680. [Google Scholar] [CrossRef] [PubMed]
35. Gupta, P.; Srivastava, S.; Seth, C.S. 24-Epibrassinolide and sodium nitroprusside alleviate the salinity stress in Brassica juncea L. cv. Varuna through cross talk among proline, nitrogen metabolism and abscisic acid. Plant Soil 2017, 411, 483–498. [Google Scholar] [CrossRef]
36. Shemi, R.; Wang, R.; Gheith, E.M.S.; Hussain, H.A.; Cholidah, L.; Zhang, K.P.; Zhang, S.; Wang, L.C. Role of exogenous-applied salicylic acid, zinc and glycine betaine to improve drought-tolerance in wheat during reproductive growth stages. BMC Plant Biol. 2021, 21, 574. [Google Scholar] [CrossRef]
37. Wang, P.; Sun, X.; Li, C.; Wei, Z.W.; Liang, D.; Ma, F.W. Long-term exogenous application of melatonin delays drought-induced leaf senescence in apple. J. Pineal Res. 2013, 54, 292–302. [Google Scholar] [CrossRef]
38. Wang, J.; Shi, S.H.; Wang, D.Y.; Sun, Y.; Zhu, M.; Li, F.H. Exogenous salicylic acid ameliorates waterlogging stress damages and improves photosynthetic efficiency and antioxidative defense system in waxy corn. Photosynthetica 2021, 59, 84–94. [Google Scholar] [CrossRef]
39. Yue, J.Q.; Zhang, S.Y.; Li, X.D.; Shao, Y.H.; Fang, B.T.; Ge, S.X.; Wang, H.F.; Zhang, D.Q.; Yang, C.; Shi, Y.H.; et al. Effect of low temperature stress on chlorophyll fluorescence parameters and yield of Wheat. J. Oftriticeae Crops 2021, 40, 105–110. (In Chinese) [Google Scholar]
40. Liu, J.L.; Wang, W.X.; Wang, L.Y.; Sun, Y. Exogenous melatonin improves seedling health index and drought tolerance in tomato. Plant Growth Regul. 2015, 77, 317–326. [Google Scholar] [CrossRef]
41. Zhang, P.; Hu, Y.; Zhou, R.J.; Zhang, X.N.; Hu, H.L.; Lang, D.M. The antioxidant system response to drought-stressed Diospyros lotus treated with exogenous melatonin. PeerJ 2022, 10, e13936. [Google Scholar] [CrossRef]
42. Molla, M.R.; Rohman, M.M.; Islam, M.R.; Hasanuzzaman, M.; Hassan, L. Screening and evaluation of chilli (Capsicum annuum L.) genotypes for waterlogging tolerance at seedling stage. Biocell 2022, 46, 1613–1627. [Google Scholar] [CrossRef]
43. Faried, H.N.; Ayyub, C.M.; Amjad, M.; Ahmed, R.; Wattoo, F.M.; Butt, M.; Bashir, M.; Shaheen, M.R.; Waqas, M.A. Salicylic acid confers salt tolerance in potato plants by improving water relations, gaseous exchange, antioxidant activities and osmoregulation. J. Sci. Food Agric. 2017, 97, 1868–1875. [Google Scholar] [CrossRef] [PubMed]
44. Khan, I.; Raza, M.A.; Awan, S.A.; Shah, G.A.; Rizwan, M.; Ali, B.; Tariq, R.; Hassan, M.J.; Alyemeni, M.N.; Brestic, M.; et al. Amelioration of salt induced toxicity in pearl millet by seed priming with silver nanoparticles (AgNPs): The oxidative damage, antioxidant enzymes and ions uptake are major determinants of salt tolerant capacity. Plant Physiol. Biochem. 2020, 156, 221–232. [Google Scholar] [CrossRef] [PubMed]
45. HAsanuzzaman, M.; Oku, H.; Nahar, K.; Borhannuddin Bhuyan, M.H.M.; Al Mahumud, J.; Baluska, F.; Fujita, M. Nitric oxide-induced salt stress tolerance in plants: ROS metabolism, signaling, and molecular interactions. Plant Biotechnol. Rep. 2018, 12, 77–92. [Google Scholar] [CrossRef]
46. Alam, P.; Albalawi, T.H.; Altalayan, F.H.; Bakht, M.A.; Ahanger, M.A.; Raja, V.; Ashraf, M.; Ahmad, P. 24-Epibrassinolide (EBR) confers tolerance against NaCl stress in soybean plants by up-regulating antioxidant system, ascorbateglutathione cycle, and glyoxalase system. Biomolecules 2019, 9, 640. [Google Scholar] [CrossRef]
47. Mushtaq, N.; Iqbal, S.; Hayat, F.; Raziq, A.; Ayaz, A.; Zaman, W. Melatonin in micro-tom tomato: Improved drought tolerance via the regulation of the photosynthetic apparatus, membrane stability, osmoprotectants, and root system. Life 2022, 12, 1922. [Google Scholar] [CrossRef]
48. Sardar, H.; Ramzan, M.A.; Naz, S.; Ali, S.; Ejaz, S.; Ahmad, R.; Altaf, M.A. Exogenous application of melatonin improves the growth and productivity of two broccoli (Brassica oleracea L.) cultivars under salt stress. J. Plant Growth Regul. 2023, 42, 5152–5166. [Google Scholar] [CrossRef]
49. Keunen, E.; Peshev, D.; Vangronsveld, J.; Van Den Ende, W.; Cuypers, A. Plant sugars are crucial players in the oxidative challenge during abiotic stress: Extending the traditional concept. Plant Cell Environ. 2013, 36, 1242–1255. [Google Scholar] [CrossRef]
50. Li, C.; Wang, P.; Wei, Z.W.; Liang, D.; Liu, C.H.; Yin, L.H.; Jia, D.F.; Fu, M.Y.; Ma, F.W. The mitigation effects of exogenous melatonin on salinity-induced stress in Malus hupehensis. J. Pineal Res. 2012, 53, 298–306. [Google Scholar] [CrossRef]
51. Mutlu, S.; Atici, O.; Nalbantoglu, B. Effects of salicylic acid and salinity on apoplastic antioxidant enzymes in two wheat cultivars differing in salt tolerance. Biol. Plant. 2009, 53, 334–448. [Google Scholar] [CrossRef]
Kong Q, Zheng S, Li W, Liang H, Zhou L, Yang H, Jiang X, Feng S, Chen T, Ding C. Performance of Camellia oleifera Seedlings Under Alkali Stress Improved by Spraying with Types of Exogenous Biostimulants. Agriculture. 2025; 15(3):274. https://doi.org/10.3390/agriculture15030274
Перевод статьи «Performance ofCamellia oleiferaSeedlings Under Alkali Stress Improved by Spraying with Types of Exogenous Biostimulants» авторов Kong Q, Zheng S, Li W, Liang H, Zhou L, Yang H, Jiang X, Feng S, Chen T, Ding C., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
































































































Комментарии (0)