Почвенные цианобактерии как ключ к росту урожая пшеницы и здоровью почвы
Цианобактерии хорошо известны своими биоудобряющими свойствами, способными повышать плодородие почвы и рост растений. Целью данного исследования является оценка биоудобряющего эффекта местной азотфиксирующей почвенной цианобактерииAnabaena cylindricaна рост, биохимические и физиологические показатели пшеницы, а также на плодородие почвы.
Аннотация
В условиях теплицы методом почвенного полива применяли фильтрат культуральной среды, водный экстракт, обработанную ультразвуком культуру и неочищенную культуру (клеточную суспензию) A. cylindrica в различных дозах (50%, 25%, 1% и 0,2% об./об.). После 40 дней роста все цианобактериальные суспензии значительно увеличили рост пшеницы, её биохимические показатели и минеральный состав по сравнению с контролем. Наибольшие улучшения наблюдались при применении цианобактериальных суспензий в самых высоких концентрациях — 25% и 50%. Эти дозы также значительно улучшили питательные и физико-химические свойства почвы. Среди различных обработок наиболее эффективными оказались инокуляция почвы неочищенной культурой (живыми клетками) и фильтратом культуральной среды в концентрации 50%. Стимулирующий рост пшеницы эффект был обусловлен внутриклеточными или выделяемыми A. cylindrica биологически активными соединениями, такими как полисахариды, белки, фитогормон индол-3-уксусная кислота, азот, фосфор и калий. Это исследование демонстрирует, что суспензии на основе наземной A. cylindrica способствуют росту пшеницы и могут использоваться в качестве эффективного и экологически чистого биоудобрения для улучшения роста растений и урожайности сельскохозяйственных культур.
1. Введение
За последнее столетие мировое сельскохозяйственное производство значительно увеличилось, чтобы удовлетворить потребности в продовольственной безопасности растущего населения Земли. Это расширение оказало существенное давление на природные и сельскохозяйственные ресурсы [1]. Среди продовольственных культур пшеница (Triticum aestivum L.) является наиболее важной стратегической зерновой культурой в мире [2]. Для снижения рисков бедности и недоедания организации и власти рекомендовали удвоить сельскохозяйственное производство [1]. Для достижения этой цели сельскохозяйственные практики интенсивно используют химические удобрения и фитосанитарные продукты. Однако нерациональное использование этих химикатов нанесло существенный ущерб здоровью агросистем и снизило питательное качество продукции растениеводства [3]. Чтобы смягчить экологическое и медико-санитарное воздействие химических удобрений, в последнее время появились новые сельскохозяйственные практики, основанные на органическом земледелии и биоудобрениях, как устойчивые и экологически безопасные альтернативы [4,5].
Использование биоудобрений на основе различных биологических веществ или микроорганизмов из естественных местообитаний представляет собой альтернативный подход и возобновляемый вариант для стимулирования и улучшения качества и урожайности сельскохозяйственных культур [6,7]. Несколько исследований продемонстрировали, что цианобактерии обладают значительным биоудобряющим потенциалом, усиливая рост растений, их развитие и устойчивость к биотическим и абиотическим стрессам [8,9,10,11]. В последнее время водные цианобактерии также стали ценным источником биоудобрений и биостимуляторов, открывая перспективные коммерческие возможности для агрономии и агропромышленности [12,13,14]. Однако исследования биоудобрений на основе почвенных цианобактерий остаются ограниченными [8,15,16]. Фактически, почвенные цианобактерии хорошо известны как фотосинтезирующие микроорганизмы, которые обеспечивают экономически жизнеспособную и экологическую альтернативу для повышения как продуктивности сельскохозяйственных культур, так и плодородия почвы [9,10,11,13,17].
Цианобактерии встречаются в различных наземных местообитаниях, включая различные сельскохозяйственные почвы. Благодаря своим физиологическим свойствам, в частности, способности к фиксации азота, цианобактерии все чаще признаются перспективным инструментом для повышения сельскохозяйственного производства [18,19]. Действительно, использование азотфиксирующих цианобактерий может частично снизить потребность в минеральном азоте и химических удобрениях в растениеводстве [17,20]. Дополнительно, цианобактерии известны своей способностью продуцировать различные органические соединения, такие как экзополимеры и фитогормоны (ауксины, гиббереллины и цитокинины), которые играют ключевую роль в улучшении прорастания семян, роста и развития растений [21]. Недавно, в работе [22] наблюдали, что устойчивые к высушиванию цианобактерии, проявляющие потенциал стимулирования роста растений, усиливали рост проростков пшеницы.
Биоудобрения на основе цианобактерий вызвали значительный интерес в растениеводстве. Различные препараты теперь доступны на рынке, и все большее число агрохимических компаний включают экстракты цианобактерий или инокулянты в инновационные продукты биоудобрений [23,24]. Применение цианобактерий в качестве биоудобрений для роста сельскохозяйственных культур может быть достигнуто в основном двумя подходами: прямой инокуляцией в почву в виде свежей или высушенной биомассы или путем использования препаратов экстрактов (например, неочищенных экстрактов, фракций или фильтратов) [12,20]. Цианобактерии также можно применять в качестве обработки семян. Например, в работе [25] наблюдали улучшение роста пшеницы благодаря праймированию семян цианобактериями.
Среди наиболее используемых моделей, несколько гетероцистных нитчатых видов азотфиксирующих цианобактерий, таких как Anabaena, Nostoc, Tolypothrix, Scytonema и Calothrix, использовались в качестве биоудобрений для стимулирования роста растений. Например, Anabaena cylindrica и Nostoc spp. проявили высокие темпы роста и эффективное производство внеклеточных веществ и фитогормонов в питательных средах, которые оказывают прямой или косвенный биоудобряющий эффект [15]. Другие исследования показали, что гетероцистные цианобактерии, включая Anabaena, Nostoc, Calothrix и другие роды, оказывают эффективное биоудобряющее действие на большинстве рисовых полей, используемых для возделывания риса [14,26,27,28]. Однако относительно несколько исследований изучили биоудобряющее действие местных почвенных цианобактерий на посевы пшеницы [8,11,18]. Поэтому важно оценивать биоудобряющий потенциал наземных штаммов цианобактерий, хорошо адаптированных к суровым почвенным условиям, и проверить гипотезу о том, что препараты на основе суспензии живых клеток также могут улучшать рост пшеницы и плодородие почвы так же эффективно, как и жидкие экстракты.
Таким образом, данное исследование было направлено на оценку биоудобряющего действия местного почвенного азотфиксирующего штамма A. cylindrica на рост пшеницы и плодородие почвы. Были протестированы различные способы внесения в почву A. cylindrica с использованием различных препаратов, включая водный экстракт (внутриклеточные вещества), фильтрат культуральной среды (высвобожденные соединения и экссудаты), обработанную ультразвуком культуру и неочищенную культуру (живые клетки). Цель состояла в том, чтобы сравнить биоудобряющие эффекты инокуляции почвы этими цианобактериальными суспензиями при разных концентрациях и выбрать наиболее эффективные препараты для улучшения роста пшеницы, ее питательного статуса и плодородия почвы.
2. Материалы и методы
2.1. Штамм цианобактерий и условия выращивания
Штамм Anabaena cylindrica MACC-CY00070, использованный в данном исследовании, принадлежит Марракешской коллекции культур водорослей (MACC, Факультет естественных наук Семлалия, Университет Кади Айяд). Его нуклеотидная последовательность 16S рРНК депонирована в GenBank под номером доступа PQ612758. Моноводорослевой штамм культивировали в неаксеничной периодической культуре на жидкой среде Z8 [29] без азота, в контролируемых субоптимальных условиях роста (температура 25 °C ± 2, интенсивность света 62 мкмоль (фотонов) м⁻² с⁻¹, световой/темновой цикл 15 ч/9 ч и непрерывная аэрация) в лабораторной камере для культивирования. Маточную монокультуру A. cylindrica поддерживали в экспоненциальной фазе роста путем регулярного пересева, а ее чистоту подтверждали с помощью микроскопии.
Рост штамма A. cylindrica контролировали ежедневно в трех повторностях культуры путем подсчета количества клеток/нитей под световым микроскопом (Motic BA210, Сямынь, Китай) при увеличении 400×. Вкратце, подсчет нитей выполняли трижды с использованием камеры для подсчета клеток Малассе после определения среднего количества клеток на нить (подсчет клеток 30 нитей), как описано в [30]. Удельную скорость роста (μ) рассчитывали по следующей формуле [31]:
где N₂ и N₁ обозначают плотность клеток во времена t₂ и t₁ соответственно.
2.2. Биохимические и физиологические характеристики A. cylindrica
Штамм A. cylindrica был охарактеризован по различным признакам, способствующим росту, таким как солюбилизация фосфата, фиксация азота, производство индол-3-уксусной кислоты (ИУК) и экзополисахаридов (ЭПС). Солюбилизацию фосфата выявляли качественно путем нанесения штрихов штамма на чашки Петри с твердым агаром BG11, содержащим трехосновной фосфат кальция (Ca₃HPO₄) 0,3%. После инкубации при 26 ± 2 °C в течение 15 дней развитие прозрачной зоны вокруг цианобактерий указывало на солюбилизацию фосфата [32]. Потенциал фиксации азота оценивали с помощью качественного теста с использованием безазотной жидкой среды Z8. Кинетику роста цианобактерии отслеживали как подтверждение фиксации атмосферного N₂ [32].
Потенциал A. cylindrica к продукции ИУК оценивали с помощью колориметрического анализа на основе метода Салковского [33]. Вкратце, штамм цианобактерий культивировали в колбах Эрленмейера, содержащих 250 мл среды Z8, дополненной L-триптофаном. После 15 дней инкубации при непрерывной аэрации клетки цианобактерий удаляли центрифугированием при 5000× g в течение 10 мин. Затем к супернатанту добавляли реактив Салковского в соотношении 2:1 (об./об.). Смесь инкубировали в темноте при 30 °C в течение 30 мин. Развитие розовой окраски указывало на продукцию ауксина, которую количественно определяли путем измерения оптической плотности (ОП) при 530 нм с использованием калибровочной кривой стандартной ИУК [33]. Для анализа ЭПС проводили физическую экстракцию с использованием комбинированного метода нагревания и ультразвуковой экстракции, как описано в [34]. Вкратце, 0,5 г свежей биомассы A. cylindrica ресуспендировали в 5 мл 0,05% раствора хлорида натрия (NaCl). Смесь инкубировали при перемешивании в печи при 60 °C в течение 30 мин. Затем суспензию обрабатывали в ультразвуковой ванне (SONIFER® B-12 Cell Disruptor) при мощности 100 Вт в течение 10 мин при 20 °C. После ультразвуковой обработки суспензию центрифугировали (Eppendorf® Centrifuge 5804R, Гамбург, Германия), и полученный супернатант переносили в пробирку на 50 мл. Супернатант лиофилизировали (Christ® Alpha 1-4 LSC basic, Остероде-ам-Гарц, Германия) в течение 24 ч при -60 °C и 1 мбар. Массу ЭПС определяли гравиметрически.
2.3. Приготовление и характеристика обработок A. cylindrica
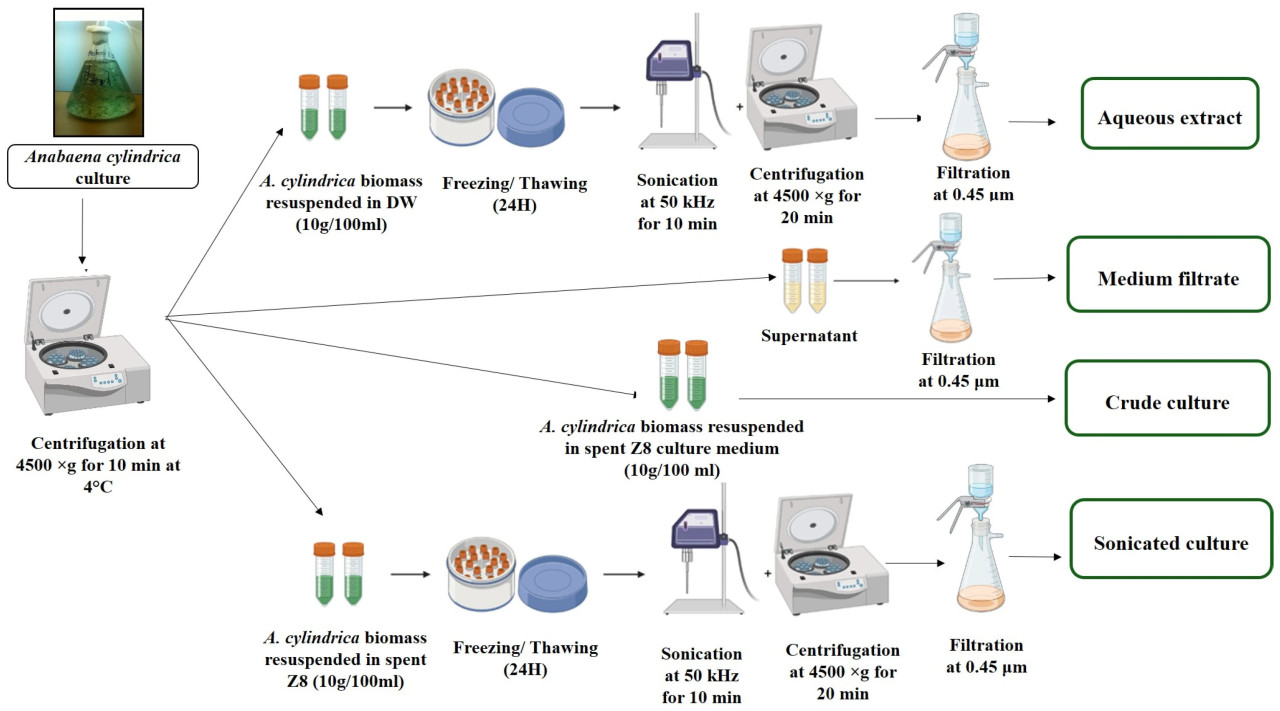
В колбы Эрленмейера на 5000 мл добавляли по 50 мл маточной культуры A. cylindrica, в трех повторностях, к 4500 мл без азотной среды Z8 и инкубировали в ранее упомянутых условиях. После 20 дней роста биомассу A. cylindrica в поздней логарифмической фазе (2,8 × 10⁷ КОЕ/мл) собирали центрифугированием с использованием центрифуги Eppendorf® Centrifuge 5804R (Eppendorf® Centrifuge 5804R, Гамбург, Германия) при 4500× g в течение 10 мин при 4 °C. Супернатант собирали, фильтровали через фильтр Millipore 0,45 мкм и затем хранили при 4 °C. Свежую биомассу собирали, промывали дистиллированной водой, взвешивали и хранили при 4 °C для дальнейшего анализа и обработки.
Были приготовлены четыре обработки с использованием различных суспензий культуры на основе A. cylindrica, как подробно описано в нашей предыдущей работе [16]. Вкратце, первая обработка представляла собой водный экстракт (внутриклеточные вещества), полученный путем замораживания-оттаивания, ультразвуковой обработки и центрифугирования биомассы A. cylindrica, ресуспендированной в дистиллированной воде для достижения конечной концентрации 10 г СВ (сырого веса)/100 мл. Вторая обработка, представляющая внеклеточную фракцию, состояла из профильтрованной отработанной культуральной среды, пропущенной через фильтр Millipore 0,45 мкм (фильтрат). Третья обработка, неочищенная культура (живые клетки), была приготовлена путем ресуспендирования свежей биомассы в отработанной культуральной среде Z8 для достижения конечной концентрации биомассы 10 г СВ/100 мл. Четвертая обработка, ультразвуковая культура, включала ресуспендирование биомассы цианобактерий в культуральной среде Z8 при 10 г СВ/100 мл с последующим замораживанием-оттаиванием, ультразвуковой обработкой (для обеспечения высвобождения всех внутриклеточных соединений), центрифугированием и фильтрацией. В этом эксперименте использовали два отрицательных контроля (дистиллированная вода (ДВ) и свежая стерильная среда Z8 (Z8)). Этот второй контроль был включен для сравнения эффектов свежей среды Z8 с обработками 2, 3 и 4 (Рисунок 1).
Рисунок 1. Приготовление различных обработок Anabaena cylindrica.
pH и электропроводность (ЕС) суспензий A. cylindrica измеряли с помощью pH-метра (pH 1970i WTW GmbH, Вайльхайм, Германия) и кондуктометра (Cond 1970i WTW GmbH, Вайльхайм, Германия) соответственно. Для биохимического анализа A. cylindrica соответствующий объем для каждой цианобактериальной суспензии предварительно лиофильно высушивали с использованием лиофилизатора (Christ® Alpha 1-4 LSC basic, Остероде-ам-Гарц, Германия). Содержание белка количественно определяли по протоколу [35] с использованием бычьего сывороточного альбумина в качестве стандарта, в то время как общее содержание сахаров (полисахаридов) определяли по методу [36] с использованием фенольно-сернокислотного анализа. Содержание минералов в различных обработках, таких как Na⁺, Ca²⁺ и K⁺, оценивали согласно методу [37] с использованием пламенного фотометра (пламенный фотометр модели AFP-100, Кипр). Общий фосфор и общий азот по Кьельдалю (ТКН) количественно определяли с использованием методов AFNOR согласно [38].
2.4. Выращивание в теплице и биотест
2.4.1. Подготовка почвы
Почву собирали с незасеянного и неудобренного сельскохозяйственного угодья в засушливом районе Марракеша (Марокко). Почва, использованная в биотесте, бедна органическим углеродом (0,43%), дефицитна по азоту (120 мг/кг), содержанию фосфора (20 мг/кг) и характеризуется суглинисто-глинистой текстурой.
2.4.2. Схема эксперимента
Биотесты роста проводили с четырьмя обработками A. cylindrica, примененными в различных дозах: 0,2%, 1%, 25% и 50% (об./об.), на основе сырого веса (СВ). Семена марокканского сорта мягкой пшеницы (Triticum aestivum L. var. Achtar) были приобретены в Национальной компании по коммерциализации семян (SONACOS, Рабат, Марокко).
Семена пшеницы, предварительно стерилизованные 10% NaCl и промытые, индивидуально замачивали в различных суспензиях обработок (50 мл) в течение 12 ч при комнатной температуре в темноте, а затем предварительно проращивали в чашках Петри. Через 24 ч прорастания здоровые проростки с высотой корешка 0,2 см пересаживали в 24-ячеечные кассеты (5 × 5 × 5 см), каждая из которых содержала 200 г стерильной почвы. В каждый горшок пересаживали два проросших семени, с восемью повторностями для каждой обработки (192 ячейки: 6 обработок × 4 дозы × 8 повторностей). В начале эксперимента кассеты инокулировали 10 мл каждой цианобактериальной суспензии при различных дозах. Неинокулированные горшки (контроль) обрабатывали только дистиллированной водой или средой Z8. Кассеты размещали в полностью рандомизированном блок-дизайне в теплице Факультета естественных наук Семлалия (FSSM, Марракеш, Марокко) в полуконтролируемых условиях (естественный дневной свет; температура 23–30 °C световой/темновой цикл и относительная влажность 60–70%). Все горшки регулярно поливали по мере необходимости. После 40 дней роста надземные и подземные части растений пшеницы собирали отдельно для измерения параметров роста, биохимических и минеральных параметров.
2.5. Биометрические параметры растений
Корни отделяли и осторожно промывали для удаления всех частиц почвы. Длину корней и побегов (см) измеряли вручную. Свежие образцы корней и побегов взвешивали (сырой вес в г), а затем сушили при 70 °C в течение 3 дней до достижения постоянного веса (сухой вес в г).
2.6. Минеральный и биохимический анализ растений
Минеральный анализ растений проводили на высушенных образцах побегов. K⁺, Na⁺ и Ca²⁺ анализировали в минерализованном материале с использованием пламенного фотометра (AFP 100 Flame Photometer) по протоколу [37]. Содержание фосфора в растениях определяли с использованием метода, описанного Мерфи и Рили [39]. Общий азот определяли по методу Кьельдаля, как сообщалось в [40]. Биохимические параметры измеряли в свежих образцах побегов и листьев. Содержание белка определяли по методу [35] с использованием бычьего сывороточного альбумина (БСА) в качестве стандарта. Общее содержание растворимых сахаров количественно определяли согласно протоколу [36]. Концентрации фотосинтетических пигментов (общий хлорофилл, хлорофилл a, хлорофилл b и каротиноиды) измеряли в свежих листьях с использованием метода экстракции 95% ацетоном и УФ-видимой спектрофотометрии, как сообщалось в [41].
2.7. Физико-химический анализ почв
Для оценки влияния цианобактериальной обработки на плодородие почвы несколько физико-химических параметров анализировали до и после цианобактериальных обработок. При сборе урожая образцы почвы собирали вблизи корней (после удаления поверхностной фракции, от 0 до 2 см), высушивали на воздухе при комнатной температуре, измельчали и просеивали (<2 мм). Содержание общего органического углерода измеряли с использованием метода, описанного в [42]. Доступный фосфор анализировали с помощью колориметрического метода, как описано в [43]. Общий азот измеряли по методу Кьельдаля [38]. Макро- и микроэлементы (K⁺, Na⁺ и Ca²⁺) анализировали с использованием пламенного фотометрического метода [37]. Гранулометрию образцов почвы оценивали с использованием метода Робинсона [44].
2.8. Статистический анализ
Статистический анализ выполняли с использованием программного обеспечения Minitab 16 (версия 16.1.1; Inc., State College, PA, USA). Все эксперименты проводили в трех повторностях, и данные представлены как среднее ± стандартное отклонение. Двухфакторный дисперсионный анализ использовали для оценки эффектов обработки (препарата) и концентрации, а также их взаимодействия, на рост пшеницы и плодородие почвы. Две независимые переменные (два фактора) в этом исследовании были Фактор А (тип препарата: водный экстракт, фильтрат среды, неочищенная культура и ультразвуковая культура) и Фактор Б (примененная концентрация: 0,2%, 1%, 25% и 50%). Зависимыми переменными были измеряемые параметры. Попарные сравнения после проверки выполняли с использованием теста Тьюки HSD при p < 0,05 для выявления значительных различий между обработками или концентрациями. Анализ главных компонент (PCA) был выполнен для изучения потенциальных корреляций между параметрами растений, физико-химическими свойствами почвы и цианобактериальными обработками с использованием программного обеспечения XLSTAT 2016 (версия 18.02.01.27444; Addinsoft, Франция).
3. Результаты
3.1. Параметры роста и физиологические характеристики A. cylindrica
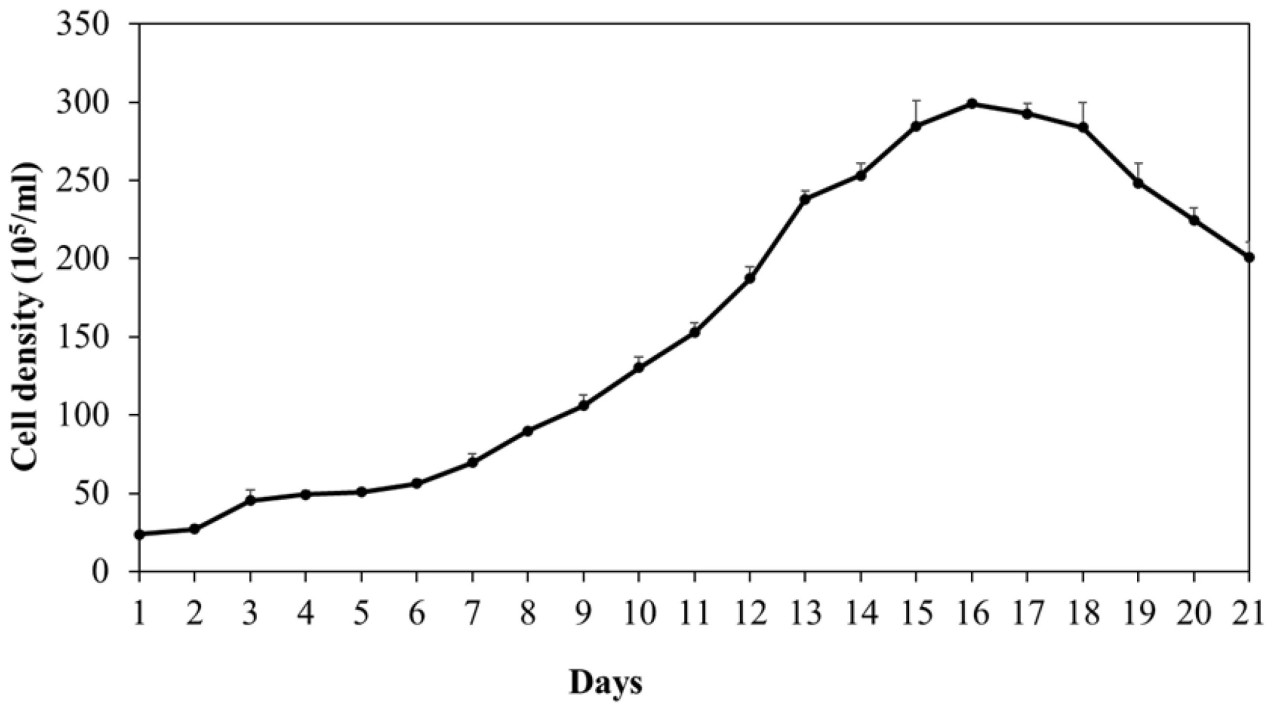
Кривая роста (выраженная в количестве клеток) A. cylindrica после 21 дня культивирования представлена на Рисунке 2. Экспоненциальная фаза роста продлилась с 6 по 16 день, при этом штамм достиг конца стационарной фазы после 18 дней роста. В субоптимальных лабораторных условиях рост A. cylindrica показал высокую конечную плотность клеток (≈300 × 10⁵ клеток/мл) и высокую удельную скорость роста (μ = 0,2/день).
Рисунок 2. Кривая роста Anabaena cylindrica на среде Z8, выраженная в плотности клеток (клетки × 10⁵/мл). Значения являются средними из трех повторностей ± СО (n = 3).
Характеристика физиологических признаков показывает, что наземный штамм A. cylindrica эффективно фиксирует атмосферный N₂, синтезирует ЭПС (42,73 ± 1,40 мг/г СВ), продуцирует фитогормон ИУК (12,74 ± 0,46 мкг/мл) и солюбилизирует трехосновной фосфат кальция (Таблица 1).
Таблица 1. Параметры роста и физиологические характеристики наземного штамма A. cylindrica.
3.2. Биохимические параметры обработок A. cylindrica
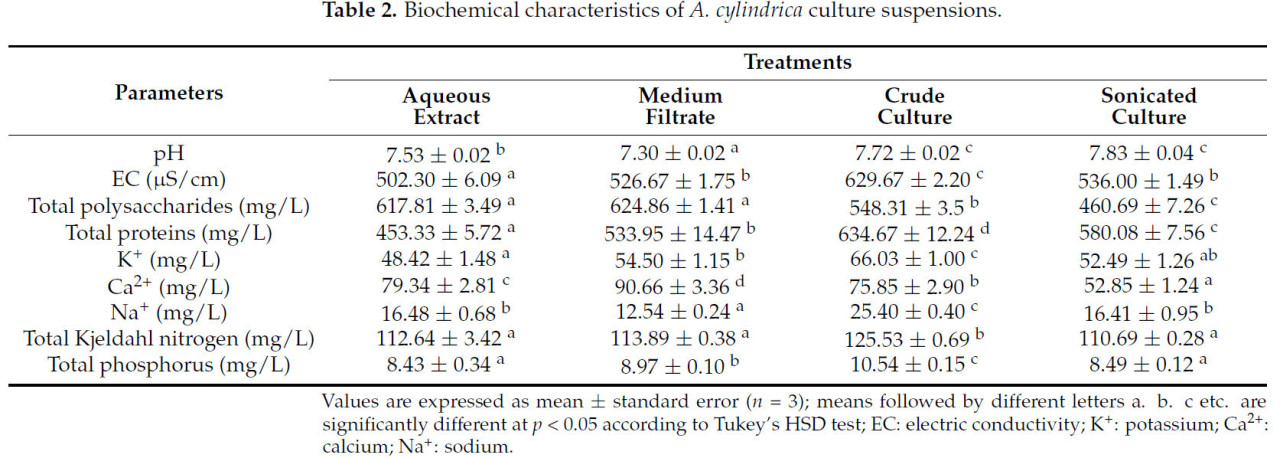
Результаты показали значительные различия (p < 0,05) в составе различных цианобактериальных обработок (Таблица 2). pH экстракта и фильтрата был нейтральным, в то время как в неочищенной и ультразвуковой культурах он был слегка щелочным. Неочищенная культура показала значительно более высокую проводимость (629,67 ± 2,20 мкСм/см) по сравнению с другими растворами. Наибольшее содержание растворимых сахаров было зарегистрировано в фильтрате (624,86 ± 1,41 мг/л) и водном экстракте (617,81 ± 3,49 мг/л), в то время как самое низкое содержание было измерено в ультразвуковой культуре. Наибольшее содержание белка (634,67 ± 12,24 мг/л), общего N (125,53 ± 0,69 мг/л), общего P (10,54 ± 0,15 мг/л), K⁺ (66,03 ± 1,00 мг/л) и Na⁺ (25,40 ± 0,40 мг/л) было зарегистрировано в неочищенной культуре, в то время как водный экстракт имел самое низкое содержание общего белка и NPK. Наибольшее содержание Ca²⁺ (90,66 ± 3,36 мг/л) было зарегистрировано в фильтрате.
Таблица 2. Биохимические характеристики суспензий культуры A. cylindrica.
3.3. Влияние суспензий A. cylindrica на рост пшеницы
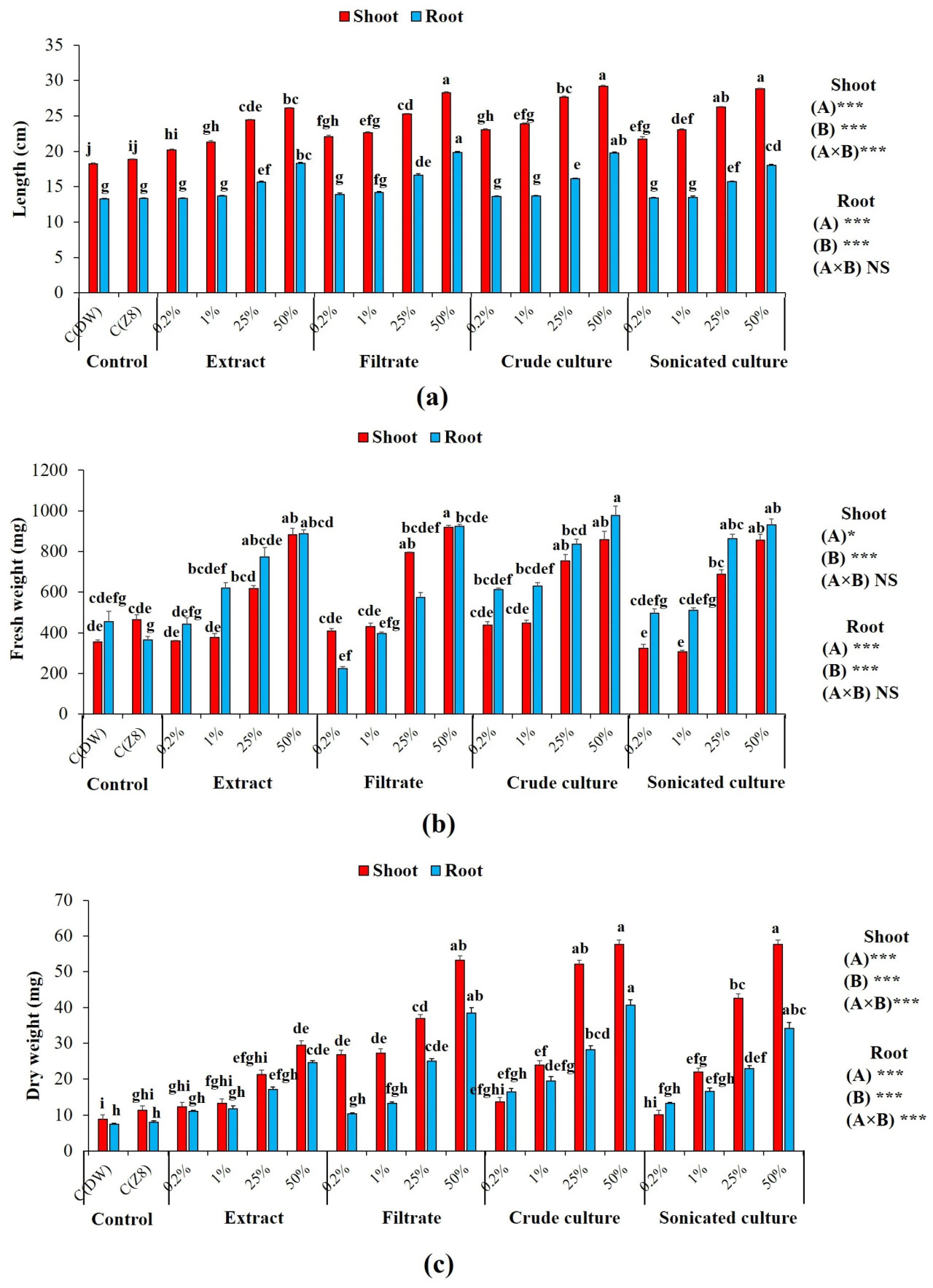
Двухфакторный дисперсионный анализ показал, что все суспензии A. cylindrica значительно (p < 0,05) улучшили все параметры роста растений пшеницы по сравнению с неинокулированными растениями (контроли). Рисунок 3 показывает, что самые высокие концентрации (25% и 50%) всех цианобактериальных обработок вызвали наибольшее увеличение биометрических параметров растений, в то время как самые низкие концентрации (0,2% и 1%) не показали значительных различий по сравнению с контролями. Однако наибольшее улучшение параметров роста пшеницы, особенно длины и веса побега, было зарегистрировано в почве, обработанной неочищенной культурой, ультразвуковой культурой и фильтратом. Наибольшее увеличение было получено при применении неочищенной культуры в концентрации 50%. Например, наблюдались значительные увеличения на 402,72% и 406,49% в сухом весе корней и побегов соответственно. Наименьшее увеличение было достигнуто при инокуляции цианобактериальным экстрактом. Двухфакторный дисперсионный анализ указал на высоко значимый эффект (p < 0,001) цианобактериальных обработок, особенно в применяемых дозах, на длину побега, сухой вес побега и корня по сравнению с контролями.
Рисунок 3. Параметры роста пшеницы при различных обработках суспензиями A. cylindrica при различных концентрациях: (a) длина корня и побега; (b) сырой вес; и (c) сухой вес; значения выражены как среднее ± стандартная ошибка, (n = 6). Строчные буквы указывают на значимые различия (p < 0,05) по тесту Тьюки HSD. НЗ: различия не значимы. Значимая разница при p < 0,05; высоко значимая разница при p < 0,001 с использованием двухфакторного дисперсионного анализа и теста Тьюки. (A) Тип обработки; (B) концентрация; C(ДВ): контроль дистиллированной воды; C(Z8) контроль среды Z8.
3.4. Влияние суспензий A. cylindrica на биохимические параметры пшеницы
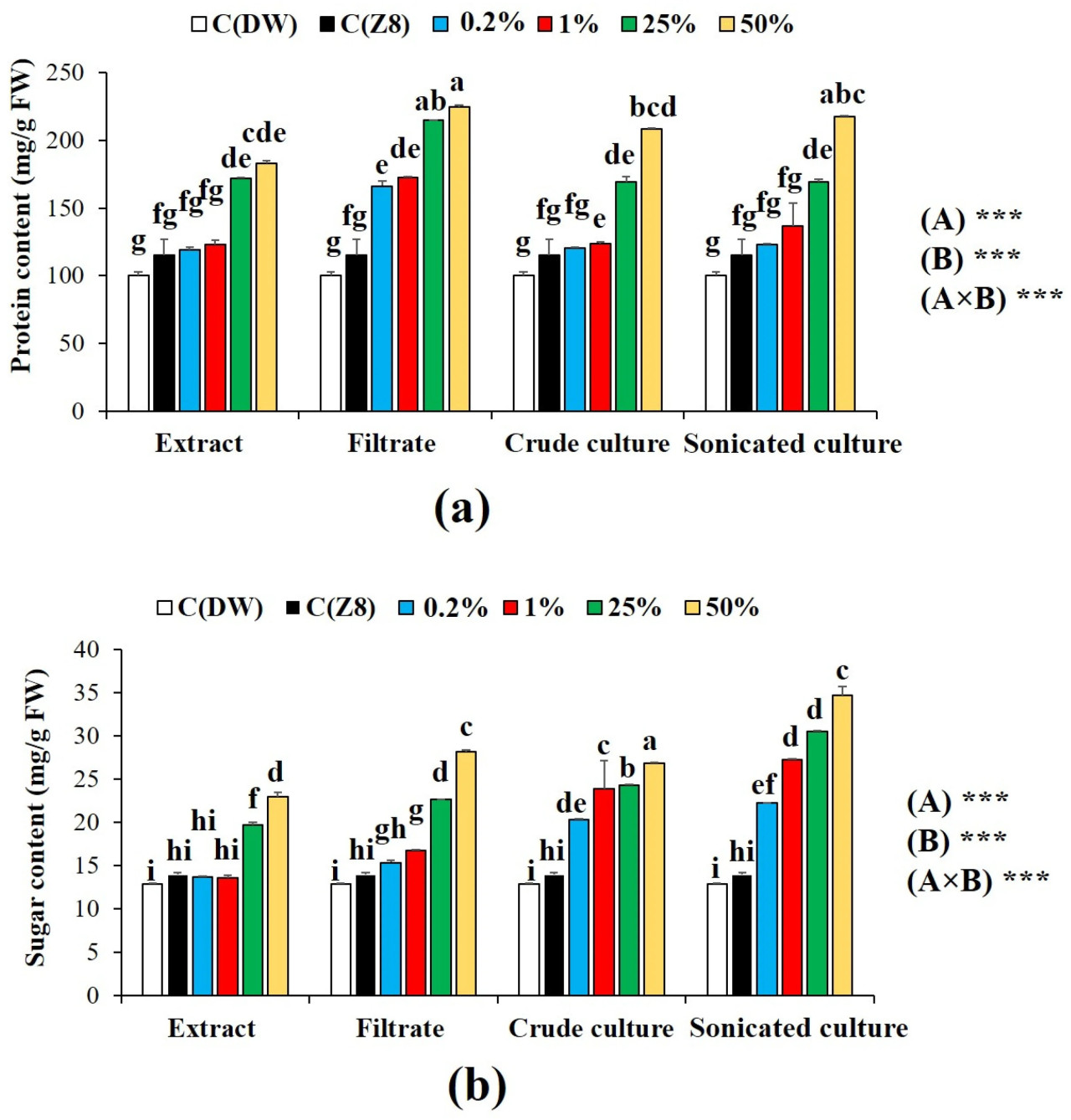
Данные, представленные на Рисунке 4, показали, что применение всех обработок A. cylindrica в самых высоких дозах (25 и 50%) значительно (p < 0,05) увеличило содержание белка и общих растворимых сахаров у растений пшеницы по сравнению с контролями. Наибольшее увеличение белков (224,47 ± 1,50 мг/г СВ) и общих сахаров (34,70 ± 1,00 мг/г СВ) было зарегистрировано при обработках фильтратом и ультразвуковой культурой при 50%. Двухфакторный дисперсионный анализ данных указал на значимый эффект (p < 0,05) как цианобактериальных обработок, так и концентрации на содержание белка и сахара в растениях пшеницы.
Рисунок 4. Биохимические параметры пшеницы при различных обработках суспензиями A. cylindrica при различных концентрациях: (a) белок; и (b) общий сахар. Значения выражены как среднее ± стандартная ошибка, (n = 3). Строчные буквы указывают на значимые различия (p < 0,05) по тесту Тьюки HSD. высоко значимая разница при p < 0,001 с использованием двухфакторного дисперсионного анализа и теста Тьюки. (A) Тип обработки; (B) концентрация; C(ДВ): контроль дистиллированной воды; C(Z8) контроль среды Z8.
3.5. Влияние суспензий A. cylindrica на физиологические свойства пшеницы
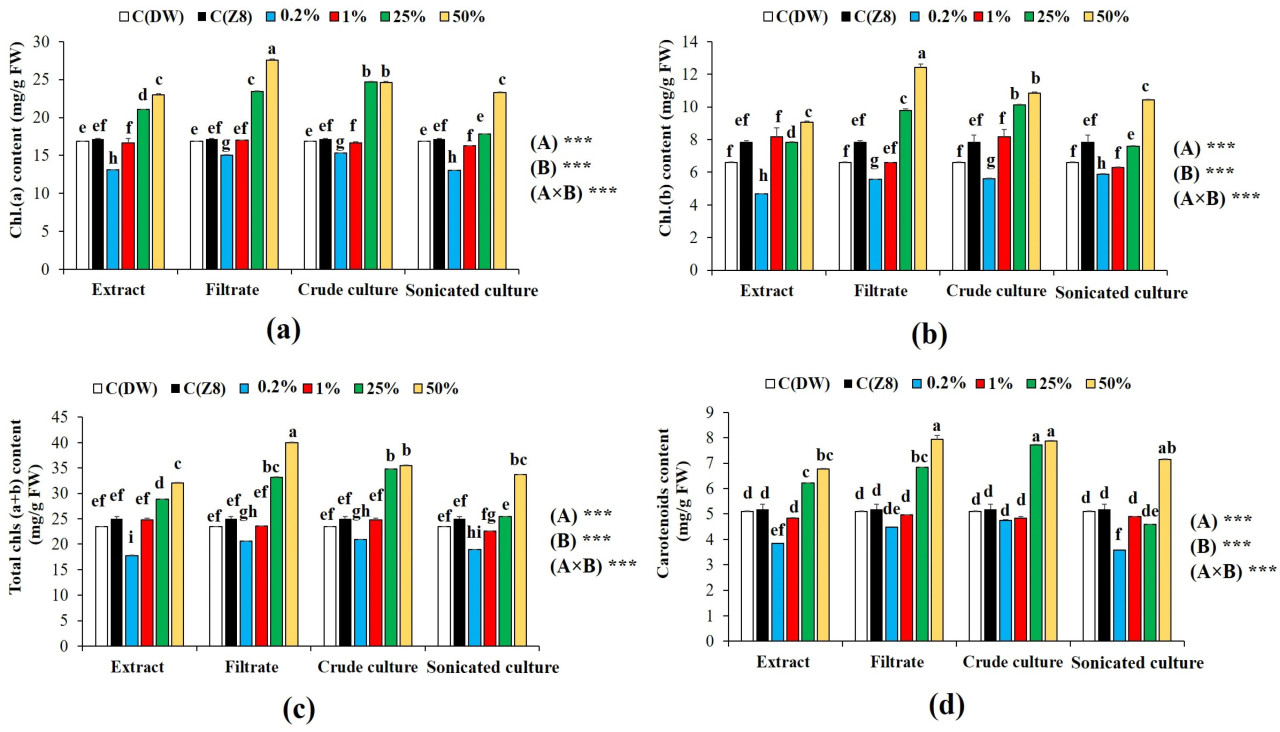
Результаты, представленные на Рисунке 5, показали, что обработки A. cylindrica при 25% и 50% значительно (p < 0,05) увеличили содержание хлорофилла и каротиноидов по сравнению с необработанными растениями. Наибольшее увеличение хлорофилла a (27,52 ± 0,21 мг/г СВ), хлорофилла b (12,42 ± 0,22 мг/г СВ) и общего хлорофилла (39,94 ± 0,13 мг/г СВ) наблюдалось при применении фильтрата среды A. cylindrica при 50%. Эта обработка также привела к наибольшему увеличению содержания каротиноидов (7,94 ± 0,16 мг/г СВ) по сравнению с другими обработками. Более того, двухфакторный дисперсионный анализ выявил значимый эффект (p < 0,05) как цианобактериальных обработок, так и концентраций на содержание фотосинтетических пигментов у растений пшеницы.
Рисунок 5. Содержание фотосинтетических пигментов в растениях пшеницы при различных обработках A. cylindrica при различных концентрациях: (a) Хлорофилл a (Хл.(a)); (b) Хлорофилл b (Хл.(b)); (c) общий хлорофилл (Общие хл. (a+b)); и (d) каротиноиды в побегах растений пшеницы после обработки A. cylindrica при разных концентрациях. СВ: сырой вес; C(ДВ): контроль дистиллированной воды; C(Z8): контроль среды Z8. Значения выражены как среднее ± стандартная ошибка, (n = 3). Строчные буквы указывают на значимые различия (p < 0,05) по тесту Тьюки HSD. высоко значимая разница при p < 0,001 с использованием двухфакторного дисперсионного анализа и теста Тьюки. (A) Тип обработки; (B) концентрация; C(ДВ): контроль дистиллированной воды; C(Z8) контроль среды Z8.
3.6. Влияние суспензий A. cylindrica на содержание минеральных элементов в пшенице
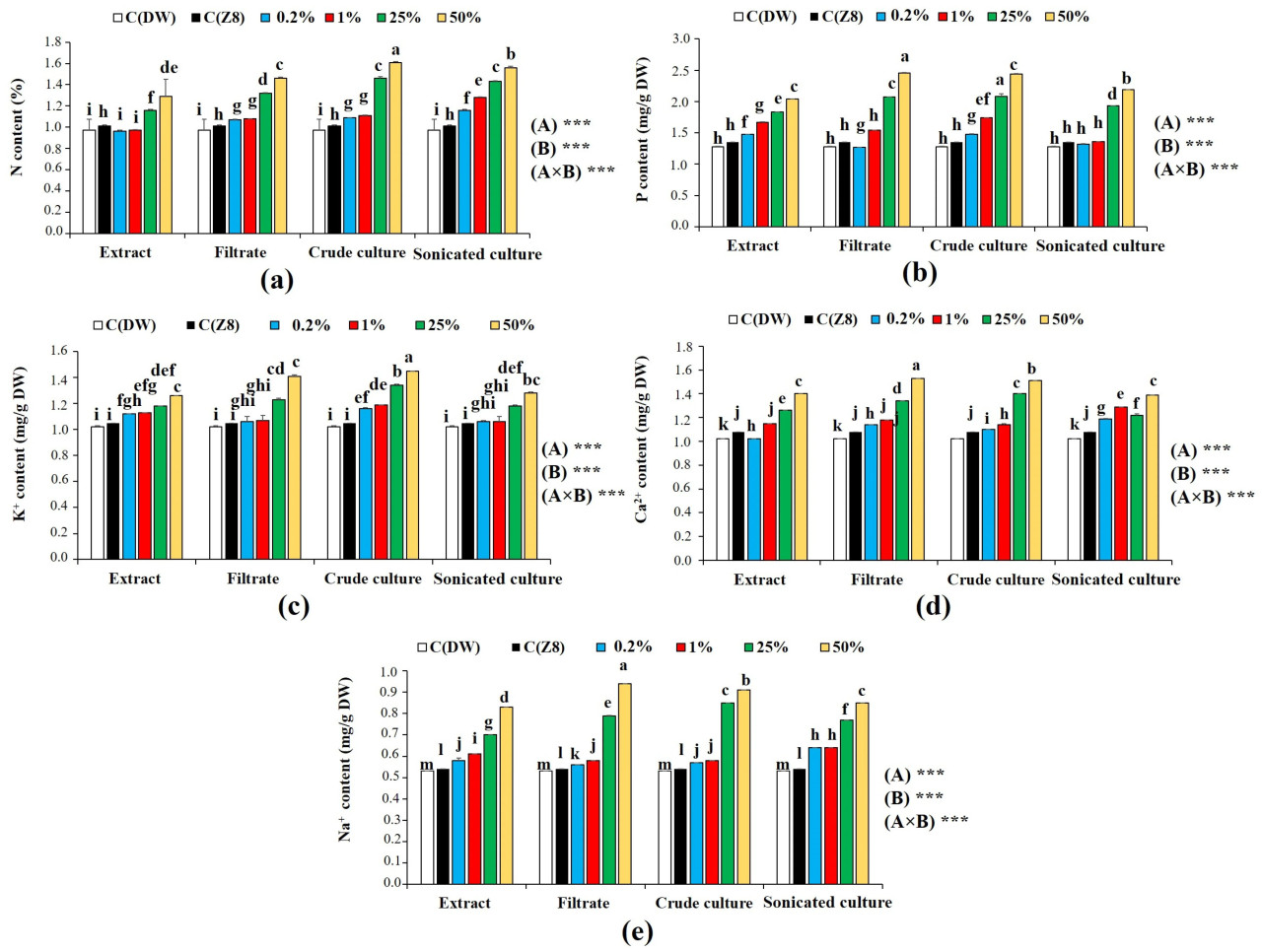
Данные, представленные на Рисунке 6, показали, что все цианобактериальные обработки при самых высоких концентрациях (25% и 50%) значительно (p < 0,05) увеличили содержание P, N, K, Na и Ca в пшенице относительно необработанных растений (контроли). Наибольшие увеличения P (2,46 ± 0,00 г/кг СВ), Na⁺ (0,94 ± 0,00 г/кг СВ) и Ca²⁺ (1,53 ± 0,00 г/кг СВ) были измерены в растениях, инокулированных фильтратом A. cylindrica при 50%. В то время как максимальные значения по N (1,61 ± 0,01 г/кг СВ) и K⁺ (1,45 ± 0,00 г/кг СВ) были зарегистрированы в растениях, инокулированных неочищенной культурой при 50%, с темпами увеличения 59,41% и 38,10% соответственно. Двухфакторный дисперсионный анализ показал высоко значимый эффект (p < 0,001) типа обработки и концентрации на содержание минеральных элементов.
Рисунок 6. Содержание макро- и микроэлементов в побегах растений пшеницы при различных обработках A. cylindrica при различных концентрациях. (a) Азот (N); (b) фосфор (P); (c) калий (K⁺); (d) кальций (Ca²⁺); и (e) натрий (Na⁺) в побегах растений пшеницы после обработки A. cylindrica при разных концентрациях. Значения выражены как среднее ± стандартная ошибка, (n = 3). Строчные буквы указывают на значимые различия (p < 0,05) по тесту Тьюки HSD. высоко значимая разница при p < 0,001 с использованием двухфакторного дисперсионного анализа и теста Тьюки. (A) Тип обработки; (B) концентрация; C(ДВ): контроль дистиллированной воды; C(Z8) контроль среды Z8; СВ: сухой вес.
3.7. Влияние суспензий A. cylindrica на плодородие почвы
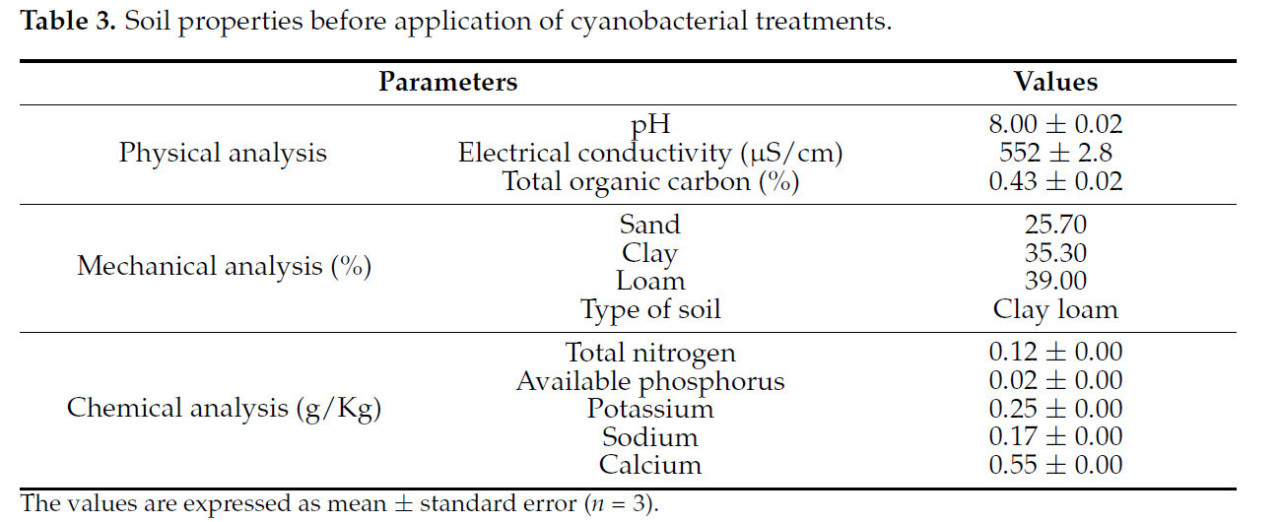
Механические и физико-химические свойства почвы были определены перед экспериментом и представлены в Таблице 3. Состав почвы по глине (35,3%), суглинку (39%) и песку (25,7%) подтвердил, что класс текстуры почвы является суглинисто-глинистым согласно треугольнику текстуры USDA. pH почвы был слегка щелочным, а проводимость умеренной (552 мкСм/см). Дополнительно, низкое содержание общего органического углерода (ООУ 0,43%) подтвердило, что почва бедна питательными веществами. Содержание доступного P и общего N также было низким (0,02 ± 0,00 и 0,12 ± 0,00 г/кг соответственно). Что касается макроэлементов, почва содержала низкое содержание K⁺ (0,25 ± 0,00 г/кг), Na⁺ (0,17 ± 0,00 г/кг) и Ca²⁺ (0,55 ± 0,00 г/кг).
Таблица 3. Свойства почвы до применения цианобактериальных обработок.
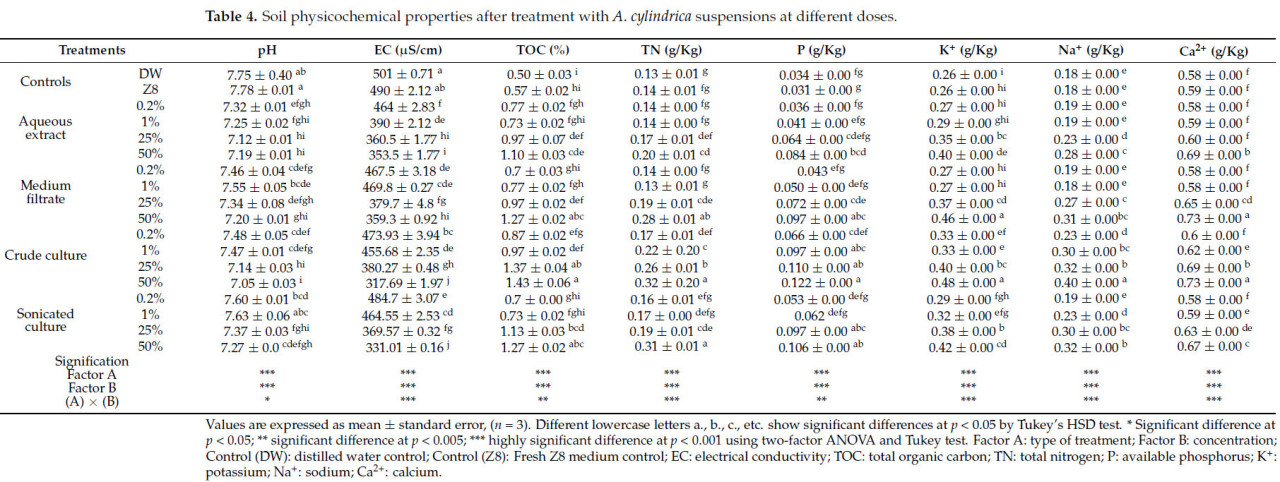
Данные о физико-химических свойствах почвы после применения цианобактериальных обработок представлены в Таблице 4. Дисперсионный анализ показал, что применение обработок A. cylindrica значительно (p < 0,05) улучшило плодородие почвы по сравнению с необработанными почвами (отрицательные контроли ДВ и Z8). Инокуляция почвы при разных концентрациях слегка снизила pH и проводимость, одновременно увеличив содержание ООУ относительно контрольных почв. Наибольшие увеличения наблюдались при применении 50% неочищенной культуры. Результаты дисперсионного анализа показали, что все обработки значительно увеличили (p < 0,05) доступность микро- и макронутриентов почвы (N, P, K, Na и Ca) по сравнению с контролями. Наибольшее содержание N (0,32 ± 0,20 г/кг), P (0,122 ± 0,00 г/кг), K⁺ (0,48 ± 0,00 г/кг), Na⁺ (0,40 ± 0,00 г/кг) и Ca²⁺ (0,73 ± 0,00 г/кг) было зарегистрировано в почве, инокулированной неочищенной культурой A. cylindrica при 50%, что представляет увеличение на 128,57%, 293,54%, 84%, 112,22% и 23,73% соответственно. Двухфакторный дисперсионный анализ показал высоко значимый эффект (p < 0,001) обработки и зависимый от дозы эффект на различные физико-химические параметры почвы (Таблица 4).
Таблица 4. Физико-химические свойства почвы после обработки суспензиями A. cylindrica при разных дозах.
3.8. Анализ главных компонент (PCA)
Анализ главных компонент (PCA) показал, что цианобактериальные обработки (синим цветом) и измеряемые переменные (красным цветом) коррелировали со степенью изменчивости по F1: 76,91% для роста пшеницы, биохимических параметров и 83,29% для питательных свойств (Рисунок 7). Анализ PCA выявил, что измеряемые параметры роста растений и биохимические параметры находились под влиянием различных обработок A. cylindrica.
Рисунок 7. Анализ главных компонент (PCA) для: (a) параметров роста и биохимических параметров пшеницы, (b) питательных свойств при различных цианобактериальных обработках. C(Z8): контроль среды Z8; C(ДВ): контроль дистиллированной воды; E0,2%: экстракт A. cylindrica при концентрации 0,2%; E1%: экстракт A. cylindrica при 1%; E25%: экстракт A. cylindrica при 25%; E50%: экстракт A. cylindrica при 50%; F0,2%: фильтрат A. cylindrica 0,2%; F1%: фильтрат A. cylindrica 1%; F25%: фильтрат A. cylindrica 25%; F50%: фильтрат A. cylindrica 50%; CC0,2%: неочищенная культура A. cylindrica при концентрации 0,2%; CC1%: неочищенная культура A. cylindrica при 1%; CC25%: неочищенная культура A. cylindrica при 25%; CC50%: неочищенная культура A. cylindrica при 50%; SC0,2%: ультразвуковая культура A. cylindrica при концентрации 0,2%; SC 1%: ультразвуковая культура A. cylindrica при 1%; SC 25%: ультразвуковая культура A. cylindrica при 25%; SC 50%: ультразвуковая культура A. cylindrica при 50%. Переменные роста: питания: и физико-химические представлены красным цветом. 10 обработок даны синим цветом. ВВП: влажный вес побега; ВВК: влажный вес корня; СВК: сухой вес корня; СВП: сухой вес побега; ДП: длина побега; ДК: длина корня; ЧЛ: число листьев; Сах: сахар; Бел: белок; Хл a: хлорофилл a; Хл b: хлорофилл b; Хл (a+b); общий хлорофилл (a+b); Кар: каротиноиды; N: азот; P: доступный фосфор; Na⁺: натрий; K⁺: калий; Ca²⁺: кальций; ЕС: электропроводность; ООУ: общий органический углерод.
Анализ PCA параметров роста и питания пшеницы указал на то, что лучшее вегетативное развитие и питательный статус (расположенные справа) коррелировали с цианобактериальными обработками при высоких концентрациях (25% и 50%) (Рисунок 7а). Напротив, самые низкие показатели роста и содержания питательных веществ (слева внизу) были связаны с контрольными растениями, обработанными дистиллированной водой (CДВ) или средой Z8 (CZ8). В то же время средние показатели роста и содержания питательных веществ (расположенные слева внизу) коррелировали с обработками при низких концентрациях (0,2% и 1%) (Рисунок 7а).
Что касается физико-химических свойств, цианобактериальные обработки при высоких концентрациях (25% и 50%) значительно улучшили плодородие почвы, а также питание растений пшеницы (Рисунок 7б). Напротив, обработки при низких концентрациях (0,2% и 1%) показали меньшее улучшение. Неинокулированные растения показали более низкую корреляцию с физико-химическими параметрами (Рисунок 7б).
4. Обсуждение
Наземный штамм A. cylindrica, использованный в данном исследовании, продемонстрировал множественные свойства, способствующие росту растений (PGP), включая фиксацию азота, солюбилизацию фосфата и продукцию ауксинов и экзополисахаридов. Эти атрибуты способствуют росту растений, обогащая питательными веществами ризосферу и обеспечивая необходимыми минеральными элементами, такими как фосфор, калий и кальций. Более того, штамм A. cylindrica проявил быструю скорость роста, достигая высокой плотности клеток и биомассы, что делает его пригодным для масштабируемого производства. В оптимальных условиях роста удельная скорость роста может приближаться к максимальной скорости роста (0,5 > μmax > 1), что согласуется с результатами для других штаммов цианобактерий [45]. Со своими разнообразными признаками PGP, эффективной производственной способностью и адаптивностью к почвенным условиям, A. cylindrica становится перспективным биоинокулянтом для улучшения роста растений и продвижения устойчивых сельскохозяйственных практик [8,11].
Сравнительный анализ результатов вегетационного эксперимента показал, что все обработки A. cylindrica значительно улучшили параметры роста пшеницы по сравнению с контролями (дистиллированная вода или свежая культуральная среда). Инокуляция почвы цианобактериальными обработками значительно увеличила длину корня и побега, сырой и сухой вес, а также биомассу корней и надземной части растений пшеницы. Наиболее существенные улучшения наблюдались при обработках неочищенной культурой и фильтратом, в то время как обработка экстрактом дала наименьшее увеличение. Наши результаты подтверждают гипотезу о том, что фильтрат культуральной среды, содержащий внеклеточные биоактивные вещества, эффективно усиливает рост пшеницы по сравнению с контролем свежей среды. Интересно, что этот результат противоречит другим работам [8], которые предполагают, что фильтраты цианобактерий могут индуцировать стрессовые факторы, ингибирующие рост пшеницы. Анализ данных выявил явный зависимый от концентрации эффект через все цианобактериальные суспензии, причем самые высокие дозы (25% и 50%) давали наилучшие улучшения роста пшеницы. Хотя потенциал цианобактерий стимулировать рост пшеницы в контролируемых условиях был ранее показан [8,46], очень несколько исследований изучили влияние местной почвенной A. cylindrica на рост злаков в природных минеральных почвах.
В работе [47] показано, что инокуляция почвы живыми клетками Anabaena oryzae значительно увеличила параметры роста пшеницы. Аналогично, несколько исследований показали, что инокуляция почвы свежей биомассой азотфиксирующих цианобактерий улучшает доступность питательных веществ, способствуя их эффективному поглощению и стимулируя рост пшеницы [8,18,48]. Полученное увеличение биомассы было приписано био-стимуляторным метаболитам, естественно продуцируемым цианобактериями [49], наряду с их способностью фиксировать атмосферный азот N₂, внося до 20–25 кг/га [50]. Этот фиксированный азот может быть доставлен непосредственно в ткани пшеницы, значительно улучшая рост, как показано на других культурах, таких как томат, рис, желтофиоль, виноград и кукуруза [20,51,52,53]. Улучшенный рост пшеницы также может быть приписан способности цианобактерий синтезировать ЭПС [54], которые улучшают структуру почвы и доступность питательных веществ, и их способности преобразовывать сложные питательные вещества в формы, доступные для растений [50]. Дополнительно, желеобразная структура цианобактерий улучшает удержание воды в почве, что дополнительно способствует росту растений [55].
Штамм A. cylindrica, протестированный в нашем вегетационном эксперименте, продемонстрировал метаболическую активность, указывающую на мощный штамм, способствующий росту растений. Эта местная почвенная цианобактерия проявила замечательные способности в солюбилизации фосфата (P) и фиксации атмосферного азота N₂. И N, и P являются критическими питательными веществами для роста растений, и многочисленные исследования установили, что инокуляция почвы азотфиксирующими и фосфат-солюбилизирующими цианобактериями улучшает рост растений, увеличивая доступность этих необходимых питательных веществ [17,56,57,58]. Дополнительно, штамм A. cylindrica продуцирует ЭПС, которые не только солюбилизируют фосфат, но и поддерживают водную пленку, которая поддерживает фотосинтетическую активность [59]. Более того, его способность синтезировать фитогормоны, такие как индол-3-уксусная кислота (ИУК), играет ключевую роль в регуляции роста и архитектуры корней [60]. Наблюдаемая стимуляция роста пшеницы также может быть приписана биохимическим соединениям и экссудатам, присутствующим в неочищенной культуре и фильтрате среды A. cylindrica. Например, растворимые сахара действуют как сигнальные молекулы и субстраты для промежуточного метаболизма, тем самым способствуя росту и развитию растений [49]. Действительно, количественный биохимический анализ показал, что обработки A. cylindrica, особенно неочищенная культура и фильтрат среды, богаты микро- и макронутриентами (N, P, K, Na и Ca), а также растворимыми сахарами и белками. Эти питательные вещества и биоактивные соединения улучшают клеточный метаболизм пшеницы, приводя к улучшению роста растений [18]. В этой связи, в работе [61] сообщалось, что питательные вещества, полученные из цианобактерий, биоактивные соединения, активность нитрогеназы и фитогормоны значительно стимулируют рост растений риса.
С другой стороны, результаты показали, что обработки A. cylindrica значительно улучшили биохимические параметры пшеницы, включая содержание растворимых сахаров и белков, по сравнению с контрольными растениями. Самые высокие содержания были получены при применении неочищенной культуры в концентрации 50%. Эти результаты согласуются с предыдущими исследованиями, показывающими, что совместное культивирование растений с цианобактериями улучшает рост растений и биохимические параметры, такие как общие сахара и белки, как в контролируемых условиях, так и в полевых испытаниях [62,63,64]. Увеличение содержания растворимых сахаров в растениях пшеницы может быть приписано повышенной скорости транспорта электронов фотосинтеза [65] и стимуляции биосинтеза пигментов [66,67]. Дополнительно, улучшенное содержание сахара может быть связано с повышенной эффективностью фиксации CO₂ [68]. Аналогично, в работе [64] утверждается, что увеличение содержания сахара в растениях гороха было результатом активности способствующих росту цианобактерий, которые усиливали активацию фотосинтетической системы растений. Улучшение содержания белка в растениях может происходить из-за активности цианобактериальной нитрогеназы, нитрогеназной редуктазы и продукции аминокислот или пептидов живыми клетками цианобактерий. Эти механизмы способствуют ассимиляции азота и синтезу белка, тем самым способствуя росту и развитию растений [53,62].
Применение обработок A. cylindrica положительно повлияло на фотосинтетические пигменты пшеницы, включая хлорофилл и каротиноиды. Эти результаты согласуются с результатами [69], которые сообщили, что инокуляция цианобактериями увеличила содержание хлорофилла и каротиноидов в растениях фасоли. Эти данные также согласуются с [70], которые показали, что культура цианобактерий содержит смесь биоактивных соединений, включая регуляторы роста растений (PGRs), которые могут уменьшать старение и транспирацию и увеличивать содержание хлорофилла в листьях. Наблюдаемое увеличение содержания пигментов может быть связано с поглощением большего количества питательных веществ из почвы, а также с синергетическим эффектом веществ, способствующих росту цианобактерий [71]. Дополнительно, значительное количество азота, фиксированного A. cylindrica и впоследствии ассимилированного тканями растений, вероятно, способствовало этому улучшению [46]. Как уже упоминалось, A. cylindrica способна продуцировать ИУК, фитогормон, известный индуцировать биосинтез пигментов и усиливать фотосинтетическую активность появляющихся проростков [62].
Результаты показали значительное улучшение содержания микро- и макронутриентов в пшенице (N, P, K, Na и Ca) после применения цианобактериальных обработок по сравнению с необработанными растениями. Наиболее заметные увеличения основных элементов наблюдались при инокуляции почвы фильтратом и неочищенной культурой A. cylindrica при концентрации 50%, которые внесли до 5,67 мг N/кг, 0,45 мг P/кг и 2,73 мг K/кг для фильтрата и 6,28 мг N/кг, 0,53 мг P/кг и 3,30 мг K/кг для неочищенной культуры. Эти результаты согласуются с результатами, полученными [72], которые выявили, что применение живой биомассы Nostoc kihlmani и Anabaena cylindrica улучшило рост и содержание N, P и K у растений пшеницы. Это исследование заключило, что наблюдаемые увеличения содержания NPK отражают улучшения в содержании азота в почве после инокуляции Nostoc kihlmani и Anabaena cylindrica, которые способствовали поглощению азота и улучшали рост растений. Увеличенное содержание азота в инокулированных растениях, вероятно, является результатом поглощения атмосферного азота, фиксированного интактными клетками цианобактерий, и его переноса в ткани растений [46]. Дополнительно, увеличение содержания фосфора в растениях пшеницы при цианобактериальных обработках может быть частично приписано продукции органических кислот цианобактериями. Эти кислоты снижают pH почвы, способствуя преобразованию недоступного фосфора в формы, доступные для растений [64,69].
В целом, как неочищенная культура, так и фильтрат среды A. cylindrica при высокой концентрации 50% значительно улучшили рост и питательный статус пшеницы. Эти результаты аналогичны результатам нашего предыдущего исследования на зеленой почвенной микроводоросли Chlorella vulgaris, которое показало, что неочищенная культура и фильтрат были наиболее эффективными обработками для улучшения показателей роста пшеницы, питательных веществ растений и минеральных элементов [16]. Наши результаты подчеркнули благотворную роль обработок A. cylindrica и C. vulgaris на параметры роста пшеницы в дополнение к их улучшению минеральных и биохимических свойств сельскохозяйственных культур, как показано в предыдущих исследованиях [3,12].
С другой стороны, результаты показали, что физико-химические и питательные свойства почвы значительно улучшились после обработок цианобактериальными препаратами. Действительно, A. cylindrica является гетероцистной цианобактерией, способной фиксировать атмосферный N₂, что может увеличивать содержание N в почве. Несколько штаммов цианобактерий, таких как Nostoc sp. и Anabaena sp., были выявлены как важные поставщики азота в почву через их атмосферную фиксацию [19,57,58,72,73]. Дополнительно, штамм A. cylindrica может продуцировать ЭПС, которые, вероятно, улучшают питание, структуру и стабильность почвы. Наши результаты выявили, что обработки A. cylindrica значительно увеличили N, P, C, K, Na и Ca в инокулированных почвах. Эти результаты согласуются с предыдущими исследованиями, сообщающими, что инокуляция почвы цианобактериями повышает биологическую активность и, следовательно, улучшает плодородие почвы [56,58,72].
Наблюдаемые увеличения содержания питательных веществ в почве были в первую очередь приписаны синергетическому росту и метаболической активности цианобактерий в почве [74]. Значительный рост содержания N и P в ризосферной почве, инокулированной цианобактериями, вероятно, связан с фиксацией N₂ и мобилизацией нерастворимых неорганических соединений P в растворимые формы, как показано в [57,69]. Увеличение органического углерода в почве может быть связано с фотоавтотрофной активностью цианобактерий, особенно живых клеток в неочищенных культурах, которые синтезируют и откладывают органические соединения в почву [75]. Недавнее исследование [12] сообщило, что ЭПС, секретируемые многими цианобактериями, обеспечивают органический углерод для роста полезных микроорганизмов, способствуя образованию биопленок в ризосфере. Дополнительно, применение обработок A. cylindrica снизило pH и проводимость почвы. Эти результаты подтверждают полученные [76], которые отметили, что цианобактерии выделяют внеклеточные вещества, такие как полисахариды, липиды, органические кислоты и пептиды, которые способствуют снижению pH почвы. Более того, эти результаты согласуются с результатами [77], которые наблюдали снижение проводимости почвы после применения цианобактерий. Это снижение может быть связано с определенными регуляторами роста растений (PGRs), высвобождаемыми цианобактериями, которые действуют как защитные механизмы против солевого стресса, тем самым смягчая засоление почвы [70].
5. Выводы
Результаты подчеркнули, что почвенный полив четырьмя суспензиями A. cylindrica (водный экстракт, фильтрат среды, неочищенная и ультразвуковая культура) значительно улучшил рост пшеницы, улучшил питательный статус растений и увеличил плодородие почвы. Среди протестированных цианобактериальных препаратов инокуляция почвы фильтратом среды и неочищенной культурой были наиболее эффективными обработками. Результаты показали зависимые от концентрации эффекты, причем доза 50% суспензий A. cylindrica давала наиболее заметные улучшения в росте пшеницы, содержании питательных веществ и плодородии почвы. Эти результаты свидетельствуют, что применение неочищенной культуры A. cylindrica в качестве биоудобрения значительно улучшило рост растений пшеницы и питательную ценность почвы и может быть полезно в качестве дополнения к традиционным удобрениям. Дополнительные исследования необходимы для понимания метаболомного профиля почвенных цианобактерий, механизмов, вовлеченных в рост растений и плодородие почвы, и эффекта их длительного применения на качество почвы. Инокуляция почвы другими инновационными цианобактериальными препаратами (например, сухой биомассой, консорциумами и микрокапсулированием) также должна быть протестирована в полевых условиях.
Ссылки
1. Food and Agriculture Organization of the United Nations. Food and Agriculture Organization Alternative Pathways to 2050; Food and Agriculture Organization of the United Nations: Rome, Italy, 2018; Volume 11, ISBN 9788578110796. [Google Scholar]
2. Savadi, S.; Prasad, P.; Kashyap, P.L.; Bhardwaj, S.C. Molecular Breeding Technologies and Strategies for Rust Resistance in Wheat (Triticum aestivum) for Sustained Food Security. Plant Pathol. 2018, 67, 771–791. [Google Scholar] [CrossRef]
3. Dineshkumar, R.; Subramanian, J.; Sampathkumar, P. Prospective of Chlorella vulgaris to Augment Growth and Yield Parameters Along with Superior Seed Qualities in Black Gram, Vigna mungo (L.). Waste Biomass Valorization 2020, 11, 1279–1287. [Google Scholar] [CrossRef]
4. Meemken, E.M.; Qaim, M. Organic Agriculture, Food Security, and the Environment. Annu. Rev. Resour. Econ. 2018, 10, 39–63. [Google Scholar] [CrossRef]
5. Drobek, M.; Frąc, M.; Cybulska, J. Plant Biostimulants: Importance of the Quality and Yield of Horticultural Crops and the Improvement of Plant Tolerance to Abiotic Stress-a Review. Agronomy 2019, 9, 335. [Google Scholar] [CrossRef]
6. Bulgari, R.; Franzoni, G.; Ferrante, A. Biostimulants Application in Horticultural Crops under Abiotic Stress Conditions. Agronomy 2019, 9, 306. [Google Scholar] [CrossRef]
7. Raimi, A.; Roopnarain, A.; Adeleke, R. Biofertilizer Production in Africa: Current Status, Factors Impeding Adoption and Strategies for Success. Sci. Afr. 2021, 11, e00694. [Google Scholar] [CrossRef]
8. Kholssi, R.; Marks, E.A.N.; Miñón, J.; Montero, O.; Lorentz, J.F.; Debdoubi, A.; Rad, C. Biofertilizing Effects of Anabaena cylindrica Biomass on the Growth and Nitrogen Uptake of Wheat. Commun. Soil Sci. Plant Anal. 2022, 53, 1216–1225. [Google Scholar] [CrossRef]
9. Massey, M.S.; Davis, J.G. Beyond Soil Inoculation: Cyanobacteria as a Fertilizer Replacement. Nitrogen 2023, 4, 253–262. [Google Scholar] [CrossRef]
10. Bibi, S.; Saadaoui, I.; Bibi, A.; Al-Ghouti, M.; Abu-Dieyeh, M.H. Applications, Advancements, and Challenges of Cyanobacteria-Based Biofertilizers for Sustainable Agro and Ecosystems in Arid Climates. Bioresour. Technol. Rep. 2024, 25, 101789. [Google Scholar] [CrossRef]
11. Alvarez, A.L.; Weyers, S.L.; Gardner, R.D. Cyanobacteria-Based Soil Amendments in the Soil-Plant System: Effects of Inoculations on Soil Nutrient and Microbial Dynamics under Spring Wheat Growth. Algal Res. 2024, 77, 103326. [Google Scholar] [CrossRef]
12. Xiao, R.; Zheng, Y. Overview of Microalgal Extracellular Polymeric Substances (EPS) and Their Applications. Biotechnol. Adv. 2016, 34, 1225–1244. [Google Scholar] [CrossRef] [PubMed]
13. Gonçalves, A.L. The Use of Microalgae and Cyanobacteria in the Improvement of Agricultural Practices: A Review on Their Biofertilising, Biostimulating and Biopesticide Roles. Appl. Sci. 2021, 11, 871. [Google Scholar] [CrossRef]
14. Bao, J.; Zhuo, C.; Zhang, D.; Li, Y.; Hu, F.; Li, H.; Su, Z.; Liang, Y.; He, H. Potential Applicability of a Cyanobacterium as a Biofertilizer and Biopesticide in Rice Fields. Plant Soil 2021, 463, 97–112. [Google Scholar] [CrossRef]
15. Jose, S.; Renuka, N.; Ratha, S.K.; Kumari, S.; Bux, F. Bioprospecting of Microalgae from Agricultural Fields and Developing Consortia for Sustainable Agriculture. Algal Res. 2024, 78, 103428. [Google Scholar] [CrossRef]
16. Minaoui, F.; Hakkoum, Z.; Chabili, A.; Douma, M.; Mouhri, K.; Loudiki, M. Biostimulant Effect of Green Soil Microalgae Chlorella vulgaris Suspensions on Germination and Growth of Wheat (Triticum aestivum Var. Achtar) and Soil Fertility. Algal Res. 2024, 82, 103655. [Google Scholar] [CrossRef]
17. Singh, H.; Khattar, J.S.; Ahluwalia, A.S. Cyanobacteria and Agricultural Crops. Vegetos 2014, 27, 37–44. [Google Scholar] [CrossRef]
18. Múnera-Porras, L.M.; García-Londoño, S.; Ríos-Osorio, L.A. Action Mechanisms of Plant Growth Promoting Cyanobacteria in Crops in Situ: A Systematic Review of Literature. Int. J. Agron. 2020, 2020, 2690410. [Google Scholar] [CrossRef]
19. Renuka, N.; Guldhe, A.; Prasanna, R.; Singh, P.; Bux, F. Microalgae as Multi-Functional Options in Modern Agriculture: Current Trends, Prospects and Challenges. Biotechnol. Adv. 2018, 36, 1255–1273. [Google Scholar] [CrossRef]
20. Kholssi, R.; Marks, E.A.N.; Miñón, J.; Maté, A.P.; Sacristán, G.; Montero, O.; Debdoubi, A.; Rad, C. A Consortium of Cyanobacteria and Plant Growth Promoting Rhizobacteria for Wheat Growth Improvement in a Hydroponic System. S. Afr. J. Bot. 2021, 142, 247–258. [Google Scholar] [CrossRef]
21. Gayathri, M.; Shunmugam, S.; Thajuddin, N.; Muralitharan, G. Phytohormones and Free Volatile Fatty Acids from Cyanobacterial Biomass Wet Extract (BWE) Elicit Plant Growth Promotion. Algal Res. 2017, 26, 56–64. [Google Scholar] [CrossRef]
22. Sneha, G.; Govindsamy, V.; Abraham, G. Identification and Characterization of Desiccation Tolerant Cyanobacteria from Pokhran, India for Their Potential Exploitation as Bio-Inoculants. Microbiology 2024, 93, 954–965. [Google Scholar] [CrossRef]
23. Ronga, D.; Biazzi, E.; Parati, K.; Carminati, D.; Carminati, E.; Tava, A. Microalgal Biostimulants and Biofertilisers in Crop Productions. Agronomy 2019, 9, 192. [Google Scholar] [CrossRef]
24. Chabili, A.; Minaoui, F.; Hakkoum, Z.; Douma, M.; Meddich, A.; Loudiki, M. A Comprehensive Review of Microalgae and Cyanobacteria-Based Biostimulants for Agriculture Uses. Plants 2024, 13, 159. [Google Scholar] [CrossRef] [PubMed]
25. Sneha, G.R.; Govindasamy, V.; Singh, P.K.; Kumar, S.; Abraham, G. Priming of Seeds with Cyanobacteria Improved Tolerance in Wheat (Triticum aestivum L.) during Post-Germinative Drought Stress. J. Appl. Phycol. 2024, 36, 1233–1246. [Google Scholar] [CrossRef]
26. Gupta, S.K.; Chakraborty, A.P. Cyanobacterial Biofertilizer for Sustainable Agriculture and Environment. Int. J. Creat. Res. Thoughts 2020, 8, 2320–2882. [Google Scholar]
27. Joshi, H.; Shourie, A.; Singh, A. Cyanobacteria as a Source of Biofertilizers for Sustainable Agriculture; INC: New Delhi, India, 2020; ISBN 9780128193112. [Google Scholar]
28. Song, X.; Zhang, J.; Li, D.; Peng, C. Nitrogen-Fixing Cyanobacteria Have the Potential to Improve Nitrogen Use Efficiency through the Reduction of Ammonia Volatilization in Red Soil Paddy Fields. Soil Tillage Res. 2022, 217, 105274. [Google Scholar] [CrossRef]
29. Kotai, J. Instructions for Preparation of Modified Nutrient Solution Z8 for Algae. Nor. Inst. Water Res. 1972, 11, 5. [Google Scholar]
30. Mischke, U.; Thackeray, S.; Dunbar, M.; McDonald, C.; Carvalho, L.; de Hoyos, C.; Jarvinen, M.; Laplace-Treyture, C.; Morabito, G.; Skjelbred, B.; et al. WISER Deliverable D3.1-4: Guidance Document on Sampling, Analysis and Counting Standards for Phytoplankton in Lakes; European Commission: Brussels, Belgium, 2012; pp. 1–51. [Google Scholar]
31. Monod, J. The Growth of Bacterial Cultures. Annu. Rev. M 1949, 3, 371–394. [Google Scholar] [CrossRef]
32. Mazhar, S.; Hasnain, S. Screening of Native Plant Growth Promoting Cyanobacteria and Their Impact on Triticum aestivum Var. Uqab 2000 Growth. Afr. J. Agric. Res. 2011, 6, 3988–3993. [Google Scholar]
33. Glickmann, E.; Dessaux, Y. A Critical Examination of the Specificity of the Salkowski Reagent for Indolic Compounds Produced by Phytopathogenic Bacteria. Appl. Environ. Microbiol. 1995, 61, 793–796. [Google Scholar] [CrossRef]
34. Strieth, D.; Stiefelmaier, J.; Wrabl, B.; Schwing, J.; Schmeckebier, A.; Di Nonno, S.; Muffler, K.; Ulber, R. A New Strategy for a Combined Isolation of EPS and Pigments from Cyanobacteria. J. Appl. Phycol. 2020, 32, 1729–1740. [Google Scholar] [CrossRef]
35. Bradford, M.M. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Anal. Biochem. 1976, 72, 248–254. [Google Scholar] [CrossRef]
36. Dubois, M.; Gilles, K.; Hamilton, J.K.; Rebers, P.A.; Smith, F. A Colorimetric Method for the Determination of Sugars. Nature 1956, 168, 167. [Google Scholar] [CrossRef]
37. Pequerul, A.; Pérez, C.; Madero, P.; Val, J.; Monge, E. A Rapid Wet Digestion Method for Plant Analysis. In Optimization of Plant Nutrition; Springer: Dordrecht, The Netherlands, 1993; pp. 3–6. [Google Scholar] [CrossRef]
38. Rodier, J.; Geoffray, C.; Rodi, L. L’analyse de l’eau: Eaux Naturelles, Eaux Résiduaires, Eau de Mer: Chimie, Physico-Chimie, Bactériologie, Biologie; Dunod: Paris, France, 1984. [Google Scholar]
39. Murphy, J.; Riley, J.P. A Modified Single Solution Method for the Determination of Phosphate in Natural Waters. Anal. Chim. Acta 1962, 27, 31–36. [Google Scholar] [CrossRef]
40. Bremner, J.M. Determination of Nitrogen in Soil by the Kjeldahl Method. J. Agric. Sci. 1960, 55, 11–33. [Google Scholar] [CrossRef]
41. Upadhyaya, H.; Shome, S.; Roy, D.; Bhattacharya, M.K. Arsenic Induced Changes in Growth and Physiological Responses in Vigna radiata Seedling: Effect of Curcumin Interaction. Am. J. Plant Sci. 2014, 5, 3609–3618. [Google Scholar] [CrossRef]
42. Aubert, G. Methodes d’Analyses Des Sols: Documents de Travail Tous Droits Reserves; Centre régional de documentation pédagogique: Montpellier, France, 1978. [Google Scholar]
43. Olsen, S.R.; Sommers, L.E. Phosphorus Methods of Soil Analyses, Part 2. Chemical and Microbiological Properties; American Society of Agronomy, Soil Science Society of America: Madison, WI, USA, 1982; ISBN 0891180729. [Google Scholar]
44. Baize, D. Guide Des Analyses Courantes En Pédologie; INRA: Paris, France, 1988. [Google Scholar]
45. Bouarab, L.; Loudiki, M.; Dauta, A. Croissance En Autotrophie et En Mixotrophie de La Microalgue Micractinium Pusillum Fres. Isolée D’un Lagunage Naturel: Influence de La Lumière et de La Température. Rev. Des Sci. L’eau/J. Water Sci. 2002, 15, 73–86. [Google Scholar] [CrossRef]
46. Karthikeyan, N.; Prasanna, R.; Nain, L.; Kaushik, B.D. Evaluating the Potential of Plant Growth Promoting Cyanobacteria as Inoculants for Wheat. Eur. J. Soil Biol. 2007, 43, 23–30. [Google Scholar] [CrossRef]
47. Boghdady, M.S.; Ali, A.S. Comparison between Effect of Azospirillum brasilense and Anabaena oryzae on Growth, Yeld and Anatomical Characters of Wheat Plants. J. Appl. Sci. Res. 2013, 9, 627–637. [Google Scholar]
48. Gantar, M.; Kerby, N.W.; Rowell, P.; Obreht, Z.; Scrimgeour, C. Colonization of Wheat (Triticum vulgare L.) by N2-fixing Cyanobacteria: IV. Dark Nitrogenase Activity and Effects of Cyanobacteria on Natural 15N Abundance in the Plants. New Phytol. 1995, 129, 337–343. [Google Scholar] [CrossRef] [PubMed]
49. Mutale-joan, C.; Redouane, B.; Najib, E.; Yassine, K.; Lyamlouli, K.; Laila, S.; Zeroual, Y.; Hicham, E.A. Screening of Microalgae Liquid Extracts for Their Bio Stimulant Properties on Plant Growth, Nutrient Uptake and Metabolite Profile of Solanum lycopersicum L. Sci. Rep. 2020, 10, 2820. [Google Scholar] [CrossRef] [PubMed]
50. Sahu, D.; Priyadarshani, I.; Rath, B. Cyanobacteria—As Potential Biofertilizer. CIBTech J. Microbiol. Jul. Sept. Oct.-Dec 2012, 1, 20–26. [Google Scholar]
51. Grzesik, M.; Romanowska-Duda, Z. Improvements in Germination, Growth, and Metabolic Activity of Corn Seedlings by Grain Conditioning and Root Application with Cyanobacteria and Microalgae. Pol. J. Environ. Stud. 2014, 23, 1147–1153. [Google Scholar]
52. Grzesik, M.; Romanowska-Duda, Z.; Kalaji, H.M. Effectiveness of Cyanobacteria and Green Algae in Enhancing the Photosynthetic Performance and Growth of Willow (Salix viminalis L.) Plants under Limited Synthetic Fertilizers Application. Photosynthetica 2017, 55, 510–521. [Google Scholar] [CrossRef]
53. Haroun, S.A.; Hussein, M.H. The Promotive Effect of Algal Biofertilizers on Growth, Protein Pattern and Some Metabolic Activities of Lupinus termis Plants Grown in Siliceous Soil. Asian J. Plant Sci. 2003, 2, 944–951. [Google Scholar] [CrossRef]
54. Chamizo, S.; Adessi, A.; Torzillo, G.; De Philippis, R. Exopolysaccharide Features Influence Growth Success in Biocrust-Forming Cyanobacteria, Moving From Liquid Culture to Sand Microcosms. Front. Microbiol. 2020, 11, 568224. [Google Scholar] [CrossRef] [PubMed]
55. Alvarez, A.L.; Weyers, S.L.; Goemann, H.M.; Peyton, B.M.; Gardner, R.D. Microalgae, Soil and Plants: A Critical Review of Microalgae as Renewable Resources for Agriculture. Algal Res. 2021, 54, 102200. [Google Scholar] [CrossRef]
56. Jhala, Y.K.; Panpatte, D.G.; Vyas, R.V. Cyanobacteria: Source of Organic Fertilizers for Plant Growth. Microorg. Sustain. 2017, 6, 253–264. [Google Scholar] [CrossRef]
57. Prasanna, R.; Hossain, F.; Babu, S.; Bidyarani, N.; Adak, A.; Verma, S.; Shivay, Y.S.; Nain, L. Prospecting Cyanobacterial Formulations as Plant-Growth-Promoting Agents for Maize Hybrids. S. Afr. J. Plant Soil 2015, 32, 199–207. [Google Scholar] [CrossRef]
58. Win, T.T.; Barone, G.D.; Secundo, F.; Fu, P. Algal Biofertilizers and Plant Growth Stimulants for Sustainable Agriculture. Ind. Biotechnol. 2018, 14, 203–211. [Google Scholar] [CrossRef]
59. Sharma, R.; Khokhar, M.K.; Jat, R.L.; Khandelwal, S.K. Role of Algae and Cyanobacteria in Sustainable Agriculture System. Wudpecker J. Agric. Res. 2012, 1, 381–388. [Google Scholar]
60. Overvoorde, P.; Fukaki, H.; Beeckman, T. Auxin Control of Root Development. Cold Spring Harb. Perspect. Biol. 2010, 2, a001537. [Google Scholar] [CrossRef]
61. Riahi, H.; Shariatmadari, Z.; Khanjir, M.; Azizi, A. Effect of Anabaena vaginicola Inoculum on Growth of Pot Plants. Acta Hortic. 2013, 1013, 507–514. [Google Scholar] [CrossRef]
62. Ismail, G.A.; Abo-Hamad, S.A. Effect of Different Anabaena variabilis (Kütz) Treatments on Some Growth Parameters and Physiological Aspects of Hordeum vulgare L. and TrigonellafFoenum-graecum L. Egypt. J. Bot. 2017, 57, 507–516. [Google Scholar] [CrossRef]
63. Mazhar, S.; Cohen, J.D.; Hasnain, S. Auxin Producing Non-Heterocystous Cyanobacteria and Their Impact on the Growth and Endogenous Auxin Homeostasis of Wheat. J. Basic Microbiol. 2013, 53, 996–1003. [Google Scholar] [CrossRef]
64. Osman, M.E.H.; El-Sheekh, M.M.; El-Naggar, A.H.; Gheda, S.F. Effect of Two Species of Cyanobacteria as Biofertilizers on Some Metabolic Activities, Growth, and Yield of Pea Plant. Biol. Fertil. Soils 2010, 46, 861–875. [Google Scholar] [CrossRef]
65. Bograh, A.; Gingras, Y.; Tajmir-Riahi, H.A.; Carpentier, R. The Effects of Spermine and Spermidine on the Structure of Photosystem II Proteins in Relation to Inhibition of Electron Transport. FEBS Lett. 1997, 402, 41–44. [Google Scholar] [CrossRef]
66. Younis, M.E.; Hasaneen, M.N.A.; Tourky, S.M.N. Plant Growth, Metabolism and Adaptation in Relation to Stress Conditions. XXIV. Salinity- Biofertility Interactive Effects on Proline, Glycine and Various Antioxidants in Lactuca sativa. Plant Omics 2009, 2, 197–205. [Google Scholar]
67. Zheleva, D.; Tsonev, T.; Sergiev, I.; Karanov, E. Protective Effect of Exogenous Polyamines against Atrazine in Pea Plants. J. Plant Growth Regul. 1994, 13, 203–211. [Google Scholar] [CrossRef]
68. Martínez Lozano, S.; Verde Star, J.; Maiti, R.K.; Oranday, A.; Gaona, H.; Aranda, E.; Rojas, M. Effect of an algae extract and several plant growth regulators on the nutritional value of potato (Solanum tuberosum L. var. gigant). Arch. Latinoam. Nutr. 1999, 49, 166–170. [Google Scholar]
69. Hegazi, A.Z.; Mostafa, S.S.M.; Ahmed, H.M.I. Influence Of Different Cyanobacterial Application Methods On Growth And Seed Production Of Common Bean Under Various Levels Of Mineral Nitrogen Fertilization. Nat. Sci. 2010, 88, 183–194. [Google Scholar]
70. Molnár, Z.; Ördög, V. The Effect of Cyanobacterial Compounds on the Organogenesis of Pea Cultured in Vitro. Acta Biol. Szeged. 2005, 49, 37–38. [Google Scholar]
71. Varalakshmi, P.; Malliga, P. Evidence for Production of Indole-3-Acetic Acid from a Fresh Water Cyanobacteria (Oscillatoria annae) on the Growth of H. Annus. Int. J. Sci. Res. Publ. 2012, 2, 1–15. [Google Scholar]
72. Gheda, S.F.; Ahmed, D.A. Improved Soil Characteristics and Wheat Germination as Influenced by Inoculation of Nostoc kihlmani and Anabaena cylindrica. Rend. Lincei 2015, 26, 121–131. [Google Scholar] [CrossRef]
73. Maqubela, M.P.; Mnkeni, P.N.S.; Issa, O.M.; Pardo, M.T.; D’Acqui, L.P. Nostoc Cyanobacterial Inoculation in South African Agricultural Soils Enhances Soil Structure, Fertility, and Maize Growth. Plant Soil 2009, 315, 79–92. [Google Scholar] [CrossRef]
74. Nisha, R.; Kaushik, A.; Kaushik, C.P. Effect of Indigenous Cyanobacterial Application on Structural Stability and Productivity of an Organically Poor Semi-Arid Soil. Geoderma 2007, 138, 49–56. [Google Scholar] [CrossRef]
75. Acea, M.J.; Prieto-Fernández, A.; Diz-Cid, N. Cyanobacteral Inoculation of Heated Soils: Effect on Microorganisms of C and N Cycles and on Chemical Composition in Soil Surface. Soil Biol. Biochem. 2003, 35, 513–524. [Google Scholar] [CrossRef]
76. El-Ayouty, Y.M.; Ghazal, F.M.; Hassan, A.Z.A.; Abd El-Aal, A.A.M. Effect of Algal Inoculation and Different Water Holding Capacity Levels on Soil Aggregation and Soil Moisture Content of Sandy and Calcareous Soils under Tomato Cultivation Condition. J. Agric. Sci. Mans. Univ. 2004, 29, 2801–2809. [Google Scholar]
77. El-Sheekh, M.M.; Zayed, M.A.; Elmossel, F.K.A.; Hassan, R.S.A. Effect of Cyanobacteria Isolates on Rice Seeds Germination in Saline Soil. Baghdad Sci. J. 2018, 15, 16–21. [Google Scholar] [CrossRef]
Hakkoum Z, Minaoui F, Chabili A, Douma M, Mouhri K, Loudiki M. Biofertilizing Effect of Soil Cyanobacterium Anabaena cylindrica–Based Formulations on Wheat Growth, Physiology, and Soil Fertility. Agriculture. 2025; 15(2):189. https://doi.org/10.3390/agriculture15020189
Перевод статьи «Biofertilizing Effect of Soil CyanobacteriumAnabaena cylindrica–Based Formulations on Wheat Growth, Physiology, and Soil Fertility» авторов Hakkoum Z, Minaoui F, Chabili A, Douma M, Mouhri K, Loudiki M., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
Фото: freepik
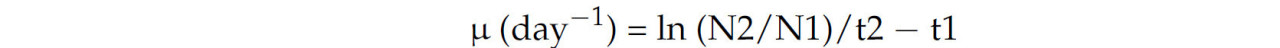




































































































Комментарии (0)