Фасоль, которая не боится морской воды: как дикий вид Vigna marina может помочь сельскому хозяйству на засоленных почвах
Проникновение морской воды в почвы, вызванное глобальным изменением климата и цунами, является значительным фактором, способствующим засолению почв в прибрежных зонах растительности, что представляет серьезную угрозу для сельского хозяйства и продовольственной безопасности. Целью данного исследования была оценка устойчивости к морской воде дикого вида вигны, Vigna marina, путем проведения сравнительных лабораторных экспериментов с с Vigna radiata (маш) и Vigna angularis (фасоль адзуки).
Аннотация
В отличие от V. radiata и V. angularis, семена V. marina показали значительную плавучесть в морской воде, оставаясь на поверхности не менее 30 дней. После такой длительной инкубации в морской воде семена V. marina сохранили 100% всхожесть, тогда как V. radiata и V. angularis в тех же условиях не проросли. Фотосинтетическая активность проростков V. marina, оцененная по параметру Fv/Fm, оставалась стабильной даже после семи дней полива морской водой. В то же время V. radiata и V. angularis погибли при поливе морской водой. Более того, проростки V. marina демонстрировали устойчивый рост при поливе морской водой, показывая последовательное увеличение как свежей, так и сухой массы. Эти данные подтверждают, что V. marina обладает выдающейся устойчивостью к морской воде — ключевой характеристикой для возделывания на территориях, подверженных проникновению морской воды.
1. Введение
Засоление почв известно как одно из долгосрочных последствий крупных цунами, таких как цунами в Индийском океане в 2004 году в Индонезии [1] и цунами Тохоку-оки в 2011 году в Японии [2]. Повышение засоленности почв после цунами влияет на производство сельскохозяйственных культур в течение нескольких лет, даже после выпадения нескольких сотен миллиметров осадков, которые вымывают соли [1]. Ущерб сельскохозяйственным угодьям от соленой воды был настолько серьезным, что даже спустя два года после катастрофы на большей части затопленных цунами земель нельзя было выращивать культуры [2]. Для обеспечения устойчивого производства продовольствия во всем мире необходимы действенные стратегии по снижению влияния морской соли на производство сельскохозяйственных культур [3].
Засоление почв вызывается не только цунами, но также и глобальным изменением климата, которое значительно повлияло на засоление сельскохозяйственных земель, в частности в засушливых, полузасушливых и прибрежных районах [4]. Потери урожая, вызванные засолением вследствие деградации земель, оказывают существенное воздействие на окружающую среду на сельское хозяйство, вызывая опасения по поводу продовольственной безопасности [5], с оценочными экономическими затратами, достигающими 27 миллиардов долларов США в год [6]. Почти половина доступных во всем мире сельскохозяйственных земель расположена в засушливых или полузасушливых регионах, и 108 миллионов гектаров из 1,4 миллиарда гектаров сельскохозяйственных угодий страдают от чрезмерных концентраций соли [7].
В Бангладеш площадь засоленных почв увеличилась с 1% до 33% в период с 1990 по 2015 год, в основном из-за вторжения морской воды в прибрежные районы [8]. Глобальное изменение климата может ускорить проникновение соленой воды в плодородные почвы в результате повышения уровня моря, а чрезмерная добыча грунтовых вод в засушливых регионах также может увеличить засоленность почв и грунтовых вод. По оценкам, около 600 миллионов человек, живущих в прибрежных зонах по всему миру, могут пострадать от засоления [9].
Фундаментальные биологические исследования, направленные на выяснение механизмов солеустойчивости у растений, давно проводятся на модельных растениях с использованием различных подходов, включая физиологию [10], геномику [11] и молекулярную селекцию [10]. Хотя наше понимание адаптивных реакций растений на ионы Na+ на молекулярном уровне значительно продвинулось [10], к сожалению, такие усилия еще не готовы к практическому применению в сельском хозяйстве в полевых условиях.
Растения рода Vigna имеют большое сельскохозяйственное значение, в частности в Азии. Наиболее известные виды этого рода включают Vigna radiata (маш), Vigna unguiculata (коровий горох, или вигна китайская) и Vigna angularis (фасоль адзуки). Эти бобовые культуры предлагают ряд преимуществ для устойчивого сельского хозяйства и продовольственной безопасности [12]. Они являются ценным источником растительного белка, что критически важно в регионах с низким потреблением мяса и молочных продуктов. Маш и коровий горох, в частности, значительно способствуют рациону питания во многих странах, помогая решать проблему недоедания [13,14].
Растения рода Vigna обладают способностью фиксировать атмосферный азот благодаря симбиотическим отношениям с азотфиксирующими бактериями Rhizobium в их корневых клубеньках. Эта фиксация азота обогащает почву азотом, сокращая потребность в синтетических удобрениях и способствуя устойчивой практике севооборота [15,16]. Выращивание видов Vigna в рамках системы севооборота помогает улучшить плодородие почвы и поддерживает здоровье последующих культур [17].
Несмотря на свое сельскохозяйственное значение, эти растения Vigna нельзя культивировать в регионах с засоленными почвами из-за их классификации как гликофитов, чувствительных к солевому стрессу [16]. Многочисленные исследования показали, что прорастание и рост V. radiata сильно подавляются солевым стрессом, причем экспериментальные данные демонстрируют такие эффекты при концентрации 200 мМ NaCl [18,19]. В этих условиях различные физиологические и биохимические параметры указывают на значительные повреждения растений [18,19,20]. Хотя различия в чувствительности к солевому стрессу наблюдались среди сортов и генотипов [21,22], на сегодняшний день не сообщалось о солеустойчивых видах V. radiata, способных процветать в условиях, эквивалентных морской воде (~600 мМ NaCl).
Vigna marina, называемая дикой береговой фасолью [23], береговым коровьим горохом [24] или дюнной фасолью [25], естественным образом произрастает в прибрежных районах тропических и субтропических регионов Пацифики [25] и Африки [26]. Ее естественная среда обитания в зонах, омываемых морем, сделала высокую солеустойчивость V. marina темой значительного интереса в исследованиях растений. В лабораторных исследованиях солеустойчивость V. marina в основном оценивали с использованием растворов NaCl. Однако ее устойчивость к морской воде — ключевой аспект базовых знаний для практического применения — еще не была продемонстрирована экспериментально. Это исследование направлено на то, чтобы наглядно показать выдающуюся устойчивость V. marina к морской воде путем проведения сравнительных экспериментов бок о бок с V. radiata и V. angularis в качестве контрольных видов с отрицательной реакцией. Полученные данные устанавливают V. marina как высокоустойчивый к морской воде вид Vigna, позиционируя его как перспективного кандидата для решения проблем производства сельскохозяйственных культур, вызванных засолением почв в результате вторжения морской воды на сельскохозяйственные земли.
2. Материалы и методы
2.1. Растительный материал
Семена Vigna marina были собраны на песчаных пляжах острова Окинава, субтропического кораллового острова в Японии. После сбора семена отделяли от стручков, сортировали и высушивали на воздухе. Семена отбирали по определенным критериям: однородный размер, цвет и дата сбора. Отобранные семена хранили в эксикаторе при комнатной температуре. Для стерилизации семян 2,5 мл гипохлорита натрия разбавляли в 25 мл стерильной дистиллированной воды, а затем смешивали с 0,1% Tween 20. Семена погружали в этот стерилизующий раствор на 5 мин. После стерилизации раствор удаляли, а семена промывали три раза стерильной дистиллированной водой. Семена Vigna radiata и Vigna angularis были приобретены у коммерческого поставщика.
2.2. Эксперименты с плавучестью семян
Из-за естественной изменчивости состава морской воды, вызванной географическими, физическими и биологическими факторами, в качестве экспериментальной среды использовалась искусственная морская вода для обеспечения согласованности и воспроизводимости экспериментов. Семена V. marina, V. radiata и V. angularis инкубировали в аквариумах, содержащих 9 л искусственной морской воды (Japan Bio-Chemicals, Токио, Япония), в течение одного месяца. Температура в помещении и воды поддерживалась на уровне 26 °C. Интенсивность света была установлена на 50 мкмоль м⁻² с⁻¹ при 12-часовом фотопериоде. Семена инкубировали в течение 1, 2, 3, 4, 5, 6, 7, 14 и 30 дней, при этом необработанные семена служили контролем. Для каждого вида использовали в общей сложности 1000 семян.
2.3. Эксперименты по прорастанию семян
Чтобы прервать покой семян V. marina, в каждом семени проделывали отверстие, создавая крошечную пору. Затем обработанные семена переносили в чашки Петри, содержащие один лист фильтровальной бумаги Whatman No. 1, увлажненной 10 мл стерилизованной дистиллированной воды. Семена инкубировали в растительной камере с интенсивностью света 50 мкмоль м⁻² с⁻¹ и 12-часовым фотопериодом при 25 °C. Количество проросших семян регистрировали ежедневно, а окончательный процент прорастания рассчитывали через 7 дней. В этих экспериментах использовали три повторности. Для сравнения использовали прорастание семян V. marina (с порами), V. radiata и V. angularis.
2.4. Эксперименты по росту проростков
Семена трех бобовых культур стерилизовали описанным выше раствором и проращивали в чашках Петри, содержащих один лист фильтровальной бумаги Whatman No. 1, увлажненной 10 мл дистиллированной воды, в течение 48 ч. Проросшие семена переносили в пластиковые горшки (диаметром 5,5 см), заполненные 240 г песка, и ежедневно поливали 20% раствором Хогланда. После полного раскрытия двух листьев здоровые проростки одинакового размера пересаживали в новые пластиковые горшки (по одному проростку на горшок), содержащие 240 г песка.
Проростки инкубировали в растительной камере при неингибирующей фотосинтез интенсивности света (35 мкмоль м⁻² с⁻¹), 12-часовом фотопериоде и температуре 25 °C. Относительную влажность поддерживали на уровне 80%, чтобы предотвратить чрезмерное испарение из среды.
Проростки ежедневно поливали равными количествами 100% искусственной морской воды (Japan Bio-Chemicals). Поскольку искусственная морская вода не содержит нитрат-ионов, для имитации прибрежной морской воды и обеспечения источника азота для роста растений добавляли 0,2 мМ нитрата натрия. После сбора растения промывали дистиллированной водой и высушивали на воздухе в течение 10 мин. Затем проростки разделяли на листья, стебли и корни и измеряли их сырую массу. Сухую массу определяли после высушивания каждой части при 80 °C в течение 48 ч.
2.5. Измерение флуоресценции хлорофилла а
Проростки с двумя полностью раскрытыми листьями использовали для мониторинга фотосинтетической активности во время обработки поливом морской водой. Влияние полива морской водой на фотосинтетическую активность оценивали с использованием максимального квантового выхода Фотосистемы II (Fv/Fm), который определяли с помощью флуориметра FluorCam 700 MF (Photon Systems Instruments, Драсов, Чехия), как описано ранее [27]. Перед измерениями флуоресценции хлорофилла растения адаптировали к темноте в течение 15 мин. Измерения проводили ежедневно в течение до 7 дней во время обработки поливом морской водой.
3. Результаты
3.1. Естественная среда обитания Vigna marina
Vigna marina (Burm.) Merrill, также известная как морская фасоль, береговой горох, прибрежный коровий горох или дюнная фасоль, является пантропическим прибрежным бобовым растением, широко распространенным на северо-востоке Австралии [28], в Индии [29], Африке [26], Юго-Восточной Азии [30] и архипелаге Рюкю, включая Окинаву, Япония [31]. На Рисунке 1A показана типичная естественная среда обитания V. marina на Окинаве. V. marina образует колонии на песчаных пляжах вблизи береговой линии. Как правило, сообщества V. marina расположены ближе всего к морю среди местных прибрежных растений, где морская вода омывает прибрежные пески (Рисунок 1B), создавая олиготрофную или бедную азотом среду.
Рисунок 1. Vigna marina, растущая в полевых условиях. (A) Общий вид местообитания V. marina. (B) V. marina, растущая на морском берегу с обильностью коралловых скелетов. (C) Желтые цветы и зрелые бобовые стручки. (D) Проросток, растущий в полевых условиях. (E) Корневые клубеньки. (F) Поперечный срез клубеньков, показывающий красноватый леггемоглобин.
На Окинаве V. marina цветет и дает семена в течение всего года (Рисунок 1C), но пик цветения приходится на сезон дождей в июне. Как бобовое растение, V. marina образует корневые клубеньки (Рисунок 1D,E), в которых обитают азотфиксирующие бактерии вместе с леггемоглобином (Рисунок 1F). В загрязненных или эвтрофных зонах эти клубеньки редко встречаются, и другие неприбрежные растения, не фиксирующие азот, такие как Ipomoea gracilis, как правило, доминируют в среде обитания. Поэтому наличие V. marina с корневыми клубеньками в полевых условиях может служить индикатором чистой и олиготрофной среды.
3.2. Устойчивость семян к морской воде
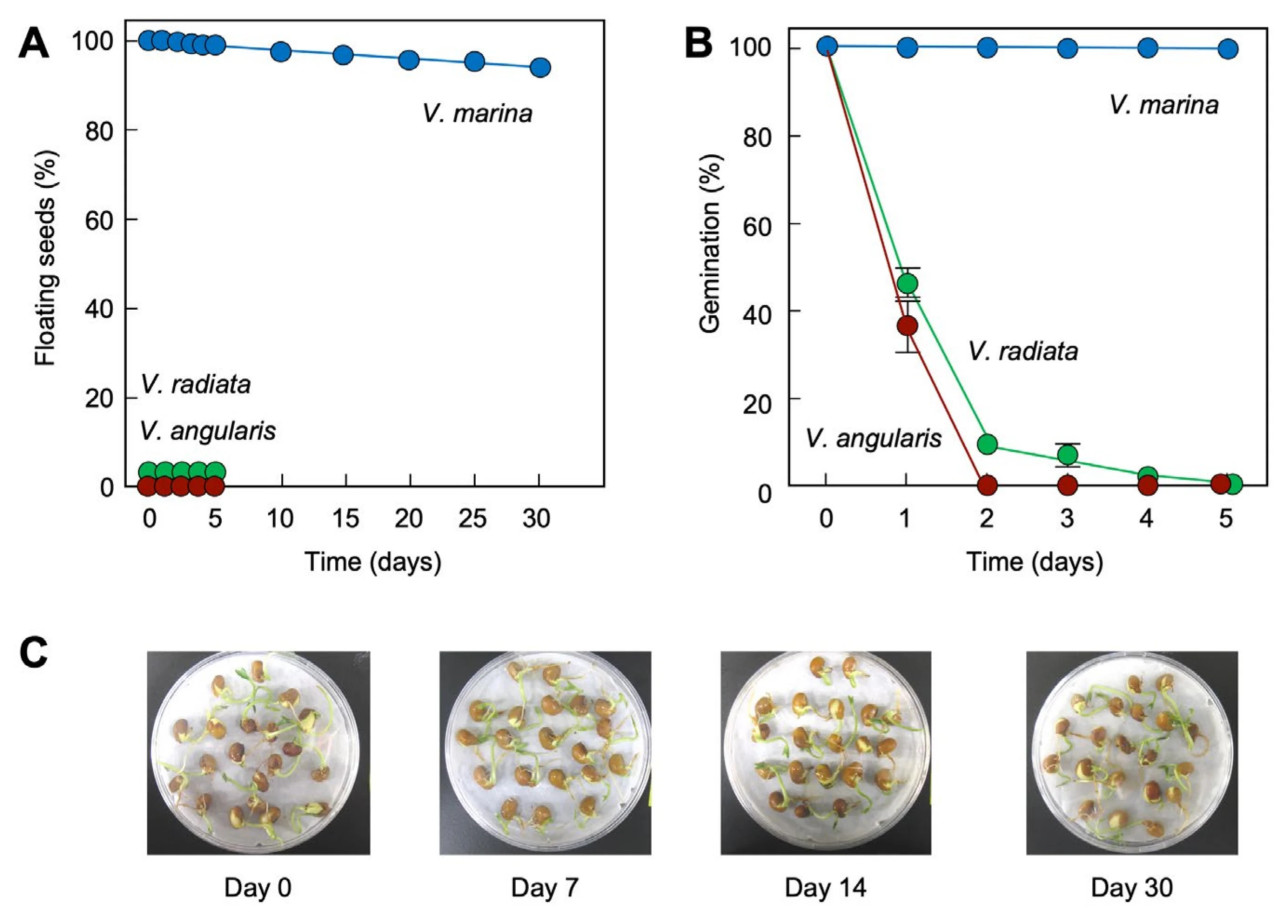
V. marina — это пантропическое прибрежное растение, известное своей способностью к расселению морем [31]. Примечательно, что зарегистрировано, что семена V. marina могут плавать в соленой воде до 25 лет, сохраняя способность к прорастанию [25]. На Рисунке 2 сравнивается устойчивость семян трех видов Vigna к морской воде: V. marina, V. radiata и V. angularis. Хотя их морфология и размер схожи (Рисунок 2A), существует значительная разница в воздушном пространстве внутри семян. Семена V. marina, заключенные в толстую семенную оболочку, образуют большую центральную полость (Рисунок 2B). Большое воздушное пространство, вероятно, способствует плавучести семян V. marina в морской воде (Рисунок 2C). В отличие от этого, семена V. radiata и V. angularis не обладают плавучестью и сразу же опускались на дно резервуара с морской водой (Рисунок 2D,E).
Рисунок 2. Семена трех видов Vigna. (A) Семена V. marina, V. radiata и V. angularis (слева направо). (B) Поперечные срезы трех видов Vigna: V. marina, V. radiata и V. angularis (слева направо). (C) Плавающие семена V. marina в резервуаре с морской водой. (D) Утонувшие семена V. radiata. (E) Утонувшие семена V. angularis.
Большинство семян V. marina сохраняли плавучесть в течение длительного времени в морской воде (Рисунок 3A). Даже после длительного погружения, например, на 30 дней, V. marina демонстрировала 100% всхожесть (Рисунок 3B,C). В отличие от этого, способность к прорастанию V. radiata и V. angularis снижалась с увеличением времени погружения в морскую воду (Рисунок 3B). Это подтверждает, что семена V. marina чрезвычайно устойчивы к длительному воздействию морской воды. Обладая высокой плавучестью и сохраненной способностью к прорастанию после длительного погружения в морскую воду, Vigna marina может достигать широкого распространения через расселение семян океаническими течениями, что является значительной характерной чертой видов, расселяемых морем [31,32].
Рисунок 3. Устойчивость трех видов Vigna к морской воде. (A) Тест на плавучесть в морской воде для трех видов Vigna. (B) Способность к прорастанию трех видов Vigna после обработки морской водой. (C) Фотографии прорастания V. marina после погружения в морскую воду на указанное количество дней. Столбики представляют стандартное отклонение (SD) (n = 3).
3.3. Устойчивость проростков к морской воде
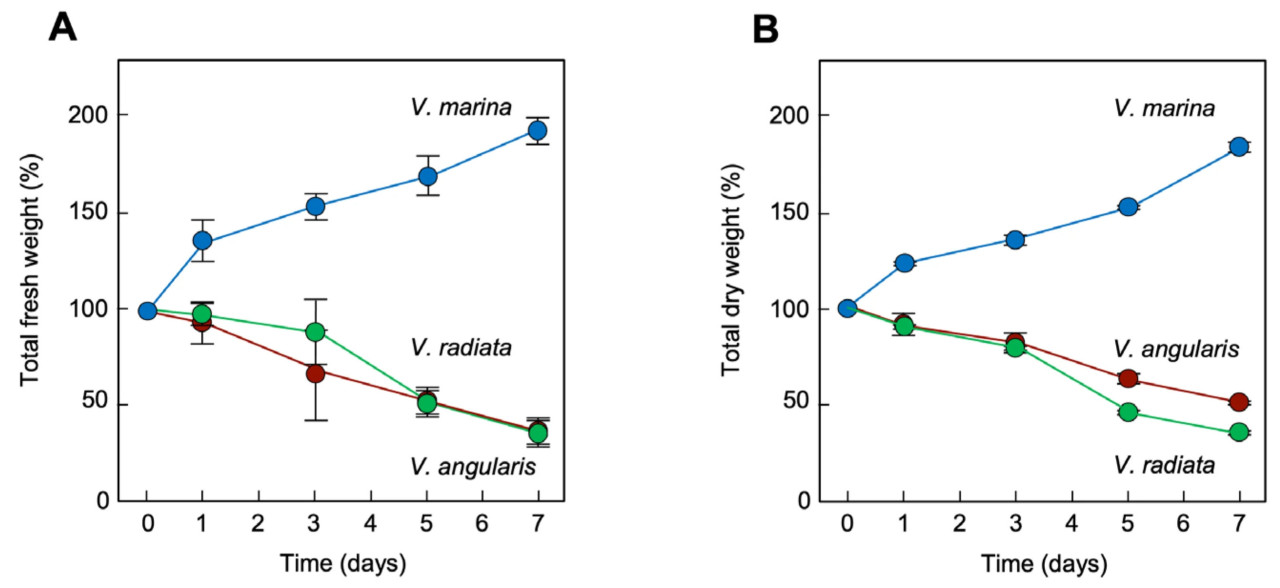
На Рисунке 4 сравнивается устойчивость проростков трех видов Vigna к морской воде. V. radiata и V. angularis были восприимчивы к поливу морской водой. Даже в первый день симптомы повреждения наблюдались на их листьях и стеблях (Рисунок 4). В отличие от этого, V. marina не подвергалась воздействию морской воды. Это было подтверждено мониторингом их сырой и сухой массы во время выращивания (Рисунок 5). Увеличение как сырой, так и сухой массы указывало на то, что V. marina продолжала расти даже при поливе морской водой. В отличие от этого, как V. radiata, так и V. angularis показали снижение как сырой, так и сухой массы при продолжительной обработке морской водой, предположительно из-за обезвоживания и деградации, приводящих к гибели. Аналогичные тенденции наблюдались при высоких концентрациях катионов и анионов (Рисунки S1 и S2), что подтверждает значительную устойчивость V. marina к солевому стрессу.
Рисунок 4. Влияние полива морской водой на проростки трех видов Vigna. Проростки ежедневно поливали морской водой. Цифры на фотографиях обозначают количество дней обработки. Белые шкалы указывают масштаб 1 см.
Рисунок 5. Изменения сырой и сухой массы проростков трех видов Vigna во время обработки морской водой. (A) Изменения общей сырой массы. (B) Изменения общей сухой массы. Столбики представляют стандартное отклонение (SD), n = 3.
3.4. Устойчивость фотосинтетической активности к морской воде
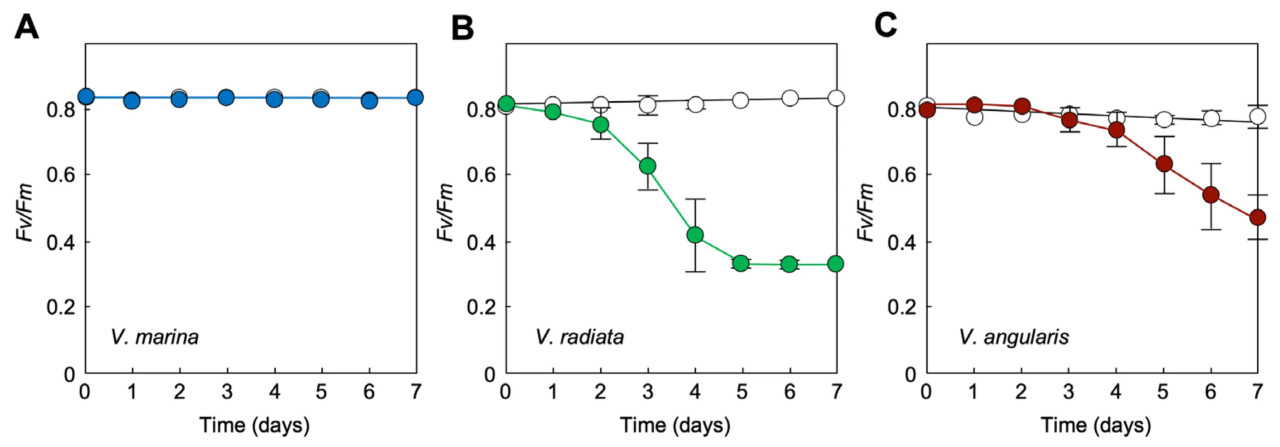
Результаты на Рисунке 5 указывают на то, что V. marina может расти даже в присутствии морской воды. Чтобы подтвердить ее фотосинтетический рост, мы исследовали изменения в фотосинтетической активности листьев у V. marina, V. radiata и V. angularis. Измерение флуоресценции хлорофилла а с модулированной амплитудой импульсов (PAM) является неразрушающим методом мониторинга фотосинтетической активности интактных растений. Квантовый выход Фотосистемы II, который отражается в параметре флуоресценции хлорофилла а Fv/Fm, широко используется для оценки физиологического повреждения фотосинтеза при различных стрессах окружающей среды. На Рисунке 6 сравниваются значения Fv/Fm трех видов Vigna во время обработки морской водой. В соответствии с ростом растений (Рисунок 5), Fv/Fm не изменился у V. marina, тогда как у V. radiata и V. angularis он снижался с увеличением дней обработки морской водой. Фотосинтетические измерения также подтверждают, что V. marina чрезвычайно устойчива к морской воде.
Рисунок 6. Влияние обработки морской водой на фотосинтетическую активность трех видов Vigna. (A) Изменения значений Fv/Fm у V. marina. (B) Изменения значений Fv/Fm у V. radiata. (C) Изменения значений Fv/Fm у V. angularis. Белые открытые кружки обозначают значения Fv/Fm листьев проростков, политых дистиллированной водой. Цветные закрашенные кружки представляют значения проростков, подвергшихся обработке морской водой. В целом, значение Fv/Fm около 0,8 служит критерием неповрежденного фотосинтеза. Снижение Fv/Fm предполагает ингибирование или нарушение фотосинтеза. Столбики представляют SD (n = 3).
4. Обсуждение
4.1. V. marina как устойчивое к морской воде бобовое растение
Сосредоточившись на сельском хозяйстве в районах, подверженных вторжению морской воды, мы продемонстрировали устойчивость семян, прорастания, роста и фотосинтеза V. marina к морской воде путем проведения сравнения бок о бок с V. radiata и V. angularis. Результаты четко указывают на то, что V. marina является высокоустойчивым к морской воде видом Vigna, что согласуется с ожиданиями, основанными на ее естественной среде обитания (Рисунок 1), и подтверждается предыдущими исследованиями с использованием растворов NaCl [25,28,30,31,33,34,35].
Сохранение фотосинтетической активности является ключевым показателем устойчивости или резистентности растений к абиотическим и экологическим стрессам [36]. Параметр флуоресценции хлорофилла а Fv/Fm, который представляет собой отношение переменной к максимальной флуоресценции после адаптации к темноте, широко используется для оценки максимального квантового выхода Фотосистемы II (ФСII) [37,38,39]. Этот параметр в частности ценен для оценки целостности фотосинтетического аппарата в условиях стресса [37], включая стресс NaCl [40,41].
На Рисунке 6 четко иллюстрируется, что фотосинтетическая активность V. marina остается незатронутой морской водой, тогда как V. radiata и V. angularis демонстрируют значительные повреждения в тех же условиях. Наблюдаемая устойчивость V. marina, на что указывает Fv/Fm, согласуется с недавними исследованиями, использующими Y(II) — меру фактического квантового выхода ФСII в условиях адаптации к свету, — которые сообщали об устойчивости V. marina к NaCl при концентрациях до 200 мМ [35]. Следовательно, можно заключить, что фотосинтетический аппарат V. marinaдемонстрирует высокую устойчивость к морской воде.
4.2. Различие между устойчивостью к NaCl и морской воде
В науке о растениях термины солеустойчивость [42], устойчивость к засолению [11,43], устойчивость к NaCl [44] и устойчивость к морской воде (данное исследование) часто используются как синонимы для описания способности растения выживать и расти при высоком содержании солей. Однако эти термины несут разные коннотации в зависимости от типов и состава солей, а также конкретных условий окружающей среды [44,45].
Для имитации условий морской воды часто применяют растворы NaCl с концентрациями 600 мМ (полная морская вода), 300 мМ (половинная) или 200 мМ (одна треть) для оценки устойчивости растений к солевому стрессу [35]. Галофиты — растения, адаптированные к засоленным средам, — экспериментально отличают от гликофитов (солечувствительных растений) в основном по их устойчивости к NaCl [46]. Важно отметить, что в дополнение к NaCl морская вода содержит высокие концентрации сульфат-ионов (SO₄²⁻), второго по распространенности аниона в морской воде после Cl⁻, примерно 30 мМ [47,48]. Это добавляет сложности стрессу от морской воды, поскольку растения должны справляться не только с ионами Na⁺ и Cl⁻, но и с SO₄²⁻.
На суше сера поступает через осадки, содержащие сернистые соединения из океанов или вулканической активности [49]. Как правило, доступность серы ограничена во внутренних почвах, что требует от растений активного поглощения серы с использованием специализированных сульфатных транспортеров (SULTR), которые опосредуют совместный транспорт H⁺ и SO₄²⁻ [50]. Серосодержащие удобрения наряду с азотными удобрениями, следовательно, ключевые для производства сельскохозяйственных культур, причем большая часть исследовательского внимания уделяется дефициту серы [51]. Недавние исследования предполагают, что в дополнение к активным формам кислорода (АФК), которые участвуют в повреждении растений, вызванном солью [11,52,53,54], активные формы азота (AFN) и активные формы серы (AFS) также играют роль в клеточном повреждении и межклеточной сигнализации у растений и других организмов [11,55]. В то время как небольшие количества этих активных молекул действуют как сигнальные агенты, их чрезмерное накопление может вызвать клеточное повреждение или гибель [55]. У растений токсичный газ сероводород (H₂S), основной источник для AFS, может образовываться из SO₄²⁻ во время ассимиляции серы в хлоропластах [49].
Токсичность серы исторически упускалась из виду в сельскохозяйственных исследованиях, поскольку сера считается необходимым питательным веществом для производства сельскохозяйственных культур. Однако, в дополнение к устойчивости к NaCl, устойчивость к морской воде может также требовать способности справляться с высокими концентрациями сульфат-ионов, значительного источника потенциально цитотоксичных AFS. Дополнительные исследования, сосредоточенные не только на устойчивости к NaCl, но и на устойчивости к токсичности серы, необходимы для выявления молекулярных механизмов, лежащих в основе устойчивости V. marina к морской воде.
4.3. V. marina как сильный кандидат для решения проблем производства сельскохозяйственных культур
V. marinaдемонстрирует значительный потенциал в качестве кандидата для решения проблем производства сельскохозяйственных культур [30,56], в частности в средах, подверженных вторжению морской воды, таких как пострадавшие от цунами. В дополнение к своей устойчивости к солевому стрессу, V. marina проявляет сильную устойчивость к жаре и засухе в жарких песчаных пляжных условиях, что делает ее в целом подходящей для регионов, сталкивающихся с множественными абиотическими стрессами.
Адаптивная селекция необходима для выведения сортов, приспособленных к различным климатам. Недавние данные, полученные из ее черновой последовательности генома и идентифицированных локусов количественных признаков (QTL), предоставляют ценную информацию для руководства будущими селекционными усилиями [29]. Из-за способности к расселению семян океаническими течениями, дикий вид V. marina мог адаптироваться к различным местным условиям, что привело к высокому генетическому разнообразию [28,56]. Дополнительные обследования этого дикого вида в тропических и субтропических прибрежных районах необходимы для изучения его генетической изменчивости [32,57,58]. Обнадеживает то, что V. marina растет зимой в субтропической Окинаве, где в январе, самом холодном месяце, средняя минимальная температура составляет 15 °C. Это предполагает ее потенциал для возделывания в умеренных регионах. В этом контексте V. marina, естественно адаптированная к субтропическому климату, отличается от тропических диких видов или подвидов и может служить уникальной платформой как для традиционных, так и для молекулярных подходов селекции, а также для технологий редактирования генома [5,52].
Вспомогательные материалы
Следующую вспомогательную информацию можно загрузить по адресу: https://www.mdpi.com/article/10.3390/agriculture15030228/s1, Рисунок S1: Влияние катионов на сырую массу трех видов Vigna; Рисунок S2: Влияние анионов на сырую массу трех видов Vigna.
Ссылки
1. McLeod, M.K.; Slavich, P.G.; Irhas, Y.; Moore, N.; Rachman, A.; Ali, N.; Iskandar, T.; Hunt, C.; Caniago, C. Soil salinity in Aceh after the December 2004 Indian Ocean tsunami. Agric. Water Manag. 2010, 97, 605–613. [Google Scholar] [CrossRef]
2. Roy, K.; Sasada, K.; Kohno, E. Salinity status of the 2011 Tohoku-oki tsunami affected agricultural lands in northeast Japan. Int. Soil Water Conserv. Res. 2014, 2, 40–50. [Google Scholar] [CrossRef]
3. Tchouaffe Tchiadje, N.F. Strategies to reduce the impact of salt on crops (rice, cotton and chili) production: A case study of the tsunami-affected area of India. Desalination 2007, 206, 524–530. [Google Scholar] [CrossRef]
4. Corwin, D.L. Climate change impacts on soil salinity in agricultural areas. Eur. J. Soil. Sci. 2020, 72, 842–862. [Google Scholar] [CrossRef]
5. Tarolli, P.; Luo, J.; Park, E.; Barcaccia, G.; Masin, R. Soil salinization in agriculture: Mitigation and adaptation strategies combining nature-based solutions and bioengineering. iScience 2024, 27, 108830. [Google Scholar] [CrossRef]
6. Qadir, M.; Quillérou, E.; Nangia, V.; Murtaza, G.; Singh, M.; Thomas, R.J.; Drechsel, P.; Noble, A.D. Economics of salt-induced land degradation and restoration. Nat. Resour. Forum 2014, 38, 282–295. [Google Scholar] [CrossRef]
7. Zorb, C.; Geilfus, C.M.; Dietz, K.J. Salinity and crop yield. Plant Biol. 2019, 21 (Suppl. S1), 31–38. [Google Scholar] [CrossRef]
8. Mukhopadhyay, R.; Sarkar, B.; Jat, H.S.; Sharma, P.C.; Bolan, N.S. Soil salinity under climate change: Challenges for sustainable agriculture and food security. J. Environ. Manag. 2021, 280, 111736. [Google Scholar] [CrossRef]
9. Dasgupta, S.; Hossain, M.M.; Huq, M.; Wheeler, D. Climate change and soil salinity: The case of coastal Bangladesh. Ambio 2015, 44, 815–826. [Google Scholar] [CrossRef]
10. van Zelm, E.; Zhang, Y.; Testerink, C. Salt tolerance mechanisms of plants. Annu. Rev. Plant Biol. 2020, 71, 403–433. [Google Scholar] [CrossRef]
11. Gupta, B.; Huang, B. Mechanism of salinity tolerance in plants: Physiological, biochemical, and molecular characterization. Int. J. Genom. 2014, 2014, 701596. [Google Scholar] [CrossRef] [PubMed]
12. Harouna, D.V.; Venkataramana, P.B.; Ndakidemi, P.A.; Matemu, A.O. Under-exploited wild Vigna species potentials in human and animal nutrition: A review. Glob. Food Secur. 2018, 18, 1–11. [Google Scholar] [CrossRef]
13. Mekonnen, T.W.; Gerrano, A.S.; Mbuma, N.W.; Labuschagne, M.T. Breeding of vegetable cowpea for nutrition and climate resilience in sub-Saharan Africa: Progress, opportunities, and challenges. Plants 2022, 11, 1583. [Google Scholar] [CrossRef] [PubMed]
14. Ehlers, J.; Hall, A. Cowpea (Vigna unguiculata L. walp.). Field Crops Res. 1997, 53, 187–204. [Google Scholar] [CrossRef]
15. Ben Gaied, R.; Brígido, C.; Sbissi, I.; Tarhouni, M. Sustainable strategy to boost legumes growth under salinity and drought stress in semi-arid and arid regions. Soil. Syst. 2024, 8, 84. [Google Scholar] [CrossRef]
16. Breria, C.M.; Hsieh, C.H.; Yen, T.B.; Yen, J.Y.; Noble, T.J.; Schafleitner, R. A SNP-based genome-wide association study to mine genetic loci associated to salinity tolerance in mungbean (Vigna radiata L.). Genes 2020, 11, 759. [Google Scholar] [CrossRef]
17. Singh, V.; Bell, M. Genotypic variability in achitectural development of mungbean (Vigna radiata L.) root systems and physiological relationships with shoot growth dynamics. Front. Plant Sci. 2021, 12, 725915. [Google Scholar] [CrossRef]
18. Sehrawat, N.; Yadav, M.; Sharma, A.K.; Kumar, V.; Bhat, K.V. Salt stress and mungbean [Vigna radiata (L.) Wilczek]: Effects, physiological perspective and management practices for alleviating salinity. Arch. Agron. Soil Sci. 2019, 65, 1287–1301. [Google Scholar] [CrossRef]
19. Patel, M.; Gupta, D.; Saini, A.; Kumari, A.; Priya, R.; Panda, S.K. Physiological phenotyping and biochemical characterization of mung bean (Vigna radiata L.) genotypes for salt and drought stress. Agriculture 2024, 14, 1337. [Google Scholar] [CrossRef]
20. Podder, S.; Ray, J.; Das, D.; Sarker, B.C. Effect of salinity (NaCl) on germination and seedling growth of mungbean (Vigna radiata L.). J. Biosci. Agric. Res. 2020, 24, 2012–2019. [Google Scholar] [CrossRef]
21. Dilipan, E.; Nisha, A.J. Assessing salinity tolerance and genetic variation in mung bean (Vigna radiata) through CAAT box and SCoT marker analysis. Ecol. Genet. Genom. 2024, 32, 100266. [Google Scholar] [CrossRef]
22. Deeroum, A.; Thepphomwong, K.; Laosatit, K.; Somta, P. Inheritance of salt tolerance in wild mungbean (Vigna radiata var. sublobata). Agric. Nat. Resour. 2024, 58, 469–476. [Google Scholar]
23. Mohamad Yunus, A.T.; Bin Chiu, S.; Ghazali, A.H. Vigna marina as a potential leguminous cover crop for high salinity soils. Pertanika J. Trop. Agric. Sci. 2024, 47, 481–494. [Google Scholar] [CrossRef]
24. Chankaew, S.; Isemura, T.; Naito, K.; Ogiso-Tanaka, E.; Tomooka, N.; Somta, P.; Kaga, A.; Vaughan, D.A.; Srinives, P. QTL mapping for salt tolerance and domestication-related traits in Vigna marina subsp. oblonga, a halophytic species. Theor. Appl. Genet. 2014, 127, 691–702. [Google Scholar] [CrossRef]
25. Lawn, R.; Cottrell, A. Seeds of Vigna marina (burm.) Merrill survive up to 25 years flotation in salt water. Qld. Nat. 2016, 54, 3–13. [Google Scholar]
26. Maxted, N.; Mabuza-Diamini, P.; Moss, H.; Padulosi, S.; Jarvis, A.; Guarino, L. An Ecogeographic Study African Vigna. 2004. Available online: https://hdl.handle.net/10568/105017 (accessed on 5 January 2025).
27. Hossain, K.K.; Nakamura, T.; Yamasaki, H. Effect of nitric oxide on leaf non-photochemical quenching of fluorescence under heat-stress conditions. Russ. J. Plant Physiol. 2011, 58, 629–633. [Google Scholar] [CrossRef]
28. Lawn, R.; Watkinson, A. Habitats, morphological diversity, and distribution of the genus Vigna Savi in Australia. Aust. J. Agric. Res. 2002, 53, 1305–1316. [Google Scholar] [CrossRef]
29. Singh, A.K.; Velmurugan, A.; Gupta, D.S.; Kumar, J.; Kesari, R.; Konda, A.; Singh, N.P.; Roy, S.D.; Biswas, U.; Kumar, R.R.; et al. Draft genome sequence of a less-known wild Vigna: Beach pea (V. marina cv. ANBp-14-03). Crop J. 2019, 7, 660–666. [Google Scholar] [CrossRef]
30. Septiana, A.; Analuddin. Potential uses of marine bean (Vigna marina Burm.) as salt tolerant kegume in coastal salty land, Southeast Sulawesi, Indonesia. IOP Conf. Ser. Earth Environ. Sci. 2019, 260, 012142. [Google Scholar] [CrossRef]
31. Nakanishi, H. Dispersal ecology of the maritime plants in the Ryukyu Islands, Japan. Ecol. Res. 1988, 3, 163–173. [Google Scholar] [CrossRef]
32. Yamamoto, T.; Tsuda, Y.; Takayama, K.; Nagashima, R.; Tateishi, Y.; Kajita, T. The presence of a cryptic barrier in the West Pacific Ocean suggests the effect of glacial climate changes on a widespread sea-dispersed plant, Vigna marina (Fabaceae). Ecol. Evol. 2019, 9, 8429–8440. [Google Scholar] [CrossRef] [PubMed]
33. Elanchezhian, R.; Rajalakshmi, S.; Jayakumar, V. Salt tolerance characteristics of rhizobium species associated with Vigna marina. Indian J. Agric. Sci. 2009, 79, 980–985. [Google Scholar]
34. Noda, Y.; Sugita, R.; Hirose, A.; Kawachi, N.; Tanoi, K.; Furukawa, J.; Naito, K. Diversity of Na+ allocation in salt-tolerant species of the genus Vigna. Breed. Sci. 2022, 72, 326–331. [Google Scholar] [CrossRef] [PubMed]
35. Wang, F.; Iki, Y.; Tanoi, K.; Naito, K. Phenotypic responses in the root of salt-tolerant accessions of Vigna marina and Vigna luteola under salt stress. Genet. Resour. Crop Evol. 2023, 71, 2631–2640. [Google Scholar] [CrossRef]
36. Murata, N.; Takahashi, S.; Nishiyama, Y.; Allakhverdiev, S.I. Photoinhibition of photosystem II under environmental stress. Biochim. Biophys. Acta 2007, 1767, 414–421. [Google Scholar] [CrossRef]
37. Takahashi, S.; Tamashiro, A.; Sakihama, Y.; Yamamoto, Y.; Kawamitsu, Y.; Yamasaki, H. High-susceptibility of photosynthesis to photoinhibition in the tropical plant Ficus microcarpa L. f. cv. Golden Leaves. BMC Plant Biol. 2002, 2, 1–8. [Google Scholar] [CrossRef] [PubMed]
38. Souza, R.; Machado, E.; Silva, J.; Lagôa, A.; Silveira, J. Photosynthetic gas exchange, chlorophyll fluorescence and some associated metabolic changes in cowpea (Vigna unguiculata) during water stress and recovery. Environ. Exp. Bot. 2004, 51, 45–56. [Google Scholar] [CrossRef]
39. Yang, X.; Lu, C. Photosynthesis is improved by exogenous glycinebetaine in salt-stressed maize plants. Physiol. Plant. 2005, 124, 343–352. [Google Scholar] [CrossRef]
40. Hniličková, H.; Hnilička, F.; Martinkova, J.; Kraus, K. Effects of salt stress on water status, photosynthesis and chlorophyll fluorescence of rocket. Plant Soil. Environ. 2017, 63, 362–367. [Google Scholar] [CrossRef]
41. Sheng, M.; Tang, M.; Chen, H.; Yang, B.; Zhang, F.; Huang, Y. Influence of arbuscular mycorrhizae on photosynthesis and water status of maize plants under salt stress. Mycorrhiza 2008, 18, 287–296. [Google Scholar] [CrossRef]
42. Deinlein, U.; Stephan, A.B.; Horie, T.; Luo, W.; Xu, G.; Schroeder, J.I. Plant salt-tolerance mechanisms. Trends Plant Sci. 2014, 19, 371–379. [Google Scholar] [CrossRef] [PubMed]
43. Negrao, S.; Schmockel, S.M.; Tester, M. Evaluating physiological responses of plants to salinity stress. Ann. Bot. 2017, 119, 1–11. [Google Scholar] [CrossRef] [PubMed]
44. Quesada, V.; Garcia-Martinez, S.; Piqueras, P.; Ponce, M.R.; Micol, J.L. Genetic architecture of NaCl tolerance in Arabidopsis. Plant Physiol. 2002, 130, 951–963. [Google Scholar] [CrossRef]
45. Parida, A.K.; Das, A.B. Salt tolerance and salinity effects on plants: A review. Ecotoxicol. Environ. Saf. 2005, 60, 324–349. [Google Scholar] [CrossRef] [PubMed]
46. Sarkar, A.K.; Sadhukhan, S. Impact of salinity on growth and development of plants with the central focus on Glycophytes: An overview. Bull. Environ. Pharmacol. Life Sci. 2023, 12, 235–266. [Google Scholar]
47. Kester, D.R.; Pytkowicx, R.M. Sodium, magnesium, and calcim sulfate ion-pairs in seawater at 25 °C. Limnol. Oceanogr. 1969, 14, 686–692. [Google Scholar] [CrossRef]
48. Dickson, A.G.; Goyet, C. Handbook of Methods for the Analysis of the Various Parameters of the Carbon Dioxide System in Sea Water. Version 2; Oak Ridge National Laboratory (ORNL): Oak Ridge, TN, USA, 1994; p. 198. Available online: https://www.osti.gov/biblio/10107773 (accessed on 5 January 2025).
49. Yamasaki, H.; Cohen, M.F. Biological consilience of hydrogen sulfide and nitric oxide in plants: Gases of primordial earth linking plant, microbial and animal physiologies. Nitric Oxide 2016, 55–56, 91–100. [Google Scholar] [CrossRef]
50. Wang, L.; Chen, K.; Zhou, M. Structure and function of an Arabidopsis thaliana sulfate transporter. Nat. Commun. 2021, 12, 4455. [Google Scholar] [CrossRef]
51. Narayan, O.P.; Kumar, P.; Yadav, B.; Dua, M.; Johri, A.K. Sulfur nutrition and its role in plant growth and development. Plant Signal Behav. 2023, 18, 2030082. [Google Scholar] [CrossRef]
52. Guo, J.; Shan, C.; Zhang, Y.; Wang, X.; Tian, H.; Han, G.; Zhang, Y.; Wang, B. Mechanisms of salt tolerance and molecular breeding of salt-tolerant ornamental plants. Front. Plant Sci. 2022, 13, 854116. [Google Scholar] [CrossRef]
53. Shelar, P.V.; Mankar, G.D.; Sontakke, O.P.; Bhosale, K.S.; Nikalje, G.C.; Ahire, M.L.; Nikam, U.D.; Barmukh, R.B. A Review of the physio-biochemical and molecular mechanisms of salt tolerance in crop. Curr. Agric. Res. J. 2024, 12, 545–563. [Google Scholar] [CrossRef]
54. Hao, S.; Wang, Y.; Yan, Y.; Liu, Y.; Wang, J.; Chen, S. A review on plant responses to salt stress and their mechanisms of salt resistance. Horticulturae 2021, 7, 132. [Google Scholar] [CrossRef]
55. Yamasaki, H.; Itoh, R.D.; Mizumoto, K.B.; Yoshida, Y.S.; Otaki, J.M.; Cohen, M.F. Spatiotemporal characteristics determining the multifaceted nature of reactive oxygen, nitrogen, and sulfur species in relation to poton homeostasis. Antioxid. Redox Signal 2024. [Google Scholar] [CrossRef] [PubMed]
56. Padulosi, S.; Ng, N.Q. A useful and enexploited herb, Vigna marina (Lgeguminosae-Papliionoidease) and the taxonomic revision of its genetic diversity. Bulll. Nat. Plantention Belg. 1993, 62, 119–126. [Google Scholar] [CrossRef]
57. Takahashi, Y.; Muto, C.; Iseki, K.; Naito, K.; Somta, P.; Pandiyan, M.; Senthil, N.; Tomooka, N. A new taxonomic treatment for some wild relatives of mungbean (Vigna radiata (L.) Wilcz.) based on their molecular phylogenetic relationships and morphological variations. Genet. Resour. Crop Evol. 2017, 65, 1109–1121. [Google Scholar] [CrossRef]
58. Takahashi, Y.; Somta, P.; Muto, C.; Iseki, K.; Naito, K.; Pandiyan, M.; Natesan, S.; Tomooka, N. Novel genetic resources in the genus Vigna unveiled from gene bank accessions. PLoS ONE 2016, 11, e0147568. [Google Scholar] [CrossRef]
Septiana A, Nakamura SP, Naomasa RF, Yamasaki H. Seawater Tolerance of the Beach Bean Vigna marina (Burm.) Merrill in Comparison with Mung Bean (Vigna radiata) and Adzuki Bean (Vigna angularis). Agriculture. 2025; 15(3):228. https://doi.org/10.3390/agriculture15030228
Перевод статьи «Seawater Tolerance of the Beach BeanVigna marina(Burm.) Merrill in Comparison with Mung Bean (Vigna radiata) and Adzuki Bean (Vigna angularis)» авторов Septiana A, Nakamura SP, Naomasa RF, Yamasaki H., оригинал доступен по ссылке. Лицензия: CC BY. Изменения: переведено на русский язык
































































































Комментарии (0)